根肿病是芸薹属根肿菌引起的土传性真菌病害,专性危害十字花科植物的根部[1]。感病后的植株在其根部形成大小不等的肿瘤,地上叶片萎垂,植株生长缓慢,最终造成产量损失25%左右,严重发病区产量损失高达60%[2-3]。若土壤一旦被根肿菌污染,由于休眠孢子存活力较强,将无法种植十字花科的植物,严重危害十字花科植物的生产[4]。根肿病始发于地中海和欧洲南部地区[5],当前在我国安徽、四川、山东、广东、重庆、北京等省市地区均有发生,随着农业机械化程度的提高,发病面积逐年急剧增加[6]。根肿菌属小种分化专性寄生菌,1931年Honig首次证明了该病原菌存在生理小种分化。目前国际上广为认可的根肿菌生理小种鉴别系统有2个,即Williams 系统和ECD系统[7]。在中国尚没有研究出适合国内根肿病菌生理小种鉴定的鉴别寄主系统。国内学者研究根肿病菌生理小种通常采用Williams鉴别系统。丁云花、季海雯、费维新等[8-10]曾先后用Williams系统对我国根肿菌进行生理小种鉴定,共鉴定出2、4、5、7、13号5个生理小种,并指出我国目前主要以4号生理小种为主。
甘蓝型油菜( Brassica napus L.) 是世界上种植面积最广的油料作物,也是我国目前主要种植的油菜类型,具有产量高,抗病虫、抗逆性强等优点[11],但是对于甘蓝型油菜抗根肿病材料的报道却很少。一些研究者已经在萝卜、甘蓝、芜菁、黑芥、白芥等油菜的近缘物种中发现了抗根肿病的种质,并利用远缘杂交和人工合成的方法,将这些近缘物种的抗性基因导入到甘蓝型油菜中,合成了多份抗根肿病的油菜中间材料[12]。但是截至目前极少有合成抗根肿病的甘蓝型油菜品种的报道。自20世纪90年代以来,随着生物技术的发展,发现白菜抗根肿病基因主要来源于欧洲芜菁,且各抗性基因之间都保持相对独立[13]。目前,在大白菜中已经发现8个根肿病抗性基因,分别为Crr1、Crr2、Crr3、Crr4、CRa、CRb、CRc和CRk[14-18],这些CR基因均表现为显性单基因遗传。
由于根肿菌存在较为复杂的生理机制及小种分化,所以筛选种质资源,并将抗性基因转移,进而开展抗病育种工作是解决根肿病最有效的方法之一[19]。本研究的目的是从收集到的30份十字花科材料中筛选出抗根肿病种质,同时将获得的抗性种质与感病甘蓝型油菜育种骨干亲本杂交,将根肿病抗性基因导入到感病的甘蓝型油菜中,并对杂种后代进行真假杂种鉴定,旨在为甘蓝型油菜根肿病抗性育种提供材料支持。
表1 30份十字花科供试材料及来源
Tab.1 The name and origin of the 30 cruciferae varieties

编号No.种名Variety来源Origin编号No.种名Variety来源OriginLB-A萝卜西北农林科技大学油菜研究室搜集3004白菜型油菜西北农林科技大学油菜课题组LB-B萝卜西北农林科技大学油菜研究室搜集3008白菜型油菜西北农林科技大学油菜课题组LB-C萝卜西北农林科技大学油菜研究室搜集徐09 Xu 09甘蓝型油菜西北农林科技大学油菜课题组春宝 Chunbao白菜西北农林科技大学油菜研究室搜集陕油28 Shanyou 28甘蓝型油菜西北农林科技大学油菜课题组春蕾 Chunlei 白菜西北农林科技大学油菜研究室搜集1700甘蓝型油菜西北农林科技大学油菜课题组春旺 Chunwang白菜西北农林科技大学油菜研究室搜集1888甘蓝型油菜西北农林科技大学油菜课题组根抗518 Genkang 518白菜西北农林科技大学油菜研究室搜集1903甘蓝型油菜西北农林科技大学油菜课题组文甘 Wengan甘蓝西北农林科技大学油菜研究室搜集1910甘蓝型油菜西北农林科技大学油菜课题组2943白菜型油菜西北农林科技大学油菜课题组1919甘蓝型油菜西北农林科技大学油菜课题组2946白菜型油菜西北农林科技大学油菜课题组1920甘蓝型油菜西北农林科技大学油菜课题组2956白菜型油菜西北农林科技大学油菜课题组1921甘蓝型油菜西北农林科技大学油菜课题组2958白菜型油菜西北农林科技大学油菜课题组1986甘蓝型油菜西北农林科技大学油菜课题组2981白菜型油菜西北农林科技大学油菜课题组斯露加Siloga欧洲芜菁西北农林科技大学油菜研究室搜集2995白菜型油菜西北农林科技大学油菜课题组德白瑞Debra欧洲芜菁西北农林科技大学油菜研究室搜集3003白菜型油菜西北农林科技大学油菜课题组米蓝白Milan white欧洲芜菁西北农林科技大学油菜研究室搜集
1 材料和方法
1.1 试验材料
用于种质筛选的供试材料为30份十字花科种质(表1),包括3份萝卜、4份白菜、1份甘蓝、9份白菜型油菜、10份甘蓝型油菜和3份欧洲芜菁,供试菌种为四川成都4号根肿菌,-20 ℃保存备用。
1.2 菌液制备与接种筛选
本试验病原菌种是由沈阳农业大学朴钟云课题组提供的采于四川成都白菜根肿病病根,-20 ℃保存备用。菌液制备参考肖崇刚、郭向华[20]的方法:取50 g根肿粉碎,加蒸馏水搅成匀浆;用8层尼龙网过滤后将滤液500 r/min,离心5 min,取上清液及上层灰色沉淀;再将获得的上清液及上层灰色沉淀3 000 r/min离心10 min;将获得的沉淀物利用血球计数器和光学显微镜稀释孢子到1×107个/mL,并调pH值6.2作为原培养液。
将30份供试材料播种于50(5×10)穴盘中,每份材料播10穴,每穴播1粒种子,2次重复。出苗后3 d用注射法对其根部注射5 mL菌液,继续培养,35 d后统计抗感病株数及抗病等级。根肿病分级标准参考Kuginuki等[21]的标准(表2)。
表2 根肿病发病调查分级标准
Tab.2 The grading standard of clubroot resistance

级别Grade病害症状Symptom0无症状1主根无发病,只有须根上有一些少而小的独立的根瘤2主根上有轻微的感病症状,须根上有稍小的根瘤3主根上有较大的根瘤,严重的根变成一团,甚至几乎没有须根
1.3 病情指数统计与数据分析
按下列公式计算出根肿病发病率和发病指数[21]:
发病率![]()
病情指数![]()
抗性分级以病情指数划分参照李妍等[22]的标准如下:高抗(HR):病情指数=0;抗病(R):病情指数<10;中感(MS):10≤病情指数≤20;感病(S):20≤病情指数≤50;高感(HS):病情指数>50。
1.4 杂交授粉与杂种培育
以筛选获得的抗性材料欧洲芜菁Debra作父本,感病材料甘蓝型油菜作母本,采用花期重复授粉[23]的方法配制杂交组合。在杂交之前,去除母本已经开放的花以及较小的花蕾,剥蕾、去雄。取套袋父本花药,均匀涂抹于母本柱头上,授粉后套袋、挂牌。第1次授粉3 d后,重复授粉1次。种荚成熟后,采收、脱粒。
为提高杂种成活率,采用组培方法培养杂种苗。将获得的杂种70%乙醇消毒1 min,无菌水冲洗4~5次,接种于MS培养基上,组培箱培养,培养条件为:温度25 ℃,光周期16 h/8 h,光强12 000 lx。15 d后杂种苗根系粗壮进行练苗2 d,之后移苗至基质培养,常规管理。
1.5 真假杂种植株鉴定
1.5.1 DNA提取及PCR扩增 采用改良CTAB法[24]提取筛选的抗性种质材料及远缘杂交获得对的杂种植株叶片DNA,并纯化。PCR反应的试剂购于康为世纪生物科技有限公司。
PCR反应体系为50 μL:2×Taq MasterMix 25 μL,上游引物和下游引物(10 U)各 2 μL,100 ng/μL 的DNA模板1 μL,ddH2O 补齐至50 μL。PCR反应程序:94 ℃预变性2 min;94 ℃变性30 s,(TM-2)℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃终延伸2 min,4 ℃保存。
1.5.2 SSR分子标记 从http://ukcrop.net/perl/ace/search/BrassicaDB与http:www.brassica.info/ssr/SSRinfo. htm 搜索、选取100对SSR引物(Ra、Na、BN与BRMS-系列)用于杂种鉴定。
以上所有引物均由上海生工生物工程股份有限公司合成。
2 结果与分析
2.1 供试十字花科材料抗病性差异分析
对30份供试材料出苗7 d后进行人工接种鉴定,结果表明,不同抗性水平材料之间的发病率和发病指数均具有极显著性差异(表3、图1)。最终鉴定结果为:这些材料的发病率为0~100.00%,平均发病率为69.13%;病情指数为0~86.02,平均发病指数为51.45。按照抗病分级标准,将病情指数为10(图1,黑色虚线)以下的划为抗病品种。其中有7份材料的病情指数为0,为抗病种质,分别是3份白菜:春蕾、春宝、根抗518;1份甘蓝:文甘;3份欧洲芜菁:斯露加、德白瑞、米蓝白,占供试材料的23.33%。其他供试材料表现不同程度的感病:2份表现为中感、2份表现为感病、19份表现为高感,分别占供试材料的6.67%,6.67%,63.33%。其中19份油菜材料全部表现高感,而所得的7份抗性材料均来源于其他十字花科材料。
表3 30份供试材料抗性水平分析
Tab.3 Resistance difference and significance of 30 rape varieties
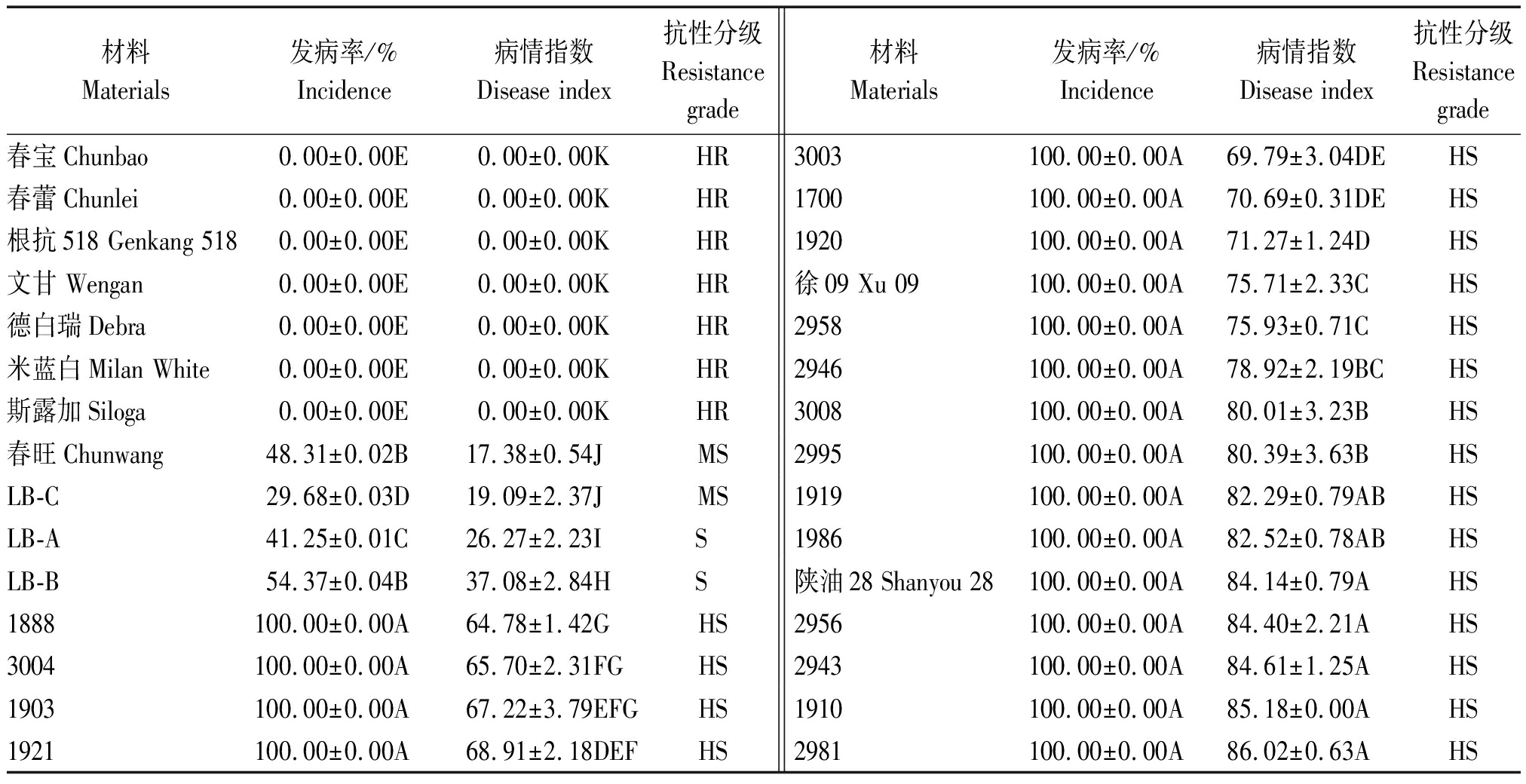
材料Materials发病率/%Incidence病情指数Disease index抗性分级Resistance grade材料Materials发病率/%Incidence病情指数Disease index抗性分级Resistance grade春宝Chunbao0.00±0.00E0.00±0.00KHR3003100.00±0.00A69.79±3.04DEHS春蕾Chunlei0.00±0.00E0.00±0.00KHR1700100.00±0.00A70.69±0.31DEHS根抗518 Genkang 5180.00±0.00E0.00±0.00KHR1920100.00±0.00A71.27±1.24DHS文甘 Wengan0.00±0.00E0.00±0.00KHR徐09 Xu 09100.00±0.00A75.71±2.33CHS德白瑞Debra 0.00±0.00E0.00±0.00KHR2958100.00±0.00A75.93±0.71CHS米蓝白Milan White0.00±0.00E0.00±0.00KHR2946100.00±0.00A78.92±2.19BCHS斯露加Siloga 0.00±0.00E0.00±0.00KHR3008100.00±0.00A80.01±3.23BHS春旺Chunwang48.31±0.02B17.38±0.54JMS2995100.00±0.00A80.39±3.63BHSLB-C29.68±0.03D19.09±2.37JMS1919100.00±0.00A82.29±0.79ABHSLB-A41.25±0.01C26.27±2.23IS 1986100.00±0.00A82.52±0.78ABHSLB-B54.37±0.04B37.08±2.84HS 陕油28 Shanyou 28100.00±0.00A84.14±0.79AHS1888100.00±0.00A64.78±1.42GHS2956100.00±0.00A84.40±2.21AHS3004100.00±0.00A65.70±2.31FGHS2943100.00±0.00A84.61±1.25AHS1903100.00±0.00A67.22±3.79EFGHS1910100.00±0.00A85.18±0.00AHS1921100.00±0.00A68.91±2.18DEFHS2981100.00±0.00A86.02±0.63AHS
注:表中大写字母代表1%水平的显著性差异。
Note: Uppercase letters represent significant in 1% respectively.
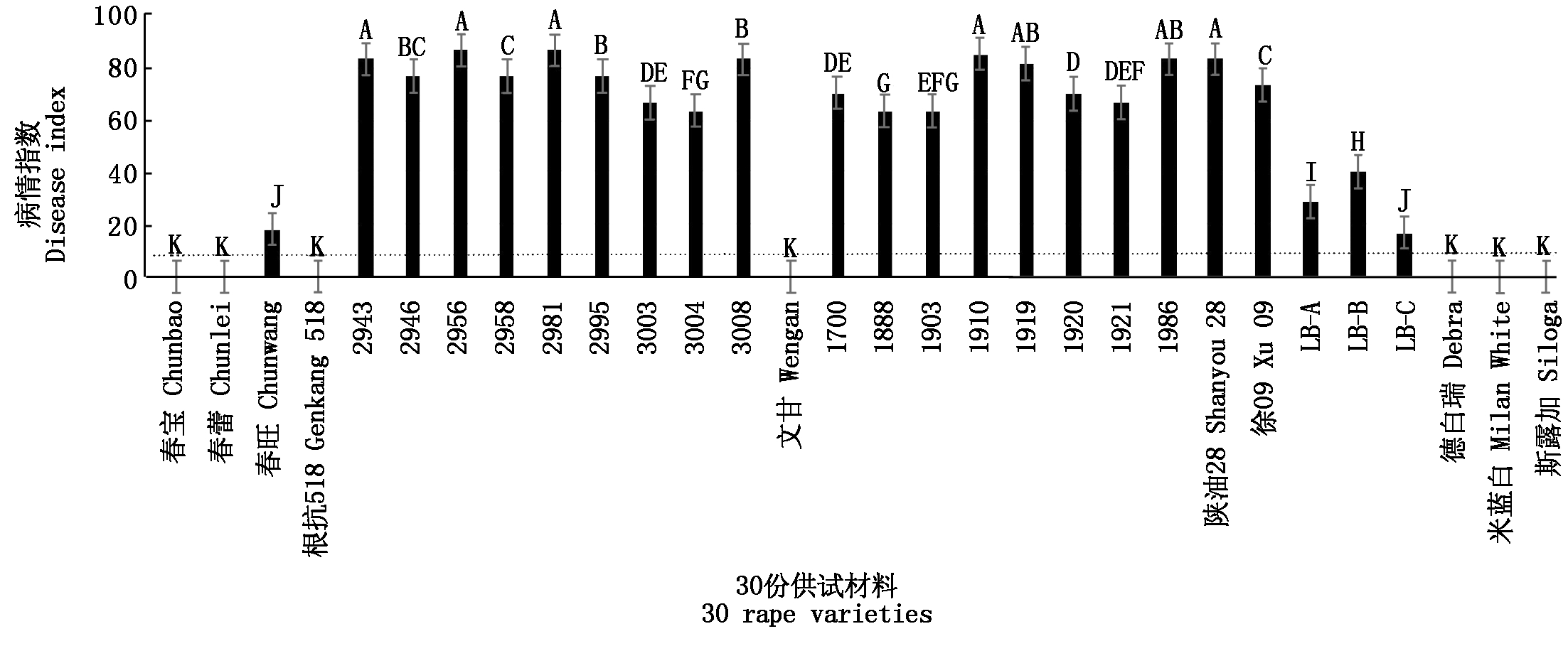
图中大写字母代表1%水平的显著性差异。
Uppercase letters represent significant in 1% respectively.
图1 30份供试材料病情指数对比
Fig.1 The disease index comparison of 30 rape varieties
2.2 供试材料欧式距离连锁聚类分析
对30份供试材料的病情指数利用SPSS软件欧式系统聚类分析法进行连锁聚类分析,结果显示(图2):当连锁距离为5时,可以将30份供试材料对根肿病的抗性归为抗病、中感、感病、高感4个类群。其中,在连锁距离为0.97处将抗病材料斯露加、德白瑞、米蓝白、春蕾、春宝、根抗518、文甘7份材料聚为一类;2份中感和2份感病材料LB-A、LB-B、LB-C和春旺在连锁距离为2.87处聚为一类;在连锁距离为2.13处,将19份高感油菜聚为一类。这与病情指数分析结果相符合。
2.3 供试十字花科材料发病率与病情指数相关性分析
对30份供试材料进行发病率与病情指数的相关性分析(图3):不同材料的病情指数随着发病率的增加而增加,两者之间具有显著相关性(P<0.05),其相关系数r=0.980,决定系数为R2=0.960 7,一元线性回归方程为y =78.186x-2.095 9。由图3可以看出,19个高感油菜品种(黑色方框内)的发病率达到100%,病情指数均在60以上;虚线三角形框中2份感病材料病情指数为20~40,发病率均高于40%;7份高抗材料集中于原点处;其余为中感材料。

图2 30份供试材料欧式距离系统连锁聚类图
Fig.2 Cluster plans chain with Euclidean distance of 30 rape varieties
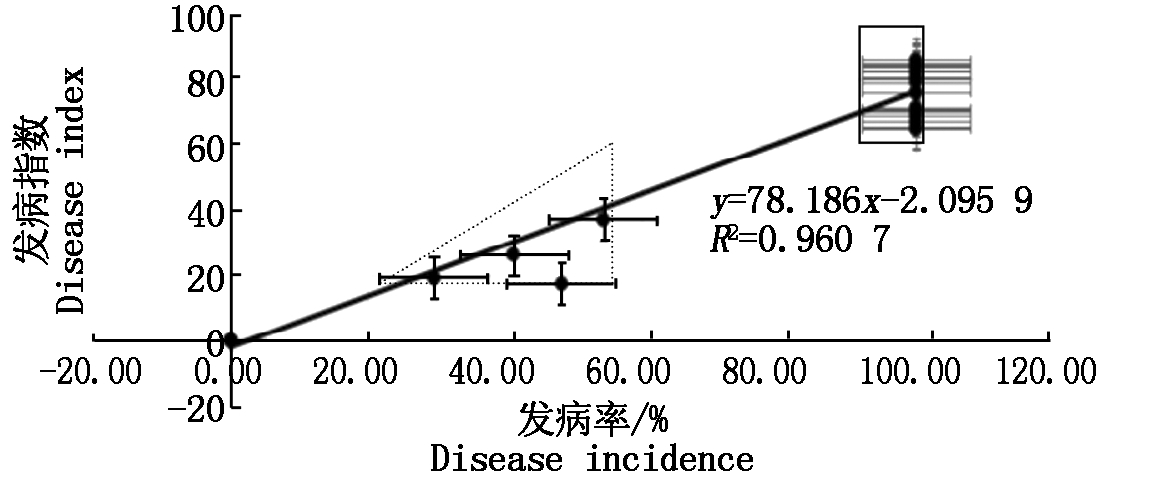
图3 30份供试材料发病率与病情指数关系
Fig.3 Relations between disease index and disease incidence of 30 rape varieties
2.4 远缘杂交真假杂种鉴定
2.4.1 F1杂种形态表征及抗性鉴定 杂交组合徐09×Debra经重复授粉的方式,对7个柱头进行授粉,最终获得2个角果3粒F1杂种种子。将获得的3株F1杂种播于基质中后,对F1杂种及双亲的叶形、叶色、叶缘等形态学特征进行比较(图4):经过初步鉴定,F1杂种叶色浓绿,叶片肥厚且无明显缺刻,叶缘刺毛较少,叶型修长呈椭圆形。母本为圆叶,无明显缺刻,父本有明显缺刻,叶片整体性状表现介于两亲本之间且偏向于母本。
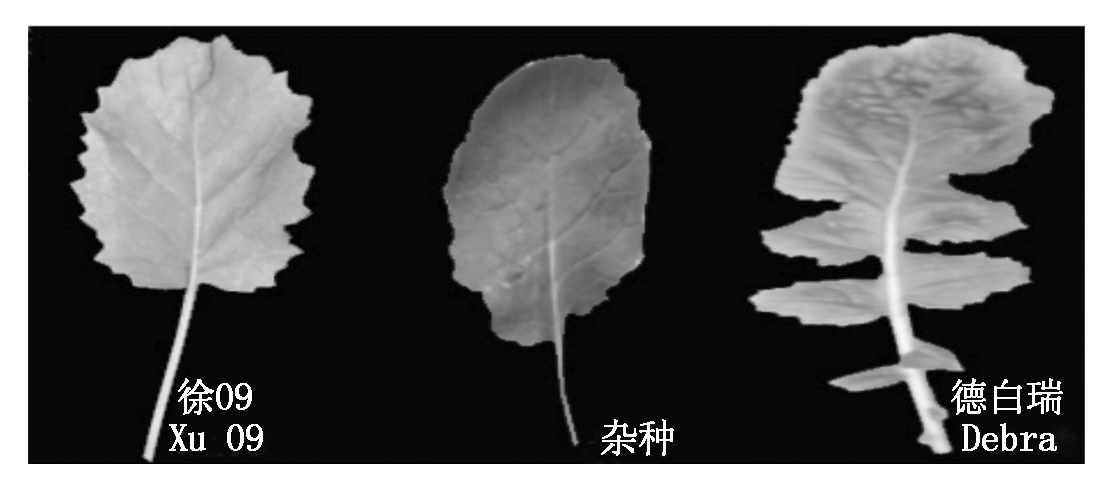
图4 杂种F1真假鉴定
Fig.4 F1 identification of hybrid authenticity
将获得的F1杂种用P4生理小种菌液进行抗性鉴定。通过接种鉴定结果表明,接种后的F1杂种无发病症状,这说明获得的F1杂种为真杂种。
2.4.2 F1杂种SSR分子标记鉴定 用100对SSR引物去扫描远缘杂种F1及双亲,进行多态性分析。若杂种表现父本DNA带型或同时表现父母本DNA带型的为真杂种,仅出现母本DNA带型的为假杂种。
鉴定结果最终筛选出15对SSR引物在F1杂种及双亲间具有较好的扩增多态性(表4),多态性引物占总引物的15%。由电泳图(图5)可以看到,3个杂种的带型均同时表现父母本带型,因此,可以确定此杂交组合所有F1杂种均为真杂种。
表4 多态性引物信息
Tab.4 Polymorphic primer information
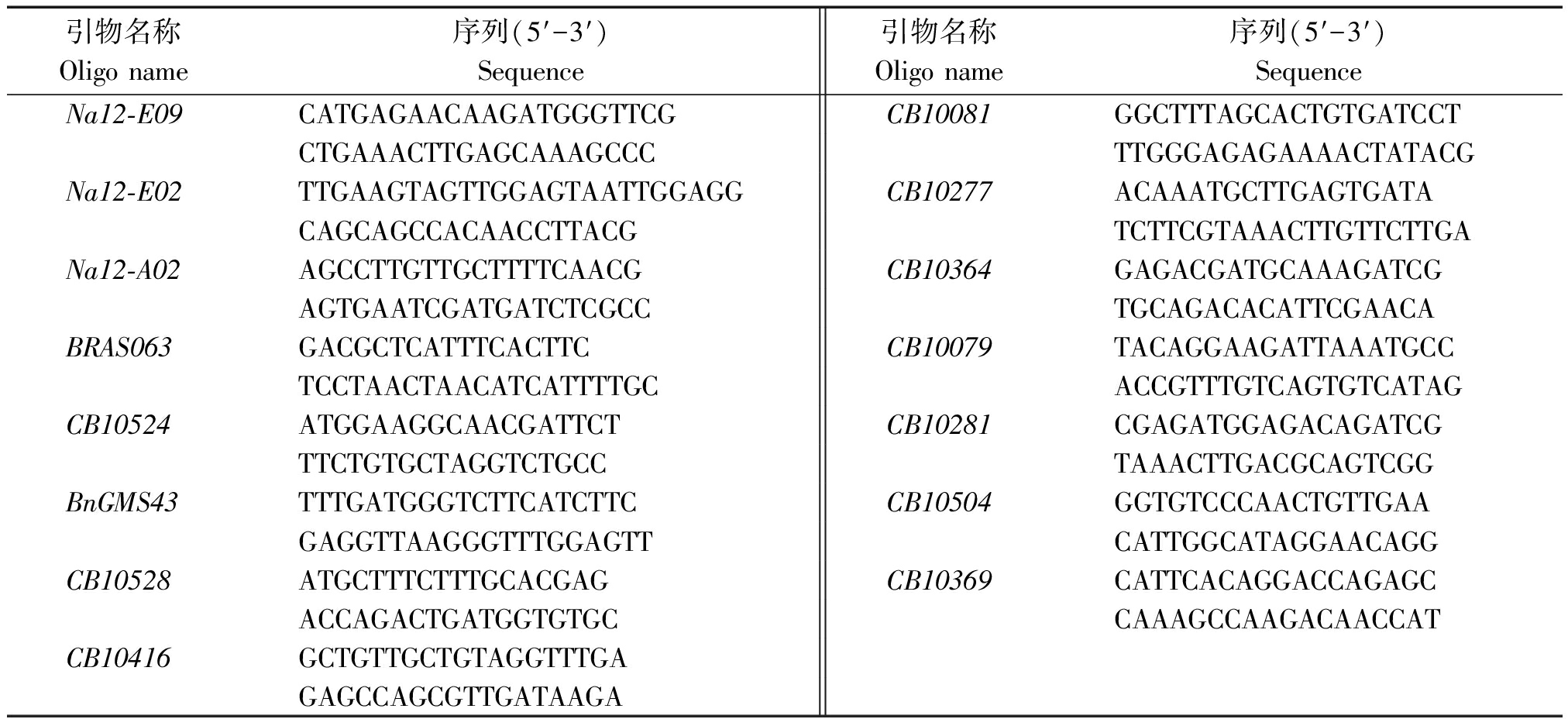
引物名称Oligo name序列(5′-3′)Sequence引物名称Oligo name序列(5′-3′)SequenceNa12-E09CATGAGAACAAGATGGGTTCGCB10081GGCTTTAGCACTGTGATCCTCTGAAACTTGAGCAAAGCCCTTGGGAGAGAAAACTATACGNa12-E02TTGAAGTAGTTGGAGTAATTGGAGGCB10277ACAAATGCTTGAGTGATACAGCAGCCACAACCTTACGTCTTCGTAAACTTGTTCTTGANa12-A02AGCCTTGTTGCTTTTCAACGCB10364GAGACGATGCAAAGATCGAGTGAATCGATGATCTCGCCTGCAGACACATTCGAACABRAS063GACGCTCATTTCACTTCCB10079TACAGGAAGATTAAATGCCTCCTAACTAACATCATTTTGCACCGTTTGTCAGTGTCATAGCB10524ATGGAAGGCAACGATTCTCB10281CGAGATGGAGACAGATCGTTCTGTGCTAGGTCTGCCTAAACTTGACGCAGTCGGBnGMS43TTTGATGGGTCTTCATCTTCCB10504GGTGTCCCAACTGTTGAAGAGGTTAAGGGTTTGGAGTTCATTGGCATAGGAACAGGCB10528ATGCTTTCTTTGCACGAGCB10369CATTCACAGGACCAGAGCACCAGACTGATGGTGTGCCAAAGCCAAGACAACCATCB10416GCTGTTGCTGTAGGTTTGAGAGCCAGCGTTGATAAGA
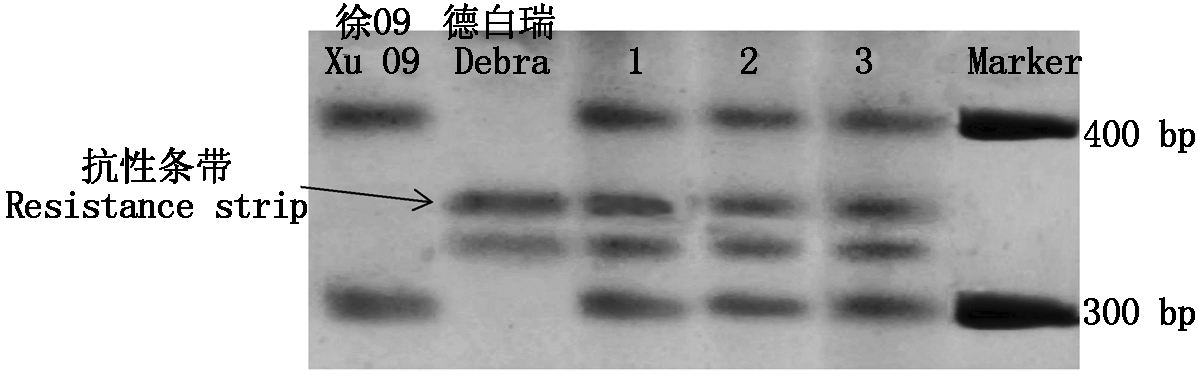
图5 引物BRAS063对徐09×德白瑞杂交组合
扩增DNA电泳
Fig.5 Primer BRAS063 amplification DNA electrophoresis of Xu 09×Debra
3 讨论与结论
陕西省是我国油菜主产区之一,其根肿病发病已呈逐年加重趋势,严重制约着油菜产量、品质及生产机械化的推广[25]。我国对根肿病的研究起步较晚,目前主要通过轮作、药剂防治、生物防治以及筛选抗病品种方法来防治该病害。王保通等[26]利用生物制剂解淀粉芽孢杆菌(Bacillus subtilis)Ba168对甘蓝苗期根肿病的发生进行了研究,其防治效果约为80%。国外对根肿病的研究较多,尤其在日本、加拿大和许多欧洲国家。日本研究者曾在2000年发现十字花科作物的根部内生菌(Endophytie fungi)Heteroconium chaetospica能够使根瘤减少52%~97%,有效防治根肿病的发生;同时,H.chaetospira可以降低轮枝菌引起的黄化病[27]。
在进行人工抗性鉴定接种的过程中,研究者已经发明许多接种方法,如:插入法、沾根法、注射法、菌土法等等,但所有方法最终目的均是使栽培土中含有根肿菌,为根肿病发病提供条件。本研究采用的是使用较多、操作简便的注射法[28],用4号生理小种菌对搜集的30份十字花科材料进行抗性筛选,其中19份高感材料均为油菜,其余十字花科材料分别表现不同抗性,平均发病率为69.13%。春蕾、春宝、根抗518、文甘、Siloga、Debra、Milan White共7份为高抗种质资源,其中,文甘这份高抗根肿病的甘蓝材料,是目前报道的为数不多的甘蓝抗根肿病资源,为根肿病抗性机理研究及油菜抗根肿病新品种的选育提供了材料基础。
由于甘蓝型油菜中缺乏抗根肿病的资源,因此,急需利用远缘杂交技术从其近缘物种中导入根肿病的抗性基因。于是本研究以甘蓝型油菜育种骨干亲本徐09为母本,以抗病欧洲芜菁Debra为父本,通过远缘杂交结合常规育种获得杂种F1。Debra具有很好的抗性,它不仅能够抗国外根肿菌P5生理小种,还能够抗中国的P4生理小种,而且具有多个抗性位点,是抗性基因的良好来源。因此,本研究选择了Debra作为远缘杂交的抗性基因的供体亲本。由于远缘杂交容易出现假杂种,因此,有必要对其后代材料进行真假杂种鉴定,为了准确的判断F1杂种的真假,采用形态学鉴定、SSR分子标记鉴定及抗性鉴定3种方法对F1杂种苗进行真假杂种鉴定,获得了3株F1真杂种。这3份材料可以再通过回交育种,作为抗根肿病过渡“桥梁材料”用于后续的研究。
[1] 何海艳, 司军. 十字花科蔬菜根肿病及其综合防控技术[J]. 长江蔬菜, 2017(14): 1-4. doi:10.3865/j.issn.1001-3547.2017.14.001.
He H Y, Si J. Comprehensive prevention techniques for cruciferous vegetables clubroot[J]. Journal of Changjiang Vegetables, 2017(14):1-4. doi:10.3865/j.issn.1001-3547.2017.14.001.
[2] 黄蓉, 胡建坤, 张景云, 华菊玲, 李湘民, 黄瑞荣. 江西省蔬菜根肿病菌致病性分化研究[J]. 植物病理学报, 2017, 47(1): 133-137. doi:10.13926/j.cnki.apps.000006.
Huang R, Hu J K, Zhang J Y, Hua J L, Li X M, Huang R R. Studies on virulence differentiation of Plasmodiophora brassicae infecting cruciferous vegetables in Jiangxi province[J]. Acta Phytopathologica Sinica, 2017,47(1):133-137. doi:10.13926/j.cnki.apps.000006.
[3] 费维新, 王淑芬, 胡宝成, 李强生, 侯树敏, 荣松柏, 吴晓芸. 不同杀菌剂对油菜根肿病的防效及对油菜产量损失的影响[J]. 植物保护, 2015, 41(1): 201-204. doi:10.3969/j.issn.0529-1542.2015.01.042.
Fei W X, Wang S F, Hu B C, Li Q S, Hou S M, Rong S B, Wu X Y. Control effect of different fungicides on clubroot and yield loss caused by Plasmodiophora brassicae in Brassica napus[J]. Plant Protection, 2015, 41(1):201-204. doi:10.3969/j.issn.0529-1542.2015.01.042.
[4] 田雅琳. 十字花科根肿病研究现状及未来趋势[J]. 天津农业科学, 2015, 21(4): 123-126. doi:10.3969/j.issn.1006-6500.2015.04.029.
Tian Y L. Review of cruciferous root disease research[J]. Tianjin Agricultural Sciences, 2015, 21(4):123-126. doi:10.3969/j.issn.1006-6500.2015.04.029.
[5] Karling J S. The plasmodiophorales[M].New York: Hafner Publishing Co,1968:1. doi:10.2307/1295321.
[6] 方国斌, 刘元明, 朱国芳. 湖北省十字花科根肿病发生与防治[J]. 湖北植保, 2017(2): 47-48. doi:10.3969/j.issn.1005-6114.2017.02.020.
Fang G B, Liu Y M, Zhu G F. Occurrence and prevention of cruciferae clubroot in Hubei province[J]. Hubei Plant Protection, 2017(2):47-48. doi:10.3969/j.issn.1005-6114.2017.02.020.
[7] 朱焕焕. 大白菜根肿病研究进展[J]. 蔬菜, 2017(7): 19-26. doi:10.3969/j.issn.1001-8336.2017.07.007.
Zhu H H. Research progress of Chinese cabbage clubroot[J]. Vegetables, 2017(7):19-26. doi:10.3969/j.issn.1001-8336.2017.07.007.
[8] 丁云花, 简元才, 余阳俊, 汪维红, 耿丽华, 康俊根. 我国8省市十字花科蔬菜根肿病菌生理小种的鉴定[J]. 中国蔬菜, 2013, 1(16): 85-88. doi:10.3969/j.issn.1000-6346.2013.16.014.
Ding Y H, Jian Y C, Yu Y J, Wang W H, Geng L H, Kang J G. Identification of pathotype of Plasmodiophora brassicae on crucifer vegetables in eight provinces of China[J]. China Vegetables, 2013, 1(16):85-88. doi:10.3969/j.issn.1000-6346.2013.16.014.
[9] 季海雯, 任莉, 陈坤荣, 徐理, 刘凡, 孙超超, 李俊, 刘胜毅, 方小平. 油菜根肿病病原主要生理小种和品种抗病性鉴定[J]. 中国油料作物学报, 2013, 35(3): 301-306.doi:10.7505/j.issn.1007-9084.2013.03.012.
Ji H W, Ren L, Chen K R, Xu L, Liu F, Sun C C, Li J, Liu S Y, Fang X P. Identification of physiological races of club root and resistance of rape cultivars to Plasmodiophora brassicae[J]. Chinese Journal of Oil Crop Sciences, 2013,35(3):301-306. doi:10.7505/j.issn.1007-9084.2013.03.012.
[10] 费维新, HWANG, Sheau-Fang S,王淑芬,吴晓芸,高智谋,李强生,侯树敏,荣松柏,江莹芬,雷伟侠,郝仲萍,胡宝成.根肿菌生理小种鉴定与甘蓝型油菜品种资源的抗性评价[J]. 中国油料作物学报, 2016, 38(5): 1007-9084. doi:10.7505/j.issn.1007-9084.2016.05.013.
Fei W X, HWANG, Sheau-Fang S, Wang S F, Wu X Y, Gao Z M, Li Q S, Hou S M, Rong S B, Jiang Y F, Lei W X,Hao Z P, Hu B C. Pathotype identification of Plasmodiophora brassicae and resistance of rapeseed variety resources to clubroot disease[J]. Chinese Journal of Oil Crop Sciences, 2016, 38(5):1007-9084. doi:10.7505/j.issn.1007-9084.2016.05.013.
[11] 刘后利. 油菜遗传育种学[M]. 北京: 中国农业大学出版社, 2000.
Liu H L. Rapeseed genetics and breeding.[M]. Beijing: China Agricultural University Press,2000
[12] 王爱凡, 康雷, 李鹏飞, 李再云. 我国甘蓝型油菜远缘杂交和种质创新研究进展[J]. 中国油料作物学报, 2016, 38(5): 691-698. doi:10.7505/j.issn.1007-9084.2016.05.021.
Wang A F, Kang L, Li P F, Li Z Y. Review on new germplasm development in Brassica napus through wide hybridizations in China[J]. Chinese Journal of Oil Crop Sciences, 2016,38(5):691-698. doi:10.7505/j.issn.1007-9084.2016.05.021.
[13] 周娜, 陆景伟, 郑阳, 胡燕, 陶伟林. 十字花科蔬菜根肿病抗性遗传及抗病育种研究进展[J]. 蔬菜, 2018(2):19-23.
Zhou N, Lu J W, Zheng Y, Hu Y, Tao W L. Research progress on the genetics of resistance and disease resistant breeding of cruciferous vegetable clubroot[J]. Vegetables,2018(2):19-23.
[14] Sakamoto K, Saito A, Hayashida N, Taguchi G, Matsumoto E. Mapping of isolate-specific QTLs for clubroot resistance in Chinese cabbage (Brassica rapa L. ssp. pekinensis)[J]. Theoretical and Applied Genetics,2008,117(5):759-767.doi:10.1007/s00122-008-0817-0.
[15] Suwabe K, Tsukazaki H, Iketani H, Hatakeyama K, Fujimura M, Nunome T, Fukuoka H, Matsumoto S, Hirai M. Identification of two loci for resistance to clubroot (Plasmodiophora brassicae Woronin) in Brassica rapa L.[J]. Theoretical and Applied Genetics, 2003, 107(6):997-1002. doi:10.1007/s00122-003-1309-x.
[16] Suwabe K, Tsukazaki H, Iketani H, Hatakeyama K, Kondo M, Fujimura M, Nunome T, Fukuoka H, Hirai M, Matsumoto S. Simple sequence repeat-based comparative genomics between Brassica rapa and Arabidopsis thaliana: The genetic origin of clubroot resistance[J].Genetics,2006,173(1):309-319. doi:10.1534/genetics.104.038968.
[17] Hirai M, Harada T, Kubo N, Tsukada M, Suwabe K, Matsumoto S.A novel locus for clubroot resistance in Brassica rapa and its linkage markers[J]. Theoretical and Applied Genetics, 2004, 108(4):639-643. doi:10.1007/s00122-003-1475-x.
[18] Piao Z Y, Deng Y Q, Choi S R, Park Y J, Lim Y P.SCAR and CAPS mapping of CRb, a gene conferring resistance to Plasmodiophora brassicae in Chinese cabbage (Brassica rapa ssp. pekinensis)[J]. Theoretical and Applied Genetics,2004,108(8):1458-1465. doi:10.1007/s00122-003-1577-5.
[19] Hatakeyama K, Niwa T, Kato T, Ohara T, Kakizaki T, Matsumoto S. The tandem repeated organization of NB-LRR genes in the clubroot-resistant CRb locus in Brassica rapa L.[J].Molecular Genetics and Genomics,2017,292(2):397-405.doi:10.1007/s00438-016-1281-1.
[20] 肖崇刚, 郭向华. 甘蓝根肿病菌的生物学特性研究[J]. 菌物系统, 2002, 21(4): 597-603. doi:10.3969/j.issn.1672-6472.2002.04.027.
Xiao C G, Guo X H. Biological characteristic of Plasmodiophora brassicae [J]. Mycosystema, 2002,21(4):597-603.doi:10.3969/j.issn.1672-6472.2002.04.027.
[21] Kuginuki Y, Yoshikawa H, Hirai M. Variation in virulence of Plasmodiophora brassicae in Japan tested with clubroot-resistant cultivars of Chinese cabbage (Brassica rapa L. ssp pekinensis)[J].European Journal of Plant Pathology,1999,105(4):327-332.doi:10.1023/A:1008705413127.
[22] 李妍, 谢学文, 向文胜, 石延霞, 李宝聚, 王平. 白菜根肿病的接种方法[J]. 植物保护学报, 2011, 38(1): 95-96. doi:10.13802/j.cnki.zwbhxb.2011.01.018.
Li Y, Xie X W, Xiang W S, Shi Y X, Li B J, Wang P. The inoculation methods of Chinese cabbage clubroot[J]. Acta Phytophylacica Sinica, 2011,38(1):95-96. doi:10.13802/j.cnki.zwbhxb.2011.01.018.
[23] 赵彩霞. 油菜远缘杂交研究[J]. 农业科技与信息, 2015(20): 60-62. doi:10.3969/j.issn.1003-6997.2015.20.029.
Zhao C X. Studies on distant hybridization of Brassica rape[J]. Information of Agricultural Science and Technology, 2015(20):60-62. doi:10.3969/j.issn.1003-6997.2015.20.029.
[24] Wang X, Lou P, Bonnema G, Yang B, He H, Zhang Y, Fang Z. Linkage mapping of a dominant male sterility gene Ms-cd1 in Brassica oleracea[J].Genome,2005,48(5):848-854.doi:10.1139/g05-044.
[25] 唐建祥, 董忠强, 熊一, 肖慧. 勉县油菜根肿病调查及防治对策[J]. 基层农技推广, 2016(11): 77-78.
Tang J X, Dong Z Q, Xiong Y, Xiao H. Investigation and control of clubroot in Mian county[J]. Primary Agricultural Technology Extension, 2016(11):77-78.
[26] 王保通, 陈宏, 申雪雪, 李强, 王芳, 程永安. 解淀粉芽孢杆菌Ba168防治十字花科根肿病效果研究[J]. 陕西农业科学, 2016, 62(2): 39-41. doi:10.3969/j.issn.0488-5368.2016.02.011.
Wang B T, Chen H, Shen X X, Li Q, Wang F, Cheng Y A. Effect of bacillus amyloidosis Ba168 on the prevention and treatment of cruciferae clubroot[J]. Shaanxi Journal of Agricultural Sciences, 2016,62(2):39-41. doi:10.3969/j.issn.0488-5368.2016.02.011.
[27] Narisawa K, Ohki K T, Hashiba T. Suppression of clubroot and Verticillium yellows in Chinese cabbage in the field by the root endophytic fungus, Heteroconium chaetospira[J].Plant Pathology,2000,49(1):141-146. doi: 10.1046/j.1365-3059.2000.00425.x.
[28] 索欢, 陈龙正, 徐海, 宋波, 樊小雪, 袁希汉, 何长征. 小白菜根肿病接种鉴定研究[J]. 江苏农业科学, 2016, 45(5): 193-195. doi: 10.15889/j.issn.1002-1302.2016.05.054.
Suo H, Chen L Z, Xu H, Song B, Fan X X, Yuan X H, He C Z. Study on inoculation methods of clubroot in Brassica rapa chinensis[J]. Jiangsu Agricultural Sciences, 2016,45(5):193-195. doi: 10.15889/j.issn.1002-1302.2016.05.054.