茎腐病是造成玉米倒伏减产的主要病害[1-4],禾谷镰孢(Fusarium graminearum)是引起茎腐病的主要病原真菌[5-7],在国家推行绿色生产方式、农业部提出“农药化肥双减”和“农药零增长”的概念和目标下,本研究把国际上公认的高效、广谱、无毒的植物激素油菜素内酯(BR,Brassinosteroid)作为研究对象,明确BR对禾谷镰孢生长发育的影响及提高玉米抗禾谷镰孢侵染的作用机制,为BR在玉米抗茎腐病和抗倒伏方面的高效利用提供理论依据和技术参考。禾谷镰孢又称禾谷镰刀菌,禾谷镰孢能侵染玉米等禾谷类作物的茎、茎基部和根部等部位,引起茎腐、茎基腐和根腐病等病害[6]。禾谷镰刀菌侵染玉米后,快速生出白色绒状或絮状菌丝,由白色逐步变至玫瑰色、粉红色或砖红色[7]。茎腐病是由单个病原菌或多个病原菌复合侵染造成茎基腐烂的一类病害,主要由镰刀真菌侵染引起,镰刀菌生长的最适温度为25~26 ℃,其生长条件要求湿度较低,因此,在干旱地区(如我国西北部地区)以镰刀菌型茎基腐为主[8]。土壤肥沃,有机质丰富,排灌条件良好的地区,玉米生长健壮,发病轻;土壤瘠薄,排水条件差,玉米生长较弱,发病重[9]。BR对可改良株型[10-12]、促进根系生长[13-15]、提高抗逆性[16-18]、降低农药残留 [19-20]、提高植物的抗病性且具有广谱性[21]。已有研究表明,BR可提高玉米的光合性能[22]、提高玉米叶片捕光能力[23]、CO2的固定能力[22,24]、促进光合产物的积累和运输[25-26],但BR对禾谷镰孢生长发育的影响及BR提高玉米抗禾谷镰孢菌侵染的具体机制尚不明确。
本研究从BR对病原菌和对寄主玉米两方面的影响作为切入点,探讨BR提高玉米抗禾谷镰孢菌侵染的机制。旨在明确BR对玉米茎腐病病原菌禾谷镰孢生长发育的影响,深化BR提高玉米抗侵染的机制,为“农药化肥双减”和“农药零增长”的推行提供技术支持。
1 材料和方法
1.1 试验材料
供试玉米品种是郑单958,购于市场。禾谷镰孢由河北农业大学真菌毒素与植物分子病理学实验室保存。
1.2 试验设计
玉米的培养条件为28 ℃、12 h光照,20 ℃、12 h黑暗。 试验所用油菜素内酯为人工合成的2,4-表油菜素内酯(2,4-Epicastasterone, 2,4-eBL)。采用叶面喷施的方法,在玉米八叶期叶面喷施前期预试验选定的2,4-eBL浓度为100 nmol/L,每株20 mL,全株均匀喷施。喷施BR后10 d,在玉米茎基部第2节用注射的方法接种禾谷镰孢,并设不接种禾谷镰孢的对照进行观测和分析。
1.3 测定项目及方法
1.3.1 禾谷镰孢接种玉米方法 活化的禾谷镰孢加入适量无菌水,用血球计数板计算孢子数目,孢子悬浮液的数目达到106个/mL即可用于侵染玉米茎部。用5 mL注射器注射至玉米基本第2个茎节中部,每个茎节接种5 mL。
1.3.2 禾谷镰孢的培养及观察 将禾谷镰孢接种到含0,10,1 000 nmol/L的PDA 培养基中,25 ℃黑暗培养 5 d。用打孔器(直径 5 mm)取菌落边缘的菌丝琼脂块,然后将禾谷镰孢菌丝块接种,培养 3 d 后测量禾谷镰孢菌落面积,每个处理重复 3 次,观察禾谷镰孢的生长情况。
1.3.3 禾谷镰孢侵染玉米的观测 取接种禾谷镰孢后生长20 d后的玉米茎节,纵向剖开,观察玉米发病情况。
1.3.4 玉米株型的观测 于成熟期, 选取不同处理群体生长一致的10株, 选定主茎, 测定最上面叶的长、宽、叶基角(叶片基部与茎秆的夹角)、叶干质量。
1.3.5 玉米保护酶活性的检测 过氧化物酶(Peroxidase,POD)、超氧化物歧化酶(Superoxide dismutase,SOD)和PAL(苯丙氨酸解氨酶)活性测定参照路文静等[27]的方法进行。
1.3.6 玉米抗倒伏能力测定 利用 YYD1B 数显植物茎秆强度检测仪对玉米进行茎秆抗倒伏强度测定,具体方法为用橡皮条将植物茎秆强度检测仪前端附件与玉米茎秆1/2 处固定, 在茎秆与地面呈直角的情况下轻推玉米茎秆,待玉米茎秆倾斜到与地面呈45°夹角时,记录压力值。
1.3.7 玉米叶片糖含量检测 糖含量的测定参照路文静等[27]的方法进行。
1.3.8 叶绿体超微结构观察 制作玉米叶片超微切片,在透射电镜下观察。
1.4 数据分析
采用SPSS 17. 0 数据处理系统进行试验数据的分析,应用 t 检验法进行差异显著性检验。
2 结果与分析
2.1 油菜素内酯提高玉米抗禾谷镰孢侵染的能力
在未接种禾谷镰孢的生长状态下,玉米茎秆表面健康光滑(图1-A),剖面内正常,无病菌侵染(图1-B);在未喷施BR1的自然生长条件下,在玉米上接种禾谷镰孢,15 d后调查玉米发病情况,结果发现茎秆表面有明显的病原菌沿接种针孔侵染扩散的痕迹(图1-C),剖面内玉米髓组织黑褐色严重,几乎整个节间均已被侵染(图1-D);但在喷施1 mg/L BR 10 d后再接种禾谷镰孢,15 d后调查玉米发病情况,发现茎秆表面虽然仍有病原菌沿接种针孔侵染扩散的痕迹(图1-E),但剖面内玉米髓组织黑褐色明显减轻,发病程度明显减轻(图1-F)。

图1 BR处理对玉米抗禾谷镰孢侵染的影响
Fig.1 Effect of BR on net photosynthetic rate in maize leaf
2.2 BR处理对玉米抗倒伏能力的影响
禾谷镰孢侵染导致的茎腐病是造成玉米倒伏、减产的主要原因。因此,检测了玉米茎秆抗倒伏能力,在一定程度上反映BR提高玉米抗禾谷镰孢侵染能力。本研究利用YYD-1B数显植物茎秆强度检测仪(浙江托普)对不同处理的玉米进行茎秆抗倒伏强度测定,结果表明,1 mg/L BR处理后玉米茎秆抗倒伏强度是172.32 kPa,而未用BR处理的对照玉米茎秆抗倒伏强度是121.61 kPa。说明BR处理增强了玉米茎秆的抗倒伏能力。
2.3 BR对禾谷镰孢生长发育的影响
分别在含0,1,2 mg/L BR的PDA培养基上培养禾谷镰孢,3 d后观察禾谷镰孢生长情况(图2),结果发现BR处理对禾谷镰孢的生长发育没有明显的影响(表1)。
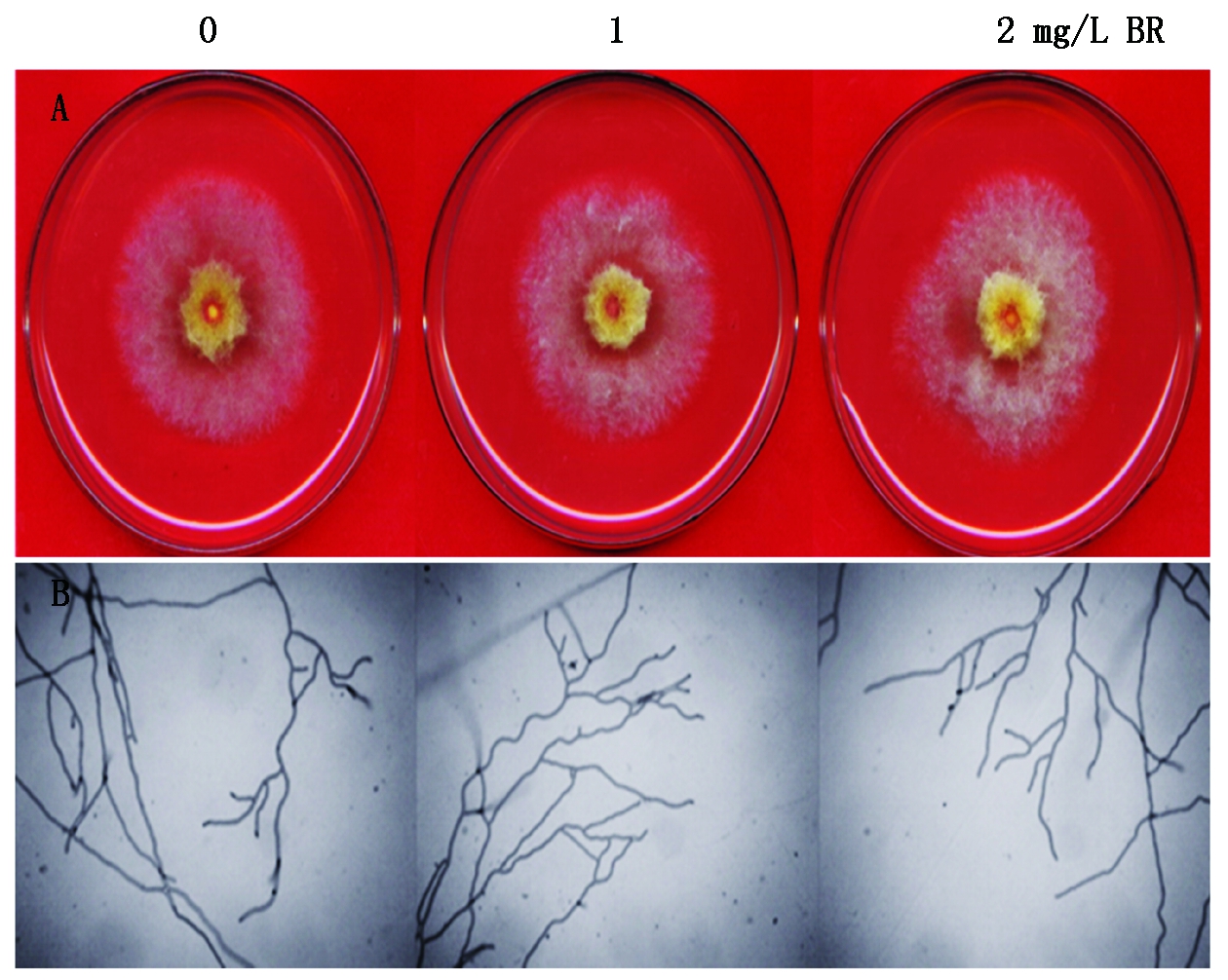
图2 BR处理3 d对禾谷镰孢生长发育的影响
Fig.2 Effect of 3 days BR treatment on the growth and development of Fusarium graminearum
表1 BR对禾谷镰孢菌株生长速度的影响
Tab.1 The effect of BR on the growth rate of the strain of Fusarium graminearum
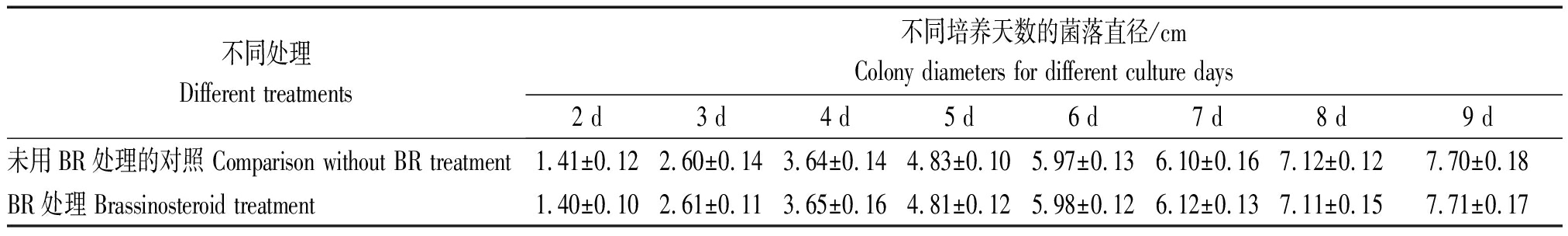
不同处理Different treatments不同培养天数的菌落直径/cmColony diameters for different culture days2 d3 d4 d5 d6 d7 d8 d9 d未用BR处理的对照 Comparison without BR treatment1.41±0.122.60±0.143.64±0.144.83±0.105.97±0.136.10±0.167.12±0.127.70±0.18BR处理 Brassinosteroid treatment1.40±0.102.61±0.113.65±0.164.81±0.125.98±0.126.12±0.137.11±0.157.71±0.17
注:表中数据差异均不显著。
Note:No significant difference in data in the table.
2.4 BR处理对玉米碳水化合物代谢的影响
玉米在生长发育过程中,若体内缺乏碳、糖等有机营养则会造成植株细弱窜高,抵抗病原菌能力降低。本研究表明,BR处理后,玉米叶片的可溶性糖含量为3.50 mg/g,极显著高于对照叶片的2.80 mg/g可溶性糖含量(表2),可溶性糖含量的增加可为增强玉米抗病能力提供物质基础。
表2 BR对玉米抗逆性相关指标的影响
Tab.2 The effect of BR on the resistance index in maize
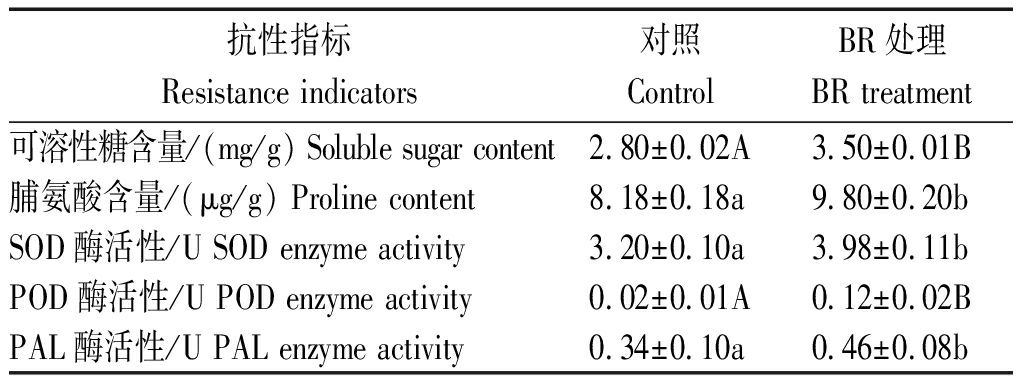
抗性指标Resistance indicators对照ControlBR处理BR treatment可溶性糖含量/(mg/g) Soluble sugar content2.80±0.02A3.50±0.01B脯氨酸含量/(μg/g) Proline content8.18±0.18a9.80±0.20bSOD酶活性/U SOD enzyme activity3.20±0.10a3.98±0.11bPOD酶活性/U POD enzyme activity0.02±0.01A0.12±0.02BPAL酶活性/U PAL enzyme activity0.34±0.10a0.46±0.08b
注:表中同行内不同小写和大写字母分别表示5%和1%差异显著水平。
Note:Different small and capital letters in a row indicate 5% and 1% significant level respectively.
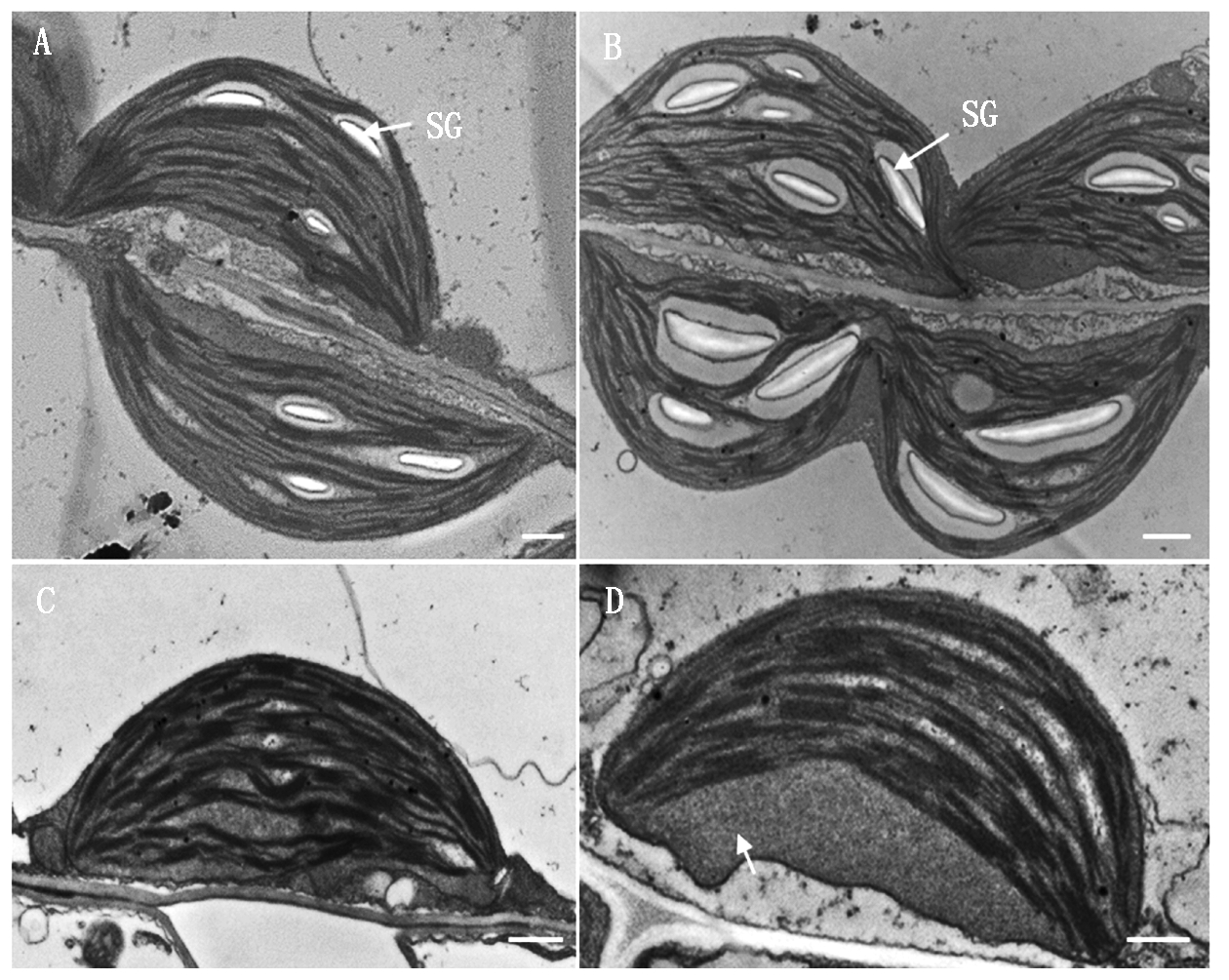
A和B. 白天14:00玉米叶绿体超微结构(A.对照;B.BR处理15 d);SG.淀粉粒;C 和 D.凌晨5:00玉米叶绿体超微结构(C.对照;D.BR处理15 d);白色箭头.大量内含物;Bar=300 nm。
A and B. The ultrastructure of the maize chloroplast at 14:00 in light (A. Control; B. 15 days after BR treatment); SG. Starch granule; C,D. The ultrastructure of the maize chloroplast at 5:00 in the morning (C. Control; D.15 days after BR treatment); The arrow shows the bulk inclusion. Bar=300 nm.
图3 BR处理对玉米叶绿体超微结构的影响
Fig.3 Effect of BR on cell ultrastructure of maize chloroplast
对玉米叶片叶绿体超微结构观察发现,白天BR处理后的叶绿体中淀粉粒积累明显多于对照;夜晚BR处理后的叶绿体中呈现大量内含物,推测可能是由于淀粉转化为大量可溶性蔗糖,然后运出叶绿体(图3)。
2.5 BR处理对玉米脯氨酸代谢的影响
脯氨酸是植物蛋白组分之一,是一种渗透调节物质,以游离状态存在于植物体内,脯氨酸的积累有利于植物的抗逆性。本研究发现,BR处理后的玉米叶片内脯氨酸含量为9.80 μg/g,而未经BR处理的对照叶片脯氨酸含量是8.18 μg/g,且差异达显著水平(表2),脯氨酸含量的增加有利于玉米快速合成抗病相关蛋白,增强其抗病能力。
为进一步分析BR对脯氨酸代谢的影响,本研究对BR处理后玉米叶片中调控脯氨酸合成的基因ZmP5CS进行实时定量分析,结果如图4所示,接种禾谷镰孢菌1 h和3 h后,对照和BR处理的叶片中编码脯氨酸合成酶的基因ZmP5CS的表达量差异均极显著,接种5 h后,ZmP5CS的表达量没有继续增加,说明在接种禾谷镰孢菌3 h内,BR处理和对照叶片的脯氨酸的合成代谢均明显增强,但在接种相同时间内,BR处理的叶片中ZmP5CS的表达量极显著高于对照,表明 BR处理可促进脯氨酸的合成,从而使脯氨酸积累,增强植物抵抗逆境的能力。
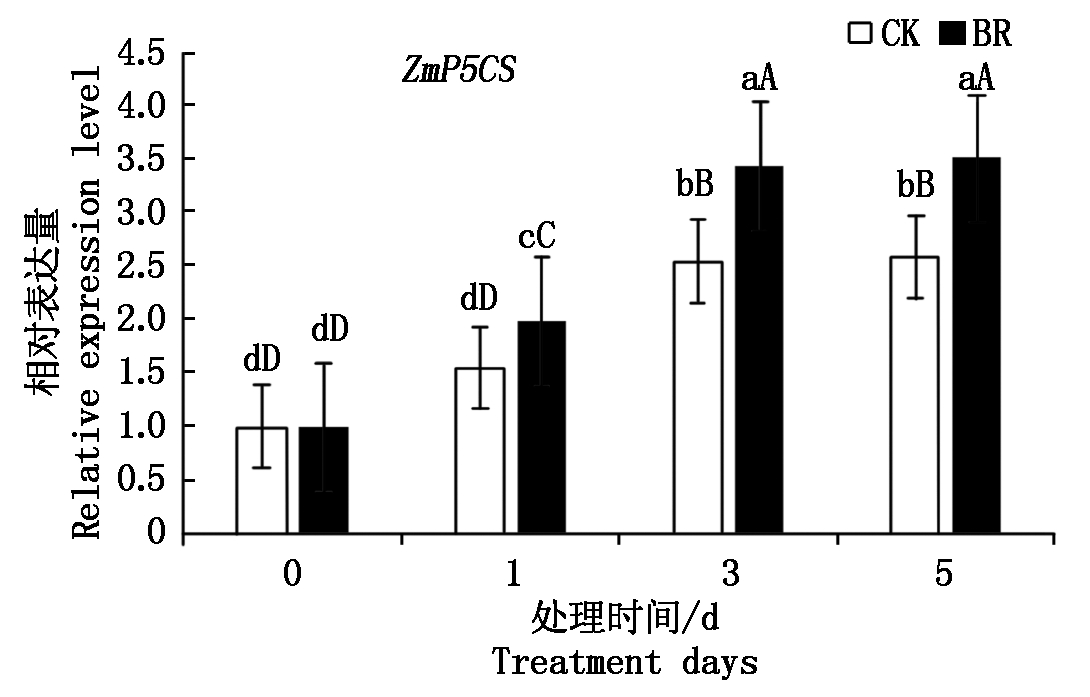
图中不同大写字母表示差异水平极显著(P<0.01);不同小写字母表示差异水平显著(P<0.05)。
In the figure, the different capital letters indicate very significant difference
(P<0.01);Different lowercase indicate significant difference(P<0.05).
图4 油菜素内酯处理对玉米叶片ZmP5CS表达量的影响
Fig.4 Effect of BR on the expression level of ZmP5CS in maize leaf
2.6 BR处理对玉米保护酶活性的影响
本研究分析了BR处理后玉米叶片的SOD、POD和PAL的活性,结果表明,BR处理后,玉米叶片中SOD和POD的酶活性分别为3.98,0.12 U,对照叶片的SOD和POD的酶活性分别为3.20,0.02 U,且BR处理与对照的差异分别达显著或极显著水平(表2),说明BR处理后保护酶活性快速提升,迅速清除活性氧,降低活性氧对生物大分子的破坏作用;PAL(苯丙氨酸解氨酶)是一个可把苯丙氨酸用于酚类化合物合成的酶。本研究结果表明,BR处理后玉米叶片中PAL的活性为0.46 U,显著高于对照叶片中0.34 U的PAL活性,说明BR处理可提高PAL的活性,进而增加酚类物质的合成,增强玉米抗病能力。
3 结论与讨论
在我国,镰孢茎腐病非常普遍,因病减产可达20%。近年来推广高密度种植方式,田间环境利于镰孢菌的侵染和茎腐病的发生,同时,由茎腐病引发或加剧的植株早衰、倒伏现象成为推广高密度种植技术的主要障碍。目前,缺少理想的抗性品种,常用的化学或生物杀菌剂的效果并不理想。油菜素内酯(BR)作为一种新型绿色环保植物生长调节剂,一般可使农作物增产10%~20%,甚至高达30%,并能明显改善品质,提高作物抗旱、抗寒能力,缓解作物遭受病虫害、药害、肥害、冻害的症状[17,28]。BR增强水稻、马铃薯、小麦等植物对真菌、细菌、病毒等的抗性早已有报道[29-30],但BR的抗病机制研究较少,因为BR提高植物抗病性机制不同于公认的抗病途径,BR诱导的抗性不需要水杨酸生物合成,也不用诱导(病程相关蛋白)PR相关基因的表达,因此,BR诱导抗性不同于水杨酸类的系统获得抗病性 (Systemic acquired resistance,SAR),可能有其独特的机制(BR-mediated disease resistance,BDR)[30]。基于上述原因,本研究确认了BR在玉米抵抗禾谷镰孢侵染中的作用,并对其机制进行了分析。
植物受到病原物侵染后,会引起一些酚类代谢相关酶的活性增强,其中以苯丙氨酸解氨酶和过氧化物酶最重要。SOD和POD可以清除植物体内活性氧自由基,使细胞生物大分子免遭膜脂过氧化引起的伤害[31]。PAL的活性与酚类化合物的合成密切,多酚的氧化与POD有关,POD活性的增强可以大大增加酚氧化物的含量,酚被氧化后可钝化病原菌的蛋白质、酶和核酸,对病原菌产生毒性,提高作物抗病能力。本研究表明,BR处理可提高SOD、POD和PAL酶活性,清除活性氧的积累,提高玉米自身免疫能力,同时产生较多的酚类化合物,对防止病菌扩展及抗病起到一定的作用。本研究结果表明,BR处理可促进玉米叶片中可溶性糖和脯氨酸的积累,为玉米生长发育提供物质基础,同时还可以为抗病相关新物质的合成提供中间产物,这些生理变化均在BR提高玉米的抗性过程中起着重要的作用。
油菜素内酯对禾谷镰孢的生长发育没有抑制作用;油菜素内酯提高玉米抗禾谷镰孢侵染的原因不是抑制禾谷镰孢的生长发育,而是通过提高玉米保护酶活性、可溶性糖含量、调控脯氨酸的代谢,从而提高玉米自身免疫能力。
[1] Yu C J S K.Virulence of Fusarium spp. associated with stalk rot of maize in North-East China[J].Physiological&Molecular Plant Pathology, 2016(98):1-8. doi:10.1016/j.pmpp.2016.12.004.
[2] Tesso T, Ejeta G.Stalk strength and reaction to infection by Macrophomina phaseolina of brown midrib maize(Zea mays)and sorghum(Sorghum bicolor)[J].Field Crops Research,2011,120(2):271-275.doi:10.1016/j.fcr.2010.10.015.
[3] Borah S N, Deka S, Sarma H K.First report of Fusarium verticillioides causing stalk rot of maize in Assam, India[J].Plant Disease,2016,100(7):1501.doi:10.1094/PDIS-01-16-0074-PDN.
[4] Mir Z R, Singh P K, Zaidi P H, Vinayan M, Krishna M K, Vemula A K, Rathore A .Genetic analysis of resistance to post flowering stalk rot in tropical germplasm of maize(Zea mays L.)[J].Crop Protection,2018,106:42-49.doi:10.1016/j.cropro.2017.12.004.
[5] Kohl J, Lombaers C, Moretti A, Bandyopadhyay R, Somma S, Kastelein P.Analysis of microbial taxonomical groups present in maize stalks suppressive to colonization by toxigenic Fusarium spp.: A strategy for the identification of potential antagonists[J].Biological Control,2015,83:20-28.doi:10.1016/j.biocontrol.2014.12.007.
[6] Yang Q, Yin G, Guo Y, Zhang D, Chen S, Xu M.A major QTL for resistance to Gibberella stalk rot in maize[J].Theoretical and Applied Genetics,2010,121(4):673-687.doi:10.1007/s00122-010-1339-0.
[7] Gai X T, Xuan Y H, Gao Z G.Diversity and pathogenicity of Fusarium graminearum species complex from maize stalk and ear rot strains in Northeast China[J].Plant Pathology,2017,66(8):1267-1275.doi:10.1111/ppa.12670.
[8] Li Y Q, Sun R Y, Yu J, Saravanakumar K A.Antagonistic and biocontrol potential of Trichoderma asperellum ZJSX5003 against the maize stalk rot pathogen Fusarium graminearum[J].Indian Journal of Microbiology,2016,56(3):318-327.doi:10.1007/s12088-016-0581-9.
[9] Reid L M, Zhu X, Ma B L.Crop rotation and Nitrogen effects on maize susceptibility to Gibberella(Fusarium graminearum) ear rot[J].Plant and Soil,2001,237(1):1-14.doi:10.1023/A:1013311703454.
[10] Lin Y, Zhao Z, Zhou S, Liu L, Kong W, Chen H, Long W, Feng Z, Jiang L, Wan J.Top bending panicle1 is involved in brassinosteroid signaling and regulates the plant architecture in rice[J].Plant Physiology and Biochemistry,2017,121:1-13.doi:10.1016/j.plaphy.2017.10.001.
[11] Thussagunpanit J, Jutamanee K, Homvisasevongsa S, Suksamrarn A, Yamagami A, Nakano T, Asami T.Characterization of synthetic ecdysteroid analogues as functional mimics of brassinosteroids in plant growth[J].The Journal of Steroid Biochemistry and Molecular Biology,2017,172:1-8.doi:10.1016/j.jsbmb.2017.05.003.
[12] Zeng Y H, Yu-Ping Z, Xiang J, Wu H, Chen H Z, Zhang Y K, Zhu D F.Effects of chilling tolerance induced by spermidine pretreatment on antioxidative activity, endogenous hormones and ultrastructure of indica-japonica hybrid rice seedlings[J].Journal of Integrative Agriculture,2016,15(2):295-308.doi:10.1016/S2095-3119(15)61051-6.
[13] Chaiwanon J, Wang Z Y.Spatiotemporal brassinosteroid signaling and antagonism with auxin pattern stem cell dynamics in Arabidopsis roots[J].Current Biology,2015,25(8):1031-1042.doi:10.1016/j.cub.2015.02.046.
[14] Kim S K, Chang S C, Lee E J, Chung W S, Kim Y S, Hwang S, Lee J S.Involvement of brassinosteroids in the gravitropic response of primary root of maize[J].Plant Physiology,2000,123(3):997-1004. doi:10.1104/pp.123.3.997.
[15] Ahammed G J, He B B, Qian X J, Zhou Y H, Shi K, Zhou J, Yu J Q, Xia X J.24-Epibrassinolide alleviates organic pollutants-retarded root elongation by promoting redox homeostasis and secondary metabolism in Cucumis sativus L.[J].Environmental Pollution,2017,229:922-931.doi:10.1016/j.envpol.2017.07.076.
[16] Wang X, Teng Y, Zhang N, Christie P, Li Z, Luo Y, Wang J.Rhizobial symbiosis alleviates polychlorinated biphenyls-induced systematic oxidative stress via brassinosteroids signaling in alfalfa[J].The Science of the Total Environment,2017,592:68-77.doi:10.1016/j.scitotenv.2017.03.066.
[17] Rahman T, Divi U, Krishna P.Genes involved in brassinosteroid-mediated abiotic stress tolerance[J].Journal of Biotechnology,2010,150(1):S112.doi:10.1016/j.jbiotec.2010.08.289.
[18] Divi U K, Krishna P.Brassinosteroid: a biotechnological target for enhancing crop yield and stress tolerance[J].New Biotechnology,2009,26(3/4):131-136.doi:10.1016/j.nbt.2009.07.006.
[19] Zhou Y H, Xia X J, Yu G B, Wang J T, Wu J X, Wang M M, Yang Y X, Shi K, Yu Y L, Chen Z X, Gan J, Yu J Q.Brassinosteroids play a critical role in the regulation of pesticide metabolism in crop plants[J].Scientific Reports,2015,5:9018.doi:10.1038/srep09018.
[20] Xia X J, Zhang Y, Wu J X, Wang J T, Zhou Y H, Shi K, Yu Y L, Yu J Q.Brassinosteroids promote metabolism of pesticides in cucumber[J].Journal of Agricultural and Food Chemistry,2009,57(18):8406-8413.doi:10.1021/jf901915a.
[21] De Bruyne L, Höfte M, De Vleesschauwer D.Connecting growth and defense: the emerging roles of brassinosteroids and gibberellins in plant innate immunity[J].Molecular Plant,2014,7(6):943-959.doi:10.1093/mp/ssu050.
[22] Chang K S, Jeon H, Seo S, Lee Y, Jin E.Improvement of the phosphoenolpyruvate carboxylase activity of Phaeodactylum tricornutum PEPCase 1 through protein engineering[J].Enzyme and Microbial Technology,2014,60:64-71.doi:10.1016/j.enzmictec.2014.04.007.
[23] Xia X J, Huang L F, Zhou Y H, Mao W H, Shi K, Wu J X, Asami T, Chen Z, Yu J Q.Brassinosteroids promote photosynthesis and growth by enhancing activation of Rubisco and expression of photosynthetic genes in Cucumis sativus[J].Planta,2009,230(6):1185-1196.doi:10.1007/s00425-009-1016-1.
[24] Daloso D M, Antunes W C, Pinheiro D P, Waquim J P, Araújo W L, Loureiro M E, Fernie A R, Williams T C.Tobacco guard cells fix CO2 by both Rubisco and PEPcase while sucrose acts as a substrate during light-induced stomatal opening[J].Plant Cell & Environment,2015,38(11):2353-2371.doi:10.1111/pce.12555.
[25] 李涛涛, 高永峰, 马瑄, 陈永富, 王阳, 马金彪. 外源油菜素内酯对三种杨树在干旱、盐和铜胁迫下光合生理的影响[J]. 基因组学与应用生物学, 2016, 35(1): 218-226. doi:10.13417/j.gab.035.000218.
Li T T, Gao Y F, Ma X, Chen Y F, Wang Y, Ma J B. Effect of exogenous brassinosteroid on photosynthesis of three spesies of populous under drought,salt and copper stress [J]. Genomics and Applied Biology, 2016,35(1):218-226. doi:10.13417/j.gab.035.000218.
[26] Zhang M C, Zhai Z X, Tian X L, Duan L S, Li Z H. Brassinolide alleviated the adverse effect of water deficits on photosynthesis and the antioxidant of soybean (Glycine max L.) [J]. Plant Growth Regulation, 2008, 56(3): 257-264. doi:10.1007/s10725-008-9305-4.
[27] 路文静, 李奕松. 植物生理学实验教程[M]. 北京: 中国林业出版社, 2012:34-42.
Lu W J, Li Y S. Experimental course of plant physiology[M]. Beijing:China Forestry Publishing House,2012:34-42.
[28] Bend S.Brassinosteroids-bioactivity and crop productivity[J].Journal of Plant Physiology,2004,161(11):1286-1287. doi:10.1016/j.jplph.2004.05.007.
[29] Wang Q S, Tian X Y, Jiang Q, Xu G C.Effects of brassinosteroids on the yield and quality of machine-transplanted hybrid rice[J].Field Crops Research,2016, 33:473-479. doi: 10.1016/j.fcr.2016.02.016.
[30] Nakashita H, Yasuda M, Nitta T, Asami T, Fujioka S, Arai Y,Sekimatal K,Takatsuto S,Yamaguchi I,Yoshida S.Brassinosteroid functions in a broad range of disease resistance in tobacco and rice[J].The Plant Journal,2003, 33(5): 887-898. doi:10.1046/j.1365-313X.2003.01675.x.
[31] Kanwar M K, Bhardwaj R.Arsenic induced modulation of antioxidative defense system and brassinosteroids in Brassica juncea L. [J].Ecotoxicology and Environmental Safety,2015,115:119-125.doi:10.1016/j.ecoenv.2015.02.016.