磷是植物生长发育过程中不可缺少的元素之一。然而,土壤溶液中磷的浓度较低,95%以上的磷为吸附固定态和矿物态难溶性磷,不能被植物根系直接吸收利用[1-2]。土壤中植物可利用的磷源一般可以通过2种途径实现,一是施用含磷的化肥或者有机肥,但是化肥磷素在土壤中的当季利用率很低(5%~25%);二是添加具有溶磷功能的微生物以促进固定态磷的释放,提高土壤磷的植物有效性。研究发现,土壤中存在大量微生物能够转化难溶性的含磷化合物为有效磷源,数量约为土壤微生物总量的10%,且种类繁多[3],具有这种活化难溶性磷能力的微生物统称为溶磷微生物或溶磷菌,目前该功能性微生物在细菌、真菌、放线菌中均有发现[4]。Hariprasad等[5]研究发现,从番茄根际分离出来的溶磷细菌PSRB,促进了番茄植株的生长、提高了其吸磷量和根际土壤的有效磷含量;在石灰性土壤上施用难溶性磷肥,添加含有青霉菌的微生物菌剂不仅可以增加小麦-玉米的株高、生物量、产量,而且植物体内磷的累积量也显著增加,说明青霉菌促进了土壤及肥料中固定态磷的释放[6];研究还表明,添加草酸青霉菌P8使玉米的生物量和吸磷量分别增加了12.30%~25.50%,28.95%~39.17%[7];接种草酸青霉菌C2′促进小麦植株全长增加了12.31%,鲜质量增加了21.25%,地上部和根部的磷浓度也分别增加了28.02%,32.46%[8]。此外,有研究表明,施用微生物菌剂会显著提高土壤的相关酶活性及土壤微生物量,改善土壤生物化学肥力状况[9]。而且玉米秸秆夹层处理能够很好地改善土壤的生物学性状,并且随着时间的增加,各种酶活性达到最高,作物产量达到1 914 kg/hm2[10]。
耿丽平等[11]自主筛选的草酸青霉菌HB1能高效分解纤维素,促进秸秆腐解,且通过室内摇瓶试验发现,该菌在分解纤维素的同时还具有较强溶解难溶性磷的能力。但是,土壤环境复杂,其中很多物理、化学和生物学因素都可能会影响草酸青霉菌HB1的溶磷能力。此外,秸秆还田是当前我国农业普遍采用的一种农艺措施,该措施对施入土壤的草酸青霉菌HB1的促生效应,溶磷能力及土壤生物学特性影响效应还不是很清楚。
本研究以草酸青霉菌(Penicillium oxalicum)HB1为供试菌株,配施小麦秸秆,通过土壤培养试验探究其对土壤生物学及化学特性的影响;通过白菜培养试验进一步明确其对植物的促生效应,活化土壤磷的能力,以及在改善土壤生物学特性方面的影响效应,以期为溶磷微生物肥料的开发应用提供优良菌株,为改善土壤磷素营养提供技术支撑。
1 材料和方法
1.1 试验材料
1.1.1 供试土壤 试验用土取自河北农业大学教学实验场(三分厂)白菜地,土壤理化性状如表1所示。
表1 供试土壤基本理化性质
Tab.1 Basic physical and chemical properties of tested soil
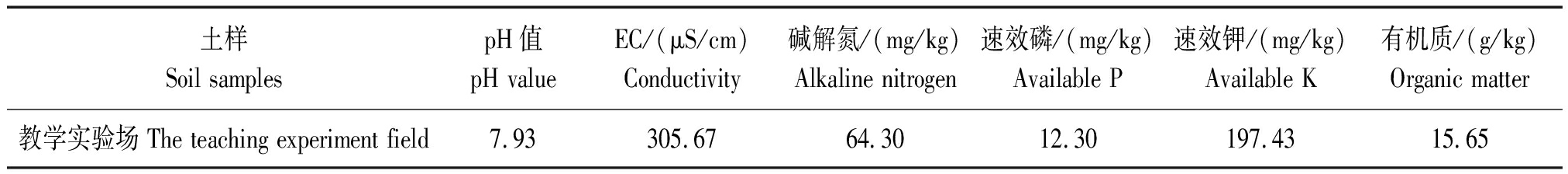
土样Soil samplespH值pH valueEC/(μS/cm)Conductivity碱解氮/(mg/kg)Alkaline nitrogen速效磷/(mg/kg)Available P速效钾/(mg/kg)Available K有机质/(g/kg)Organic matter教学实验场 The teaching experiment field7.93305.6764.3012.30197.4315.65
1.1.2 供试菌株 草酸青霉菌HB1由河北省农田生态环境重点实验室前期获得,并保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.4842。
1.1.3 供试植物 白菜(Brassica pekinensis)种子购自神农绿帮菜-天津神农种业有限公司。
1.1.4 其他供试材料 小麦秸秆采自河北农业大学教学试验场,小麦为白菜前茬作物。
1.2 试验方法
1.2.1 草酸青霉HB1菌株活化 从斜面菌种挑取菌种,转接到PDA固体培养基上,于30 ℃培养48~72 h,待长满整个平板。然后从培养好的平板上挑取菌种,转接到PDA固体培养基上,于30 ℃培养72 h,待长满整个平板,备用。
1.2.2 草酸青霉HB1菌液的制备 将活化好的HB1菌株用无菌水制成孢子悬浮液,置于显微计数板测定孢子数量,约为1×108 cfu/mL。
1.2.3 白菜种子处理 白菜:播种前用0.4%的次氯酸钠(NaClO,分析纯)表面灭菌,加入的溶液量淹没种子为宜,盖塞,振荡30 min。然后用灭菌蒸馏水清洗4次,55 ℃灭菌蒸馏水浸种2 h后,于37 ℃培养箱中过夜,次日转入灭菌的纱布上催芽[12],避免外源菌的影响。露白后转入盆栽中培养。
1.2.4 小麦秸秆处理 将小麦秸秆清洗、灭菌、烘干,干燥后进行常规粉碎,避免其他病源菌的影响。
1.2.5 土壤处理 将在河北农业大学科学实验场取回的土壤进行风干过2 mm筛后备用。
1.3 试验处理
本研究设置了没有种植白菜的土壤培养试验和种植白菜的培养试验。2个培养试验均设4个处理:对照(CK)、添加小麦秸秆处理(秸秆)、添加草酸青霉菌HB1处理(HB1)、添加秸秆和草酸青霉菌HB1处理(秸秆+HB1)。
土壤培养试验:将450 g风干土壤与2 g处理好的小麦秸秆充分混匀后放入培养钵中,先加入100 mL蒸馏水湿润土壤,在土壤呈湿润状态下加入2 mL(有效孢子数为2×108 cfu/mL)草酸青霉HB1菌悬液,放入生化培养箱(SPX-150,宁波海曙赛福)中,于30 ℃下培养30 d。每个处理设3次重复。
白菜培养试验:将450 g风干土壤与2 g处理好的小麦秸秆充分混匀后放入培养钵中,先加100 mL蒸馏水湿润土壤,待土壤全部湿润后移入已催芽的白菜种子,之后放入30 ℃生化培养箱中培养。待白菜生长稳定后,再添加2 mL(有效孢子数为2×108 cfu/mL)草酸青霉HB1菌悬液,培养30 d。每个处理设6次重复。
培养试验中浇水全部使用蒸馏水。
1.4 样品采集与测定
1.4.1 植物样品采集与测定 用不锈钢剪刀剪取白菜地上部,将地上部洗净、擦干,称其鲜质量;将培养钵中的土全部倒出,挑取植物根部,洗净;再将地上部和根部于烘箱中105 ℃杀青30 min,60 ℃烘至恒质量,分别称干质量后粉碎备用。采用H2SO4-H2O2消煮,钒钼黄比色法[13]测定白菜各部分中P含量。
1.4.2 土壤样品的采集与测定 试验结束后,将培养钵中的土全部倒出,挑出根系,将土壤混匀后取部分鲜土用于测定土壤纤维素酶活性和细菌、真菌和放线菌的有效活菌数,土壤纤维素活性的测定采用硝基水杨酸比色法[14];土壤微生物有效活菌数的测定按《土壤微生物研究原理与方法》进行[15];剩下的土样风干过1 mm的筛后待测,土壤pH值、速效磷的测定按《土壤农化分析》中的方法进行[13];土壤碱性磷酸酶活性的测定采用磷酸苯二钠比色法进行[14]。
1.5 数据分析
采用Miccrosoft Excel 2007进行数据和图表处理,采用SPSS 17.0软件对试验数据进行方差分析。
2 结果与分析
2.1 草酸青霉菌HB1对白菜幼苗生物量的影响
接种草酸青霉菌HB1 30 d后白菜生物量如图1所示,对照(CK)、添加秸秆处理(秸秆)和添加草酸青霉菌HB1处理(HB1)之间的白菜鲜质量没有显著差异,但三者均显著高于添加秸秆和菌剂处理(秸秆+HB1)(P<0.05),增幅分别为107.40%,83.44%和152.21%;虽然秸秆处理、HB1处理与CK相比白菜鲜质量差异不显著,但前者减少了11.55%,后者则增加了21.61%。由此可见,加入HB1菌株促进了白菜的生长,生物量增加了20%以上。但小麦秸秆的施用对白菜的生长无促进作用,且在秸秆还田条件下施用HB1菌后,白菜的生长最差,生物量最低,这可能是由于草酸青霉菌HB1具有分解纤维素和溶解土壤磷的双重功能[16],加入HB1后,促进了小麦秸秆的腐解,参与小麦腐解的微生物数量增加,增加的微生物会和白菜幼苗竞争土壤中的养分,从而抑制了白菜的生长。
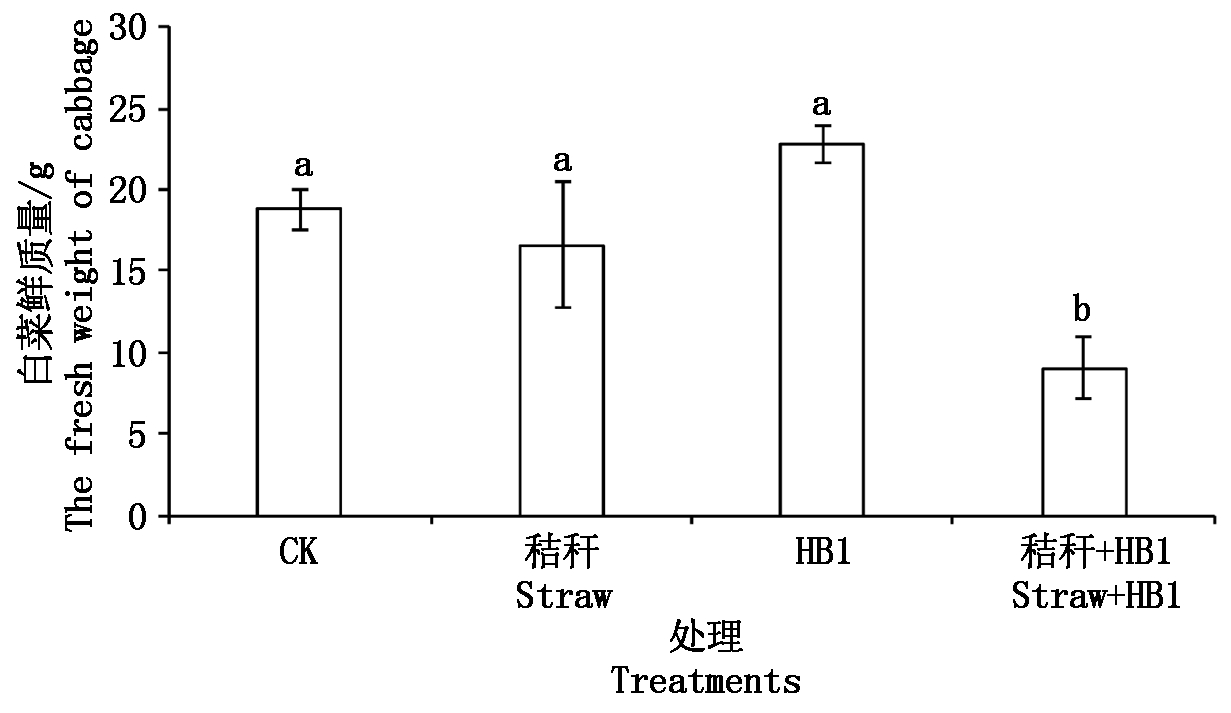
不同字母表示处理间差异达到了显著性水平(P<0.05)。图2-5同。
Different letters on the top of column represent significant differences among different treatments. The same as Fig.2-5.
图1 草酸青霉HB1对白菜幼苗生物量的影响
Fig.1 Effects of Penicillium oxailcum HB1 on biomass of Chinese cabbage seedlings
2.2 草酸青霉菌HB1对土壤pH值的影响
前期的研究表明,草酸青霉菌HB1在分解难溶性含磷矿物时可以降低培养基质的pH值,因此,土壤培养试验和白菜培养试验结束后均测定了土壤pH值(表2)。在土壤培养试验中,添加小麦秸秆提高了土壤pH值,而添加HB1对土壤pH没有显著影响。已有研究表明,向土壤中添加作物秸秆能够极显著地提高土壤的pH值,降低土壤的酸度[17]。这是因为秸秆在腐解过程中增加了土壤的盐基饱和度,使土壤pH值升高[18]。在白菜培养试验中,不同处理的土壤pH值间差异均不显著。说明在白菜幼苗生长过程中,无论是添加小麦秸秆还是草酸青霉菌HB1均不会影响土壤的酸碱度。但从总体上看,白菜的种植提高了土壤的pH值,且与未种植白菜的处理相比,分别提高了6.69%,5.01%,8.02%,3.58%,差异均达到显著水平。这是因为白菜生长在通气良好的土壤中,氮素主要以硝态氮的形式存在,白菜和HB1主要吸收的是硝态氮,且硝态氮主要是和H+协同主动进入白菜根系的,从而使土壤中OH-的数量增加。因此,种植白菜的土壤pH值要高于没有种植白菜的土壤。
表2 草酸青霉菌HB1对土壤pH值的影响
Tab.2 Effects of Penicillium oxalicum HB1 on soil pH
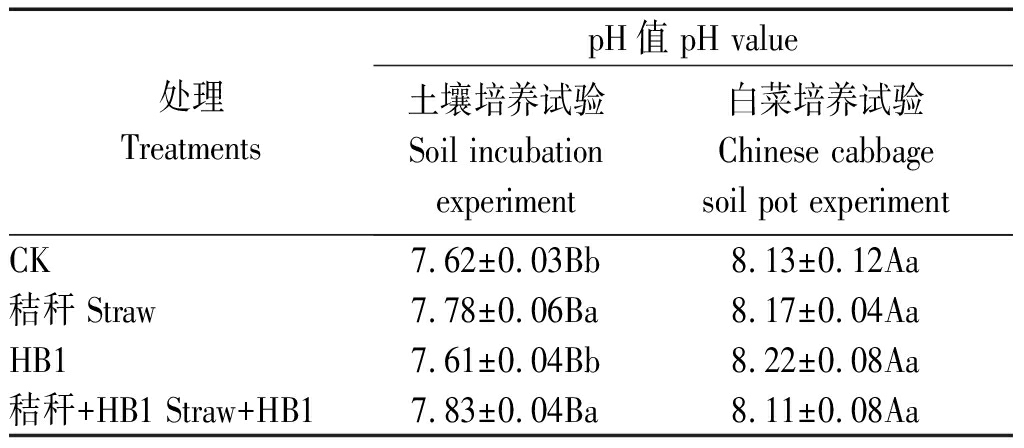
处理TreatmentspH值 pH value土壤培养试验Soil incubationexperiment白菜培养试验Chinese cabbage soil pot experimentCK7.62±0.03Bb8.13±0.12Aa秸秆 Straw7.78±0.06Ba8.17±0.04AaHB17.61±0.04Bb8.22±0.08Aa秸秆+HB1 Straw+HB17.83±0.04Ba8.11±0.08Aa
注:同行数据后不同大写字母表示不同试验间差异显著(P<0.05);同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。表3同。
Note:Different capital letters in the same line represent significant differences among different treatments in P<0.05; Different lowercase in the same column represent significant differences among different treatments in P<0.05.The same as Tab.3.
2.3 草酸青霉菌HB1对土壤速效磷含量的影响
图2-A为土壤培养试验土壤速效磷含量。从图2-A可以看出,秸秆处理的土壤速效磷含量与对照相比降低了16.24%,且二者之间差异显著(P<0.05),此外,秸秆+HB1处理的土壤速效磷含量与HB1处理相比也显著降低了17.72%(P<0.05)。说明在没有种植物的土壤培养过程中添加小麦秸秆不利于土壤固定态磷的释放,可能是因为草酸青霉菌HB1具有分解纤维素和溶解土壤磷的双重功能 [16]。此外,HB1添加并没有明显影响土壤中有效磷的水平。
图2-B为白菜培养试验中土壤速效磷含量。从图2-B可以看出,秸秆处理的土壤速效磷含量比对照显著降低了45.13%(P<0.05);而且秸秆+HB1处理比HB1处理也显著降低了13.69%(P<0.05)。说明在种植白菜的情况下,添加秸秆降低了土壤的速效磷含量。但是在添加秸秆的同时再添加HB1菌,土壤速效磷的含量都提高了45.22%,且差异达到显著水平(P<0.05)。此结果进一步明确了在秸秆还田条件下,种植白菜施用草酸青霉菌HB1,可以促进土壤中磷素的释放。
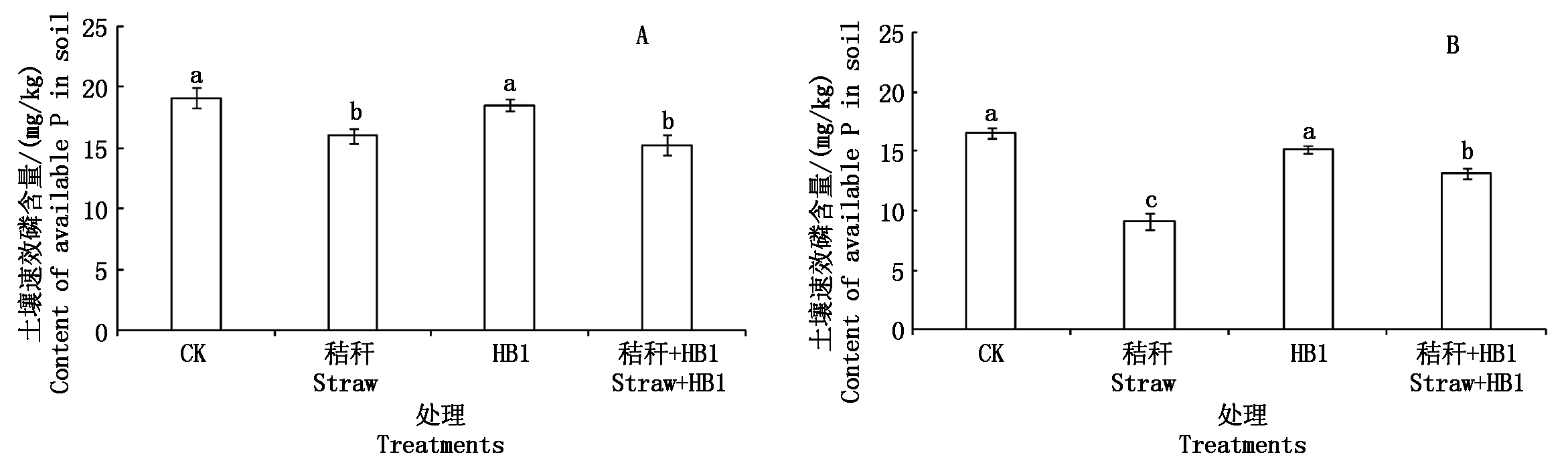
A.土壤培养试验;B.白菜培养试验。图3-5同。
A. Soil incubation experiment;B. Chinese cabbage soil pot experiment.The same as Fig.3-5.
图2 草酸青霉HB1对土壤速效磷含量的影响
Fig.2 Effect of Penicillium oxalicum HB1 on soil available P concentration
2.4 草酸青霉菌HB1对土壤磷活化能力的影响
有研究表明,植物增加吸磷量是溶磷菌溶解土壤磷素能力强弱的体现,其吸磷量和产量是评价微生物溶磷效果的重要指标[12]。因此,本研究采用白菜的总吸磷量来表征土壤磷素被活化的能力。
如表3所示,从地上部累积磷量来看,秸秆处理、HB1处理的磷累积量与CK相比分别增加了59.59%,76.68%;而秸秆+HB1处理的磷累积量与秸秆处理、HB1处理相比分别减少了64.29%,67.74%,且处理之间的差异均达到显著水平(P<0.05)。由此说明,单施HB1菌增加了白菜地上部磷的累积量,而秸秆还田条件下施用HB1菌则显著降低了白菜地上部植株磷累积量,这是由该处理白菜生物量最低造成的。
从根部磷累积量来看,HB1处理的磷累积量与CK相比增加了60.58%,且二者之间差异显著(P<0.05);秸秆+HB1处理比秸秆处理的磷累积量增加了15.00%,这进一步验证了图2-B的结果,添加HB1菌有助于土壤有效磷的增加,从而促进了白菜根系对磷的吸收。
从白菜磷总累积量来看,与CK相比,HB1处理的磷总累积量增加了81.64%,两者之间差异显著(P<0.05)。但秸秆+HB1处理与HB1处理相比减少了64.63%,且二者之间的差异达到显著水平(P<0.05)。由此说明,单施草酸青霉菌HB1不仅促进了白菜的生长,而且明显促进了土壤中难溶性磷的释放,这进一步肯定了在种植植物的情况下施用草酸青霉菌HB1提高了土壤磷素的活化能力。但是,对于施用秸秆和草酸青霉HB1的处理,二者配施虽然促进了土壤磷的释放,促进了根中磷的累积,但是该处理增加的微生物数量与白菜竞争土壤有效养分的程度也加强了,严重抑制了白菜的生长,其生物量最低,因此,白菜植株对磷的累积最少。
表3 草酸青霉菌HB1对白菜各部分磷含量的影响
Tab.3 Effect of Penicillium oxalicum HB1 on the accumulation of phosphorus in different parts of Chinese cabbage
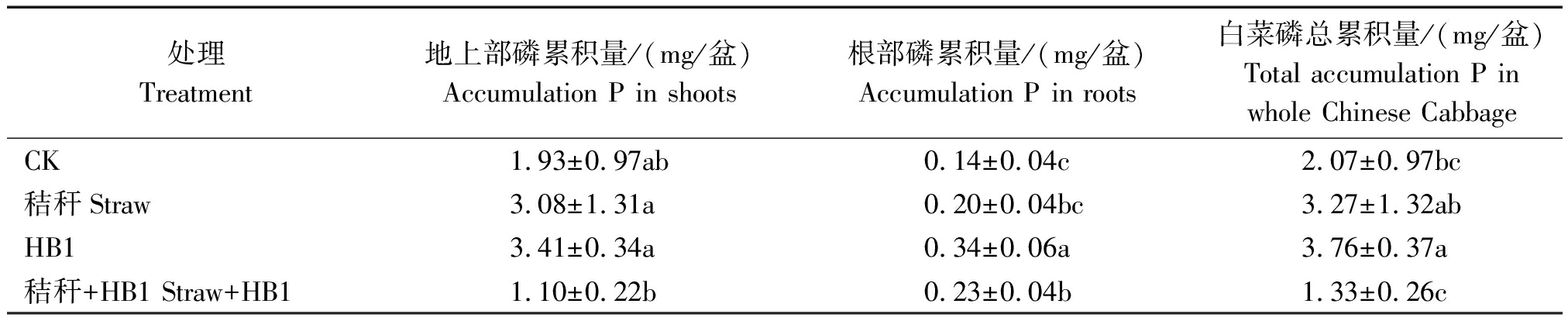
处理Treatment地上部磷累积量/(mg/盆)Accumulation P in shoots根部磷累积量/(mg/盆)Accumulation P in roots白菜磷总累积量/(mg/盆)Total accumulation P in whole Chinese CabbageCK1.93±0.97ab0.14±0.04c2.07±0.97bc秸秆Straw3.08±1.31a0.20±0.04bc3.27±1.32abHB13.41±0.34a0.34±0.06a3.76±0.37a秸秆+HB1 Straw+HB11.10±0.22b0.23±0.04b1.33±0.26c
2.5 草酸青霉菌HB1对土壤碱性磷酸酶活性的影响
土壤磷酸酶是催化土壤中磷酸单酯和磷酸二酯水解的酶,它能将有机磷酯水解为无机磷酸盐,在植物吸收利用土壤有效磷过程中起着重要的作用,其活性可作为土壤供磷能力的重要指标之一[19]。有研究发现,解磷菌剂对土壤中难溶性无机磷的溶解释放程度与土壤的磷酸酶活性有关[20]。本试验的供试土壤属于碱性土壤,因此,针对性测定了不同处理情况下土壤碱性磷酸酶活性。
从图3-A可以看出,秸秆、HB1、秸秆+HB1 3个处理的土壤碱性磷酸酶活性都高于对照,提高幅度分别为37.64%,10.62%,27.11%,且秸秆处理、秸秆+HB1处理的土壤碱性磷酸酶活性与对照相比,其差异达到显著水平(P<0.05)。由此可见,添加小麦秸秆有助于土壤碱性磷酸酶活性的提高。这是由于秸秆中的磷为有机磷源,添加后会促使土壤碱性磷酸酶激活而分解有机态磷,从而导致碱性磷酸酶活性增高。
图3-B为白菜培养试验土壤碱性磷酸酶活性,不同处理间土壤磷酸酶活性差异均不显著。故在白菜培养试验中,小麦秸秆和草酸青霉菌HB1的添加对土壤的碱性磷酸酶活性无明显影响。但是种植白菜的土壤碱性磷酸酶活性高于不种植白菜的土壤,这也说明在种植白菜的情况下,白菜根系分泌物缓解了秸秆和草酸青霉菌对土壤中碱性磷酸酶的活性的影响课题组前期研究发现,草酸青霉菌HB1能增强纤维素酶的活性,从而能高效分解纤维素,促进秸秆腐解[11]。因此,本试验进一步探究HB1菌在秸秆还田条件下溶解土壤难溶性磷的同时,其对秸秆的分解能力。
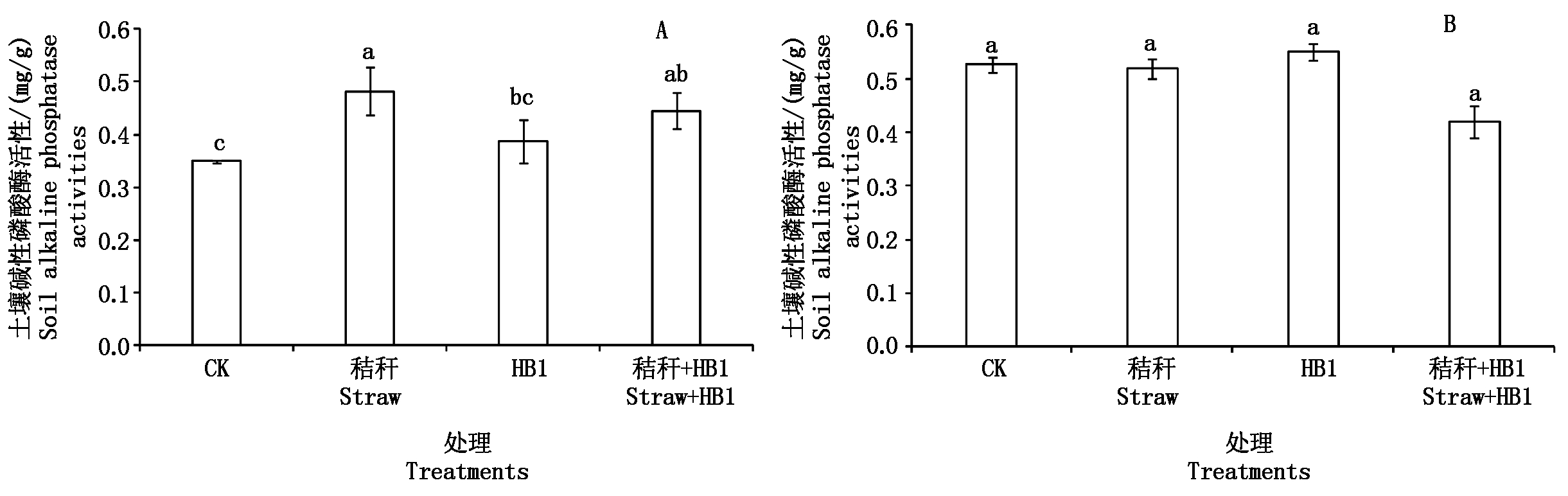
图3 草酸青霉HB1对土壤碱性磷酸酶活性的影响
Fig.3 Effect of Penicillium oxalicum HB1 on soil alkaline phosphatase activities
2.6 草酸青霉菌HB1对土壤纤维素酶活性的影响
课题组前期研究发现,草酸青霉菌HB1能增强纤维素酶的活性,从而能高效分解纤维素,促进秸秆腐解[11]。因此,本试验进一步探究HB1菌在秸秆还田条件下溶解土壤难溶性磷的同时,其对秸秆的分解能力。
图4-A为土壤培养试验中不同处理土壤纤维素酶的活性。HB1处理的纤维素酶活性与对照相比提高了56.41%,且二者之间差异显著(P<0.05);而其他处理与对照之间差异均不明显。可见,添加草酸青霉菌HB1能够显著地提高土壤纤维素酶的活性。
从图4-B可以看出,在种植白菜的条件下,秸秆处理和HB1处理的土壤纤维素酶活性与对照相比,分别提高了27.79%和12.32%,但差异不显著;秸秆+HB1处理的土壤纤维素酶活性最高,与对照之间差异显著(P<0.05)。因此,在种植白菜时,单纯加入秸秆或草酸青霉菌HB1不会引起土壤的纤维素酶活性大幅度变化,而同时加入秸秆和HB1能够有效提高土壤纤维素酶活性。
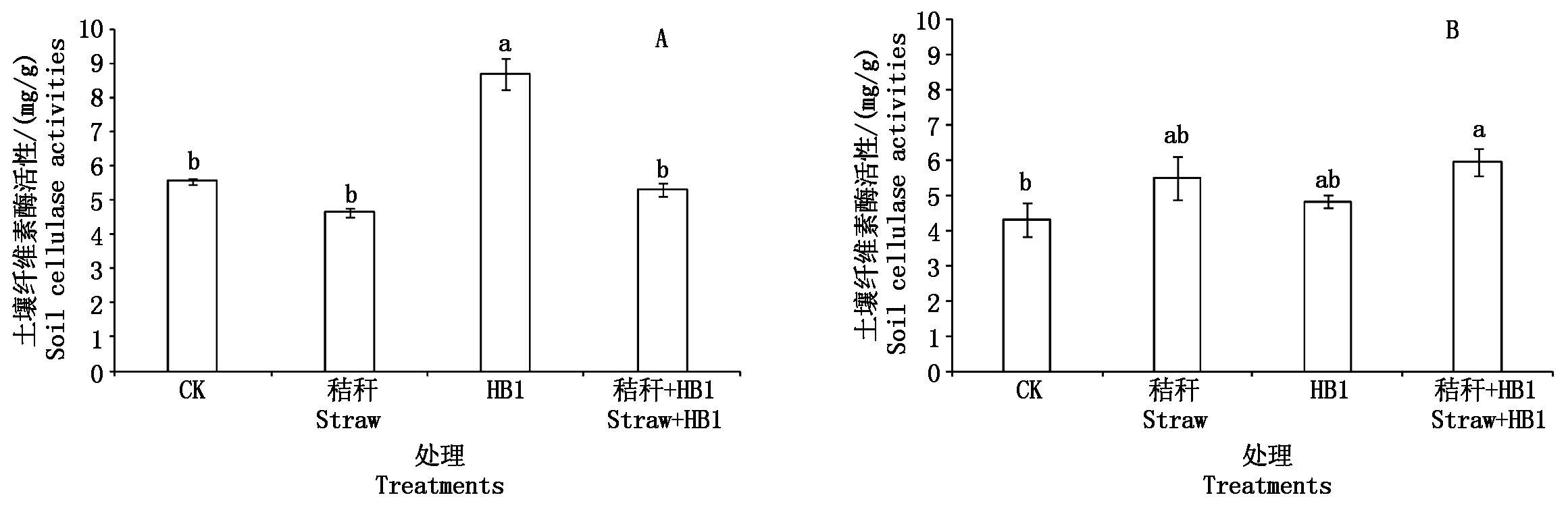
图4 草酸青霉HB1对土壤纤维素酶活性的影响
Fig.4 Effect of Penicillium oxalicum HB1 on soil cellulase activities
2.7 草酸青霉菌HB1对土壤中微生物数量的影响
为了探究草酸青霉菌HB1作为溶磷且能分解纤维素的真菌施入土壤后,对种植植物和不种植植物的土壤中微生物群落数量的影响,本试验测定了白菜收获后土壤中细菌、真菌和放线菌的有效活菌数。
在土壤培养条件下(图5-A),秸秆、HB1、秸秆+HB1处理与对照相比,细菌和真菌的有效活菌数分别增加了140.00%,108.75%,156.25%和60.79%,96.45%,142.19%,且差异均达到显著水平(P<0.05);而不同处理对土壤中放线菌的有效活菌数没有产生显著影响。由此可知,无论是添加秸秆还是添加HB1菌或是二者配施均能显著增加土壤中的细菌和真菌的有效活菌数。这说明HB1菌的添加不会降低土壤中土著微生物的数量,反而改善了土壤的微生物学性状。
在种植白菜条件下(图5-B),秸秆、HB1、秸秆+HB1处理与对照相比,细菌、真菌的有效活菌数分别提高了52.67%,27.48%,64.12%和98.11%,33.02%,101.35%,且差异均达到显著水平(P<0.05);秸秆、HB1、秸秆+HB1处理的放线菌有效活菌数与对照相比分别增加了9.43%,29.06%,3.77%,其中添加HB1菌的处理和对照之间的差异达到显著水平(P<0.05)。由此可知,在种植植物的情况下添加HB1菌能有效增加土壤中细菌、真菌和放线菌的数量,改善土壤生物学性状,影响土壤微生物环境。
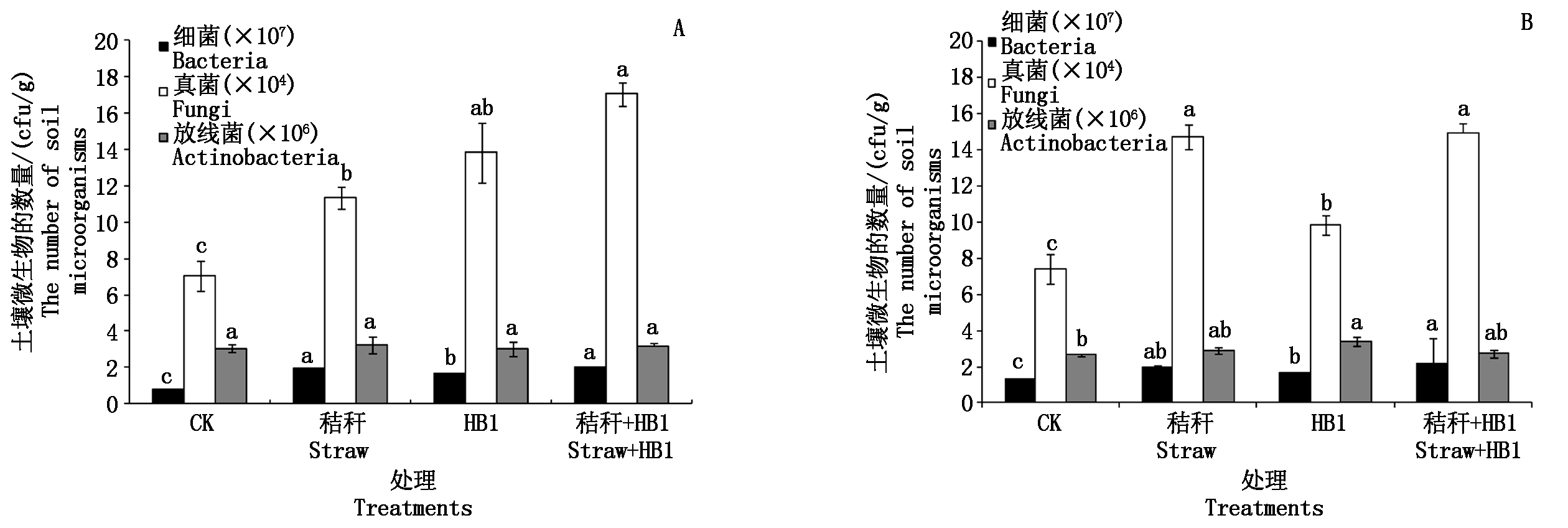
图5 草酸青霉HB1对土壤微生物数量的影响
Fig.5 Effect of Penicillium oxalicum HB1 on the number of soil microorganisms
3 讨论与结论
草酸青霉菌HB1具有分解纤维素和溶解土壤中固定态磷的双重功能[16],可促进植物的生长。在本研究中添加草酸青霉菌HB1的白菜生物量增加了21.61%,这说明HB1菌对白菜有促生效应。综合前人的研究发现,在难溶性磷源丰富的条件下施用斜卧青霉菌(Penicillium decumbens) P83,其玉米植株地上部与地下部的干物质分别增加了26.09%和35.42%[3];在不同磷水平土壤中(有效磷:1号土13.5 mg/L;2号土4.7 mg/L;3号土5.2 mg/L)接种草酸青霉菌P8能有效增加花生和油菜的生物量,其收获第1茬的增幅分别为10.21%~30.39%和11.85%~39.58%[12];此外,从大麦根际土壤中筛选出的一株枯草芽孢杆菌具有高效的解磷促生能力,该菌对小白菜的促生作用明显,鲜质量增幅达到16.72%[21]。这说明溶磷菌不仅能促进单子叶植物的生长,并且对双子叶植物的促生效果也较为明显。本试验小组前期研究发现,添加草酸青霉菌HB1后小麦植株生物量增加了16.80%[16],这说明HB1菌对单子叶植物和双子叶植物均有促生效果。
草酸青霉菌HB1的促生效应可能与其溶解土壤中难溶性磷的能力及改善土壤生物学环境有关。本研究供试土壤中Olsen-P含量为12.30 mg/kg,属于极低的肥力等级[22],在土壤有效磷源如此匮乏的情况下种植白菜势必会影响其生长,但是施用草酸青霉菌HB1却促进了植物的生长,这与该菌活化磷的能力密切相关。作物增加吸磷量是溶磷菌溶磷效果的体现[12],接种溶磷菌组合革兰氏阴性菌(Pseudomonas fluorescens)与阳性菌(Bacillus megaterium)处理的玉米植株磷的吸收量显著高于未接菌处理,增幅达到50%~60%[23]。本研究的结果也证明了这一点,草酸青霉菌HB1的添加促进了白菜磷的总累积量,并且比对照增加了81.64%,这说明在没有外源磷添加的情况下HB1菌有效活化了土壤中难溶性磷,提高了白菜不同生长阶段土壤磷的植物有效性,促进了白菜的生长。值得注意的是,在目前农药化肥减施的前提下,一定比例的有机肥和微生物肥料替代化肥成为当前科学施肥技术的重点研究领域,那么在秸秆还田的情况下,施用微生物菌剂其促生效果和活化土壤养分的能力是否会受到影响,本研究的结果为解答该问题提供了数据和理论支持。在本研究中,白菜鲜质量,HB1处理比秸秆+HB1处理增加了152.21%;溶磷能力,秸秆+HB1处理比HB1处理降低了64.63%,在秸秆还田条件下施用该菌后,白菜的生物量和吸磷量均为最低,这说明草酸青霉菌HB1对白菜的促生效应和溶解土壤磷的能力在秸秆还田的情况下受到一定程度的抑制。因此,针对秸秆还田条件,在HB1菌的施用量、施用时期和施用方法对植物的促生效应和活化磷能力的影响等方面应展开深入研究。
土壤磷酸酶能将有机磷酯水解为无机磷酸,土壤中的有机磷在磷酸酶的作用下才能转化为能被植物利用的无机磷[24]。通过土壤培养试验研究发现,添加小麦秸秆的2组处理土壤碱性磷酸酶活性提高较明显,其原因是秸秆中的磷为有机磷源,秸秆添加后加速了土壤磷酸酶的分解,从而导致磷酸酶活性增高。有研究发现,通过施用降解菌种使秸秆还田,测得5年后土壤中碱性磷酸酶活性比对照提高4.35倍[25]。因此,秸秆还田有助于土壤碱性磷酸酶活性提高。另外,耿丽平等[11]研究发现,草酸青霉菌HB1能显著地提高土壤纤维素酶的活性,并且具有较强的秸秆分解能力。本研究也发现在土壤培养试验中,添加草酸青霉菌HB1处理的土壤纤维素酶活性比对照提高了56.41%,且二者之间差异显著;在白菜培养试验中与对照相比也提高了12.32%。由此可见,草酸青霉菌HB1的施加能够提高土壤纤维素酶的活性。
微生物是土壤中最活跃的肥力因子之一。细菌、真菌和放线菌构成了土壤微生物的主要生物量,它们的数量变化和区系组成常能反映出土壤生物活性水平[10]。本研究发现,无论是在土壤培养试验还是白菜培养试验中,HB1菌的添加并没有降低土壤微生物的数量,细菌、真菌的有效活菌数与对照相比反而有不同程度的增加,且差异均达到显著水平。已有研究表明,在盆栽试验中无论是单独还是双接种溶磷细菌和丛枝菌根真菌均能提高根基土壤中微生物的数量,增加土壤中的微生物多样性,改善土壤的微生物环境[26]。另外,在温室土壤灭菌盆栽条件下接种丛枝菌根AM真菌,结果发现,土壤中的细菌、真菌数量分别比未接菌处理增加了4.30%和45.23%,差异均达到显著水平,改善了根际土壤的生物学性状。由此,草酸青霉菌HB1在一定程度上影响了土壤的微生物环境[27]。
综上所述,草酸青霉菌HB1能有效溶解土壤中难溶性磷,增强白菜对土壤磷的吸收利用,并从关键性土壤酶和土壤微生物数量方面改善土壤的生物学性状。
草酸青霉菌HB1的施用增加了白菜生物量,其增幅达到21.61%。同时HB1菌有效地溶解了土壤中难溶性磷源,增强了白菜不同生长阶段对土壤磷的植物有效性,提高了白菜磷的累积量,提高幅度为81.64%,促生效果显著。但在秸秆还田条件下HB1菌的促生作用受到了抑制,白菜的生物量和植株磷的累积量均为最低值。
小麦秸秆和草酸青霉菌HB1的添加能够改善土壤的相关酶活性。在土壤培养试验中,添加小麦秸秆2组处理的土壤碱性磷酸酶活性均有所升高,分别比对照显著增加了37.64%和27.11%;另外,添加草酸青霉菌HB1使土壤的纤维素酶活性也得到了显著性提升,增幅达到56.41%。
添加小麦秸秆、草酸青霉菌HB1或二者共施均能够改变土壤的微生物环境。在土壤培养条件下,秸秆、HB1、秸秆+HB1处理的细菌和真菌有效活菌数增加幅度为108.75%~156.25%和60.79%~142.19%;在种植白菜条件下,秸秆、HB1、秸秆+HB1处理的细菌、真菌的有效活菌数增加幅度为27.48%~64.12%和33.02%~101.35%。
[1] 陈丹阳, 李汉全, 张炳火, 查代明, 杨建远. 两株解磷细菌的解磷活性及作用机制研究[J]. 中国生态农业学报, 2017, 25(3): 410-418. doi: 10.13930/j.cnki.cjea.160667.
Chen D Y, Li H Q, Zhang B H, Zha D M, Yang J Y. Phosphate solubilization activities and action mechanisms of two phosphate-solubilizing bacteria [J]. Chinese Journal of Eco-agriculture, 2017,25(3):410-418. doi: 10.13930/j.cnki.cjea.160667.
[2] 滕泽栋, 李敏, 朱静, 宋明阳. 解磷微生物对土壤磷资源利用影响的研究进展[J]. 土壤通报, 2017, 48(1): 229-235. doi: 10.19336/j.cnki.trtb.2017.01.30.
Teng Z D, Li M, Zhu J, Song M Y. Research advances in effect of phosphate-solubilizing microorganisms on soil phosphorus resource utilization [J]. Chinese Journal of Soil Science, 2017,48(1):229-235. doi: 10.19336/j.cnki.trtb.2017.01.30.
[3] 史发超. 高效溶磷真菌的筛选鉴定及溶磷促生效果研究[D]. 北京:中国农业科学院, 2014.
Shi F C. Screening, identification of P-dissolving fungus and effects on phosphate solubilization and plant growth promotion[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation, 2014.
[4] 林启美, 赵海英, 赵小蓉. 4株溶磷细菌和真菌溶解磷矿粉的特性[J]. 微生物学通报, 2002, 29(6): 24-28. doi:10.3969/j.issn.0253-2654.2002.06.007.
Lin Q M, Zhao H Y, Zhao X R. The characteristics of solubilizing rock phosphate by four isolates of bacteria and fungi [J]. Microbiology, 2002,29(6):24-28. doi:10.3969/j.issn.0253-2654.2002.06.007.
[5] Hariprasad P, Niranjana S R.Isolation and characterization of phosphate solubilizing rhizobacteria to improve plant health of tomato[J].Plant and Soil,2009,316(1/2):13-24.doi:10.1007/s11104-008-9754-6.
[6] Singh H, Reddy M S.Effect of inoculation with phosphate solubilizing fungus on growth and nutrient uptake of wheat and maize plants fertilized with rock phosphate in alkaline soils[J].European Journal of Soil Biology,2011,47(1):30-34.doi:10.1016/j.ejsobi.2010.10.005 .
[7] 范丙全, 金继运, 葛诚. 溶磷真菌促进磷素吸收和作物生长的作用研究[J]. 植物营养与肥料学报, 2004, 10(6): 620-624. doi: 10.3321/j.issn:1008-505X.2004.06.012.
Fan B Q, Jin J Y, Ge C. Effect of phosphate-dissolving fungi on growth and Phosphorus uptake of crops [J]. Plant Nutrition and Fertilizer Science, 2004,10(6):620-624. doi: 10.3321/j.issn:1008-505X.2004.06.012.
[8] 王莉晶, 高晓蓉, 吕军, 安利佳. 解磷真菌C2'的分离鉴定及其在土壤中实际解磷效果的研究[J]. 土壤通报, 2009, 40(4): 771-775. doi: 10.19336/j.cnki.trtb.2009.04.012.
Wang L J, Gao X R, Lü J, An L J. Phosphate-solubilizing mechanism of C2′ and Its Actual Phosphate-solubilizing effect in soil [J]. Chinese Journal of Soil Science, 2009,40(4):771-775. doi: 10.19336/j.cnki.trtb.2009.04.012.
[9] 闫瑞瑞, 卫智军, 乌仁其其格,陈金强,代景忠,姚静,白玉婷,辛晓平.微生物肥料对呼伦贝尔打孔羊草草甸草原土壤微生物及酶活性的影响研究[J]. 生态环境学报, 2017, 26(4): 1674-5906. doi: 10.16258/j.cnki.1674-5906.2017.04.008.
Yan R R, Wei Z J, Wuren Q Q G, Chen J Q, Dai J Z, Yao J, Bai Y T, Xin X P. Effect of combined microbial fertilizer on soil microorganism and enzyme activity in the hulunber punching leymus chinensis meadow steppe [J]. Ecology and Environmental Sciences, 2017,26(4):1674-5906. doi: 10.16258/j.cnki.1674-5906.2017.04.008.
[10] 范富, 张庆国, 邰继承, 侯迷红, 孙德智, 王闪闪, 张佳楠. 玉米秸秆夹层改善盐碱地土壤生物性状[J]. 农业工程学报, 2015, 31(8): 133-139. doi: 10.3969/j.issn.1002-6819.2015.08.020.
Fan F, Zhang Q G, Tai J C, Hou M H, Sun D Z, Wang S S, Zhang J N. Biological traits on corn straw interlayer in improving saline-alkali soil [J]. Transactions of the Chinese Society of Agricultural Engineering, 2015,31(8):133-139. doi: 10.3969/j.issn.1002-6819.2015.08.020.
[11] 耿丽平, 陆秀君, 赵全利, 高宁大, 刘文菊. 草酸青霉菌产酶条件优化及其秸秆腐解能力[J]. 农业工程学报, 2014, 30(3): 170-179. doi:10.3969/j.issn.1002-6819.2014.03.023.
Geng L P, Lu X J, Zhao Q L, Gao N D, Liu W J. Optimization of enzyme-production conditions of Penicillium oxalicum and its ability for decomposition of stalks [J]. Transactions of the Chinese Society of Agricultural Engineering, 2014,30(3):170-179. doi:10.3969/j.issn.1002-6819.2014.03.023.
[12] 范丙全. 北方石灰性土壤中青霉菌P8(Penicillium oxalicum)活化难溶磷的作用和机理研究[D]. 北京:中国农业科学院, 2001.
Fan B Q. Study on effects and mechanisms of Penicillium oxalicum on solubilization of insoluble phosphate from calcareous soils in North China[D]. Beijing:Chinese Academy of Agricultural Sciences Dissertation, 2001.
[13] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
Bao S D. Soil agro-chemistrical analysis[M]. 3rd ed. Beijing:China Agriculture Press,2000
[14] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
Lu R K. Soil argrochemistry analysis protocoes[M]. Beijing:China Agricultural Science and Technology Press,2000.
[15] 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010.
Lin X G. Principles and methods of soil microbiology[M]. Beijing:Higher Education Press,2010.
[16] 耿丽平. 秸秆还田土壤中高效纤维素分解菌的筛选、鉴定及其生物效应研究[D]. 保定: 河北农业大学, 2012. doi: 10.7666/d.y2143075.
Geng L P. Isolation of cellulose-decomposing bacteria in soil with long-term straw returning and study on the biological effects[D].Baoding:Agricultural University of Hebei, 2012. doi: 10.7666/d.y2143075.
[17] 孙婧, 田永强, 高丽红, 彭杏敏, 佟二建. 秸秆生物反应堆与菌肥对温室番茄土壤微环境的影响[J]. 农业工程学报, 2014, 30(6): 153-164. doi: 10.3969/j.issn.1002-6819.2014.06.019.
Sun J, Tian Y Q, Gao L H, Peng X M, Tong E J. Effects of straw biological reactor and microbial agents on physicochemical properties and microbial diversity of tomato soil in solar greenhouse [J]. Transactions of the Chinese Society of Agricultural Engineering, 2014,30(6):153-164. doi: 10.3969/j.issn.1002-6819.2014.06.019.
[18] 兰丽丽, 李东海, 王继红, 孙越, 李玲, 李芳明. 添加作物秸秆对土壤酸度变化的影响[J]. 吉林农业大学学报, 2016, 38(1): 74-79. doi: 10.13327/j.jjlau.2015.2632.
Lan L L, Li D H, Wang J H, Sun Y, Li L, Li F M. Effects of crop straw on amelioration of soil acidity [J]. Journal of Jilin Agricultural University, 2016,38(1):74-79. doi: 10.13327/j.jjlau.2015.2632.
[19] 李小磊. 微生物菌剂及耕作方式对小麦/玉米土壤生物化学特性的影响[D]. 保定: 河北农业大学, 2011. doi: 10.7666/d.y1897119.
Li X L. The influences of tillage and application of microbial inoculants on soil chemical and biological characteristics in rotation of wheat and corn[D].Baoding:Agricultural University of Hebei, 2011. doi: 10.7666/d.y1897119.
[20] 郜春花, 张强, 卢朝东, 董云中, 王岗, 张乃明. 选用解磷菌剂改善缺磷土壤磷素的有效性[J]. 农业工程学报, 2005, 21(5): 56-59. doi:10.3321/j.issn:1002-6819.2005.05.013.
Gao C H, Zhang Q, Lu C D, Dong Y Z, Wang G, Zhang N M. Improving the availability of soil phosphate by phosphate liberation bacteria [J]. Transactions of the Chinese Society of Agricultural Engineering, 2005,21(5):56-59. doi:10.3321/j.issn:1002-6819.2005.05.013.
[21] 邢芳芳, 高明夫, 禚优优, 胡兆平, 李新柱. 大麦根际高效溶磷菌的筛选、鉴定及促生效果研究[J]. 华北农学报, 2016, 31(S1): 252-257. doi: 10.7668 /hbnxb.2016.S1.042.
Xing F F, Gao M F, Zhuo Y Y, Hu Z P, Li X Z. Screening and identification of phosphate solubilizing bacteria in hordeum vulgare rhizosphere and its growth promoting effect [J]. Acta Agriculturae Boreali-Sinica, 2016,31(S1):252-257. doi: 10.7668 /hbnxb.2016.S1.042.
[22] 张福锁, 陈新平, 陈清. 中国主要作物施肥指南[M]. 北京: 中国农业大学出版社, 2009.
Zhang F S, Chen X P, Chen Q. Guidelines for fertilization of major crops in China[M]. Beijing:China Agricultural University Press,2009.
[23] 王誉瑶, 韦中, 徐阳春, 沈其荣. 溶磷菌株组合的溶磷效应及对玉米生长的影响[J]. 植物营养与肥料学报, 2017, 23(1): 262-268. doi: 10.11674/zwyf.16087.
Wang Y Y, Wei Z, Xu Y C, Shen Q R. Dissolving capacity of phosphate dissolving bacteria strains [J]. Plant Nutrition and Fertilizer Science, 2017,23(1):262-268. doi: 10.11674/zwyf.16087.
[24] 战厚强, 颜双双, 王家睿, 马春梅, 龚振平, 董守坤, 张钦文. 水稻秸秆还田对土壤磷酸酶活性及速效磷含量的影响[J]. 作物杂志, 2015(2): 78-83. doi: 10.16035/j.issn.1001-7283.2015.02.016.
Zhan H Q, Yan S S, Wang J R, Ma C M, Gong Z P, Dong S K, Zhang Q W. Effects of rice straw returning on activities of soil phosphatase and available P values in soil [J]. Crops, 2015(2):78-83. doi: 10.16035/j.issn.1001-7283.2015.02.016.
[25] 李鑫, 孙玉禄, 孙立梅. 施用降解菌种使秸秆还田对土壤酶活性玉米产量的影响[J]. 园艺与种苗, 2015(1): 896-2095. doi: 10.3969/j.issn.2095-0896.2015.01.011.
Li X, Sun Y L, Sun L M. Affect of straw returning with degrading bacteria on soil enzyme activity and corn production [J]. Horticulture & Seed, 2015(1):896-2095. doi: 10.3969/j.issn.2095-0896.2015.01.011.
[26] 付晓峰, 张桂萍, 张小伟, 任嘉红. 溶磷细菌和丛枝菌根真菌接种对南方红豆杉生长及根际微生物和土壤酶活性的影响[J]. 西北植物学报, 2016, 36(2): 353-360. doi: 10.7606/j.issn.1000-4025.2016.02.0353.
Fu X F, Zhang G P, Zhang X W, Ren J H. Effects of PSB and AMF on growth,microorganisms and soil enzyme activities in the rhizosphere of Taxus chinensis var.mairei seedings [J]. Acta Botanica Boreali-Occidentalia Sinica, 2016,36(2):353-360. doi: 10.7606/j.issn.1000-4025.2016.02.0353.
[27] 孙秀秀, 贺超兴, 李衍素, 于贤昌. AM真菌对黄瓜根围土壤微生物群落功能的影响[J]. 菌物学报, 2017, 36(7): 892-903. doi: 10.13346/j.mycosystema.170054.
Sun X X, He C X, Li Y S, Yu X C. Effects of arbuscular mycorrhizal fungi on microbial community and function in the rhizosphere soil of cucumber plants [J]. Mycosystema, 2017,36(7):892-903. doi: 10.13346/j.mycosystema.170054.