光呼吸是植物中除光合作用以外的第二大代谢流[1-4],光呼吸代谢起始于2-磷酸乙醇酸的生成,2-磷酸乙醇酸经磷酸酶水解成乙醇酸(GLC)并被运至过氧化物酶体从而进入光呼吸乙醇酸代谢途径[5]。乙醇酸氧化酶(Glycolate oxidase, 简称GLO, EC 1.1.3.15)是一类黄素蛋白氧化酶,在光呼吸途径中,GLO负责氧化乙醇酸生成乙醛酸(GLX)并产生等量的H2O2[6]。已知GLO普遍集中在绿色植物的叶片表达,其他部位表达量较低[7-9]。GLO活性的变化不但直接调节着植物光呼吸速率还对植物光合作用有着间接的调控功能[10]。例如,抑制GLO可导致水稻光合速率下降, 而过表达GLO则可提升高光高温条件下水稻的光合速率[11-12]。此外,GLO在植物逆境响应过程中也具有重要功能,植物的GLO活性可被各种环境胁迫所诱导[13-15],在干旱胁迫条件下烟草(Nicotiana tabacum)、豌豆(Pisurn sativurn)及豇豆(Vigna catjang)中GLO活性均显著上升[16-18]。在植物抵御病原菌入侵过程中GLO活性也存在上调现象[19-20]。Rojas等[21]发现烟草及拟南芥(Arabidopsis thaliana)的非寄主抗性与GLO氧化乙醇酸生成的H2O2紧密相关。而Noctor等[22]证实C3植物中约70%的H2O2来源于光呼吸中的乙醇酸氧化过程,且在干旱及高温等逆境条件下这一比例会变得更高。因此,GLO可能在H2O2相关的信号途径中发挥着重要功能[23-25]。
Zelitch等[26]首次从菠菜叶中纯化得到了GLO蛋白(SpGLO),随后的多肽测序进一步鉴定了SpGLO的一级结构[27],这使得SpGLO成为研究黄素蛋白氧化酶类的最佳模式蛋白。SpGLO先后在酿酒酵母(Saccharomyces cerevisiae)、大肠杆菌(Escherichia coli)、毕赤酵母(Pichia pastoris)及汉逊酵母(Hansenula polymorpha)中进行过异源表达[28-29],此外SpGLO还被用于乙醛酸的生物催化合成研究[30]。然而,目前关于SpGLO的酶学特性研究结果比较琐碎,其全面系统的酶学特性研究还未见报道。此外,SpGLO同工酶的种类仍存在争议[31],并且适合SpGLO的同工酶电泳方法也一直未见报道。本研究克隆了SpGLO基因,将其在酿酒酵母中进行了异源表达与纯化,并在现有研究报道的基础上进一步全面系统分析了SpGLO的酶学特性。此外本研究利用改进的GLO同工酶电泳方法,首次通过同工酶电泳技术分析得出SpGLO含有2条GLO同工酶谱带。对SpGLO酶学特性及其同工酶组成的进一步阐明,可望为今后在植物中调节或改造光呼吸代谢进而提高植物光合效率以及研究植物抗逆机制等提供理论依据与切入点。
1 材料和方法
1.1 材料与试剂
1.1.1 试验材料 菠菜(Spinacea oleracea, American hybrid 424)、 大肠杆菌(Escherichia coli)菌株DH5α、酵母菌(Saccharomyces cerevisiae, INVSC1) (his3Δ1/his3Δ1 leu2/leu2 trp1-289/trp1-289 ura3-52/ura3-52)与酵母表达载体pYES2购自Invitrogen公司。反转录试剂盒 PrimeScript TM II 1st Strand cDNA Synthesis Kit购自宝生物。pMD19-T 载体和基因操作相关的酶均购自TaKaRa公司。蛋白纯化柱(ProfinityTM IMAC resin column,10×64 mm)购自Bio-Rad公司。其他基因操作相关的试剂盒购自北京天根生物技术公司,其他化学试剂为生工生物产品。
1.1.2 培养基 YPD液体培养基:胰蛋白胨20 g,酵母提取物10 g,葡萄糖20 g,水1 000 mL;固体YPD培养基添加15 g/L琼脂。SC缺陷培养基(缺少尿嘧啶):YNB 6.7 g,葡萄糖20 g,根据酵母表达载体pYES2质粒的基因标记补加16种氨基酸、腺嘌呤,水1 000 mL;固体SC缺陷培养基添加15 g/L琼脂。SC诱导缺陷培养基,在SC缺陷培养基的基础上用D-半乳糖替代葡萄糖。
1.2 试验方法
1.2.1 总RNA提取及cDNA的合成 取0.2 g叶片,液氮研磨,加1 mL TRIzol,振荡混匀,室温放置5 min;12 000 r/min离心5 min,收集上清;加入200 μL氯仿,振荡混匀,室温放置15 min;4 ℃,12 000 r/min离心15 min,收集上清;加500 μL异丙醇,振荡混匀,放置30 min;4 ℃,12 000 r/min离心10 min,弃上清;加1 mL 75%乙醇洗涤沉淀,4 ℃,12 000 r/min离心5 min,通风橱中风干,加84.4 μL DEPC水溶解;然后在84.4 μL的RNA溶液中,加入10 μL 10×DNase Ⅰ Buffer,1.6 μL HPR Ⅰ (40 U/μL)和4 μL DNase Ⅰ(5 U/μL),总体系100 μL,37 ℃处理1 h,除去DNA;加75 μL水饱和酚,25 μL氯仿,充分振荡,冰浴10 min;4 ℃,12 000 r/min离心5 min,取上清;加1/10体积的3 mol/L NaAc和2倍体积无水乙醇,-20 ℃放置30 min;4 ℃,12 000 r/min离心5 min,弃上清;加500 μL 75%乙醇洗涤沉淀,通风橱中风干,用100 μL DEPC水溶解,用NanoDrop-1000测定浓度及质量[32-34]。选取高质量的RNA以反转录试剂盒合成cDNA以作为模板用于后续的SpGLO基因扩增。
1.2.2 菠菜SpGLO基因表达序列的克隆 根据NCBI数据库提供的菠菜(S. oleraceai, American hybrid 424)中SpGLO基因mRNA序列信息(J03492.1),设计特异引物(引物于生工合成)并以菠菜叶片cDNA为模板,利用PCR高保真酶KOD plus扩增目标序列,产物纯化后连接到pMD19-T载体上并测序鉴定。再次设计特异引物且在上游引物增加1个6-His标签,以测序后的pMD19-T-SpGLO载体为模板扩增SpGLO基因的CDS区域,然后将整个NHisSpGLO片段克隆至pYES2载体。
1.2.3 酿酒酵母的转化 酿酒酵母的转化参照Gietz等[35-36]1992年建立的PEG介导热击转化法。将酵母菌种INVSC1划线至YPD平板于30 ℃培养3 d,挑取单菌落接种至10 mL YPD液体培养基中,30 ℃,250 r/min培养18 h。测定酵母液OD600,吸取适量该菌液至50 mL YPD液体培养基使得其OD600最终为0.4;然后于30 ℃,250 r/min培养3 h。室温5 000 r/min,5 min离心收集上述菌体,将菌体用1×TE (10 mmol/L)洗涤1次,以同样条件收集洗涤后的菌体,将菌体沉淀重悬于2 mL的1×LiAc (100 mmol/L)/0.5×TE中,室温孵化10 min。吸取100 μL孵化后的菌体与2 μL的pYES2-NHisSpGLO载体混匀,并加入700 μL的1×LiAc/40%PEG4000/1×TE,于30 ℃孵化30 min。最后加入88 μL DMSO,42 ℃热冲击7 min进行转化,室温离心收集菌体,取100 μL 1×TE重悬菌体,并涂于固体SC缺陷培养基上30 ℃培养3 d进行筛选。
1.2.4 菠菜GLO蛋白的表达与纯化 NHisSpGLO在酵母菌中的诱导表达参考Invitrogen公司的操作手册,挑选固体SC缺陷培养基上的酵母单菌落至10 mL 液体SC缺陷培养基中,30 ℃,250 r/min培养18 h。测定上述酵母液OD600,吸取适量菌液至50 mL SC诱导液体培养基中使得其OD600最终为0.4;30 ℃,250 r/min培养约20 h,于4 ℃,5 000 r/min,5 min离心收集菌体并利用酸洗玻璃珠进行振荡破碎。将该酵母破碎液与His-tag亲和柱层析上样缓冲液(600 mmol/L NaCl,10 mmol/L咪唑,100 mmol/L PBS pH值8.0)等量混匀后上蛋白纯化柱,先以1 mL/min流速用His-tag亲和柱洗涤缓冲液(300 mmol/L NaCl,10 mmol/L咪唑,50 mmol/L PBS pH值8.0)洗涤约10个柱体积,然后以1 mL/min流速用His-tag亲和柱洗脱缓冲液(300 mmol/L NaCl,250 mmol/L咪唑,50 mmol/L PBS pH值8.0)洗脱5个柱体积,收集洗脱所得的目的蛋白。纯化的蛋白经过超滤脱盐可保存于-80 ℃备用。
1.2.5 酶偶联法测定GLO活性 参照彭新湘和李明启[37]的方法并略有改动。1 mL测定体系中含0.52 mL 100 mmol/L的磷酸缓冲液PBS (pH值8.0),0.1 mL 30 mmol/L的4-氨基安替吡啉,0.1 mL的150 U/mL辣根过氧化物酶POD(现配现用),0.1 mL 20 mmol/L苯酚(现配现用),0.1 mL 1 mmol/L黄素单核苷酸FMN,0.05 mL 100 mmol/L GLC,0.03 mL酶液(适情况稀释),摇匀于25 ℃恒温保温1 min后,测定其在520 nm波长下的吸收值的变化,共测定1 min。
GLO酶动力学参数测定参考Lineweaver 和Burk[38]的方法,分别在不同底物浓度梯度条件下测定反应速度(乙醇酸:0.1~0.8 mmol/L;乙醛酸:1.0~8.0 mmol/L;甘油酸:0.5~6.0 mmol/L),通过双倒数作图计算得到各米氏常数Km,测定草酸的抑制常数Ki时草酸的浓度为1.0~8.0 mmol/L,Ki同样结合双倒数作图计算获得[38-39]。
1.2.6 GLO同工酶谱分析 菠菜叶片中的SpGLO蛋白在进行GLO同工酶电泳前进行了部分纯化,具体步骤如下:先用10%的预冷冰醋酸缓慢加入离心后的菠菜叶片粗提液上清液中至pH值5.8,静置15 min;4 ℃,12 000 r/min离心20 min,取上清。然后缓慢添加固体(NH4)2SO4 到上清液至20%饱和度,静置20 min;4 ℃,12 000 r/min离心20 min,取上清后再加 (NH4)2SO4 到上清液至饱和度达到40%,静置4 h;4 ℃,14 000 r/min离心20 min,弃上清。用适量预冷的20 mmol/L PBS pH值7.8充分溶解沉淀。静置20 min后,4 ℃,14 000 r/min离心20 min,取上清液至Sephadex G-50层析柱(2.0 cm×32 cm),以预冷的20 mmol/L PBS pH值8.0洗脱,流速为3.0 mL/min,收集活性部分。将活性部分进行超滤浓缩用于后续电泳。GLO同工酶电泳为ClearNative-PAGE体系,使用Caps-氨水缓冲液(pH值10.2)为电泳液[40],其电泳条件为6%的分离胶,3%的浓缩胶,于4 ℃,100 V电泳9 h后利用GLO活性染色液(NBT 0.016% m/V,吩嗪二甲酯硫酸盐PMS 0.003% m/V,FMN 0.1 mmol/L,GLC 5 mmol/L,PBS 100 mmol/L pH值8.0)于25 ℃染色20 min,然后观察。
1.2.7 蛋白浓度测定 粗酶液蛋白含量利用考马斯亮蓝法测定[41-43],纯化后的蛋白含量利用NanoDrop ND-1000测定。
2 结果与分析
2.1 菠菜SpGLO蛋白的表达与纯化
本试验中为了纯化酵母异源表达的SpGLO蛋白,在SpGLO的N端融合有1个组氨酸标签(NHis),将构建好的pYES2-NHisSpGLO载体与pYES2空载体分别转入酿酒酵母表达菌株INVSC1中,先按Invitrogen操作手册诱导发酵10 h,然后破碎酵母并测定粗酶GLO活性,发现转有pYES2-NHisSpGLO的酿酒酵母粗酶液可检测到GLO活性,而转入空载体pYES2的粗酶液无GLO活性。为了得到较高的GLO活性蛋白产量,本试验于不同诱导时间点取样并测定其活性,结果如图1所示,转化有pYES2-NHisSpGLO的酿酒酵母菌株在诱导发酵20 h后能得到最高的GLO活性。而延长发酵时间至32 h后GLO活性显著下降(P<0.05)。该NHisSpGLO蛋白经过His-tag亲和柱(Profinity IMAC Resins)分离纯化后所得的纯蛋白经SDS-PAGE分析如图2所示已达到较高的纯度,可以用于后续的酶学特性分析。
2.2 菠菜SpGLO的酶学特性分析
将纯化所得NHisSpGLO在不同pH值条件下以GLC为底物测定其催化活力从而确定其最适pH值,结果如图3-A所示,NHisSpGLO在pH值8.0具有最高的催化活力。而在pH值<7.5及pH值>8.5的区间其催化活力较小(P<0.05),然后再将NHisSpGLO在pH值8.0的PBS缓冲液体系中在不同温度条件下以GLC为底物测定其催化活力从而确定其最适反应温度,NHisSpGLO的最适反应温度约为39 ℃,在35 ℃以下及40 ℃以上的温度区间其催化活力显著降低(P<0.05)(图3-B)。
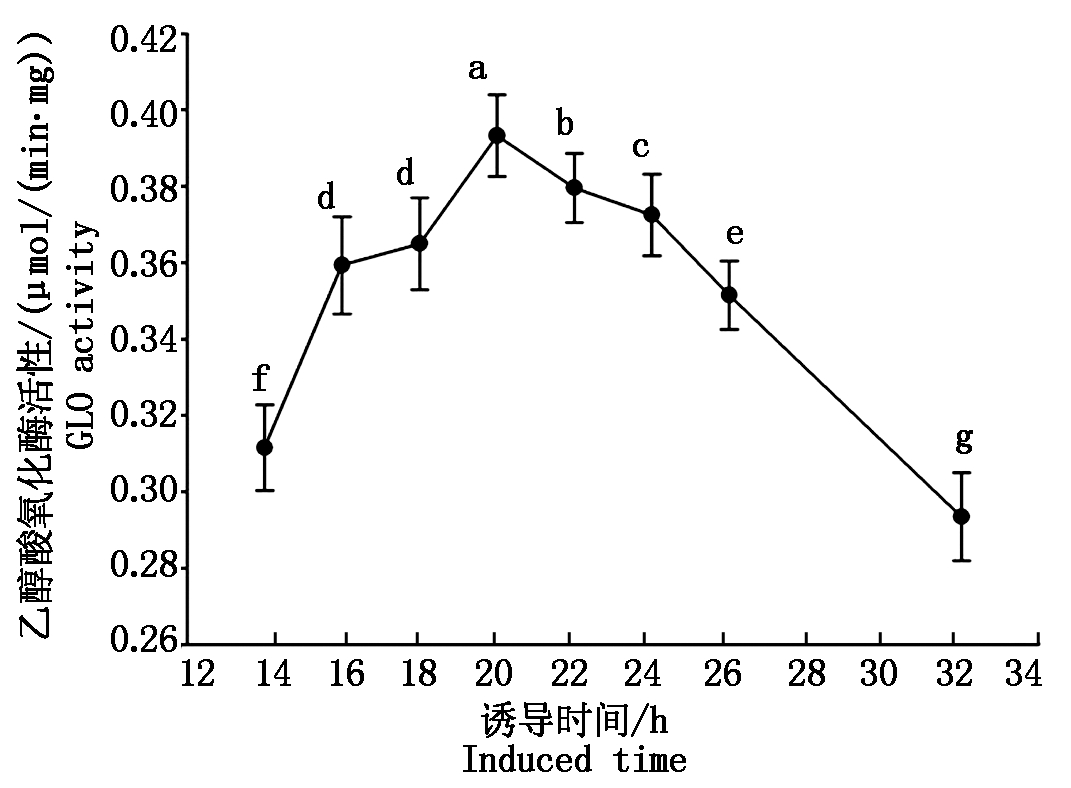
所有数据为3次独立试验的平均值±SD;根据Duncan的多范围检验,不同小写字母表示差异显著(P<0.05)。图3同。
All values are means±SD of three replicates; Means denoted by the same letter did not significantly different at P<0.05 according to Duncan′s multiple range tests. The same as Fig.3.
图1 pYES2-NHisSpGLO于INVSC1中异源表达时不同诱导时间条件下GLO比活
Fig.1 The GLO activity of pYES2-NHisSpGLO expressed in INVSC1 at various induced time
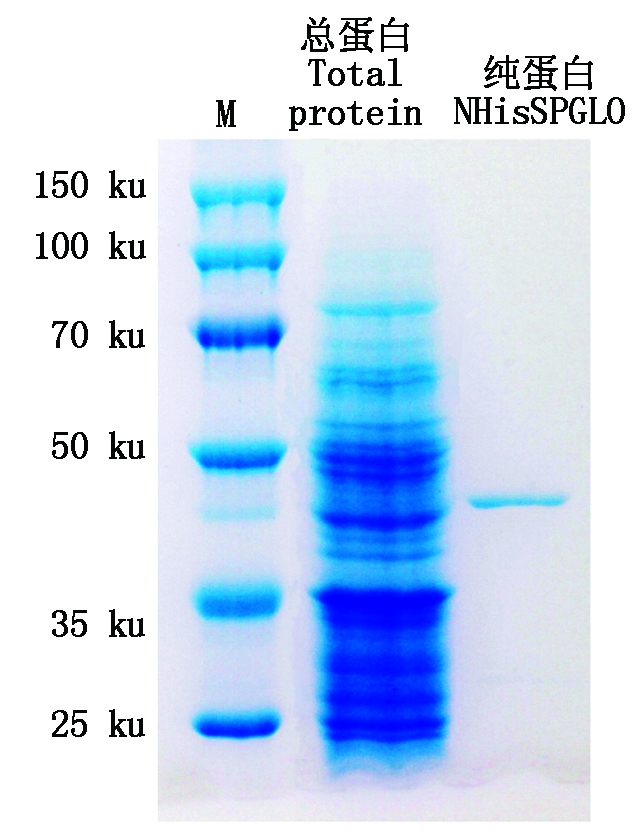
图2 纯化NHisSpGLO的SDS-PAGE分析
Fig.2 SDS-PAGE assays of the purified NHisSpGLO
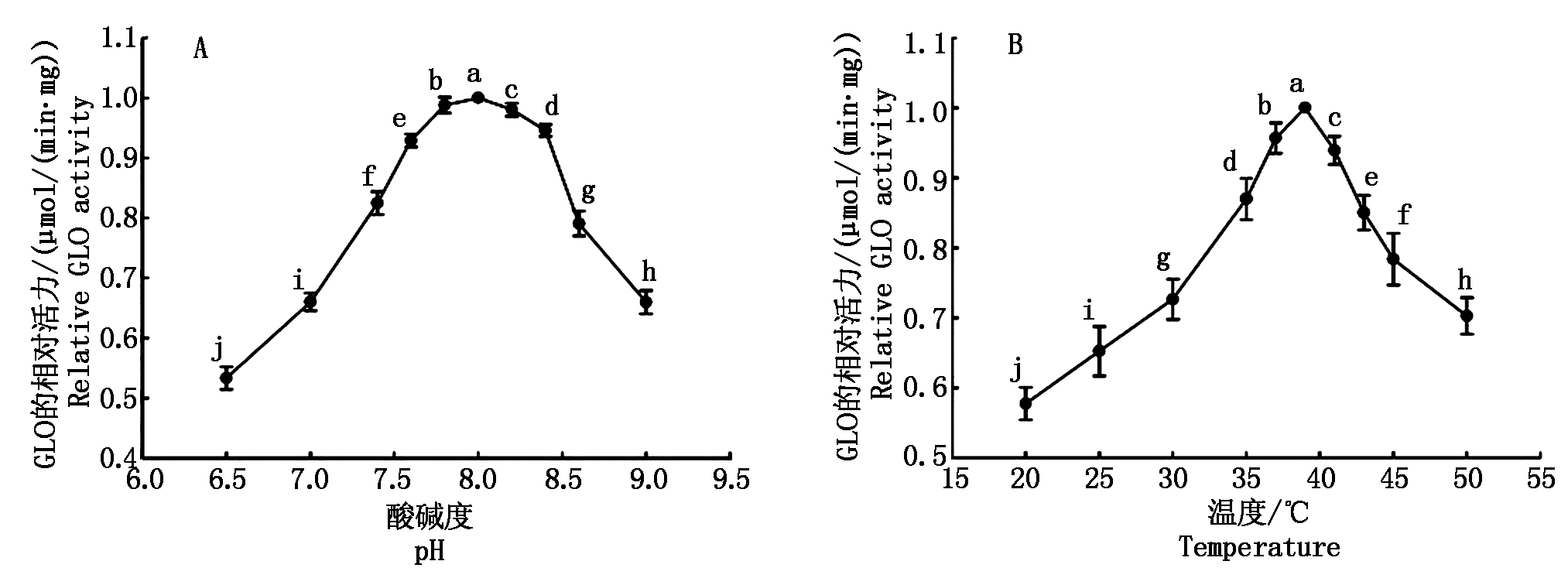
图3 纯化所得的NHisSpGLO在不同pH值/温度条件下的相对活力
Fig.3 Relative activities of NHisSpGLO at various pH/temperatures
先前有关菠菜GLO催化特性的研究都比较单一,本研究系统的测定了菠菜GLO的相关酶学参数。将纯化的NHisSpGLO进行了酶动力学分析,发现NHisSpGLO对乙醇酸的亲和力最高,Km(乙醇酸)为0.41 mmol/L(表1),而其对乙醛酸与甘油酸的亲和力较低,Km(乙醛酸)与Km(甘油酸)分别为5.83,4.75 mmol/L (表1),同时NHisSpGLO催化乙醇酸的Vm也显著高于乙醛酸与甘油酸(表1)。此外由于乙醇酸代谢与草酸代谢可能存在密切的关系,乙醛酸又是水稻草酸合成的前提[44],而草酸又是GLO天然的竞争性抑制剂[44-45],所以本研究分别分析了NHisSpGLO催化乙醇酸或乙醛酸时草酸对其活性的抑制效果,测定了其各自的Ki,结果见表2。相对于乙醇酸,在以乙醛酸为底物时,NHisSpGLO的催化反应更容易被草酸所抑制(较低的Ki)。
表1 NHisSpGLO催化不同底物时的Km与Vm
Tab.1 Km and Vm of NHisSpGLO with various substrates

底物 Substrate乙醇酸 Glycolate乙醛酸 Glyoxylate甘油酸 Glyceric acidKm/(mmol/L)0.41±0.03c5.83±1.28a4.75±0.96bVm/(μmol/ (min·mg))45.92±7.81a5.53±1.06c29.37±5.49b
注:所有数据为3次独立试验的平均值±SD;根据Duncan的多范围检验,不同小写字母表示差异显著(P<0.05)。表2同。
Note:All values are means ±SD of three replicates; Means denoted by the different letter were significantly different at P <0.05 according to Duncan′s multiple range tests. The same as Tab.2.
表2 草酸对NHisSpGLO催化活性的抑制效果
Tab.2 Inhibition effect of NHisSpGLO with oxalate

底物 Substrate乙醇酸 Glycolate乙醛酸 GlyoxylateKi(草酸)/(mmol/L)4. 61±0.78a2.09±0.32bKi(Oxalate)
2.3 菠菜SpGLO的同工酶谱分析
目前在同工酶的研究中主要采用同工酶谱分析,即将待检测酶液通过电泳分离,再用特异的显色方法使酶的位置直接在凝胶中以染色条带的形式表现出来。酶在凝胶中所显示的图谱即为同工酶谱,该分析过程中使用较多的为CN-PAGE电泳[46]。本研究在前期使用了常见的Laemmli体系进行CN-PAGE,该体系使用pH值8.3的Tris-Gly电泳缓冲液[47],但利用该体系进行SpGLO同工酶谱分析时条带模糊,分辨率较低。为了提高SpGLO的同工酶谱分辨率,本研究先对SpGLO进行部分纯化,主要纯化步骤为选择性酸变性,(NH4)2SO4 分级沉淀及葡聚糖凝胶过滤脱盐。纯化后的SpGLO再以Caps-氨水缓冲液作为CN-PAGE的电泳缓冲液进行同工酶电泳[40]。该CN-PAGE体系具有较高的分辨率,能较好地分离SpGLO同工酶(图4)。SpGLO经过电泳与活性染色后出现2条同工酶带,表明菠菜叶片中可能存在2种GLO同工酶。
3 结论与讨论
在本研究中,首先从菠菜叶片总RNA中通过反转录PCR扩增得到了SpGLO基因。然后选择酿酒酵母表达系统对N端融合有His-tag的SpGLO蛋白进行异源表达。因为GLO是定位于过氧化物酶体的真核蛋白,而酿酒酵母表达系统能够提供真核蛋白质所需的一些翻译后修饰,可以保证异源蛋白SpGLO的生物活性与天然构象[48]。此外His-tag通常不会影响目的蛋白的可溶性及催化活性等特性[49],这也是后续试验中利用酵母表达的SpGLO开展生化及酶学特性研究的重要基础。在获得SpGLO蛋白的活性表达产物后,本研究通过His-tag亲和层析纯化了酵母表达的SpGLO蛋白,并系统的测定了其相关的动力学参数。SpGLO对乙醇酸的亲和力最高,同时其在利用乙醇酸为底物时也表现出最高的Vm,因此,可推测乙醇酸为SpGLO的最佳生理底物。在体外酶学特性分析中SpGLO不仅可以催化乙醇酸形成乙醛酸,其同时还具有将乙醛酸氧化为草酸的活性,而且GLO蛋白也曾经被认为可能参与了植物体内的草酸合成代谢[50],不过后续一些研究表明植物中GLO活性的改变并未能显著影响其草酸合成[51]。现有一些研究表明,植物体内的乙醇酸与乙醛酸浓度可能处在相近的水平[11,52],在这种生理环境中SpGLO更倾向于利用乙醇酸为底物行使其催化功能,本试验结果也显示,SpGLO的乙醛酸氧化活性比其乙醇酸氧化活性更易受到草酸的抑制,因此,在植物体内其催化乙醛酸的活性很可能被植物中的高草酸浓度所抑制,该SpGLO不太可能主导菠菜体内的草酸合成。
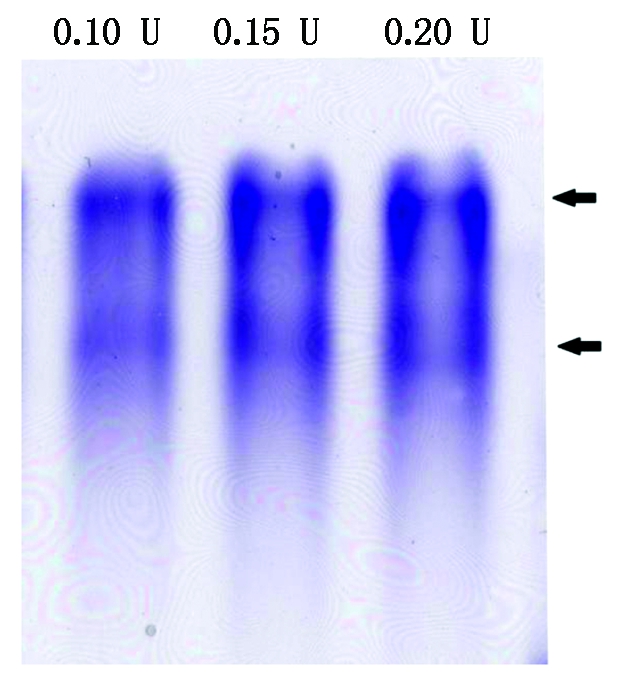
图4 SpGLO同工酶谱分析(Caps-氨水电泳缓冲体系)
Fig.4 SpGLO isozyme pattern (Caps-ammonium hydroxide running buffer system)
虽然有多篇报道曾提及菠菜中可能含有2种或3种GLO同工酶[31,53],但有关SpGLO的同工酶电泳图谱还未见报道。同工酶电泳是同工酶分析最为直接的证据之一,但不同种类的酶其同工酶电泳条件也不相同,需要大量的摸索试验来优化电泳条件以得到较高的分辨率,这也制约了同工酶电泳技术在GLO等同工酶分析中的应用。本研究初期以Laemmli体系为基础进行SpGLO同工酶电泳分析,但一直未能得到理想的结果。由于SpGLO可能具有较高的pI[53],因此,本研究后期改用pH值10.2的Caps-氨水电泳缓冲液进行同工酶电泳,发现经过部分纯化的SpGLO在该体系中具有较高的分辨率,且首次通过同工酶电泳显示SpGLO含有2条同工酶谱带,该结果与Lindqvist[54]的研究结果一致。生物体内的同工酶虽然催化相同的反应,但不同的同工酶常常具有不同的生化特性与生理功能,例如,在盐芥中Cu/Zn-SOD受到KCN的抑制,而Fe-SOD只可被H2O2抑制[55];番茄中的果糖激酶同工酶FRK1主要在开花过程中起作用,而另一个同工酶FRK2则主要与不同器官的生长发育有关[56]。GLO是植物光呼吸途径的关键酶,主要负责氧化乙醇酸生成乙醛酸并同时产生等量的H2O2,由于光呼吸是除光合作用以外的第二大代谢流,这一过程中产生的H2O2量可达到植物总H2O2的70%[22],而H2O2为植物体内重要的信号物质,参与了植物体内的多种逆境响应过程[57-60],因此,关于植物GLO同工酶的研究对植物的光呼吸与光合作用的代谢调控及逆境响应相关的H2O2信号途径研究均具有重要的指导意义。本研究通过改进的GLO同工酶电泳技术提高了GLO同工酶电泳的稳定性与分辨率,得到了SpGLO同工酶图谱,该技术可望进一步被用于其他植物的GLO同工酶谱研究,为将来深入研究植物GLO同工酶之间的生化特性差异并分析其不同生理功能奠定良好的试验技术基础。
[1] 张智胜, 彭新湘. 光呼吸的功能及其平衡调控[J]. 植物生理学报, 2016, 52(11): 1692-1702. doi:10.13592/j.cnki.ppj.2016.1017.
Zhang Z S, Peng X X. Multifunctional roles of photorespiration and its regulation for the balance [J]. Acta Phytophysiologica Sinica, 2016,52(11):1692-1702. doi:10.13592/j.cnki.ppj.2016.1017.
[2] Bloom A J.Photorespiration and nitrate assimilation: a major intersection between plant carbon and nitrogen[J].Photosynthesis Research,2015,123(2):117-128. doi:10.1007/s11120-014-0056-y.
[3] Bloom A J, Kameritsch P. Relative association of rubisco with manganese and magnesium as a regulatory mechanism in plants[J].Physiologia Plantarum,2017,161(4):545-559. doi:10.1111/ppl.12616.
[4] 张树伟, 王霞, 马燕斌, 李换丽, 韩渊怀, Rupert, Fray, 吴霞, 王新胜. 植物光呼吸途径及其支路研究进展[J]. 山西农业大学学报(自然科学版), 2016, 36(12): 885-889. doi:10.13842/j.cnki.issn1671-8151.2016.12.009.
Zhang S W, Wang X, Ma Y B, Li H L, Han Y H, Rupert, Fray, Wu X, Wang X S. Research progress on photorespiration and its bypass [J]. Journal of Shandong Agricultural University(Natural Science Edition), 2016,36(12):885-889. doi:10.13842/j.cnki.issn1671-8151.2016.12.009.
[5] 郭玉朋. 植物光呼吸途径研究进展[J]. 草业学报, 2014, 23(4): 322-329. doi:10.11686/cyxb20140439.
Guo Y P. A study on advances in plant photorespiration [J]. Acta Prataculturae Sinica, 2014,23(4):322-329. doi:10.11686/cyxb20140439.
[6] Foyer C H, Bloom A J, Queval G, Noctor G.Photorespiratory metabolism: genes, mutants, energetics, and redox signaling[J].Annual Review of Plant Biology,2009,60(1):455-484. doi:10.1146/annurev.arplant.043008.091948.
[7] Barak S, Nejidat A, Heimer Y, Volokita M.Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings[J].Plant Molecular Biology, 2001, 45(4): 399-407.
[8] 汪义龙, 张洁, 夏莹萍, 吴倩, 梁建生. 水稻乙醇酸氧化酶基因的克隆和表达分析[J]. 扬州大学学报(农业与生命科学版), 2014, 35(3): 54-58. doi:10.16872/j.cnki.1671-4652.2014.03.012.
Wang Y L, Zhang J, Xia Y P, Wu Q, Liang J S. Cloning and expression analysis of glycolate oxidase gene in Oryza sativa[J]. Journal of Yangzhou University(Agricultural and Life Science Edition), 2014,35(3):54-58. doi:10.16872/j.cnki.1671-4652.2014.03.012.
[9] 赵利, 陈桂信, 潘东明, 王玉珍, 吕恃衡, 姜翠翠. 叶片乙醇酸氧化酶基因全长cDNA的分离与表达研究[J]. 江西农业大学学报, 2014, 36(5): 965-970. doi:10.13836/j.jjau.2014154.
Zhao L, Chen G X, Pan D M, Wang Y Z, Lü S H, Jiang C C. Isolation of full-length cDNA of GLO from Pranus salicina leaf and its expression [J]. Acta Agriculturae Universitatis Jiangxiensis(Natural Sciences Edition), 2014,36(5):965-970. doi:10.13836/j.jjau.2014154.
[10] Hodges M, Dellero Y, Keech O, Betti M, Raghavendra A S, Sage R, Zhu X G, Allen D K, Weber A P.Perspectives for a better understanding of the metabolic integration of photorespiration within a complex plant primary metabolism network[J].Journal of Experimental Botany,2016,67(10):3015-3026.doi:10.1093/jxb/erw145.
[11] Lu Y, Li Y, Yang Q, Zhang Z, Chen Y, Zhang S, Peng X X.Suppression of glycolate oxidase causes glyoxylate accumulation that inhibits photosynthesis through deactivating Rubisco in rice[J].Physiologia Plantarum,2014,150(3):463-476.doi:10.1111/ppl.12104.
[12] Cui L L, Lu Y S, Li Y, Yang C, Peng X X.Overexpression of glycolate oxidase confers improved photosynthesis under high light and high temperature in rice[J].Frontiers in Plant Science,2016,7:1165.doi:10.3389/fpls.2016.01165.
[13] Voss I, Sunil B, Scheibe R, Raghavendra A S. Emerging concept for the role of photorespiration as an important part of abiotic stress response[J].Plant Biology,2013,15(4, SI):713-722.doi:10.1111/j.1438-8677.2012.00710.x.
[14] 程汉, 陈相, 黄华孙. 巴西橡胶树乙醇酸氧化酶HbGOX1基因的鉴定与表达分析[J]. 热带农业科学, 2016, 36(8): 19-25. doi:10.12008/j.issn.1009-2196.2016.08.005.
Cheng H, Chen X, Huang H S. Identification and expression of glycolate oxidase HbGOX1 gene from Hevea brasiliensis[J]. Chinese Journal of Tropical Agriculture, 2016,36(8):19-25. doi:10.12008/j.issn.1009-2196.2016.08.005.
[15] 敬志豪. 水分亏缺对不同抗旱性小麦穗部光呼吸特性的影响[D]. 杨凌: 西北农林科技大学, 2015.
Jing Z H. Photorespiron performance of ear oganss in diffrent drought ressistance wheats under water deficit[D].Yangling:Northwest A&F University, 2015.
[16] Mukherjee S P, Choudhuri M A.Implications of water stress-induced changes in the levels of endogenous ascorbic acid and hydrogen peroxide in vigna seedlings[J].Physiologia Plantarum,1983,58(2):1399-3054. doi:10.1111/j.1399-3054.1983.tb04162.x.
[17] Mittler R, Zilinskas B A.Regulation of pea cytosolic ascorbate peroxidase and other antioxidant enzymes during the progression of drought stress and following recovery from drought[J].The Plant Journal,1994,5(3):397-405.
[18] Rizhsky L, Liang H, Mittler R.The combined effect of drought stress and heat shock on gene expression in tobacco[J].Plant Physiology,2002,130(3):1143-1151.doi:10.1104/pp.006858.
[19] Schäfer P, Hückelhoven R, Kogel K H. The white barley mutant albostrians shows a supersusceptible but symptomless interaction phenotype with the hemibiotrophic fungus Bipolaris sorokiniana[J].Molecular Plant-microbe Interactions,2004,17(4):366-373.doi:10.1094/MPMI.2004.17.4.366.
[20] Maksimov I V, Yarullina L G, Surina O B.The effect of exogenous phytohormones on resistance of wheat calluses to(D.C.)Tul.&C.Tul[J].American Journal of Plant Sciences,2014,5(12):1745-1754.doi:10.4236/ajps.
[21] Rojas C, Mysore K S.Glycolate oxidase is an alternative source for H2O2 production during plant defense responses and functions independently from NADPH oxidase[J].Plant Signaling & Behavior,2012,7(7):752-755.doi:10.4161/psb.20429.
[22] Noctor G, Veljovic-Jovanovic S, Driscoll S, Novitskaya L, Foyer C H.Drought and oxidative load in the leaves of C3 plants: a predominant role for photorespiration?[J].Annals of Botany,2002,89(7):841-850.
[23] Sandalio L M, Rodríguez-Serrano M, Romero-Puertas M C, del Río L A. Role of peroxisomes as a source of reactive oxygen species (ROS) signaling molecules[J]. Sub-cellular Biochemistry, 2013, 69: 231-255. doi:10.1007/978-94-007-6889-5_13.
[24] Baxter A, Mittler R, Suzuki N.ROS as key players in plant stress signalling[J].Journal of Experimental Botany,2014,65(5):1229-1240.doi:10.1093/jxb/ert375.
[25] Zhang Z, Xu Y, Xie Z, Li X, He Z H, Peng X X.Association-Dissociation of glycolate oxidase with catalase in rice: a potential Switch to modulate intracellular H2O2 levels[J].Molecular Plant,2016,9(5):737-748.doi:10.1016/j.molp.2016.02.002.
[26] Zelitch I S, Reduction O G, Glyoxylic A I. Glycolic acid oxidase[J].Journal of Biological Chemistry,1953,201(2):707-718.
[27] Cederlund E, Lindqvist Y, Söderlund G, Brändén C I, Jörnvall H.Primary structure of glycolate oxidase from spinach[J].European Journal of Biochemistry,1988,173(3):523-530.
[28] 张建国, 杨洁. 生物法合成乙醛酸[J]. 微生物学杂志, 2003, 23(3): 32-34, 38.
Zhang J G, Yang J. The production of glyoxylic acid using microbial methods [J]. Journal of Microbiology, 2003,23(3):32-34, 38.
[29] 马宁, 朱康佳, 毛银, 邓禹. 代谢工程改造大肠杆菌提高乙醇酸产率[J]. 生物工程学报, 2018, 34(2): 224-235. doi:10.13345/j.cjb.170209.
Ma N, Zhu K J, Mao Y, Deng Y. Improving glycolic acid yield by metabolic engineering in Escherichia coli[J]. Chinese Journal of Biotechnology, 2018,34(2):224-235. doi:10.13345/j.cjb.170209.
[30] Jin J, Tan T, Wang H, Su G.The expression of spinach glycolate oxidase (GO) in E.coli and the application of GO in the production of glyoxylic acid[J].Molecular Biotechnology,2003,25(3):207-214.doi:10.1385/MB:25:3:207.
[31] 徐杰, 吴燕燕. 菠菜叶片中乙醇酸氧化酶3种同工酶的生化特性[J]. 中国生物化学与分子生物学报, 2001, 17(4): 537-540. doi:10.13865/j.cnki.cjbmb.2001.04.031.
Xu J, Wu Y Y. Biochemical properties of glycolate oxidase isozymes of Spinacia oleracea[J]. Chinese Journal of Biochemistry and Molecular Biology, 2001,17(4):537-540. doi:10.13865/j.cnki.cjbmb.2001.04.031.
[32] 张晓丽, 代红军. 植物RNA提取方法的研究进展[J]. 北方园艺, 2014(8): 175-178.
Zhang X L, Dai H J. Research progress on extraction method of plant RNA [J]. Northern Horticulture, 2014(8):175-178.
[33] 付占成, 李艳, 赵红星. 植物总RNA提取研究进展[J]. 现代农业科技, 2014,(18): 168, 173. doi:10.3969/j.issn.1007-5739.2014.18.108.
Fu Z C, Li Y, Zhao H X. Research progress of isolation of plant total RNA [J]. XianDai NongYe KeJi, 2014(18):168, 173. doi:10.3969/j.issn.1007-5739.2014.18.108.
[34] 陈心语. 改良TRIzol试剂法提取番茄成熟叶总RNA探究[J]. 南方农业, 2018, (2): 104-104. doi:10.19415/j.cnki.1673-890x.2018.02.056.
Chen X Y. Extraction of Total RNA from Lycopersicon esculentum Mill with Improved TRIzol Method[J]. South China Agriculture, 2018, (2): 104-104. doi:10.19415/j.cnki.1673-890x.2018.02.056.
[35] Gietz D, St Jean A, Woods R A, Schiestl R H. Improved method for high efficiency transformation of intact yeast cells[J].Nucleic Acids Research,1992,20(6):1425.
[36] Gietz R D, Woods R A.Yeast transformation by the LiAc/SS Carrier DNA/PEG method[J].Methods in Molecular Biology,2006,313:107-120.doi:10.1385/1-59259-958-3:107.
[37] 彭新湘, 李明启. 乙醇酸氧化酶的纯化结晶和酪氨酸残基的修饰对酶活性的影响[J]. 植物生理学报, 1989, 15(3): 257-262.
Peng X X, Li M Q. Purification and crystallization of glycolate oxidase and effect of modification of tyrosione residue on its activity [J]. Acta Phytophysiologica Sinica, 1989,15(3):257-262.
[38] Lineweaver H, Burk D.The determination of enzyme dissociation constants[J].Journal of the American Chemical Society,1934,56(3):658-666. doi:10.1021/ja01318a036.
[39] 赵文婷, 狄斌. FLT3抑制剂CHMFL-FLT3-122解离常数的测定[J]. 中国现代应用药学, 2017, 34(7): 1002-1006. doi:10.13748/j.cnki.issn1007-7693.2017.07.015.
Zhao W T, Di B. Determination of dissociation constants of FLT3 inhibitor CHMFL-FLT3-122 [J]. Chinese Journal of Modern Applied Pharmacy, 2017,34(7):1002-1006. doi:10.13748/j.cnki.issn1007-7693.2017.07.015.
[40] Mclellan T.Electrophoresis buffers for polyacrylamide gels at various pH[J].Analytical Biochemistry,1982,126(1):94-99. doi:10.1016/0003-2697(82)90113-0.
[41] 蒋大程, 高珊, 高海伦, 邱念伟. 考马斯亮蓝法测定蛋白质含量中的细节问题[J]. 实验科学与技术, 2018, 16(3): 1672-4550. doi:10.3969/j.issn.1672-4550.2018.03.031.
Jiang D C, Gao S, Gao H L, Qiu N W. The details of protein content determination by coomassie brilliant blue staining [J]. Experiment Science and Technology, 2018,16(3):1672-4550. doi:10.3969/j.issn.1672-4550.2018.03.031.
[42] 赵卓, 嵇雅茹, 籍浩天, 赵海荣, 郝锡联. 温度对考马斯亮蓝法测定蛋白质浓度的影响[J]. 安徽农业科学, 2015, 43(4): 5-7, 36. doi:10.16175/j.cnki.1009-4229.2015.02.004.
Zhao Z, Ji Y R, Ji H T, Zhao H R, Hao X L. Effects of temperature on determination of protein concentration with coomassie brilliant blue method [J]. Journal of Anhui Agricultural Science, 2015,43(4):5-7, 36. doi:10.16175/j.cnki.1009-4229.2015.02.004.
[43] 赵卓, 籍浩天, 刘东波, 嵇雅茹, 郝锡联. 光照对考马斯亮蓝法测定蛋白质浓度影响的研究[J]. 吉林师范大学学报(自然科学版), 2015(2): 112-116. doi:10.16862/j.cnki.issn1674-3873.2015.02.026.
Zhao Z, Ji H T, Liu D B, Ji Y R, Hao X L. Light effect on the determination of protein concentration by coomassie brilliant blue method [J]. Jilin Normal University Journal(Natural Science Edition), 2015(2):112-116. doi:10.16862/j.cnki.issn1674-3873.2015.02.026.
[44] 蔡晓锋, 徐晨曦, 王小丽, 葛晨辉, 王全华. 植物中的草酸:合成、降解及其积累调控[J]. 植物生理学报, 2015, 51(3): 267-272. doi:10.13592/j.cnki.ppj.2014.0526.
Cai X F, Xu C X, Wang X L, Ge C H, Wang Q H. The oxalic acid in plants:biosynthesis,degradation and its accumulation regulation [J]. Acta Phytophysiologica Sinica, 2015,51(3):267-272. doi:10.13592/j.cnki.ppj.2014.0526.
[45] 陆育生. 水稻乙醇酸氧化酶的分子调控与功能研究[D]. 广州: 华南农业大学, 2012.
Lu Y S. Molecular regulation and functional analysis of glycolate oxidase in rice[D].Guangzhou: South China Agricultural University, 2012
[46] Wittig I, Schägger H.Native electrophoretic techniques to identify protein-protein interactions[J].Proteomics,2009,9(23):5214-5223.doi:10.1002/pmic.200900151.
[47] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685. doi:10.1038/227680a0.
[48] Böer E, Steinborn G, Kunze G, Gellissen G.Yeast expression platforms[J].Applied Microbiology and Biotechnology,2007,77(3):513-523.doi:10.1007/s00253-007-1209-0.
[49] Gräslund S, Nordlund P, Weigelt J, Hallberg B M, Bray J, Gileadi O, Knapp S, Oppermann U, Arrowsmith C, Hui R, Ming J, Dhe-Paganon S, Park H W, Savchenko A, Yee A, Edwards A, Vincentelli R, Cambillau C, Kim R, Kim S H, Rao Z, Shi Y, Terwilliger T C, Kim C Y, Hung L W, Waldo G S, Peleg Y, Albeck S, Unger T, Dym O, Prilusky J, Sussman J L, Stevens R C, Lesley S A, Wilson I A, Joachimiak A, Collart F, Dementieva I, Donnelly M I, Eschenfeldt W H, Kim Y, Stols L, Wu R, Zhou M, Burley S K, Emtage J S, Sauder J M, Thompson D, Bain K, Luz J, Gheyi T, Zhang F, Atwell S, Almo S C, Bonanno J B, Fiser A, Swaminathan S, Studier F W, Chance M R, Sali A, Acton T B, Xiao R, Zhao L, Ma L C, Hunt J F, Tong L, Cunningham K, Inouye M, Anderson S, Janjua H, Shastry R, Ho C K, Wang D, Wang H, Jiang M, Montelione G T, Stuart D I, Owens R J, Daenke S, Schutz A, Heinemann U, Yokoyama S, Bussow K, Gunsalus, C K. Protein production and purification[J].Nature Methods,2008,5(2):135-146. doi:10.1038/nmeth.f.202.
[50] Li X X, Franceschi V R.Distribution of peroxisomes and glycolate metabolism in relation to calcium oxalate formation in Lemna minor L.[J].European Journal of Cell Biology,1990,51(1):9-16.
[51] Dutta C, Avitahl-Curtis N, Pursell N, Larsson Cohen M, Holmes B, Diwanji R, Zhou W, Apponi L, Koser M, Ying B, Chen D, Shui X, Saxena U, Cyr W A, Shah A, Nazef N, Wang W, Abrams M, Dudek H, Salido E, Brown B D, Lai C. Inhibition of glycolate oxidase with dicer-substrate siRNA reduces calcium oxalate deposition in a mouse model of primary hyperoxaluria type 1[J].Molecular Therapy : the Journal of the American Society of Gene Therapy,2016,24(4):770-778.doi:10.1038/mt.2016.4.
[52] Xu H, Zhang J, Zeng J, Jiang L, Liu E, Peng C, He Z, Peng X. Inducible antisense suppression of glycolate oxidase reveals its strong regulation over photosynthesis in rice[J].Journal of Experimental Botany,2009,60(6):1799-1809.doi:10.1093/jxb/erp056.
[53] 徐杰. 菠菜中的乙醇酸氧化酶是一个同工酶[J]. 中国生物化学与分子生物学报, 1998, 14(6): 160-164. doi:10.13865/j.cnki.cjbmb.1998.06.031.
Xu J. Glycolate oxidase is an isozyme [J]. Chinese Journal of Biochemistry and Molecular Biology, 1998,14(6):160-164. doi:10.13865/j.cnki.cjbmb.1998.06.031.
[54] Lindqvist Y.Refined structure of spinach glycolate oxidase at 2 A resolution[J].Journal of Molecular Biology,1989,209(1):151-166.
[55] M′rah S.Ouerghi Z,Berthomieu C,Havaux M,Jungas C,Hajji M,Grignon C,Lacha l M.Effects of NaCl on the growth, ion accumulation and photosynthetic parameters of Thellungiella halophila[J].Journal of Plant Physiology,2005,163(10):1022-1031. doi:10.1016/j.jplph.2005.07.015.
l M.Effects of NaCl on the growth, ion accumulation and photosynthetic parameters of Thellungiella halophila[J].Journal of Plant Physiology,2005,163(10):1022-1031. doi:10.1016/j.jplph.2005.07.015.
[56] Odanaka S, Bennett A B, Kanayama Y.Distinct physiological roles of fructokinase isozymes revealed by gene-specific suppression of Frk1 and Frk2 expression in tomato[J].Plant Physiology,2002,129(3):1119-1126.doi:10.1104/pp.000703.
[57] Mittler R, Vanderauwera S, Gollery M, Van Breusegem F.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9(10):490-498.doi:10.1016/j.tplants.2004.08.009.
[58] 胡杰. 草酸氧化酶基因(OxO)遗传转化拟南芥及其抗病机理的初步分析[D]. 郑州: 郑州大学, 2014.
Hu J. Expressing a gene encoding oxalate oxidase shows an involvement of antioxidant enzymes and higher accumulation of nonenzymatic antioxidant in Arabidopsis thaliana[D].Zhengzhou: Zhengzhou University, 2014.
[59] Sabater B, Martín M.Hypothesis: increase of the ratio singlet oxygen plus superoxide radical to hydrogen peroxide changes stress defense response to programmed leaf death[J].Frontiers in Plant Science,2013,4(2):479.doi:10.3389/fpls.2013.00479.
[60] 钱宝云. 内源H2O2和Ca2+参与高表达转玉米C4-pepc基因水稻耐旱性调节[D]. 南京: 南京农业大学, 2014.
Qian B Y. Regulation of drought tolerance via endogenous H2O2 and Ca2+ in transgenic rice with overexpessing C4-pepc from maize[D].Nanjing: Nanjing Agricultural University, 2014.