水稻(Oryza sativa L.)是重要的粮食作物之一,起源于热带或亚热带,水稻生长对低温反应比较敏感,培育耐冷的水稻品种是育种的主要目标之一[1]。近年来,随着栽培技术的发展,直播水稻具有节约成本、节约秧田等多方经济效益而受到人们的日益关注。目前,直播稻的种植区域主要集中在长江中下游和宁夏等稻区,种植面积占我国水稻栽培总面积的15%以上[2]。对于直播稻而言,种子萌发时的出芽率和成苗率是决定其能否稳产的关键之一。在水稻早期生长阶段,低温冷害是降低种子发芽率和成苗率的主要因素之一[3]。因此,挖掘耐冷QTL,聚合耐冷性状成为一亟待攻克的课题。
多数研究认同,水稻的耐冷性是由多个基因控制的复杂农艺性状,根据已发表文献和国家水稻数据中心(http://www.ricedata.cn/、http://qtaro.abr.affrc.go.jp/qtab/table)的不完全统计,定位或克隆耐冷相关的基因/主效QTL 98个,其中分布在第1、2、3、4、6染色体上较多,共60个;而第10、12染色体上很少,仅为6个[4-5]。不同学者利用不同的耐冷鉴定方法,定位群体检测到的QTL位点和数量不同,相同QTL在不同遗传背景下所具有的遗传效应也存在较大差异。Baruah等[6]对比了57份水稻品种的耐冷性,发现在生长早期,粳稻的耐冷性明显优于籼稻和普通野生稻,并利用RIL群体定位到5个耐冷QTL。陈玮等[7]利用籼粳交构建RIL群体,以卷纸法进行耐冷鉴定,将芽期耐冷QTL定位于第1、3、7、11染色体上。杨洛淼等[8]利用粳粳交的RIL群体,在15 ℃和5 ℃低温条件下分别对水稻发芽期和芽期进行耐冷性鉴定,检测到1个芽期耐冷QTL和17个控制低温发芽力的QTL,单个QTL贡献率为5.54%~35.67%;周勇等[9]以籼稻亲本9311为受体,粳稻亲本日本晴为供体构建稳定遗传的单片段代换系BC5F4群体进行QTL分析,定位到23个与芽期和苗期耐冷相关的QTL,其中qCTP12.1、qCTP12.2能在2个时期同时检测到;Zhao等[10]以东乡野生稻为供体构建了159个片段代换系,定位到7个耐冷QTL,并鉴定1株极耐寒株系SIL157,通过基因表达量的分析确定了6个在冷胁迫下上调的候选基因。王会民等[11]结合前人研究结果,鉴定出一个主效QTL-qCT10,并通过构建近等基因系将其定位到224.5 kb内。然而,检测到水稻生长早期耐冷的QTL仍然较少,且利用同一群体对发芽期和苗期进行耐冷QTL分析的报道也相对较少。本研究以辽宁省超级粳稻品种沈农265和四川籼稻品种泸恢99构建RIL群体,对水稻发芽期和苗期进行耐冷QTL分析,以期进一步发掘耐冷性新基因,丰富水稻耐冷相关机制的理论基础。
1 材料和方法
1.1 试验材料
以南方籼型杂交稻恢复系品种泸恢99为母本,北方粳型超级稻品种沈农265为父本配置杂交组合,采用单粒传法获得144个F8稳定遗传的RIL群体作为试验材料。
1.2 发芽期耐冷性鉴定
发芽期耐冷性鉴定参考李太贵[12]的方法稍加改动。将种子在50 ℃恒温箱内高温处理48 h,使其充分干燥和打破休眠。挑选饱满种子100粒,均匀放置于垫滤纸的培养皿中, 3次重复。用消毒液浸种10 min后,用自来水洗涤3~4次。加入少量水浸种24 h后,再用自来水洗涤2~3次,放入14 ℃低温恒温箱中处理。低温下处理种子14 d,调查种子发芽率。发芽标准以芽长达到种子长度的一半(约5 mm),根长达到种子长度时记为发芽(约10 mm)。
1.3 苗期耐冷性鉴定
苗期耐冷性参照韩龙植等[13]方法。种子按常规方法经消毒、浸种和催芽,将催芽的种子播种于装有床土的育苗盘中。每个材料播15~20粒,以2 cm距离点播,3次重复。在20~30 ℃的温室中育苗。3-4叶期,把材料放入5 ℃人工气候箱中处理7 d。低温处理后,将材料移至温度20~30 ℃,并有阳光的温室进行恢复性生长。7 d后调查幼苗的耐冷性。以叶赤枯度作为幼苗期耐冷性的评价标准,共分1~9级(表1)。
表1 苗期耐冷性评价标准
Tab.1 Evaluation standard of seedling stage in rice

级别Level苗期耐冷性Cold tolerance at the seedling stage1所有叶青绿或接近青绿3叶子有一点脱色或黄色5叶子大部分黄化7叶子干枯,有的苗死亡9大部分或者全部苗死亡
1.4 QTL分析
利用Excel 2010软件对发芽期和苗期耐冷数据进行处理,运用SPSS(Version 17.0 for Windows)软件进行统计和相关性检验分析。
亲本和RIL群体的基因组DNA 均采用CTAB法提取。利用均匀分布在12条染色体上的456对(包含SSR、Indel、SSILP)引物对亲本进行多态性筛选,10 μL PCR反应体系:模板DNA 2.0 μL,10 μmol/L 引物1.0 μL,10×PCR Buffer 1.0 μL,2.5 mmol/L dNTPs 0.8 μL,5 U/μL Taq酶0.1 μL,ddH2O 4.1 μL。PCR扩增反应程序为:95 ℃预变性4 min;95 ℃变性40 s,50~58 ℃退火40 s,72 ℃复性40 s,36个循环;72 ℃延伸10 min,保存于12 ℃备用。反应产物在4%~5%琼脂糖凝胶上电泳检测,经GoldView染色后在凝胶成像仪上成像并记录数据。最终筛出179对多态性良好的标记用于构建遗传图谱[14],采用QTL ICI Mapping v3.0的完备区间作图(ICIM)方法[15]进行QTL分析,LOD的阈值设为2.5,当实际求得的LOD值大于LOD阈值时,就判定该区段存在1个QTL,同时估算每个QTL的加性效应值和贡献率。QTL的命名遵循McCouch等原则[16]。
2 结果与分析
2.1 发芽期和苗期耐冷的表型分布及相关性分析
沈农265和泸恢99在发芽期和苗期耐冷性上存在显著差异(表2)。在低温条件下, RIL群体种子相对发芽率存在较大幅度变异,呈现双向超亲分离,表现为近似连续正态分布。同样,冷处理后RIL群体苗期耐冷性存在较大幅度变异,近似于正态分布,表明这2个耐冷性状均表现为数量遗传,符合QTL的作图要求(图1、表2)。
表2 发芽期和苗期耐冷在RILs群体中的分布情况
Tab.2 Distribution of germination and seedling stage traits in RILs populations
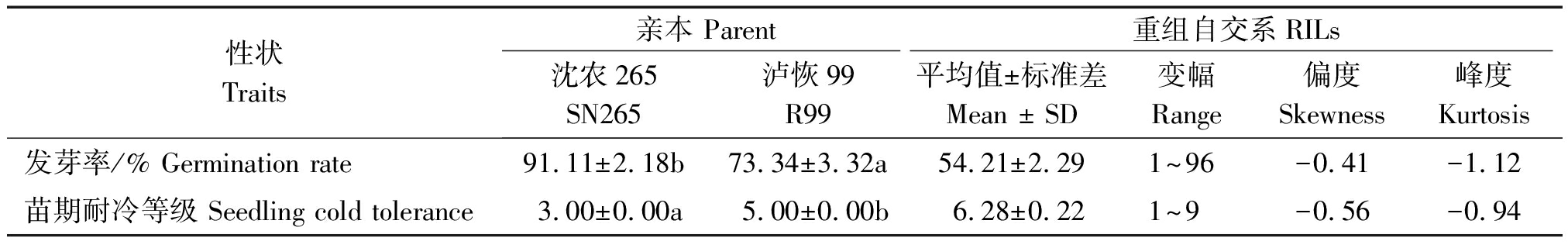
性状Traits亲本 Parent重组自交系RILs沈农265SN265泸恢99R99平均值±标准差Mean ± SD变幅Range偏度Skewness峰度Kurtosis发芽率/% Germination rate91.11±2.18b73.34±3.32a54.21±2.291~96-0.41-1.12苗期耐冷等级 Seedling cold tolerance3.00±0.00a5.00±0.00b6.28±0.221~9-0.56-0.94
注:同一行数据后不同字母表示0.05水平的显著性。
Note:The same row of date is followed by different letters to indicate the significance of 0.05 level.
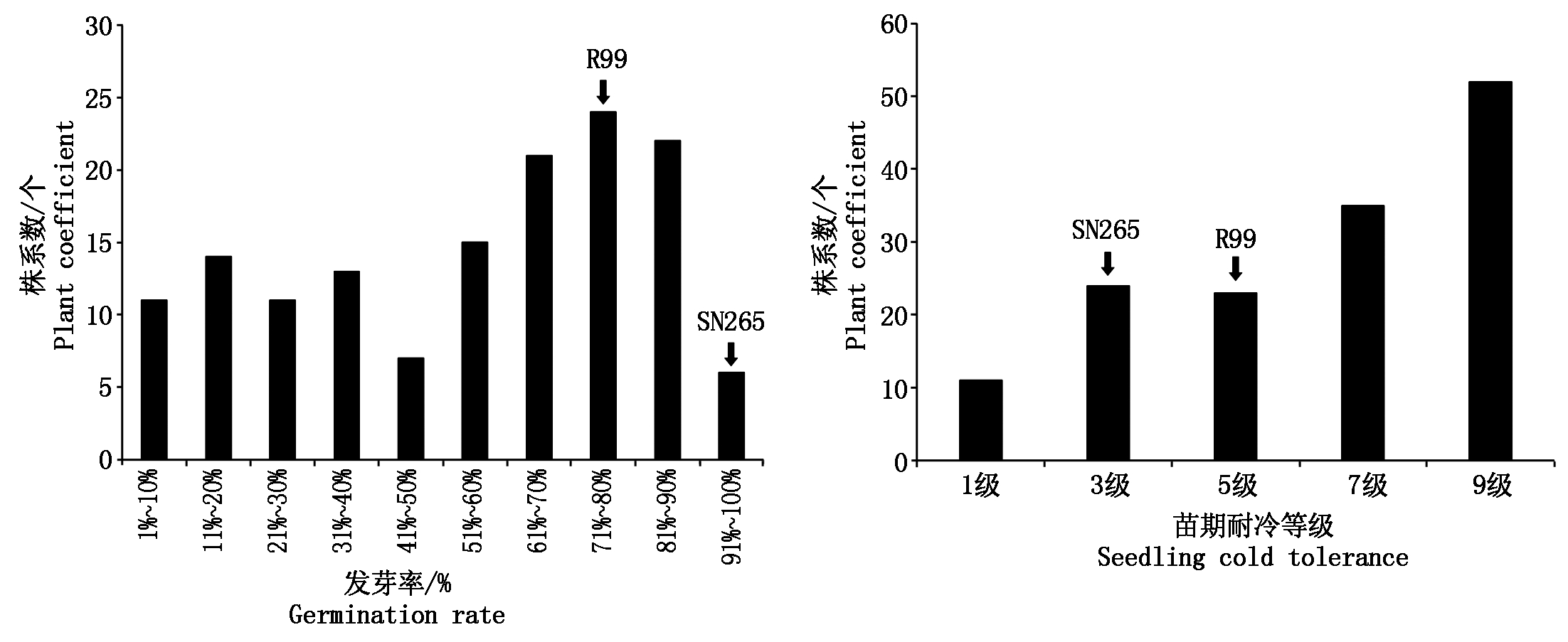
图1 低温条件下发芽率(左)和苗期耐冷性等级(右)分布
Fig.1 Distribution of germination rate (left) and cold tolerance (right) at low temperature
2.2 发芽期和苗期耐冷性状QTL定位
通过完备复合区间作图法分析(图2、表3),共检测到2个控制发芽期耐冷性的QTL,分别位于第3和第5染色体上,命名为qLTG-3、qLTG-5,相应染色体上的区域为分子标记STS4~RM22和R5M13~RS8,遗传距离约4.4,8.0 cM,LOD值为3.60,2.73,加性效应为0.09,-0.10,可解释表型变异的11.02%,14.07%,增效等位基因分别来源于亲本沈农265和泸恢99;检测到1个控制苗期耐冷性的QTL,位于第9染色体上,命名为qSCT-9,相应染色体的区域为分子标记RS19~RS20,遗传距离约4.9 cM,LOD值为2.52,加性效应为-0.09,可解释表型变异的12.18%,增效等位基因来源于亲本泸恢99。
表3 检测到的耐冷性QTL位点
Tab.3 QTL for cold resistant detected at germination stage and seedling stage

位点Locus染色体Chromosome标记区间Marker intervalLOD值LOD value加性效应Additive effect贡献率/%PVEqLTG-33STS4~RM223.600.0911.02qLTG-55R5M13~RS82.73-0.1014.07qSCT-99RS19~RS202.52-0.0912.18
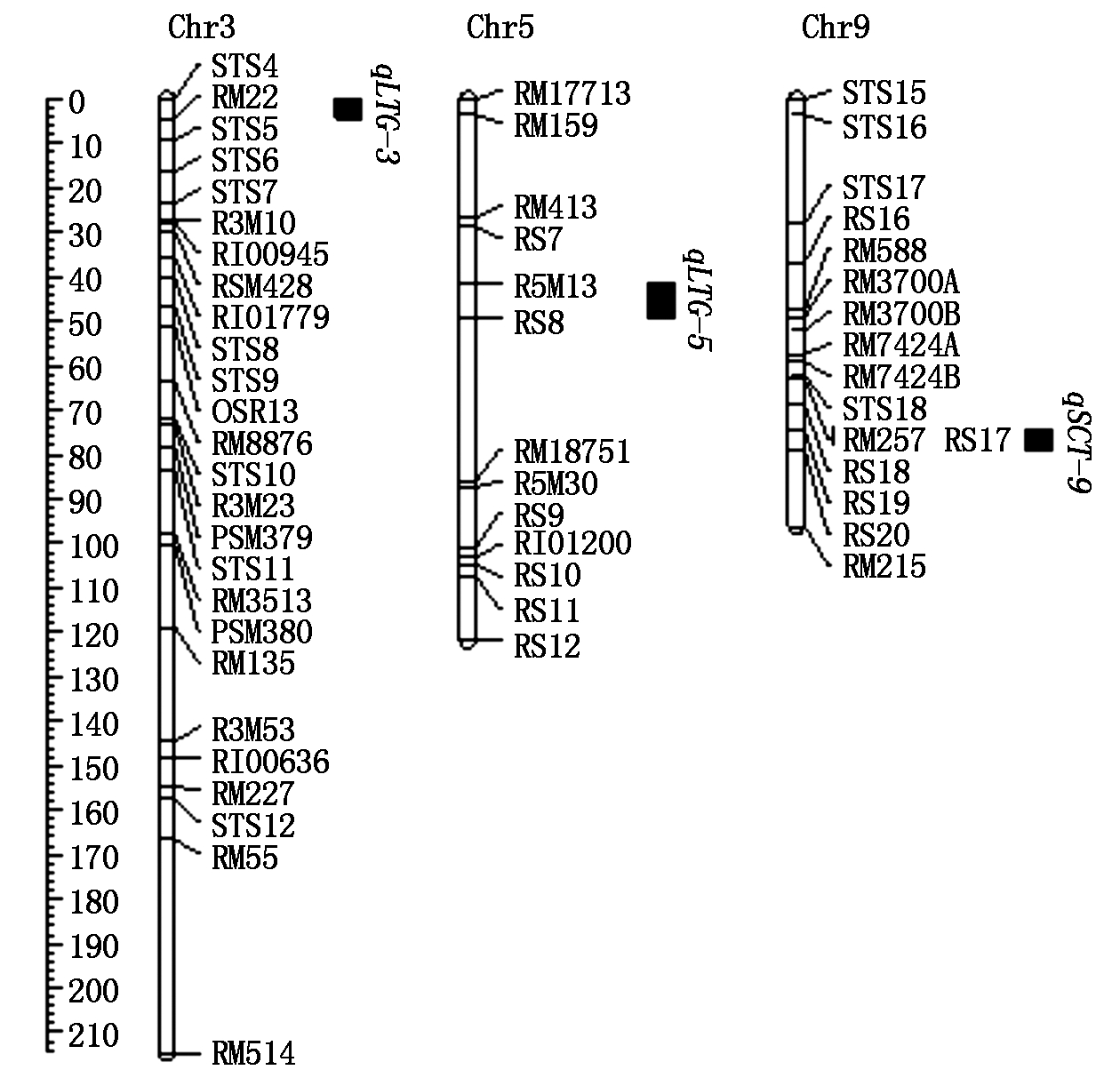
图2 发芽期和苗期检测到的耐冷性QTLs在染色体上的分布
Fig.2 Chromosome localization of QTLs for cold tolerance detected at germination stage and seedling stage
3 结论与讨论
水稻是世界上近一半人口的口粮作物,提高水稻的产量、抗性和品质是水稻育种家的首要任务。其中,提高对各种逆境的耐受性是保障产量和品质的先决条件。一直以来,有关低温引起水稻产量降低的报道屡见不鲜,据统计,我国每年因低温冷害使稻谷减产30亿~50亿kg。水稻在早期生长易受低温侵袭而造成冷害。在发芽期,低温会导致种子发芽时间延长,发芽率下降;苗期则会延迟生长甚至死亡[17-20]。因此,挖掘耐冷基因,聚合耐冷性状对于常规栽培稻和直播水稻都具有重要意义。在水稻发芽期和苗期耐冷性的研究方面,研究人员(韩龙植等[13]、纪素兰等[21]、周勇等[9]、陈大洲等[22]、夏瑞祥等[23])利用不同的遗传群体在12条染色体上均有检测到耐冷相关的QTL,其中qLTG4、qLTG3-1、qLTG3-2、qLTG-6、qLTG-11、qSCT-1、qSCT-2、qRC10-1-1、qRC10-1-2等在不同亲缘的遗传背景下在相同区间内重复检测到,说明这些QTL广泛、真实的存在于不同的水稻品种中。
本研究检测到的qLTG-3与水稻低温发芽势主效控制基因qLTG3-1位置一致[24],该基因编码1个功能未知的蛋白,在种子发芽过程中,qLTG3-1 特异的在种皮的糊粉层和覆盖胚芽鞘的上胚层表达,可能通过调节这些组织的细胞液泡化,从而引起这些组织的松弛而提高种子在低温下的发芽势。位于第9染色体上的qSCT-9与苗期低温失绿cisc(t)[25]和詹庆才等[26]检测到的控制苗期耐冷性的QTL区间相同。在该区间内存在1个编码胁迫蛋白的基因(OSISAP1、LOC_Os09g31200),研究表明,过量表达OSISAP1基因的转基因烟草对冷、干旱和盐胁迫具有耐受性[27]。在相邻区间存在OsDREB1A、OsDREB1B基因,这2个基因在转化拟南芥植株中表现出耐低温等特征[28]。检测到的qLTG-5位于第5染色体R5M13~RS8标记,贡献率12.18%,该区间未见相关水稻发芽期耐冷的QTL报道,可能为一新的控制水稻发芽期耐冷性的QTL。
此外,本研究中的qLTG-5和qLTG-9增效等位基因均来自籼稻品种泸恢99,这与多数学者的研究不谋而合,即籼稻中可能隐藏着一些耐冷QTL位点,并且这些耐冷位点在不同亲缘背景下构建的遗传群体中是可以稳定表达的,因此,在籼稻品种中发掘、分离、聚合耐冷基因亦是可行的。以上研究期望为水稻耐冷分子遗传机制的研究奠定基础。
[1] Zhang Q, Chen Q H, Wang S L, Hong Y H, Wang Z L. Rice and cold stress: methods for its evaluation and summary of cold tolerance-related quantitative trait loci[J]. Rice, 2014, 7(1): 24. doi:10.1186/s12284-014-0024-3.
[2] 苏柏元, 陈惠哲, 朱德峰. 水稻直播栽培技术发展现状及对策[J]. 农业科技通讯, 2014 (1): 7-11. doi:10.3969/j.issn.1000-6400.2014.01.003.
Su B Y, Chen H Z, Zhu D F. Development status and countermeasures of rice direct seeding cultivation technology[J]. Bulletin of Agricultural Science and Technology, 2014 (1):7-11. doi:10.3969/j.issn.1000-6400.2014.01.003.
[3] 杨梯丰, 张少红, 王晓飞, 董景芳, 黄章慧, 赵均良, 刘清, 毛兴学, 张桂权, 刘斌. 多样性国际稻种4个生长发育时期的耐冷性及其与籼粳性的关系[J]. 分子植物育种, 2017 (2): 763-773. doi:10.13271/j.mpb.015.000763.
Yang T F, Zhang S H, Wang X F, Dong J F, Huang Z H, Zhao J L, Liu Q, Mao X X, Zhang G Q, Liu B. Evaluation of cold tolerance at four growth stages and analysis of relationship between cold tolerance and indica-japonica differentiation in a diverse rice collection(Oryza sativa L.)[J]. Molecular Plant Breeding, 2017 (2):763-773. doi:10.13271/j.mpb.015.000763.
[4] 肖宁, 李育红, 王志平, 戴正元, 黄年生, 潘存红, 张小祥, 周长海, 吴云雨, 余玲, 钱熀俊, 陈建民, 李爱宏. 水稻耐冷QTL定位以及分子机理研究进展[J]. 分子植物育种, 2016, 14(7): 1698-1704. doi:10.13271/j.mpb.014.001698.
Xiao N, Li Y H, Wang Z P, Dai Z Y, Huang N S, Pan C H, Zhang X X, Zhou C H, Wu Y Y, Yu L, Qian H J, Chen J M, Li A H.Research advances on QTL mapping of cold tolerant and the molecular mechanism in rise[J]. Molecular Plant Breeding, 2016,14(7):1698-1704. doi:10.13271/j.mpb.014.001698.
[5] 刘次桃,王威,毛毕刚,储成才.水稻耐低温逆境研究:分子生理机制及育种展望[J].遗传,2018,40(3):171-185. doi:10.16288/j.yczz.18-007.
Liu C L, Wang W, Mao B G, Chu C C. Cold stress tolerance in rice: physiological changes, molecular mechanism, and future prospects[J]. Hereditas, 2018,40(3):171-185. doi:10.16288/j.yczz.18-007.
[6] Baruah A R, Ishigo-Oka N, Adachi M, Oguma Y, Tokizono Y, Onishi K, Sano Y.Cold tolerance at the early growth stage in wild and cultivated rice[J].Euphytica,2009,165(3):459-470.doi:10.1007/s10681-008-9753-y.
[7] 陈玮, 李炜. 水稻RIL群体芽期耐冷性基因的分子标记定位[J]. 武汉植物学研究, 2005, 23(2): 116-120. doi:10.3969/j.issn.2095-0837.2005.02.004.
Chen W, Li H. Mapping of QTL conferring cold tolerance at early seedling stage of rice by molecular markers[J]. Journal of Wuhan Botanical Research, 2005,23(2):116-120. doi:10.3969/j.issn.2095-0837.2005.02.004.
[8] 杨洛淼, 王敬国, 刘化龙, 孙健, 郑洪亮, 邹德堂. 寒地粳稻发芽期和芽期的耐冷性QTL定位[J]. 作物杂志, 2014(6): 44-51. doi:10.16035/j.issn.1001-7283.2014.06.009.
Yang L M, Wang J G, Liu H L, Sun J, Zheng H L, Zou D T. QTL mapping of cold tolerance for the germination period and the bud bursting period of japonica in cold area[J]. Crops, 2014(6):44-51. doi:10.16035/j.issn.1001-7283.2014.06.009.
[9] 周勇, 朱孝波, 袁华, 郑英, 钦鹏, 魏应海, 王玉平, 黄世君, 李仕贵. 水稻单片段代换系芽期和苗期耐冷性分析及耐冷性QTL鉴定[J]. 中国水稻科学, 2013, 25(4): 381-388. doi:10.16035/j.issn.1001-7283.2014.06.009.
Zhou Y, Zhu X B, Yuan H, Zheng Y, Qin P, Wei Y H, Wang Y P, Huang S J, Li S G. Characterization of cold tolerance and identification of clod tolerance QTLs for rice single segment substitution lines at plumule and seedling stages[J]. Chinese Journal of Rice Science, 2013,25(4):381-388. doi:10.16035/j.issn.1001-7283.2014.06.009.
[10] Zhao J, Qin J J, Song Q, Sun C Q, Liu F X.Combining QTL mapping and expression profile analysis to identify candidate genes of cold tolerance from Dongxiang common wild rice(Oryza rufipogon Griff.)[J].Journal of Integrative Agriculture,2016,15(9):1933-1943. doi:10.1016/S2095-3119(15)61214-X.
[11] 王会民, 唐秀英, 龙起樟, 黄永兰, 芦明, 徐晓明, 万建林. 一个水稻耐冷主效QTL-qCT10的分离鉴定[J]. 分子植物育种, 2017 (2): 582-588. doi:10.13271/j.mpb.015.000582.
Wang H M, Tang X Y, Long Q Z, Huang Y L, Lu M, Xu X M, Wan J L. Identification of qCT10,a major QTL associated with rice cold tolerance[J]. Molecular Plant Breeding, 2017(2):582-588. doi:10.13271/j.mpb.015.000582.
[12] 李太贵. 在低温下筛选水稻不同生长期耐寒品种的室内方法[J]. 国外农业技术, 1981(4): 18-21.
Li T G. Indoor method for screening cold-tolerant varieties of rice in different growth stages at low temperature[J]. Foreign Agricultural Technology, 1981(4): 18-21.
[13] 韩龙植, 张三元. 水稻耐冷性鉴定评价方法[J]. 植物遗传资源学报, 2004, 5(1): 75-80. doi:10.3969/j.issn.1672-1810.2004.01.017.
Han L Z, Zhang S Y. Methods of characterization and evaluation of cold tolerance in rice[J]. Journal of Plant Genetic Resources, 2004,5(1):75-80. doi:10.3969/j.issn.1672-1810.2004.01.017.
[14] 张玲, 李晓楠, 王伟, 杨生龙, 李清, 王嘉宇. 水稻株型相关性状的QTL分析[J]. 作物学报, 2014, 40(12): 2128-2135. doi:10.3724/SP.J.1006.2014.02128.
Zhang L, Li X N, Wang W, Yang S L, Li Q, Wang J Y. Analysis of QTLs for plant type traits in rice(Oryza sativa)[J]. Acta Agronomica Sinica, 2014,40(12):2128-2135. doi:10.3724/SP.J.1006.2014.02128.
[15] Wang J K, Li H H, Zhang L. Users′ Manual of QTL ICI Mapping v3.0 2011.Webpage:http//www.isbreeding.net.
[16] McCouch S R, Cho Y G, Yano M. Report on QTL nomenclature[J]. Rice Genet Newsletter,1997,14:11-13.
[17] Zhang Z Y, Li J J, Pan Y H, Li J L, Zhou L, Shi H L, Zeng Y W, Guo H F, Yang S M, Zheng W W, Yu J P, Sun X M, Li G L, Ding Y L, Ma L, Shen S Q, Dai Y L, Zhang H L, Yang S H, Guo Y, Li Z C. Natural variation in CTB4a enhances rice adaptation to cold habitats[J]. Nat Commun, 2017, 8(3): 14788. doi:10.1038/ncomms14788.
[18] Shakiba E, Edwards J D, Jodari F, Duke S E, Baldo A M, Korniliev P, McCouch S R, Eizenga G C. Genetic architecture of cold tolerance in rice (Oryza sativa) determined through high resolution genome-wide analysis[J]. PLoS One, 2017, 12(3): e0172133. doi:10.1371/journal.pone.0172133.
[19] Schläppi M R, Jackson A K, Eizenga G C, Wang A J, Chu C C, Shi Y, Shimoyama N, Boykin D L. Assessment of five chilling tolerance traits and GWAS mapping in rice using the USDA Mini-Core collection[J]. Front Plant Sci, 2017, 8: 957. doi:10.3389/fpls.2017.00957.
[20] Zhao J L, Zhang S H, Yang T F, Zeng Z C, Huang Z H, Liu Q, Wang X F, Leach J, Leung H, Liu B. Global transcriptional profiling of a cold-tolerant rice variety under moderate cold stress reveals different cold stress response mechanisms[J]. Physiol Plant, 2015, 154(3): 381-394. doi:10.1111/ppl.12291.
[21] 纪素兰, 江玲, 王益华, 刘世家, 刘喜, 翟虎渠, 吉村醇, 万建民. 水稻种子耐低温发芽力的QTL定位及上位性分析[J]. 作物学报, 2008, 34(4): 551-556. doi:10.3724/SP.J.1006.2008.00551.
Ji S L, Jiang L, Wang Y H, Liu S J, Liu X, Zhai H Q, Ji C C, Wan J M. QTL and epistasis for low temperature germinability in rice[J]. Acta Agronomica Sinica, 2008,34(4):551-556. doi:10.3724/SP.J.1006.2008.00551.
[22] 陈大洲, 钟平安, 肖叶青, 黄英金, 谢建坤. 利用SSR标记定位东乡野生稻苗期耐冷性基因[J]. 江西农业大学学报(自然科学), 2002, 24(6): 753-756. doi:10.3969/j.issn.1000-2286.2002.06.004.
Chen D Z, Zhong P A, Xiao Y Q, Huang Y J, Xie J K. Identification of QTLs for cold tolerance at seedling stage in dongxiang wild rice (Oryza rufipogon griff.)by SSR markers[J]. Acta Agriculturae Universitis Jiangxiensis, 2002,24(6):753-756. doi:10.3969/j.issn.1000-2286.2002.06.004.
[23] 夏瑞祥, 肖宁, 洪义欢, 张超, 苏琰, 张小蒙, 陈建民. 东乡野生稻苗期耐冷性的QTL定位[J]. 中国农业科学, 2010, 43(3): 443-451. doi:10.3864/j.issn.0578-1752.2010.03.001.
Xia R X, Xiao N, Hong Y H, Zhang C, Su Y, Zhang X M, Chen J M. QTLs mapping for cold tolerance at seedling stage in dongxiang wild rice (Oryza rufipogon griff.)[J]. Scientia Agricultura Sinica, 2010,43(3):443-451. doi:10.3864/j.issn.0578-1752.2010.03.001.
[24] Fujino K, Sekiguchi H.Origins of functional nucleotide polymorphisms in a major quantitative trait locus, qLTG3-1, controlling low-temperature germinability in rice[J].Plant Molecular Biology,2011,75(1/2):1-10.doi:10.1007/s11103-010-9697-1.
[25] Lan T, Wang B, Ling Q P, Xu C H, Tong Z J, Liang K J, Duan Y L, Jin J, Wu W R.Fine mapping of cisc(t),a gene for cold-induced seedling chlorosis,and identification of its candidate in rice[J].Chinese Science Bulletin,2010,55(Z2):3149-3153. doi:10.1007/s11434-010-4041-3.
[26] 詹庆才, 曾曙珍, 熊伏星, 齐藤浩二,加藤明.水稻苗期耐冷性QTLs的分子定位[J]. 湖南农业大学学报(自然科学版), 2003, 29(1): 7-11. doi:10.3321/j.issn:1007-1032.2003.01.002.
Zhan Q C, Zeng S Z, Xiong F X,Qi T H E, Jia T M. Molecular mapping of QTLs for seedling cold tolerance in rice[J]. Journal of Hunan Agricultural University(Natural Science), 2003,29(1):7-11. doi:10.3321/j.issn:1007-1032.2003.01.002.
[27] Kothari K S, Dansana P K, Giri J A.Rice stress associated protein 1 (OsSAP1) interacts with aminotransferase (OsAMTR1) and Pathogenesis-Related 1a protein (OsSCP) and regulates abiotic stress responses[J].Frontiers in Plant Science,2016,7:1057.doi:10.3389/fpls.2016.01057.
[28] Mao D, Chen C.Colinearity and similar expression pattern of rice DREB1s reveal their functional conservation in the Cold-Responsive pathway[J].PLoS One,2012,7(10):e47275. doi:10.1371/journal.pone.0047275.