环境中的各种非生物胁迫会影响植物的正常生长和产量,由于全球异常气候频现和不适当的农业经营管理方法,非生物胁迫已经成为威胁全球农业生产和发展的一大挑战。非生物胁迫对植物的伤害主要是通过使细胞内的平衡失调和细胞死亡的方式造成[1]。为了维持细胞内细胞结构和功能机制的稳定性,植物进化出一组相关基因,这些基因的表达可以帮助植物适应逆境环境,从而使植物可以在逆境条件下生存下来[2]。干旱和低温胁迫是植物在生命周期中经常会遇到的胁迫压力。迄今为止,已经发现了许多与干旱和低温胁迫防御机制相关的基因,膜联蛋白就是其中的一类,膜联蛋白广泛存在于动物、植物和微生物体内,最近,还有报道在原核生物里也发现了膜联蛋白的存在,膜联蛋白是一个超级基因家族,植物膜联蛋白属于家族D,其下面又被进一步分化成几个亚基因家族[3-4],在进化过程中,植物膜联蛋白的结构和功能都变得越来越多样化[3]。已经有报道,无论是在正常生长条件还是在胁迫环境条件下,膜联蛋白在植物的生长发育过程中都发挥着重要作用[3, 5-7]。在拟南芥中首先鉴定到了第一个多基因膜联蛋白家族,该家族有8个基因组成[3, 5, 8-14],表达和功能分析证实它们是一个多功能的蛋白质家族。它们具有Ca2+结合、离子通道和过氧化物酶活性等不同的生物学功能,这些功能都是与植物生长发育和植物在胁迫条件下的反应紧密相关的[15]。已有报道在不同的胁迫条件下,植物膜联蛋白的表达量会增强且会大量聚集在细胞膜上[16-19]。膜联蛋白在细胞膜上的大量聚集可能与离子通道结构搭建,膜的保护以及ROS诱导信号等诸多功能相关。
虽然关于植物膜联蛋白的研究已有不少报道,然而,有关水稻膜联蛋白在非生物胁迫条件下的作用和相关机制的研究目前仍处于初级阶段。Jami等[20]利用公共数据库中公布的水稻基因组序列,通过与拟南芥中的膜联蛋白基因进行同源序列比对,首次在水稻中鉴定发现10个膜联蛋白基因家族成员。随后,Qiao 等[18]通过RNAi和过表达的分析证实,水稻膜联蛋白OsAnn1通过调控抗氧化物质的积累增强了水稻对干旱胁迫的耐受性。Shen等[21]通过CRISPR/CAS9介导基因编辑技术定点敲除了水稻OsAnn3位点,并进一步证实了T1敲除突变体植株的耐寒性相比耐冷野生型对照明显减弱,说明水稻膜联蛋白OsAnn3参与了水稻低温胁迫条件下的耐冷性反应。
本研究以三-四叶期的耐冷粳稻TP309作为试验材料,采用实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)技术对水稻膜联蛋白基因家族成员之一的OsAnn8(LOC_Os09g20330)在低温胁迫条件下和干旱处理条件下的表达模式进行分析,而后通过CRISPR/Cas9介导的基因编辑技术对水稻膜联蛋白基因OsAnn8的外显子进行定点编辑,并成功地获得了靶位点敲除的T0转基因突变体植株。该研究为后续OsAnn8基因在干旱和低温胁迫环境下的功能和作用机制研究奠定了重要的材料基础。也证实了CRISPR/CAS9技术在水稻功能基因研究中应用的高效和易操作的特点。
1 材料和方法
1.1 试验材料
1.1.1 植物材料与处理 以水稻粳稻品种TP309作为转基因受体和非生物胁迫处理试验材料。在江西省作物生长发育调控重点实验室中用无菌水及滤纸发芽,然后移栽到规格19.5 cm×14.5 cm×5.5 cm(长× 宽× 高)的盛有稻田泥土的塑料盒中,每盒种植3棵,种植于平均温度约35 ℃的实验室内,待正常生长至三-四叶期,选择水稻苗长势一致的2个盆分别用于干旱和低温处理,其中一盆处理样品停止灌溉直到泥土表面看不到水,开始进行土壤干旱胁迫处理,处理后72 h(3 d)和96 h(4 d)对水稻苗叶片进行取样;将另一盆于4 ℃培养箱中进行24 h(1 d)、48 h(2 d)和72 h(3 d)的低温处理。
1.1.2 载体与转化菌株 本研究中,使用到的载体包括T载体pEASY-Blunt Zero Cloning Kit,基因编辑克隆载体psgR-Cas9-Os和植物表达载体pSK51[21-22],使用到的菌株有大肠杆菌菌株Trans5α和农杆菌菌株EHA105。
1.2 试验方法
1.2.1 水稻材料RNA 提取 将TP309水稻幼苗在实验室中常温条件下培养至三-四叶期,分别取处理前和各阶段处理的水稻叶片于液氮中研磨成粉,总RNA的提取按OMEGA公司E.Z.N.A® Total RNA KitⅡ试剂盒说明进行。
1.2.2 引物设计和cDNA第一链合成 参考Rice Genome Annotation Project Database (http://rice.plantbiology.msu.edu/index.shtml) 中公布的LOC_Os09g20330位点的cDNA序列设计荧光定量扩增引物OsAnn8-F和OsAnn8-R (表1)。引物序列由上海生工生物有限公司合成,使用试剂盒中的Oligo dT 作为反转录的3′端引物,然后根据TOYOBO公司的First Strand cDNA Synthesis Kit ReverTra Ace-α-(code no.FSK-100) 反转录试剂盒使用说明进行cDNA 第一链的合成。
表1 引物序列
Tab.1 Primers used in this study
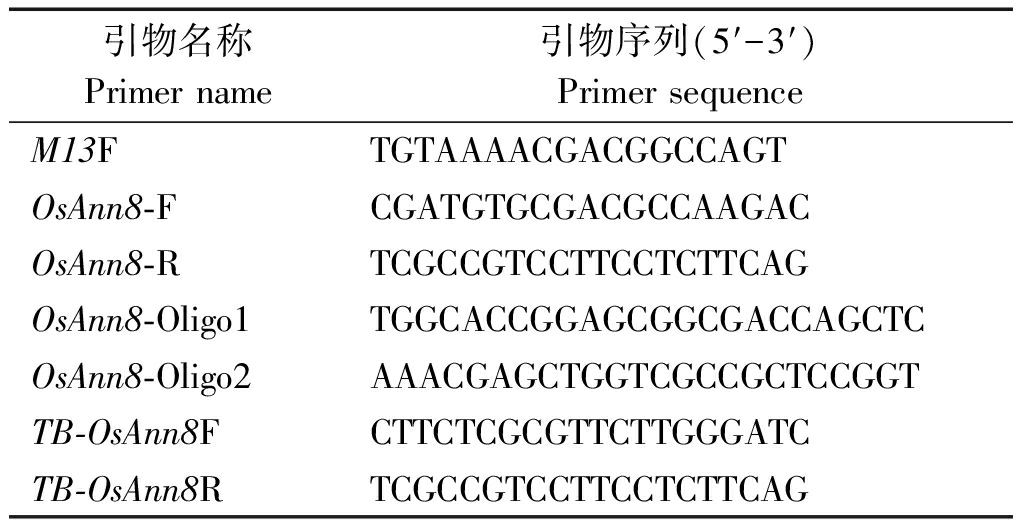
引物名称Primer name引物序列(5′-3′)Primer sequenceM13FTGTAAAACGACGGCCAGTOsAnn8-FCGATGTGCGACGCCAAGACOsAnn8-RTCGCCGTCCTTCCTCTTCAGOsAnn8-Oligo1TGGCACCGGAGCGGCGACCAGCTCOsAnn8-Oligo2AAACGAGCTGGTCGCCGCTCCGGT TB-OsAnn8FCTTCTCGCGTTCTTGGGATCTB-OsAnn8RTCGCCGTCCTTCCTCTTCAG
1.2.3 实时荧光定量PCR 在进行实时荧光定量PCR实验之前,先进行退火温度的梯度PCR扩增摸索调整引物扩增的特异性,选择扩增特异性好的退火温度在StepOnePlusTM荧光定量PCR仪中进行实时荧光定量PCR扩增,通过计算ΔΔCt值的方法评估基因表达水平,泛素基因被使用作为本研究的内参,设置3个生物学重复和3次技术重复。反应体系为: 20 μL反应体系中加入2× SuperReal PreMix 10 μL,50×Ro×Reference Dye 1 μL,上游引物OsAnn8-F和下游引物OsAnn8-R各0.5 μL,RNase-free ddH2O 6 μL,模板cDNA 1 μL。反应条件为: 95 ℃ 10 min; 94 ℃变性15 s, 60 ℃退火30 s, 72 ℃延伸30 s, 40个循环。
1.2.4 敲除靶位点的选择、靶点接头分子的设计及克隆 选择位于靶基因外显子PAM前的20个碱基作为靶位点,根据靶位点序列合成2条带有接头的寡聚靶点接头分子OsAnn8-Oligo1和OsAnn8-Oligo2 (表1),接头分子的设计、复性和克隆参照沈春修[21-22]报道的方法进行。
1.2.5 目标基因的敲除靶位点突变检测 参照目标基因OsAnn8靶位点侧翼序列设计特异引物TB-OsAnn8F和TB-OsAnn8R,对野生型和转基因植株目标基因的靶位点使用全式金pfu高保真酶进行PCR扩增并送样测序。对靶位点测序检测到碱基突变或者测序峰图出现重叠峰的个体,再次对该个体的靶位点序列进行扩增并完成T载体大肠杆菌克隆,而后送4~6个克隆进行靶位点的测序,扩增反应程序为: 94 ℃ 5 min 预变性;94 ℃ 30 s,57 ℃ 40 s,72 ℃ 30 s,进行35 个循环;72 ℃延伸11 min。
2 结果与分析
2.1 干旱胁迫下水稻幼苗OsAnn8基因表达的荧光定量分析
以TP309幼苗叶片作为试验材料,通过荧光定量PCR技术分析了水稻OsAnn8基因在不同干旱处理时间下的表达情况。结果如图1 所示, 在干旱处理前, OsAnn8表达量较高, 干旱处理3 d后表达量出现大幅度下调,为处理前的0.08倍,当干旱处理4 d后,表达量较处理3 d后的水稻又有一定幅度回升,为处理前的0.14倍。OsAnn8基因在干旱胁迫处理前后表达量表现出高-低-高的变化规律。
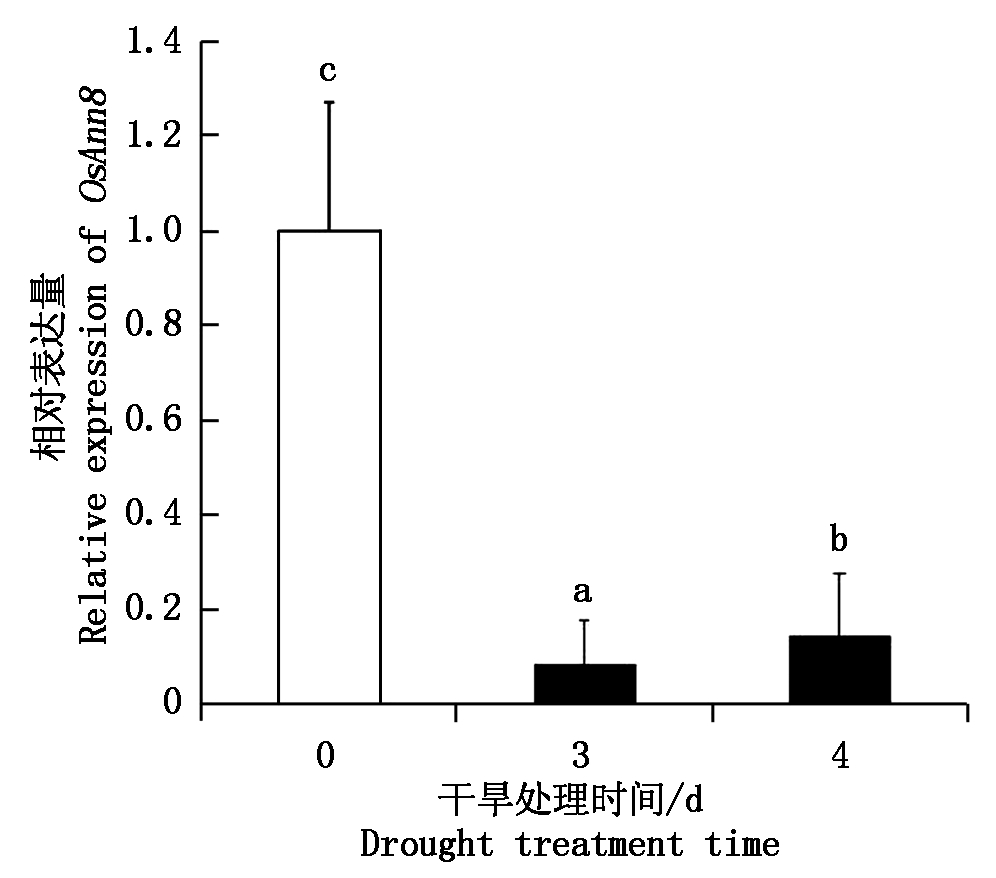
柱形图上方不同字母代表不同处理时间段差异显著(P<0.05)。图2同。
Different letters donate significant difference (P<0.05) between different stress treats.The same as Fig.2.
图1 水稻OsAnn8基因干旱胁迫下表达分析
Fig.1 Expression analysis of OsAnn8 in rice under drought stress
2.2 冷胁迫处理下水稻幼苗OsAnn8基因表达的荧光定量分析
同样以TP309幼苗叶片作为试验材料,通过荧光定量PCR技术分析了OsAnn8基因在冷胁迫处理条件下的表达情况。结果如图2 所示, 在冷胁迫处理之前, OsAnn8表达量较低, 冷胁迫处理1 d后表达量达到最高, 为处理前的48.4倍,冷胁迫处理2 d后表达量出现下调,但仍比处理前的表达水平高,为处理前的5.7倍,冷胁迫处理3 d后表达量继续下调, 但还是比冷胁迫处理之前的表达量高,为处理前的1.7倍。OsAnn8基因在冷胁迫处理前后表达量呈现出低-高-低-低的变化规律。
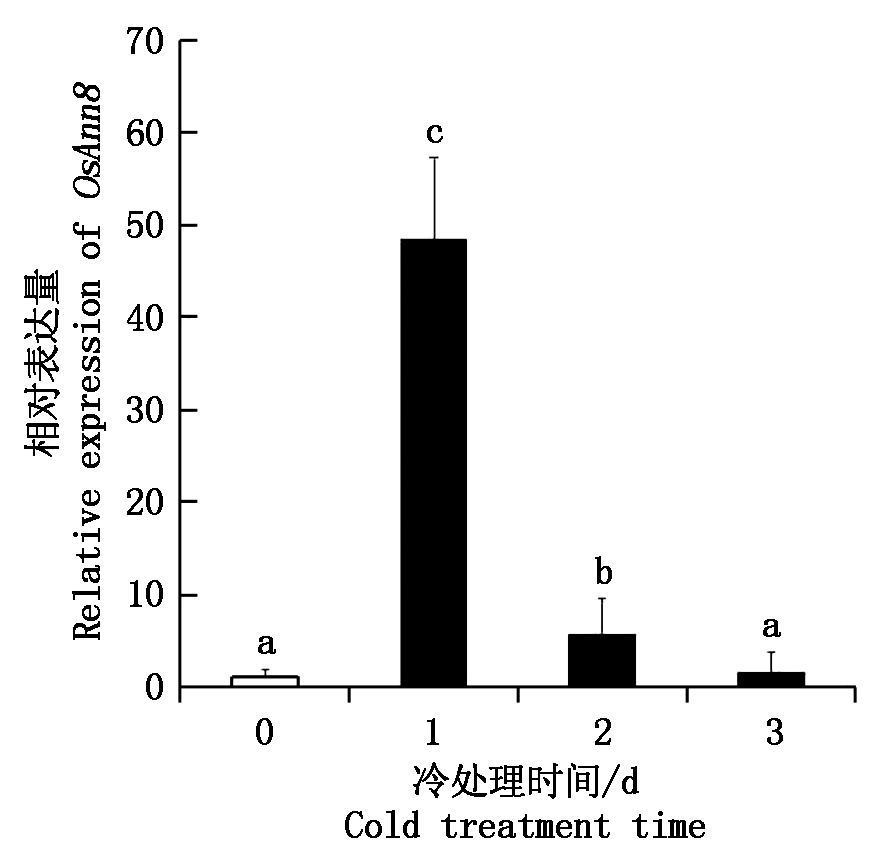
图2 水稻OsAnn8基因冷胁迫下表达分析
Fig.2 Expression analysis of OsAnn8 in rice under cold stress
2.3 OsAnn8靶位点的基因编辑克隆载体构建
选择在目标基因OsAnn8的第4外显子序列上设计靶位点,将完成复性的OsAnn8的双链靶点接头与经BbsⅠ稀有内切酶酶切后的CRISPR/Cas9克隆载体psgR-Cas9-Os进行连接,转化大肠杆菌后挑取单菌落进行阳性克隆鉴定,由于靶位点接头只有20个碱基长度,不适宜进行插入片段的质粒酶切鉴定,本研究根据psgR-Cas9-Os载体sgRNA序列的上游存在的M13位点设计上游引物M13-F,而后与下游的其中一条寡聚靶点接头分子OsAnn8-Oligo2一起通过菌液PCR进行阳性克隆的鉴定,结果发现挑取的4个单菌落克隆都扩增出了约250 bp大小的片段,此片段大小刚好与预期目的片段的大小相符,而以psgR-Cas9-Os空载体做模板的阴性对照没有能够扩增出相应目的条带,表明目标基因OsAnn8靶位点的CRISPR/Cas9克隆载体Cas9-OsAnn8已经成功构建(图3),阳性克隆测序后的序列比对分析也证实了这一结果。
2.4 OsAnn8基因靶位点的CRISPR/Cas9植物表达载体构建
OsAnn8靶位点基因编辑植物表达载体的具体构建方法如图4所示,首先使用快切限制性内切酶EcoR Ⅰ和Hind Ⅲ双酶切测序正确的OsAnn8靶位点的重组质粒Cas9-OsAnn8,1%的琼脂糖凝胶上电泳分离后, 纯化回收携带Cas9核酸剪切酶基因和引导RNA序列的5.6 kb DNA片断,与经限制性内切酶酶切后同样携带EcoR Ⅰ和Hind Ⅲ黏性末端的pSK51植物表达载体进行连接反应,热激转化大肠杆菌后涂板,15 h后挑取3个单菌落克隆摇菌,然后抽提质粒DNA,同样使用上述2个限制性内切酶(EcoR Ⅰ和Hind Ⅲ)进行质粒克隆的阳性鉴定,结果表明,3个单菌落克隆酶切后都出现了一条约11 kb的载体大片段和一条约5.6 kb的插入片段,说明 OsAnn8的CRISPR/Cas9基因编辑植物表达载体pSK51-Cas9-OsAnn8已经成功构建(图5)。
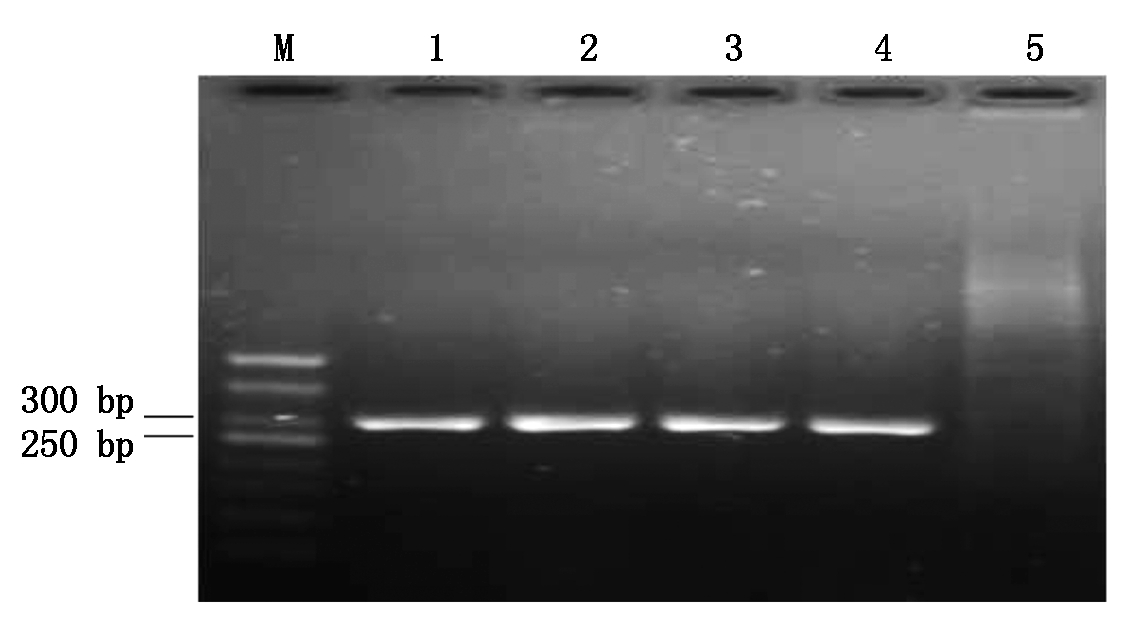
M.DL500; 1-4.阳性克隆; 5.空载体阴性对照。
M.DL500 Marker; 1-4.Positive clones; 5.Negative control.
图3 Cas9-OsAnn8重组克隆的PCR鉴定
Fig.3 PCR detection of Cas9-OsAnn8 recombined clones
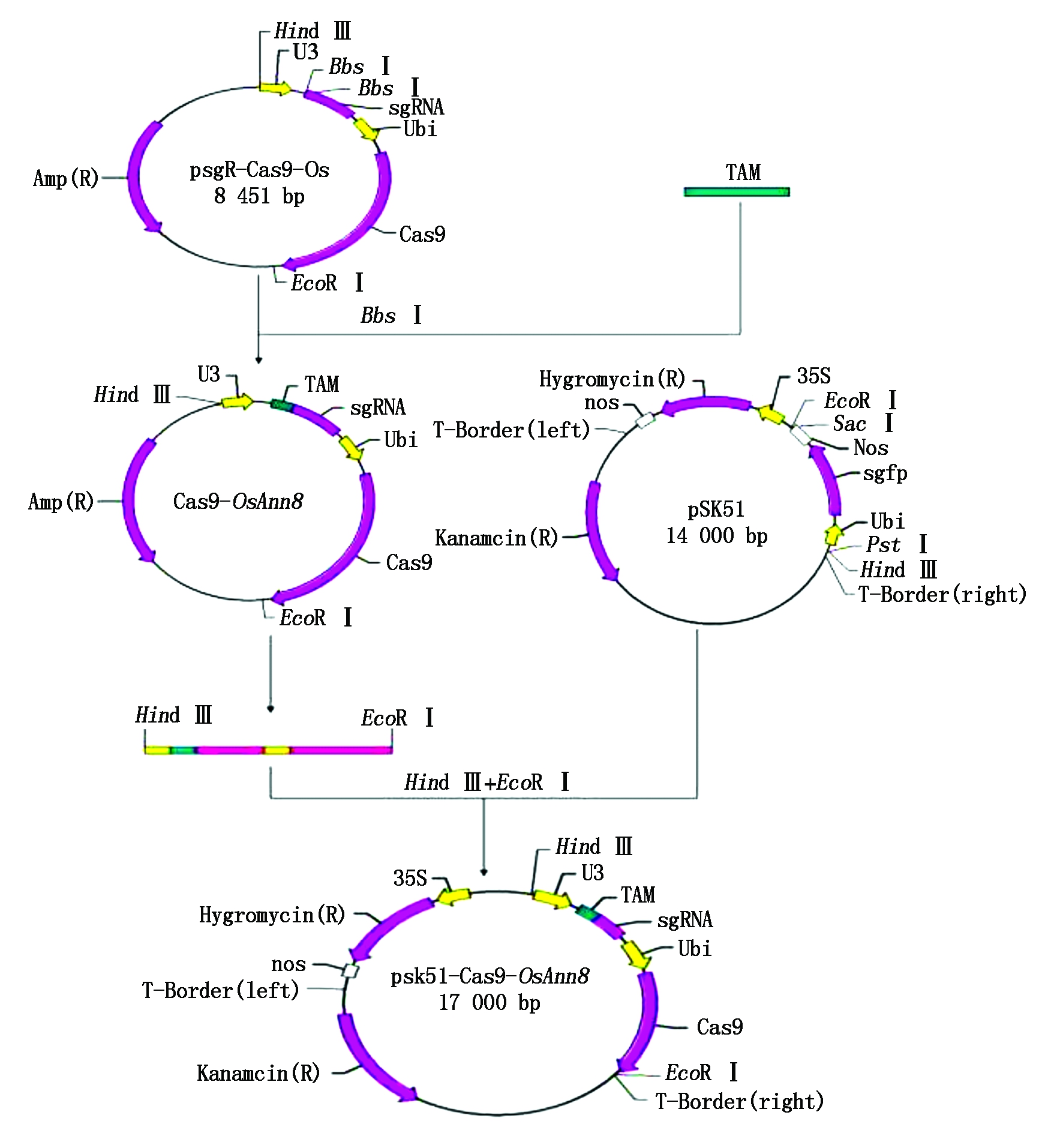
TAM.靶点接头。
TAM.Target adapter molecule.
图4 植物表达载体pSK51-Cas9-OsAnn8的构建流程
Fig.4 Construction of plant expression vector pSK51-Cas9-OsAnn8
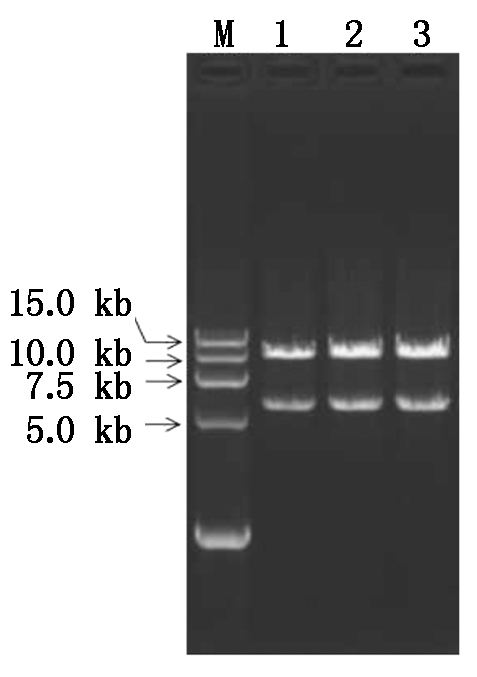
M.DL15000分子标记; 1-3.pSK51-Cas9-OsAnn8阳性克隆。
M.DL15000 Marker; 1-3.pSK51-Cas9-OsAnn8 positive clones.
图5 重组质粒pSK51-Cas9-OsAnn8酶切鉴定
Fig.5 Digestion detection of pSK51-Cas9-OsAnn8
2.5 T0转基因植株目标基因靶位点序列突变检测
通过农杆菌介导方法[23]转化重组质粒pSK51-Cas9-OsAnn8进入到转基因受体品种TP309,经过各个培养阶段的潮霉素筛选后共获得32株转基因植株 (图6)。使用目标基因OsAnn8第4外显子上靶位点的侧翼引物TB-OsAnn8F和TB-OsAnn8R (表1), 通过高保真DNA聚合酶PCR扩增T0转基因植株靶位点序列,随后送样PCR产物测序进行突变检测,结果发现,在32株T0转基因植株的测序峰图中,其中有2个单株出现了重叠峰 (图7),一个是T0-22(在PAM前第7个碱基开始出现重叠峰),另一个单株是T0-31(在PAM前第4个碱基开始出现重叠峰),序列比对结果也表明,只有这2个单株的靶位点序列与野生型相比发生了改变,说明本研究已获得了目标基因OsAnn8靶位点成功编辑的2个突变体单株,紧接着2个突变体植株突变位点的PCR扩增产物被分别克隆到T载体上,各自随机选择4~6个阳性克隆送样进行DNA测序。检测到了2种不同类型的NHEJ(非同源端连接)突变:+1(1-bp插入)、-7(7-bp缺失) (图8),其中T0-22相比野生型水稻品种TP309缺失了紧连着PAM前的 7个碱基(CCAGCTA),而T0-31与野生型水稻品种TP309相比在PAM前第4个碱基的位置上插入了1个碱基A, 但2个都是单等位突变体。
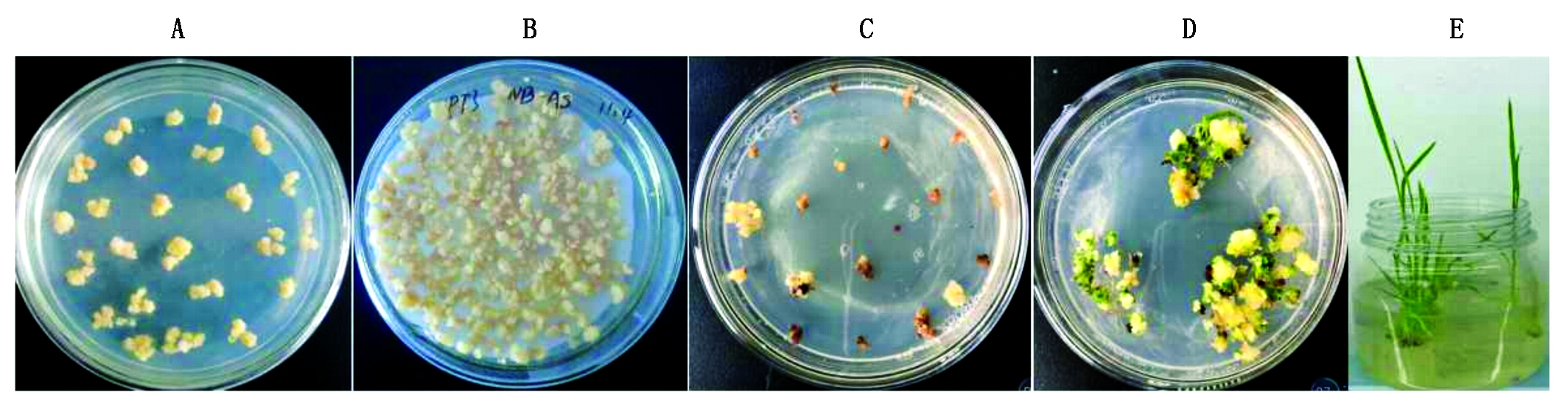
A.愈伤组织培养;B.pSK51-Cas9-OsAnn8农杆菌克隆与愈伤组织共培养;C.抗性愈伤组织筛选培养;D.抗性愈伤组织分化培养;E.转基因植株生根炼苗。
A.Callus culture; B.Co-culture of pSK51-Cas9-OsAnn8 agrobacterium clone and callus;C.The resistant callus culture;D.Resistant calli redifferentiation;E.Rooting of transgenic seedling.
图6 重组质粒pSK51-Cas9-OsAnn8遗传转化实物
Fig.6 The map of recombinant plasmid pSK51-Cas9-OsAnn8 genetic transformation process
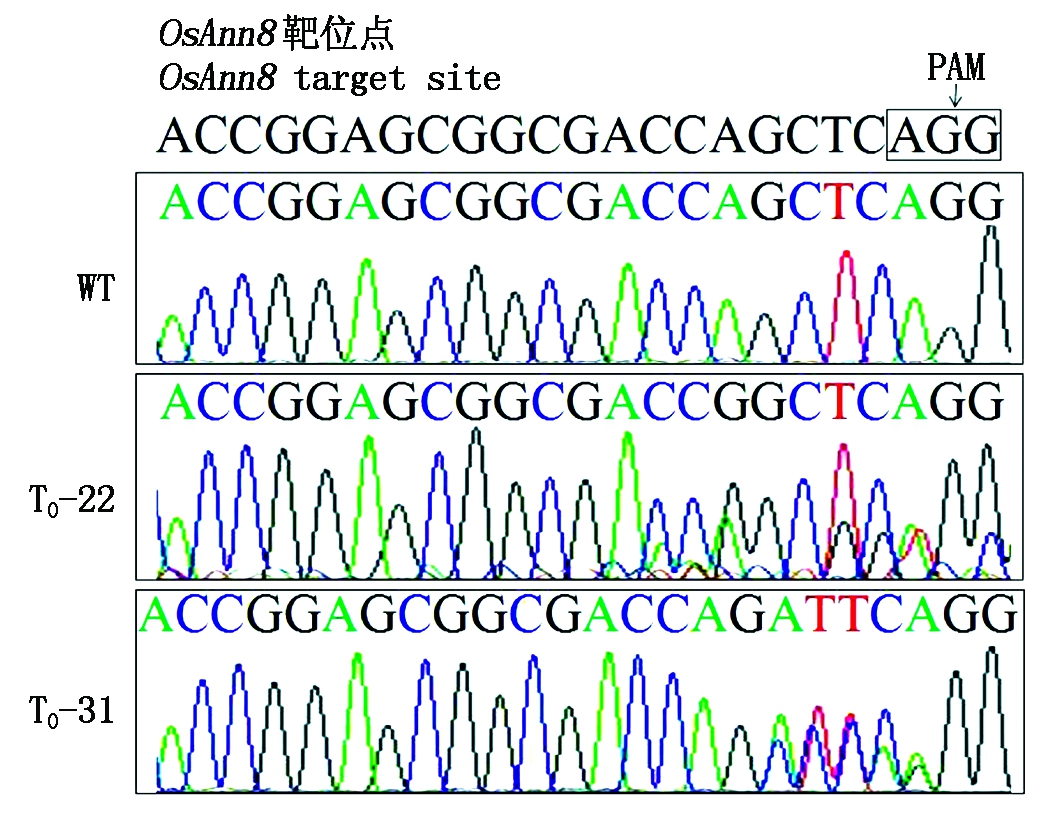
PAM.前间区序列邻近基序;WT.野生型。图8同。
PAM.Protospacer-adjacent motif;WT.Wild type.The same as Fig.8.
图7 野生型和突变体植株靶位点PCR扩增产物测序峰
Fig.7 PCR product sequencing for target modification site in WT and mutant plantlets
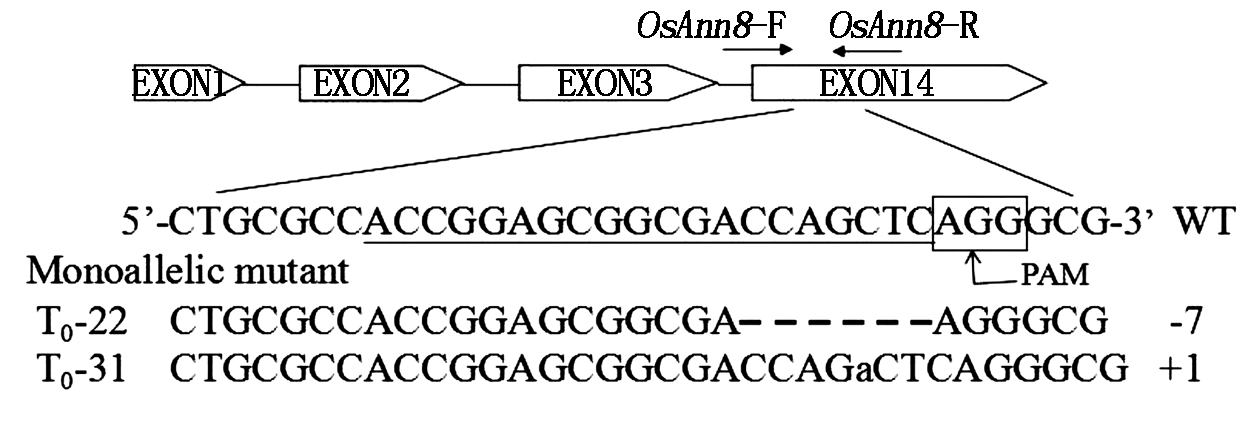
下划线.靶序列。
Underline.Target sequence.
图8 OsAnn8基因靶位点突变模式
Fig.8 Mutation pattern of the target site in OsAnn8 gene
3 结论与讨论
膜联蛋白是广泛存在于动植物体内且通过钙离子依赖方式与膜磷脂结合得一类蛋白家族,自从1978年从人类细胞中克隆出第一个膜联蛋白以来[24],目前已经陆续发现超过了1 000个膜联蛋白亚家族成员,其中,人类基因组中发现了13 个膜联蛋白亚家族成员,拟南芥基因组中发现了8 个基因家族成员[25],水稻中也发现了10 个膜联蛋白亚家族成员[20],相比动物膜联蛋白基因家族而言,在植物中,膜联蛋白基因家族成员较少也比较简单,而且基因功能和调节机制方面的研究都有待进一步深入。
水稻膜联蛋白基因家族10个成员的编码区彼此之间在核苷酸水平上具有45%~83%的序列同源性,在对应的氨基酸水平上也有16%~84%的序列一致性[20]。在植物中,在特定的条件下或特定的细胞类型中膜联蛋白家族基因成员的表达水平经常会有不同。因此,尽管膜联蛋白家族成员之间基因序列非常相似,但是植物膜联蛋白家族中不同基因成员仍可能具有不同的功能。
OsAnn8基因是水稻膜联蛋白基因家族成员之一,在Rice Genome Annotation Project (http://rice.plantbiology.msu.edu/index.shtml) 公共数据库查询显示水稻膜联蛋白OsAnn8基因全长1 543 bp,cDNA全长1 092 bp,共编码363个氨基酸,包含4个外显子组成。Jami等[20]通过对OsAnn8基因上游启动子区域分析发现,该基因包含1个胁迫相关的顺式作用元件DRE/CRT (C-repeat/Drought responsive element)(G/ACCGCC),而DRE/CRT是植物耐冷调控转录因子CBFs(C-REPEAT BINDING FACTORS)对冷反应相关基因进行转录调节的结合位点,调节基因CBF的表达蛋白通过结合到下游结构基因启动子上的CRT/DRE序列元件上, 从而诱导CBF作用的下游结构基因的表达, 使植物的耐寒性提高[26],这表明OsAnn8有可能作为CBF转录因子调控的下游基因参与水稻对冷胁迫条件的响应。
在本研究中2种非生物胁迫环境下,OsAnn8基因对干旱和低温处理都做出了响应,在干旱处理3,4 d后表达量分别下降为处理前的0.08倍和0.14倍。说明OsAnn8基因可能通过负调控的方式参与了水稻对干旱胁迫的响应。然而,OsAnn8基因在冷胁迫处理1,2,3 d后,其表达量则表现出上调,尤其是4 ℃刚处理1 d后的表达量达到最大,为处理前的48.4倍。这说明OsAnn8基因可能主要是在水稻遭受冷胁迫环境后24 h左右起作用,通过大幅度提高表达量以正调控的方式参与水稻对低温胁迫的响应,帮助水稻抵御冷胁迫条件。尽管水稻OsAnn8基因对干旱和低温胁迫都作出了响应,但却有所不同,OsAnn8基因对干旱胁迫做出了下调表达的响应,而在低温胁迫处理后却做出了上调表达的响应,这可能是因为水稻OsAnn8基因通过不同的调节机制参与了水稻对干旱和低温胁迫的响应。
利用CRISPR/Cas9介导的基因编辑技术,本研究成功获得了水稻OsAnn8基因位点的2个单等位突变体,下一步将在2个T0单等位突变体完成自交后,在T1中各自分别筛选出部分OsAnn8基因位点的双等位突变体与野生型水稻品种TP309一起用于干旱和低温胁迫处理后的表型鉴定比较分析,因此,本研究为OsAnn8基因在干旱和低温胁迫环境下的功能和作用机理研究提供了重要的突变体材料,对解析水稻OsAnn8基因在逆境胁迫条件下的生物学功能具有重要意义。
本研究通过对水稻膜联蛋白基因家族成员OsAnn8在干旱和低温胁迫条件下表达水平的荧光定量分析,证实OsAnn8参与了水稻对干旱和低温胁迫的应答,初步了解了OsAnn8在干旱和低温胁迫条件下的表达模式及规律。本研究进一步利用CRISPR/Cas9介导的基因编辑技术,成功获得了水稻OsAnn8基因位点的2个突变体,为OsAnn8基因在非生物胁迫环境下的功能和作用机制研究提供了重要的材料基础,对解析水稻OsAnn8基因在非生物胁迫条件下的生物学功能具有重要意义。
[1] Wang W, Vinocur B, Altman A.Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance[J].Planta,2003,218(1):1-14.doi:10.1007/s00425-003-1105-5.
[2] Apel K, Hirt H.Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.doi:10.1146/annurev.arplant.55.031903.141701.
[3] Clark G B, Morgan R O, Fernandez M P, Roux S J.Evolutionary adaptation of plant annexins has diversified their molecular structures, interactions and functional roles[J].The New Phytologist,2012,196(3):695-712.doi:10.1111/j.1469-8137.2012.04308.x.
[4] Moss S E, Morgan R O.The annexins[J].Genome Biology,2004,5(4):219.doi:10.1186/gb-2004-5-4-219.
[5] Davies J.Annexin-mediated calcium signalling in plants[J].Plants,2014,3(1):128-140.
[6] Gerke V, Creutz C E, Moss S E.Annexins: linking Ca2+ signalling to membrane dynamics[J].Nature Reviews Molecular Cell Biology,2005,6(6):449-461.doi:10.1038/nrm1661.
[7] Jami S K, Clark G B, Ayele B T, Ashe P, Kirti P B.Genome-wide comparative analysis of annexin superfamily in plants[J].PLoS One,2012,7(11):e47801.doi:10.1371/journal.pone.0047801.
[8] Clark G B, Sessions A, Eastburn D J, Roux S J.Differential expression of members of the annexin multigene family in Arabidopsis[J].Plant Physiology,2001,126(3):1072-1084.
[9] Hofmann A.Annexins in the plant kingdom:Perspectives and potentials[J].Annexins,2004,1(1):51-61.
[10] Huh S M, Noh E K, Kim H G, Jeon B W, Bae K, Hu H C, Kwak J M, Park O K.Arabidopsis annexins AnnAt1 and AnnAt4 interact with each other and regulate drought and salt stress responses[J].Plant and Cell Physiology,2010,51(9):1499-1514.doi:10.1093/pcp/pcq111.
[11] Jia F J, Wang C Y, Huang J, Yang G D, Wu C A, Zheng C C.SCF E3 ligase PP2-B11 plays a positive role in response to salt stress in Arabidopsis[J].Journal of Experimental Botany,2015,66(15):4683-4697.doi:10.1093/jxb/erv245.
[12] Wang X, Ma X L, Wang H, Li B J, Clark G, Guo Y, Roux S, Sun D Y, Tang W Q.Proteomic study of microsomal proteins reveals a key role for arabidopsis annexin 1 in mediating heat stress-induced increase in intracellular calcium levels[J].Molecular & Cellular Proteomics,2015,14(3):686-694.doi:10.1074/mcp.M114.042697.
[13] Zhu J E, Wu X R, Yuan S J, Qian D, Nan Q, An L Z, Xiang Y.Annexin5 plays a vital role in Arabidopsis pollen development via Ca2+-Dependent membrane trafficking[J].PLoS One,2014,9(7):e102407.doi:10.1371/journal.pone.0102407.
[14] Zhu J E, Yuan S J, Wei G, Qian D, Wu X R, Jia H L, Gui M Y, Liu W Z, An L Z, Xiang Y.Annexin5 is essential for pollen development in Arabidopsis[J].Molecular Plant,2014,7(4):751-754.doi:10.1093/mp/sst171.
[15] Mortimer J C, Laohavisit A, Macpherson N, Webb A, Brownlee C, Battey N H, Davies J M.Annexins: multifunctional components of growth and adaptation[J].Journal of Experimental Botany,2008,59(3):533-544.doi:10.1093/jxb/erm344.
[16] Konopka-Postupolska D, Clark G, Goch G, Debski J, Floras K, Cantero A, Fijolek B, Roux S, Hennig J.The role of annexin 1 in drought stress in Arabidopsis[J].Plant Physiology,2009,150(3):1394-1410.doi:10.1104/pp.109.135228.
[17] Lee S, Lee E J, Yang E J, Lee J E, Park A R, Song W H, Park O K.Proteomic identification of annexins, calcium-dependent membrane binding proteins that mediate osmotic stress and abscisic acid signal transduction in Arabidopsis[J].The Plant Cell,2004,16(6):1378-1391.doi:10.1105/tpc.021683.
[18] Qiao B, Zhang Q, Liu D L, Wang H Q, Yin J Y, Wang R, He M L, Cui M, Shang Z L, Wang D K, Zhu Z G.A calcium-binding protein, rice annexin OsANN1, enhances heat stress tolerance by modulating the production of H2O2[J].Journal of Experimental Botany,2015,66(19):5853-5866.doi:10.1093/jxb/erv294.
[19] Zhou M L, Yang X B, Zhang Q, Zhou M, Zhao E Z, Tang Y X, Zhu X M, Shao J R, Wu Y M.Induction of annexin by heavy metals and jasmonic acid in Zea mays[J].Functional & Integrative Genomics,2013,13(2):241-251.doi:10.1007/s10142-013-0316-5.
[20] Jami S K, Clark G B, Ayele B T, Roux S J, Kirti P B.Identification and characterization of annexin gene family in rice[J].Plant Cell Reports,2012,31(5):813-825.doi:10.1007/s00299-011-1201-0.
[21] Shen C X, Que Z, Xia Y M, Tang N, Li D, He R H, Cao M L.Knock out of the annexin gene OsAnn3 via CRISPR/Cas9-mediated genome editing decreased cold tolerance in rice[J].Journal of Plant Biology,2017,60(6):539-547.doi:10.1007/s12374-016-0400-1.
[22] 沈春修. 水稻LOC_Os10g05490位点冷胁迫条件下表达分析及CRISPR/Cas9定向编辑[J]. 浙江农业学报, 2017, 29(2): 177-185.
Shen C X. CRISPR/Cas9 editing and expression analysis of LOC_Os10g05490 locus under cold stress[J]. Acta Agriculturae Zhejiangensis, 2017,29(2):177-185.
[23] 李丁. 以潮霉素为筛选标记的水稻叶绿体转化体系的建立[D]. 长沙: 中南大学, 2013.
Li D. Establishment of the chloroplst genetic transformation system in rice by using hygromycin B as selection pressure[D]. Changsha: Zhongnan University,2013.
[24] Creutz C E, Pazoles C J, Pollard H B.Identification and purification of an adrenal medullary protein (synexin) that causes calcium-dependent aggregation of isolated chromaffin granules[J].The Journal of Biological Chemistry,1978,253(8):2858-2866.
[25] Cantero A, Barthakur S, Bushart T J, Chou S, Morgan R O, Fernandez M P, Clark G B, Roux S J.Expression profiling of the Arabidopsis annexin gene family during germination, de-etiolation and abiotic stress[J].Plant Physiology and Biochemistry,2006,44(1):13-24.doi:10.1016/j.plaphy.2006.02.002.
[26] Fowler S, Thomashow M F.Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway[J].The Plant Cell,2002,14(8):1675-1690. doi: 10.1105/tpc.003483.