我国猕猴桃资源丰富,自然分布有52个种。猕猴桃果实维生素C含量较高,且富含多种矿物质和膳食纤维,具有极高的营养和保健价值,被誉为“水果之王”。猕猴桃是典型的呼吸跃变型果实,需经过贮藏使其完成后熟过程,因此,贮藏能力是影响其商品价值的重要因素之一。影响猕猴桃贮藏品质的因素除了低温、气调贮藏、冷链运输等采后环节外,最主要的影响因素是采前环节,包括品种、砧木等遗传因素、气候条件、栽培管理水平、病虫害发生情况等,而CPPU(N-(2-氯-4-吡啶基)-N-苯基脲)的施用与否也与其贮藏品质有关[1-2]。
CPPU是一种具细胞分裂素活性的植物生长调节剂,能显著促进细胞分裂和增长,在葡萄、草莓、西瓜、梨等果品生产中使用普遍,表现出极大的促进果实生长、增加单果质量的作用[3]。随着CPPU施用的普及,研究者发现它还能影响果实在成熟时的营养成分,如果实的糖、酸等含量[4-6]。在猕猴桃果实的应用中,CPPU能改善果实碳水化合物的代谢,增加生长期可溶性糖和淀粉从而改善果实品质[7];花后喷施5 mg/L CPPU使猕猴桃果实单果质量增加的同时,还能增加果实可溶性固形物和总糖的含量,而20 mg/L CPPU处理虽能较好地增加果实单果质量,但果实风味品质变差[8-9]。也有研究者认为,在猕猴桃上施用CPPU能同时显著降低可溶性固形物和可滴定酸的含量[10]。但目前关于 CPPU 处理影响猕猴桃采后贮藏期间糖含量的机理尚未得到阐释。为了探究CPPU处理对猕猴桃果实品质影响的分子机制,本研究在盛花后20 d,采用20 mg/L的CPPU处理徐香猕猴桃(Actinidia deliciosa cv. Xuxiang),成熟后采集果实并在常温条件下贮藏2,4,6,8 d,分别测定果实的糖、酸及转录组数据,对转录组测序结果进行组装和注释,并鉴定与糖含量变化相关的候选基因。旨在为鉴定猕猴桃果实贮藏过程相关的基因提供有用资源,并为探究通过分子手段抑制CPPU处理果实品质下降的可行性提供理论依据。
1 材料和方法
1.1 试验材料
试验于2016年4月在猕猴桃主产区河南省西峡县商品果园内进行,以清水为对照,用20 mg/L的CPPU处理徐香猕猴桃幼果。9月,采摘成熟、大小一致、无病虫害的猕猴桃果实,迅速运至实验室,置于温度25 ℃、湿度60%左右的条件下常温贮藏。分别于采后2,4,6,8 d取6~8个果实,去皮,取果肉混合至液氮冷冻后-80 ℃保存,供糖、酸含量测定及RNA提取。
1.2 测定项目及方法
1.2.1 可溶性固形物的测定 参照农业行业标准(NY/T 2637-2014)《水果和蔬菜可溶性固形物含量的测定折射仪法》[11]。
1.2.2 可溶性总糖的测定 采用菲林试剂滴定法。果肉匀浆后称取20 g,用水洗入250 mL的容量瓶中,加盐酸3.5 mL,放入80 ℃水浴中15 min,冷却后调pH值至中性,定容至250 mL,过滤液即为总糖提取液,用菲林试剂测定总糖含量(以葡萄糖计)。
1.2.3 可滴定酸含量的测定 参照国标(GB/T 12456-2008)《食品中总酸的测定》[12]。
1.3 转录组测序
利用多糖多酚植物RNA提取试剂盒(北京华越洋生物科技有限公司)提取果肉RNA,加DNaseⅠ(TaKaRa)去除DNA,利用琼脂糖电泳检测RNA的纯度后,利用Ist Strand cDNA Synthesis Kit(TaKaRa)对RNA进行反转录合成cDNA。
利用单链cDNA、dNTPs、RNase H和DNA 聚合酶Ⅰ合成双链cDNA,之后添加接头,纯化并构建测序文库,在北京百迈客生物科技有限公司的HiSeq 2500(Illumina,San Diego,CA,USA)上进行测序。测序结果去除接头和低质量序列,利用TopHat 2[13]软件将序列比对至参考基因组[14],基因表达量的计算采用FPKM(Fragments per kb per million reads)值表示。
1.4 目标基因的GO注释和KEGG分析
GO(Gene Ontology)注释采用Blast2GO软件[15],KEGG(Kyoto Encyclopedia of Genes and Genomes)采用NCBI的Blastall程序进行通路分析。
2 结果与分析
2.1 猕猴桃贮藏过程中糖、酸含量的变化
贮藏过程中,猕猴桃果实可溶性固形物、可滴定酸和可溶性糖含量的变化情况如图1所示。
从图1可以看出,猕猴桃果实在常温贮藏过程中,对照和CPPU处理果实的可溶性固形物和可溶性糖含量变化与贮藏天数成正比,可滴定酸含量变化趋势相反。对照的果实可溶性固形物比同时期CPPU处理明显提高,贮藏第4天时提高比例最高,达20%,其次是贮藏第6天,提高比例为17%,且差异显著(P<0.05)。对照的果实可溶性糖含量高于同期CPPU的处理,贮藏第6天时二者差异显著(P<0.05)。而对照和CPPU处理的可滴定酸含量随贮藏时间的变化差异不显著(P>0.05),可见,可溶性糖含量的增加是可溶性固形物含量上升的主要原因。结果表明,施用CPPU降低了猕猴桃果实可溶性固形物和可溶性糖的含量。
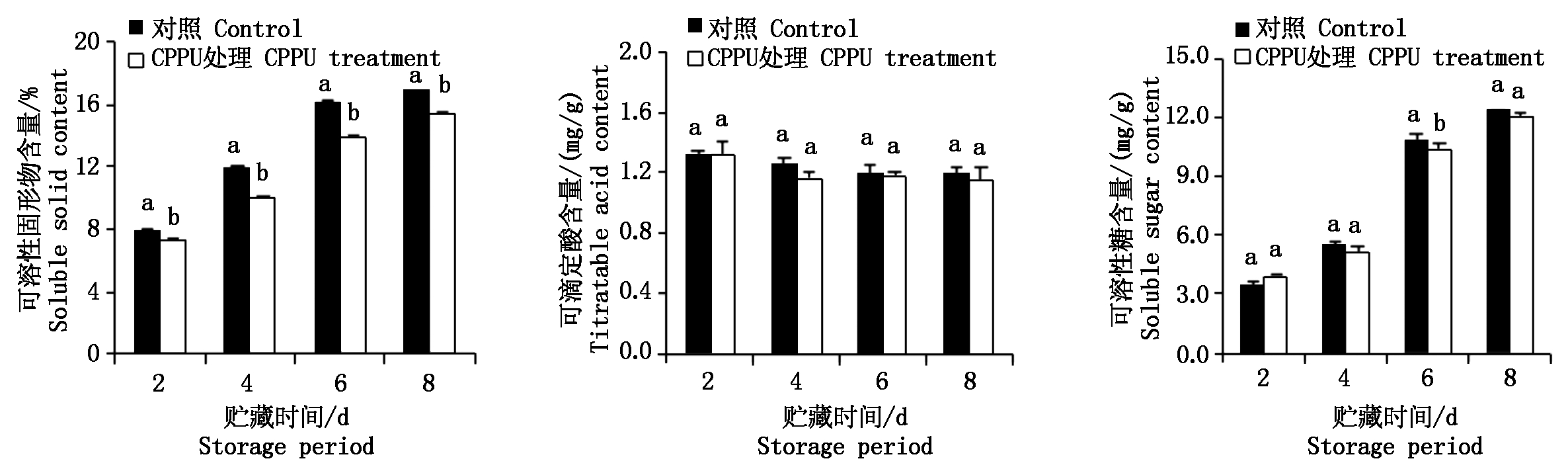
图中不同小写字母表示不同处理间差异显著(P<0.05)。图4同。
Different lowercase letters in the figure indicate significant differences of different treatments(P<0.05).The same as Fig.4.
图1 猕猴桃贮藏过程中可溶性固形物、可滴定酸和可溶性糖含量的变化
Fig.1 TSS,TA, and SSC content during storage of kiwifruit
2.2 糖代谢相关基因的筛选
转录组测序结果参考Luo等[16],即8个文库共得到56.68 Gb的序列。根据可溶性固形物含量的变化,CPPU处理果实中共筛选出2 009个上调表达的基因,对照果实中有1 761个上调表达的基因,二者均为上调的基因有580个。
2.3 糖代谢相关基因的GO富集
对2.2中580个均为上调的基因进行GO富集分析,如图2。对注释基因的功能进行归类,即生物过程、细胞构成和分子作用,再细化为53个二级功能。在生物过程中,细胞过程和单细胞生物过程基因数量较多;在细胞构成中,细胞部分和细胞基因数量较多;在分子作用中,约束和催化活性基因数量较多。

图2 筛选基因的GO注释
Fig.2 GO annotation of screening gene
2.4 糖代谢相关基因的KEGG注释
KEGG的Pathway分析如图3。
在代谢中,基因数目最多的为氨基糖和核苷酸糖代谢途径,其次为氧化磷酸化、糖酵解、内质网蛋白加工代谢途径,另外还有丙酮酸、氮、脂肪酸等代谢途径,其中的脂肪酸、醚、丙酮酸、苯丙氨酸、萜类可能与猕猴桃后熟过程中的香气成分代谢有关[16]。
2.5 糖代谢相关基因的表达分析
根据KEGG注释结果,有2个基因(Achn069851和Achn203191)涉及果糖和甘露糖代谢、3个基因(Achn161931、Achn199771和Achn295291)涉及戊糖和葡萄糖醛酸酯的转化、7个基因(Achn019911、Achn069851、Achn087691、Achn161931、Achn206141、Achn270701和Achn295291)涉及淀粉和蔗糖代谢,这些基因可能与糖含量的上升有关。去除冗余基因后,剩余基因8个,其表达如图4。
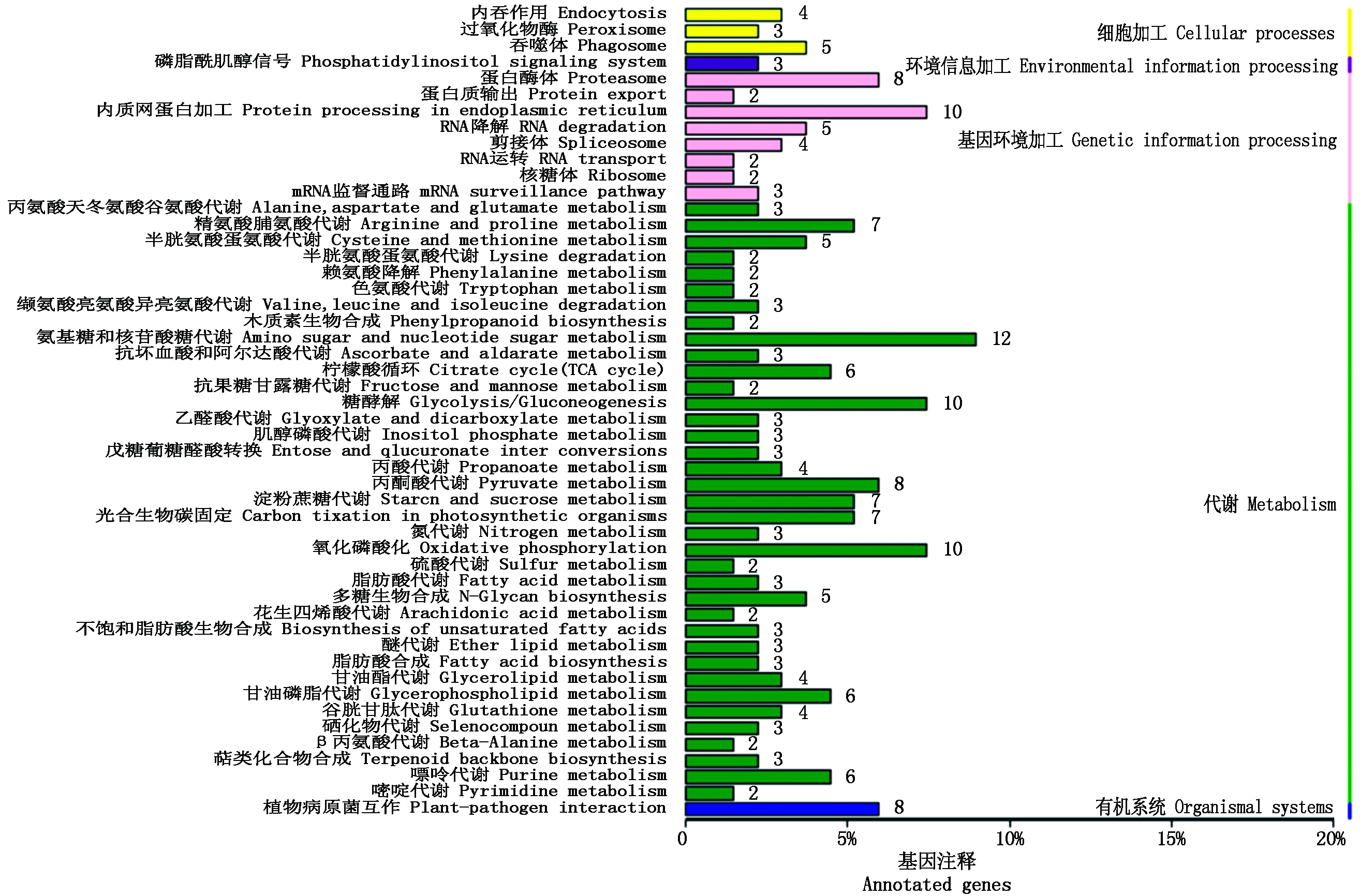
图3 筛选基因的KEGG注释
Fig.3 KEGG annotation of screening gene
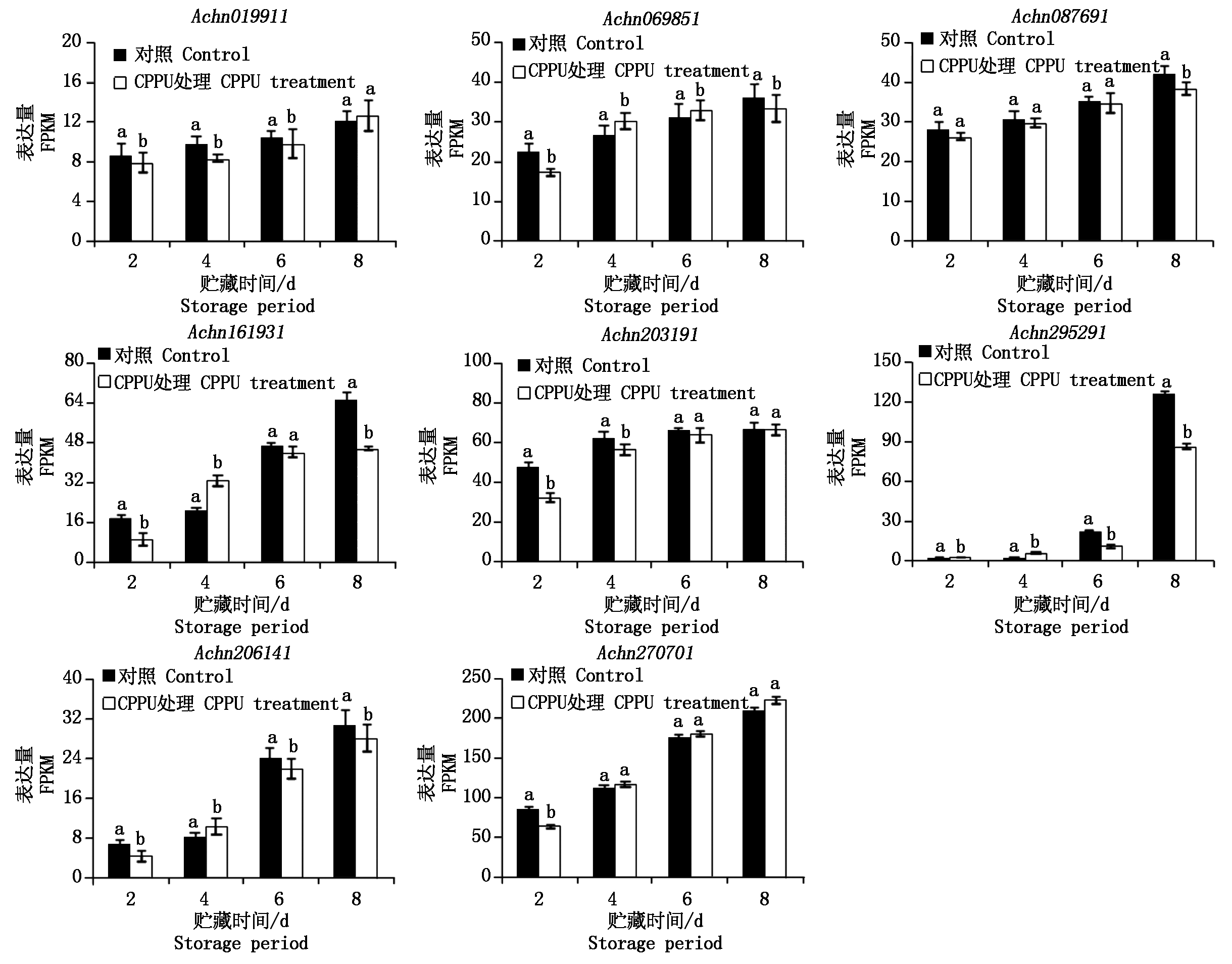
图4 糖含量相关基因在贮藏过程中的表达变化
Fig.4 Expression changes of sugar-related genes during storage
在上述8个基因中,整体表达量从高到低排列依次为基因Achn270701被注释为葡萄糖-1-磷酸腺苷转移酶(APS2),基因Achn295291被注释为编码果胶甲酯酶(PME),基因Achn203191 被注释为编码磷酸丙糖异构酶(TPI),基因Achn161931被注释为编码尿苷二磷酸葡萄糖脱氢酶(UGD),基因Achn087691被注释为编码磷酸己糖异构酶(GPI),基因Achn069851被注释为编码己糖激酶(HXK),基因Achn206141被注释为编码尿苷二磷酸-葡萄糖醛酸酯-4-表异构酶(GAE),基因Achn019911 被注释为葡萄糖醛酸转移酶(GAUT3)。可以看出,基因Achn270701在贮藏期间表达量整体高于其他基因,基因Achn019911在贮藏期间表达量整体较低。基因Achn019911、Achn069851、Achn087691和Achn203191从贮藏第2天到第8天的表达量上升缓慢,上升倍数小于1.5,而基因Achn161931、Achn206141和Achn295291在从第2~8天的表达量上升3倍以上。对照与CPPU处理基因Achn011911、Achn087691、Achn203191的相对表达量变化趋势基本一致,且对照整体高于CPPU处理;基因Achn069851、Achn161931和Achn206141的相对表达量的均呈现对照比CPPU处理高-低-高的变化趋势。基因Achn295291和Achn161931的相对表达量在对照和CPPU处理间差异较大,其中,在贮藏第2天对照基因Achn161931的表达量高于CPPU处理,贮藏第4天CPPU处理的表达量明显高于对照,贮藏第6,8天对照又高于CPPU处理,对照基因Achn295291在贮藏第2,4天几乎没有表达,而在贮藏第6天以后表达量明显高于CPPU处理。
3 结论与讨论
猕猴桃发育过程糖积累为淀粉转化型,即叶片光合产物输入果实后,除用果实生长发育与呼吸消耗外,多余部分主要以淀粉形式积累于果实中直至采收,采收后的果实经后熟将淀粉转化为可溶性糖。Cruz-Castillo 等[17]认为,施用CPPU影响海沃德猕猴桃果实发育过程中糖组分、可滴定酸的含量,成熟后对照果实糖酸含量明显高于处理果。本研究表明,0 mg/L处理的猕猴桃果实在常温贮藏软化过程中可溶性固形物和糖含量较同时期20 mg/L处理的果实增高明显,与上述研究结果吻合。
潘俨等[18]研究表明,代谢强度较高的糖酵解途径(EMP)与蔗糖/淀粉代谢关联,是促进香梨果心和果肉糖代谢、单糖持续积累的有利条件。磷酸己糖异构酶和磷酸丙糖异构酶,二者是EPM关键酶,在常温贮藏软化过程中,处理果基因Achn087691(编码磷酸己糖异构酶)和基因Achn203191(编码磷酸己糖异构酶)的表达量均低于对照果实,说明这2个基因与处理果实糖含量降低有密切关系。
己糖激酶参与催化己糖进入糖酵解的第一步不可逆反应,既能催化果糖的磷酸化又能催化葡萄糖的磷酸化。秦巧平等[19]研究表明,在温州蜜柑果实发育过程中,可食部分果糖激酶活性逐渐降低,糖含量不断增加,成熟期果皮蔗糖和葡萄糖含量略有下降,果糖激酶活性却略有升高。本研究猕猴桃常温贮藏过程中,对照和CPPU处理果实的基因Achn069851(编码己糖激酶)表达均呈上升趋势,CPPU处理果实从第2天到第4天表达量升高明显高于对照,由此可见,CPPU处理后的猕猴桃果实在贮藏期糖酵解反应增强,己糖代谢量增加,是致使果实糖含量低于对照的可能原因。
尿苷二磷酸葡萄糖脱氢酶(UGD)催化UDP-葡萄糖氧化生成UDP-葡萄糖醛酸酯,之后转化生成半乳糖醛酸、木糖、阿拉伯糖、芹菜糖等糖类,这些糖类是植物细胞壁中半纤维素和果胶等物质合成的前体;尿苷二磷酸葡萄糖脱氢酶、尿苷二磷酸-葡萄糖醛酸酯-4-表异构酶(GAE)和果胶甲酯酶(PME)与果实软化有密切的关系[20-22],本研究中,不同处理果实的基因Achn161931(编码尿苷二磷酸葡萄糖脱氢酶)、基因Achn206141(编码尿苷二磷酸-葡萄糖醛酸酯-4-表异构酶)、基因Achn295291(编码果胶甲酯酶)在贮藏过程中均有相同的变化趋势,CPPU处理果实第4天的表达量高于对照,第6天和第8天的表达量低于对照,由此推测,CPPU使果实提前软化,这与庞荣等[23]在6种猕猴桃果实的研究结果相似,并且CPPU抑制了猕猴桃贮藏后期与软化相关的酶的表达。
综上所述,20 mg/L CPPU处理明显影响了徐香猕猴桃果实中可溶性糖含量与相关基因的表达,致使果实常温贮藏过程中可溶性固形物和可溶性糖含量降低,并且提前软化。
[1] 王玮, 何宜恒, 李桦, 梁春强, 饶景萍. CPPU处理对‘华优’猕猴桃品质及耐贮性的影响[J]. 食品科学, 2016, 37(6): 261-266. doi:10.7506/spkx1002-6630-201606047.
Wang W, He Y H, Li H, Liang C Q, Rao J P. Effect of -(2-Chloropyridin-4-yl)-3-phenylurea (CPPU) treatment on postharvest fruit quality and storability in‘Huayou’ kiwifruit[J]. Food Science, 2016, 37(6): 261-266. doi:10.7506/spkx1002-6630-201606047.
[2] 王玮, 靳蜜静, 饶景萍. CPPU处理对采后猕猴桃品质及耐冷性的影响[J]. 北方园艺, 2016(1):11-117. doi:10.11937/bfyy.201601029.
Wang W, Jin M J, Rao J P. Effect of CPPU treatment on postharvest fruit quality and chilling resistance in kiwifruit[J]. Northern Horticulture, 2016(1): 11-117.doi:10.11937/bfyy.201601029.
[3] 侯勇, 马国瑞, 夏中梅, 曾显斌. CPPU研究进展[J]. 植物营养与肥料学报, 1999, 5(2): 11-19. doi:10.11674/zwyf.1999.02.003.
Hou Y, Ma G R, Xia Z M, Zeng X B. Advances in CPPU research[J]. Plant Nutrition and Fertilizer Science, 1999, 5(2):11-19. doi:10.11674/zwyf.1999.02.003.
[4] Peppi M C, Fidelibus M W. Effects of forchlorfenuron and abscisic acid on the quality of ′Flame Seedless′ grapes[J].HortScience,2008,43(1):173-176.
[5] 赵治兵, 王金华, 刘永玲, 李莹, 马立志. 基于主成分分析法研究氯吡脲对猕猴桃品质的影响[J]. 食品工业, 2018, 39(9):190-193.
Zhao Z B, Wang J H, Liu Y L, Li Y, Ma L Z. Explore the influences of forchlorfenuron on the kiwi fruit quality based on principal component analysis method[J]. The Food Industry, 2018, 39(9):190-193.
[6] 董金磊, 郭文川. 不同质量浓度氯吡脲对猕猴桃果实理化参数的影响[J]. 西北农林科技大学学报(自然科学版),2015, 43(10):146-151. doi:10.13207/j.cnki.jnwafu.2015.10.019.
Dong J L, Guo W C. Effects of forchlorfenuron concentration on physical and chemical properties of kiwifruits[J]. Journal of Northwest A & F University(Natural Science Edition) ,2015, 43(10):146-151. doi:10.13207/j.cnki.jnwafu.2015.10.019.
[7] Antognozzi E, Battistelli A, Fam I F, et al.Influence of CPPU on carbohydrate accumulation and metabolism in fruits of A ctinidia deliciosa(A.Chev.)[J].Scientia Horticulture,1996(95):00852-00857. doi:org/10.1016/0304-4238(95)00852-7.
[8] 郭叶, 王亚萍, 费学谦, 刘力. 不同浓度CPPU处理对“徐香”猕猴桃贮藏生理和品质的影响[J]. 食品工业科技, 2012, 33(20): 324-327, 354. doi:10.13386/j.issn1002-0306.2012.20.007.
Guo S, Wang Y P, Fei X Q, Liu L. Effect of different concentrations of CPPU on physiological and nutritional quality of "xuxiang" kiwifruit[J]. Science and Technology of Food Industry, 2012,33(20):324-327, 354. doi:10.13386/j.issn1002-0306.2012.20.007.
[9] 朱杰丽, 杨柳, 柴振林. 氯吡脲对“徐香”猕猴桃果实品质的影响[J]. 福建林业科技,2014,41(1):114-165. doi:10.13428/j.cnki.fjlk.2014.01. 024.
Zhu J L,Yang L,Chai Z L. Effect of forchlorfenuron on Xuxiang actinidia deliciosa fruit quality[J]. Journal of Fujian Forestry Science and Technology, 2014, 41(1): 114-165. doi:10.13428/j.cnki.fjlk.2014.01. 024.
[10] Kim J G, Takami Y, Mizugami T, Beppu K, Fukuda T, Kataoka I.CPPU application on size and quality of hardy kiwifruit[J].Scientia Horticulturae, 2006,110:219-222. doi:10.1016/j.scienta.2006.06.017.
[11] 聂继云, 李静, 徐国峰, 李海飞.NY/T 2637-2014.水果和蔬菜可溶性固形物含量的测定折射仪法[S].北京:中国农业出版社,2015.
Nie J Y, Li J, Xu G F, Li H F. NY/T 2637-2014. Determination of soluble solids in fruits and vegetables by Refractometer[S]. Beijing: China Agriculture Press, 2015
[12] 龚玲娣, 徐清渠.GB/T 12456-2008.食品中总酸的测定[S].北京:中国标准出版社,2008.
Gong L D, Xu Q Q, GB/T 12456-2008. Determination of total acid in foods[S]. Beijing: Standards Press of China, 2008.
[13] Kim D,Pertea G,Trapnell C,Pimentel H,Kelleyr R,Salzberg S L. TopHat2: accurate alignment of transcriptomes in the presence of insertions,deletions and gene fusions[J]. Genome Biology,2013,14 (4):R36. doi: 10.1186/gb-2013-14-4-r36.
[14] Huang S, Ding J, Deng D, Tang W, Sun H, Liu D, Zhang L, Niu X, Zhang X, Meng M, Yu J, Liu J, Han Y, Shi W, Zhang D, Cao S, Wei Z, Cui Y, Xia Y, Zeng H, Bao K, Lin L, Min Y, Zhang H, Miao M, Tang X, Zhu Y, Sui Y, Li G, Sun H, Yue J, Sun J, Liu F, Zhou L, Lei L, Zheng X, Liu M, Huang L, Song J, Xu C, Li J, Ye K, Zhong S, Lu B R, He G, Xiao F, Wang H L, Zheng H, Fei Z, Liu Y. Draft genome of the kiwifruit Actinidia chinensis[J].Nature Communications,2013,4(2013):2640.doi:10.1038/ncomms3640.
[15] Conesa A and Gotz S. Blast2GO:acomprehensive suite for functional analysis in plant genomics[J]. International Journal of Plant Genomics,2008,619-632. doi:10.1155/2008/619832.
[16] Luo J, Guo L L, Huang Y A, Wang C, Qiao C K, Pang R L, Li J, Pang T, Wang R P, Xie H Z, Fang J B. Transcriptome analysis reveals the effect of pre-harvest CPPU treatment on the volatile compounds emitted by kiwifruit stored at room temperature[J].Food Research International,2017,102:666-673. doi:10.1016/j.foodres.2017.09.051.
[17] Cruz-Castillo J G, Baldicchi A, Frioni T, Marocchi F, Moscatello S, Proietti S, Battistelli A,Famiani F. Pre-anthesis CPPU low dosage application increases ‘hayward’ kiwifruit weight without affecting the other qualitative and nutritional characteristics[J].Foodchem,2014(158):224-228. doi:10.1016/j. foodchem.2014.01.131.
[18] 潘俨, 孟新涛, 车凤斌, 薛素琳, 张婷, 赵世荣, 廖康. 库尔勒香梨果实发育成熟的糖代谢和呼吸代谢响应特征[J]. 中国农业科学, 2016, 49(17): 3391-3412. doi:10.3864/j.issn.0578-1752.2016.17.013.
Pan Y, Meng X T, Che F B, Xue S L, Zhang T, Zhao S R, Liao K. Metabolic profiles of sugar metabolism and respiratory metabolism of korla pear(Pyrus sinkiangensis Yu)throughout fruit development and ripening[J]. Scientia Agricultura Sinica, 2016, 49(17):3391-3412. doi:10.3864/j.issn.0578-1752.2016.17.013.
[19] 秦巧平, 张上隆, 陈俊伟, 吴延军, 陈昆松. 温州蜜柑果实发育期间果糖激酶与糖积累的关系[J]. 植物生理与分子生物学学报, 2004, 30(4): 435-440. doi:10.3321/j.issn:1671-3877.2004.04.011.
Qin Q P, Zhang S L, Chen J W, Wu Y J, Chen K S. The relationship of fructokinase and sugar accumulation during fruit development in satsuma Mandarin[J]. Journal of Plant Physiology and Molecular Biology, 2004,30(4):435-440. doi:10.3321/j.issn:1671-3877.2004.04.011.
[20] Van Buggenhout S, Sila D N, Duvetter T, Van Loey A, Hendrickx M.Pectins in processed fruits and vegetables:Part ill-texture engineering[J].Comprehensive Reviews in Food Scicnce and Food Safety,2009,8(2):1541-4337. doi:org/10.1111/j.1541-4337.2009.00072.x.
[21] 曾秀丽, 张光伦, 吕秀兰, 龚荣高, 罗楠, 胡强. 3类生境下脐橙果实细胞壁酶、瓤囊壁超微结构和品质变化的研究[J]. 果树学报, 2006, 23(5): 670-675. doi:10.13925/j.cnki.gsxb.2006.05.003.
Zeng X L, Zhang G L, Lv X L, Gong R G, Luo N, Hu Q. Cell wall enzyme activity,cell ultrastructure and fruit quality of Robertson navel orange grown in three different habitats[J]. Journal of Fruit Science, 2006,23(5):670-675. doi:10.13925/j.cnki.gsxb.2006.05.003.
[22] Dong T, Xia R X, Xiao Z Y, Wang P, Song W H.Effect of pre-harvest application of Calcium and Boron on dietary fibre, hydrolases and ultrastructure in `Cara Cara′ navel orange (Citrus sinensis L. Osbeck) fruit[J].Scientia Horticulturae,2009,121(3):272-277.doi:10.1016/j.scienta.2009.02.003.
[23] 庞荣, 任亚梅, 袁春龙, 师俊玲, 樊明涛. 膨大剂处理对六种猕猴桃采收和软熟时品质的影响[J]. 现代食品科技, 2017, 33(8): 1673-9078. doi:10.13982/j.mfst.1673-9078.2017.8.034.
Pang R, Ren Y M, Yuan C L, Shi J L, Fan M T. Effects of forchlorfenuron treatment on the quality of six varieties of kiwifruit during harvest and ripening periods[J]. Modern Food Science and Technology, 2017,33(8):1673-9078. doi:10.13982/j.mfst.1673-9078.2017.8.034.