生长素(Auxin)是英国科学家达尔文(Darwin)父子发现的一种植物激素[1]。1928年荷兰科学家温特(Went)将其命名为生长素[2]。生长素在细胞水平调控细胞伸长、分裂与分化[3-6];在植物个体水平,生长素调控器官建构、果实发育、植物衰老等多种生命过程[7-9]。生长素通过极性运输实现在植物体内的差异分布[8]。
PIN家族是目前公认的一种生长素输出载体,细胞膜上呈现极性分布,将生长素由细胞内运输到细胞,因而调节着生长素浓度梯度的动态平衡[10-11]。PIN1、PIN2、PIN3、PIN4 、PIN7 等基因已先后从拟南芥或其他物种中分离出, 并发现这些基因参与调控器官建构、根的伸长、向地性、胚胎发育等过程[12-13]。
荠菜(Capsella bursa-pastoris),十字花科草本植物,营养价值丰富,同时还具有较高的药用价值,属药食同源植物[14]。另外,荠菜还是一种研究果实形态建成的模式植物。前期研究发现,生长素在荠菜心皮发育过程中起重要调控作用,同时生长素极性运输基因PIN3在荠菜果实生长素的侧向运输中起着关键作用[15]。PIN1作为生长素极性运输家族的重要一员,其在荠菜器官发育中的作用还未知。因此,笔者根据GenBank中拟南芥PIN1氨基酸序列,设计同源引物,通过RT-PCR技术,克隆了荠菜PIN1基因编码区cDNA序列,并进行了序列生物信息学分析。同时,分析了PIN1在拟南芥原生质体中的定位以及在荠菜组织中的表达特性。此外,对PIN1蛋白进行了原核表达,还构建了植物过表达载体,获得了转基因植株,为进一步研究PIN1在荠菜器官发育中的作用奠定了基础。
1 材料和方法
1.1 试验材料
供试荠菜品种为野生型荠菜。供试拟南芥品种为Col-0,种子经氯酸钠表面消毒,无菌水冲洗后,铺于MS培养基上,4 ℃春化2 d,生化恒温光照培养箱中培养10 d。将幼苗转移到基质中(营养土∶蛭石=1∶1),生长条件为22 ℃,12 h/12 h光照/黑暗,培养21 d叶片用于制备原生质体。
大肠杆菌DH5α;质粒pSAT6-YFP、pBI121均由湖南农业大学保存,PMD18-T载体购自TaKaRa公司。
甘油、琼脂粉、各种抗生素、MS粉等购自上海生工生物有限公司;植物总RNA提取试剂盒、反转录试剂盒、DNA纯化试剂盒、质粒提取试剂盒、荧光定量PCR试剂盒、各种限制性内切酶、dNTPs、普通/高保真Taq DNA聚合酶、DNA连接酶等购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 荠菜CbPIN1基因的克隆 严格按照试剂盒说明书提取荠菜叶片总RNA,甲醛变性胶电泳与核酸紫外分光光度计法分析检测提取的RNA质量与浓度,然后采用反转录试剂盒将提取的总RNA反转录成cDNA。荠菜PIN1基因克隆引物的设计参考GenBank中拟南芥PIN1基因(NM_106017.4)序列进行(表1)。
将反转录的荠菜cDNA用于PCR反应,反应体系为:1 μL cDNA模板,2.5 μL PCR Buffer(10×),1 μL dNTPs (10 μmol/L),1 μL CbPIN1-C-F (10 μmol/L),1 μL CbPIN1-C-R (10 μmol/L),2 U Taq DNA聚合酶,补水至总体积25 μL。PCR反应程序为: 95 ℃,3 min; 94 ℃,1 min,55 ℃,1 min,72 ℃,2 min,35个循环;72 ℃,10 min。纯化试剂盒纯化PCR产物,连接至T载体后转化至DH5α感受态细胞中,含IPTG和X-gal的氨苄青霉素LB培养基上筛选转化子。试剂盒法小提白色克隆所含质粒,双酶切法检测并送测序进行分析。
1.2.2 荠菜CbPIN1生物信息学分析 CbPIN1基因核酸序列同源性采用Blast法进行分析;CbPIN1开放阅读框的查找和翻译、氨基酸序列组成特点以及理化性质分析利用DNAStar软件进行分析;CbPIN1蛋白结构特征采用蛋白质分析系统(http://www.expsy/ch/tools)进行分析;CbPIN1蛋白系统进化树采用ClustalX 1.8与MEGA 5.0软件进行构建。
1.2.3 荠菜CbPIN1亚细胞定位 扩增CbPIN1全长cDNA,PCR纯化产物、pSAT6-YFP载体经XhoⅠ和EcoRⅠ酶切后,进行连接反应,构建35Spro-CbPIN1-YFP重组分子。分离制备拟南芥叶片原生质体,PEG介导法将35Spro-CbPIN1-YFP导入原生质体中进行瞬时表达。激光共聚焦显微镜测定YFP荧光。引物序列见表1。
1.2.4 荠菜CbPIN1组织表达分析 分别提取荠菜根、茎、叶、花、种子部位总RNA并将其反转录成cDNA。β-actin为内参,实时荧光定量PCR(q-PCR)方法分析CbPIN1基因表达水平。采用Roche Lightcycler 480系统扩增CbPIN1基因。扩增体系:2 μL cDNA,0.8 μL CbPIN1-T-F,0.8 μL CbPIN1-T-R,10 μL SYBR Green Mix(2×),补水至总体积20 μL。扩增程序:95 ℃,3 min;95 ℃,10 s,60 ℃,30 s,72 ℃,10 min。CbPIN1相对表达量的分析按照2-ΔΔCt方法进行。
1.2.5 荠菜PIN1蛋白原核表达 扩增CbPIN1全长cDNA,采用Hind Ⅲ和EcoRⅠ酶切PCR纯化产物和pMal-p2X载体,构建重组DNA分子pMal-p2X-CbPIN1。含重组DNA分子的大肠杆菌经 IPTG (1.0 mmol/L)诱导6 h后,SDS-PAGE检测蛋白表达产物。
1.2.6 荠菜转化pBI121-CbPIN1 扩增CbPIN1全长cDNA,Hind Ⅲ和XbaⅠ酶切纯化的PCR产物和载体pBI121,16 ℃过夜连接反应,连接产物转化DH5α感受态细胞,涂布在含卡纳霉素的LB培养基上,挑选抗性克隆,抽提质粒,双酶切检测后送测序。测序正确的重组质粒可用于后续植物转基因研究。引物序列见表1。
构建好的重组载体pBI21-CbPIN1转化至根癌农杆菌GV3101中,菌落PCR检测分析。当野生型荠菜主花序10 cm左右,次花序在莲座开始形成时,剪掉已开花或将要开花的花苞,花絮浸渍法进行荠菜的遗传转化,转化植物培养至种子成熟,收取转基因荠菜种子进行下一步的筛选与检测分析。
表1 所用引物
Tab.1 Primers used

名称 Name引物 Primer序列(5′-3′) SequencesCbPIN1-CCbPIN1-C-FATGATTACGGCGGCGGACTTCTCbPIN1-C-RTCATAGACCCAAGAGAATGTAGCbPIN1-SCbPIN1-S-FCCGCTCGAGATGATTACGGCGGCGGACTTCTCbPIN1-S-RCCGGAATTCTCATAGACCCAAGAGAATGTAGCbPIN1-TCbPIN1-T-FTACTCGATGATGGCTTCTGGTGGTCbPIN1-T-RTCTCCACAAACAGGTTGTCGTTACCbPIN1-PCbPIN1-P-FCGGAATTCATGATTACGGCGGCGGACTTCTCbPIN1-P-RGGGAAGCTTTCATAGACCCAAGAGAATGTAGCbPIN1-ECbPIN1-V-FCCCAAGCTTATGATTACGGCGGCGGACTTCTCbPIN1-V-RTGCTCTAGATCATAGACCCAAGAGAATGTAGactinβ-actin-FCACTTGCACCAAGCAGCATGAAGAβ-actin-RAATGGAACCACCGATCCAGACACT
注:下划线部分为酶切位点。
Note: The underlined characters were restriction enzyme cutting sites.
2 结果与分析
2.1 荠菜CbPIN1基因的克隆
提取21 d荠菜叶片总RNA并反转录成cDNA,以cDNA为模板,进行RT-PCR反应,经琼脂糖凝胶电泳检测,获得了一条约2 000 bp大小条带(图1)。纯化PCR产物,进行序列测定,最终确定所克隆cDNA全长1 869 bp,C+G含量为49%。Blast比对结果显示,所克隆序列与拟南芥(Arabidopsis thaliana)PIN1高度同源,相似性高达93%,与毛白杨(Populus tomentosa)、碎米芥(Cardamine hirsuta)、金鱼草(Antirrhinum majus)等植物中PIN1基因同源性均超过70%。因此,荠菜PIN1基因已被成功克隆,命名为CbPIN1,并提交至GenBank(登录号:JN051352.1)。
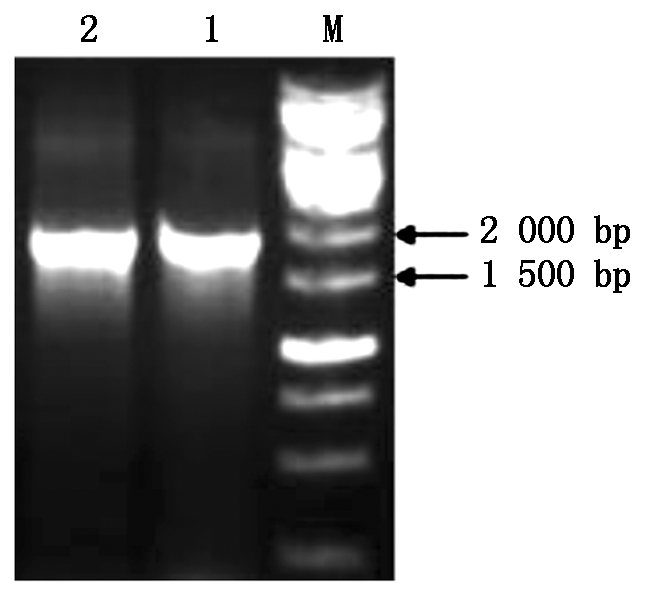
M.1 kb plus DNA 分子质量标准;1-2.PCR扩增结果。
M.1 kb plus DNA ladder; 1-2. Result of PCR.
图1 扩增CbPIN1基因
Fig.1 Amplification of CbPIN1 gene
2.2 荠菜CbPIN1蛋白结构分析
利用DNAStar软件翻译结果显示,CbPIN1编码的氨基酸个数为622(图2),蛋白分子量为67.05 ku,等电点为9.02。CbPIN1蛋白中包含49个碱性氨基酸(K、R);42个酸性氨基酸(D、E);241个疏水氨基酸(A、I、L、F、W、V);157个极性氨基酸(N、C、Q、S、T、Y)。在拟南芥中,生长素极性运输功能的发挥依赖于PIN组分关键位点的磷酸化修饰。因此,NetPhosBac 1.0 Server 在线预测了CbPIN1蛋白是否存在磷酸化修饰,发现12个丝氨酸磷酸化位点,1个苏氨酸磷酸化位点存在于CbPIN1蛋白中(图3),这暗示磷酸化修饰可能也会影响CbPIN1蛋白功能的发挥。

图2 CbPIN1基因核苷酸序列及推测氨基酸序列
Fig.2 Nucleotide and deduced amino acid sequences of the CbPIN1
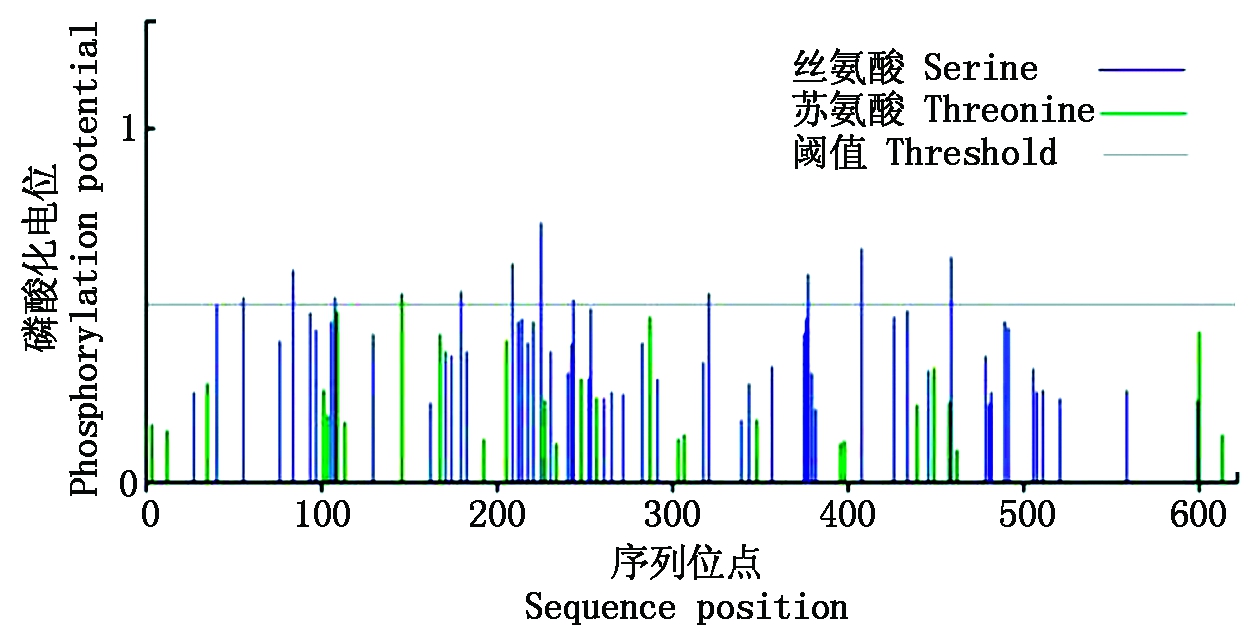
图3 CbPIN1蛋白的磷酸化位点预测
Fig.3 Phosphorylation prediction of CbPIN1 protein
蛋白质二级结构在线预测结果表明:CbPIN1蛋白无规卷曲(Random coil(c))为56.91%;β-折叠(Extended strand(e))为25.08%;α-螺旋(Alpha helix (h))为18.01%。ChloroP 1.1 Server预测结果显示,CbPIN1蛋白信号肽切割位点在N端第1-73位氨基酸残基之间,成熟蛋白质为549个氨基酸。TMHMM Server V.2.0 World Wide Web Server预测结果显示,CbPIN1属于跨膜蛋白,N端具有5个跨膜区,C端具有4个跨膜区(图4)。
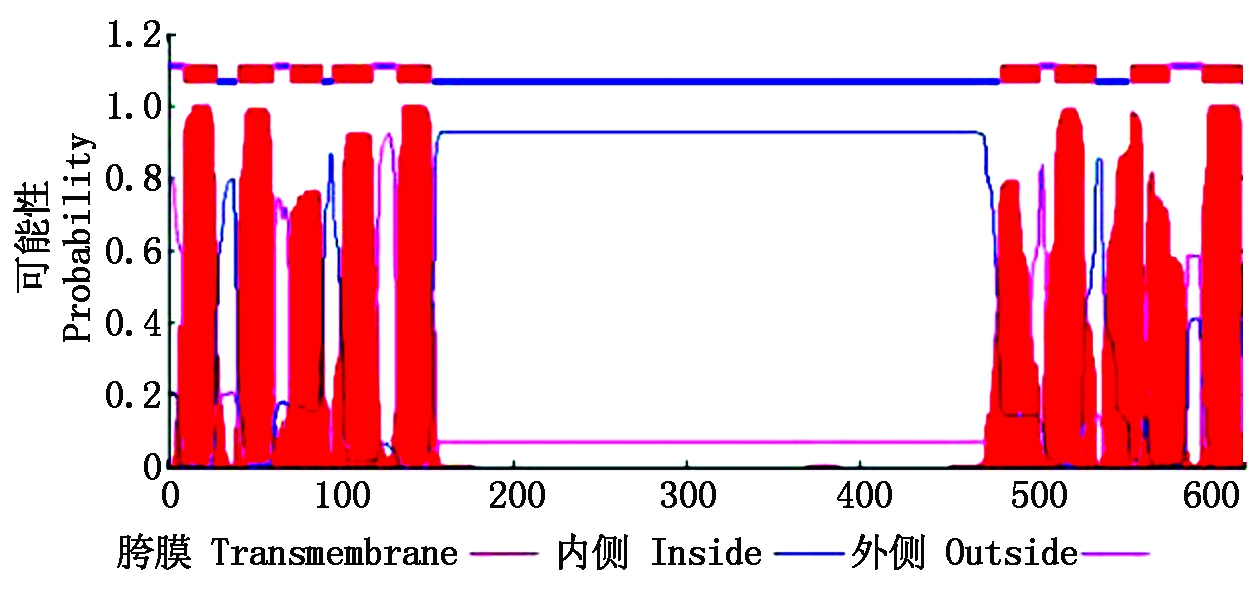
图4 CbPIN1蛋白跨膜区预测
Fig.4 Prediction of transmembrane domain of CbPIN1 protein
2.3 荠菜CbPIN1蛋白系统进化分析
利用MEAG 5.1构建了PIN1系统进化树来分析CbPIN1蛋白的进化关系,发现在亲缘关系上荠菜PIN1与拟南芥PIN1最近,同属于进化树上的一支;与菠萝(Ananas comosus)PIN1(AcPIN1)亲缘关系最远(图5)。
进一步分析表明,荠菜PIN1蛋白与拟南芥PIN1蛋白结构同源性超过90%,二者的N端和C端包含保守的跨膜结构域。此外, CbPIN1与AtPIN1亲缘关系最近,属于进化树上的同一支;与AtPIN2关系也较近;与AtPIN6亲缘关系最远(图6)。
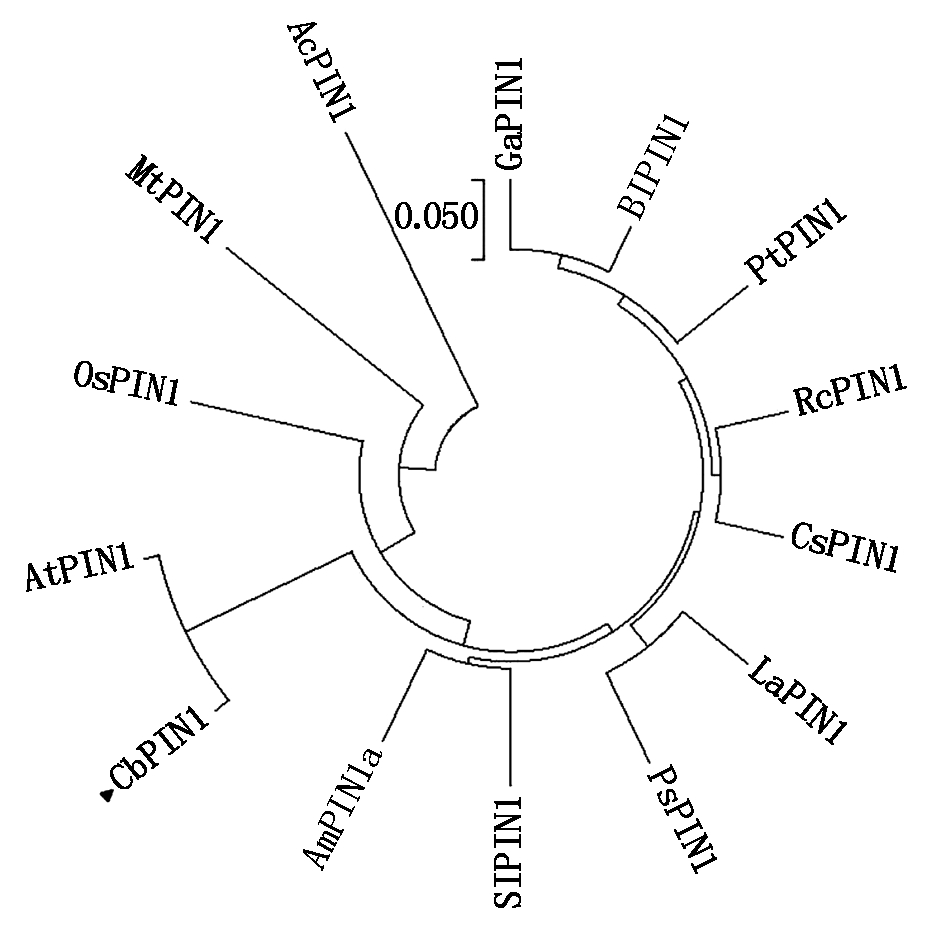
图5 CbPIN1蛋白系统进化分析
Fig.5 Phylogenetic analysis between CbPIN1 and other PIN1 proteins
2.4 荠菜CbPIN1亚细胞定位
首先,在线预测了CbPIN1亚细胞定位,结果显示,CbPIN1在细胞膜上进行表达(图7-A)。为进一步证实CbPIN1在细胞中的表达部位,构建了荠菜亚细胞定位载体35Spro-CbPIN1-YFP,PEG介导法将35Spro-CbPIN1-YFP载体转化至拟南芥原生质体细胞中,发现拟南芥原生质体细胞膜上可检测到YFP信号(图 7-B-E),进一步证明CbPIN1 定位于细胞膜。
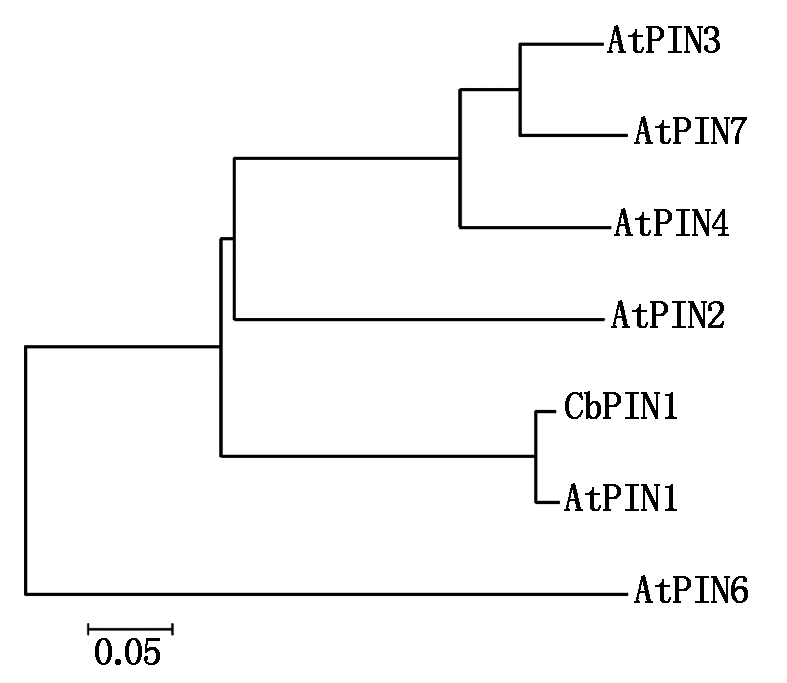
图6 PIN蛋白同源性分析
Fig.6 Homologous analysis of PIN protein family
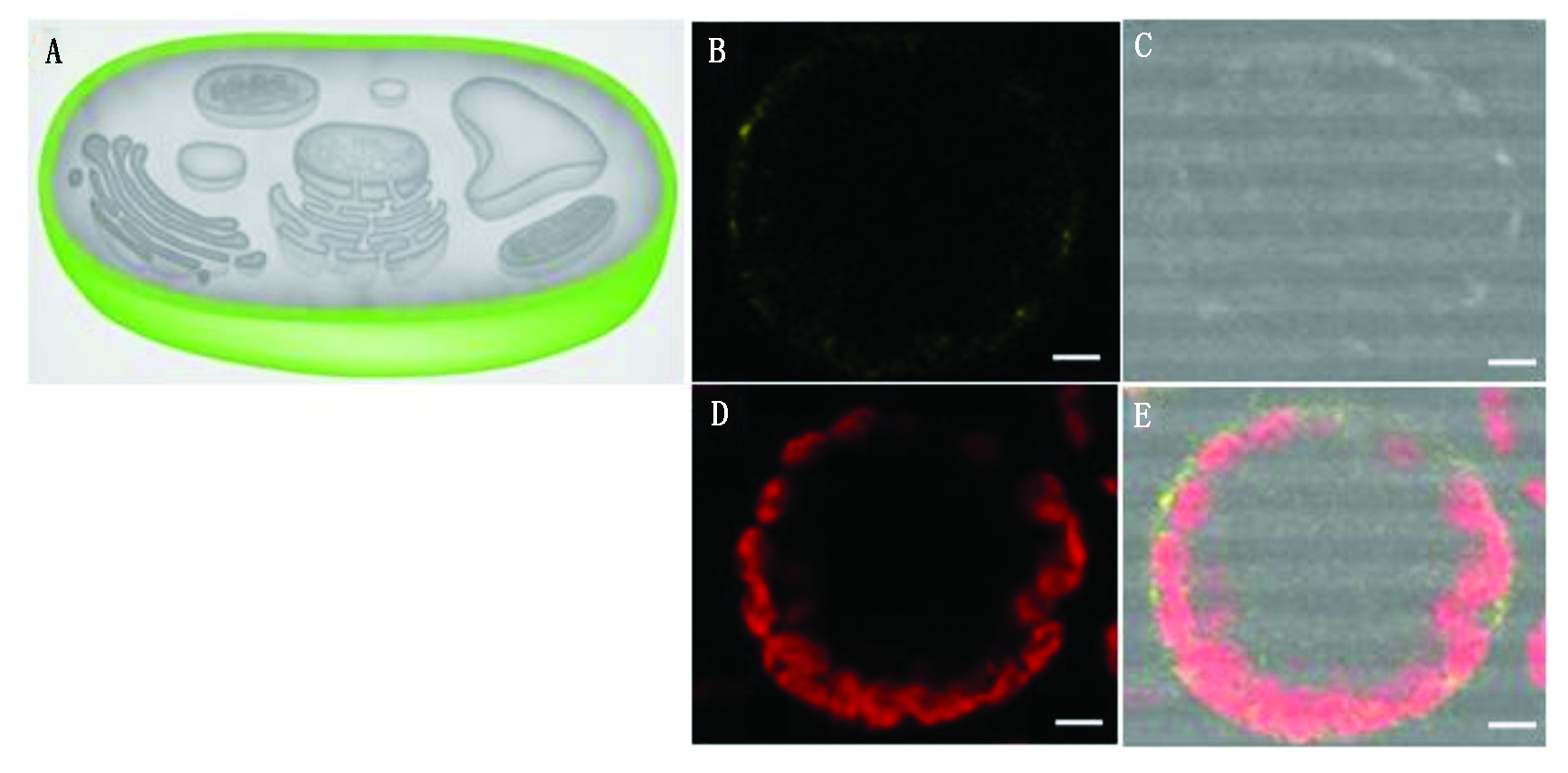
A.在线预测结果;B-E.原生质体瞬时表达结果(Bar=5 μm)。
A.Prediction of subcellular location on line;B-E.Result of transient expression in the protoplasts (Bar=5 μm).
图7 CbPIN1亚细胞定位
Fig.7 Subcellular location of CbPIN1
2.5 荠菜CbPIN1组织表达分析
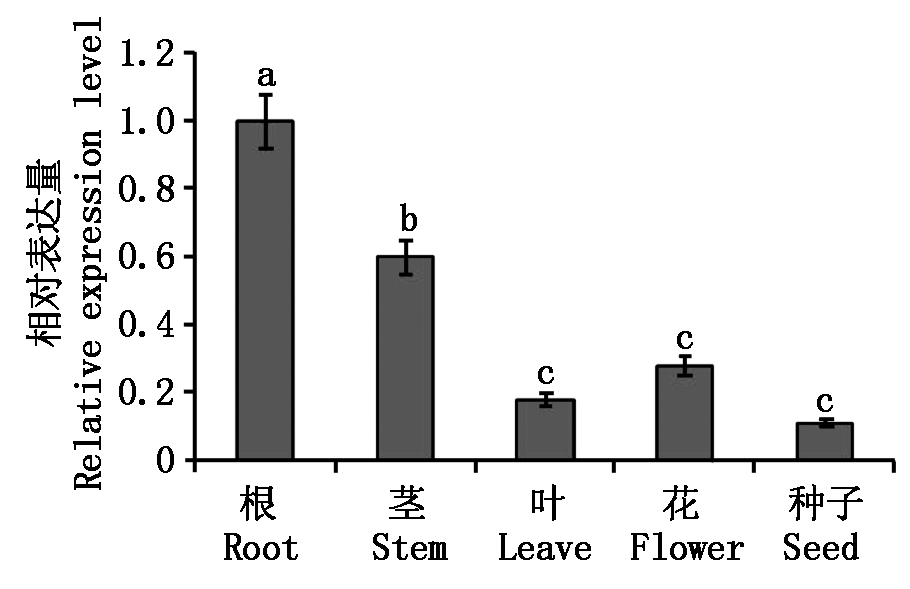
为分析CbPIN1基因表达模式,q-PCR方法检测CbPIN1在荠菜不同组织部位的表达情况。结果显示,在荠菜根、茎、叶、花以及种子中CbPIN1基因均进行表达,但其表达量不同(图8)。荠菜根中CbPIN1基因表达量最高,茎、花以及叶、种子中表达量均显著低于根中的表达量。由此推测,CbPIN1可能参与调控荠菜在根、茎和叶的发育过程。
2.6 荠菜CbPIN1原核表达
为进一步分析CbPIN1蛋白表达情况,构建了原核表达载体pET-32a-CbPIN1,转化至大肠杆菌。CbPIN1蛋白推测为67.05 ku。pET-32a载体自身tag序列大概20 ku,则表达出来的蛋白质大小应为87.05 ku。pET-32a-CbPIN1经IPTG诱导,6 h后表达了预期蛋白条带(图9)。
2.7 荠菜过表达CbPIN1基因植株的获得
为进一步研究CbPIN1对荠菜生长发育的影响,构建了植物过表达载体pBI121-CbPIN1。重组载体双酶切反应,经琼脂糖凝胶电泳,可显示出载体与目的基因2个片段,大小均符合预期,表明载体构建成功(图10-A)。
图柱上的不同字母表示不同组间差异显著(P<0.05)。图10同。
Different letters above the columns indicated significant differences among the different groups at 0.05 levels.The same as Fig.10.
图8 荠菜CbPIN1组织表达分析
Fig.8 Expression analysis of CbPIN1 in different tissues of Capsella bursa-pastoris
植物过表达载体pBI121-CbPIN1经根癌农杆菌介导法转化野生型荠菜植株,经卡纳霉素检测与分子检测获得了5株转基因植株(图10-B、C)。荧光定量PCR方法检测其CbPIN1基因表达量,结果显示,过表达植株中CbPIN1 基因表达量显著增加(图10-D)。
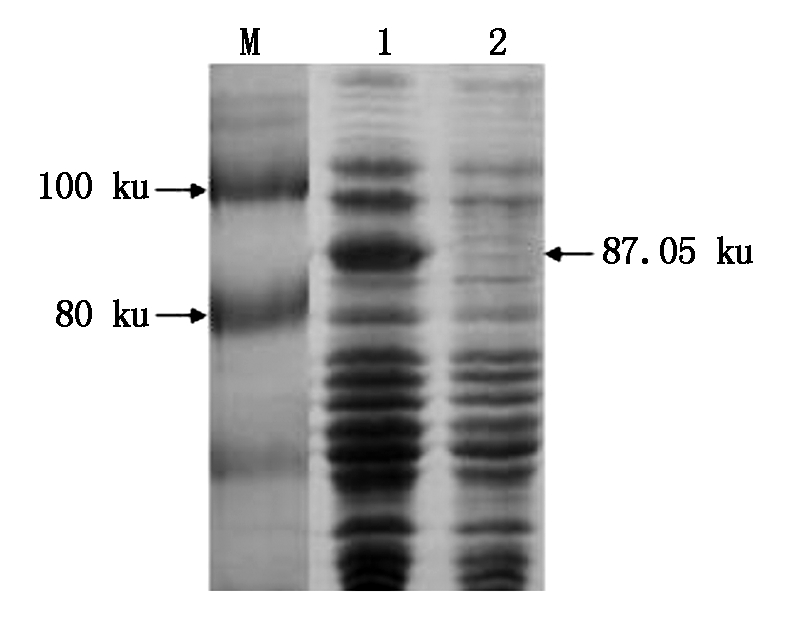
图9 荠菜CbPIN1原核表达
Fig.9 Prokaryotic expression of CbPIN1
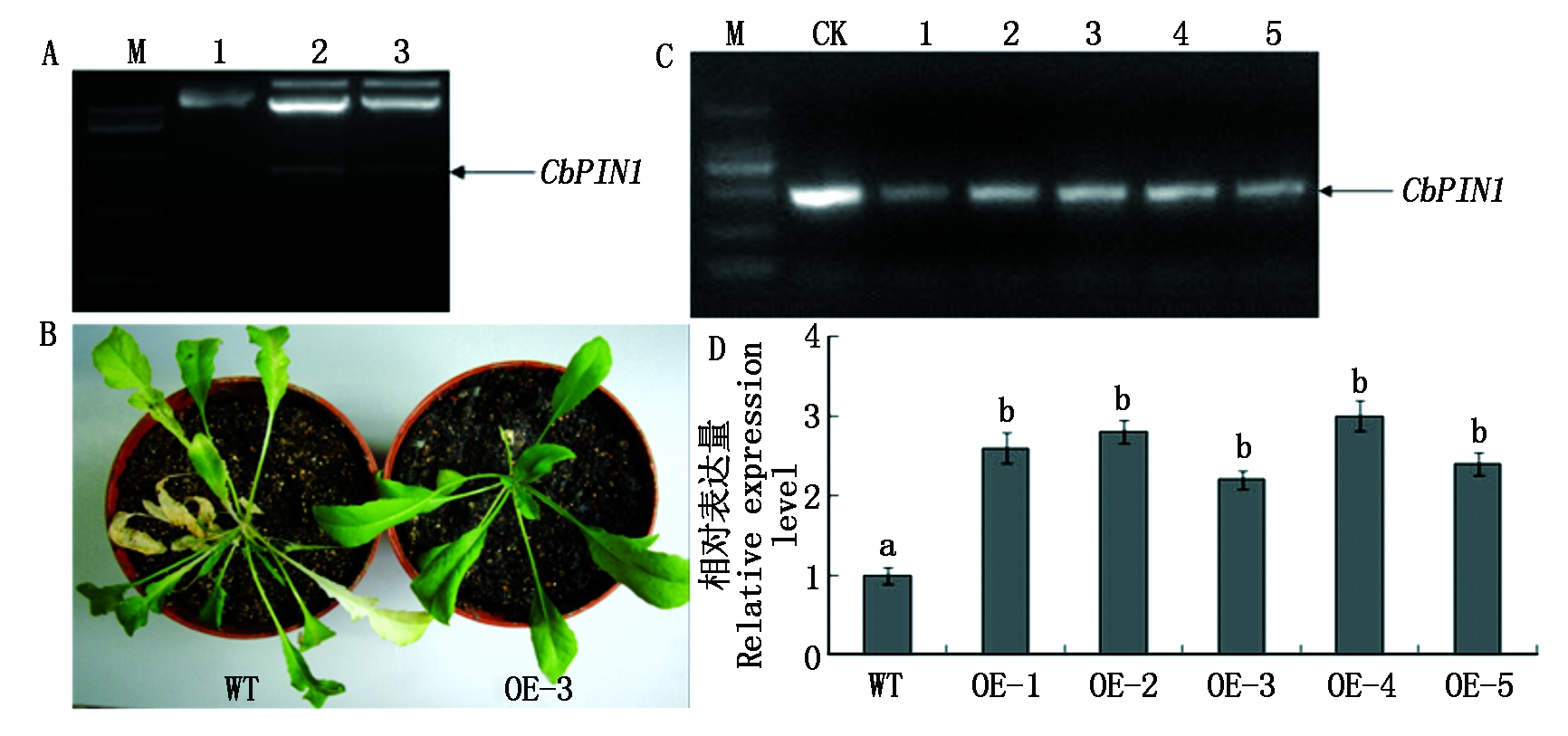
A.pBI121-CbPIN1载体构建:1.空载体,2-3.重组载体双酶切结果;B.转基因植株卡纳霉素筛选;C.转基因植株分子检测:CK. pBI121-CbPIN1载体,1-5.转基因植株;D.荧光定量PCR检测转CbPIN1基因表达量。
A.Construction of plant expression vector pBI121-CbPIN1: 1.Empty vector, 2-3.Double restriction enzyme digestion of recombinant vector; B.Kanamycin screening of transgenetic seedlings; C.Molecular identification of transgenetic seedlings:CK.Plant expression vector pBI121-CbPIN1, 1-5. Transgenetic seedlings; D.Detection CbPIN1 expression level using q-PCR method.
图10 pBI121-CbPIN1载体构建与荠菜转基因植株的检测
Fig.10 Construction of plant expression vector pBI121-CbPIN1 and transgenetic seedlings identification
3 结论与讨论
生长素作为植物体内的一种重要激素,受到国内外学者的广泛关注,而作为生长素运输载体之一的PIN1,其自然也一直是植物学中研究的一个重点研究领域。在拟南芥、水稻、狗蔷薇、苹果、桑树等多种草本、木本植物中先后均被克隆出来,也做了相应的功能分析,发现均参与生长素的运输过程,调控植物根、果实等器官的发育过程。而荠菜作为一种药食同源的植物,也可作为一种模式植物,但其PIN1基因一直未被克隆,且功能还未知,因此,本研究根据拟南芥PIN1蛋白序列,同源克隆了荠菜PIN1基因编码区cDNA区域,结果发现,荠菜PIN1基因与拟南芥PIN1基因相似性高达93%。实质上,荠菜与拟南芥同属十字花科,二者在遗传背景和生理特性上都较为一致,因此,二者PIN1基因高度相似。另外CbPIN1与碎米芥(Cardamine hirsuta)、金鱼草(Antirrhinum majus)等多种植物PIN1基因同源性也超过70%。说明植物中PIN1基因较为保守,暗示其功能可能较类似。为进一步证明其功能,采用生物信息学的方法分析了CbPIN1蛋白结构特点。发现CbPIN1是一个跨膜蛋白,亚细胞定位结果证实其在细胞膜上表达,这与其可能发挥生长素的运输功能相一致。
Zhang等[16]研究发现,在拟南芥中PIN蛋白在发挥生长素的极性运输载体功能时,需要其特定结构域被磷酸化;Weller等[17]试验结果进一步证实拟南芥特定TPRXS(N/S)模体(Motifs)位点的磷酸化是PIN1发挥生长素极性运输的必要前提。因此,在线分析了CbPIN1磷酸化情况,结果表明,CbPIN1蛋白包含12个丝氨酸磷酸化位点,1个苏氨酸磷酸化位点,这暗示磷酸化修饰可能也会影响CbPIN1蛋白功能的发挥。另外,进一步分析发现CbPIN1磷酸化位点分布特点与其他植物PIN1磷酸化位点分布较为一致。
越来越多的研究结果证实,PIN1在植物根(包括侧根、侧根原基、根尖等部位)的发育中发挥着重要的调控作用[18-20]。通过荠菜PIN1组织表达分析显示,CbPIN1在荠菜根中表达水平最高,这暗示了CbPIN1也可能参与调控荠菜根的生长发育过程。此外,在茎、叶、花等部位CbPIN1也存在表达,但其表达量显著低于根中的表达量,推测其CbPIN1基因可能参与调控这些器官的建构过程。
本研究通过同源克隆的方法获得了CbPIN1 cDNA编码区,生物信息学预测了蛋白结构特点;对CbPIN1进行了基因亚细胞定位、组织表达分析以及原核表达,另外,构建了植物过表达载体,获得了转基因荠菜,结果显示,CbPIN1表达量均显著增加。因此,本研究对荠菜PIN1基因做了初步分析,为进一步研究荠菜PIN1功能奠定了基础,同时也丰富与完善了植物PIN1。
[1] Gao Y, Zhang Y, Zhang D, Dai X, Estelle M, Zhao Y.Auxin binding protein 1 (ABP1) is not required for either auxin signaling or Arabidopsis development[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(7):2275-2280. doi:10.1073/pnas.1500365112.
[2] Yue J, Hu X, Huang J. Origin of plant auxin biosynthesis[J].Trends in Plant Science,2014,19(12):764-770.doi:10.1016/j.tplants.2014.07.004.
[3] Chandler J W. Auxin response factors[J].Plant, Cell & Environment,2016,39(5):1014-1028. doi:10.1111/pce.12662.
[4] Miao Z Q, Zhao P X, Mao J L, Yu L H, Yang Y, Hui T, Liu Z B, Xiang C B.HOMEOBOX PROTEIN52 mediates the crosstalk between ethylene and auxin signaling during primary root elongation by modulating auxin Transport-Related gene expression[J].The Plant Cell,2018,30(11):2761-2778.
[5] Ishida J K, Wakatake T, Yoshida S, Takebayashi Y, Kasahara H, Wafula E, Depamphilis C W, Namba S, Shirasu K. Local auxin biosynthesis mediated by a YUCCA flavin monooxygenase regulates haustorium development in the parasitic plant Phtheirospermum japonicum[J].The Plant Cell,2016,28(8):1795-1814.doi:10.1105/tpc.16.00310.
[6] Di Mambro R, De Ruvo M, Pacifici E, Salvi E, Sozzani R, Benfey P N, Busch W, Novak O, Ljung K, Di Paola L, Mar e A F, Costantino P, Grieneisen V A, Sabatini S. Auxin minimum triggers the developmental Switch from cell division to cell differentiation in the Arabidopsis root[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(36):E7641-E7649.doi:10.1073/pnas.1705833114.
[7] Paque S, Weijers D.Q&A: auxin: the plant molecule that influences almost anything[J].BMC Biology,2016,14(1):67.doi:10.1186/s12915-016-0291-0.
[8] Strader L C, Zhao Y. Auxin perception and downstream events[J].Current Opinion in Plant Biology,2016,33:8-14.doi:10.1016/j.pbi.2016.04.004.
[9] Chaiwanon J, Wang Z Y. Spatiotemporal brassinosteroid signaling and antagonism with auxin pattern stem cell dynamics in Arabidopsis roots[J].Current Biology,2015,25(8):1031-1042.doi:10.1016/j.cub.2015.02.046.
[10] Santos F, Teale W, Fleck C, Volpers M, Ruperti B, Palme K. Modelling polar auxin transport in developmental patterning[J].Plant Biology,2010,12(S1):1438-8677.doi: 10.1111/j.1438-8677.2010.00388.x.
[11] Wang J, Jin Z, Yin H, Yan B, Ren Z Z, Xu J, Mu C J, Zhang Y, Wang M Q, Liua H. Auxin redistribution and shifts in PIN gene expression during Arabidopsis grafting[J].Russian Journal of Plant Physiology,2014,61(5):688-696. doi: 10.1134/S102144371405015X.
[12] Adamowski M, Friml J.PIN-dependent auxin transport: action, regulation, and evolution[J].The Plant Cell,2015,27(1):20-32.doi:10.1105/tpc.114.134874.
[13] Habets M E, offringa R.PIN-driven polar auxin transport in plant developmental plasticity:a key target for environmental and endogenous signals[J].New Phytologist,2014,203(2):362-377. doi: org/10.1111/nph.12831.
[14] 张洁, 荆知敏. 荠菜的生药鉴定[J]. 中药材, 2012, 35(8): 1241-1243. doi: 10.13863/j.issn1001-4454.2012.08.022.
Zhang J, Jing Z M. Identification of crude drug of Capsella bursa-pastoris[J]. Journal of Traditional Chinese Medicine, 2012,35(8):1241-1243. doi: 10.13863/j.issn1001-4454.2012.08.022.
[15] 刘晓柱, 李银凤, 赵燕, 张学文. 生长素对荠菜心皮发育的影响[J]. 河南农业科学, 2018, 47(8): 1004-3268. doi: 10. 15933/j.cnki.1004-3268. 2018.08.015.
Liu X Z, Li Y F, Zhao Y, Zhang X W. Effects of auxin on the carpel development of Capsella bursa-pastoris[J]. Journal of Henan Agricultural Sciences, 2018,47(8):1004-3268. doi: 10. 15933/j.cnki.1004-3268. 2018.08.015.
[16] Zhang J, Nodzynski T, Pencik A, Rolcik J, Friml J.PIN phosphorylation is sufficient to mediate PIN polarity and direct auxin transport[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(2):918-922. doi: org/10.1073/pnas.0909460107.
[17] Weller B, Zourelidou M, Frank L, Barbosa I C, Fastner A, Richter S, Jürqens G, Hammes U Z, Schwechheimer C. Dynamic PIN-FORMED auxin efflux carrier phosphorylation at the plasma membrane controls auxin efflux-dependent growth[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(5):E887-E896. doi: org/10.1073/pnas.1614380114.
[18] Omelyanchuk N A, Kovrizhnykh V V, Oshchepkova E A, Pasternak T, Palme K,Mironova1 V V. A detailed expression map of the PIN1 auxin transporter in Arabidopsis thaliana root[J].BMC Plant Biology,2016,16(S1):5. doi: 10.1186/s12870-015-0685-0.
[19] Zhang K X, Xu H H, Gong W, Jin Y, Shi Y Y, Yuan T T, Li J, Lu Y T. Proper PIN1 distribution is needed for root negative phototropism in Arabidopsis[J].PLoS One,2014,9(1):e85720.doi:10.1371/journal.pone.0085720.
[20] Li K, Kamiya T, Fujiwara T.Differential roles of PIN1 and PIN2 in root meristem maintenance under Low-B conditions in Arabidopsis thaliana[J].Plant & Cell Physiology,2015,56(6):1205-1214.doi:10.1093/pcp/pcv047.