磷脂二酰甘油酰基转移酶(Phospholipids: diacylglycerol acyltransferase, PDAT1)是催化合成TAG的重要酶,在不依赖酰基-CoA 的三酰甘油合成代谢途径中催化最后一个反应。拟南芥dgat1-1背景下干扰PDAT1表达或pdat1-1 背景下干扰 DGAT1表达,种子含油量下降70%~80%,且均导致胚胎无法正常发育。目前,还没有获得dgat1-1×pdat1-2双纯和突变体。这些结果表明,PDAT1 在拟南芥TAG 生物合成中与DGAT1功能重叠[1]。转过表达载体35S-AtPDAT1,拟南芥中根和叶的PDAT活性与 PDAT 的一致,表明其编码的蛋白为 PDAT1。AtPDAT1可以利用碳链从 10 到 22的磷脂作为酰基供体,当酰基供体含有羟基、双键或环氧时酶活性最高。过表达 AtPDAT1 17 d的拟南芥突变体幼苗中脂肪酸和总脂含量与野生型差异不明显[2]。Mhaske 等[3]分离得到1个 pdat 突变体,它的PDAT上插入1个 T-DNA,种子TAG含量和脂肪酸组成与野生型差异同样不明显,表明PDAT 并不是种子合成 TAG的决定酶,应从PDAT 基因突变体其他组织中寻找表型差异。
过表达 AtPDAT(At5g13640),发现拟南芥 7 周大的突变体莲座叶TAG含量比野生型提高了 28 倍,导致油滴通过融合而体积过度膨胀[4]。已有研究表明,过表达 OLE1,增加酵母中TAG的积累[5]。过表达 OLE1,拟南芥转基因植株 3 周大的叶片中 TAG 含量增加 7 倍,小油滴聚集成簇形成指环结构,脂肪酸组分主要是C16∶0、C18∶2、C18∶3[6]。在拟南芥PDAT1/OLE1 的双转化株中,发现其 7 周大的莲座叶中 TAG 含量比野生型提高 74 倍,总脂肪酸提高了 2 倍,油体成簇,与OLE1异位表达结果相似;但是叶片中不存在大而不规则的油体,与PDAT1过表达结果不同[6]。上述证明植物组织的含油量受多基因控制,提高其含油量需调控多个关键基因。后续研究表明,PDAT 在叶片中的功能有:一是过表达增加脂肪酸合成速率;二是介导脂肪酸从膜脂转移到TAG。
PDAT在TAG合成过程中具有提高特殊脂肪酸含量的现象,从亚麻种子克隆的PDAT基因,偏好含有亚麻酰基链底物,合成三亚麻酸甘油酯。过表达亚麻酸特异的 PDAT,可大幅度提升酵母和拟南芥中 TAG的亚麻酸比例。从蓖麻中克隆的特异PDAT1-2底物偏好含有蓖麻酰基链的磷脂,其能够显著提高 TAG 中羟基脂肪酸的积累[7-8]。在泽漆、斑鸠菊、蓖麻和琉璃菊等物种种子中,PDAT与环氧化脂肪酸和羟基积累密切相关[9]。
DGAT和PDAT是催化二酰甘油合成三酰甘油(TAG) 的关键酶[10]。DGAT的研究较为系统和深入,而PDAT发现较晚,研究较少,主要集中在拟南芥、酵母、蓖麻、亚麻、亚麻荠[11]、海甘蓝[12]、向日葵、红花种子[13]和衣藻[14]中。油菜是异源四倍体,基因多拷贝现象十分常见,油脂合成中涉及的基因与通路更复杂。穆娇[15]以白菜型油菜中克隆得到2个PDAT1 基因的全长编码序列(Coding sequence, CDS),并在拟南芥 Col-0 中验证了它们的功能,BrPDAT1 重复基因结构上存在差异,BrPDAT1-2 缺少跨膜区域,但它们均能提高叶片中TAG及不饱和脂肪酸的含量。笔者已从湘油15号cDNA中克隆到3个PDAT1 CDS分别定位于A02、A10、C09号染色体,分别命名为BnaA02.PDAT1、BnaA10.PDAT1和BnaC09.PDAT1,其序列长分别为1 998,2 002,2 004 bp,各自编码665,666,667个氨基酸,酵母互补验证了PDAT1酶活性[16]。
本研究拟通过研究BnaPDAT1不同拷贝在2个含油量不同的甘蓝型油菜(Brassica napus L.)双低品系中表达特性,分析其表达与含油量的相关性。
1 材料和方法
1.1 试验材料
双低油菜品种(系):选择含油量 50%左右、35%左右的甘蓝型油菜双低品系 2 个,其中855(49.72%)、868(35.06%)均由国家油料改良中心湖南分中心提供。
试剂与试剂盒:RNA提取试剂盒(Transzol)、染料法qRT-PCR试剂盒TransStart Green qPCR SuperMix UDG购自北京全式金生物技术有限公司;cDNA合成试剂盒PrimeScriptTM RTreagent Kit with gDNA Eraser (Perfect Real-time) (宝生物工程有限公司);硅胶G60薄层色谱板、制备板(青岛海洋),普通层析板(默克.密里博);十七烷酸甘油三酯购自西格玛公司;其他试剂均购自国药集团药业股份有限公司。
1.2 试验方法
1.2.1 材料种植与取材 甘蓝型油菜双低品种(系)2013年秋季播种于湖南农业大学耘园实验基地,种植密度 15 万株/hm2,常规水、肥栽培管理。苗期(七叶一心)取叶片,盛花期取花蕾,立即使用液氮速冻,-80 ℃保存,用于总RNA的提取以及cDNA合成。分别取授粉后15,20,25,30,35,40,45 d的角果(分别用DAP15、DAP20、DAP25、DAP30、DAP35、DAP40、DAP45表示),并在低温条件下,剥离角果皮与种子,液氮速冻后-80 ℃保存,用于种子总RNA和油脂提取。
1.2.2 RNA提取与qRT-PCR 使用北京全式金生物技术有限公司TransZolTM up RNA试剂盒,按照说明书提取甘蓝型油菜种子、叶、花总RNA,按照宝生物的PrimeScriptTM RTreagent Kit with gDNA Eraser (Perfect Real-time)试剂盒说明进行反转录,获得cDNA第一链作为qRT-PCR模板。
分析克隆获得的BnaPDAT1序列并从BRAD数据库中获取其3′端非翻译区(Untranslated region, UTR),根据BnaPDAT1各拷贝UTR序列特征设计分型引物,以BnaUBC21作为内参基因,用于BnaPDAT1的时空表达分析,每样品进行 3 次重复。qRT-PCR在ABI7500荧光定量PCR系统上运行。PCR体系包含: 1 μL cDNA、10 μL 2×FastStart Universal SYBR GreenMaster with ROX、10 μmol/L正向引物和反向引物各0.5 μL、8 μL ddH2O。PCR程序为: 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 15 s, 72 ℃ 32 s, 35个循环。反应完成后进行95 ℃ 20 s, 60 ℃ 20 s, 95 ℃ 20 s, 59 ℃ 20 s绘制熔解曲线检测扩增产物的正确性和引物二聚体。
1.2.3 qRT-PCR分型引物设计与数据处理 分析显示BnaPDAT1基因三拷贝序列相似性超过 95%,基于CDS序列差异无法有效区分三拷贝,因此,通过鉴别3′非翻译区(3′-UTR)差异对BnaPDAT1基因三拷贝进行分型。
首先,基于甘蓝型油菜基因组数据库,获取BnaPDAT1基因三拷贝 3′端下游序列(根据 3′-UTR序列长度的一般特征,选择 3′下游400 bp长度);根据 3′序列设计一系列间隔若干碱基的引物对,上游引物引物固定于各拷贝CDS序列的 5′末端。同时对cDNA与BnaPDAT1基因三拷贝的CDS序列进行扩增,找出在cDNA扩增中能出现条带,而在CDS序列中无法完成扩增的所有引物对,然后对三拷贝mRNA序列库进行分型扩增,找出最合适的qRT-PCR引物,测定引物扩增效率备用。
1.2.4 不同发育时期油菜种子粗脂肪含量 采用索氏抽提法[17]测定。
1.2.5 不同发育时期油菜种子TAG提取与测定 采用薄层色谱法[18]。
2 结果与分析
2.1 BnaPDAT1基因分型引物设计
基于在BnaPDAT1基因 3 个拷贝序列特征,在BnaPDAT1的CDS末端设计固定的5′端引物,并分别在3′-UTR区域内设计 8,10,10 条 3′端分型引物(表 1);分别使用与BnaPDAT1基因克隆相同的gDNA模板和cDNA模板进行分型验证,挑选出其中最好的3对引物(A02-R2、A10-R2、C09-R1)用于BnaPDAT1基因三拷贝的qRT-PCR。
表1 BnaPDAT1基因分型引物
Tab.1 BnaPDAT1 genotyping primers

A02引物A02 primer序列(5′-3′)SequenceA10引物A10 primer序列(5′-3′)SequenceC09引物C09 primer序列(5′-3′)SequenceA02-FTGAATGGTCTGAGCGTATTA10-FGAATGGTCAGAGCGTATTGC09-FGAATGGTCAGAGCGTATTGA02-R0CGAATCAATAACCGTCTGAAA10-R0CTCAGTACGGTTCGATTCTC09-R0GGTTATTTCGGTTCAGTAGGA02-R1CTGACAGCTTTCAAAGAGATA10-R1CTGCGTGGAAGTAATAAGTTC09-R1CGTGGAAGCAATAAGTTCAA02-R2CCATGATGATGATCTCTCTTGA10-R2TGATGATGATGATGATGAGCC09-R2GATGATGATGATGATCTCTCCA02-R3TTGTGACTTGAGCATCGTA10-R3CTTGTGACTCGGACATCAC09-R3CTTGTGACTCGGACATCAA02-R4ATATCAACCTCAGGCTTCTTA10-R4GCACCACCACACATATCAC09-R4GCACCACCAAACATATCATA02-R5TTGGACCACCACAAATATCAA10-R5GAAGGGTACTGAGAATATTGCC09-R5GAAGGGTACTGAGAATATTGCA02-R6CATTATCGTTCCAAGGACAAA10-R6CACAAACATAAACAGGATGGC09-R6CACAAACATAAACAGGATGGA02-R7CGACAAGACAAACAACATGA10-R7TGCACTATCGTTCCAAGAAC09-R7TGCACTATCGTTCCAAGAAA02-R8CCGTCTGAAATAACCAAACTA10-R8ATAGACATGACGCAGCAAC09-R8CGACAAGACAAACAGACATA10-R9GATGCTTTCGACAAGACAAC09-R9AGTTGAAGCTATGTAGAACCA10-R10GATGTGTAATAGAGGAACTCTCC09-R10CTAGACCTAGTTCACGATGT
2.2 BnaPDAT1基因在甘蓝型油菜不同品系中的表达
含油量不同的 2 个油菜品系855和868中BnaA02.PDAT1的表达(图 1)随种子发育呈先升高后降低的趋势,但在2个材料的表达变化规律有一定差异。高含油量品系855种子在授粉后 30 d出现表达量峰值;低含油量品系868种子在授粉后 25 d出现表达量峰值,而授粉后 30 d的种子中几乎不表达。2个油菜品系的花、叶中均有BnaA02.PDAT1表达,且高含油量品系 855 在叶中表达量为全生育期最高值(3.639 9)。高油品系855相对低油品系868在叶和授粉后20 d的种子中BnaA02.PDAT1表达具有极显著性差异(P<0.01),差异分别为 5.57 倍和3.64倍。
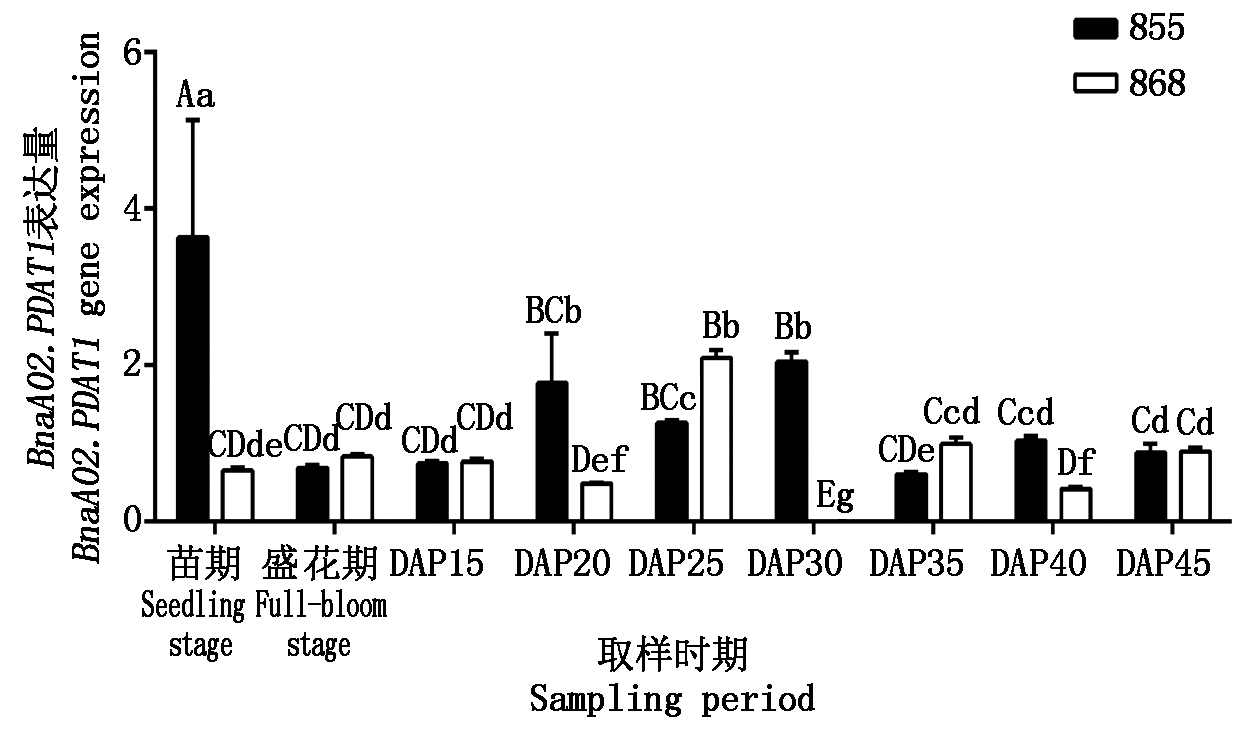
不同大小写字母分别表示数值由大到小间差异达0.01,0.05显著水平。图2-4、表2,3同。
Different upper and lower letters indicate that the value varies from large to small,with a difference of 0.01,0.05.The same as Fig.2-4,Tab.2,3.
图1 BnaA02.PDAT1在不同品系甘蓝型油菜中的表达
Fig.1 Expression of BnaA02.PDAT1 in different Brassica napus strains
除授粉后 20 d的种子中存在极显著差异外,855和858中 BnaA10.PDAT1表达无明显差异(图 2),在叶中几乎不表达,在授粉后 25 d的种子中表达量极低,在花和授粉后其他时期的种子中均表达。BnaA10.PDAT1在高含油量品系855授粉后 20 d 种子中表达量为全生育期最高值(5.322 1),与868中表达量具有极显著差异(P<0.01),差异为7.33倍。
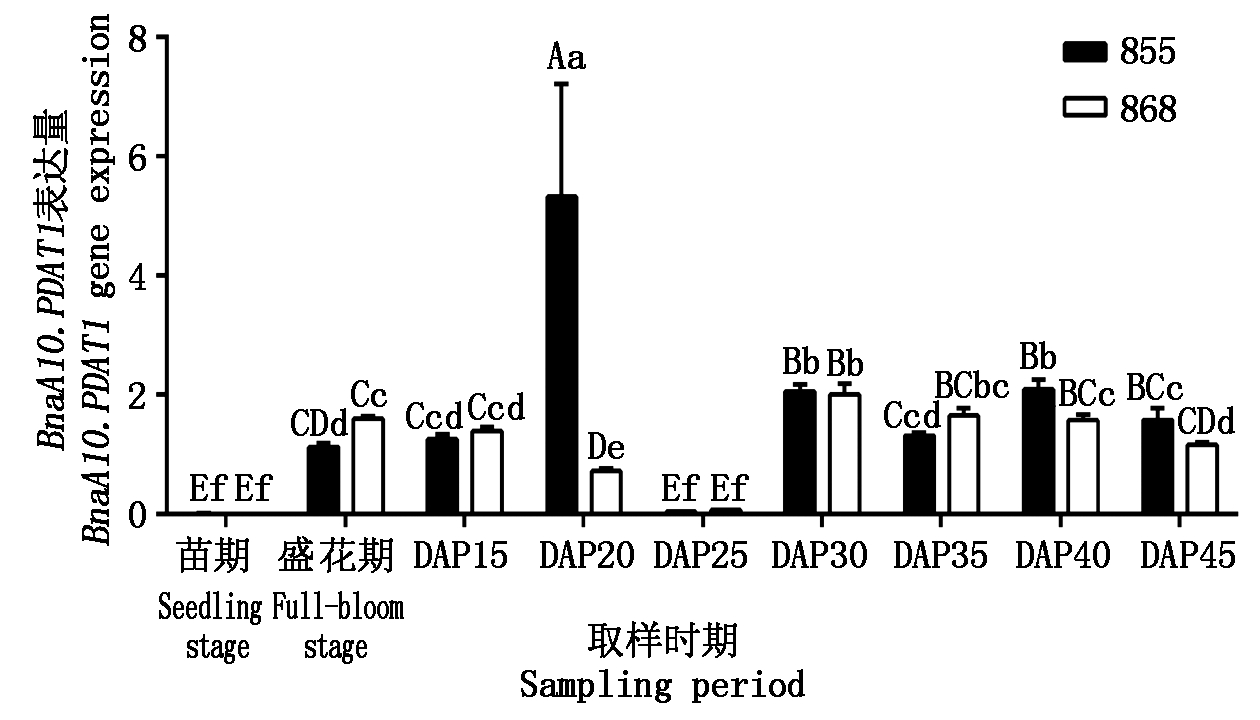
图2 BnaA10.PDAT1在不同品系甘蓝型油菜中的表达
Fig.2 Expression of BnaA10.PDAT1 in different Brassica napus strains
855和858中BnaC09.PDAT1的表达(图 3)随种子发育呈先升高后降低的趋势,与BnaA02.PDAT1基本一致, 855种子在授粉后 20 d 表达量出现峰值,868种子在授粉后 25 d 表达量出现峰值;BnaC09.PDAT1在叶和花中均表达,其中高含油量品系855叶中BnaC09.PDAT1表达量为全生育期最高值(5.2063)。另外在高含油量品系 855 相对低含油量品系868在授粉后 20 d种子和叶中BnaC09.PDAT1表达量具有极显著差异(P<0.01),差异分别为 4.10 倍和9.43 倍。
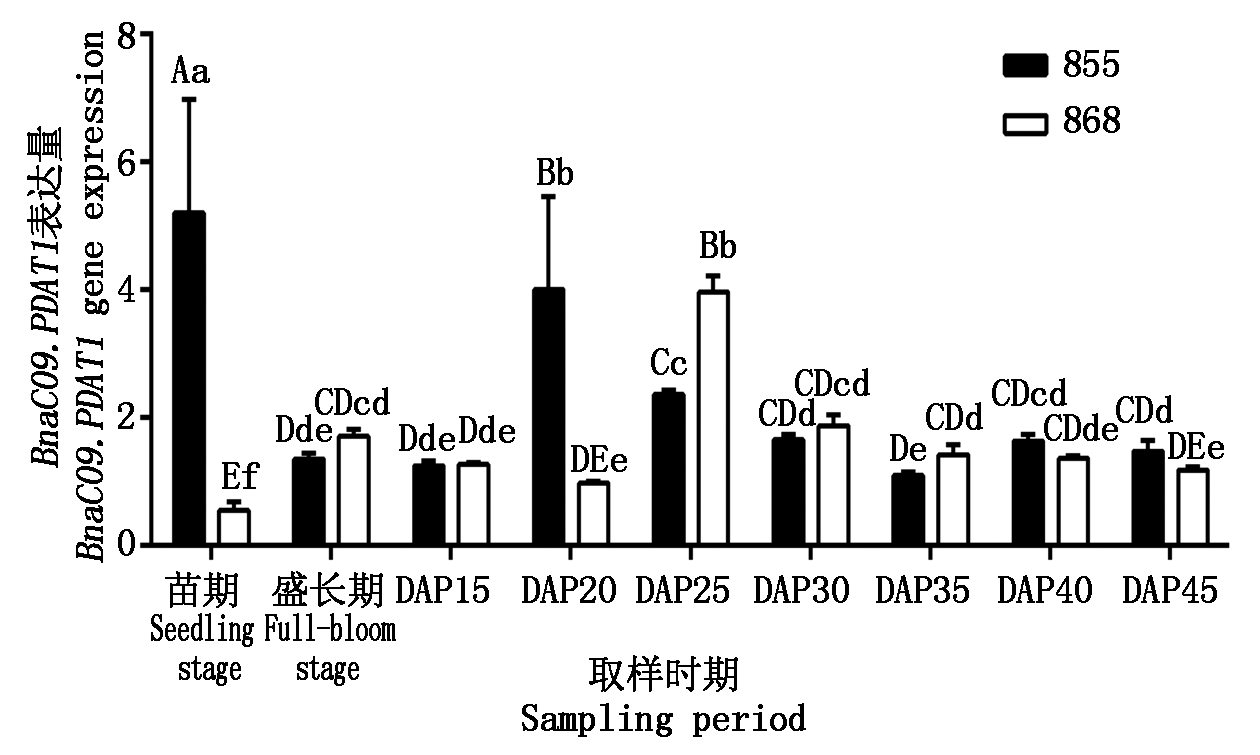
图3 BnaC09.PDAT1在不同品系甘蓝型油菜中的表达
Fig.3 Expression of BnaC09.PDAT1 in different Brassica napus strains
855和868中3个BnaPDAT1拷贝的总表达量(图4)在授粉后种子中同样呈先升高后降低的趋势,855种子在授粉后20 d表达量出现高峰,868种子在授粉后25 d表达量出现高峰;花、叶片、种子中均有BnaPDAT1表达,除叶和授粉后20 d 种子中表达量差异较大外,其余各时期两品系间表达差异不大,与湘油15号表达特性一致[16],整体调控的特点得到验证。BnaPDAT1在高含油量品系855中授粉后20 d表达量为全生育期最高值(11.100 9),是868的5.07倍;叶中表达量8.858 6,为868的7.34倍。BnaPDAT1整体表达特性与BnaC09.PDAT1相似。
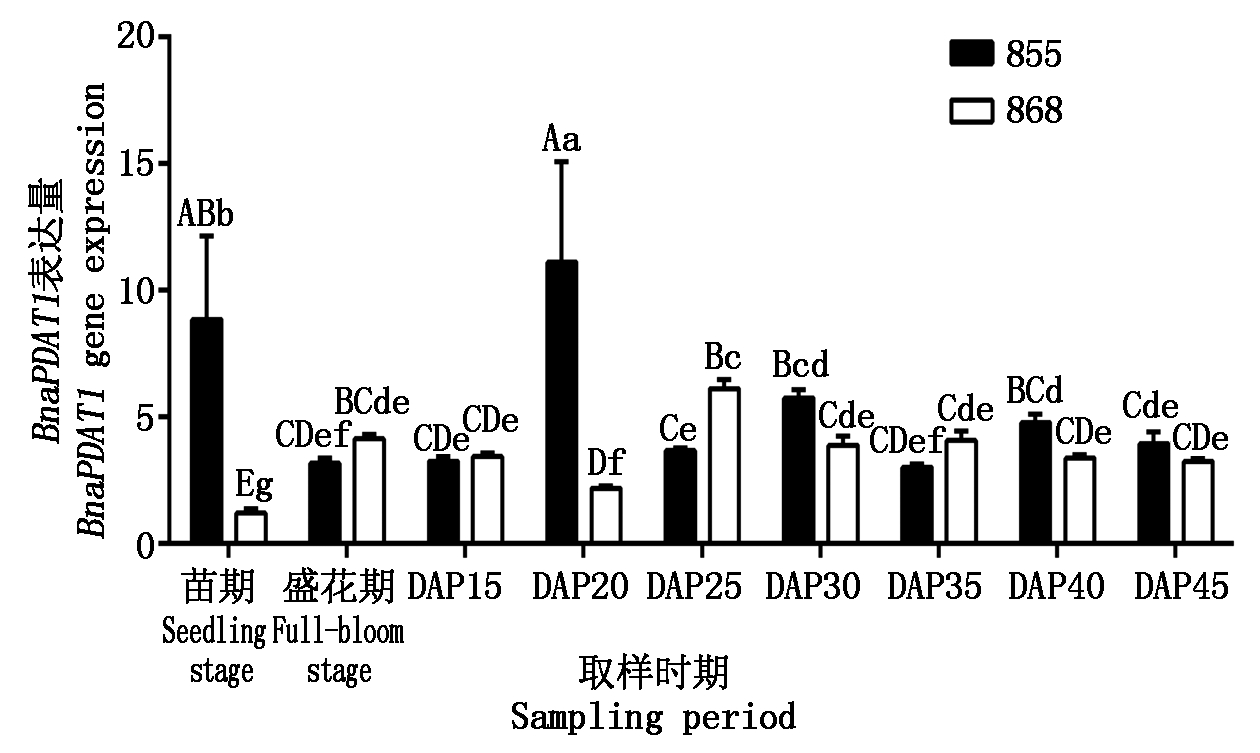
图4 BnaPDAT1在不同品系甘蓝型油菜中的表达
Fig.4 Expression of BnaPDAT1 in different Brassica napus strains
2.3 不同油菜品系种子发育中TAG积累规律
油菜成熟种子中油脂以TAG形式固定、贮存,但是前期种子发育过程中甘油一酯、甘油二酯和游离脂肪酸所占比重较大,粗脂肪含量不能代替TAG含量。经研究在成熟种子中TAG含量可以代表含油量,相关系数 r=0.992 9**。从2个品系不同时期TAG含量值看(图5),其趋势基本一致,类似S型,授粉后20 d以前TAG含量很低,授粉20 d后油脂合成速度加快,授粉后30 d进入快速增长阶段,授粉后35 d进入缓慢增长期,授粉后30 d以前TAG含量材料间差异不大,授粉后35 d开始出现差异,授粉后40 d差异进一步扩大并趋于稳定,这与姚金保等[19]的研究结论一致。
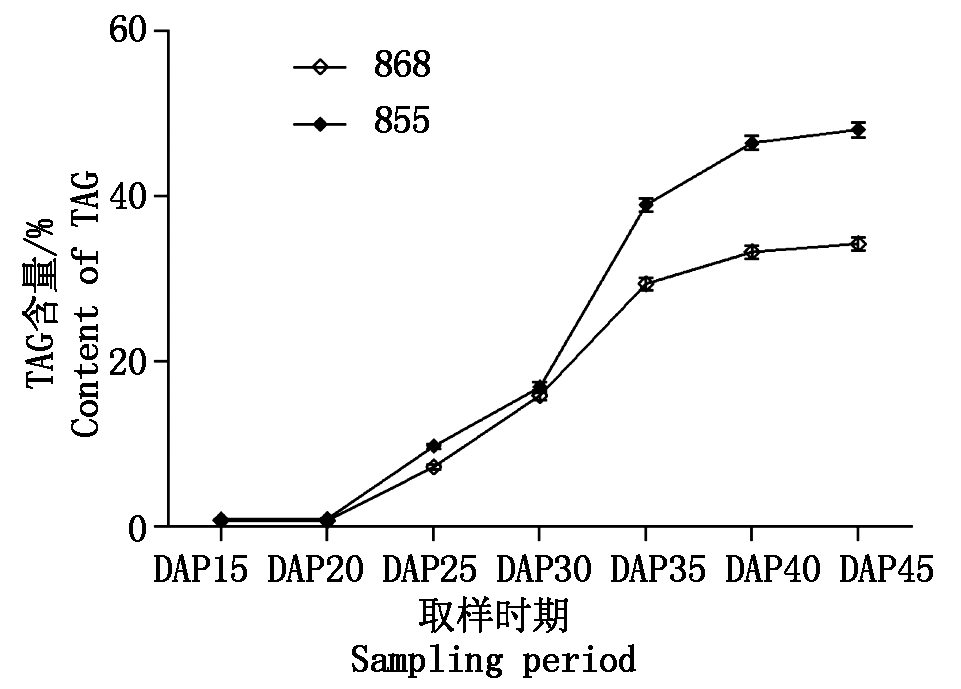
图5 不同含油量油菜品系 TAG含量变化
Fig.5 Variation of TAG content in rapeseed varieties with different oil contents
从2个材料TAG含量增长值看,授粉后20 d以前TAG含量和增长值很小,20~25 d,25~30 d,30~35 d,35~40 d TAG增长值较大,0~15 d,40~45 d TAG增长值变小。其中高含油品系855中TAG增长值最大的是授粉后30~35 d,其次是授粉后20~25 d,35~40 d和25~30 d相差不大 ;低含油品系868中TAG增长值最大的是授粉后30~35 d,其次是授粉后25~30 d,再次是20~25 d。两者增长量差异最大的是30~35 d,其次是35~40 d (表2)。
表2 种子不同发育时期TAG含量变化
Tab.2 Changes of TAG content in different developmental stages of seeds
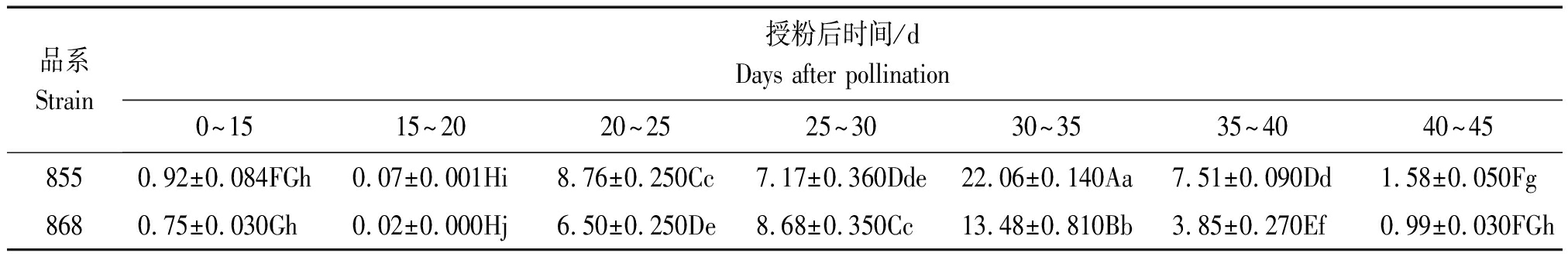
品系Strain授粉后时间/dDays after pollination0~1515~2020~2525~3030~3535~4040~458550.92±0.084FGh0.07±0.001Hi8.76±0.250Cc7.17±0.360Dde22.06±0.140Aa7.51±0.090Dd1.58±0.050Fg8680.75±0.030Gh0.02±0.000Hj6.50±0.250De8.68±0.350Cc13.48±0.810Bb3.85±0.270Ef0.99±0.030FGh
2.4 BnaPDAT1基因对不同发育时期种子TAG含量的影响
分析前述2个具有不同含油量水平的甘蓝型油菜品系TAG积累规律与BnaPDAT1基因表达的关系如图6(TAG含量)和图7(TAG增长量)所示。
由图 6,7可见,BnaPDAT1基因表达和种子TAG含量变化没有明显的相关性,但总体而言,高油品系中BnaPDAT1基因表达水平具有更大的峰值。2个油菜品系TAG增长量均呈现先升高后降低的趋势,855在授粉后 25~40 d 均具有较稳定的增长量,授粉后 35 d 达到峰值;868在授粉后 25~35 d 均具有较稳定的增长量,授粉后 35 d 达到峰值,表明在授粉后 35 d前后为甘蓝型油菜TAG积累的核心时期。从BnaPDAT1基因表达值看,在不同品系油菜中存在差异,授粉后逐渐变大,855中在授粉后 20 d表达量出现高峰,授粉后 30 d表达量出现次高峰;868中授粉后 30 d表达量出现高峰,后期下降趋势均不明显。
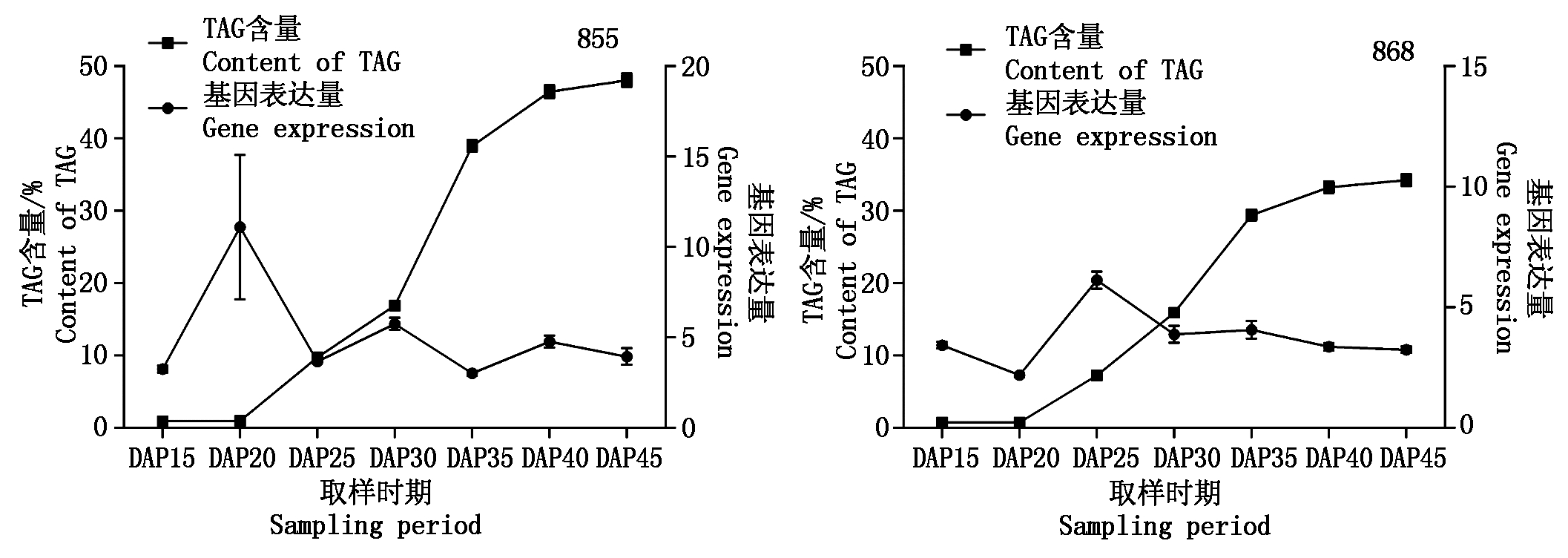
图6 不同时期油菜品系TAG含量和BnaPDAT1表达量
Fig.6 TAG content and BnaPDAT1 expression in rape varieties at different times
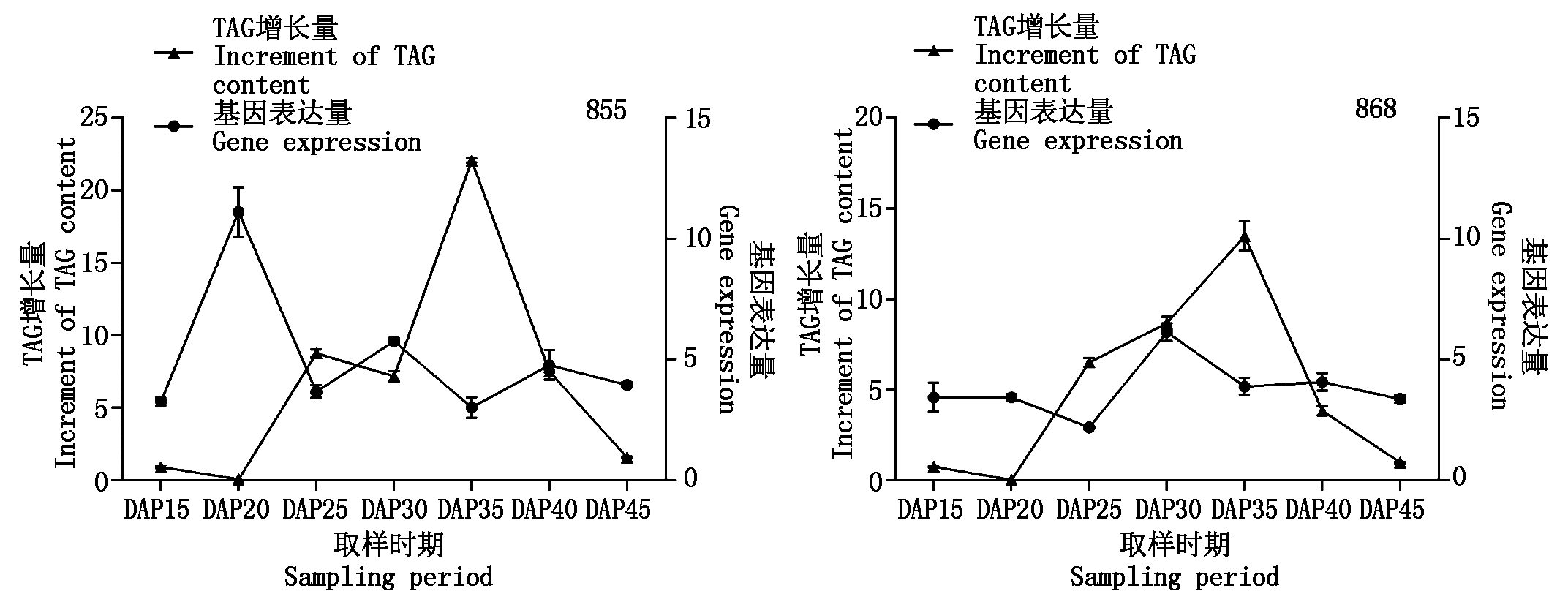
图7 不同时期油菜品系TAG增长量和BnaPDAT1表达量
Fig.7 TAG increment and BnaPDAT1 expression in rape varieties at different times
授粉后 20~25 d BnaPDAT1基因表达值出现峰值,但是TAG含量变化最大的时间是授粉后 30~35 d,主要是种子体积在开花后 25~30 d 基本定型,干物质积累速度 35 d 达最高值[20],前期TAG合成绝对值增大快但体积增大也很快,且不完全用于存储性油脂积累,所以TAG比例变化不大。另外,BnaPDAT1基因表达值是其催化能力的代表,而TAG含量是一个逐步累积的相对值,在前期一定积累的基础上,后期增长速度必然减缓。
另外,对苗期、开花后0~25 d,0~45 d以及全生育期2个品系PDAT1表达量之和进行统计,发现高油品系 855极显著高于低含油品系868(表3)。
表3 不同含油量品系BnaPDAT1表达量分析
Tab.3 Analysis of expression level of BnaPDAT1 in different oil content lines

品系Strain苗期Seedling stage授粉后0~25 dDAP 0-25 d授粉后0~45 dDAP 0-45 d所有时期All periods8558.858 6Ef18.024 9Dd35.523 2Bb47.557 9Aa8681.206 9Fg11.750 2Ee26.323 5Cc31.671 2BCbc855/8687.341.531.351.50
3 结论与讨论
本研究结果显示,BnaPDAT1在叶、花和种子中均有表达,与在花生[21]、油茶[22]、紫苏[23]中研究结果一致。甘蓝型油菜在授粉后 20~30 d油脂合成转化效率明显提高,且种子发育后期BnaPDAT1保持较高表达水平。BnaPDAT1基因表达和种子TAG含量相关性分析显示,二者之间没有明显的相关性,由于PDAT1蛋白仅具备酰基转移蛋白功能,与在花生[21]、油茶[22]中研究结果相似。这表明影响TAG含量的并非单一由TAG组装效率决定,而是由光合底物合成与TAG组装能力共同决定。TAG组装过程中至少还存在1条以上有别于PDAT途径的酰基转移方式将脂肪酸链转移至甘油骨架上。
在DGAT1基因突变体中,PDAT1 途径所产生的 TAG 含量是野生型种子的 70%;拟南芥PDAT1和DGAT1双突变体中种子含油量下降 70%~80%,胚发育不正常。Fan 等[4]过表达了 AtPDAT(At5g13640),拟南芥 7 周大的莲座叶TAG含量比野生型提高了28 倍;而Mhaske 等[3]获得的 pdat 突变体种子TAG 含量及脂肪酸组分与野生型无明显差异;Ståhl等[24]过表达了AtPDAT1,17 d苗龄的拟南芥幼苗中脂肪酸和总脂的含量也与野生型无明显差异。说明PDAT 是拟南芥TAG合成关键基因,但是与DGAT具有功能重叠,2个基因具有动态调节特性。
笔者从甘蓝型油菜中克隆的BnaPDAT1基因能恢复缺陷型酵母H1246的油脂合成能力,3个拷贝均能够明显提高拟南芥突变体pdat1 TAG含量,证实该基因编码蛋白具有PDAT1 酶活性,但是在甘蓝型油菜中3个拷贝表达特性有差异,且不同拷贝表达量在不同含油量材料中同一时期和不同时期均与含油量没有表现出相关性,同样体现出总体调控的特点。另外,从基因表达到酶活力产生作用有一个过程,受到很多因素的影响,而且在自然条件下,每一个取样时期天气状况也不一样,与DGAT基因也有相互竞争[25]。
通过分析还发现,BnaA02.PDAT1、BnaA10.PDAT1、BnaC09.PDAT1、BnaPDAT1基因在高含油量品系 855 授粉后 20 d表达量均极显著高于低含油品系868,BnaA02.PDAT1、BnaC09.PDAT1、BnaPDAT1基因在高含油量品系 855 叶中表达量均极显著高于低含油品系868,是否可以将这一指标作为选择高含油量油菜品种的特征性指标,以及其临界点有待进一步验证。
本研究选择 2 个含油量具有显著差异的甘蓝型油菜双低品系855和868对BnaPDAT1基因表达特性及与种子中油脂积累的相关性开展研究,取得了一些初步结果。此结果对油菜高含油量育种具有一定的指导意义。
[1] Zhang M, Fan J, Taylor D C, Ohlrogge J. DGAT1 and PDAT1 acyltransferases have overlapping functions in Arabidopsis triacylglycerol biosynthesis and are essential for normal pollen and seed development[J].Plant Cell, 2009, 21(12): 3885-3901. doi:10.1105/tpc.109.071795.
[2] Stahl U, Carlsson A S, Lenman M, Dahlqvist A, Huang B,Banas W,Banas A,Stymne S. Cloning and functional characterization of a Phospholipid: Diacylglycerol acyltransferase from Arabidopsis[J]. Plant Physiology, 2004, 135(3): 1324-1335. doi:10.1104/pp.104.044354.
[3] Mhaske M, Beljilali K, Ohlrogge J, Pollard M. Isolation and characterization of an Arabidopsis thaliana knockout line for phospholipid:diacylglycerol transacylase gene (At5g-13640)[J]. Plant Physiol Biochem,2005,43:413-417.
[4] Fan J, Yan C, Roston R, Shanklin J, Xu C. Arabidopsis lipins, PDAT1 acyltransferase, and SDP1 triacylglycerol lipase synergistically direct fatty acids toward β-oxidation, thereby maintaining membrane lipid homeostasis[J].Plant Cell, 2014, 26(10): 4119-4134. doi:10.1105/tpc.114.130377.
[5] Froissard M, D′andréa S, Boulard C, Chardot T.Heterologous expression of AtClo1,a plant oil body protein,induces lipid accumulation in yeast[J]. FEMS Yeast Research, 2009, 9(3): 428-438.
[6] Fan J L, Yan C S, Zhang X E, Xu C. Dual role for phospholipid: diacylglycerol acyltransferase: enhancing fatty acid synthesis and diverting fatty acids from membrane lipids to triacylglycerol in arabidopsis leaves[J]. Plant Cell, 2013, 25(9): 3506-3518. doi:10.1105/tpc.113.117358.
[7] Pan X, Siloto R M, Wickramarathna A D, Mietkiewska E, Weselake R J. Identification of a pair of phospholipid:diacylglycerol acyltransferases from developing flax (Linum usitatissimum L.) seed catalyzing the selective production of trilinolenin[J]. The Journal of Biological Chemistry, 2013, 288(33): 24173-24188. doi:10.1074/jbc.M113.475699.
[8] Kim H U, Lee K R, Go Y S, Jung J H, Suh M C, Kim J B. Endoplasmic reticulum-located PDAT1-2 from castor bean enhances hydroxy fatty acid accumulation in transgenic plants[J]. Plant & Cell Physiology, 2011, 52(6): 983-993. doi:10.1093/pcp/pcr051.
[9] Li R, Yu K, Hatanaka T, Hildebrand D F. Vemonia DGATs increase accumulation of epoxy fatty acids in oil[J]. Plant Biotechnology Journal, 2010, 8(2): 184-195.
[10] Xu Y, Caldo K M P, Pal-Nath D, Ozga J, Lemieux M J, Weselake R J, Chen G. Properties and Biotechnological Applications of Acyl-CoA. Diacylglycerol acyltransferase and phospholipid:diacylglycerol acyltransferase from terrestrial plants and microalgae[J]. Lipids, 2018, 53(7): 663-688.
[11] Yuan L, Mao X, Zhao K, Ji X, Ji C, Xue J, Li R. Characterisation of phospholipid: diacylglycerol acyltransferases (PDATs) from Camelina sativa and their roles in stress responses[J]. Biology Open, 2017, 6(7): 1024-1034. doi:10.1242/bio.026534.
[12] Guan R, Li X, Hofvander P, Zhou X R, Wang D, Stymne S, Zhu L H. RNAi targeting putative genes in phosphatidylcholine turnover results in significant change in fatty acid composition in Crambe abyssinica seed oil[J]. Lipids, 2015, 50(4): 407-416.
[13] Banas'W, Sanchez Garcia A, Banas'A, Banas'A, Stymne S. Activities of acyl-CoA:diacylglycerol acyltransferase (DGAT) and phospholipid:diacylglycerol acyltransferase (PDAT) in microsomal preparations of developing sunflower and safflower seeds[J]. Planta, 2013, 237(6): 1627-1636. doi:10.1007/s00425-013-1870-8.
[14] Zhu Z, Yuan G, Fan X, Yang M, Yin Y, Liu J, Liu Y, Cao X, Tian J, Xue S. The synchronous TAG production with the growth by the expression of chloroplast Transit peptide-fused ScPDAT in Chlamydomonas reinhardtii[J]. Biotechnology for Biofuels, 2018, 11: 156. doi:10.1186/s13068-018-1160-6.
[15] 穆娇.白菜型油菜 PDAT1 基因的克隆与功能分析[D]. 杨凌:西北农林科技大学, 2015.
Mu J. Cloning and functional analysis of PDAT1 gene in Brassica napus L.[D]. Yang Ling: Northwest A&F University, 2015.
[16] 谭太龙, 冯韬, 罗海燕, 彭烨, 刘睿洋, 官春云. 甘蓝型油菜磷脂二酰甘油酰基转移酶(BnPDAT1)cDNA的克隆和功能鉴定[J]. 作物学报, 2016, 42(5): 658-666.
Tan T L, Feng T, Luo H Y, Peng Y, Liu R Y, Guan C Y. Cloning and characterization of phospholipids:diacylglycerol acyltransferase(BnPDAT1) cDNA from Brassica napus L.[J]. Acta Agronomica Sinica, 2016, 42(5): 658-666.
[17] 陈钧辉. 生物化学实验[M]. 北京: 科学出版社, 2003.
Chen J H. Biochemistry experiment[M]. Beijing: Science Press, 2003.
[18] Burja A M, Armenta R E, Radianingtyas H, Barrow C J. Evaluation of fatty acid extraction methods for Thraustochytrium sp. ONC-T18[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4795-4801. doi:10.1021/jf070412s.
[19] 姚金保, 许才康. 甘蓝型黄籽油菜种子发育过程中若干特性的研究[J]. 中国油料, 1995, 17(3): 4-6.
Yao J B, Xu C K. Studies on some characteristics of seed development of Brassica napus L.[J]. Chinese Oilseeds, 1995, 17(3): 4-6.
[20] Del age G, Combet C, Blanchet C, Geourjon C. ANTHEPROT: an integrated protein sequence analysis software with client/server capabilities[J]. Computers in Biology and Medicine, 2001, 31(4): 259-267.
[21] 徐赫, 潘丽娟, 陈娜, 陈明娜, 王冕, 王通, 禹山林, 梁成伟, 迟晓元. 磷脂二酰甘油酰基转移酶(PDAT)基因的克隆与表达分析[J]. 花生学报,2018,47(4): 33-40.
Xu H, Pan L J, Chen N, Chen M N, Wang M, Wang T, Yu S L, Liang C W, Chi X Y. Cloning and expression analysis of two phospholipid: diacylglycerol acyltransferase genes in Peanut[J]. Journal of Peanut Science, 2018,47(4): 33-40.
[22] 赵广, 宋志波, 刘美兰, 龙洪旭, 李泽, 张琳. 油茶CoPDAT基因的克隆与表达分析[J]. 植物生理学报, 2017, 53 (9): 1619-1628.doi: CNKI:SUN:ZWSL.0.2017-09-006.
Zhao G, Song Z B, Liu M L, Long H X, Li Z, Zhang L. Cloning and expression analysis of a phospholipid:diacylglycerol acyltransferase (PDAT) gene in Camellia oleifera[J]. Plant Physiology Journal 2017, 53 (9): 1619-1628. doi: CNKI:SUN:ZWSL.0.2017-09-006.
[23] 周雅莉, 安茜, 任文燕, 李璐, 赵静, 王计平. 紫苏PfPDAT1基因序列及表达特性分析[J]. 山西 农业大学学报(自然科学版), 2018,38(12):44-49.
Zhou Y L, An X, Ren W Y, Li L, Zhao J, Wang J P. Analysis of PfPDAT1 gene sequence and expression characteristics in Perilla frutescens[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2018,38(12):44-49.
[24] Ståhl U, Carlsson A S, Lenman M, Dahlqvist A, Huang B, Banas W, Banas A, Stymne S. Cloning and functional characterization of a phospholipid:diacylglycerol acyltransferase from Arabidopsis[J]. Plant Physiol, 2004,135(3): 1324-1335.
[25] 虢慧, 贺慧, 吴宁柔, 官梅. 不同关键酶基因在油菜种子发育进程中的表达[J]. 分子植物育种, 2017, 15(8): 3030-3035.
Guo H, He H, Wu N R, Guan M. Expression of different key enzyme gene during seeds development in rapeseed (Brassica napus L.)[J]. Molecular Plant Breeding, 2017, 15(8): 3030-3035.