温度是影响作物生长发育及产量品质的主要因素之一。据报道,21世纪全球平均地表气温将比20世纪升高1.4~5.8 ℃。近年来我国短期异常高温频发[1]。玉米在抽雄吐丝期对温度尤为敏感[2],玉米授粉的适宜日平均温度为25~28 ℃。黄淮海平原是我国夏玉米核心产区,其年高温期(7月下旬-8月上旬)恰逢黄淮海平原夏玉米抽雄散粉及吐丝受精期。花粒期高温胁迫降低玉米花粉活力、影响花丝生长[3]、阻碍授粉受精过程、影响籽粒库容的形成,从而导致籽粒败育率增加[4],造成有效籽粒减少及籽粒容重降低[5],最终对该地区夏玉米产量及品质造成严重损失。花粒期高温胁迫对不同基因型玉米危害程度不同[5]。因此,很有必要深入开展玉米花粒期高温胁迫对不同基因型玉米分子机理影响的研究,从而挖掘玉米耐高温胁迫的关键基因及其代谢途径,为利用生物技术手段提高玉米耐高温胁迫提供理论依据。
国内外学者多从产量指标及生理生化特征对玉米花粒期高温胁迫开展研究。赵龙飞等[6]研究发现,花粒期高温胁迫导致玉米花粉败育及雌雄间隔期延长,穗粒数及行粒数减少,穗粗变小,穗长变短,秃尖增加,最终造成产量减少。花粒期高温胁迫降低了玉米花粉活力、叶绿素含量、叶片光合速率[7]、叶片气孔导度、丙二醛(MAD)含量、籽粒ATPase活性以及根系活力[8],提高超氧化物歧化酶(SOD)[9]、过氧化物酶(POD)、过氧化氢酶(CAT)3种氧化物酶的活性以及叶片细胞间CO2浓度[10-11]。品质方面,花粒期高温胁迫增加玉米籽粒粗蛋白、粗脂肪和赖氨酸含量[12]。花粒期高温胁迫降低了玉米腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)和可溶性淀粉合成酶(SSS)活性[13],从而降低了籽粒内淀粉含量[14]。
目前玉米增温处理多在人工气候室或大田模拟条件下进行,研究结果不尽一致。灌浆期白天温度超过35 ℃后玉米单位面积产量平均减产42%。日平均温度在10~25 ℃,玉米灌浆速率随着温度的升高而升高;25~35 ℃玉米灌浆速率开始降低,温度每升高1 ℃,籽粒产量降低3%~4%。玉米灌浆速率在40~45 ℃时显著降低。李德等[15]根据决定热害程度大小的极端最高气温、日最高气温≥35 ℃的天数、日最高气温≥35 ℃的积害量、高温期间平均最小相对湿度4个花粒期高温致灾因子构建了玉米高温热害综合气候指数。综合气候指数与高温热害减产率呈显著正相关,比仅将日平均气温≥30 ℃或日最高气温≥35℃持续3 d及以上作为评估和预警作物高温热害指标更加准确。花粒期高温胁迫对不同基因型玉米影响不同,高温胁迫下耐热基因型玉米浚单20比热敏感基因型玉米驻玉309可以保持更强的根系活力、光合作用能力及更高的抗氧化酶、ATP酶活性。于康珂等[16]对耐热基因型玉米郑单958和热敏感基因型玉米先玉335花期模拟大田条件增温4.03 ℃后发现雌雄穗中抗氧化酶活性(SOD、POD、CAT)、MAD、可溶性糖、脯氨酸、可溶解性蛋白均有较大的差异。于康珂等[17]通过16个相关性状指标综合评价了黄淮海地区主栽的30个玉米品种的花粒期耐热性。自交系所属类群与耐高温性相关,黄改系及农家品种耐高温性较强,旅大红骨系统的耐高温性较差。花粒期高温胁迫对不同基因型玉米生理生化影响都有所不同,但是对花粒期耐热性较强的郑单958的母本郑58及父本昌7-2耐热性分子机理的研究尚未明确。鉴于此,对我国玉米骨干自交系昌7-2、郑58花粒期高温胁迫后收集花粉进行高通量转录组测序,对差异表达基因进行分析注释,找到响应高温胁迫的重要基因及其调控途径,为用分子生物学技术手段提高玉米抗热性奠定基础。
1 材料和方法
1.1 供试材料
试验选用国内玉米骨干自交系郑58、昌7-2作为供试材料,于2017年6月10日播种于河南省农业科学院原阳县现代农业科技示范基地,标准化大田管理。试验田前茬作物为冬小麦,土壤为潮土,地势平坦,排灌方便,地力均匀一致。
1.2 试验设计
主要试验因素为温度,高温处理用长×宽×高为20 m×15 m×4 m的自制生长箱框架固定于田间,周围用透光率为95%的树脂薄膜覆盖,顶部密封80%,均匀留出20%的空隙便于气体交换。从第9片叶片展开时进行增温处理,直至抽雄吐丝期结束。期间每天的8:30-17:30通过覆盖薄膜进行增温,用温湿计记录群体穗位处气温及相对湿度。以棚外自然条件下生长的玉米植株作为对照。高温处理结束后拆除生长箱,使玉米植株在自然条件下生长,试验重复3次。高温处理期间生长箱内气温平均高于外界田间4.5 ℃,光照强度、相对湿度等生长条件与生长箱外基本一致。
1.3 测定项目与方法
1.3.1 花粉活性检测 玉米植株抽雄开始散粉后分别收集3株玉米的花粉,立即用于花粉活性鉴定。将昌7-2、郑58的高温处理材料及其对照样本分别命名为: HT昌7-2、CK昌7-2、HT郑58、CK郑58。玉米花粉活性采用AmphaTM Z30花粉活性分析仪(Amphays,瑞士)进行测定。AmphaTM Z30花粉活性分析仪是基于阻抗分析的流式细胞仪,无需染色,实时不间断检测单个细胞在电场中的阻抗,操作简便,以点图形显示花粉活性的百分比率。
1.3.2 花药转录组测序 玉米植株散粉后开始收集花粉样本,每个样本由5株玉米花粉混合组成,不同处理基因型材料重复取花粉3次,立即置于液氮中,然后于-80 ℃超低温冰箱保存,用于提取花粉RNA进行全转录组测序分析。全转录测序由上海美吉生物公司完成。将昌7-2、郑58的高温处理材料及其对照样本分别命名为:HT郑58-1、HT郑58-2、HT郑58-3;CK郑58-1、CK郑58-2、CK郑58-3;HT昌7-2-1、HT昌7-2-2、HT昌7-2-3;CK昌7-2-1、CK昌7-2-2、CK昌7-2-3。
2 结果与分析
2.1 玉米自交系花粒期高温胁迫后花粉活性分析
AmphaTM Z30花粉活性分析仪检测结果显示,正常生长条件下CK昌7-2、CK郑58的花粉活性分别为42.89%,64.83%。高温胁迫后HT昌7-2、HT郑58的花粉活性分别为24.37%,35.57%。由此可见,高温胁迫处理大大降低了玉米骨干自交系昌7-2和郑58的花粉活力。
2.2 玉米自交系花粒期高温胁迫后测序产量统计及基因组比对
HT昌7-2-1转录组经过上机测序后获得了64 923 124条初始化序列,经过质量剪切统计共获得63 117 492条清除序列(表1)。利用Hisat2序列比对软件,参照B73基因组分析后有89.60%的mapping序列,得到56 554 484条序列;CK昌7-2-1获得了65 163 254条初始化序列,经过质量剪切统计共获得63 190 882条清除序列。利用Hisat2序列比对软件,参照B73基因组分析后有91.83%的mapping序列,得到58 029 234条序列;HT郑58-1获得了58 732 018条初始化序列,经过质量剪切统计共获得56 993 330条清除序列。利用Hisat2序列比对软件,参照b73基因组分析后有91.71%的mapping序列,得到52 267 437条序列;CK郑58-1获得了65 897 202条初始化序列,经过质量剪切统计共获得64 019 786条清除序列利用Hisat2序列比对软件,参照玉米自交系B73基因组分析后有91.88%的mapping序列,得到58 823 393条序列。
2.3 玉米自交系花粒期高温胁迫造成的转录组差异
为了探索花粒高温胁迫对基因表达的影响,分别用昌7-2、郑58高温胁迫和正常生长条件下的花粉进行全转录组测序,经过序列饱和度、覆盖度和冗余度等分析后,与公布的参照基因组比对后共得到47 560个基因,上调表达基因多于下调表达基因,见图1。尤其是自交系郑58转录组中下调基因远远少于上调基因。用fpkm(每1 000 000条序列中每个基因以1 000个碱基为单位)比对上的reads个数来衡量比对基因的表达水平。以P<0.05,|log2FC|≥为筛选标准,在CK昌7-2和HT昌7-2的花粉转录组中共检测到3 386个特异的差异显著表达基因。在CK郑58和HT郑58的花粉转录组中共检测到4 697个特异的差异显著表达基因。其中790个差异显著表达基因均在昌7-2和郑58不同玉米自交系花粉转录组中表达。即高温胁迫后在昌7-2花粉转录组中共检测到4 176个显著差异表达基因,郑58花粉转录组中共检测到5 487个显著差异表达基因。
表1 玉米自交系12个花药样本转录组测序数据评估统计
Tab.1 The statistical sequencing results of the 12 maize anther samples
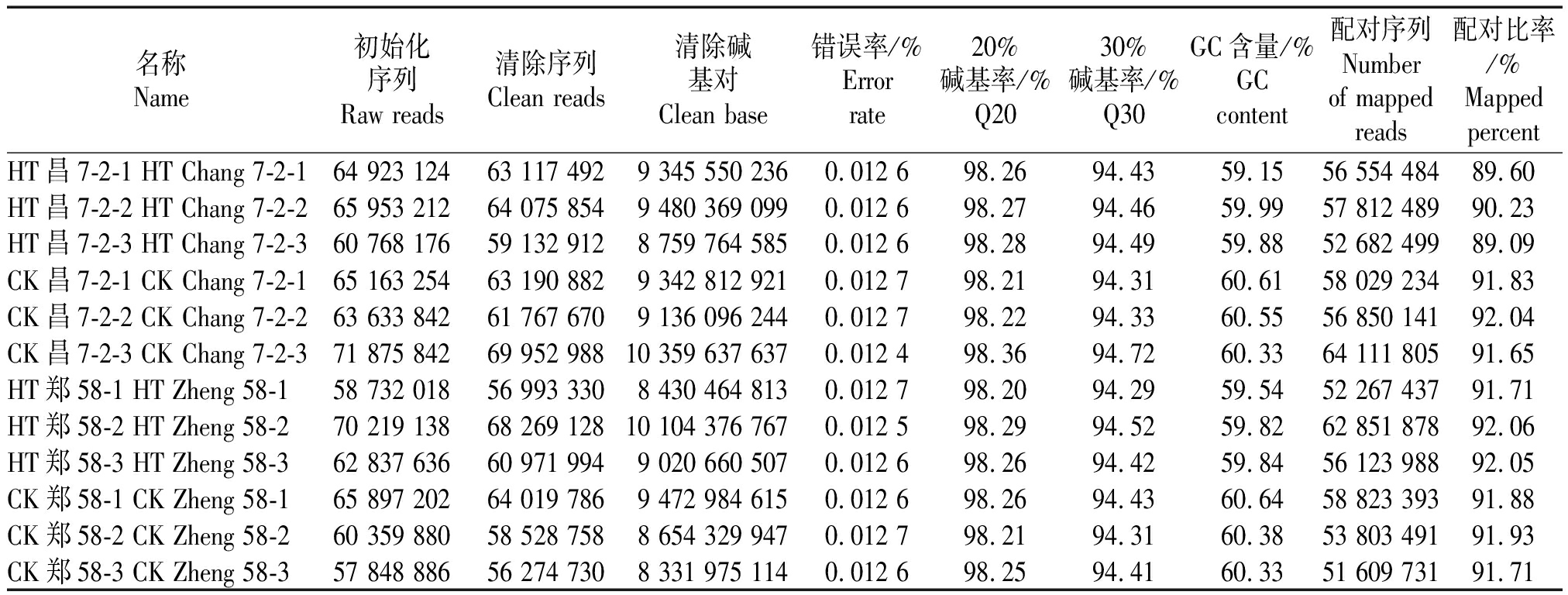
名称Name初始化序列Raw reads清除序列Clean reads清除碱基对Clean base错误率/%Error rate20%碱基率/%Q2030%碱基率/%Q30GC含量/%GC content配对序列Number of mapped reads配对比率/%Mapped percentHT昌7-2-1 HT Chang 7-2-164 923 12463 117 4929 345 550 2360.012 698.2694.4359.1556 554 48489.60HT昌7-2-2 HT Chang 7-2-265 953 21264 075 8549 480 369 0990.012 698.2794.4659.9957 812 48990.23HT昌7-2-3 HT Chang 7-2-360 768 17659 132 9128 759 764 5850.012 698.2894.4959.8852 682 49989.09CK昌7-2-1 CK Chang 7-2-165 163 25463 190 8829 342 812 9210.012 798.2194.3160.6158 029 23491.83CK昌7-2-2 CK Chang 7-2-263 633 84261 767 6709 136 096 2440.012 798.2294.3360.5556 850 14192.04CK昌7-2-3 CK Chang 7-2-371 875 84269 952 98810 359 637 6370.012 498.3694.7260.3364 111 80591.65HT郑58-1 HT Zheng 58-158 732 01856 993 3308 430 464 8130.012 798.2094.2959.5452 267 43791.71HT郑58-2 HT Zheng 58-270 219 13868 269 12810 104 376 7670.012 598.2994.5259.8262 851 87892.06HT郑58-3 HT Zheng 58-362 837 63660 971 9949 020 660 5070.012 698.2694.4259.8456 123 98892.05CK郑58-1 CK Zheng 58-165 897 20264 019 7869 472 984 6150.012 698.2694.4360.6458 823 39391.88CK郑58-2 CK Zheng 58-260 359 88058 528 7588 654 329 9470.012 798.2194.3160.3853 803 49191.93CK郑58-3 CK Zheng 58-357 848 88656 274 7308 331 975 1140.012 698.2594.4160.3351 609 73191.71
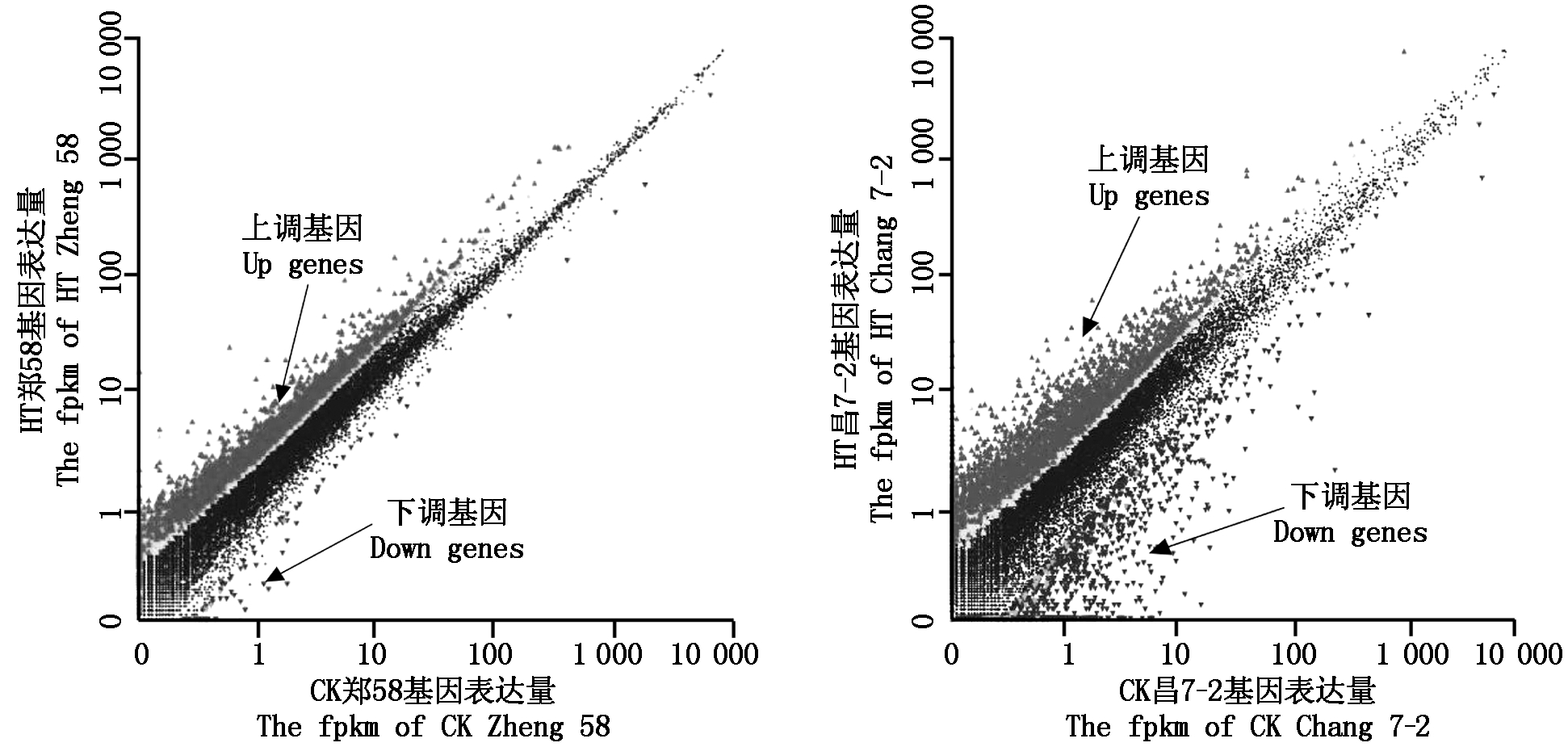
图1 正常生长条件及高温胁迫下昌7-2、郑58花粉转录组中差异表达基因热点
Fig.1 The scatter-plot of different expression genes regulated by heat stress in Chang 7-2 and Zheng 58
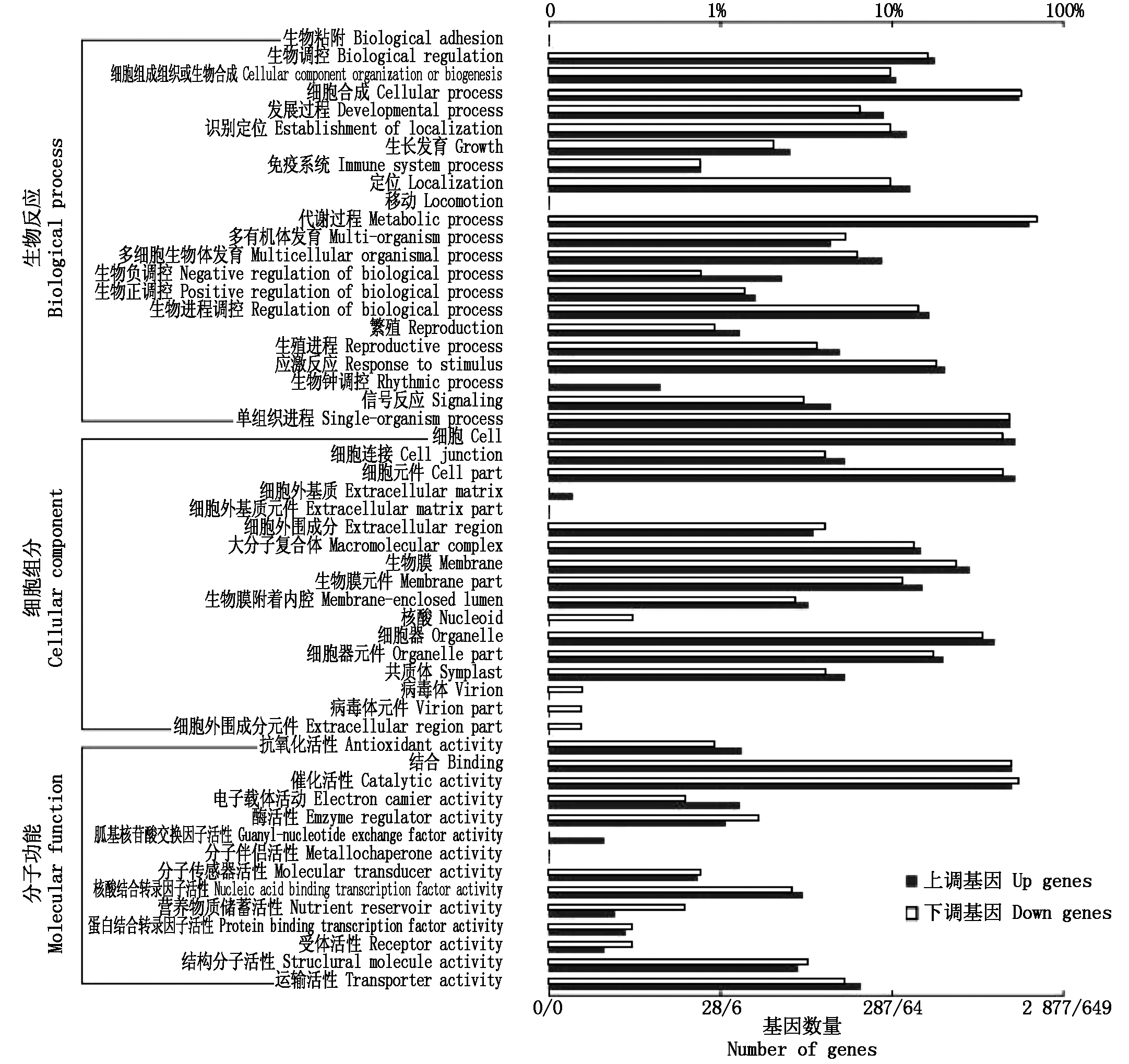
图2 玉米自交系昌7-2花粒期高温胁迫差异表达基因聚类
Fig.2 The gene Ontology of different expression genes in Chang 7-2
2.4 花粒期高温胁迫相关差异表达基因的分类
按照基因所参与的生物反应、细胞组分、分子功能三大类具体功能将检测的表达差异基因进行分类,图2为昌7-2花粒期高温胁迫条件下差异表达基因聚类图。图3为郑58花粒期高温胁迫条件下差异表达基因聚类图。在所检测到的差异表达基因中上调表达基因的比下调表达的基因数目多,主要分布在细胞间相互作用、发育过程、新陈代谢过程、生物调控过程、应激反应、单一组织代谢、细胞组分、结合作用、催化作用等生命活动中。
在几千个差异表达基因中尤其值得注意的是在昌7-2转录组中监测到了256个相似的Hsps热激蛋白和Hsfs热激转录因子的表达量在高温胁迫处理前后发生了变化。在郑58转录组中监测到了75个相似的Hsps热激蛋白和Hsfs热激转录因子的表达量在高温胁迫处理前后发生了变化。其中包括Hsp41、Hsp20、HspA5、Hsp90B、Hsp16、Hsp22、Hsp70、Hsp72、Hsp23、HspA5、HspD、HspA02、Hsp7R、Hsp7C、HspE1、HspR2等热激蛋白。基因启动子序列分析中也发现有26个热激蛋白基因以及Hsps启动子序列。热激蛋白在玉米花粒期响应高温胁迫中起着重要作用。在郑58、昌7-2自交系中发现了32个表达生长素IAA相似基因表达量发生显著变化。而且在郑58、昌7-2自交系材料中均发现12个相似的表达磷脂酰基醇-4,5-二磷酸(PIP2)的基因表达量发生了显著性变化。
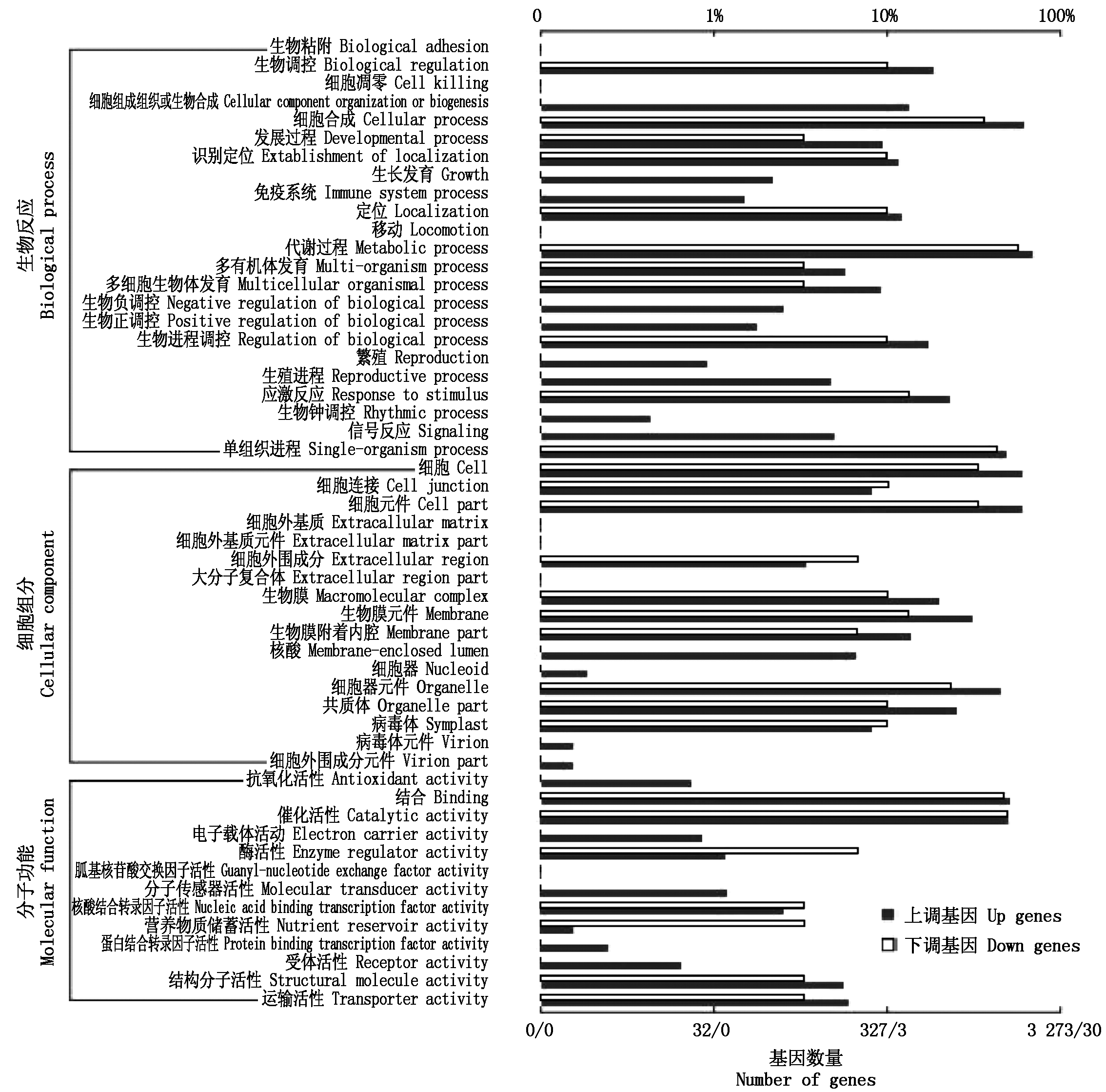
图3 玉米自交系郑58花粒期高温胁迫差异表达基因聚类
Fig.3 The gene Ontology of different expression genes in Zheng 58
昌7-2和郑58在花粒期高温胁迫条件下差异表达基因GO富集柱状图更加详细地展示了差异表达基因在不同代谢途经中的富集情况(图4-5)。昌7-2转录组中测到了11个显著富集代谢通路,郑58转录组中监测到了27个显著富集代谢通路。二者共有4个显著富集代谢通路,分别为芪类化合物、二芳基庚烷和姜醇生物合成;α-亚麻酸代谢;泛醌和其他萜类化合物醌类的生物合成;丙酸代谢途经。昌7-2特有的显著富集代谢通路:色氨酸代谢途经;黄酮类化合物生物合成;类苯基丙烷生物合成;丁酸甲酯代谢途径;氨基糖和核苷酸糖代谢途径;酮体物的合成和降解;硫胺素代谢途经。郑58特有的显著富集代谢通路:过氧化物酶体;核糖体;缬氨酸、亮氨酸和异亮氨酸生物合成;缬氨酸、亮氨酸和异亮氨酸降解;苯丙氨酸代谢;酪氨酸代谢;C5支链二元酸的代谢;丙酮酸代谢;芳香族化合物的降解;2-氧代羧酸代谢;脂肪酸降解;维生素A代谢;谷胱甘肽代谢;柠檬烯和蒎烯降解; 细胞色素P450对异种生物的代谢作用;细胞色素P450药物代谢;氯烷烃和氯烯烃降解;萘降解;氧化物酶体增殖物激活受体信号通路;甲状腺激素的合成;雌激素信号通路;抗原加工转运;NOD受体信号通路。
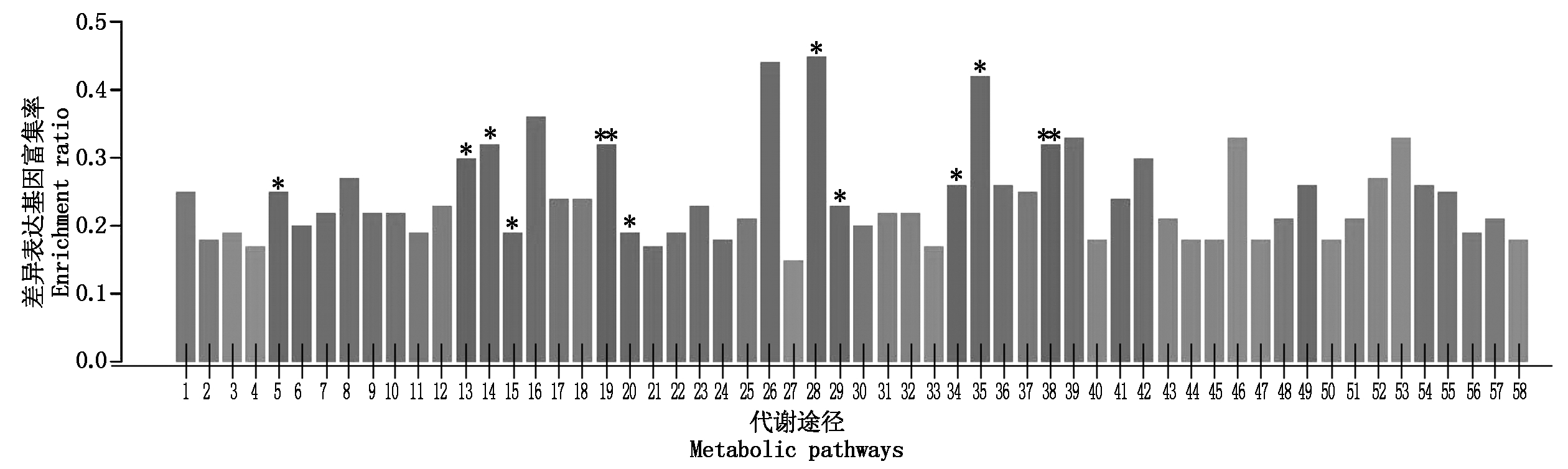
1.双组分元件系统;2.cAMP信号路径;3.VEGF信号路径;4.TGF-β信号路径;5.色氨酸代谢途经;6.甘氨酸、丝氨酸和苏氨酸代谢途经;7.缬氨酸、亮氨酸和异亮氨酸降解;8.缬氨酸、亮氨酸和异亮氨酸生物合成;9.苯基丙氨酸代谢途经;10.酪氨酸代谢途经;11.精氨酸和脯氨酸代谢途经;12.赖氨酸生物合成;13.黄酮类化合物生物合成;14.芪类化合物、二芳基庚烷和姜醇生物合成;15.类苯基丙烷生物合成;16.苯并恶嗪烷生物合成;17.异喹啉生物碱生物合成;18.胺菌素生物合成;19.丁酸甲酯代谢途径;20.氨基糖和核苷酸糖代谢途径;21.淀粉和蔗糖代谢途经;22.乙醛酸盐和二元羧酸盐代谢途经;23.氮代谢;24.氧化磷酸化;25.硫代谢;26.芳香化合物降解;27.氨基酸生物合成;28.酮体物的合成和降解;29.α-亚麻酸代谢途经;30.脂肪酸的降解;31.角质素、木质素和蜡质素的生物合成;32.亚麻酸代谢途经;33.甘油酯类代谢途经;34.泛醌和其他萜类化合物的生物合成;35.硫胺素代谢途经;36.泛酸酯类和CoA的生物合成;37.叶酸碳库;38.丙氨酸代谢途经;39.牛磺酸和亚牛磺酸代谢途经;40.氰基氨基酸代谢途经;41.类胡萝卜素生物合成;42.油菜素类固醇生物合成;43.双萜生物合成;44.类帖物质生物合成;45.药物代谢-细胞色素代谢P450;46.萘降解;47.轴突导向;48.平衡电感元件分泌;49.甲状腺素合成;50.植物生物钟;51.加压素借导的水分重吸收;52.醛甾酮借导的钠元素重吸收;53.近端小管重碳酸盐再利用;54.胞间DNA识别路径;55.小体激活反应;56.长期增强作用;57.氨基丁酸突触;58.谷氨酸突触。*.P<0.05,**.P<0.01,***.P<0.001;图5同。
1.Tow-component system; 2.cAMP signaling pathway; 3.VEGF signaling pathway; 4.TGF-beta signaling pathway; 5.Trytophan metabolism; 6.Glycine, serine and threonine metabolism; 7.Valine, leucine and isoleucine degradation; 8.Valine, leucine and isoleucine biosynthesis; 9.Phenylalanine metabolism; 10.Tyrosine metabolism; 11.Arginine and proline metabolism; 12.Lysine biosynthesis; 13.Flavonoid biosynthesis; 14.Stilbenoid, diarylheptanoid and gingerol biosynthesis; 15.Phenylpropanoid biosynthesis; 16.Benzoxazinoid biosynthesis; 17.Isoquinoline alkaloid biosynthesis; 18.Monobactam biosybthesis; 19.Butanoate metabolism; 20.Amino sugar and nucleotide sugar metabolism; 21.Starch and sucrose metabolism; 22.Glyoxylate and dicarboxylate metabolism; 23.Nitrogen metabolism; 24.Oxidative phosphorylation; 25.Sulfur metabolism; 26.Degradation of aromatic compounds; 27.Biosynthesis of amino acids; 28.Synthesis and degradation of ketone bodies; 29.Alpla-linolenic acid metabolism; 30.Fatty acid degradation; 31.Cutin, suberine and wax biosynthesis; 32.Linoleic acid metabolism; 33.Glycerolipid metabolism; 34.Ubiquinone and other terpenoid-quinone biosynthesis; 35.Thiamine metabolism; 36.Pantothenate and CoA biosynthesis; 37.One carbon pool by folate; 38.Beta-alanine metabolism; 39.Taurine and hypotaurine metabolism; 40.Cyanoamino acid metabolism; 41.Carotenoid biosynthesis; 42.Brassinosteroid biosynthesis; 43.Diterpenoid biosynthesis; 44.Terpenoid backbone biosynthesis; 45.Drug metabolism-cytochrome P450; 46.Naphthalene degradation; 47.Axon guidance; 48.Bile secretion; 49.Thyroid hormone synthesis; 50.Circadian rhythm-plant; 51.Vasopressin-regulated water reabsorption; 52.Aldosterone-regulated sodium reabsorption; 53.Proximal tubule bicarbonate reclamation; 54.Cytosolic DAN-sensing pathway; 55.Platelet activation; 56.Long-term potentiation; 57.Gabaergic synapse; 58.Glutamatergic synapse.*.P<0.05, **.P<0.01, ***.P<0.001; The same as Fig.5.
图4 玉米自交系昌7-2花粒期高温胁迫下差异表达基因GO富集
Fig.4 The DEG enrichment/GO analysis in Chang 7-2 with and without high temperature treatment
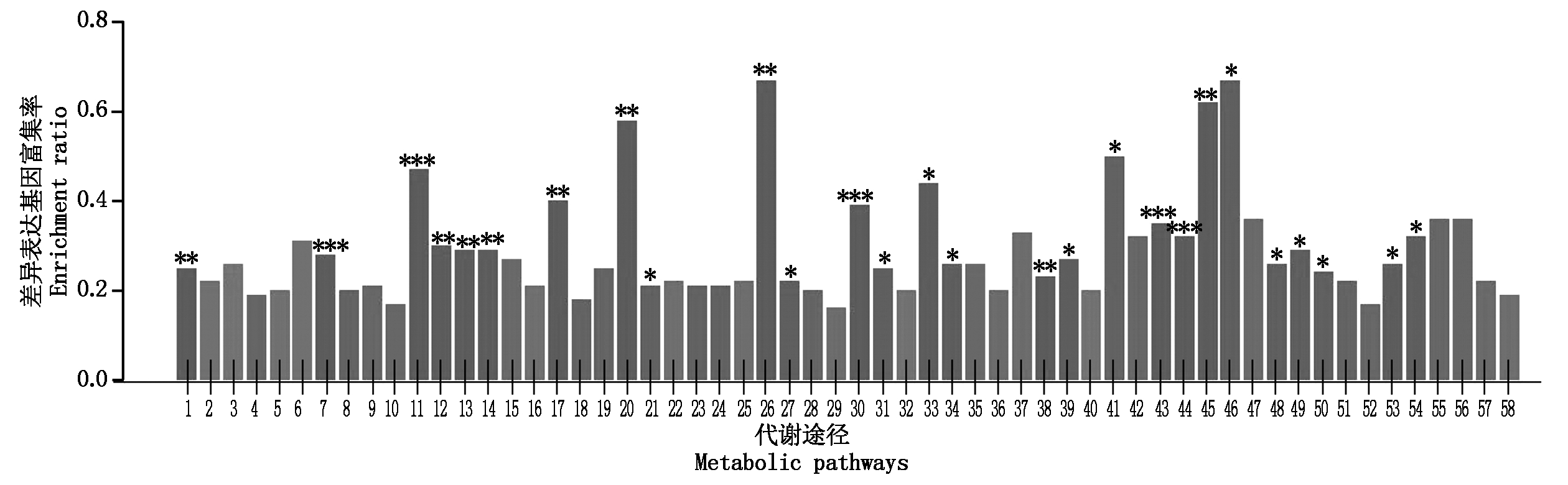
1.过氧化物酶体;2.ABC转运体;3.细菌分泌系统;4.PI3K-Akt信号通路;5.mTOR信号通路;6.MAPK信号通路;7.核糖体;8.真核生物核糖体合成;9.氨酰-tRNA合成;10.RNA转运;11.缬氨酸、亮氨酸和异亮氨酸生物合成;12.缬氨酸、亮氨酸和异亮氨酸降解;13.苯丙氨酸代谢;14.酪氨酸代谢;15.组氨酸代谢;16.色氨酸代谢;17.芪类、二乙烯类和姜辣素生物合成;18.类苯基丙烷生物合成;19.黄酮类生物合成;20.C5支链二元酸的代谢;21.丙酮酸代谢;22.丙酸代谢;23.光合作用;24.光合生物碳固定;25.原核生物碳固定途径;26.芳香族化合物的降解;27.2-氧代羧酸代谢;28.脂肪酸代谢;29.碳代谢;30.脂肪酸降解;31.亚麻酸代谢;32.不饱和脂肪酸的生物合成;33.维生素A代谢;34.泛素和其他萜类化合物醌类的生物合成;35.泛酸盐和CoA生物合成;36.卟啉和叶绿素代谢;37.维生素b1代谢;38.谷胱甘肽代谢;39.β-氨基丙酸代谢;40.酪蛋白氨基酸代谢;41.柠檬烯和蒎烯降解;42.单萜生物合成;43.细胞色素P450对异种生物的代谢作用;44.细胞色素P450药物代谢;45.氯烷烃和氯烯烃降解;46.萘降解;47.苯乙烯降解;48.PPAR信号通路;49.甲状腺激素的合成;50.雌激素信号通路;51.脂肪细胞因子信号通路;52.植物-病原相互作用;53.抗原加工转运;54.NOD样受体信号通路;55.类胆碱突触;56.羟色胺突触;57.谷氨酸突触;58.突触囊泡循环。
1.Peroxisome; 2.ABC transporters; 3.Bacterial secretion system; 4.PI3K-Akt signaling pathway; 5.mTOR signaling pathway; 6.MAPK signaling pathway; 7.Ribosome; 8.Ribosome biogenesis in eukaryotes; 9.Aminoacyl-tRNA biosynthesis; 10.RNA transport; 11.Valine, Leucine and isoleucine biosynthesis; 12.Valine, Leucine and isoleucine degradation; 13.Phenylalanine metabolism; 14.Tyrosine metabolism; 15.Histidine metabolism; 16.Tryptophan metabolism; 17.Stilbenoid, diarytheptanoid and gingerol biosynthesis; 18.Phenylpropanoid biosynthesis; 19.Flavonoid biosynthesis; 20.C5-Branched dibasic acid metabolism; 21.Pyruvate metabolism; 22.Propanoate metabolism; 23.Photosynthesis; 24.Carbon fixation in photosynthetic organisms; 25.Carbon fixation pathways in prokaryotes; 26.Degradation of aromatic compounds; 27.2-Oxocarboxylic acid metabolism; 28.Fatty acid metabolism; 29.Carbon metabolism; 30.Fatty acid degradation; 31.alpha-Linolenic acid metabolism; 32.Biosynthesis of unsaturated fatty acids; 33.Retionl metabolism; 34.Ubiquinone and other terpenoid-quinone biosynthesis; 35.Pantothenate and CoA biosynthesis; 36.Porphyrin and chlorophyll metabolism; 37.Thiamine metabolism; 38.Glutathione metabolism; 39.beta-Alanine metabolism; 40.Cyanoamino acid metabolism; 41.Limonene and pinene degradation; 42.Monoterpenoid biosynthesis; 43.Metabolism of xenobiotics by cytochrome P450; 44.Drug metabolism-cytochrome P450; 45.Chloroalkane and chloroalkene degradation; 46.Naphthalene degradation; 47.Styrene degradation; 48.PPAR signaling pathway; 49.Thyroid hormone synthesis; 50.Estrogen signaling pathway; 51.Adipocytokine signaling pathway; 52.Plant-pathogen interaction; 53.Antigen processing and presentation; 54.NOD-like receptor signaling pathway; 55.Cholinergic synapse; 56.Serotonergic synapse; 57.Glutamatergic synapse; 58.Synaptic vesicle cycle.
图5 玉米自交系郑58花粒期高温胁迫下差异表达基因GO富集
Fig.5 The DEG enrichment/GO analysis in Zheng 58 with and without high temperature treatment
2.5 与高温胁迫相关的代谢通路
KEGG是系统分析基因功能、联系基因组信息和功能信息的知识库。利用KEGG数据库将差异表达基因按照参与的pathway通路或功能进行分类,并以参照样本为对照绘制差异表达基因KEGG注释通路图。结果显示,在郑58正常生长条件下和高温处理胁迫下的花粉转录组中有2 062个差异表达基因富集到399个相关通路上。在昌7-2正常生长条件和高温处理条件下的花粉转录组中有1 943个差异表达基因富集到352个相关通路上。这些代谢通路参与玉米生长发育的多个生物代谢途径,其中包括果糖和甘露糖代谢途径(图6)以及光合代谢途径(图7)等玉米中重要生物代谢过程。
2.6 与高温胁迫相关的转录因子分析
通过花粉转录组测序后转录因子分析共获得55个转录因子家族,其中有45个转录因子都包含10个以上差异表达基因,如表2所示。其中26个基因都包含有热激蛋白Hsps表达基因,分别是:GRMZM2G010871_P03、GRMZM2G132971_P01、GRMZM2G164909_P01、AC216247.3_FGP001、GRMZM2G118485_P01、GRMZM2G165972_P02、GRMZM2G115456_P01、GRMZM2G098696_P01、GRMZM2G384339_P01、GRMZM2G105348_P01、GRMZM2G179802_P02、GRMZM2G059851_P01、AC206165.3_FGP007、GRMZM2G125969_P01、GRMZM2G139535_P01、AC205471.4_FGP003、GRMZM2G086880_P01、GRMZM2G118453_P01、GRMZM2G173090_P01、GRMZM2G118047_P01、GRMZM2G026742_P04、GRMZM2G301485_P01、GRMZM2G005815_P02、GRMZM2G089525_P01、GRMZM2G002131_P01、GRMZM2G088242_P01。推测这些基因在玉米自交系花粉高温逆境中起着重要作用。从表2可以看出,包含逆境相关转录因子的表达差异基因很多,例如有169个差异基因都包括了MRKY转录因子。MRKY转录因子主要参与植物特有的生理过程,包括抗逆和衰老。这些包含MRKY转录因子的基因可能在玉米花粉抗高温过程中扮演重要角色。
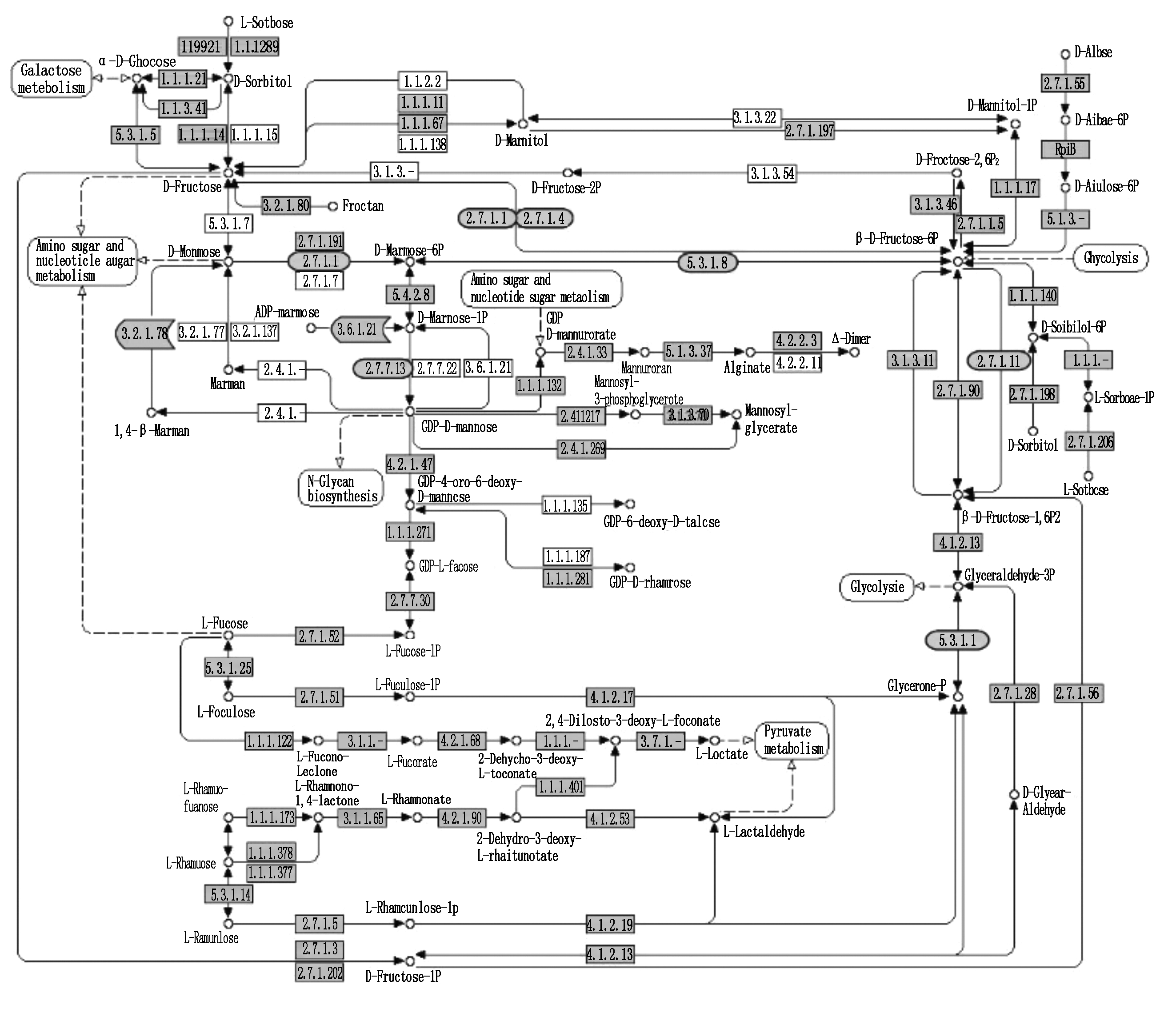
![]() . 不同光合代谢途经中上调表达的差异表达基因;
. 不同光合代谢途经中上调表达的差异表达基因;![]() . 下调表达的差异表达基因;
. 下调表达的差异表达基因;![]() . 表达水平差异不显著的基因;
. 表达水平差异不显著的基因;![]() . 不相关基因。
. 不相关基因。![]() . Up expressing DEGs;
. Up expressing DEGs; ![]() . Down expressing DEGs;
. Down expressing DEGs; ![]() . The expression is not significant;
. The expression is not significant; ![]() . Unrelated DGEs.
. Unrelated DGEs.
图6 果糖和甘露糖代谢途经中花粒期高温胁迫下差异表达基因的具体表达水平
Fig.6 The expression level of DEGs in fructose and mannose metabolism
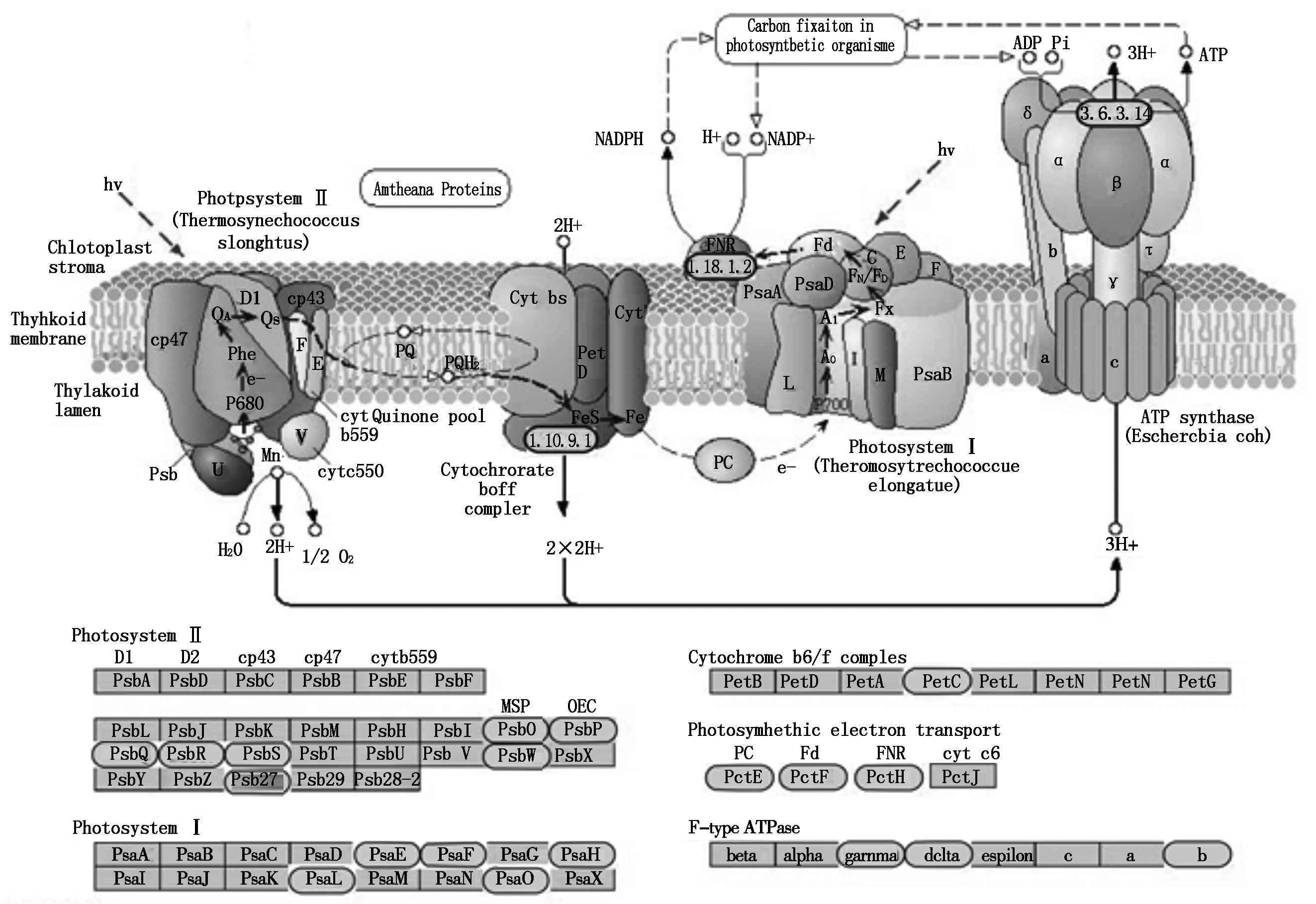
![]() .上调表达的差异表达基因;
.上调表达的差异表达基因;![]() . 下调表达的差异表达基因。
. 下调表达的差异表达基因。![]() . Up expressing DEGs;
. Up expressing DEGs; ![]() . Down expressing DEGs.
. Down expressing DEGs.
图7 光合代谢途径中花粒期高温胁迫下差异表达基因的具体表达水平
Fig.7 The expression level of DEGs in photosynthesis pathway
3 结论与讨论
花粒期高温影响花粉外壁加厚及细胞核的有丝分裂过程,从而抑制花粉发育, 不利于花粉的形成,阻碍开花授粉。本研究检测了郑58、昌7-2高温胁迫和正常生长条件下的花粉活性,结果显示,高温胁迫后的玉米花粉活性比对照花粉活性低,不同基因型材料降低程度不同。郑58高温胁迫前后花粉活性均高于昌7-2花粉活性。可见不同基因型玉米自交系对高温的响应不同,作为郑单958母本的郑58花粉活性受高温影响的程度比父本昌7-2的影响程度要高。文献报道了水稻花器官相关性状与高温胁迫相关基因[18],主要包括花药发育过程(Hd1、Ehd1、Hd3a、RFT1)[19]、花药开裂控制基因(AID1)[20]、光周期调节基因(SE5、MADbox家族、RCN1)等[21]。利用花粉转录组测序技术发现在昌7-2自交系中存在9类差异表达基因,高温胁迫下多数呈上调表达,表达蛋白有花粉阿拉伯半聚乳糖蛋白BAN102、玉米花粉蛋白C13、花粉蛋白SF3/SF21、玉米花粉激酶参与蛋白、花粉锚蛋白类蛋白、花粉过敏原ph1 p2/p11 蛋白。只有花粉多亮氨酸延伸蛋白呈下调表达。在郑58自交系中也发现了与昌7-2自交系中相同的表达差异基因,花粉锚蛋白类蛋白和玉米花粉激酶参与蛋白两类基因蛋白除外。推测这两类差异表达基因在昌7-2自交系响应花粒期高温胁迫时扮演着重要响应的高温胁迫的作用。
表2 玉米高温花粉转录组测序表达差异基因转录因子统计
Tab.2 The transcription factors of the different expression genes in Chang 7-2 and Zheng 58
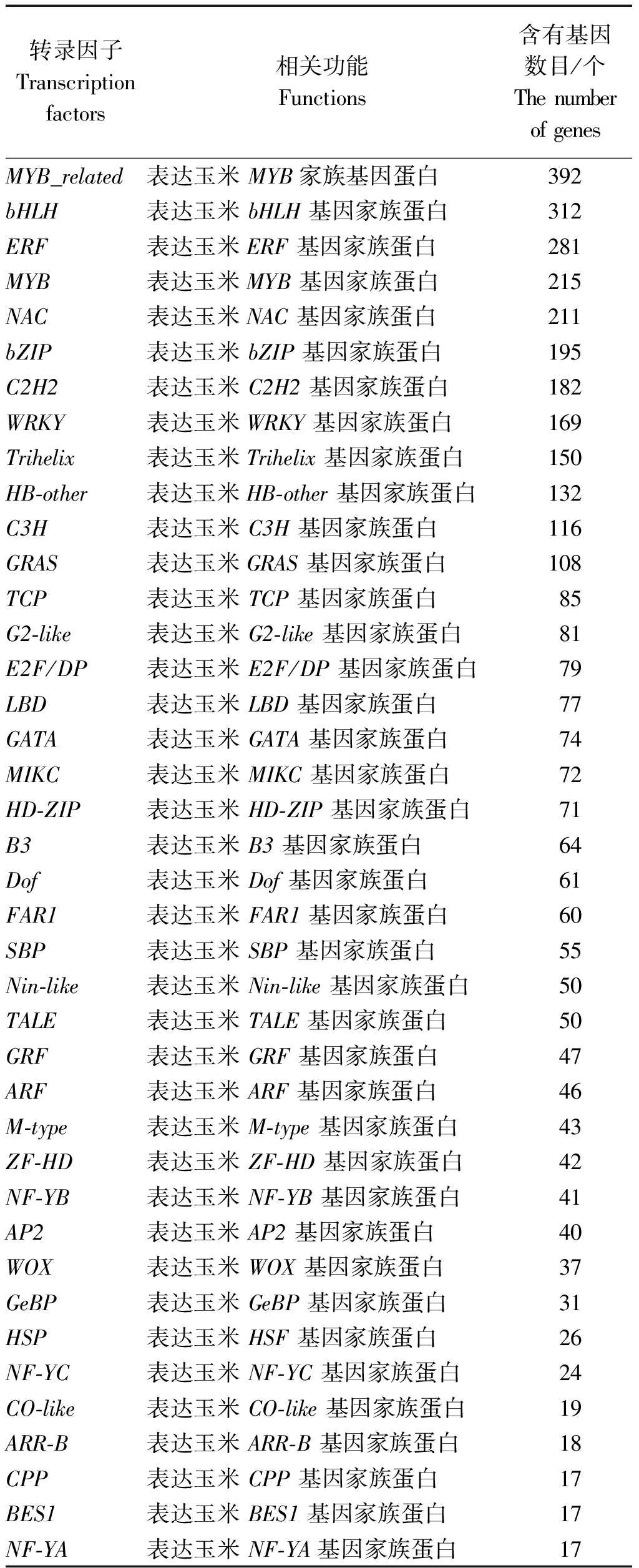
转录因子Transcription factors相关功能Functions含有基因数目/个The number of genesMYB_related 表达玉米 MYB家族基因蛋白392bHLH表达玉米 bHLH 基因家族蛋白312ERF表达玉米ERF 基因家族蛋白281MYB表达玉米MYB 基因家族蛋白215NAC表达玉米NAC 基因家族蛋白211bZIP表达玉米 bZIP 基因家族蛋白195C2H2表达玉米 C2H2 基因家族蛋白182WRKY表达玉米WRKY 基因家族蛋白169Trihelix表达玉米Trihelix 基因家族蛋白150HB-other表达玉米HB-other 基因家族蛋白132C3H表达玉米 C3H 基因家族蛋白116GRAS表达玉米GRAS 基因家族蛋白108TCP表达玉米 TCP 基因家族蛋白85G2-like表达玉米 G2-like 基因家族蛋白81E2F/DP表达玉米 E2F/DP 基因家族蛋白79LBD表达玉米 LBD 基因家族蛋白77GATA表达玉米 GATA 基因家族蛋白74MIKC表达玉米 MIKC 基因家族蛋白72HD-ZIP表达玉米 HD-ZIP 基因家族蛋白71B3表达玉米 B3 基因家族蛋白64Dof表达玉米 Dof 基因家族蛋白61FAR1表达玉米 FAR1 基因家族蛋白60SBP表达玉米 SBP 基因家族蛋白55Nin-like表达玉米 Nin-like 基因家族蛋白50TALE表达玉米 TALE 基因家族蛋白50GRF表达玉米 GRF 基因家族蛋白47ARF表达玉米 ARF 基因家族蛋白46M-type表达玉米 M-type 基因家族蛋白43ZF-HD表达玉米 ZF-HD 基因家族蛋白42NF-YB表达玉米 NF-YB 基因家族蛋白41AP2表达玉米 AP2 基因家族蛋白40WOX表达玉米 WOX 基因家族蛋白37GeBP表达玉米 GeBP 基因家族蛋白31HSP表达玉米 HSF 基因家族蛋白26NF-YC表达玉米 NF-YC 基因家族蛋白24CO-like表达玉米 CO-like 基因家族蛋白19ARR-B表达玉米 ARR-B 基因家族蛋白18CPP表达玉米 CPP 基因家族蛋白17BES1表达玉米 BES1 基因家族蛋白17NF-YA表达玉米 NF-YA基因家族蛋白 17
转录组测序结果表明,2个不同玉米基因型材料存在大量的表达差异基因,其中上调基因多于下调基因,这些上调基因和下调基因影响了玉米花粒期高温的抗逆性。经过表达差异基因重叠区域Venn图分析发现,昌7-2、郑58基因组中共有790个相同的差异显著表达基因。昌7-2中共检测到了5 487个表达差异显著基因。郑58中共检测到了4 176个表达差异显著基因。由此可见,自交系昌7-2中检测到的表达差异显著基因比自交系郑58中检测到的较多。归属于生物钟过程、细胞外基质、鸟苷酸交换活性等代谢途径中表达显著差异基因上调表达差异基因明显多于下调表达基因。而归属于核酸、病毒组分、细胞外组分等生命活动中的表达显著差异基因中下调表达差异基因明显多于上调表达基因,推测这些基因可能通过负调控作用增加玉米的抗高温性。郑58花粒期高温胁迫引起表达差异基因聚类GO图与昌7-2花粒期高温胁迫引起表达差异基因聚类GO图有着相似的趋势,但是上调表达差异基因数比昌7-2中多,尤其是在细胞成分组织或生物代谢、生长发育、免疫系统过程、生物过程正调控、生物过程负调控、生殖代谢、生物钟过程、信号传导、膜内腔、核酸、病毒组分、抗氧化活性、电子载体活性、分子转化活性、蛋白转录结合因子活性以及受体活性等生命活动中上调表达差异基因明显多于下调表达差异基因。从而推测这些基因在郑58、昌7-2不同基因型中表现的耐受高温胁迫差异中起着重要的作用。
响应植物高温胁迫网络主要包括热激蛋白和热激转录因子基因组成的植物高温胁迫响应调控网络、氧化胁迫调控网络、锌指蛋白转录因子抗逆响应网络、激素参与的高温胁迫应答、高温胁迫下的磷脂信号通路。热激蛋白(Hsps)参与植物生长发育过程,包括Hsp100、Hsp90、Hsp70、Hsp60、Hsp20、sHsp等家族成员。热激转录因子(Hsfs)在植物响应高温胁迫中起着重要作用。水稻中已经发现了19种热激转录因子,依据其蛋白结构可以分为A、B、C 3个家族。利用转录组测序技术发现昌7-2、郑58自交系中分别有256,75个相似Hsps热激蛋白和Hsfs热激转录因子表达发生变化,其中包括Hsp41、Hsp20、HspA5、Hsp90B、Hsp16、Hsp22、Hsp70、Hsp72、Hsp23、HspA5、HspD、HspA02、Hsp7R、Hsp7C、HspE1、HspR2等热激蛋白。在后续检测到的基因启动子序列分析中也发现有26个热激蛋白基因以及Hsps启动子序列。由此推测,热激蛋白在玉米花粒期高温胁迫中起着重要作用。
花药发育早期对高温胁迫最为敏感,此时IAA含量显著降低,最终导致玉米花粉不育[22]。在郑58、昌7-2自交系中发现了32个表达IAA相似基因表达发生显著变化。玉米代谢途径图中显示了不仅生长素代谢途径发生变化,细胞分裂素代谢途径、赤霉素代谢途径、水杨酸代谢途径、乙烯代谢途径、油菜素内酯代谢途径、茉莉酸代谢途径、脱落酸代谢途径中均发生变化。另一个重要的响应玉米花粒期高温胁迫是磷脂信号通路。当植物处于高温胁迫时脂膜往往发生重组现象,改变脂质信号,其中包括磷脂酰基醇-4,5-二磷酸(PIP2)和磷脂酸(PA)。在郑58、昌7-2自交系材料中均发现12个相似的表达PIP的基因表达水平发生了显著性变化。在后续研究中,可以通过miRNA载体敲除基因家族或者过表达载体转化,从而验证此类激素基因的具体功能。还可以通过分子育种转基因技术培育出较耐高温的玉米自交系,从而用于耐高温玉米新品种的应用。
[1] 张倩, 赵艳霞, 王春乙. 我国主要农业气象灾害指标研究进展[J]. 自然灾害学报, 2010, 19(6): 40-54. doi: 10.13577/j.jnd.2010.0606.
Zhang Q, Zhao Y X, Wang C Y. Advances in research on major agro-meteorological disaster index in China[J]. Journal of Natural Disasters, 2010,19(6):40-54. doi: 10.13577/j.jnd.2010.0606.
[2] 尹小刚, 王猛, 孔箐锌, 王占彪, 张海林, 褚庆全, 文新亚, 陈阜. 东北地区高温对玉米生产的影响及对策[J]. 应用生态学报, 2015, 26(1): 186-198. doi:10.13287/j.1001-9332.20141021.008.
Yin X G, Wang M, Kong Q X, Wang Z B, Zhang H L, Chu Q Q, Wen X Y, Chen F. Impacts of high temperature on maize production and adaptation measures in Northeast China[J]. Chinese Journal of Applied Ecology, 2015,26(1):186-198. doi:10.13287/j.1001-9332.20141021.008.
[3] 赵龙飞, 李潮海, 刘天学, 王秀萍, 僧珊珊, 潘旭. 玉米花期高温响应的基因型差异及其生理机制[J]. 作物学报, 2012, 38(5): 857-864. doi:10.3724/SP.J.1006.2012.00857.
Zhao L F, Li C H, Liu T X, Wang X P, Seng S S, Pan X. Genotypic responses and physiological mechanisms of maize to high temperature stress during flowering[J]. Acta Agronomica Sinica, 2012,38(5):857-864. doi:10.3724/SP.J.1006.2012.00857.
[4] 降志兵,陶洪斌,吴拓,王璞,宋庆芳.高温对玉米花粉活力的影响[J]. 中国农业大学学报, 2016, 21(3): 1007-4333. doi:11841/j.issn.1007-4333.2016.03.04.
Jiang Z B, Tao H B, Wu T, Wang P, Song Q F. Effects of high temperature on maize pollen viability[J]. Journal of China Agricultural University, 2016,21(3):1007-4333. doi:11841/j.issn.1007-4333.2016.03.04.
[5] 张吉旺, 董树亭, 王空军, 刘鹏, 胡昌浩. 大田增温对夏玉米光合特性的影响[J]. 应用生态学报, 2008, 19(1): 81-86. doi:10.13287/j.1001-9332.2008.0027.
Zhang J W, Dong S T, Wang K J, Liu P, Hu C H. Effects of increasing field temperature on photosynthetic characteristics of summer maize[J]. Chinese Journal of Applied Ecology, 2008,19(1):81-86. doi:10.13287/j.1001-9332.2008.0027.
[6] 赵龙飞, 李潮海, 刘天学, 王秀萍, 僧珊珊. 花期前后高温对不同基因型玉米光合特性及产量和品质的影响[J]. 中国农业科学, 2012, 45(23): 4947-4958. doi:10.3864/j.issn.0578-1752.2012.23.023.
Zhao L F, Li C H, Liu T X, Wang X P, Seng S S. Effect of high temperature during flowering on photosynthetic characteristics and grain yield and quality of different genotypes of maize (Zea Mays L.)[J]. Scientia Agricultura Sinica, 2012,45(23):4947-4958. doi:10.3864/j.issn.0578-1752.2012.23.023.
[7] Wang G P, Tian F X, Zhang M, Wang W. The over accumulation of glycinebetaine alleviated damages to PSⅡ of wheat flag leaves under drought and high temperature stress combination[J].Acta Physiologiae Plantarum,2014,36(10):2743-2753. doi:10.1007/s11738-014-1645-2.
[8] Guo M, Liu J H, Ma X, Luo D X, Gong Z H, Lu M H. The plant heat stress transcription factors (HSFs): structure, regulation, and function in response to abiotic stresses[J].Frontiers in Plant Science,2016,7(273):114.doi:10.3389/fpls.2016.00114.
[9] Gill S S, Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930. doi:10.1016/j.plaphy.2010.08.016.
[10] 胡秀丽, 李艳辉, 杨海荣, 刘全军, 李潮海. HSP70可提高干旱高温复合胁迫诱导的玉米叶片抗氧化防护能力[J]. 作物学报, 2010, 36(4): 636-644. doi: 10.3724/SP.J.1006.2010.00636.
Hu X L, Li Y H, Yang H R, Liu Q J, Li C H. Heat shock protein 70 may improve the ability of antioxidant defense induced by the combination of drought and heat in maize leaves[J]. Acta Agronomica Sinica, 2010,36(4):636-644. doi: 10.3724/SP.J.1006.2010.00636.
[11] Xu Z S, Li Z Y, Chen Y, Chen M, Li L C, Ma Y Z. Heat shock protein 90 in plants: molecular mechanisms and roles in stress responses[J].International Journal of Molecular Sciences,2012,13(12):15706-15723.doi:10.3390/ijms131215706.
[12] 赵丽晓, 雷鸣, 王璞, 陶洪斌. 花期高温对玉米子粒发育和产量的影响[J]. 作物杂志, 2014 (4): 6-9. doi:10.16035/j.issn.1001-7283.2014.04.003.
Zhao L X, Lei M, Wang P, Tao H B. Effects of high temperature stress during flowering on maize kernel development and grain yield[J]. Crops, 2014 (4):6-9. doi:10.16035/j.issn.1001-7283.2014.04.003.
[13] 张桂莲, 廖斌, 武小金, 肖应辉, 肖浪涛, 陈立云. 高温对水稻胚乳淀粉合成关键酶活性及内源激素含量的影响[J]. 植物生理学报, 2014, 50(12): 1840-1844. doi: 10.13592/j.cnki.ppj.2014.0344.
Zhang G L, Liao B, Wu X J, Xiao Y H, Xiao L T, Chen L Y. Effect of high temperature on activities of enzymes associated with starch synthesis and hormones contents in endosperm of rice[J]. Acta Phytophysiologica Sinica, 2014,50(12):1840-1844. doi: 10.13592/j.cnki.ppj.2014.0344.
[14] 赵丽晓, 张萍, 王若男, 王璞, 陶洪斌. 花后前期高温对玉米强弱势籽粒生长发育的影响[J]. 作物学报, 2014, 40(10): 1839-1845. doi:10.3724/SP.J.1006.2014.01839.
Zhao L X, Zhang P, Wang R N, Wang P, Tao H B. Effect of high temperature after flowering on growth and development of superior and inferior maize kernels[J]. Acta Agronomica Sinica, 2014,40(10):1839-1845. doi:10.3724/SP.J.1006.2014.01839.
[15] 李德, 孙义, 孙有丰. 淮北平原夏玉米花期高温热害综合气候指标研究[J]. 中国生态农业学报, 2015, 23(8): 1035-1044. doi: 10.13930/j.cnki.cjea.150061.
Li D, Sun Y, Sun Y F. Use of integrated climatic index to determine high temperature damage to summer maize at florescence in the Huaibei plain[J]. Chinese Journal of Eco-agriculture, 2015,23(8):1035-1044. doi: 10.13930/j.cnki.cjea.150061.
[16] 于康珂, 刘源, 李亚明, 孙宁宁, 詹静, 尤东玲, 牛丽, 李潮海, 刘天学. 玉米花期耐高温品种的筛选与综合评价[J]. 玉米科学, 2016, 24(2): 62-71. doi: 10.13597/j.cnki.maize.science.20160213.
Yu K K, Liu Y, Li Y M, Sun N N, Zhan J, You D L, Niu L, Li C H, Liu T X. Screening and comprehensive evaluation of heat-tolerance of maize hybrids in flowering stage[J]. Journal of Maize Science, 2016,24(2):62-71. doi: 10.13597/j.cnki.maize.science.20160213.
[17] 于康珂, 孙宁宁, 詹静, 顾海靖, 刘刚, 潘利文, 刘天学. 高温胁迫对不同热敏型玉米品种雌雄穗生理特性的影响[J]. 玉米科学, 2017, 25(4): 84-91. doi:10.13597/j.cnki.maize.science.20170413.
Yu K K, Sun N N, Zhan J, Gu H J, Liu G, Pan L W, Liu T X. Effect of high temperature stress on physiological characteristics of tassel and ear in different maize varieties[J]. Journal of Maize Science, 2017,25(4):84-91. doi:10.13597/j.cnki.maize.science.20170413.
[18] Syed A Z, Amjad H, Muhammad A N, Wei M, Mehmood A, Muzammil H, Mehboob R. Mechanisms and molecular approaches for heat tolerance in rice under climate change scenario[J].Journal of Integrative Agriculture,2018,17(4):726-738. doi: 10.1016/S2095-3119(17)61718-0.
[19] Sato H, Todaka D, Kudo M, Mizoi J, Kidokoro S, Zhao Y, Shinozaki K, Yamaguchi S K. The Arabidoposis transcriptional regulator DPB3-1enhances heat stress tolerance without growth retardation in rice[J].Plant Biotechnology,2016,14(8):1756-1767. doi: 10.1111/pbi.12535.
[20] Todaka D, Nakashima K, Shinozaki K A.Toward understanding transcriptional regulatory networks in abiotic stress responses and tolerance in rice[J].Rice,2012,5(1):6. doi:10.1186/1939-8433-5-6.
[21] Qu A L, Ding Y F, Jiang Q, Zhu C. Molecular mechanisms of the plant heat stress response[J].Biochemical and Biophysical Research Communications,2013,432(2):203-207. doi:10.1016/j.bbrc.2013.01.104.
[22] Sakata T, Oshino T, Miura S, Tomabechi M, Tsunaga Y, Higashitani N, Miyazawa Y A, Watanabe M, Higashitani A. Auxins reverse plant male sterility caused by high temperatures[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(19):8569-8574.doi:10.1073/pnas.1000869107.