小麦是世界上最重要的粮食作物之一,保障小麦高产稳产是全世界目前重要的课题[1],小麦种子高活力及其苗期健壮生长是获得高产的基础[2]。种子萌发及幼苗生长阶段需要大量的生物能,三磷酸腺苷(ATP)通常被认为是存在于细胞内的“能量货币”[3],ATP作为一个重要动力因素,对种子萌发及幼苗生长过程起着非常重要的作用[4]。但是由于贮藏方式或者贮藏时间影响了种子活力,导致其细胞内合成的能量可能满足不了自身正常萌发及幼苗生长的需要,因此,细胞外ATP的供给尤为重要。研究表明,尽管胞外ATP不能自由穿过细胞膜,但在细胞膜上存在相应的受体蛋白[5],而胞外ATP可作为一种信号分子通过跨膜受体蛋白的介导作用使细胞内部产生第二信使,诱导特定基因和蛋白质的表达,并调节细胞的多种生理学反应[6],例如细胞活力、细胞生长发育等[7-8]。因此,胞外ATP可作为一种细胞外信号分子参与植物诸多生理反应的调节[3]。小麦种子萌发及幼苗生长是小麦生长发育的基础阶段,但是未见细胞外ATP对小麦种子萌发及幼苗生长发育是否具有调节作用的研究报道。为此,本研究通过细胞外ATP浸种,就ATP提高小麦种子活力的生理基础及幼苗生长发育的最佳浸种浓度进行了研究,为实际应用提供科学依据。
1 材料和方法
1.1 试验材料
试验于2018年11月在金正大生态工程集团股份有限公司智能玻璃温室中进行。供试小麦种子为鲁麦18;土壤为临沭县当地土壤,土壤有机质含量11.05 g/kg、碱解氮70.26 mg/kg、有效磷34.30 mg/kg、速效钾100.25 mg/kg,pH值6.50。试验用ATP为杭州志聚生物技术有限公司生产,有效含量大于等于98%。
1.2 试验设计
试验共设6个处理,即设置不同浓度ATP浸种,ATP浓度分别为0,5,10,15,20,25 mg/L。浸种前先用10%双氧水对种子表面消毒5 min,并用无菌水冲洗8次,晾干后开始浸种,浸种时间为24 h,浸种完毕后进行发芽试验和电导率、酶活性测定。发芽试验以盆栽的方式进行,每个处理均重复4次,每盆体积约为4.3 dm3,装土5 kg,将浸种完的小麦种子阴干后分别播种于盆中,每盆播种30粒颗粒饱满种子,覆土0.5 kg(约2.0 cm),播种后浇足等量水,期间注意浇水与观察记录,整盆收获并进行指标测定。
1.3 测定项目与方法
发芽期间逐日记录发芽粒数,第4天计算种子发芽势,第12天计算种子发芽率,发芽指数,第13天测定幼根长度(胚根及下胚轴),并计算简化活力指数[9]。发芽势为第4天时发芽种子数/供试种子数;发芽率为第12天时发芽种子数/供试种子数;发芽指数(GI)=∑(Gt/Dt),式中Dt为发芽日数,Gt为与Dt相对应的每天发芽种子数;简化活力指数=发芽率×幼根长度(cm)。
电导率测定:各处理浸种完毕后,分别取50粒小麦种子用蒸馏水冲洗5次,滤纸吸干表面水分,加入50 mL的离心管内,加蒸馏水40 mL,放入离心机内4 000 r/min离心10 min,然后用DDS-11A型电导率仪测定电导率。酶活性测定:采用愈创木酚法测定过氧化物酶[10];脱氢酶的活力测定(TTC)法[4]参照张伟峰等[4]的方法,以490 nm处的吸光值表示酶活力大小;过氧化氢酶活性的测定采用紫外分光光度计法[10]。
根系参数采用EPSON根系扫描仪分析,测定总根长、总根表面积和根尖数;采用TTC法[11]测定根系活力(根系TTC还原强度);地上部及根系干质量测定均采用称量法,干质量测定时,先将地上部与根系分开,105 ℃杀青30 min,80 ℃烘干后称量[12]。
试验数据采用Excel软件进行统计与分析,用SPSS软件进行差异显著性分析。
2 结果与分析
2.1 ATP浸种对小麦出苗性状及种子活力的影响
由表1可知,经ATP浸种处理后,小麦种子的发芽势、发芽率及发芽指数均较空白对照提高,其中ATP浓度在10~20 mg/L的各处理均与对照处理差异显著,增大幅度分别为14.16~27.50百分点,5.83~10.00百分点,1.31~2.98百分点,且各指标均在ATP浓度为20 mg/L时最高,较对照分别提高27.50,10.00,2.98百分点;各处理的幼根长度相比空白对照增大,同样在ATP浓度为20 mg/L时达到最大值,增大幅度为17.01%。
经ATP处理后,小麦种子的简化活力指数大幅度提高,其中ATP浓度为10,15,20 mg/L的处理与对照达到显著差异,提高幅度为14.61%~30.52%,同样在ATP 20 mg/L时提高幅度最大,较对照提高30.52%。
2.2 ATP浸种对小麦过氧化物酶、脱氢酶、过氧化氢酶和电导率的影响
由表2可知,经过ATP浸种后,种子浸出液的电导率均下降,除5 mg/L处理外,其他各处理均与对照达显著差异,降幅为5.97%~7.12%。经过ATP处理后,过氧化物酶活力均有所提高,且各处理与对照均达显著差异,在ATP 20 mg/L时提高幅度最大,为38.79%;脱氢酶活力同样提高,除ATP 5,10 mg/L外,其他各处理与对照达显著差异,提高幅度为9.09%~18.18%。过氧化氢酶活力也有所提高,除ATP 5 mg/L外,其他各处理与对照达显著差异,在ATP 20 mg/L时提高幅度最大,为26.43%。
表1 ATP浸种对小麦出苗性状及种子活力的影响
Tab.1 Effects of soaking seed with adenosine triphosphate on wheat seeds germination and seeds activity
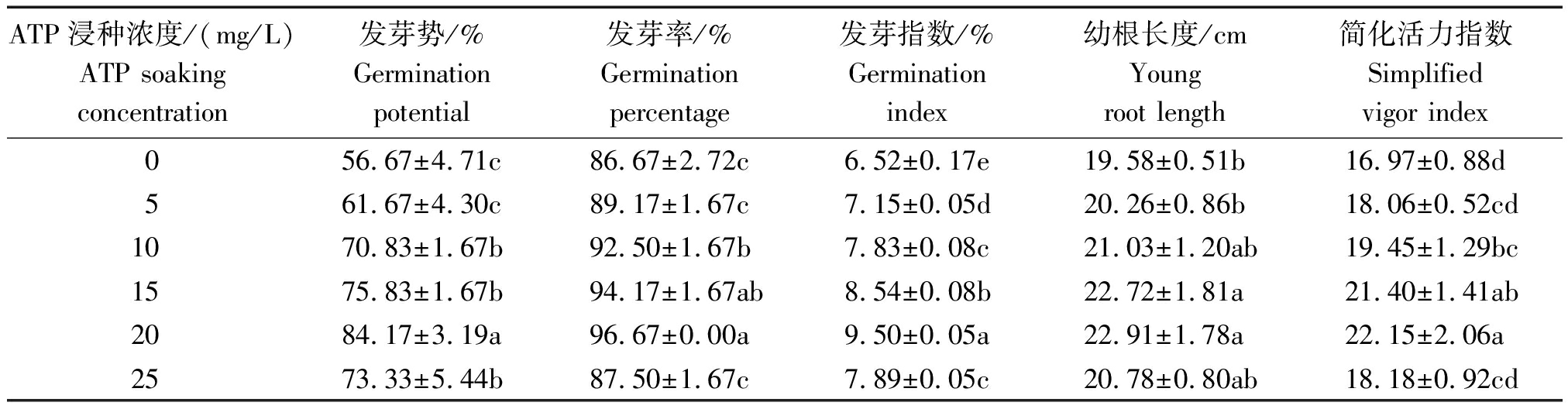
ATP浸种浓度/(mg/L)ATP soaking concentration发芽势/%Germinationpotential发芽率/%Germinationpercentage发芽指数/%Germinationindex幼根长度/cm Youngroot length简化活力指数Simplifiedvigor index056.67±4.71c86.67±2.72c6.52±0.17e19.58±0.51b16.97±0.88d561.67±4.30c89.17±1.67c7.15±0.05d20.26±0.86b18.06±0.52cd1070.83±1.67b92.50±1.67b7.83±0.08c21.03±1.20ab19.45±1.29bc1575.83±1.67b94.17±1.67ab8.54±0.08b22.72±1.81a21.40±1.41ab2084.17±3.19a96.67±0.00a9.50±0.05a22.91±1.78a22.15±2.06a2573.33±5.44b87.50±1.67c7.89±0.05c20.78±0.80ab18.18±0.92cd
注:图中不同小写字母表示在0.05水平差异显著。表2-4同。
Note:Values followed by different lowercase letters in the figure show significant differences at 0.05 level.The same as Tab.2-4.
表2 ATP浸种对小麦过氧化物酶、脱氢酶、过氧化氢酶和电导率的影响
Tab.2 Effects of soaking seed with adenosine triphosphate on wheat seeds peroxidase, dehydrogenase and
catalase activities and electric conductivity rate

ATP浸种浓度/(mg/L)ATP soaking concentration电导率/(μS/cm)Electricconductivity rate 过氧化物酶/(U/(g·min)) Peroxidase脱氢酶/(U/(g·min))Dehydrogenase过氧化氢酶/(U/(g·min))Catalase0523.25±3.77a23.87±1.86d0.33±0.01c19.03±0.96c5517.00±3.54a26.72±1.42c0.33±0.01c20.06±1.46bc10492.00±3.67b27.86±0.73c0.34±0.01bc22.10±1.42ab15487.50±6.18b30.29±0.79b0.36±0.00b22.99±1.40a20486.00±6.52b33.13±2.24a0.39±0.01a24.06±1.42a25491.75±8.26b27.25±1.21c0.36±0.03b22.00±1.34ab
2.3 ATP浸种对小麦根系生长及根系活力的影响
从表3可以看出,ATP浸种有利于小麦根系的生长,表现为根长密度、根表面积增大,根尖数增多。随着ATP浸种浓度的升高,小麦根长密度、根表面积、根尖数均呈现先升高后降低的趋势,且均在ATP浸种浓度为20 mg/L时达到最大值,增长幅度分别为17.55%,16.14%,19.13%,与对照差异显著。
根系活力是根系的吸收、合成、氧化和还原能力等,是反应根系生命活动的一项综合指标[13-14],而根系TTC还原强度是根系活力的重要指标[15],从表3可知,根系TTC还原强度同样随着ATP浸种浓度的增大先增大后降低,且在ATP浸种浓度为20 mg/L时达到最大值,增幅为11.70%,与对照差异显著。
表3 ATP浸种对小麦根系生长及根系活力的影响
Tab.3 Effects of soaking seed with adenosine triphosphate on wheat root growth and root activity
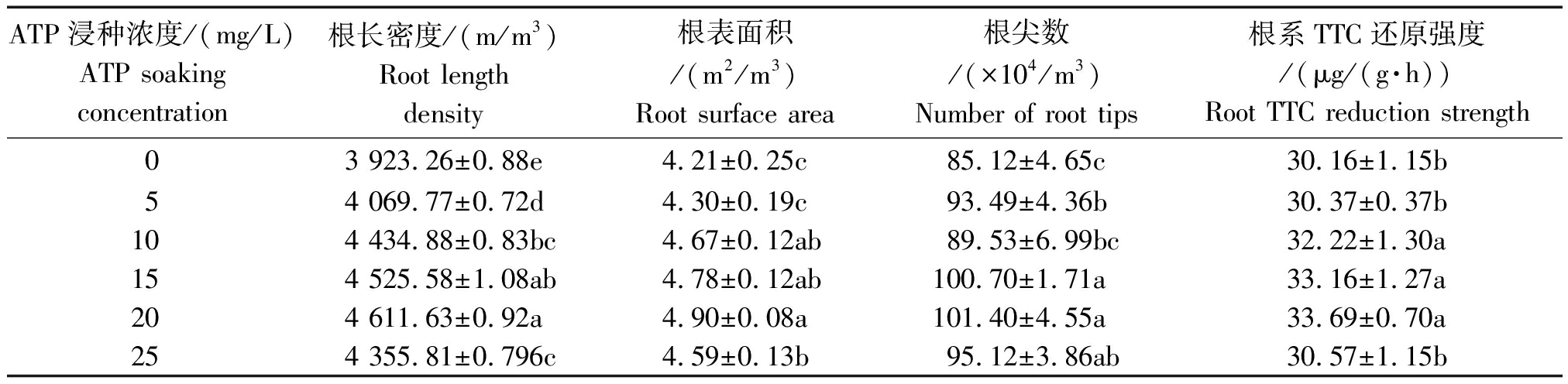
ATP浸种浓度/(mg/L)ATP soaking concentration根长密度/(m/m3)Root length density根表面积/(m2/m3)Root surface area 根尖数/(×104/m3)Number of root tips 根系TTC还原强度/(μg/(g·h))Root TTC reduction strength03 923.26±0.88e4.21±0.25c85.12±4.65c30.16±1.15b54 069.77±0.72d4.30±0.19c93.49±4.36b30.37±0.37b104 434.88±0.83bc4.67±0.12ab89.53±6.99bc32.22±1.30a154 525.58±1.08ab4.78±0.12ab100.70±1.71a33.16±1.27a204 611.63±0.92a4.90±0.08a101.40±4.55a33.69±0.70a254 355.81±0.796c4.59±0.13b95.12±3.86ab30.57±1.15b
2.4 ATP浸种对小麦干物质积累量的影响
由表4可知,在试验浓度范围内,小麦总干质量、地上部及根系干质量均随着ATP浸种浓度的增大先增大后减小,且均在ATP浓度为20 mg/L时达到最大值。其中在总干质量及地上部干质量方面,ATP 20 mg/L处理显著高于其他所有处理,较对照分别增长18.84%,17.32%;在根系干质量方面,ATP 15,20 mg/L处理显著高于其他处理,较对照分别提高18.24%,24.15%。
表4 ATP浸种对小麦干物质积累量的影响
Tab.4 Effects of soaking seed with adenosine
triphosphate on wheat dry matter accumulation
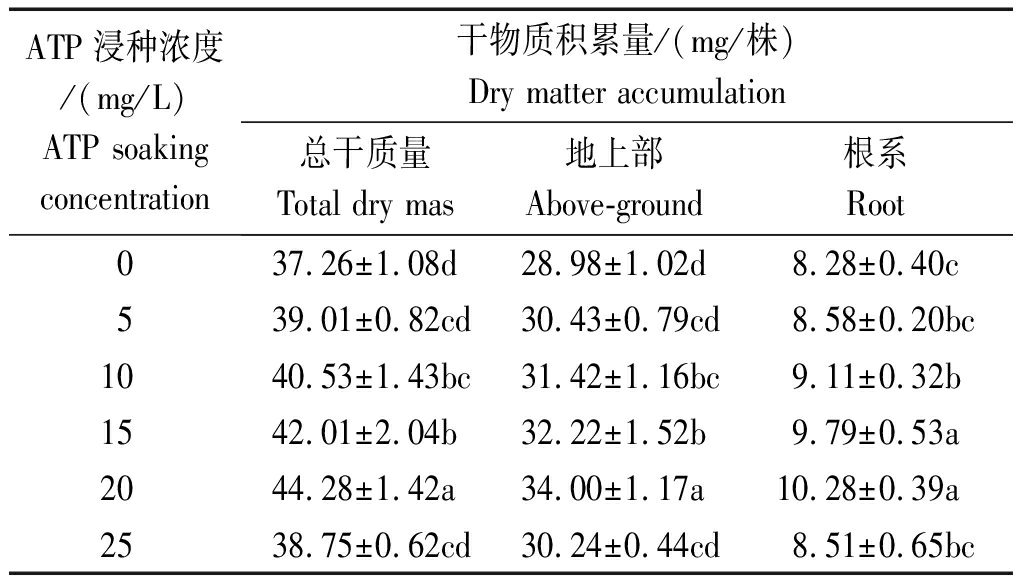
ATP浸种浓度/(mg/L)ATP soakingconcentration 干物质积累量/(mg/株)Dry matter accumulation 总干质量Total dry mas地上部Above-ground根系Root037.26±1.08d28.98±1.02d8.28±0.40c539.01±0.82cd30.43±0.79cd8.58±0.20bc1040.53±1.43bc31.42±1.16bc9.11±0.32b1542.01±2.04b32.22±1.52b9.79±0.53a2044.28±1.42a34.00±1.17a10.28±0.39a2538.75±0.62cd30.24±0.44cd8.51±0.65bc
3 结论与讨论
ATP是氧化磷酸化和光合磷酸化的产物,是活细胞中的能量通货,也是活细胞进行新陈代谢最重要的生理指标,因此,维持适当水平的ATP含量是植物进行生命活动的重要前提[16]。种子在吸胀萌动过程中,ATP随呼吸氧化磷酸化迅速合成,但同时伴随着种子的生物合成过程不断消耗,尤其在低温、干旱等逆境条件下,细胞内ATP含量下降更为明显[9,16],导致种子活力降低,所以外施ATP是种子萌发提供能量的有效途径。本研究发现,小麦经不同浓度ATP浸种后,种子发芽势、发芽率、发芽指数及种子简化活力都有不同程度的提升,且均在ATP浓度为20 mg/L时达到最大值,各指标增长幅度分别为27.50,10.00,2.98百分点,因此,ATP浸种有助于促进种子的萌发性能。
种子浸出液的电导率作为检测种子活力高低的指标已成为种子检验中的常规方法。种子浸出液的电导率低表明细胞内营养物质渗漏减少,种子细胞膜的结构稳定性好,种子活力高[17]。过氧化物酶、脱氢酶、过氧化氢酶等酶活力也是检测种子活力的重要指标。脂质过氧化导致细胞膜损伤是种子衰老和活力降低的原因之一,而过氧化物酶是消除脂质过氧化的主要系统之一[17];由脱氢酶催化的脱氢作用是一种重要的生物氧化反应,脱氢酶的活性大小可以侧面反映种子生物氧化反应的水平[18];过氧化氢酶是植物体内重要的自由基清除剂,在清除机体内超氧阴离子等对生物体的毒性过程起着关键性的作用[19]。张伟峰等[4]、孙渭等[9]通过在烟草种子上的研究发现,ATP浸种可降低烟草种子浸出液电导率,同时提高过氧化物酶等酶的活性。本研究发现,经ATP浸种后,小麦种子浸出液电导率下降,而过氧化物酶、脱氢酶、过氧化氢酶都有不同程度的提高,这与前人研究结果一致,说明ATP浸种有利于提高小麦种子活力,与前面ATP有助于提高种子萌发性能相对应。
小麦根系在其整个生长发育过程中扮演者非常重要的角色,特别是早期根的数目、总根长、根系活力等,对小麦产量影响较大[20]。本研究发现,ATP浸种有助于小麦根系形态指标及根系活力的提高,同时对小麦各器官干物质积累量均有不同程度的促进作用,且均在ATP浓度为20 mg/L时达到最大值。
综上所述,ATP浸种不仅可以提高小麦种子萌发性能,同时还能显著促进幼苗的生长,且所需浓度较低,价格低廉,具有进一步研究和应用价值。
[1] 邓茜,张爱华,侯立江,王丹,许盛宝.油菜素内酯对小麦幼苗根系发育的影响[J].麦类作物学报,2018,38(12):1504-1511. doi: 10.7606/j.issn.1009-1041.2018.12.15.
Deng Q, Zhang A H, Hou L J, Wang D, Xu S B. Effects of brassinolide on development of root system of wheat seedlings[J]. Journal of Triticeae Crops, 2018,38(12):1504-1511.
[2] 王征宏,赵威,郭秀璞,吕淑芳,王春平,邓西平.不同倍性小麦种子萌发特征及其对水分胁迫敏感性的差异[J].植物生理学报, 2013, 49(8):817-823. doi: 10.13592/j.cnki.ppj.2013.08.013.
Wang Z H, Zhao W, Guo X P, Lü S F, Wang C P, Deng X P. Seed germinination characteristics and their differences in sensitivity to water stress in wheat with different ploidy levels[J]. Plant Physiology Journal, 2013, 49(8):817-823.
[3] 冯汉青, 焦青松,田武英,孙坤,贾凌云.不同光强下细胞外三磷酸腺苷对菜豆叶片光化学反应特性的影响[J].植物生态学报,2014, 38 (10): 1117-1123. doi:10.3724/SP.J.1258.2014.00106.
Feng H Q, Jiao Q S, Tian W Y, Sun K, Jia L Y. Effects of extracellular ATP on the characteristics of photochemical reaction in bean (Phaseolus vulgaris) leaves under different light intensities[J]. Chinese Journal of Plant Ecology, 2014, 38 (10): 1117-1123.
[4] 张伟峰,孙渭,李斌,杨建雄.几种化学药剂对烟草种子萌发的促进效果[J].种子,2004,12(23):20-23.doi:10.3969/j.issn.1001-4705.2004.12.006.
Zhang W F, Sun W, Li B, Yang J X. Effect of soaking with some chemicals on the promotion of tobacco seed germination[J].Seed, 2004,12(23):20-23.
[5] Choi J, Tanaka K, Cao Y R, Qi Y, Qiu J, Liang Y, Lee S Y, Stacey G. Identification of a plant receptor for extracelluar ATP [J]. Science, 2014, 343(6168):290-294. doi: 10.1126/science.343.6168.290.
[6] Sun J, Zhang C L, Zhang X, Deng S R, Zhao R, Shen X, Chen S L. Extracellular ATP signaling and homeostasis in plant cells [J]. Plant Signaling & Behavior, 2012, 7(5):566-569. doi: 10.4161/psb.19857.
[7] Chivasa S, Ndimba B K, Simon W J, Lindsey K, Slabas A R. Extracellular ATP functions as an endogenous external metabolite regulating plant cell viability [J]. The Plant Cell, 2005, 17(11), 3019-3034. doi: 10.1105/tpc.105.036806.
[8] Wu J, Steinebrunner I, Sun Y, Butterfield T, Torres J,Arnold D, Gonzalea A, Jacob F, Reichler S, Roux S J. Apyrases (Nucleoside Triphosphate-Diphosphohydrolases) play a key role in growth control in Arabidopsis[J]. Plant Physiology, 2007, 144(2):961-975. doi: 10.1104/pp.107.097568.
[9] 孙渭,李斌,奚柏龙,胡捷,雷学峰.腺苷三磷酸对促进烟草种子萌发的效果[J].中国烟草科学,2003,24(1):34-36. doi: 10.3969/j.issn.1007-5119.2003.01.013.
Sun W, Li B, Xi B L, Hu J, Lei X F. Enhancement of ATP on tobacco seed germination[J]. Chinese Tobacco Science, 2003,24(1):34-36.
[10] 郝舒雪,曹红霞,王虎兵,潘小燕.水分胁迫对番茄幼苗生理特性的影响[J].排灌机械工程学报, 2018, 36(10):943-947. doi: 10.3969/j.issn.1674-8530.18.1169.
Hao S X, Cao H X, Wang H B, Pan X Y. Effects of water stress on physiological characteristics during tomato seedlings period[J]. Journal of Drainage and Irrigation Machinery Engineering, 2018, 36(10):943-947.
[11] 郑坚,陈秋夏,金川,郭秀珠,黄品湖.不同TTC法测定枫香等阔叶树容器苗根系活力探讨[J].浙江农业科学,2008(1):39-42. doi: 10.3969/j.issn.0528-9017.2008.01.016.
Zheng J, Chen Q X, Jin C, Guo X Z, Huang P H. Study on root activity of container seedlings of liquidambar formosana by different TTC method[J]. Journal of Zhejiang Agricultural Sciences, 2008(1):39-42.
[12] 胡兆平,马存金,任士伟,张营,陈剑秋,李新柱.硫酸锌拌种对小麦幼苗生长发育的影响[J].湖北农业科学,2017,56(4):613-617. doi: 10.14088/j.cnki.issn0439-8114.2017.04.005.
Hu Z P, Ma C J, Ren S W, Zhang Y, Chen Q J, Li X Z. Effects of ZnSO4 seed dressing on the growth and development of wheat seedling[J]. Hubei Agricultural Sciences, 2017,56(4):613-617.
[13] 刘海龙,郑桂珍,关军锋,李广敏.干旱胁迫下玉米根系活力和膜透性的变化[J].华北农学报,2002,17(2):20-22. doi: 10.3321/j.issn:1000-7091.2002.02.005.
Liu H L, Zheng G Z, Guan J F, Li G M. Changes of root activity and membrane permeability under drought stress in maize[J]. Acta Agriculturae Boreali-Sinica, 2002,17(2):20-22.
[14] 王亮亮,宋伟杰,高志山,宋涛.土壤渗透剂对番茄生长发育的影响[J].中国土壤与肥料,2018(6):198-201. doi:10.11838/sfsc.20180629.
Wang L L, Song W J, Gao Z S, Song T. Effects of soil penetrating agent on tomato growth[J]. Soils and Fertilizers Sciences in China, 2018(6):198-201.
[15] 齐文增,刘慧慧,李耕,邵立杰,王飞飞,刘鹏,董树亭,张吉旺,赵斌.超高产夏玉米根系时空分布特点[J].植物营养与肥料学报,2012,18(1):69-76. doi: 10.11674/zwyf.2012.11223.
Qi W Z, Liu H H, Li G, Shao L J, Wang F F, Liu P, Dong S T, Zhang J W, Zhao B. Temporal and spatial distribution characteristics of super-high-yield summer maize root[J]. Journal of Plant Nutrition and Fertilizers, 2012,18(1):69-76.
[16] 张明生,谢波,谈锋,张启堂.甘薯可溶性蛋白、叶绿素及ATP含量变化与品种抗旱性关系的研究[J].中国农业科学,2003,36(1):13-16. doi: 10.3321/j.issn:0578-1752.2003.01.003.
Zhang M S, Xie B, Tan F, Zhang Q T. Relationship among soluble protein, chlorophyll and ATP in sweet potato under water stress with drought resistance[J]. Scientia Agricultura Sinica, 2003,36(1):13-16.
[17] 许如根,吕超,杨荣伟,高峰,陈培红,何琳华.大麦种子贮藏期间的生理变化及其安全贮藏年限[J].麦类作物学报,2004,24(2):61-64. doi: 10.3969/j.issn.1009-1041.2004.02.015.
Xu R G, Lü C, Yang R W, Gao F, Chen P H, He L H. Physiological changes of barley seed during the storage and its safe storage life[J]. Journal of Triticeae Crops, 2004,24(2):61-64.
[18] 薛刚,张文明,姚大年.小麦种子活力及其与脱氢酶活性的相关性研究[J].安徽农业科学,2009,37(9):3905-3908. doi: 10.3969/j.issn.0517-6611.2009.09.021.
Xue G, Zhang W M, Yao D N. Research on the wheat seed viability and its relevance with dehydrogenase acitivity[J]. Journal of Anhui Agricultural Sciences, 2009,37(9):3905-3908.
[19] 吴道藩,宋明.提高甘蓝种子活力的方法与机理研究[J].园艺学报,2002,29(6):542-546. doi: 10.3321/j.issn:0513-353X.2002.06.009.
Wu D F, Song M. Studies on methods and mechanisms of improving vigor in cabbage seed(Brassia oleracea L.var.capitato)[J].Acta Horticulturae Sinica, 2002,29(6):542-546.
[20] Xie Q, Fernando K M C, Mayes S, Sparkes D L. Identifying seedling root architectural traits associated with yield and yield components in wheat[J]. Annals of Botany, 2017,119(7):1115-1129. doi: 10.1093/aob/mcx001.