抗生素因其具有治疗、预防疾病和提高饲料利用率的作用而被长期应用到畜禽生产,但滥用抗生素会产生耐药性和残留等问题[1]。益生菌作为与抗生素有同样功效的饲料添加剂而成为国内外研究重点,其中芽孢杆菌因其营养简单、生长快、易分离培养、较强的抗逆性等特点被广泛研究与应用[2-4]。无毒蜡样芽孢杆菌(Bacillus cereus)是国内外常用于畜禽生产上的益生菌之一,能产生具有抗逆性的内生芽孢,稳定性好,在饲料中添加该菌制剂可促进畜禽生长,提高动物的抗病能力[5-7]。潘康成等[8-9]发现,蜡样芽孢杆菌PAS38能降低小肠SS细胞数量和表达,提高5-HT细胞数量和表达,同时能显著增加家兔HPA轴5-羟色胺(5-HT)阳性细胞的表达数量与5-HT细胞的表达强度,进而证明蜡样芽孢杆菌PAS38对家兔的生长和免疫功能具有正面积极的作用。但蜡样芽孢杆菌PAS38对肉鸡血清细胞因子和淋巴器官免疫相关基因mRNA转录水平的影响未见报道,因此,本试验通过在日粮中添加蜡样芽孢杆菌PAS38制剂给予肉鸡,观察其对肉鸡生长性能的同时,测定肠道淀粉酶、蛋白酶活性,检测血清中几种细胞因子和胸腺、法氏囊组织中免疫相关基因mRNA转录水平,探讨其对肉鸡免疫功能的影响,为蜡样芽孢杆菌PAS38作为饲料添加剂在肉鸡生产上的应用提供理论依据。
1 材料和方法
1.1 菌种及芽孢杆菌PAS38制剂的制备
蜡样芽孢杆菌PAS38,由四川农业大学动物微生态研究中心保存。保存的菌种经活化、培养、收集芽孢后,加入玉米淀粉为载体,70 ℃烘干,测定其活菌量为2.39×109 cfu/g,室温下保存备用。
1.2 试验动物分组及管理
80羽1 d AA肉鸡(购自四川省温江正大畜禽有限公司),基础日粮适应性饲喂至7 d,随机分为对照组和试验组,每组4个重复,每个重复10羽(其中一个重复于28 d时,取样检测,不用于统计生长性能),鸡只采用笼养,每笼10只。对照组饲喂基础日粮,试验组在基础日粮中添加0.05%的蜡样芽孢杆菌PAS38制剂。2组鸡分别隔开饲养,保温灯保温,粉料饲喂,自由采食饮水,正式饲喂时间为35 d,每天观察鸡只采食、饮水与健康情况,记录耗料量等情况,期间不进行任何免疫。
1.3 基础日粮
采用玉米-豆粕型基础日粮,日粮组成及其营养水平参考文献[10]配制。
1.4 生长性能检测
于28 d及42 d早上8:00对每组的3个重复组肉鸡进行空腹称质量(称质量前断料8 h,断水2 h),计算净增质量和料质量比。
1.5 样品采集及指标测定
于28,42 d时选取每组的1个重复组肉鸡6羽(雌雄各半),翅下静脉采血并分离血清,血清用于测定血清免疫球蛋白含量及细胞因子水平。然后颌下动脉放血致死后,摘取淋巴器官并称质量,同时无菌采集空、回肠内容物。肠道内容物和淋巴器官组织迅速置于液氮中并带回实验室,置于-80 ℃冰箱中保存备用。
1.5.1 免疫器官指数检测 摘取脾脏、法氏囊和两侧胸腺,小心剥离脂肪和结缔组织,称质量并计算免疫器官指数,免疫器官指数=免疫器官质量(g)/活体质量(kg)。
1.5.2 肠道消化酶活性检测 从-80 ℃冰箱中取出保存的空肠及回肠内容物,玻璃匀浆器匀浆并加入适当稀释液,4 ℃ 2 500 r/min 离心10 min,取上清液,按照试剂盒(南京建成生物研究所)说明方法进行肠道淀粉酶和中性蛋白酶活性的检测。
1.5.3 血清免疫球蛋白含量检测 从-20 ℃冰箱中取出保存的血清,参照蔡杰等[11] 醋酸纤维薄膜电泳法分离测定鸡血清蛋白质的方法测定肉鸡血清免疫球蛋白含量。
1.5.4 血清细胞因子水平检测 从-20 ℃冰箱中取出保存的42 d鸡血清,根据ELISA试剂盒(成都里来生物科技有限公司)说明方法中的操作步骤进行。
1.5.5 免疫相关基因mRNA转录水平的检测 从-80 ℃冰箱中取出保存的胸腺、法氏囊组织,按照试剂盒(东源致远公司)说明方法提取RNA和反转录为cDNA,然后在Bio-Rad CFX96 touch仪上进行实时荧光定量PCR检测免疫相关基因mRNA的转录水平。检测的基因、引物序列、退火温度、扩增的基因长度见表1,所有引物由生工生物工程(上海)股份有限公司合成。基因相对定量的计算以内参基因(β-actin)为对照,计算公式:RQ=2-ΔΔCT(其中ΔΔCT=ΔCT-整组最大ΔCT,ΔCT=目的基因Ct值-内参基因Ct值)。
表1 荧光定量PCR引物
Tab.1 The primers for qRT-PCR

基因GeneGenBank登录号Accession number引物序列Primer sequences (5′-3′)退火温度/℃Annealing temperature长度/bpLengthβ-actinL08165F: TGCTGTGTTCCCATCTATCG57150R: TTGGTGACAATACCGTGTTCAIL-2AF000631F: CAAGAGTCTTACGGGTCTAAATCAC58 99R: GTTGGTCAGTTCATGGAGAAAATCIL-4001007079.1F: AGCACTGCCACAAGAACCT60160R: GCTAGTTGGTGGAAGAAGGTACIL-10001004414.2F: CATGCTGCTGGGCCTGAA60 94R: CGTCTCCTTGATCTGCTTGATGIFN-γX99774F: GACAAGTCAAAGCCGCACA55127R: TCAAGTCGTTCATCGGGAGCGBP1204652.1F: ACCCAGCATCCAACTTTGTC55111R: CCAGGTACTCGTCCTCACTCAIRF1015294014.1F:TCTCATCTCATCTCATCTCGGCTCTG62 83R: TGCTGTGCTGTGTTGTGCTGAG
1.6 数据处理与分析
采用Excel 2010软件对试验数据进行初步处理与统计,采用t-检验分析显著性差异,数据用平均数±标准差表示。
2 结果与分析
2.1 蜡样芽孢杆菌PAS38对肉鸡生长性能的影响
在35 d的全期饲喂过程中,未见肉鸡发病死亡现象,蜡样芽孢杆菌PAS38对肉鸡生长性能的影响见表2。由表2可知,28,42 d,试验组肉鸡体质量及净增质量均较对照组高,28 d时体质量显著高于对照组(P<0.05),全期净增质量提高了7.48%(P>0.05);试验组的料质量比虽较对照组有所下降,但差异不显著(P>0.05)。
表2 蜡样芽孢杆菌PAS38对肉鸡生长性能的影响
Tab.2 Effect of B. cereus PAS38 on growth of broilers
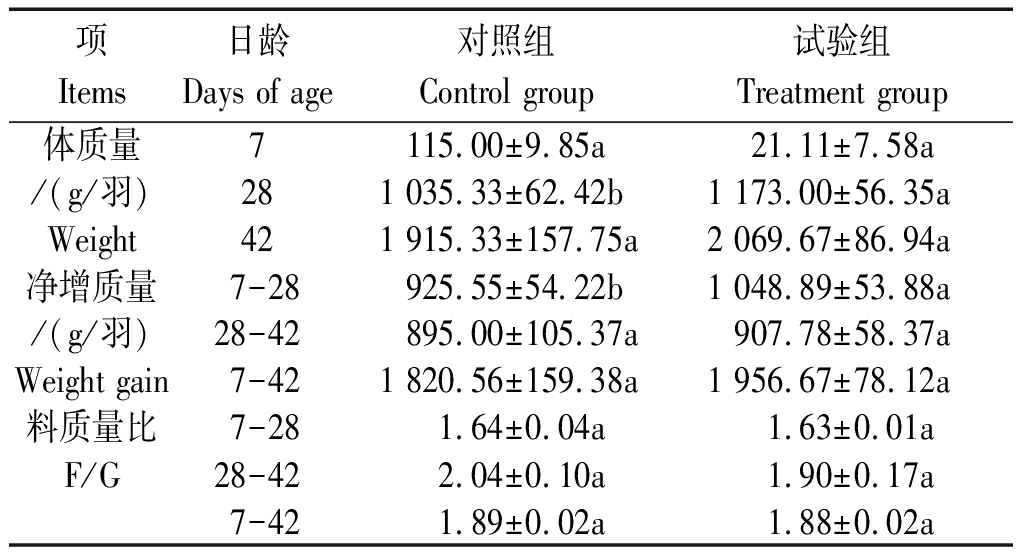
项Items日龄Days of age对照组Control group试验组Treatment group体质量7 115.00±9.85a 21.11±7.58a/(g/羽)281 035.33±62.42b1 173.00±56.35aWeight 42 1 915.33±157.75a2 069.67±86.94a净增质量7-28 925.55±54.22b1 048.89±53.88a/(g/羽)28-42 895.00±105.37a907.78±58.37aWeight gain7-421 820.56±159.38a1 956.67±78.12a料质量比7-28 1.64±0.04a 1.63±0.01aF/G28-42 2.04±0.10a 1.90±0.17a7-42 1.89±0.02a 1.88±0.02a
注:同行数据不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01);相同字母表示差异不显著(P>0.05)。表3-7同。
Note: Data in the same row with different small letter mean significant difference(P<0.05);Different capital letter mean strongly significantly different(P<0.01);The same letter mean not significantly different(P>0.05). The same as Tab.3-7.
2.2 蜡样芽孢杆菌PAS38对肉鸡肠道消化酶活性的影响
由表3可知,试验组肉鸡肠道淀粉酶和蛋白酶活性均高于对照组(P<0.05和P<0.01),说明蜡样芽孢杆菌PAS38具有促进肉鸡肠道消化酶活性的作用。
表3 蜡样芽孢杆菌PAS38对肉鸡肠道消化酶活性的影响
Tab.3 Effects of B. cereus PAS38 on
intestinal digestive enzyme activity of broilers U/mg
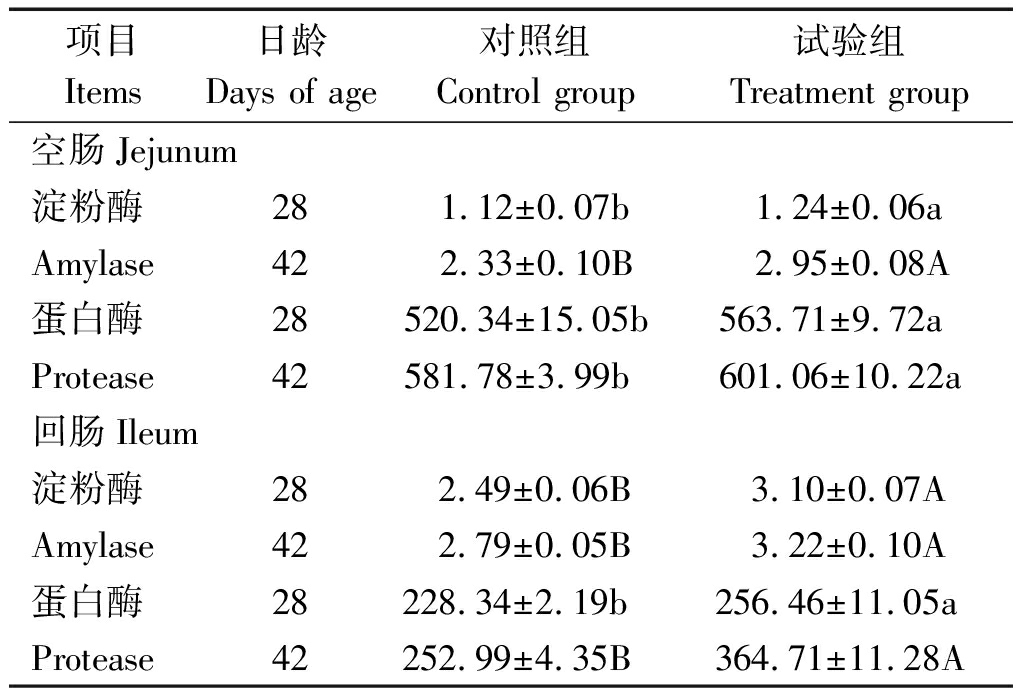
项目Items日龄Days of age对照组Control group试验组Treatment group空肠Jejunum 淀粉酶281.12±0.07b1.24±0.06aAmylase422.33±0.10B 2.95±0.08A蛋白酶28520.34±15.05b563.71±9.72aProtease42581.78±3.99b 601.06±10.22a回肠Ileum淀粉酶282.49±0.06B3.10±0.07AAmylase422.79±0.05B3.22±0.10A蛋白酶28228.34±2.19b 256.46±11.05aProtease42252.99±4.35B364.71±11.28A
2.3 蜡样芽孢杆菌PAS38对肉鸡免疫器官指数的影响
由表4可知,试验组肉鸡的免疫器官指数均比对照组有所增加,法氏囊指数在42 d时差异显著(P<0.05),胸腺指数和脾脏指数分别在28,42 d时差异显著(P<0.05)和极显著(P<0.01)。
表4 蜡样芽孢杆菌PAS38对肉鸡免疫器官指数的影响
Tab.4 Effects of B. cereus PAS38 on
immune organ index of broilers g/kg
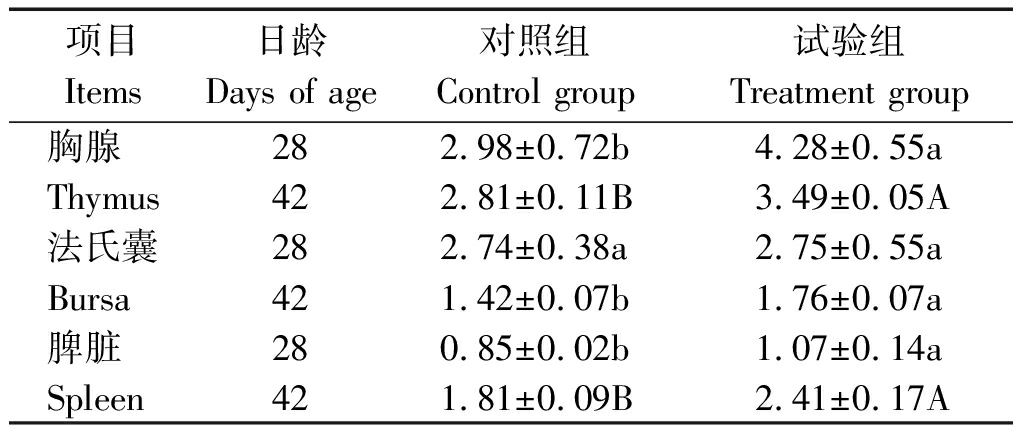
项目Items日龄Days of age对照组Control group试验组Treatment group胸腺282.98±0.72b4.28±0.55aThymus422.81±0.11B3.49±0.05A法氏囊282.74±0.38a2.75±0.55aBursa421.42±0.07b1.76±0.07a脾脏280.85±0.02b1.07±0.14aSpleen421.81±0.09B2.41±0.17A
表5 蜡样芽孢杆菌PAS38对肉鸡血清免疫球蛋白含量
Tab.5 Effects of B. cereus PAS38 on serum
immunoglobulin level of broilers %
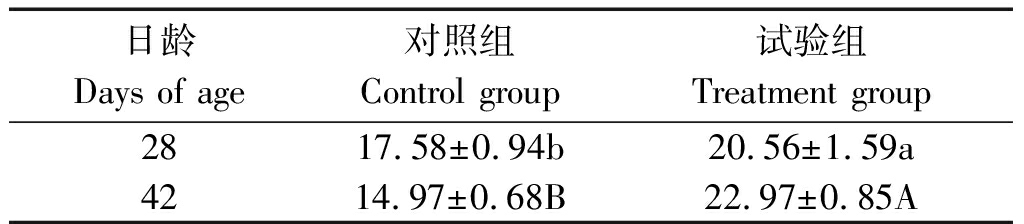
日龄Days of age对照组Control group试验组Treatment group28 17.58±0.94b20.56±1.59a42 14.97±0.68B22.97±0.85A
2.4 蜡样芽孢杆菌PAS38对肉鸡血清免疫球蛋白含量的影响
由表5可知,28,42 d试验组血清免疫球蛋白含量显著和极显著高于对照组(P<0.05和P<0.01)。
2.5 蜡样芽孢杆菌PAS38对肉鸡血清细胞因子水平的影响
由表6可知,42 d时试验组肉鸡血清中IL-2和IFN-γ含量高于对照组,IL-4含量低于对照组,差异不显著(P>0.05)。
表6 蜡样芽孢杆菌PAS38对血清细胞因子水平
Tab.6 Effects of B. cereus PAS38 on
serum cytokines level of broilers pg/mL
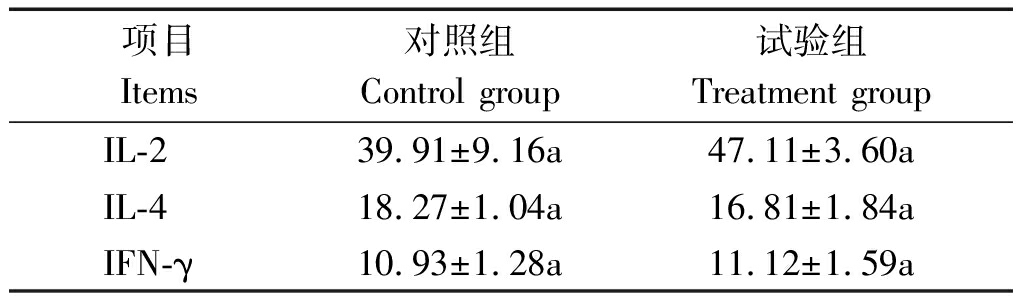
项目Items 对照组Control group试验组Treatment groupIL-239.91±9.16a47.11±3.60aIL-418.27±1.04a16.81±1.84aIFN-γ10.93±1.28a11.12±1.59a
2.6 蜡样芽孢杆菌PAS38对肉鸡胸腺和法氏囊免疫相关基因mRNA转录水平的影响
由表7结果可见,IL-2、IFN-γ、GBP1、IRF1的mRNA转录水平在2种免疫器官中,试验组均不同程度地高于对照组,IL-10 mRNA转录水平低于对照组;IL-4 mRNA转录水平在胸腺组织中显著高于对照组(P<0.05),而在法氏囊组织中则显著(P<0.05)和极显著(P<0.01)低于对照组。
表7 蜡样芽孢杆菌PAS38对肉鸡胸腺和法氏囊免疫相关基因的mRNA的转录水平的影响
Tab.7 Effects of B. cereus PAS38 on transcriptional level of mRNA of immune-related
genes in thymus and bursa fabricii of broilers
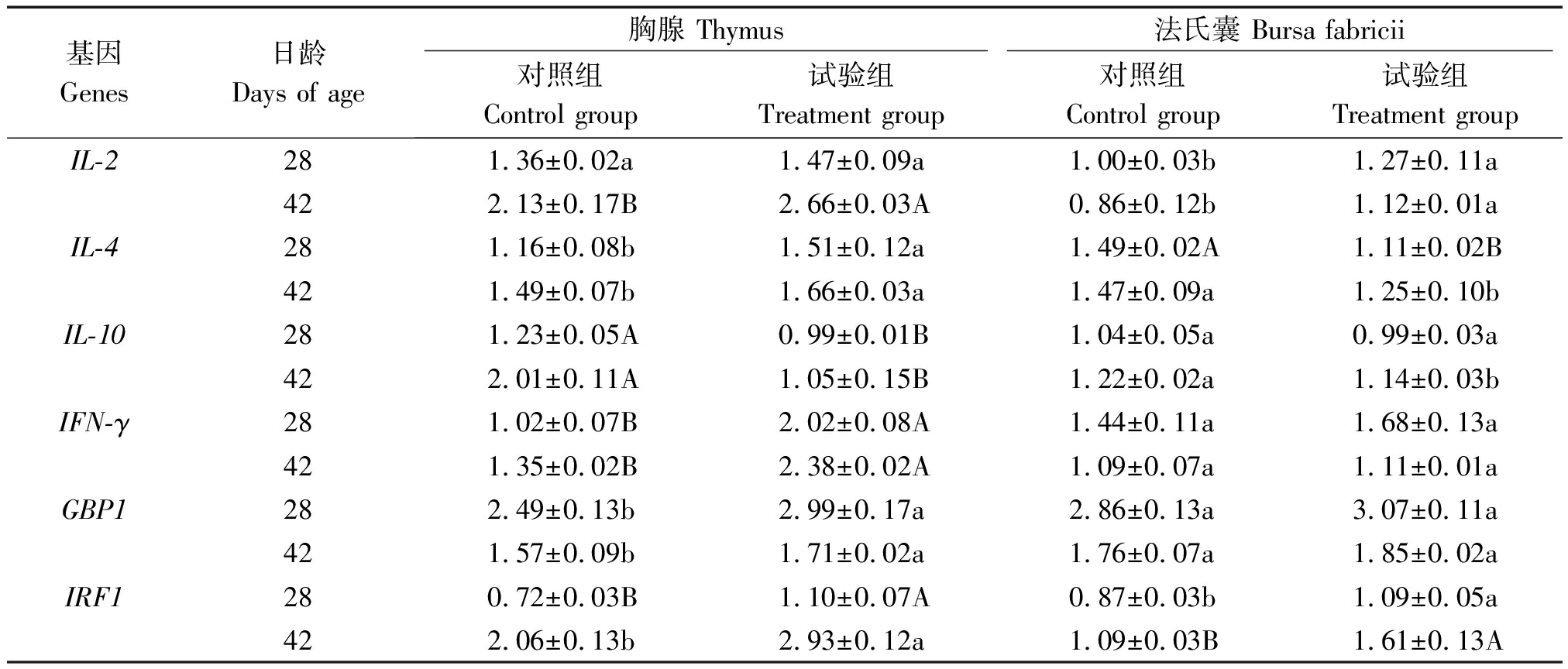
基因Genes日龄 Days of age胸腺 Thymus法氏囊 Bursa fabricii对照组Control group试验组Treatment group对照组Control group试验组Treatment groupIL-2281.36±0.02a1.47±0.09a1.00±0.03b1.27±0.11a422.13±0.17B2.66±0.03A0.86±0.12b1.12±0.01aIL-4281.16±0.08b1.51±0.12a1.49±0.02A1.11±0.02B421.49±0.07b1.66±0.03a1.47±0.09a1.25±0.10bIL-10281.23±0.05A0.99±0.01B1.04±0.05a0.99±0.03a422.01±0.11A1.05±0.15B1.22±0.02a1.14±0.03bIFN-γ281.02±0.07B2.02±0.08A1.44±0.11a1.68±0.13a421.35±0.02B2.38±0.02A1.09±0.07a1.11±0.01aGBP1282.49±0.13b2.99±0.17a2.86±0.13a3.07±0.11a421.57±0.09b1.71±0.02a1.76±0.07a1.85±0.02aIRF1280.72±0.03B1.10±0.07A0.87±0.03b1.09±0.05a422.06±0.13b2.93±0.12a1.09±0.03B1.61±0.13A
3 讨论与结论
3.1 蜡样芽孢杆菌PAS38对肉鸡生长性能和消化酶活性的影响
研究表明,日粮中添加适量益生菌有助于提高肉鸡的生长性能、饲料转化率、胴体形状、肌肉品质、提高存活率和抗病能力等[12-13]。叶玉娥等[14]研究表明,在饲料中添加蜡样芽孢杆菌BC1和蜡样芽孢杆菌BC2联合对提高肉鸡日增质量和降低料质量比的效果最佳(P<0.05)。本试验结果表明,蜡样芽孢杆菌PAS38对肉鸡的生长性能具有积极正向的影响,推测可能原因是蜡样芽孢杆菌PAS38具有调节肉鸡肠道菌群平衡[15],增强健康的同时,促进肉鸡肠道消化酶的活性,提高饲料的利用率,从而促进生长。动物对营养物质消化吸收的能力主要取决于其消化道内消化酶的活性高低,Bhatnagar等[16]在卷毛鲷饲料中添加蜡样芽孢杆菌,除了提高鱼的生长性能外,还可显著提高肠道中的蛋白酶、淀粉酶和纤维素酶活性(P<0.05); Reda等[17]研究表明,蜡样芽孢杆菌可显著提高胡子鲶的血清淀粉酶、蛋白酶、脂肪酶活性,提高鲶鱼生长性能。本研究在肉鸡饲粮中添加蜡样芽孢杆菌PAS38制剂,可显著提高肉鸡肠道淀粉酶、中性蛋白酶活性,这一结果与已报道的结果相似。
3.2 蜡样芽孢杆菌PAS38对肉鸡免疫功能的影响
胸腺、法氏囊和脾脏是禽类重要的免疫器官,其器官指数可用于评价禽类免疫状态,免疫球蛋白是介导体液免疫的主要抗体,血清抗体水平在一定程度上反映机体对疾病的抵抗能力。目前有大量的研究表明,益生菌和肠道菌群具有促进免疫器官的发育,提高免疫器官指数和血清的抗体滴度[18-19]。赵娜等[20]研究表明,凝结芽孢杆菌可显著提高肉鸡的免疫器官指数和血清球蛋白水平,凝结芽孢杆菌调节肉鸡的免疫功能可能是在消化道的识别抗原位上发挥其免疫佐剂的作用,活化免疫系统,强化机体的体液和细胞免疫水平。叶玉娥等[14]研究证实,蜡样芽孢杆菌BC1和蜡样芽孢杆菌BC2联合应用可显著提高肉鸡脾脏和法氏囊指数(P<0.05)。本研究发现,28 d试验组肉鸡的胸腺、法氏囊和脾脏指数均显著高于对照组(P<0.05),42 d时均极显著高于对照组(P<0.01),同时提高血清中免疫球蛋白水平(P<0.05和P<0.01),这一结果与上述报道相似,表明蜡样芽孢杆菌PAS38具有活化肉鸡免疫系统和促进免疫功能的作用。
潘康成等[8-9]采用免疫组化技术分析蜡样芽孢杆菌PAS38对家兔的小肠SS细胞和5-HT细胞的数量及其2种细胞的细胞因子进行测定,结果表明蜡样芽孢杆菌PAS38对家兔的免疫功能具有正面积极的作用。王春迪等[21]将蜡样芽孢杆菌PC465添加到凡纳滨对虾养殖水体中,可以明显降低养殖水体内弧菌数量,通过感染试验并采用qRT-PCR方法测定了对虾3种免疫相关基因的表达情况,益生菌处理组的LGBP、βGBP-HDL、Hsp70 mRNA的表达量呈显著上调趋势,结果提示,蜡样芽孢杆菌可提高对虾的抗感染能力,其作用机制可能是调节免疫相关基因的表达水平。本试验通过测定肉鸡血清中IL-2、IL-4和IFN-γ细胞因子,结果发现,42 d时血清中IL-2和IFN-γ含量,试验组中高于对照组,IL-4含量低于对照组,但差异不显著。进一步采用qRT-PCR测定免疫相关基因mRNA 转录水平,发现在试验组的胸腺和法氏囊组织中,具有促进免疫功能的IL-2、IFN-γ和抗菌活性相关基因GBP1(鸟苷酸结合蛋白1)、IRF1(干扰素调节因子1)的mRNA表达量均有不同程度的上调;具有免疫抑制作用的IL-10 mRNA的表达下调;具有活化T-细胞产生的IL-4 mRNA在胸腺组织中显著上调,而在法氏囊组织中则呈显著和极显著下调,结果表明,肉鸡给予蜡样芽孢杆菌PAS38后,可能通过调节免疫相关基因mRNA的表达,从非特异性和细胞免疫方面增强免疫功能,增强机体抗病能力。
在饲料中添加蜡样芽孢杆菌PAS38制剂能促进肉仔鸡的生长性能和提高肠道消化酶活性,促进免疫器官的发育,通过调节免疫相关基因mRNA的转录水平,从而提高机体的非特异性免疫和细胞免疫,增强机体抗病能力。
[1] Bacanl M, Ba
M, Ba aran N. Importance of antibiotic residues in animal food[J]. Food and Chemical Toxicology, 2019, 125:462-466. doi:10.1016/j.fct.2019.01.033.
aran N. Importance of antibiotic residues in animal food[J]. Food and Chemical Toxicology, 2019, 125:462-466. doi:10.1016/j.fct.2019.01.033.
[2] 潘慧青,张炎达,肖建设.饲用益生芽孢杆菌在畜禽无抗养殖中的应用研究[J].中国饲料,2019(3):51-56. doi:10.15906/j.cnki.cn11-2975/s.20190312.
Pan H Q, Zhang Y D, Xiao J S. Study on the application of Bacillus probiotics used in antibiotic-free breeding [J]. China Feed, 2019(3):51-56.
[3] Kuebutornye F K A, Abarike E D, Lu Y S. A review on the application of Bacillus as probiotics in aquaculture [J]. Fish & Shellfish Immunology, 2019, 87: 820-828. doi:10.1016/j.fsi.2019.02.010.
[4] 陈连民,喻礼怀,王淑楠,李志兵,张艳云. 日粮添加巨大芽孢杆菌1259对蛋鸡生产性能及蛋品质的影响[J].华北农学报,2016,31(S1):480-484. doi:10.7668/hbnxb.2016.S1.082.
Chen L M, Yu L H, Wang S N, Li Z B, Zhang Y Y. Effects of dietary Bacillus magaterium 1259 supplementation on production performance and egg quality of laying hens [J]. Acta Agriculturae Boreali-Sinica, 2016, 31(S1):480-484.
[5] Altmeyer S, Kröger S, Vahjen W, Zentek J, Scharek-Tedin L. Impact of a probiotic Bacillus cereus strain on the jejunal epithelial barrier and on the NKG2D expressing immune cells during the weaning phase of piglets [J].Veterinary Immunology and Immunopathology, 2014,161(1-2):57-65. doi:10.1016/j.vetimm.2014.07.001.
[6] Zhao Y C, Yuan L, Wan J L, Sun Z X, Wang Y Y, Sun H S. Effects of potential probiotic Bacillus cereus EN25 on growth, immunity and disease resistance of juvenile sea cucumber Apostichopus japonicas[J]. Fish & Shellfish Immunology, 2016, 49:237-242. doi:10.1016/j.fsi.2015.12.035.
[7] Barba-Vidal E, Martín-Orúe S M, Castillejos L. Practical aspects of the use of probiotics in pig production: A review [J]. Livestock Science, 2019, 223:84-96. doi:10.1016/j.livsci.2019.02.017.
[8] 潘康成,陈正礼,崔恒敏,袁朝富,陈刚. 腊样芽孢杆菌PAS38和甘露聚糖制剂对家兔小肠SS及5-HT免疫阳性细胞的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(5): 578-584. doi:10.3785/j.issn.1008-9209.2009.05.01.
Pan K C, Chen Z L, Cui H M, Yuan C F, Chen G. Effect of Bacillus cereus PAS38 and mannosan preparation on immunoreactive cells of somatostatin and 5-HT in small intestine of rabbit [J]. Journal of Zhejiang University(Agriculture & Life Sciences)2009,35(5):578-584.
[9] 潘康成, 冯轼,崔恒敏,陈刚,陈正礼. 微生态制剂对幼兔生长及HPA轴5-HT能细胞的影响[J]. 动物营养学报, 2009, 21(6): 945-952. doi:10.3969/j.issn.1006-267x.2009.06.022.
Pan K C, Feng S, Cui H M, Chen G, Chen Z L. Effect of microecological preparation on growth performance and immunoreactive cells of 5-HT in Hypothalamus-pituitary-adrenal axis of rabbit [J]. Chinese Journal of Animal Nutrition, 2009, 21(6):945-952.
[10] 唐慧琴,王振华,潘康成,张娇,冯杰. 重组枯草芽孢杆菌SE1制剂对肉鸡生长、抗氧化能力及免疫功能的影响[J]. 中国预防兽医学报,2018,40(3):248-252. doi:10.3969/j.issn.1008-0589.201704045.
Tang H Q, Wang Z H, Pan K C, Zhang J, Feng J. Effect of recombinant Bacillus subtilis SE1 on the growth, antioxidant capacity and immune function of Broilers [J].Chinese Journal of Preventive Veterinary Medicine, 2018,40(3):248-252.
[11] 蔡杰,刘芸.醋酸纤维薄膜电泳法分离测定鸡血清蛋白质[J].贵州大学学报(自然科学版), 2006,23(1):94-95. doi:10.15958/j.cnki.gdxbzrb.2006.01.021.
Cai J, Liu Y. Isolate and determin the proteins of chicken serum by cellulose acetate membrane electrophoresis [J]. Journal of Guizhou University(Natural Sciences), 2006, 23(1):94-95.
[12] 谢文惠,姜宁,张爱忠.复合益生菌制剂对肉鸡生长性能、屠宰性能和免疫指标的影响[J].动物营养学报,2018,30(1):360-367. doi:10.3969/j.issn.1006-267x.2018.01.043.
Xie W H, Jiang N, Zhang A Z. Effects of compound probiotics on growth performance, slaughter performance and immune indices of broilers [J]. Chinese Journal of Animal Nutrition, 2018, 30(1):360-367.
[13] Hussein E, Selim S. Efficacy of yeast and multi-strain probiotic alone or in combination on growth performance, carcass traits, blood biochemical constituents, and meat quality of broiler chickens [J]. Livestock Science, 2018, 216:153-159. doi:10.1016/j.livsci.2018.08.008.
[14] 叶玉娥,叶明,张蓉,蔡振宇,胡士明,刘彩霞.芽孢杆菌制剂对艾维茵肉鸡胴体性能和肠道菌群的影响[J]. 浙江大学学报(农业与生命科学版),2012,38(3):305-310. doi:10.3785/j.issn.1008-9209.2012.03.011.
Ye Y E, Ye M, Zhang R, Cai Z Y, Hu S M, Liu C X. Effects of Bacillus preparation on carcass performance and intestinal microflora of avian broiler chicken [J]. Journal of Zhejiang University(Agric & Life Sci ), 2012,38(3):305-310.
[15] 冯兴.益生芽孢杆菌PAS38在肉鸡肠道中的消长规律及对肠道菌群调节作用研究[D].雅安:四川农业大学, 2009.
Feng X. Study on the regulation of probiotic Bacillus PAS38 in the intestinal tract of broilers and its effect on intestinal flora [D]. Ya,an: Sichuan Agricultural University, 2009.
[16] Bhatnagar A, Lamba R. Antimicrobial ability and growth promoting effects of feed supplemented with probiotic bacterium isolated from gut microflora of Cirrhinus mrigala [J]. Journal of Integrative Agriculture, 2015, 14(3): 583-592. doi:10.1016/S2095-3119(14)60836-4.
[17] Reda R M, El-Hady M A, Selim K M, El-Sayed H M. Comparative study of three predominant gut Bacillus strains and a commercial B. amyloliquefaciens as probiotics on the performance of Clarias gariepinus [J]. Fish and Shellfish Immunology, 2018, 80:416-425. doi:10.1016/j.fsi.2018.06.031.
[18] Daneshmand A, Sadeghi G H, Karimi A, Vaziry A, Ibrahim S A. Evaluating complementary effects of ethanol extract of propolis with the probiotic on growth performance, immune response and serum metabolites in male broiler chickens [J]. Livestock Science, 2015, 178:195-201. doi:10.1016/j.livsci.2015.04.012.
[19] Broom L J, Kogut M H. The role of the gut microbiome in shaping the immune system of chickens [J]. Veterinary Immunology and Immunopathology, 2018, 204: 44-51. doi:10.1016/j.vetimm.2018.10.002.
[20] 赵娜,申杰,魏金涛,张巍,陈芳,杨雪海,郭万正,杜金平,黄少文. 凝结芽孢杆菌对肉鸡生长性能、免疫器官指数、血清生化指标及肠道菌群的影响[J]. 动物营养学报, 2017, 29(1): 249-256. doi:10.3969/j.issn.1006-267x.2017.01.028.
Zhao N, Shen J, Wei J T, Zhang W, Chen F, Yang X H, Guo W Z, Du J P, Huang S W. Effects of Bacillus coagulans on growth performance, immune organ indexes, serum biochemical indexes and intestinal flora of broilers [J]. Chinese Journal of Animal Nutrition, 2017, 29(1):249-256.
[21] 王春迪,宋晓玲,张晓静,张盛静,孙新颖,刘宝彬,高文辉,黄倢. 养殖水体中添加蜡样芽孢杆菌PC465对凡纳滨对虾抗病力的影响[J].中国水产科学,2016, 23(1): 146-155. doi:10.3724/SP.J.1118.2016.15118.
Wang C D, Song X L, Zhang X J, Zhang S J, Sun X Y, Liu B B, Gao W H, Huang J. Effects of adding Bacillus cereus PC465 to rearing water on disease resistance of Litopenaeus vannamei [J].Journal of Fishery Sciences of China, 2016,23(1):146-155.