醋酸钙不动杆菌(Acinetobacter calcoaceticus)是自然界水、土壤以及医院环境中普遍存在的一种条件致病菌[1-4]。Dickie等[5]报道,于患有肌炎和败血症的母马体内分离出醋酸钙不动杆菌。Das等[6]报道,在三例流产水牛中分离出该菌而得到重视。Kuzi等[7]报道,该菌可引起猫狗肺炎,尿路感染,败血症等。根据以往报道醋酸钙不动杆菌已从10例患有脑膜炎的儿童中被分离出来[8]。本研究从吉林省某牛场患病牛肺脏分离得到1株细菌,命名为9-1,经鉴定确定其为醋酸钙不动杆菌。对分离得到的醋酸钙不动杆菌进行致病性检测和药物敏感性试验,并对β-内酰胺类的4种耐药基因进行检测,以期对由该菌引起的疾病做深一步的研究。
1 材料和方法
1.1 病料来源与背景
吉林省松原市某养殖场送检1头病死牛,眼见变化该牛体态消瘦,鼻周围有黏性液体。剖检死亡牛,取其肺脏进行细菌分离培养。通过对畜主的询问,得知该牛病程初期精神不振,食欲减退,体温升高至40.5 ℃,伴有咳嗽;后期多表现为呼吸系统症状且急速消瘦。
1.2 培养基及试剂
TSA固体培养基、TSB液体培养基。细菌生化微量鉴定管购自杭州微生物试剂有限公司。10×Buffer、dNTP Mixtur、Ex TaqDNA聚合酶、DNA Marker DL2000、pMD18-T载体 、切胶回收试剂盒购自宝生物工程技术服务公司。庆大霉素、链霉素、氟苯尼考、头孢唑啉、头孢噻肟等12种抗菌药物购自杭州微生物试剂有限公司。
1.3 试验动物
16只健康昆明小鼠,雌雄数量各占一半,体质量均为(30±5) g,购自吉林大学的实验动物中心。
1.4 细菌分离培养
取肺脏,表面灭菌,用高压后的接种环沾取肺脏里部无菌划线接种于TSA固体培养基上,恒温培养箱中37 ℃需氧培养24 h,随后进行细菌纯化培养,挑取纯化后单个菌落于TSB液体培养基中24 h增殖培养,备用。
1.5 形态学观察
从TSA固体培养基中挑取单个菌落于载玻片上,无菌生理盐水稀释,加热固定,进行革兰氏染色,显微镜下油镜观察菌体形态特征。
1.6 生化试验
以柠檬酸盐、葡萄糖、果糖、蔗糖、DL-乳酸盐等12种生化试剂对分离菌株进行生化检测。试验结果参照《伯杰氏细菌鉴定手册》进行对比。
1.7 小鼠致病性试验
根据预试验计算出菌株9-1 其LD50为2.35×1011 cfu/mL,将16只健康昆明小鼠分成4组,其中1组作为对照组,腹腔注射无菌生理盐水0.3 mL/只,其他以平板计数法将TSB液体培养基中的细菌悬液浓度调定为3个浓度梯度,分别为2.35×1010,2.35×1011,2.35×1012 cfu/mL,以相同的方式注射0.3 mL/只,每6 h记录小鼠精神状态及死亡情况,剖检死亡小鼠,采集病变组织并进行细菌分离培养。
1.8 分离菌株16S rDNA基因序列测定及建立系统进化树
取2.0 mL备用菌液,以12 000 r/min离心10 min,收集菌体,按照细菌基因组DNA提取试剂盒说明提取DNA(购自生工生物工程公司),并用作16S rDNA基因PCR扩增的模板。通过Primer Premier 5.0软件设计引物,预期目的片段大小为1 500 bp左右。
上游引物:5′-ATCCGCTATTTACCCAGTGG-3′,下游引物:5′-GCTGTAAACGAACTCGCCAC-3′。反应体系:DNA模板0.5 μL,10×Buffer 2.5 μL,dNTP 2.0 μL,Ex Taq 0.2 μL,上游引物1 μL,下游引物1 μL,dd水补充至25 μL。反应条件:94 ℃ 5 min;94 ℃ 1 min,50 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
混合2.5 μL PCR的扩增产物与0.4 μL 6×Loading Buffer(购自生工生物工程公司),通过1%琼脂糖凝胶电泳检测并进行切胶回收,连接,转化,提取质粒及鉴定,将纯化质粒送往生工生物工程(上海)技术服务有限公司进行核苷酸序列测定。
将16S rDNA测序结果与GenBank数据库进行Blast分析比对,并应用MEGA 7.0软件构建系统进化树。
1.9 药物敏感性试验
选用近年来兽医临床上常见的12种药物:头孢噻肟、阿米卡星、庆大霉素、阿奇霉素等,采用微量稀释法测定MIC(Minimum inhibitory concentration)。根据美国临床和实验室标准协会的标准[8]判定其耐药情况。
1.10 β-内酰胺耐药基因检测
采用常规PCR法检测4种β-内酰胺耐药基因。耐药基因引物及参考文献见表1。
反应体系:DNA模板4.0 μL,10×Buffer 2.5 μL,dNTP 2.0 μL,Ex Taq 0.3 μL,上游引物1 μL,下游引物1 μL,dd水补充至25 μL。反应条件:94 ℃5 min;94 ℃ 1 min,退火1 min,72 ℃1 min,30个循环;72 ℃延伸10 min,将扩增产物经琼脂糖凝胶电泳进行检测。
表1 耐药基因PCR引物序列、终产物长度及参考文献
Tab.1 Primer sequence final product length and references of PCR gene

耐药基因Resistance gene序列Sequence片段大小Fragment size退火温度/℃Annealing temperature参考文献ReferenceTEMF: ATGAGTATTCAACATTTCCGT 53559[9]R: TTACCAATGCTTAATCAGTGADHAF: AACTTTCACAGGTGTGCTGGGT 50459[10]R: CCGTACGCATACTGGCTTTGCOXA-23F: GATGTGTCATAGTATTCGTCG1 06752[11]R: TCACAACAACTAAAAGCACTGOXA-58F: CGATCAGAATGTTCAAGCGC 52852[12]R: ACGATTCTCCCCTCTGCGC
2 结果与分析
2.1 细菌的分离培养
分离得到1株菌,将其命名为9-1,纯化后使用9线法划于TSA培养基上,生长出白色菌落及单个菌株,圆形且边缘不齐,表面凸起(图1)。

图1 分离菌株菌落形态
Fig.1 Colony morphology of the isolate
2.2 形态学观察结果
在油镜下观察分离菌株为短杆状,单个或成双排列,两端钝圆的革兰阴性菌(图2)。
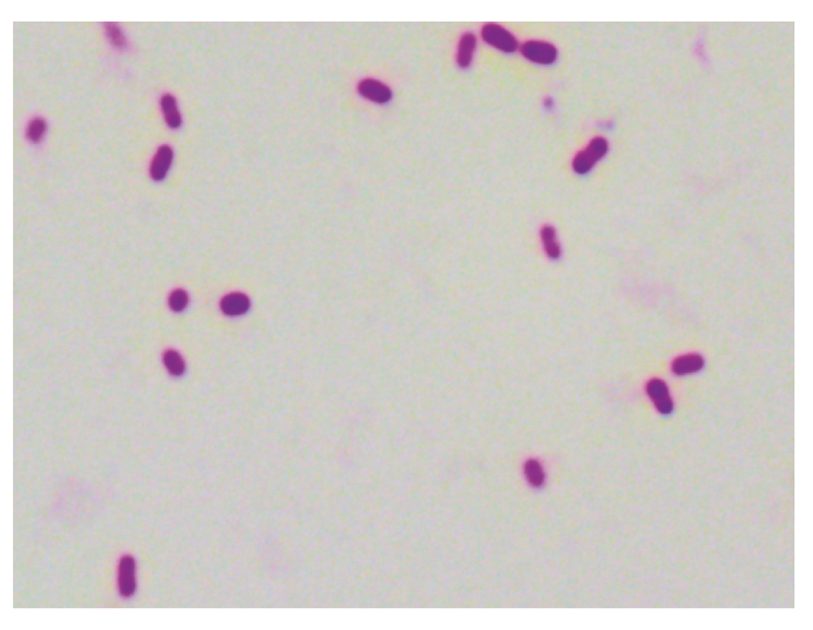
图2 革兰染色镜检结果(1 000×)
Fig.2 Gram staining results(1 000×)
2.3 生化试验结果
生化试验结果参照《伯杰氏细菌鉴定手册》,分离菌株的生理生化特性与醋酸钙不动杆菌的生理生化特性基本一致(表2),初步确定为醋酸钙不动杆菌。
表2 菌株9-1生理生化特性
Tab.2 Physiological and biochemical characteristics of isolate 9-1
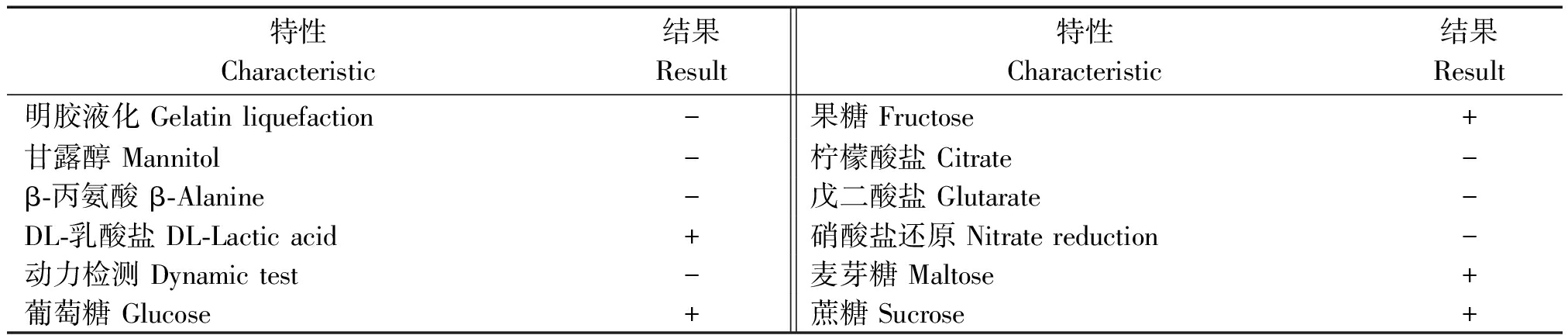
特性Characteristic结果Result特性Characteristic结果Result明胶液化 Gelatin liquefaction-果糖 Fructose+甘露醇 Mannitol-柠檬酸盐 Citrate-β-丙氨酸 β-Alanine-戊二酸盐 Glutarate-DL-乳酸盐 DL-Lactic acid+硝酸盐还原 Nitrate reduction-动力检测 Dynamic test-麦芽糖 Maltose+葡萄糖 Glucose+蔗糖 Sucrose+
注:+.阳性;-.阴性。表5同
Note:+. Positive; -. Negative. The same as Tab.5.
2.4 动物致病性试验结果
接种后第6 h观察小鼠出现厌食、被毛粗乱、拱背、敏感焦躁;12 h观察试验组中有4只小鼠死亡,其他小鼠均出现精神萎靡、呼吸急促症状;24 h观察试验组中有2只小鼠死亡;第3天观察时,试验组中的小鼠出现转归,开始进水进食、精神状态逐渐恢复(表3)。剖检死亡小鼠,发现小鼠肠道明显肿胀、有出血点,肠壁变薄,脾脏肿胀、充血(图3)。对照组4只小鼠状态良好。
表3 菌株9-1对小鼠的致病性
Tab.3 Pathogenicity of 9-1 to mice
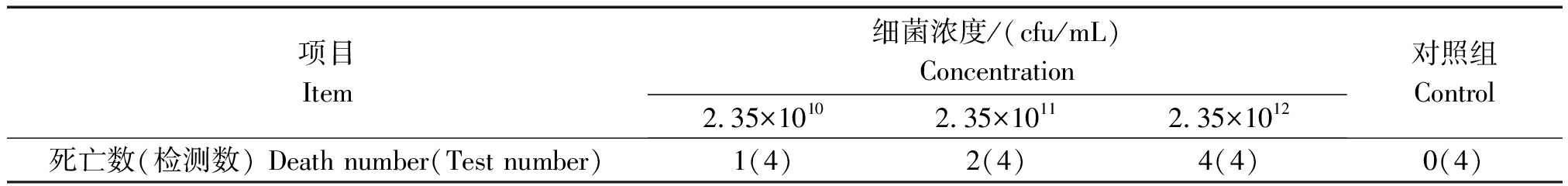
项目Item细菌浓度/(cfu/mL)Concentration2.35×10102.35×10112.35×1012对照组Control死亡数(检测数) Death number(Test number)1(4)2(4)4(4)0(4)
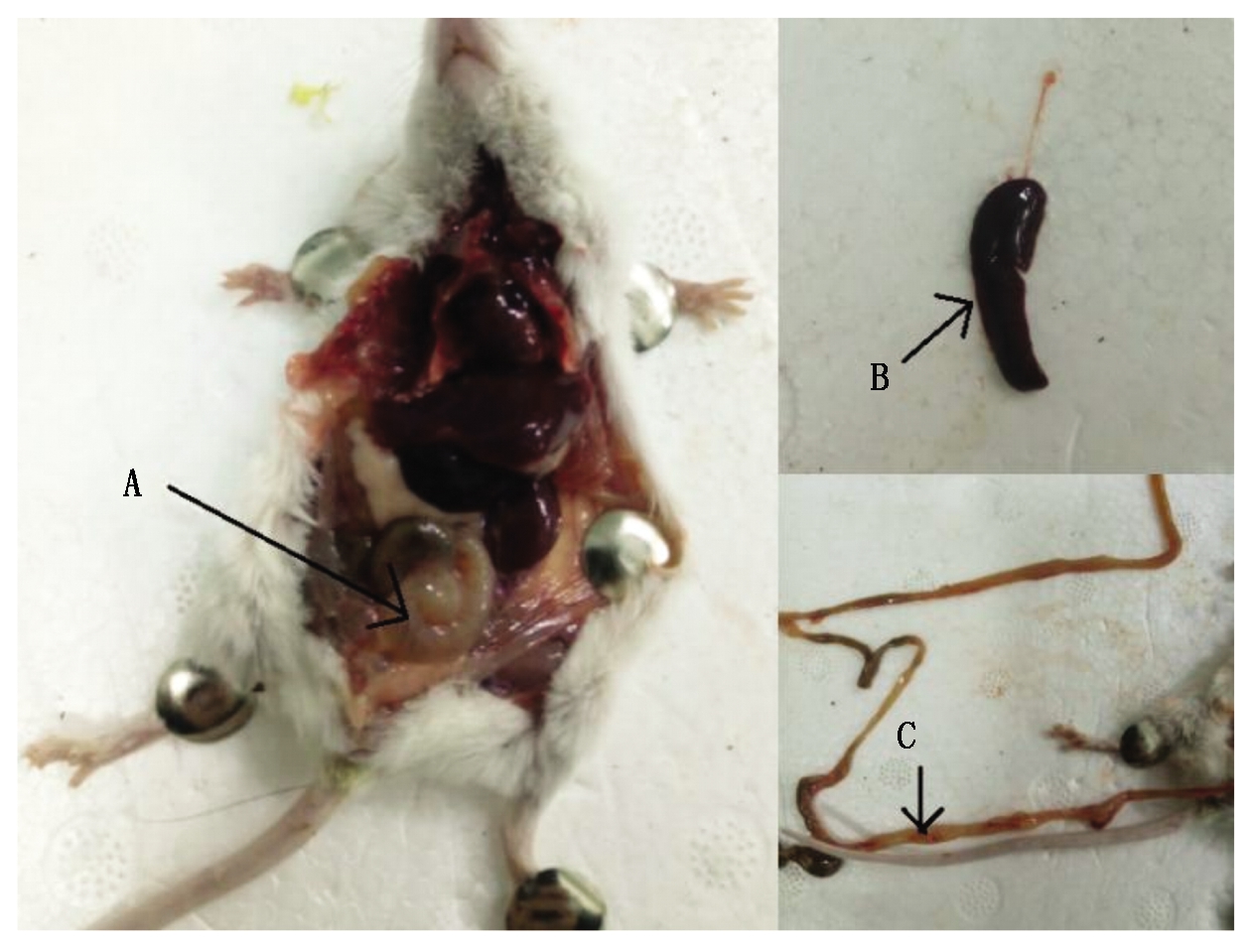
A.肠道肿胀;B.脾脏变黑;C.肠道出血点。
A.Intestinal swelling; B.Spleen darkens; C.Intestinal bleeding point.
图3 小鼠剖检观察
Fig.3 Observation of mice
2.5 分离菌株16S rDNA基因的PCR检测结果
PCR检测结果(图4)显示,得到的条带为1 424 bp,与预期大小相符,证明扩增成功。将测得序列上传至GenBank,经比较与醋酸钙不动杆菌(Acinetobacter calcoaceticus)的相似度为99%,证明该分离菌株9-1为醋酸钙不动杆菌。
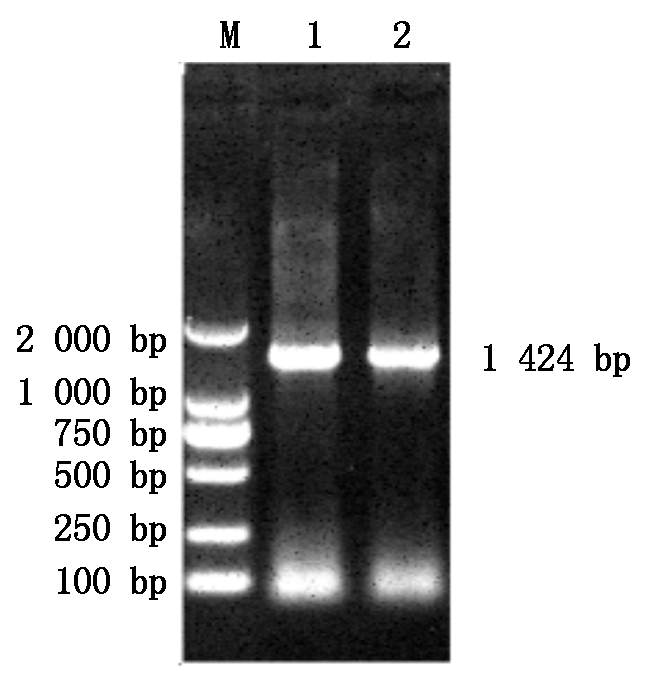
M.DNA分子质量标准;1和2.9-1 16S rDNA的PCR产物。
M.DL2000 DNA Marker; 1 and 2.PCR-amplified
16S rDNA gene from strain 9-1.
图4 16S rDNA扩增结果
Fig.4 16S rDNA amplification results
2.6 系统进化树的构建
测序结果在GenBank数据库中进行Blast分析比对,并与不动杆菌属的其他种构建进化树,结果(图5)显示,该分离菌与醋酸钙不动杆菌(JN9343383.1)同在一个分支,表明该分离菌为醋酸钙不动杆菌。
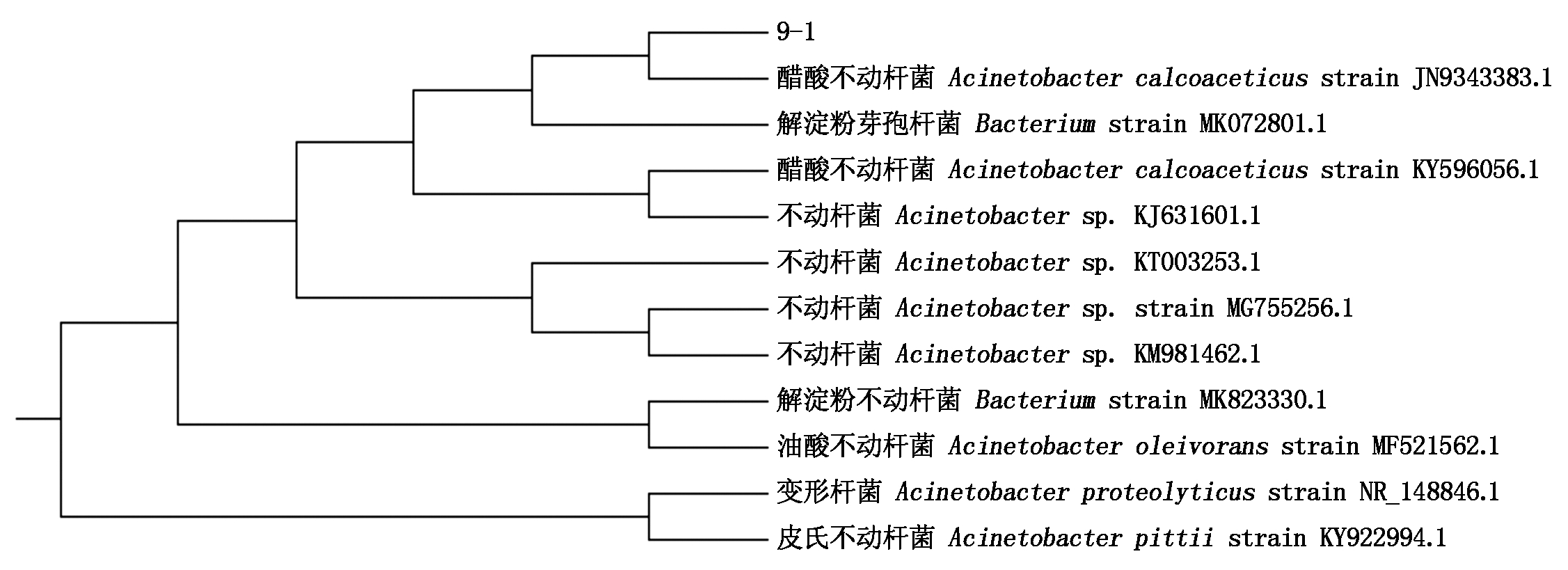
图5 菌株9-1株与相关菌株的系统发育树
Fig.5 Phylogenetic tree constructed by 9-1 strain and other Acinetobacter strains
表4 菌株9-1药敏试验结果
Tab.4 Drug susceptibility test results of strain 9-1
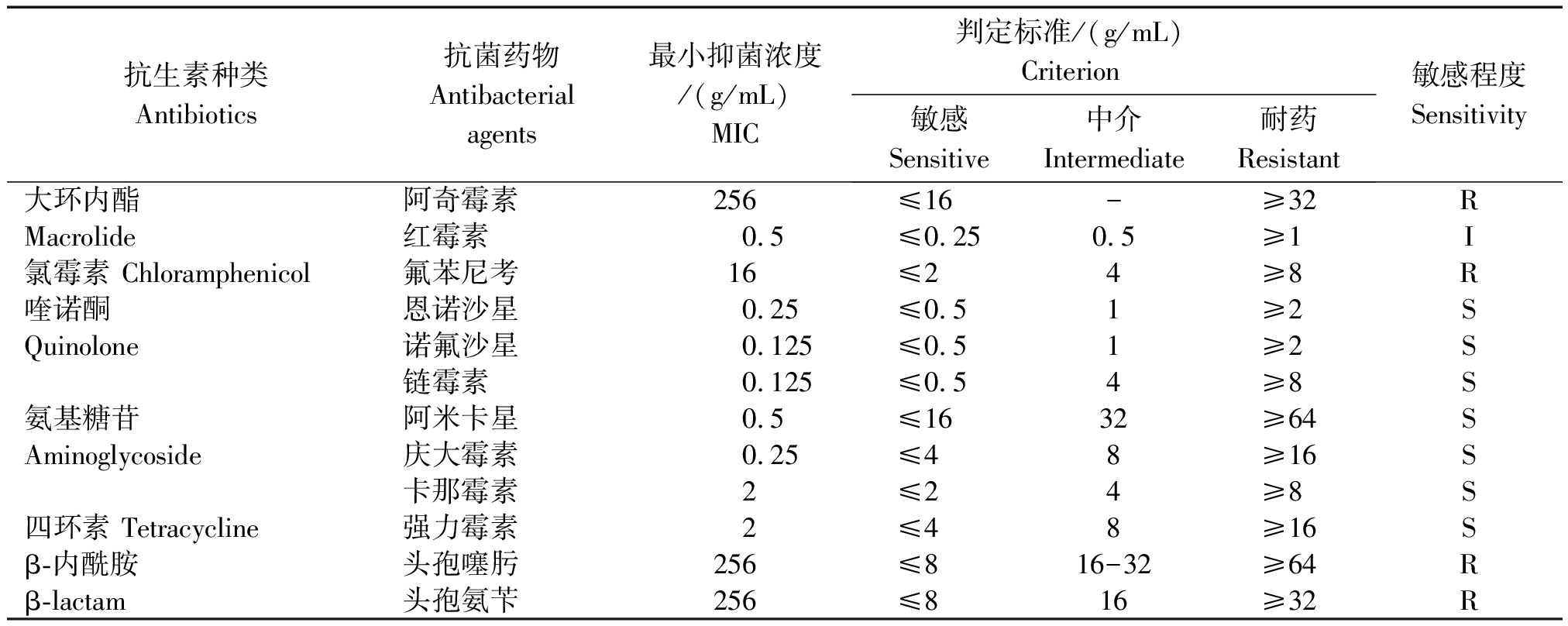
抗生素种类Antibiotics抗菌药物Antibacterial agents最小抑菌浓度/(g/mL) MIC判定标准/(g/mL)Criterion敏感 Sensitive中介 Intermediate耐药 Resistant敏感程度Sensitivity大环内酯阿奇霉素256≤16-≥32RMacrolide红霉素0.5≤0.250.5≥1I氯霉素 Chloramphenicol氟苯尼考16≤24≥8R喹诺酮恩诺沙星0.25≤0.51≥2SQuinolone诺氟沙星0.125≤0.51≥2S链霉素0.125≤0.54≥8S氨基糖苷阿米卡星0.5≤1632≥64SAminoglycoside庆大霉素0.25≤48≥16S卡那霉素2≤24≥8S四环素 Tetracycline强力霉素2≤48≥16Sβ-内酰胺头孢噻肟256≤816-32≥64Rβ-lactam头孢氨苄256≤816≥32R
2.7 药敏试验结果
采用微量稀释法对分离菌株进行12种抗菌药物MIC值的测定,参照美国临床和实验室标准协会的标准,药敏结果(表4)显示,分离菌株对头孢噻肟、头孢氨苄、氟苯尼考和阿奇霉素显著耐药,对红霉素的敏感性偏低。
2.8 β-内酰胺耐药基因检测结果
对β-内酰胺类(TEM、DHA、OXA-23、OXA-58)耐药基因进行检测,共计4种基因皆为阴性(表5)。
表5 分离菌株4种抗生素耐药基因检测结果
Tab.5 Test results of four antibiotic
resistance genes of the isolate
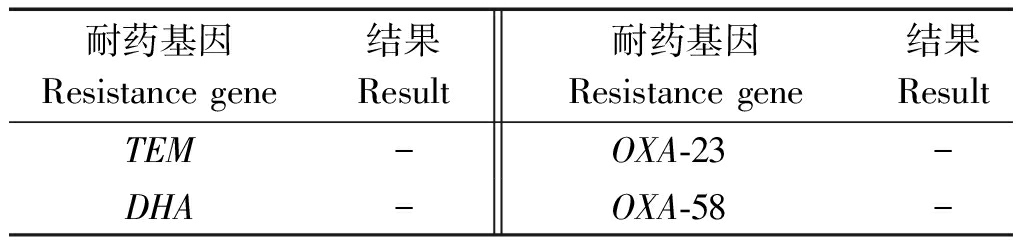
耐药基因Resistance gene结果Result耐药基因Resistance gene结果ResultTEM-OXA-23-DHA-OXA-58-
3 讨论
不动杆菌是荷兰微生物学家Beijerinck于1911年首次从土壤中分离得到,非发酵糖类、专性需氧、氧化酶阴性、无鞭毛、无芽孢、不运动的革兰氏阴性杆菌[13-15]。1986年Bouvet和Grimont[16]使用DNA杂交技术将该菌属分为12个基因种,并且对其中的一些种进行了正式命名。不动杆菌在自然界分布广泛,如水、土壤、蔬菜等,也可以从人体皮肤和家畜体内分离得到,其中以醋酸钙不动杆菌(Acinetobacter calcoaceticus)和鲍曼不动杆菌(Acinetobacter baumanii)为代表,是重要的条件致病菌[17-19]。
本试验于死亡牛肺脏中分离得到一株优势菌,命名为9-1,经形态特征观察、生化特性结果、结合16S rDNA基因的序列测定,使用MEGA7.0软件构建该分离菌株系统发育树,最终确定该分离株9-1为醋酸钙不动杆菌。动物致病性试验结果显示,分离菌株浓度为2×1012 cfu/mL时能够导致小鼠100%死亡,具有较强的致病性。药敏结果显示,该菌对卡那霉素、强力霉素、恩诺沙星、链霉素等8种药物敏感,对头孢噻肟、头孢氨苄、氟苯尼考和阿奇霉素显著耐药。头孢噻肟和头孢氨苄皆属于β-内酰胺类药物,因此,对β-内酰胺4种耐药基因进行检测,结果皆为阴性。分析该菌对β-内酰胺类药物产生耐药性的原因,由于当前牛群饲养过程中起主要危害的细菌性疾病,包括牛子宫内膜炎、隐形乳腺炎以及牛肠道疾病等,其较为有效的办法均为β-内酰胺类抗生素的使用,长此以往,耐β-内酰胺类的细菌被保留下来[20]。这提醒着养殖人员在病畜患病时应合理使用抗生素,避免耐药细菌甚至是超级细菌问题的产生。
防治由醋酸钙不动杆菌引起的细菌病,首要是改善饲养管理,严格实行兽医卫生监督,提高动物机体自身的免疫机能,加强圈舍环境卫生,同时需根据实际情况结合实验室检测科学的选用药物进行治疗。随着我国畜牧业的快速发展,滥用抗生素的情况日益严重,给临床治疗带来巨大挑战。因此,细菌耐药机制的研究成为当前科研工作者的主要研究方向,期望掌握其获得耐药基因的途径,合理、科学地选用药物,以获取更高的经济价值。
[1] Hunt J P, Buechter K J, Fakhry S M. Acinetobacter calcoaceticus pneumonia and the formation of pneumatoceles[J]. The Journal of Trauma: Injury, Infection, and Critical Care, 2000, 48(5):964-970. doi:10.1097/00005373-200005000-00027.
[2] 王旭. 我国不动杆菌的耐药性、遗传多态性及产NDM耐药菌研究[D]. 北京:中国人民解放军军事医学科学院, 2015.
Wang X. Study on drug resistance, genetic polymorphism and NDM-producing bacteria of acinetobacter in China[D]. Beijing:Academy of Military Medical Sciences, Chinese People′s Liberation Army, 2015.
[3] Hsu L Y, Apisarnthanarak A, Khan E, Suwantarat N, Ghafur A, Tambyah P A. Carbapenem-resistant Acinetobacter baumannii and Enterobacteriaceae in South and Southeast Asia[J]. Clinical Microbiology Reviews, 2017, 30(1):1-22. doi:10.1128/cmr.00042-16.
[4] De Vos D, Pirnay J P, Bilocq F, Jennes S, Verbeken G, Rose T, Keersebilck E, Bosmans P, Pieters T, Hing M, Heuninckx W, De Pauw F, Soentjens P, Merabishvili M, Deschaght P, Vaneechoutte M, Bogaerts P, Glupczynski Y, Pot B, van der Reijden T J, Dijkshoorn L. Molecular epidemiology and clinical impact of Acinetobacter calcoaceticus-baumannii complex in a Belgian Burn Wound Center[J]. PLoS One, 2016, 11(5):e0156237. doi: 10.1371/journal.pone.0156237.
[5] Dickie C W, Regnier J O. Equine myositis and septicemia caused by Acinetobacter calcoaceticus infection[J]. Journal of the American Veterinary Medical Association, 1978, 172(3):357-359.
[6] Das A M, Paranjape V L. Acinetobacter calcoaceticus in three cases of late abortion in water buffaloes[J]. Veterinary Record, 1986, 118(8):214. doi:10.1136/vr.118.8.214.
[7] Kuzi S, Blum S E, Kahane N, Adler A, Hussein O, Segev G, Aroch I. Multi-drug-resistant, Acinetobacter calcoaceticus-Acinetobacter baumannii, complex infection outbreak in dogs and cats in a veterinary hospital[J]. Journal of Small Animal Practice, 2016, 57(11):617-625. doi:10.1111/jsap.12555.
[8] Filka J, Huttova M, Schwartzov D, Kurak M, Krcméryov
D, Kurak M, Krcméryov T, Tuharsk J, Kralinsk
T, Tuharsk J, Kralinsk K, Sagét T, Krcmér
K, Sagét T, Krcmér V Jr. Nosocomial meningitis due to Acinetobacter calcoaceticus in 10 children after ventriculoperitoneal shunt insertion[J].The Journal of Hospital Infection, 2000, 44(1):76-77. doi:10.1053/jhin.1999.0641.
V Jr. Nosocomial meningitis due to Acinetobacter calcoaceticus in 10 children after ventriculoperitoneal shunt insertion[J].The Journal of Hospital Infection, 2000, 44(1):76-77. doi:10.1053/jhin.1999.0641.
[9] 彭黎明, 周林涛. 美国临床实验室标准化委员会更名为临床和实验室标准协会[J]. 中华检验医学杂志, 2005, 28(8):875-876. doi:10.3760/j:issn:1009-9158.2005.08.040.
Peng L M, Zhou L T. The American clinical laboratory standardization committee was renamed the clinical and laboratory standards association[J]. Chinese Journal of Laboratory Medicine, 2005, 28(8): 875-876.
[10] 张静, 赵水娣, 张之烽. 南京市部分地区医院感染鲍曼不动杆菌的耐药基因和分子流行病学研究[J]. 国际检验医学杂志, 2017,38(1):74-79. doi:10.3969/j.issn.1673-4130.2017.01.028.
Zhang J, Zhao S D, Zhang Z F. Study on drug resistance genes and molecular epidemiology of Acinetobacter baumanii in some areas of Nanjing City[J]. International Journal of Laboratory Medicine, 2017, 38(1):74-79.
[11] 杨燕, 肖慈然, 邹玖明, 李智山. 多重耐药鲍曼不动杆菌β-内酰胺类耐药基因研究[J]. 中国感染控制杂志, 2015, 14(10):658-662. doi:10.3969/j.issn.1671-9638.2015.10.003.
Yang Y, Xiao C R, Zou J M, Li Z S. Study on drug resistance genes for β-lactams in multidrug-resistant Acinetobacter baumannii[J].Chinese Journal of Infection Control, 2015, 14 (10): 658-662.
[12] 葛忆琳, 陈越火, 徐春华, 王致, 沈伟. 医院重症监护室环境分离鲍氏不动杆菌携带耐药相关基因研究[J]. 中华医院感染学杂志, 2017,27(19): 4344-4347. doi:10.11816/cn.ni.2017-170358
Ge Y L, Chen Y H, Xu C H, Wang Z, Shen W. Related resistant genes carried by Acinetobacter baumannii strains isolated from the environment of intensive care unit (ICU)[J]. Chinese Journal of Nosocomiology, 2017, 27(19): 4344-4347.
[13] 黄育波, 张天托, 朱家馨, 郑文争, 吴文斌, 李慧, 彭宣宪. 医院获得性肺炎患者醋酸钙-鲍曼不动杆菌复合体的鉴定和耐药基因研究[J]. 实用医学杂志, 2015, 31(3):476-481. doi:10.3969/j.issn.1006-5725.2015.03.046
Huang Y B, Zhang T T, Zhu J X, Zheng W Z, Wu W B, Li H, Peng X X. Identification and drug resistance genes study of Acinetobacter calcoaceticus-A. baumannii complex from patients with hospital acquired pneumonia[J]. Journal of Practical Medicine, 2015, 31 (3): 476-481.
[14] Bochniarz M, Adaszek  , Dzięgiel B, Nowaczek A, Wawron W, Dąbrowski R, Szczubia
, Dzięgiel B, Nowaczek A, Wawron W, Dąbrowski R, Szczubia M. Winiarczyk S. Factors responsible for subclinical mastitis in cows caused by Staphylococcus chromogenes and its susceptibility to antibiotics based on bap, fnbA, eno, mecA, tetK, and ermA genes[J].Journal of Dairy Science, 2016, 99(12):9514-9520. doi:10.3168/jds.2016-11723.
M. Winiarczyk S. Factors responsible for subclinical mastitis in cows caused by Staphylococcus chromogenes and its susceptibility to antibiotics based on bap, fnbA, eno, mecA, tetK, and ermA genes[J].Journal of Dairy Science, 2016, 99(12):9514-9520. doi:10.3168/jds.2016-11723.
[15] Aali R, Nikaeen M, Khanahmad H, Hejazi Z, Kazemi M, Hassanzadeh A. Occurrence of tetracycline resistant bacteria and resistance gene (fetw) in hospital and municipal wastewaters[J].Fresenius Environmental Bulletin,2014, 23(10A): 2560-2566.
[16] Bouvet P J M, Grimont P A D. Identification and biotyping of clinical isolates of Acinetobacter[J]. Annales De linstitut Pasteur, 1987, 138(5):569-578. doi:10.1016/0769-2609(87)90042-1.
[17] 李德宪, 谭守勇. 医院感染不动杆菌属控制进展[J]. 广东医学, 2015,36(12):1807-1809.doi:10.13820/j.cnki.gdyx.20150630.004.
Li D X, Tan S Y. Progress in the control of Acinetobacter spp. nosocomial infection[J]. Guangdong Medical Journal, 2015,36 (12): 1807-1809.
[18] Haseley S R, Holst O, Brade H. Structural and serological characterisation of the o-antigenic polysaccharide of the lipopolysaccharide from Acinetobacter haemolyticus strain ATCC 17906[J]. European Journal of Biochemistry, 2010, 244(3):761-766. doi:10.1111/j.1432-1033.1997.00761.x.
[19] De Vos D, Pirnay J P, Bilocq F, Jennes S, Verbeken G, Rose T, Keersebilck E, Bosmans P, Pieters T, Hing M, Heuninckx W, De Pauw F, Soentjens P, Merabishvili M, Deschaght P, Vaneechoutte M, Bogaerts P, Glupczynski Y, Pot B, van der Reijden T J, Dijkshoorn L. Molecular Epidemiology and Clinical Impact of Acinetobacter calcoaceticus-baumannii Complex in a Belgian Burn Wound Center[J]. PLoS One, 2016, 11(5):e0156237. doi:10.14264/uql.2015.970.
[20] 张晶. 动物源性大肠杆菌对氨基糖苷类药物耐药及其相关机制的研究[D]. 长春:吉林农业大学, 2006.
Zhang J. Resistance of animal-derived Escherichia coli to aminoglycosides and related mechanisms[D]. Changchun:Jilin Agricultural University, 2006.