板栗(Castanea mollissima Blume)属壳斗科栗属植物,是我国特色干果之一[1]。泰山板栗果实营养丰富、味道甘美,在国内外享有较高声誉,市场需求逐年增加。由于板栗果实采后呼吸旺盛,其产生的热量及物质消耗易使品质衰变。因此,板栗在贮藏期间极易受到微生物的侵袭而产生霉变,被认为是贮藏难度较大的坚果之一。我国板栗每年因贮藏不当、栗实霉烂而造成的损失高达板栗年总产量的25%[2-3]。这不仅给生产者带来巨大的经济损失,也使板栗的保鲜期和货架期缩短[4]。板栗的贮藏期病害已成为近20 a来坚果生产上的一大难题,深受社会有关方面的关注。
贮藏过程中的板栗果实腐烂主要由多种真菌复合侵染所致。戴桂馥等[5]从采用菌落分离法贮藏期板栗中发现5种病原菌,其中小穴壳菌(Dothiorella gregria)、炭疽菌(Colletotrichum gloeosporioides)和阜孢霉菌(Papularia sp.)由病种仁中分离得到,青霉(Penicillium sp.)和酵母菌由板栗表面孢子稀释分离得到。傅本重等[6]采用ITS-RFLP技术分析发现,孝感板栗实腐病菌主要为葡萄座腔菌(Botryosphaeria neofusicoccum)和镰刀菌(Fusarium)。梁丽松等[2]从板栗主产区的腐烂栗果中分离出11个属病原物,分别为拟茎点霉菌(Phomopsis sp.)、茎点霉菌(Phoma sp.)、镰刀菌、盘多毛孢菌(Pestalotia sp.)、大茎点菌(Macrophomoa sp.)、小穴壳菌、链格孢菌(Alternaria sp.)、丝核菌(Rhizoctonia sp.)、炭疽菌、青霉菌和毛霉菌(Mucor sp.)。
也有研究报道称,板栗腐烂病的发生与品种有密切关系[7]。燕山早丰是由河北农林科学院昌黎果树研究所从迁西县汉儿庄乡杨家峪村实生树中选出,具有成熟早、抗病、耐旱等特点[8]。山东是我国板栗生产的第一主产区,其种植面积和产量占全国25%左右,育成品种占全国38%左右[9]。泰山周边区域的板栗栽培历史悠久,分布着丰富的古板栗资源。古栗的留存可为经济林的丰产栽培、良种选育提供丰富的历史经验和不可多得的优质“基因库”[10]。本研究采用高通量测序技术分析了冷贮条件下,泰安市岱岳区黄前镇大峪村(hqdy)、角峪镇洪河村(jyhh)、下港镇砖瓦窑(zwy)、祝阳镇麻塔村(mtgl)和祝阳镇桐花沟古栗(thg1)及燕山早丰(yszf)栗壳和栗仁的真菌多样性和相对丰度,以期为探索板栗贮藏期病害致病原因、成灾机理,筛选抗病种质资源以及病害科学防治提供理论基础。
1 材料和方法
1.1 样品采集
贮藏板栗样品的采集地点为山东省泰安市岱岳区黄前镇板栗冷库。贮藏温度-2~-1 ℃,相对湿度85%~90%。贮藏方式为麻袋单层包装,每袋板栗质量约50 kg。入库时间为2018年9月29日至10月12日,各品种板栗在同一冷库内随机摆放。
2019年1月10日,对6个品种进行取样,每个品种设10个取样点,每点取样20粒左右,充分混匀后分为3份,每份为1个重复。以蘸有磷酸缓冲液的无菌拭子擦取板栗壳表面微生物后,将拭子置于无菌离心管中,干冰保存待送样。栗壳表面经75%乙醇消毒后,以手术刀剖开栗壳,切取栗仁装于无菌离心管中,干冰保存送样。
1.2 测序分析
栗壳表面和果肉的真菌群落结构分析由北京诺禾致源科技股份有限公司代理完成。
采用 CTAB法提取基因组DNA,以琼脂糖凝胶电泳检测其纯度和浓度,以无菌水稀释至1 ng/μL。以上述稀释后的基因组 DNA 为模板,使用带 Barcode 的ITS1区特异性引物(ITS5-1737F和ITS2-2043R)进行PCR,鉴定其真菌多样性。
PCR产物经2%的琼脂糖凝胶电泳检测,根据浓度进行等量混样,以1×TAE 的2%琼脂糖凝胶电泳纯化,切胶回收目标条带。使用Thermofisher的建库试剂盒进行文库构建,经过Qubit 定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。
1.3 信息分析
使用Cutadapt(V1.9.1)先对reads进行低质量部分剪切,截去Barcode和引物序列,初步质控得到原始数据(Raw reads),reads序列通过与物种注释数据库进行比对检测嵌合体序列,并去除嵌合体序列[11],得到最终的有效数据(Clean reads)。
利用Uparse软件(v7.0.1001)[12]对所有样品的全部有效数据进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational taxonomic units)。依据算法原则,筛选OTUs中出现频数最高的35个序列作为代表序列,用Qiime软件(Version 1.9.1)的Blast法与Unit(Version 7.2)数据库对其进行物种注释分析,并分别统计各样本在各分类水平的群落组成。使用MUSCLE(Version 3.8.31)软件[13]进行快速多序列比对,得到所有OTUs序列的系统发生关系。最后对各样品以数据量最少的为标准进行均一化处理,用于后续的Alpha和Beta多样性分析。
使用Qiime软件(Version 1.9.1)计算Alpha多样性指数。使用R软件(Version 2.15.3)绘制稀释曲线,并进行Alpha多样性指数组间差异分析。用Qiime软件(Version 1.9.1)计算Unifrac距离、构建UPGMA样本聚类树。使用R软件(Version 2.15.3)的WGCNA、stats和ggplot2软件包绘制PCoA(主坐标分析,Principal co-ordinates analysis)图。Metastats分析使用R软件在各分类水平下进行组间的permutation test,得到P值,然后对P值进行修正,得到q值。AMOVA分析使用mothur软件amova函数。组间差异显著的物种分析利用R软件做组间T_test检验并作图。
2 结果与分析
2.1 不同品种板栗样本测序结果与质控
通过高通量测序分析,36个样本的高通量测序分析共获得原始序列2 982 789条,通过与物种注释数据库进行比对,检测嵌合体序列,并去除嵌合体序列,得到有效序列2 852 054条,各处理的片段平均长度为218.3~251.0,有效率为93.2%~98.3%。有效数据可用于样本间微生物丰度和多样性的评估(表1)。
由图1可以看出,随着测序量的增加,各样本的稀释曲线均逐渐趋于平缓,表明本试验取样合理,当前测序深度能够满足真菌群落结构分析的需求。
2.2 不同品种板栗贮藏期真菌多样性及相对丰度比较
采用Qiime软件的Blast法与Unit(Version 7.2)数据库进行比对,从6个品种板栗的栗壳和栗仁中鉴定得到9门、35目、162科、289属,其中子囊菌门(Ascomycota)真菌占54.3%,担子菌门(Basidiomycota)真菌占17.6%。由图2可以看出,不同品种板栗栗壳和栗仁的真菌种类和相对丰度差异较大。祝阳镇麻塔古栗壳(mtgl.s)的银耳科真菌(Papiliotrema)和多泡角石属真菌(Polydesmia)的相对丰度较高,麻塔古栗仁(mtgl.p)的双足囊菌属(Dipodascus)、伊萨酵母属(Issatchenkia)、筒孢霉属(Cylindrium)真菌的相对丰度较高。桐花沟栗壳(thgl.s)的树粉孢属(Oidiodendron)、支顶孢属(Acremonium)真菌的相对丰度较高,桐花沟栗仁(thgl.p)的腐皮壳属(Diaporthe)、赤霉菌属(Gibberella)真菌的相对丰度较高。黄前镇大峪村古栗壳(hqdy.s)的银耳属(Tremella)和枝孢属(Cladosporium)真菌的相对丰度较高,黄前大峪古栗仁(hqdy.p)的镰孢菌属、葡萄座腔菌属真菌的相对丰度较高。下港镇砖瓦窑古栗栗壳的斑替支孢霉(Cladophialophora)、枝孢属和青霉属真菌的相对丰度较高,砖瓦窑古栗栗仁的子囊菌门拟盘多毛孢属(Pestalotiopsis)真菌的相对丰度较高。角峪镇洪河村古栗栗壳的季也蒙酵母(Meyerozyma)和踝节菌属(Talaromyces)真菌的相对丰度较高,角峪镇洪河村古栗栗仁的隔孢伏革属(Peniophora)和木霉属(Trichoderma)真菌的相对丰度较高。燕山早丰栗壳的青霉菌属和白冬酵母属(Leucosporidium)、木拉克酵母属(Mrakia)真菌的相对丰度较高,燕山早丰栗仁的炭疽菌属真菌的相对丰度较高。
表1 各样本序列数据统计
Tab.1 Statistics of sample sequences data
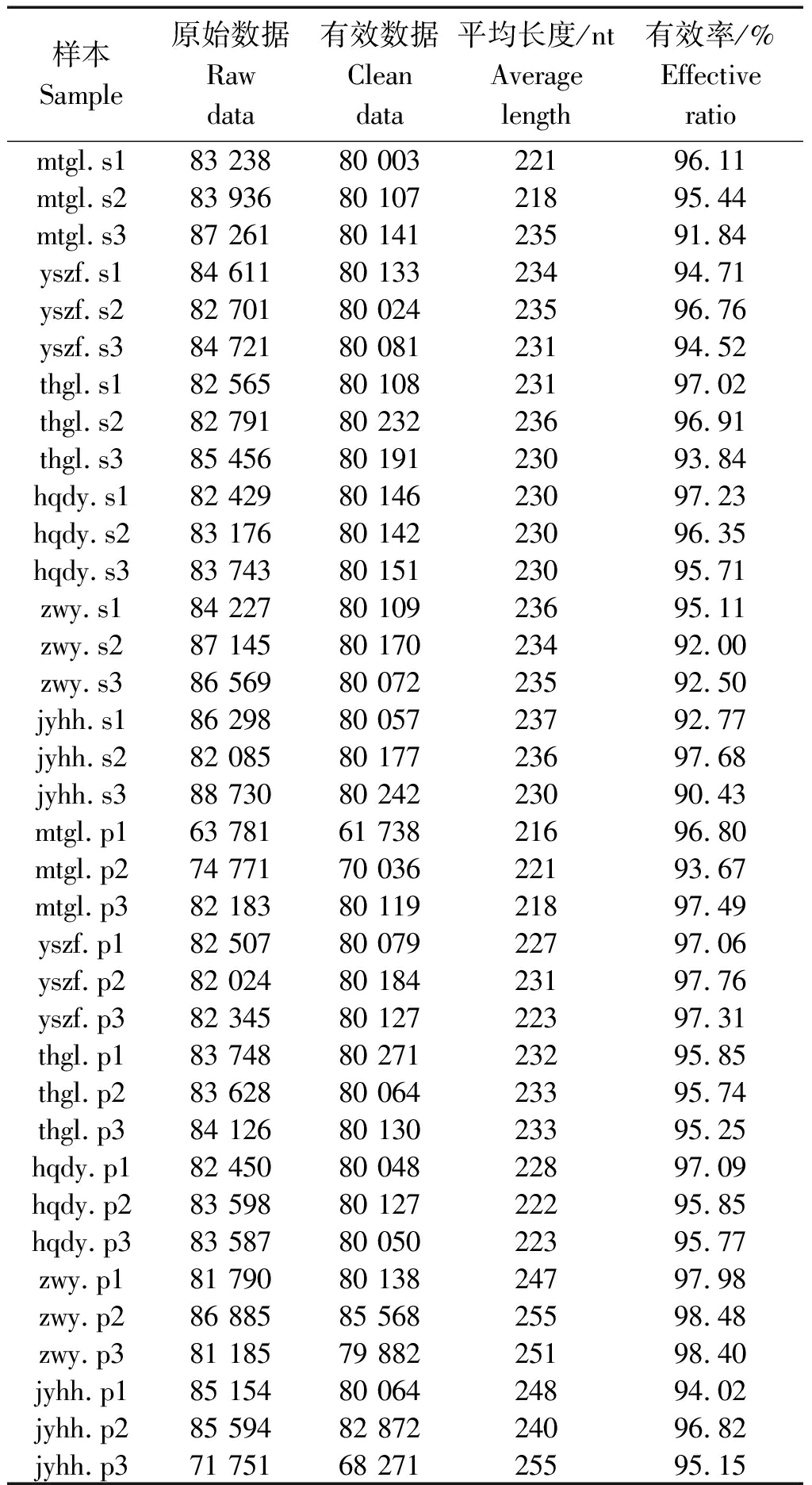
样本Sample原始数据Raw data有效数据Clean data平均长度/ntAverage length有效率/%Effective ratiomtgl.s183 23880 00322196.11mtgl.s283 93680 10721895.44mtgl.s387 26180 14123591.84yszf.s184 61180 13323494.71yszf.s282 70180 02423596.76yszf.s384 72180 08123194.52thgl.s182 56580 10823197.02thgl.s282 79180 23223696.91thgl.s385 45680 19123093.84hqdy.s182 42980 14623097.23hqdy.s283 17680 14223096.35hqdy.s383 74380 15123095.71zwy.s184 22780 10923695.11zwy.s287 14580 17023492.00zwy.s386 56980 07223592.50jyhh.s186 29880 05723792.77jyhh.s282 08580 17723697.68jyhh.s388 73080 24223090.43mtgl.p163 78161 73821696.80mtgl.p274 77170 03622193.67mtgl.p382 18380 11921897.49yszf.p182 50780 07922797.06yszf.p282 02480 18423197.76yszf.p382 34580 12722397.31thgl.p183 74880 27123295.85thgl.p283 62880 06423395.74thgl.p384 12680 13023395.25hqdy.p182 45080 04822897.09hqdy.p283 59880 12722295.85hqdy.p383 58780 05022395.77zwy.p181 79080 13824797.98zwy.p286 88585 56825598.48zwy.p381 18579 88225198.40jyhh.p185 15480 06424894.02jyhh.p285 59482 87224096.82jyhh.p371 75168 27125595.15
注:样本标注为品种.壳/仁。
Note: Samples were labeled as variety.s(shell)/p(pip).

图1 各样本的稀释曲线
Fig.1 Dilution curve of each sample

图2 不同品种板栗真菌属水平相对丰度
Fig.2 Fungus relative abundance in genus level of different chestnut varieties
表2 不同品种板栗的真菌α-多样性指数比较
Tab.2 α-diversity index comparison of different varieties of chestnut
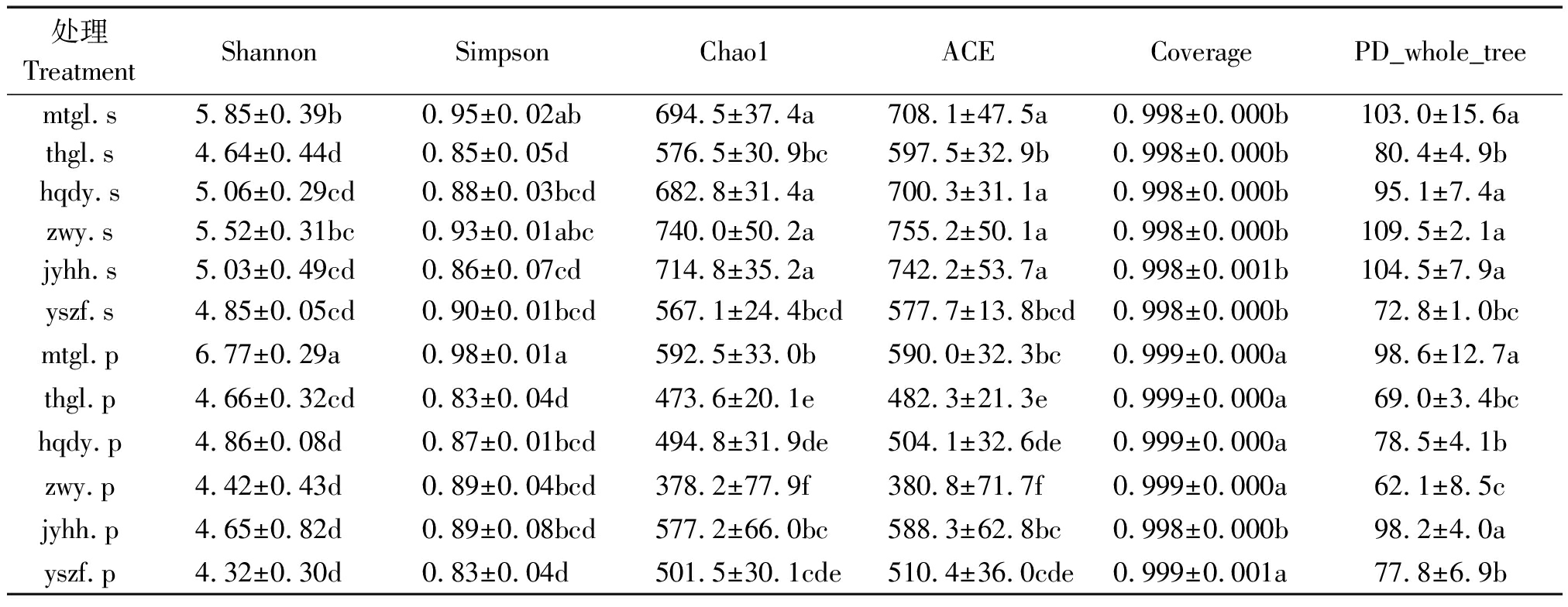
处理 TreatmentShannonSimpsonChao1ACECoveragePD_whole_treemtgl.s5.85±0.39b0.95±0.02ab694.5±37.4a708.1±47.5a0.998±0.000b103.0±15.6athgl.s4.64±0.44d0.85±0.05d576.5±30.9bc597.5±32.9b0.998±0.000b80.4±4.9bhqdy.s5.06±0.29cd0.88±0.03bcd682.8±31.4a700.3±31.1a0.998±0.000b95.1±7.4azwy.s5.52±0.31bc0.93±0.01abc740.0±50.2a755.2±50.1a0.998±0.000b109.5±2.1ajyhh.s5.03±0.49cd0.86±0.07cd714.8±35.2a742.2±53.7a0.998±0.001b104.5±7.9ayszf.s4.85±0.05cd0.90±0.01bcd567.1±24.4bcd577.7±13.8bcd0.998±0.000b72.8±1.0bcmtgl.p6.77±0.29a0.98±0.01a592.5±33.0b590.0±32.3bc0.999±0.000a98.6±12.7athgl.p4.66±0.32cd0.83±0.04d473.6±20.1e482.3±21.3e0.999±0.000a69.0±3.4bchqdy.p4.86±0.08d0.87±0.01bcd494.8±31.9de504.1±32.6de0.999±0.000a78.5±4.1bzwy.p4.42±0.43d0.89±0.04bcd378.2±77.9f380.8±71.7f0.999±0.000a62.1±8.5cjyhh.p4.65±0.82d0.89±0.08bcd577.2±66.0bc588.3±62.8bc0.998±0.000b98.2±4.0ayszf.p4.32±0.30d0.83±0.04d501.5±30.1cde510.4±36.0cde0.999±0.001a77.8±6.9b
注:表中数据表示为平均值±标准误,同列数据后不同字母表示在0.05水平上差异显著。
Note: Data in the table were shown as average±s,different letters in the same column meant significant difference at 0.05 level.
2.3 不同品种板栗的贮藏期真菌的α-多样性指数比较
在α-多样性指数中,Chao1和ACE用于表征菌群丰度,Shannon用于表征菌群多样性, Simpson用于表征优势度,Coverage 用于表征测序深度, PD_whole_tree 用于表征系统发育多样性[14-15]。由表2可以看出,各品种板栗栗壳的Shannon和Simpson指数分别为4.64~5.85和0.85~0.95,其波动范围低于各品种栗仁的4.32~6.77和0.83~0.98,可见栗仁的真菌多样性和优势度受品种影响较大。祝阳镇麻塔村古栗栗壳和栗仁的Shannon指数分别为5.85和6.77,Simpson指数分别为0.95和0.98,均高于其他品种,可见该品种古栗的真菌多样性和优势度较高。各品种板栗栗壳的Chao1和ACE指数均高于栗仁,其中祝阳镇麻塔村古栗栗壳的Chao1和ACE指数最高,分别为740.0和755.2,可见该品种板栗栗壳的菌群丰度较高。各品种板栗栗壳和栗仁的Coverage均超过0.998,其中栗仁的Coverage高于栗壳,可见各处理的测序深度均较高。各品种的PD_whole tree指数差别较大,祝阳镇麻塔村古栗和角峪镇洪河村古栗栗壳和栗仁的PD_whole tree指数均较高,表明其系统发育多样性较高;下港镇砖瓦窑古栗的栗壳PD_whole tree指数为109.5,栗仁为62.1,差异最大,表明该品种栗壳和栗仁的真菌系统多样性差异较大。
2.4 各品种板栗栗壳和栗仁的真菌多样性及丰度比较
由图3可以看出,对于下港镇砖瓦窑古栗,栗壳的踝节菌属丰度显著高于栗仁,腐皮壳属和壳三毛孢属(Robillarda)显著低于栗仁,拟盘多毛孢属的丰度极显著低于栗仁。对于祝阳镇麻塔村古栗,栗壳的镰刀菌、葡萄座腔菌属、支顶孢属、隐球菌属(Cryptococcus)、红酵母属(Rhodotorula)丰度均显著低于栗仁。对于桐花沟古栗,栗壳的树粉孢属和踝节菌属真菌丰度分别显著和极显著高于栗仁,赤霉菌属(Gibberella)真菌丰度显著低于栗仁。对于角峪镇洪河村古栗,栗壳的青霉属和枝孢属真菌丰度显著高于栗仁,裂褶菌属(Schizophyllum)真菌丰度显著低于栗仁。对于黄前镇大峪村古栗,栗壳的银耳科、短梗霉属(Aureobasidium)、头束霉属(Cephalotrichum)真菌丰度显著高于栗仁,附球菌属(Epicoccum)、茎点霉属真菌丰度极显著高于栗仁,树粉孢属(Oidiodendron)真菌丰度极显著低于栗仁。对于燕山早丰品种,栗壳的木拉克酵母属、支顶孢属和茎点霉属真菌丰度显著高于栗仁,青霉菌属、银耳属真菌丰度极显著高于栗仁,炭疽菌属真菌的丰度显著低于栗仁。

不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。
Different lowercase letters indicated significant difference (P<0.05);Different capitals indicated highly significant difference (P<0.01).
图3 各品种板栗栗壳和栗仁的真菌属水平丰度比较
Fig.3 Abundance comparison of shell and pip for each chestnut variety
2.5 不同品种板栗栗壳和栗仁真菌群落结构的PCoA分析
PCoA分析是通过将一系列的特征向量和特征值排序,从多维数据中提取出最主要的元素和结构,并选取贡献率最大的主坐标组合进行作图展示。样本距离越接近,表示物种组成结构越相似[16]。由图4可以看出,祝阳镇麻塔村古栗(mtgl)、黄前镇大峪村古栗(hqdy)、桐花沟古栗(thgl)和燕山早丰(yszf)的栗壳和栗仁处理距离较近,表明其真菌群落结构相似度高;角峪镇洪河村古栗(jyhh)和下港镇砖瓦窑古栗(zwy)栗壳和栗仁处理距离较远,表明其真菌群落结构差异较大。
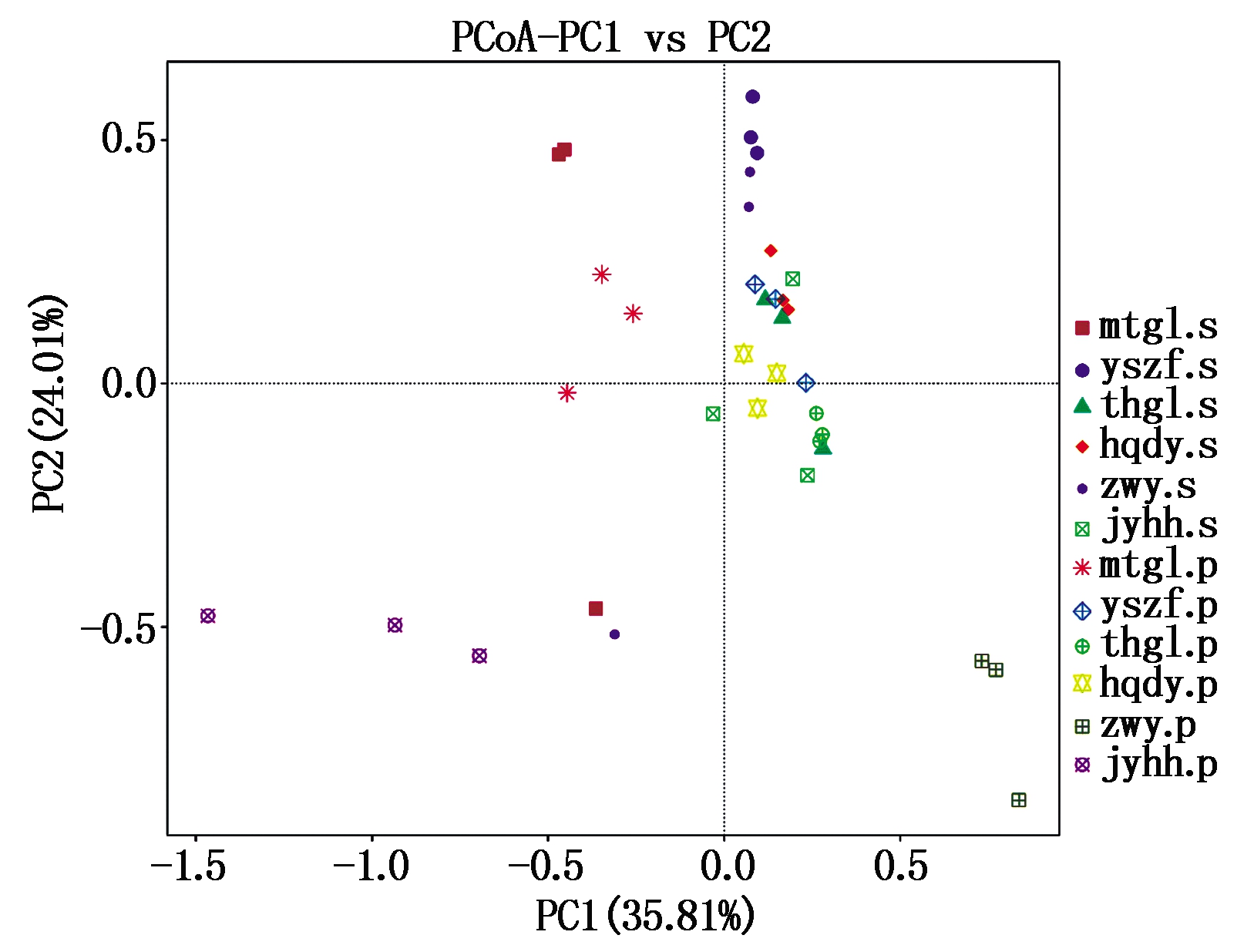
PC1.主成分1; PC2.主成分2。
PC1 and PC2 indicated principal component 1
and principal component 2 respectively.
图4 不同品种板栗栗壳和栗仁真菌群落结构的PCoA分析
Fig.4 PCoA analysis of shell and pip fungus
community structure of different chestnut varieties
3 讨论与结论
当前对板栗病原菌的分离鉴定多采用常规方法,仅可进行可培养病原微生物的分离鉴定,但对不可培养微生物的种类及其相对丰度无法进行系统分析[17]。高通量测序是通过PCR扩增,将目标区域DNA富集后进行测序的技术手段,具有测序深度高、可鉴定低丰度物种信息等优点,成为近年来微生物多样性分析的有效手段[18-19]。
本研究采用高通量测序技术分析了冷贮3个月后,泰安市岱岳区黄前镇大峪村、角峪镇洪河村、下港镇砖瓦窑和祝阳镇麻塔村古栗、桐花沟古栗以及燕山早丰栗壳和栗仁的真菌多样性和相对丰度,共获得有效序列2 852 054条,鉴定得到9门、35目、162科、289属,其中子囊菌门占比54.3%,担子菌门占比17.6%。本研究所采用的高通量测序方法能够深入阐释不同品种板栗的真菌种类和丰度差异。祝阳镇麻塔村古栗的双足囊菌属、伊萨酵母属和筒孢霉属真菌的丰度较高。桐花沟古栗的树粉孢属、支顶孢属、腐皮壳属和赤霉菌属真菌的丰度较高。黄前镇大峪村古栗的银耳属、枝孢属、镰孢菌属和葡萄座腔菌属真菌的丰度较高。下港镇砖瓦窑古栗的斑替支孢霉、枝孢属、青霉属和拟盘多毛孢属真菌的丰度较高。角峪镇洪河村古栗的季也蒙酵母、踝节菌属、隔孢伏革属和木霉属真菌的丰度较高。燕山早丰品种的青霉菌属、白冬酵母属、木拉克酵母属和炭疽菌属真菌的丰度较高。与前人报道的板栗实腐病致病菌比较发现[2],祝阳镇麻塔村古栗的致病菌较少,桐花沟古栗的致病菌主要为赤霉菌,黄前镇大峪村古栗的致病菌主要为镰孢菌和葡萄座腔菌,下港镇砖瓦窑古栗的致病菌主要为青霉菌,角峪镇洪河村古栗的致病菌主要为木霉,燕山早丰板栗的致病菌主要为青霉菌和炭疽菌,而丝核菌、链格孢菌则均未大量检出。
α多样性用于表征群落内生物种类数量以及生物种类间的相对丰度,反映了群落内物种间通过竞争或共生而产生的共存结果[20]。本研究对各品种板栗进行α-多样性指数分析发现,栗仁的真菌多样性和优势度受品种的影响大于栗壳,其中祝阳镇麻塔村古栗的真菌多样性和优势度较高。各品种板栗栗壳的菌群丰度均高于栗仁,其中祝阳镇麻塔村古栗栗壳的菌群丰度最高。祝阳镇麻塔村古栗和角峪镇洪河村古栗栗壳和栗仁真菌的系统发育多样性较高。
PCoA分析发现,对不同种质资源而言,祝阳镇麻塔村古栗、桐花沟古栗、黄前镇大峪村古栗和燕山早丰的栗壳和栗仁的真菌群落结构相似度高;角峪镇洪河村古栗和下港镇砖瓦窑古栗的栗壳和栗仁真菌群落结构差异较大,这也为后续有针对性地进行病原菌的分离、鉴定、致病力测定,以及抗病种质资源筛选提供了科学依据。
贮藏期板栗果实上的真菌来源复杂,不仅与品种有关,也与田间生长期管理、收获贮运操作等因素密切相关,今后需深入探讨,解析致病机理。
[1] 曹小艳, 李志, 张卿, 秦岭, 邢宇. 不同板栗品种(系)抗性淀粉综合评价[J]. 中国粮油学报, 2019, 34(7): 39-46. doi:10.3969/j.issn.1003-0174.2019.07.008.
Cao X Y, Li Z, Zhang Q, Qin L, Xing Y. Comprehensive evaluation of resistant starch in different Chinese chestnut varieties(lines) [J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(7): 39-46.
[2] 梁丽松, 王贵禧. 不同产区板栗病原菌的种类及其致病力研究[J]. 林业科学研究, 2003, 16(3): 284-288. doi:10.3321/j.issn:1001-1498.2003.03.006.
Liang L S, Wang G X. Studies on the varieties and pathogenic ability of the pathogenic fungi of Chinese chestnut seed in different production areas of China[J]. Forest Research, 2003, 16(3): 284-288.
[3] 吴小芹, 林树燕, 熊春红, 杨晓春. 贮藏方式对板栗品质及其微生物种类数量消长的影响[J]. 南京林业大学学报(自然科学版), 2001, 25(3): 47-51. doi:10.3969/j.issn.1000-2006.2001.03.011.
Wu X Q, Lin S Y, Xiong C H, Yang X C. Effects of different treatments on the quality and the microorganism′s kinds and quantities of chestnuts in storage[J]. Journal of Nanjing Forestry University(Natural Sciences Edition), 2001, 25(3): 47-51.
[4] 张馨方, 郭燕, 李颖, 张树航, 王广鹏. 板栗内腐病研究进展[J]. 中国植保导刊, 2018, 38(11): 25-28, 38. doi:10.3969/j.issn.1672-6820.2018.11.005.
Zhang X F, Guo Y, Li Y, Zhang S H, Wang G P. Research progress on chestnut seed rot[J]. China Plant Protection, 2018, 38(11): 25-28, 38.
[5] 戴桂馥,李宗伟, 王雁萍, 王付转, 吴健, 刘建华. 板栗贮藏中的病原菌及其控制[J]. 郑州大学学报(自然科学版), 2001, 33(1): 53-57. doi:10.3969/j.issn.1671-6841.2001.01.014.
Dai G F, Li Z W, Wang Y P, Wang F Z, Wu J, Liu J H. Pathogenetic fungi stored chestnut putrid in China and controlling methods[J]. Journal of Zhengzhou University, 2001, 33(1): 53-57.
[6] 傅本重, 王立华, 李国元, 徐东生, 王有宁, 章爱群, 邹礼平. 板栗实腐病菌rDNA-ITS的RFLP和测序分析[J]. 经济林研究, 2014, 32(2): 9-13, 18. doi:10.14067/j.cnki.1003-8981.2014.02.001.
Fu B Z, Wang L H, Li G Y, Xu D S, Wang Y N, Zhang A Q, Zou L P. RFLP and sequence analysis of rDNA-ITS in Castanea mollissima seed rot pathogens[J]. Nonwood Forest Research, 2014, 32(2): 9-13, 18.
[7] 易润华, 吴光金. 板栗腐烂机理及防腐保鲜技术的研究[J]. 中南林学院学报, 2000,20(2): 44-50. doi:10.14067/j.cnki.1673-923x.2000.02.010.
Yi R H, Wu G J. Research for the mechanism of Chinese chestnut putridity and the antiseptic and fresh-keeping technique[J]. Journal of Central South Forestry University, 2000, 20(2): 44-50.
[8] 武燕奇, 郭素娟. 5个板栗品种对干旱胁迫的生理响应及抗旱性评价[J]. 东北林业大学学报, 2017, 45(1): 20-24, 29. doi:10.13759/j.cnki.dlxb.2017.01.005.
Wu Y Q, Guo S J. Physiological response of five Chinese chestnut varieties of drought stress and evaluation of drought resistance[J]. Journal of Northeast Forestry University, 2017, 45(1): 20-24, 29.
[9] 艾呈祥, 余贤美, 张力思, 马玉敏, 苑克俊, 金松南, 刘庆忠. 山东板栗遗传多样性分析[J]. 果树学报, 2006, 23(5): 681-684. doi:10.13925/j.cnki.gsxb.2006.05.005.
Ai C X, Yu X M, Zhang L S, Ma Y M, Yuan K J, Jin S N, Liu Q Z. A study of genetic diversity of Castanea mollissima in Shandong[J]. Journal of Fruit Science, 2006, 23(5): 681-684.
[10] 刘国彬, 曹均, 王金宝, 兰彦平. 明清板栗古树遗传多样性的SSR分析[J]. 林业科学研究[J]. 2016, 29(6): 940-945. doi:10.13275/j.cnki.lykxyj.2016.06.021.
Liu G B, Cao J, Wang J B, Lan Y P. Genetic diversity analysis of ancient chestnut trees based on fluorescent SSR markers[J]. Forest Research, 2016, 29(6): 940-945.
[11] Nguyen N H, Song Z, Bates S T, Branco S, Tedersoo L, Menke J, Schilling J S, Kennedy P G. FUNGuild: An open annotation tool for parsing fungal community datasets by ecological guild[J]. Fungal Ecology, 2016, 20(1):241-248.doi:10.1016/j.funeco.2015.06.006.
[12] Haas B J, Gevers D, Earl A M, Feldgarden M, Ward D V, Giannoukos G, Ciulla D, Tabbaa D, Highlander S K, Sodergren E, Methé B, DeSantis T Z, The Human Microbiome Consortium, Petrosino J F, Knight R, Birren B W. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome research, 2011, 21(3): 494-504. doi:10.1101/gr.112730.110.
[13] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. doi:10.1038/nmeth.2604.
[14] 刘鹏飞, 红梅, 美丽, 赵巴音那木拉, 德海山, 白雪原, 李志新, 马玺. 玉米秸秆还田量对黑土区农田地面节肢动物群落的影响[J]. 生态学报, 2019, 39(1): 235-243. doi:10.5846/stxb201712062198.
Liu P F, Hong M, Mei L, Zhao B Y N M L, De H S, Bai X Y, Li Z X, Ma X. Impact of quantity of returned corn straw on the cropland ground arthropod community in a black soil area[J]. Acta Ecologica Sinica, 2019, 39(1): 235-243.
[15] 董艳辉, 于宇凤, 温鑫, 王亦学, 聂园军, 侯丽媛, 李亚莉, 刘江, 任元, 王育川, 曹秋芬, 吴慎杰, 王斌, 秦永军. 基于高通量测序的藜麦连作根际土壤微生物多样性研究[J]. 华北农学报, 2019, 34(2): 205-211. doi:10.7668/hbnxb.201751218.
Dong Y H, Yu Y F, Wen X, Wang Y X, Nie Y J, Hou L Y, Li Y L, Liu J, Ren Y, Wang Y C, Cao Q F, Wu S J, Wang B, Qin Y J. Studies on diversity of rhizosphere microorganism in quinoa continuous cropping soil by high throughput sequencing[J]. Acta Agriculturae Boreali-Sinica, 2019, 34(2): 205-211.
[16] Minchi P R. An evaluation of the relative robustness of techniques for ecological ordination[J]. Theory and Models in Vegetation Science, 1987, 69(1-3): 89-107.doi:10.1007/978-94-009-4061-1_9.
[17] 张爱梅, 韩雪英, 王嘉, 孔维宝, 牛世全, 朱学泰. 马衔山中国沙棘根瘤内共生细菌多样性研究[J]. 生态学报, 2019, 39(1): 294-301. doi:10.5846/stxb201711082004.
Zhang A M, Han X Y, Wang J, Kong W B, Niu S Q, Zhu X T. Diversity of endophytic bacteria in root nodules of Hippophae rhamnoides in the Maxian Mountains[J]. Acta Ecologica Sinica, 2019, 39(1): 294-301.
[18] Degnan P H, Ochman H. Illumina-based analysis of microbial community diversity[J]. The ISME Journal, 2012, 6(1): 183-194. doi:10.1038/ismej.2011.74.
[19] 吴朝晖, 刘清术, 孙继民, 周建群, 李鸿波, 袁隆平. 基于高通量测序的超级稻不同生育期土壤细菌和古菌群落动态变化[J]. 农业现代化研究, 2018, 39(2): 342-351. doi:10.13872/j.1000-0275.2018.0010.
Wu Z H, Liu Q S, Sun J M, Zhou J Q, Li H B, Yuan L P. Variations of soil bacterial and archaeal communities during super hybrid rice cultivation based on high throughput sequencing[J]. Research of Agricultural Modernization, 2018, 39(2): 342-351.
[20] 贺纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性, 2013, 21(4): 411-420. doi:10.3724/SP.J.1003.2013.10033.
He J Z, Li J, Zheng Y M. Thoughts on the microbial diversity-stability relationship in soil ecosystems[J]. Biodiversity Science, 2013, 21(4): 411-420.