镰孢菌属(Fusarium)可侵染黄瓜、西瓜、南瓜等葫芦科植物,其引起的根腐病是一类植物病害的总称,也是一种世界性土传病害[1]。1930年该病原菌在南非首次发现,随后在非洲、日本等不同国家相继报道,给当地生产造成了巨大的经济损失[2]。目前,该病害已在中国辽宁、山西、内蒙古等地相继发生,导致黄瓜产量损失严重[3]。现如今,随着温室大棚瓜类种植面积逐年扩大,且长期连作,导致品种抗性降低,加剧了黄瓜根腐病的发生,严重时整株枯死,甚至全棚绝收,给黄瓜主产区带来毁灭性打击[4]。
瓜类根腐病在世界范围内均有发生,该病原菌不仅能在土壤中越冬,还可种子带菌,具有传播速度快、防治困难等特点,一旦大面积发生,将会严重影响瓜类产量与品质。因此,建立一种瓜类病害早期、快速检测技术至关重要。目前,镰孢菌属的检测主要采用传统的平板分离法,耗时费力,不能满足快速鉴定的需求;常规 PCR 法快速、特异,但灵敏度有待进一步提高[5]。实时荧光定量PCR(RT-PCR)技术具有高灵敏度、高特异性以及可定量的优点,已成为植物病原体以及监控病原物感染的精确检测和定量分析的有效工具[6-10]。如史建荣等[11]构建了定量检测小麦生长期内根际土壤中镰孢菌属 Real-time PCR 检测方法,指导小麦枯萎病的早期预测与防控。
鉴于此,本研究以Fusarium的翻译延伸因子(TEF-1α)基因部分保守序列为靶基因序列,设计特异性引物,构建快捷、准确和定量检测Fusarium的 RT-PCR 方法,分析病残体内Fusarium在不同环境下菌含量DNA的动态变化并建立相关模型,为田间瓜类根腐病早期预测、风险评估和防治决策提供理论依据。
1 材料和方法
1.1 试验材料
供试菌株及植物材料:本试验所用的菌株及来源详见表1。 供试黄瓜品种:中农6号。
表1 供试菌株信息
Tab.1 Fungal strains for the PCR specificity test

序号Number标本号Code病原菌拉丁名Latin name病原菌名称Name of pathogen引起病害Disease1HG15051822Fusarium solani茄病镰孢菌黄瓜根腐病2HG17081402Fusarium oxysporum尖孢镰孢菌黄瓜枯萎病3XG11012402Pythium aphanidermatum瓜果腐霉菌西瓜猝倒病4KJ16022218Sclerotinia sclerotiorum核盘菌苦菊菌核病5FQ09092001Phytophthora infestans致病疫霉菌番茄晚疫病6LJ12010802Phytophthora capsici疫霉菌辣椒疫病7HG1603310804-1Botrytis cinerea灰葡萄孢菌黄瓜灰霉病8FQ14112206Stemphylium solani茄匍柄霉菌番茄匍柄霉叶斑病9KXC1512180122Rhizoctonia solani立枯丝核菌空心菜立枯病10KXC151218030602Rhizoctonia solani立枯丝核菌空心菜立枯病11KXC151218031211Rhizoctonia solani立枯丝核菌空心菜立枯病12HG14061105Corynespora cassiicola多主棒孢菌黄瓜棒孢叶斑病
注:以上病原菌由中国农科院蔬菜花卉所菜病综防组提供。
Note: The above viruses are provided by the the Institute of Vegetable and Flowers,Chinese Academy Agricultural Sciences.
主要仪器设备:XMTD-700水浴锅(江苏省金坛市汉康电子有限公司);3K15型高速离心机(德国Sigma公司);DYY-6C型电泳仪(北京市六一仪器厂);Jel Doc 2001型凝胶成像系统(BIO-RAD,美国);移液枪(德国Eppendorf公司);Bio-Rad S1000 PCR仪(美国伯乐公司);ABI 7500荧光定量PCR仪(BIO-RAD,美国);HPG-280H型光照培养箱(中国哈尔滨东联电子公司);HZQ-F160型摇床(中国哈尔滨东联电子公司)等。
试验试剂:植物基因组DNA提取试剂盒(DP305-03)、土壤基因组DNA提取试剂盒(DP336-02)、SuperReal PreMix Plus试剂盒(FP205-02),购自天根生物科技(北京)有限公司;TaqMix(MT201),购自博迈德科技(北京)有限公司。
1.2 引物设计与合成
使用Primier 5.0 软件,根据GenBank中Fusarium的翻译延伸因子(TEF-1α)基因部分保守序列设计1对引物F8-1(5′-GCTTCTCCCGAGTCCCA-3′)和F8-2(5′-GCTCAGCGGCTTCCTAT-3′),该引物序列由北京博迈德科技有限公司合成。
1.3 引物特异性
对12种蔬菜病原菌DNA(表1)进行提取,以ddH2O为阴性对照,应用引物F8-1/F8-2进行常规PCR和RT-PCR扩增,检测引物特异性。
常规PCR反应体系:2×Taq PCR Master Mix 10 μL,上下游引物各 0.4 μL,DNA模板 1 μL,ddH2O补足至20 μL。反应程序:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃补充延伸5 min。PCR产物经2%琼脂糖凝胶电泳(110 V,40 min)检测后,凝胶成像系统分析结果。
RT-PCR反应体系:SYBR Green Mix 10 μL,上下游引物各0.2 μL,模板1 μL,50×Reference Dye ROX加入0.4 μL,ddH2O补足至20 μL。反应条件为:95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火32 s,40个循环。在升温时收集荧光信号,建立融解曲线。
1.4 引物灵敏性
基因组 DNA 经超微量分光光度计测定浓度后按 10 倍稀释,分别釆用常规 PCR 和RT-PCR 的扩增方法进行 PCR 检测,根据扩增片段的有无和荧光值的大小,评价引物在2种 PCR 技术下对镰孢菌 DNA 检测的灵敏度。
1.5 重组质粒的制备
采用离心柱型琼脂糖凝胶回收试剂盒(全式金,北京)对 PCR 扩增产物进行回收纯化。将目标 DNA 与 p EASY®-T1 克隆载体(全式金,北京)连接,转化大肠杆菌 Trans1-T1 感受态细胞(全式金,北京)。取 200 μL 菌液涂布在含有 100 g/mL苄青霉素的 LB 固体平板培养基上,置于37 ℃ 恒温培养室倒置培养 24 h。随机挑取一定数量的白色单菌落,在含 100 g/mL的 LB 液体培养基中振荡培养。PCR 鉴定为阳性克隆后,随机选取10个阳性克隆,送北京博迈德生物公司测序。
1.6 标准曲线的构建
将镰孢菌特异性引物扩增后PCR产物纯化,连接PMD-20-T载体并转化至大肠杆菌DH5α中,经Amp抗性和菌落PCR筛选,提取并检测带有目的片段的质粒。
将阳性重组质粒DNA进行10倍梯度稀释浓度范围,使用引物F8-1/F8-2进行RT-PCR扩增,以质粒浓度对数值为横坐标,以Ct值为纵坐标,构建RT-PCR标准曲线。
1.7 RT-PCR 定量检测病残体内菌含量动态变化
将供试菌株采用PDA平板活化,打孔(Φ=5 mm)4~5个菌块移入PD液体培养基,28 ℃培养7 d。菌液采用组织捣碎机将其均匀打碎,经纱布过滤形成菌液,采用贴菌块法接种于黄瓜茎段,待其发病均匀后形成病残体,备用。
使用人工气候箱对病残体进行处理,病残体分别放置保湿盒和土壤。温度27 ℃,湿度分别设定为20%,50%,80%,使用温湿度计对其进行实时检测。每隔1,3,5,7,15,30 d提取病残体(1 g)内病原菌DNA进行Real-time PCR检测,以0 d取样为对照。
1.8 数据分析
用Microsoft Excel 2010 软件进行数据处理和作图,根据下列公式计算样本浓度和基因拷贝数[12]。
样品拷贝数(个/mL)=DNA质量浓度/DNA分子量;
DNA分子量=DNA碱基数×324.5;
DNA质量浓度=260 nm吸光度×稀释倍数×50 μg/mL×6.02×1023。
2 结果与分析
2.1 特异性检测
利用设计的引物F8-1/F8-2对镰孢菌和其他10种不同的植物病原真菌进行PCR扩增,结果表明:只有镰孢菌能扩增出187 bp目的片段(图1),其他菌株与ddH2O均未检测到条带,说明该引物对镰孢菌的PCR扩增具有特异性。
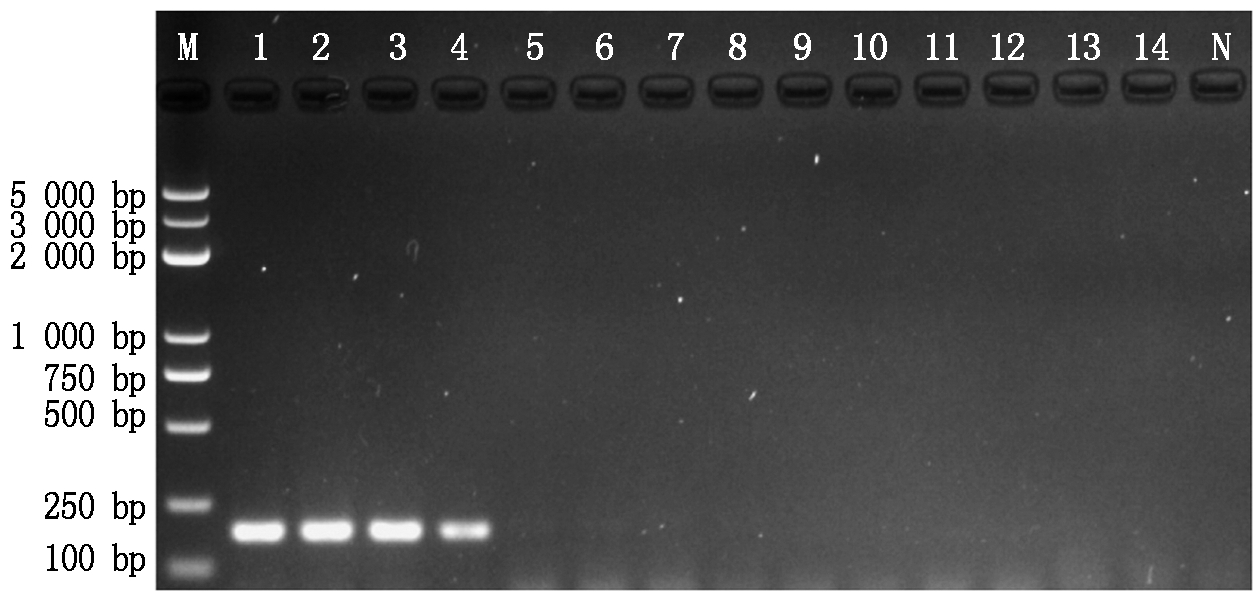
M.分子量标准BM5000 DNA Marker; 1-2.茄病镰孢菌; 3-4.尖孢镰孢菌; 5.瓜果腐霉菌; 6.核盘菌; 7.致病疫霉菌; 8.疫霉菌; 9.灰葡萄孢菌; 10.茄匍柄霉菌; 11-13.立枯丝核菌; 14.多主棒孢菌; N.阴性对照。
M.Molecular weight BM5000 DNA Marker; 1-2.Fusarium solani; 3-4.Fusarium oxysporum; 5.Pythium aphanidermatum; 6.Sclerotinia sclerotiorum; 7.Phytophthora infestans; 8.Phytophthora capsici; 9.Botrytis cinerea; 10.Stemphylium solani; 11-13.Rhizoctonia solani; 14.Corynespora cassiicola; N.ddH2O.
图1 镰刀菌引物特异性检测结果
Fig.1 The specificity of the selected primes to Fusarium
2.2 灵敏度检测
将初始浓度(2.1×105 pg/μL)模板DNA按10倍浓度梯度稀释,对特异性引物F8-1/F8-2分别进行PCR和RT-PCR灵敏度检测,结果表明:普通PCR灵敏度为2.1×103 pg/μL(图2),RT-PCR灵敏度为2.1×10-1 pg/μL(图3),RT-PCR灵敏度较普通PCR高104倍。
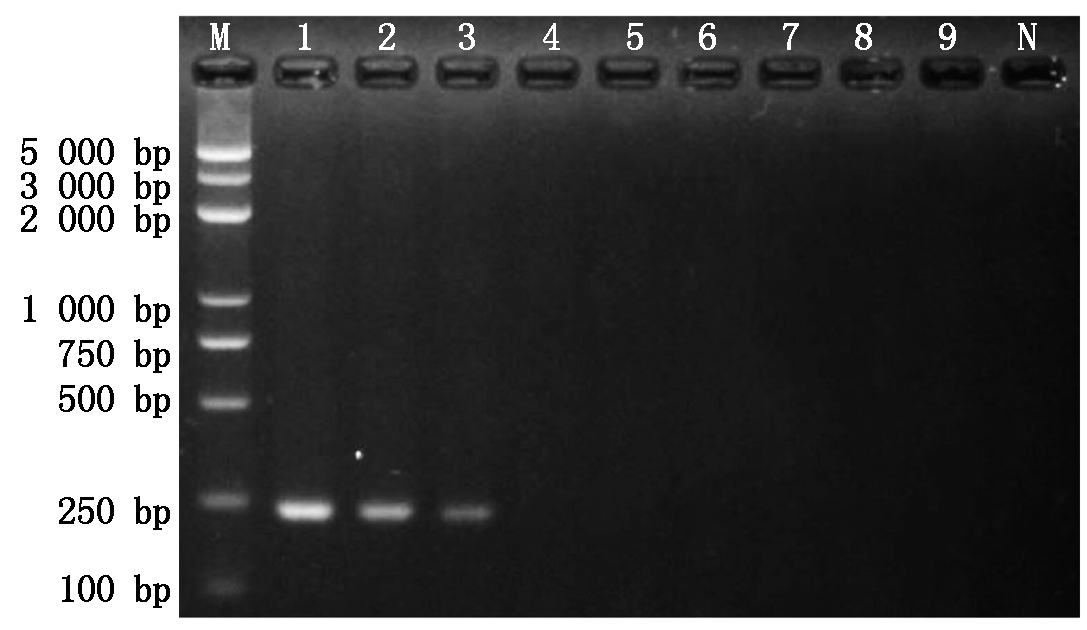
M.BM5000 DNA Marker; 1-9.质粒DNA稀释为
2.1×105~2.1×10-3 pg/μL; N. ddH2O。图3同。
M.BM5000 DNA Marker; 1-9.Plasmid diluted to
2.1×105 -2.1×10-3 pg/μL; N.ddH2O.The same as Fig.3.
图2 引物灵敏度普通PCR检测结果
Fig.2 Sensitivity detection of Fusarium primers F8-1/F8-2
by using series plasmid dilutions with PCR
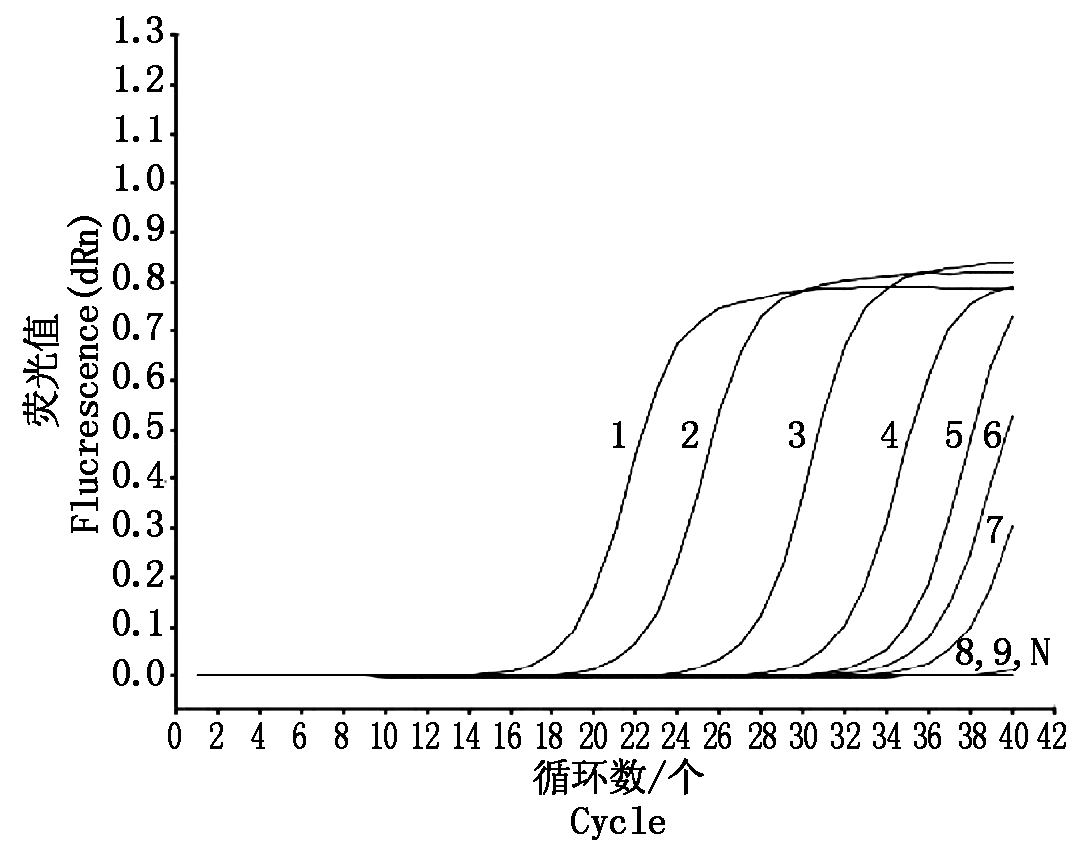
图3 引物灵敏度实时荧光定量PCR检测结果
Fig.3 Sensitivity of the Real-time RT-PCR
assay for detection of Fusarium
2.3 标准曲线的建立
利用PCR方法对阳性克隆进行普通PCR检测(图4),按10倍梯度稀释质粒标准品,以不同稀释DNA为模板,利用引物F8-1/F8-2进行RT-PCR扩增,绘制标准曲线(图5)。
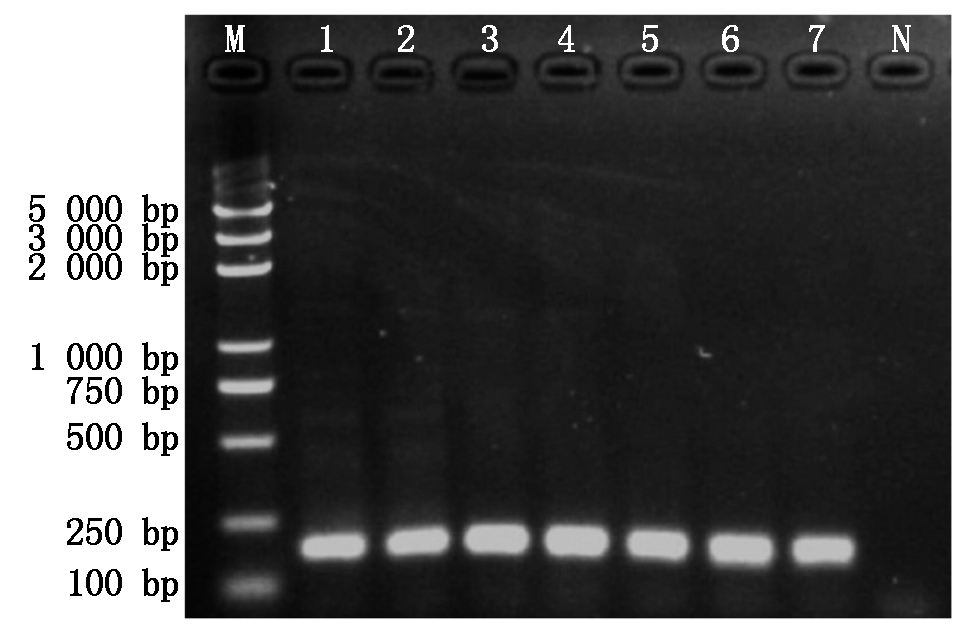
M.BM5000 DNA Marker; 1-6.质粒DNA; N.dH2O。
M.BM5000 DNA Marker; 1-6. Plasmid DNA; N.ddH2O.
图4 重组质粒的PCR鉴定
Fig.4 PCR amplification of recombinant plasmids
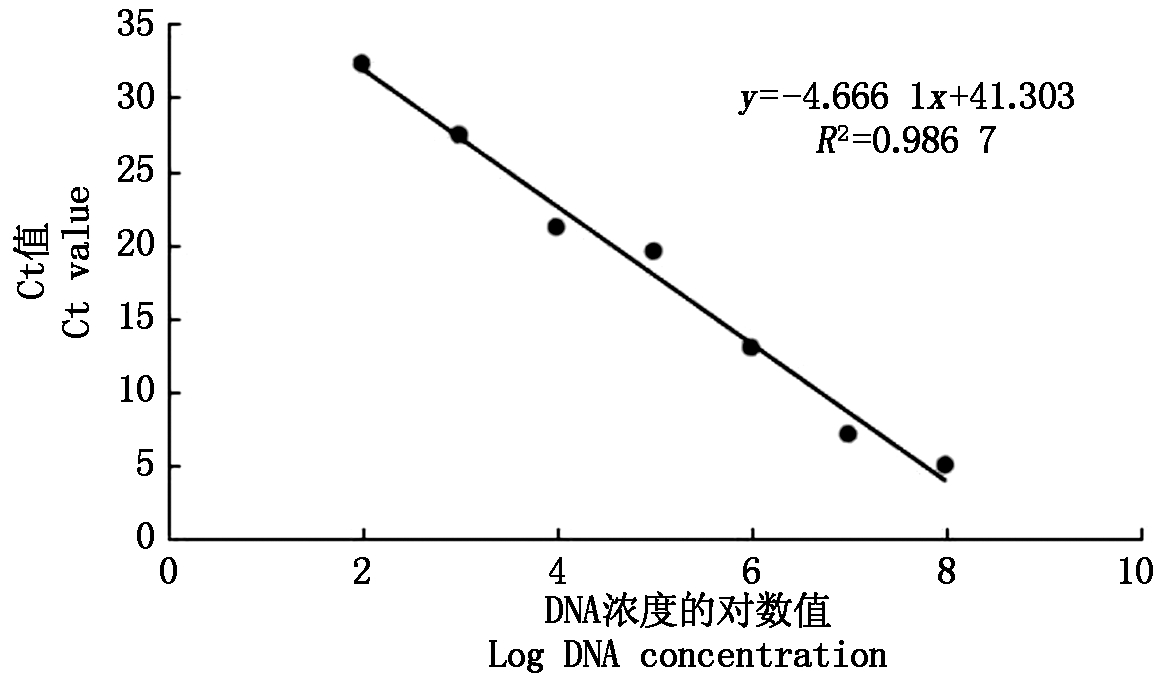
图5 荧光定量PCR不同起始模板lg(拷贝数)
和Ct值的标准曲线
Fig.5 Real-time PCR standard cure of the Fusarium input
DNA copy number versus the corresponding Ct values
2.4 不同空气湿度下病残体内镰孢菌DNA含量动态变化
将病残体放入不同湿度条件下处理,其初始含量均为6.90×1011拷贝数/g,1~5 d病残体内镰孢菌DNA含量在20%和50%湿度下逐渐下降,5~30 d内含量趋于水平下降状态,第30天DNA含量分别降至8.04×109,8.72×109拷贝数/g;而80%湿度下其DNA含量在1~30 d呈现下降趋势,第30天含量降至5.55×108拷贝数/g(图6)。表明病残体内镰孢菌DNA含量在80%湿度环境下失活速率高于20%和50%湿度环境。
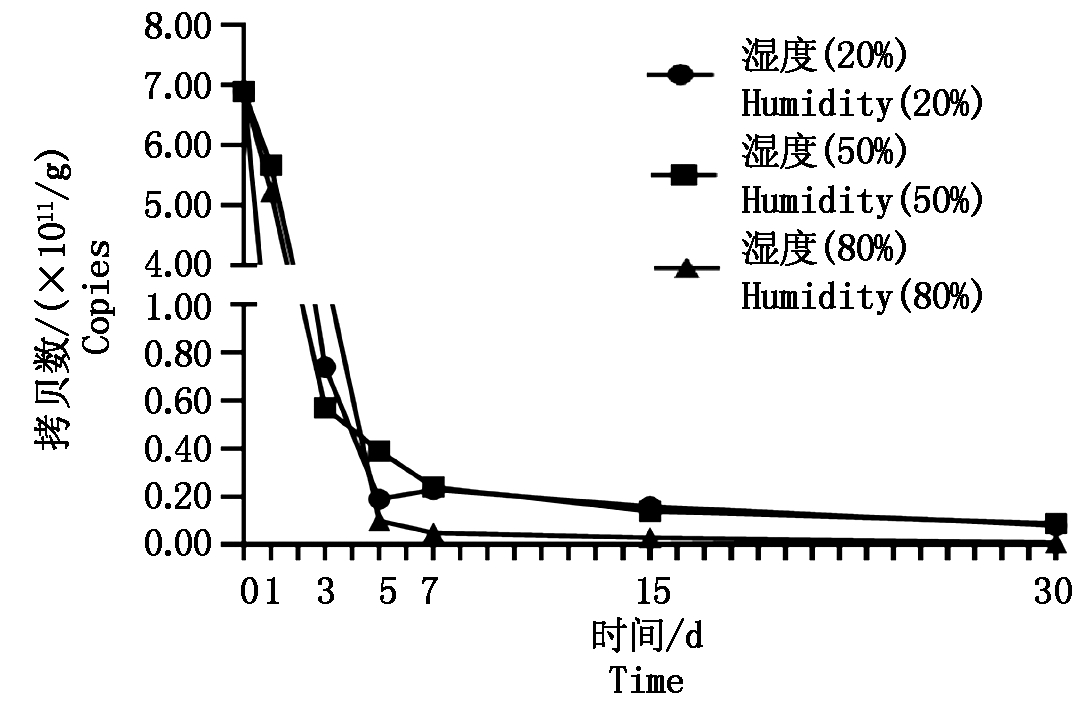
图6 不同空气湿度下病残体DNA含量动态变化
Fig.6 Crop residues of Fusarium content changes
dynamically at different humidity levels
2.5 不同土壤湿度下病残体内茄病镰孢菌DNA含量动态变化
将病残体置于不同湿度土壤内进行处理,其初始病原菌DNA含量为1.06×1012拷贝数/g,处理1 d后不同湿度土壤中病残体内病原菌DNA含量呈现下降的趋势。总体上讲(图7),其DNA含量呈现先下降后上升再下降的趋势;其中20%湿度土壤处理第30天其病残体内病原菌DNA含量为1.30×109拷贝数/g,50%和80%湿度土壤中均未检测到病残体内病原菌DNA含量。
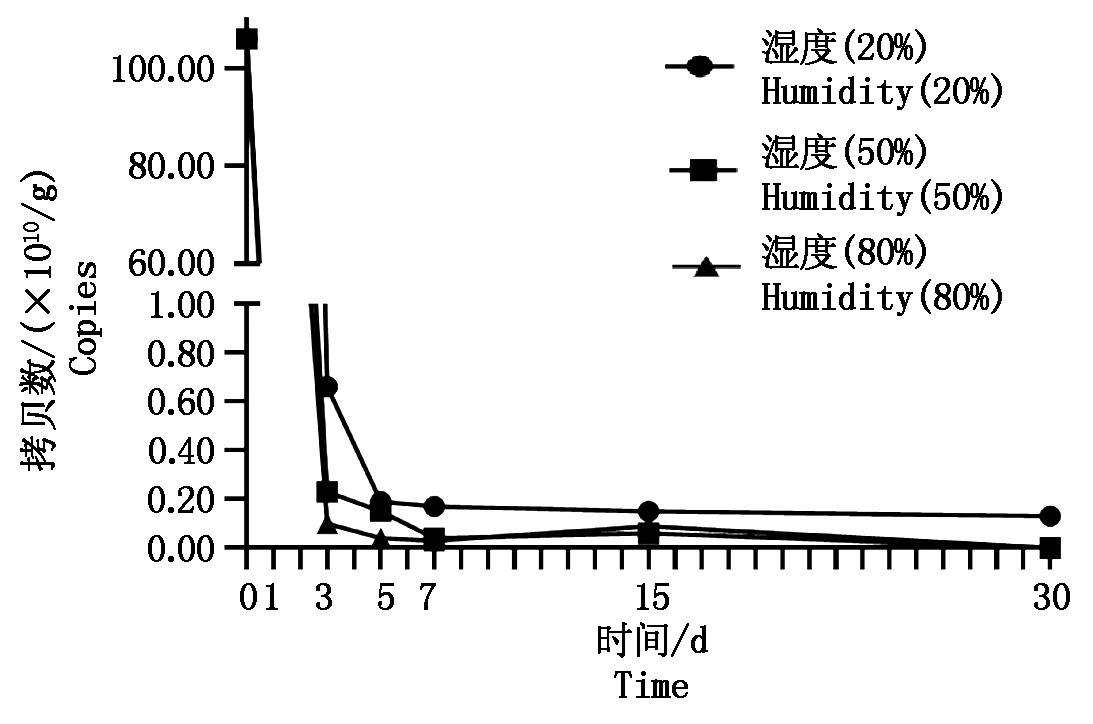
图7 不同湿度土壤下病残体DNA含量动态变化
Fig.7 Crop residues of Fusarium content changes
dynamically at different soil humidity levels
3 结论与讨论
镰孢菌可导致植物地下根部腐烂坏死,严重时整株枯死。它可在土壤中越冬越夏,还能随种子带菌,极易随着土壤、病残体以及水源扩散[13],具有较高的传播流行风险。因此,建立镰孢菌实时荧光定量 (RT-PCR)体系对于该病的监测以及整个瓜类产业的安全有重大意义。
近年来,RT-PCR 技术在植物病害检测中的得到了广泛应用。程颖超等[14]根据辣椒疫霉 Actin基因构建的 RT-PCR 体系灵敏度为 0.1 pg/μL,为常规PCR 灵敏度的 100 倍;陈长军等[15]建立的油菜菌核病菌(Sclerotinia sclerotiorum)Real-time PCR 检测方法,最低检测值为 1.4×10-3 ng/μL,灵敏度是常规 PCR的 10~100 倍;本研究基于Fusarium的翻译延伸因子(TEF-1α)基因部分保守序列设计特异性引物F8-1/F8-2,该引物具有较高的特异性,RT-PCR 熔解曲线在 85 ℃有唯一的产物吸收峰,灵敏性达到 2.1×10-1 pg/μL,是常规 PCR 的 104 倍。
目前,利用 Real-time PCR 方法对病原菌潜伏侵染的定量分析研究广泛报道,如根据保守基因序列设计的特异性引物,利用 RT-PCR 方法定量研究土壤中潜伏侵染的病原菌,明确了病原菌 DNA 含量与病害的相关性[16-17]。本次研究利用RT-PCR 方法定量检测不同湿度环境下病残体内菌含量动态变化,证实了病残体内镰孢菌DNA含量在80%湿度环境下失活速率高于20%,50%湿度环境。据报道,当田间持水量过高(75%)、相对温度较低时,立枯丝核菌在土壤内扩展较快,促使小麦根腐病侵染严重[18]。另外当草莓采收后,深翻土壤灌足水后进行地面覆盖10 d,可有效减少土传病害内病原菌数目[19]。1986年国外部分学者通过调节土壤湿度对尖孢镰孢菌生长与存活的影响,表明尖孢镰孢菌存活率随土壤水分增加而减少[20]。湿度较大的土壤可减缓病情的蔓延,马铃薯茎基腐病(Rhizoctonia solani)在干燥土壤中发病较严重[21],本次试验所得趋势与上述研究结果相符。说明湿度环境是影响DNA降解的重要因素之一,含水量增加明显促进DNA的降解,大量水分子的存在,促进了DNA脱嘌呤、断链的速度,因而加速了DNA的水解过程[22]。
镰孢菌为一类好氧型真菌,高湿土壤会导致土壤中溶解氧含量减少,因此不利于该病原菌生长。据悉印度黄檀枯萎病由镰孢菌引起,通过探索土壤水分对镰孢菌的生长与存活影响,表明土壤湿度越大,病原菌活性下降明显,因此当地通过灌溉来控制枯萎病的发生[23]。此外,磷脂脂肪酸(PLFA)分析结果还表明,病原菌受土壤水分的影响,病原菌数量比例在高湿地块中显著降低[24]。本研究中已检测出茄病镰孢菌在高湿环境下失活速率高于低湿环境,即病原菌在高湿环境下易失活,与上述结论相一致。
土壤微生物多样性极其复杂,土壤可短暂维持该病原菌存活,在土壤中只要能产生能量的环境均有微生物的存在。土壤中微生物种类繁多,个体微小、群落结构极其复杂和对环境变化等因素都会对土壤中病原菌产生影响。因此,相关土壤因子对茄病镰孢菌的影响仍需进一步研究与探讨。
[1] Nguyen D M C, Seo D J, Lee H B, Kim I S, Kim K Y, Park R D, Jung W J. Antifungal activity of gallic acid purified from Terminalia nigrovenulosa bark against Fusarium solani[J]. Microbial Pathogenesis, 2013, 56(3):8-15. doi:10.1016/j.micpath.2013.01.001.
[2] Armengol J, José C M, Moya M J, Sales R, Vicent A, García-Jiménez J. Fusarium solani f. sp. cucurbitae race 1, a potential pathogen of grafted watermelon production in Spain[J]. Eppo Bulletin, 2000, 30(2):179-183. doi:10.1111/j.1365-2338.2000.tb00875.x.
[3] Li B J, Liu Y, Shi Y X, Xie X W, Guo Y L. First report of crown rot of grafted cucumber caused by Fusarium solani in China[J]. Plant Disease,2010, 94(11):1377-1377. doi:10.1094/PDIS-03-10-0217.
[4] 刘洋. 茄病镰孢菌瓜类专化型的鉴定及其侵染途径研究[D]. 北京:中国农业科学院, 2010.
Liu Y. Study on indentification and infection routes of Fusarium solani f.sp. cucurbitae[D]. Beijing:Chinese Academy of Agricultural Sciences, 2010.
[5] 王继华,陆琳,唐开学. 香石竹尖孢镰孢菌PCR检测[J]. 西南大学学报(自然科学版),2004, 26(4):417-419. doi:10.3969/j.issn.1673-9868.2004.04.011.
Wang J H, Lu L, Tang K X. Detection of carnation wilt(Fusarium oxysporum f.sp.diathi) by PCR [J]. Journal of Southwest Agricultural University(Natural Science), 2004, 26(4):417-419.
[6] 王瑜,马建忠,张伟杰,高恺,冯海霞,张莹,车团结. 腐皮镰孢菌SYBR Green实时荧光定量PCR快速检测方法的建立[J]. 微生物学免疫学进展,2018, 46(2):34-39. doi:10.13309/j.cnki.pmi.2018.02.007.
Wang Y, Ma J Z, Zhang W J, Gao W, Feng H X, Zhang Y, Che T J. Rapid identification of Fusarium solani by SYBR Green Real time quantitative PCR[J].Progress in Microbiology and Immunology,2018, 46(2):34-39.
[7] 李文学,肖瑞刚,吕苗苗,丁宁,石华荣,顾沛雯. 葡萄霜霉病菌实时荧光定量PCR检测体系的建立和应用[J]. 中国农业科学,2019, 52(9):1529-1540.doi:10.3864/j.issn.0578-1752.2019.09.005.
Li W X, Xiao R G, Lü M M, Ding N, Shi H R, Gu P W. Establishment and application of Real-time PCR for quantitatively detecting Plasmopara viticola in Vitis vinifera[J]. Scientia Agricultura Sinica,2019, 52(9):1529-1540.
[8] 肖姬玲,张屹,李基光,朱菲莹,魏林,梁志怀. 实时荧光定量PCR检测土壤西瓜枯萎病菌体系的建立[J]. 植物保护学报,2018,45(4):921-922. doi:10.13802/j.cnki.zwbhxb.2018.2017032.
Xiao J L, Zhang Y, Li J G, Zhu F Y, Wei L, Liang Z H. Establishment of Real-time PCR system for quantitatively detecting Fusarium oxysporum f.sp.niveum in soil[J]. Journal of Plant Protection,2018,45(4):921-922.
[9] Luo Y, Ma Z, Reyes H C, Morgan D, Michailides T J. Quantification of airborne spores of Monilinia fructicola in stone fruit orchards of California using Real-time PCR[J]. European Journal of Plant Pathology, 2007, 118(2): 145-154. doi:10.1007/s10658-007-9124-x.
[10] 陈璐. 黄瓜细菌性角斑病菌和多主棒孢菌 PCR 检测技术的建立[D]. 北京:中国农业科学院, 2014.
Chen L. PCR-based specific detection of Pseudomonas syringae pv. lachrymans and Corynespora cassiicola[D]. Beijing:Chinese Academy of Agricultural Sciences, 2014.
[11] 史建荣,王秀宇,林凡云,祭芳,董飞,曹欢. 通过荧光时实定量PCR建立转基因小麦生长期内根际土壤中镰孢菌拷贝数的方法[P]. CN102517385A. 2012-06-27.
Shi J R, Wang X Y, Lin F Y, Ji F, Dong F, Cao H. Method for establishing Fusarium copy number in rhizosphere soil of transgenic wheat during growth period by real-time quantitative PCR [P]. CN102517385A. 2012-06-27.
[12] Hietala A M, Eikenes M, Kvaalen H, Solheim H, Fossdal C G. Multiplex Real-time PCR for monitoring Heterobasidion annosum Colonization in norway spruce clones that differ in disease resistance[J]. Applied and Environmental Microbiology, 2003, 69(8): 4413-4420. doi:10.1128/AEM.69.8.4413-4420.2003.
[13] 贲海燕,石延霞,谢学文,柴阿丽,李宝聚. 氰氨化钙土壤消毒对黄瓜根腐病及土壤病原菌的控制效果[J]. 园艺学报,2016, 43(11):2173-2181. doi:10.16420/j.issn.0513-353x.2016-0148.
Ben H Y, Shi Y X, Xie X W, Chai A L, Li B J. Studies of soil improvement effect of calcium cyanamide and its control efficiency on soil-borne diseases of vegetable crops[J]. Acta Horticulturae Sinica,2016, 43(11):2173-2181.
[14] 程颖超,康华军,石延霞,柴阿丽,张红杰,谢学文,李宝聚. 辣椒疫霉菌 RT-PCR 检测技术的建立及应用[J]. 园艺学报,2018, 45(5):997-1006.
Cheng Y C, Kang H J, Shi Y X, Chai A L, Zhang H J, Xie X W, Li B J. Development and application of Real-time fluorescent quantitative PCR for detection of Phytophthora capsici[J]. Acta Horticulturae Sinica,2018, 45(5) :997-1006.
[15] 陈长军,李俊,赵伟,王建新,周明国. 利用实时荧光定量 PCR 技术检测油菜菌核病菌[J]. 植物病理学报,2011, 41(5):516-525. doi:10.13926/j.cnki.apps.2011.05.008.
Chen C J, Li J, Zhao W, Wang J X, Zhou M G. Detection of Sclerotinia sclerotiorum by a quantitative real-time PCR[J]. Acta Phytopathologica Sinica,2011, 41(5): 516-525.
[16] 谢学文,程颖超,王锟,张红杰,杨杰,石延霞,柴阿丽,李宝聚. 短密木霉菌 RT-PCR 检测体系的建立及其在南瓜根际的动态分析[J]. 中国生物防治学报,2018,34(4):574-581. doi:10.16409/j.cnki.2095-039x.2018.04.012.
Xie X W, Cheng Y C, Wang K, Zhang H J, Yang J, Shi Y X, Chai A L, Li B J. Establishment of Real-time fluorescent quantitative PCR for Trichoderma brevicompactum and its dynamic change in pumpkin rhizosphere[J]. Chinese Journal of Biological Control,2018,34(4): 574-581.
[17] 贺字典,宋士清,高玉峰,石延霞,李宝聚. 棘孢木霉 Trichoderma asperellum 在土壤中定殖量的荧光定量 PCR 检测[J]. 植物保护学报,2016,43(4):552-558. doi:10.13802/j.cnki.zwbhxb.2016.04.004.
He Z D, Song S Q, Gao Y F, Shi Y X, Li B J. Detection of Trichoderma asperellum colonization in soils by Real-time fluorescent quantitative PCR[J]. Acta Phytophylacica Sinica,2016,43(4): 552-558.
[18] Gill J S, Sivasithamparam K, Smettem K R J.Effect of soil moisture at different temperatures on Rhizoctonia root rot of wheat seedlings[J]. Plant and Soil, 2001,231(1): 91-96. doi:10.1023/a:1010394119522.
[19] 杨秀荣,刘水芳,孙淑琴,刘亦学,张学文,张惟. 天津地区设施菜地主要土传病害的综合防治技术[J]. 中国蔬菜,2008(2):58-59.
Yang X R, Liu S F, Sun S Q, Liu Y X, Zhang X W, Zhang W. Comprehensive prevention and control technology of main soil-borne diseases in facility vegetable fields in Tianjin area[J]. Chinese Vegetables,2008(2): 58-59.
[20] Oritsejafor J J. Influence of moisture and pH on growth and survival of Fusarium oxysporum f. sp. elaeidis in soil[J]. Transactions of the British Mycological Society,1986, 87(4): 511-517. doi:10.1016/S0007-1536(86)80091-2.
[21] Hide G A, Firmager J P. Effects of soil temperature and moisture on stem canker(Rhizoctonia solani) disease of potatoes[J]. Potato Research, 1989, 32(1): 75-80. doi:10.1007/BF02365819.
[22] Lindahl T. Instability and decay of the primary structure of DNA[J]. Nature,1993, 362(6422):709-715. doi:10.1038/362709a0.
[23] Bakshi B K. Wilt disease of Shisham(Dalbergia sissoo Roxb.). IV. The effect of soil moisture on the growth and survival of Fusarium solani in the laboratory[J]. Indian Forester, 1957,83(8): 505-11.
[24] Boer W D, Folman L B, Summerbell R C, Boddy L. Living in a fungal world: impact of fungi on soil bacterial niche development[J]. FEMS Microbiology Reviews, 2005, 29(4): 795-811. doi:10.1016/j.femsre.2004.11.005.