麦根腐平脐蠕孢(Bipolaris sorokiniana)是半活体营养型植物致病菌,可引起小麦苗枯病、根腐病、叶斑病、黑胚病、大麦叶斑病以及燕麦、水稻等多种禾本科作物病害[1-5],但鲜有报道该病原菌引起玉米病害。据报道,20世纪90年代初,麦根腐平脐蠕孢曾在甘肃省安西县引起玉米茎腐病,发病面积占种植面积的41.3%,严重地块甚至绝收。在四川雅安,该病原菌是玉米小型叶斑病的主要病原之一,其检出率仅次于小斑病病菌[6]。近年来,在黄淮海夏玉米区由该病原菌引起的玉米叶斑病也时有发生,形成苗期和抽雄后期2个侵染高峰,前者病斑可连接成片导致整个叶片呈黄色枯死,叶片自下而上逐渐蔓延;后者病原菌主要侵染中上部叶片并造成类似弯孢霉叶斑病的病斑。该病害的发病程度在玉米品种间存在较大差异,发病率在2%~52%[7];2016年,该病害山东潍坊个别地块的发病率高达76.67%,存在爆发流行的风险。
国内关于麦根腐平脐蠕孢生物学特性的相关研究较少,但已有研究表明,不同地域或寄主来源菌株的生物学特性存在差异。何苏琴等、张婕等、刘正坪等[8-10]研究表明,西藏秋播燕麦褐斑病菌株、吉林长春草坪草离蠕孢叶枯病菌株和内蒙古西部地区小麦根腐病菌株的菌丝生长最适温度均为30 ℃,而杨叶等[11]研究结果表明,海南牛筋草菌株菌丝生长的最适温度为25 ℃;最适产孢温度也有所不同,燕麦菌株为20 ℃,牛筋草菌株为25 ℃,草坪草菌株为30 ℃;适合孢子萌发的温度范围也较广,在15~35 ℃;在碳氮源利用方面,则认为葡萄糖和硝酸钠有利于产孢。此外,通过室内药剂筛选已明确了多种杀菌剂对麦根腐平脐蠕孢不同菌株的防控效果。袁胜亮等[12]测定了6种杀菌剂对小麦叶斑、根腐病菌菌株的毒力,结果表明,40,6.45 mg/L的世高(苯醚甲环唑)对菌丝生长和孢子萌发均有很强的抑制作用;张海珊等[13]认为在测试的5种杀菌剂中咪鲜胺对小麦蠕孢菌叶枯病菌株菌丝的抑制作用最强,苯醚甲环唑、戊唑醇、噻呋酰胺次之;刘振宇等[14]认为施保功(咪鲜胺锰)对草坪草离蠕孢叶枯病菌株的效果最好;王春明等[15]认为敌力托(丙环唑)的效果最好,而李东臣[16]则认为适乐时(咯菌腈)的效果要好于丙环唑。
已有研究主要针对引起麦类作物、草坪草等叶部及根系病害的菌株,对于引起玉米叶斑病的菌株尚未开展相关研究。本研究以从玉米叶部病斑分离得到的麦根腐平脐蠕孢菌株为研究对象,开展了其生物学特性的相关研究,同时在室内评价了该菌株对不同类型杀菌剂的敏感性,为进一步开展该病原菌致病机理研究和制定病害防控措施提供依据。
1 材料和方法
1.1 试验材料
供试菌株:本研究所用菌株分离自玉米叶斑病病叶,经纯化后鉴定为麦根腐平脐蠕孢,保存在河北省农林科学院植物保护研究所。在本试验开始前将该菌株进行了回接,寄主表现典型症状后再次分离纯化备用。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂粉20 g、蒸馏水定容至1 L;察氏培养基(Czapek):NaNO3 3 g、KH2PO4 1 g、MgSO4·7H2O 0.5 g、KCl 0.5 g、FeSO4 0.01 g、蔗糖30 g、琼脂粉15 g、蒸馏水定容至1 L。将上述培养基121 ℃高压灭菌20 min备用。
菌饼:25 ℃条件下,将纯化后的菌株在PDA培养基上培养5 d,然后用直径5 mm的打孔器从菌落边缘打取菌饼待用。
孢子悬浮液:25 ℃条件下,将纯化后的菌株在PDA培养基上培养14 d,然后用灭菌水洗下分生孢子并配制成浓度为1×106/L的孢子悬浮液待用。
供试药剂:吡唑醚菌酯(Pyraclostrobin)99%原药、异菌脲(Iprodione)98.7%原药、嘧菌酯(Azoxystrobin)98.1%原药、甲基硫菌灵(Thiophanate-methyl)97.56%原药、戊唑醇(Tebuconazole)98.00%原药、苯醚甲环唑(Difenoconazole)96.00%原药、咯菌腈(Fludioxonil)97.00%原药和咪鲜胺(Prochloraz)97.00%原药。将以上原药用丙酮溶解,并配制成10 000 mg/L的母液,贮藏于4 ℃冰箱中备用,使用时用无菌水稀释至使用浓度。
1.2 试验方法
1.2.1 温度对菌丝生长、产孢和孢子萌发的影响 将载有菌饼的PDA培养基置于恒温培养箱,分别设置 5,10,15,20,25,28,30,35 ℃ 8个温度处理。培养5 d后,采用十字交叉法[17]测量菌丝生长量(下同),比较不同温度对菌株生长的影响;培养10 d后,用打孔器在菌落边缘取直径5 mm的菌饼,采用血球计数板法[18]检测产孢量(下同)。将孢子悬浮液均匀涂布在PDA培养基上,在上述温度处理下培养1.5 h后调查孢子萌发率。每个处理重复4次,试验重复2次。
1.2.2 pH对菌丝生长、产孢和孢子萌发的影响 用1.0 mol/L的盐酸或氢氧化钠溶液将PDA培养基的pH值分别调至3,4,5,6,7,8,9,10,11。将菌饼转接至不同pH值的PDA培养基上,25 ℃培养5 d后测量菌丝生长量,比较不同pH值对菌株生长的影响;培养10 d后,检测不同处理的产孢量。将孢子悬浮液均匀涂布在不同pH值的PDA培养基上,1.5 h后调查孢子萌发率。每个处理重复4次,试验重复2次。
1.2.3 不同碳/氮源对菌丝生长、产孢和孢子萌发的影响 以察氏培养基作为基础培养基,分别用蔗糖、麦芽糖、果糖、半乳糖、淀粉等量置换其中的蔗糖制成含不同碳源的培养基;以脯氨酸、CO(NH2)2、NH4NO3、(NH4)2SO4、NH4Cl等量置换其中的NaNO3制成含不同氮源的培养基。将菌饼转接至不同碳/氮源的培养基上,25 ℃培养5 d后,测量菌丝生长量,比较不同碳/氮源对菌株生长的影响;培养第10 天,检测不同处理的产孢量。将孢子悬浮液均匀涂布在含不同碳/氮源的培养基上,1.5 h后调查各处理的孢子萌发率。每个处理重复4次。
1.2.4 杀菌剂对麦根腐平脐蠕孢的室内毒力测定 测定8种杀菌剂对玉米麦根腐平脐蠕孢的毒力采用菌丝生长速率法和孢子萌发法[19-21],略做修改。将菌饼接种到含有不同浓度药剂的PDA培养基上(吡唑醚菌酯:100.00,10.00,1.00,0.10,0.01 mg/L;异菌脲:10.0,2.0,1.0,0.4,0.2 mg/L;嘧菌酯:100,20,10,2,1 mg/L;甲基硫菌灵:100,20,10,2,1 mg/L,戊唑醇:100.00,10.00,1.00,0.10,0.01 mg/L;苯醚甲环唑:10.00,1.00,0.20,0.10,0.01 mg/L;咯菌腈:100.00,10.00,1.00,0.10,0.01 mg/L;咪鲜胺:100.00,10.00,1.00,0.10,0.01 mg/L,以2%的丙酮作为对照),每处理重复4次,置于25 ℃培养箱中培养,待对照菌落长满培养基后测量各处理的菌丝生长速度。将孢子悬浮液均匀涂布在含不同浓度药剂的PDA培养基上(吡唑醚菌酯:100,20,10,2,1 mg/L;异菌脲:100,20,10,2,1 mg/L;嘧菌酯:400,200,133,100,40 mg/L;甲基硫菌灵:1000,400,200,100,40 mg/L,戊唑醇:400,200,133,100,40 mg/L;苯醚甲环唑:400,200,133,100,40 mg/L;咯菌腈:100,20,10,2,1 mg/L;咪鲜胺:200,100,20,10,2 mg/L,以2%的丙酮作为对照),每处理重复4次,25 ℃培养箱中培养2 h后调查孢子萌发率。通过菌丝生长抑制率、孢子萌发抑制率和药剂浓度对数值之间的线性回归分析,计算各药剂对菌株的有效抑制中浓度(EC50值)。
菌丝抑制生长率![]()
孢子萌发抑制率![]()
1.2.5 数据统计与分析 所有数据均由Microsoft Excel 2003与SPSS 16.0数据处理工作平台进行统计分析,方差分析和差异显著性检验采用Duncan法。
2 结果与分析
2.1 温度对菌丝生长、产孢和孢子萌发的影响
麦根腐平脐蠕孢在5~35 ℃内均可生长(图1-A),但最适生长温度为28 ℃,菌丝生长量达73.00 mm,显著高于其他处理(P<0.05);在5~28 ℃,菌丝生长速度随温度升高而增大;在28~35 ℃,菌丝生长速度随温度升高而降低;在5,35 ℃时,菌丝生长量分别为7.00,3.00 mm,且菌丝稀疏。产孢量在10~25 ℃随着温度升高而增加,并在25 ℃时达到峰值15.13×103/cm2,显著高于其他处理(P<0.05);温度高于25 ℃,产孢量则急剧下降;温度为5 ℃或35 ℃时停止产孢(图1-B)。孢子在5~35 ℃均可萌发(图1-C),最适温度为28 ℃,孢子萌发率达到96.91%,显著高于其他处理(P<0.05);在5~28 ℃,高温更利于孢子萌发,但高于28 ℃孢子萌发率呈下降趋势。
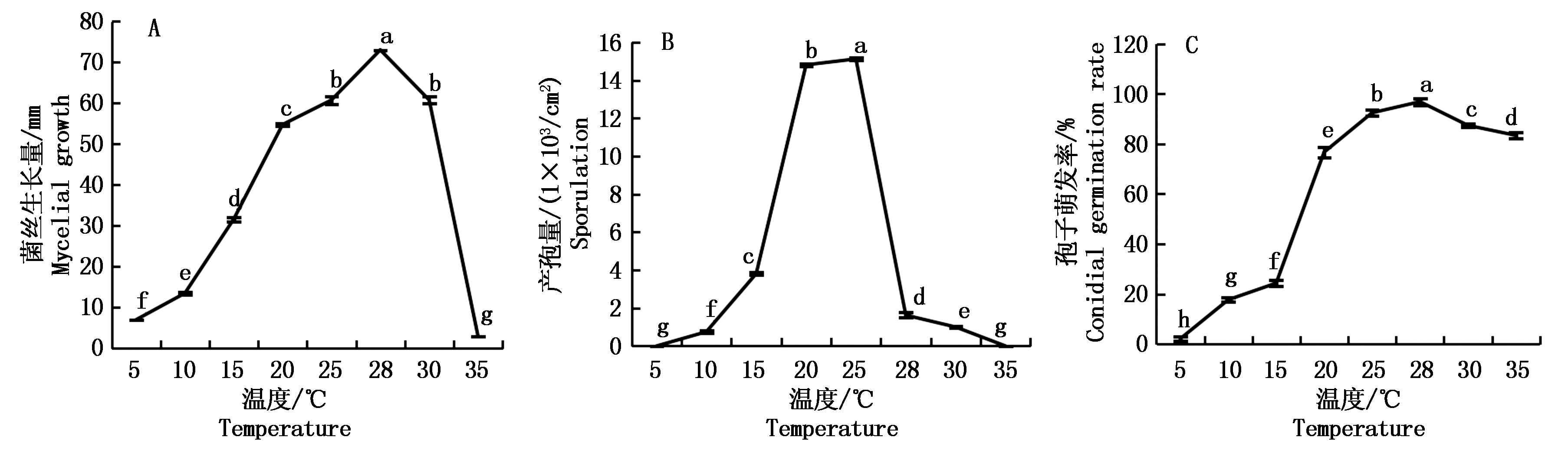
数据点上方不同小写字母表示处理间差异显著(P<0.05)。图2同。
Different lowercase letters above each point indicate significant difference between treatments (P<0.05).The same as Fig.2.
图1 不同温度下麦根腐平脐蠕孢菌丝生长量、产孢量及孢子萌发率
Fig.1 Mycelial growth, sporulation and conidial germination rate of Bipolaris sorokiniana at different temperatures
2.2 pH对菌丝生长、产孢和孢子萌发的影响
麦根腐平脐蠕孢在pH 值7和8的培养基上菌丝生长量分别为65.25,65.13 mm,显著高于其他处理(P<0.05);在pH值为3的培养基上菌丝不能生长,在pH值为4,5和11的培养基上菌丝生长量分别为5.13,14.38,46.63 mm,相比之下碱性条件比酸性条件更利于菌丝生长(图2-A)。孢子在pH值为6~11的培养基上均可产生,但弱酸条件较弱碱条件更利于产孢;最适合产孢的pH值为7,孢子量为48.44×103/cm2,显著高于其他处理(P<0.05);产孢量在pH值为8~11的培养基上呈明显下降趋势(图2-B)。在pH值为7和8的培养基上孢子萌发率分别为88.75%,85.00%,显著高于其他处理(P<0.05);相比酸性条件,在碱性条件下孢子的萌发率更高;在pH值为8~11的培养基上孢子萌发率也呈现下降趋势(图2-C)。
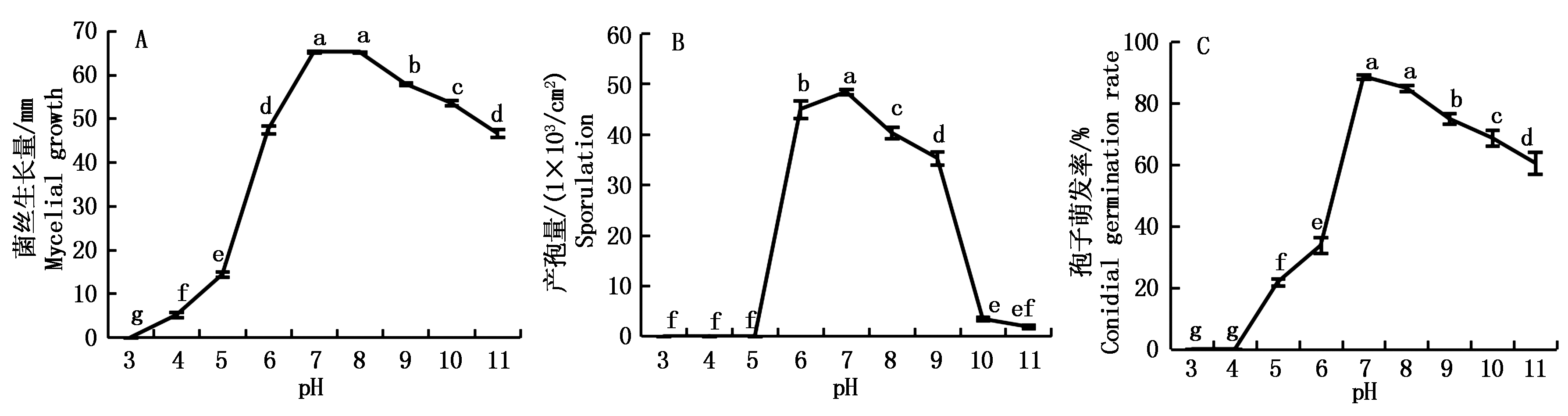
图2 不同pH值条件下麦根腐平脐蠕孢菌丝生长量、产孢量及孢子萌发率
Fig.2 Mycelial growth, sporulation and conidial germination rate of B. sorokiniana at different pH values
2.3 不同碳/氮源对菌丝生长、产孢和孢子萌发的影响
在不同碳源培养基上,麦根腐平脐蠕孢的菌丝生长量、产孢量以及孢子萌发率均存在一定差异(表1)。在以淀粉和蔗糖为碳源的培养基上菌丝生长量分别为53.00,50.17 mm,显著高于其他处理(P<0.05);在以半乳糖为碳源的培养基上产孢量为1.93×104/cm2,显著高于其他处理(P<0.05);在以淀粉、蔗糖和半乳糖为碳源的培养基上孢子萌发率均在70.00%以上,显著高于其他处理(P<0.05),在以果糖为碳源的培养基上孢子萌发率最低,为47.16%。
表1 不同碳源条件下麦根腐平脐蠕孢菌丝生长量、产孢量及孢子萌发率
Tab.1 Mycelial growth, sporulation and conidial germination rate of Bipolaris sorokiniana at different carbon sources
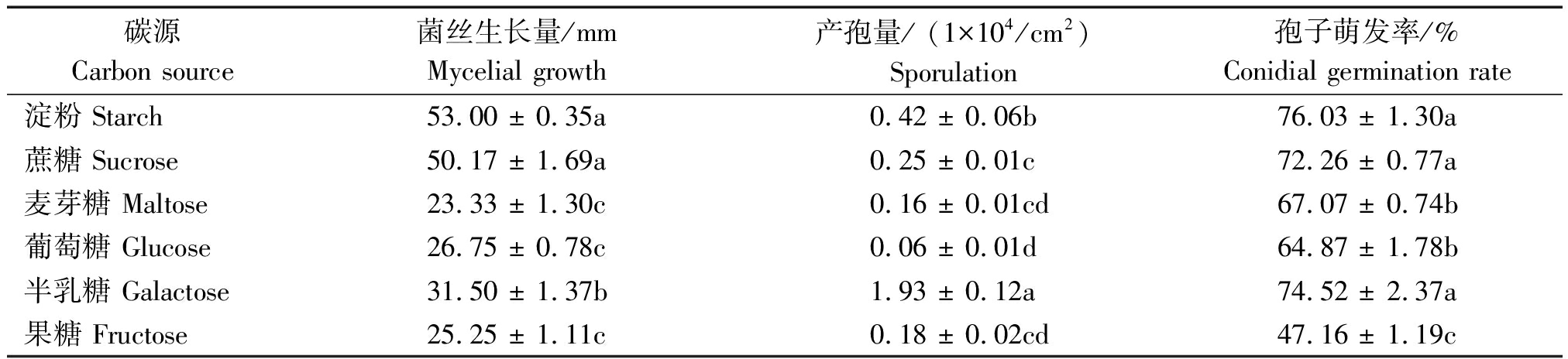
碳源Carbon source菌丝生长量/mmMycelial growth产孢量/ (1×104/cm2)Sporulation孢子萌发率/%Conidial germination rate淀粉 Starch53.00 ± 0.35a0.42 ± 0.06b76.03 ± 1.30a蔗糖 Sucrose50.17 ± 1.69a0.25 ± 0.01c72.26 ± 0.77a麦芽糖 Maltose23.33 ± 1.30c0.16 ± 0.01cd67.07 ± 0.74b葡萄糖 Glucose26.75 ± 0.78c0.06 ± 0.01d64.87 ± 1.78b半乳糖 Galactose31.50 ± 1.37b1.93 ± 0.12a74.52 ± 2.37a果糖 Fructose25.25 ± 1.11c0.18 ± 0.02cd47.16 ± 1.19c
注:表中数据为平均值±标准误。同列数据后不同小写字母表示处理间差异显著(P<0.05)。表2同。
Note:Data are given as means ± standard error. Data in a column followed by the different lowercase letters are significant difference at P<0.05. The same as Tab.2.
麦根腐平脐蠕孢在不同氮源培养基上的菌丝生长量、产孢量及孢子萌发率明显不同(表2)。在以硝酸钠为氮源的培养基上菌丝生长量达36.44 mm,与其他处理存在显著性差异(P<0.05);在以脯氨酸为氮源的培养基上产孢量为5.59×103/cm2,显著高于其他处理(P<0.05);孢子在所有供试氮源培养基上都能够萌发,在以脯氨酸和硝酸钠为氮源的培养基上孢子萌发率分别为49.38%,45.00%,显著高于其他处理(P<0.05)。此外,在以尿素、氯化铵、硝酸铵、硫酸铵等为氮源的培养基上,麦根腐平脐蠕孢的菌丝体生长缓慢、白化,并丧失产孢能力,这4种氮源不适合培养麦根腐平脐蠕孢。
表2 不同氮源条件下麦根腐平脐蠕孢菌丝生长量、产孢量及孢子萌发率
Tab.2 Mycelial growth, sporulation and conidial germination rate of B. sorokiniana at different nitrogen sources
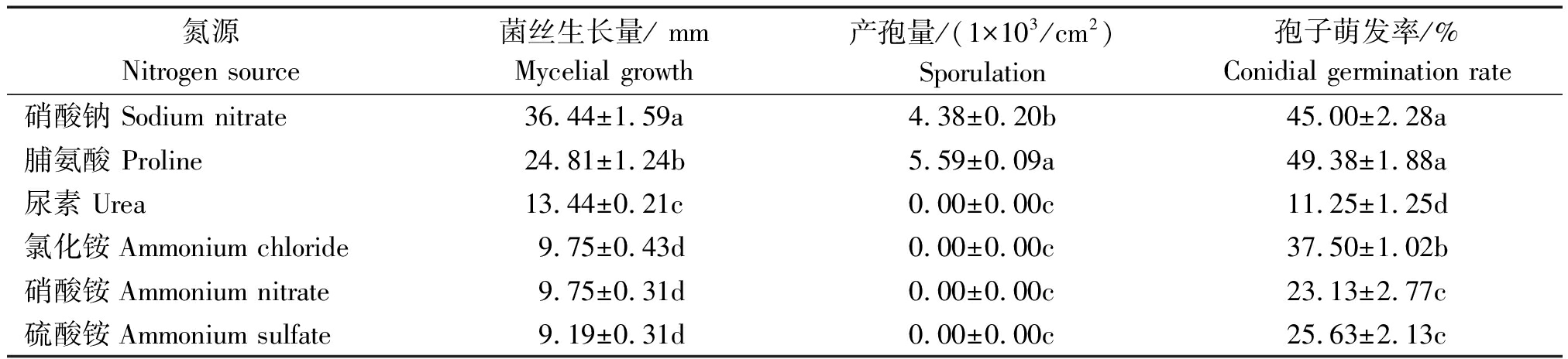
氮源Nitrogen source菌丝生长量/ mmMycelial growth产孢量/(1×103/cm2)Sporulation 孢子萌发率/%Conidial germination rate硝酸钠 Sodium nitrate36.44±1.59a4.38±0.20b 45.00±2.28a脯氨酸 Proline24.81±1.24b5.59±0.09a49.38±1.88a 尿素 Urea13.44±0.21c0.00±0.00c11.25±1.25d氯化铵Ammonium chloride9.75±0.43d0.00±0.00c37.50±1.02b硝酸铵Ammonium nitrate9.75±0.31d0.00±0.00c23.13±2.77c硫酸铵Ammonium sulfate9.19±0.31d0.00±0.00c25.63±2.13c
2.4 杀菌剂对麦根腐平脐蠕孢的室内毒力
供试的8种药剂对麦根腐平脐蠕孢的菌丝生长均表现出一定的抑制活性(表3),毒力由强到弱依次为戊唑醇、咯菌腈、咪鲜胺、异菌脲、苯醚甲环唑、吡唑醚菌酯、嘧菌酯和甲基硫菌灵。其中,戊唑醇和咯菌腈的EC50均为0.07 mg/L,毒力比最弱的甲基硫菌灵高96.43倍。相比而言,8种药剂对麦根腐平脐蠕孢孢子萌发的抑制效果较差。其中,戊唑醇的抑制作用最差,其EC50为575.71 mg/L,咯菌腈和吡唑醚菌酯的抑制效果相对较好,EC50分别为2.80,5.37 mg/L,二者毒力是戊唑醇毒力的205.61,107.21倍。
表3 八种杀菌剂对麦根腐平脐蠕孢的毒力
Tab.3 Toxicity of eight fungicides against B. sorokiniana
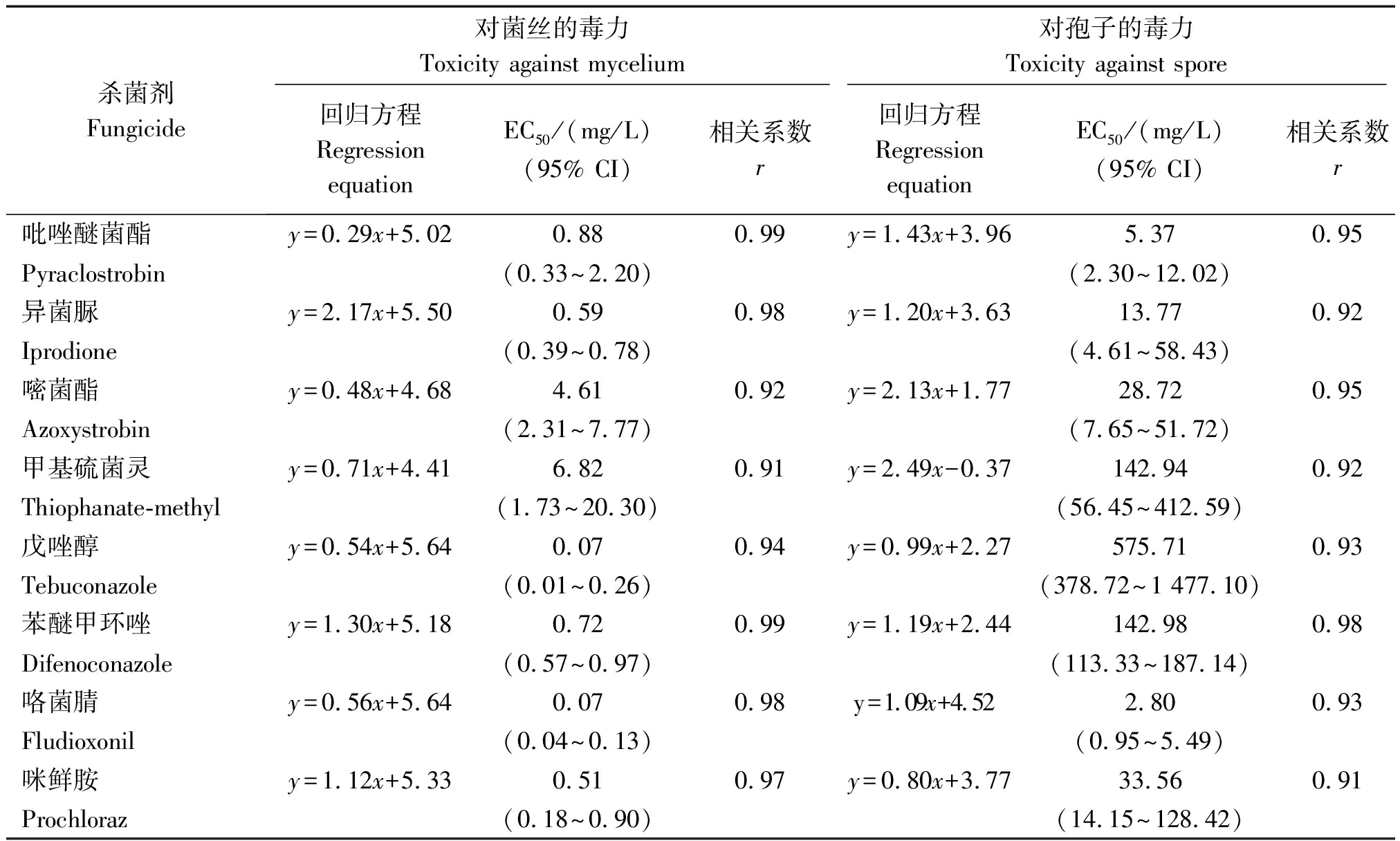
杀菌剂Fungicide对菌丝的毒力Toxicity against mycelium对孢子的毒力Toxicity against spore回归方程RegressionequationEC50/(mg/L) (95% CI)相关系数r回归方程RegressionequationEC50/(mg/L) (95% CI)相关系数r吡唑醚菌酯y=0.29x+5.020.88 0.99y=1.43x+3.965.370.95Pyraclostrobin(0.33~2.20)(2.30~12.02)异菌脲y=2.17x+5.500.590.98y=1.20x+3.6313.770.92Iprodione(0.39~0.78) (4.61~58.43)嘧菌酯y=0.48x+4.684.610.92y=2.13x+1.7728.720.95Azoxystrobin (2.31~7.77) (7.65~51.72)甲基硫菌灵y=0.71x+4.416.820.91y=2.49x-0.37142.940.92Thiophanate-methyl (1.73~20.30) (56.45~412.59)戊唑醇 y=0.54x+5.640.070.94y=0.99x+2.27575.71 0.93Tebuconazole (0.01~0.26)(378.72~1 477.10)苯醚甲环唑y=1.30x+5.180.720.99y=1.19x+2.44142.980.98Difenoconazole (0.57~0.97) (113.33~187.14)咯菌腈 y=0.56x+5.640.070.98y=1.09x+4.522.80 0.93Fludioxonil (0.04~0.13)(0.95~5.49)咪鲜胺 y=1.12x+5.330.51 0.97y=0.80x+3.7733.560.91Prochloraz(0.18~0.90) (14.15~128.42)
3 讨论
玉米麦根腐平脐蠕孢叶斑病的发生程度与病原菌的生物学特性有直接关系。本研究以分离自玉米叶部病斑的麦根腐平脐蠕孢菌株为研究对象,分析了温度、pH值以及碳/氮源等因素对其菌丝生长、产孢及孢子萌发等生物学特性的影响,以期为进一步开展病原致病机理研究提供理论基础。研究结果表明,适宜玉米麦根腐平脐蠕孢孢子萌发、菌丝生长和产孢的温度分别为20~35 ℃,20~30 ℃,20~25 ℃,相比之下孢子萌发对温度的适应性较强。菌丝生长和孢子萌发的最适温度均为28 ℃,最适合产孢的温度为25 ℃,与西藏秋播燕麦菌株、吉林草坪草菌株、内蒙古小麦菌株、海南牛筋草菌株有所差异[8-11]。由此可见,玉米麦根腐平脐蠕孢的生长和繁殖偏好低温,高温不利于叶斑病害的发生和流行,这和该病在黄淮海区域的田间发生情况相吻合。在黄淮海夏玉米区,苗期气温较高,孢子可萌发侵入并造成第一个发病高峰,但随后的高温可能抑制了病原菌在植株体内的扩展和孢子的产生,病情不再发展;后期气温回落,病原菌再次侵染植株叶片,引起第二次发病高峰。如遇持续阴雨,温度降低,可能会造成病害的流行。玉米麦根腐平脐蠕孢对pH值的要求与已有研究的菌株略有不同,本研究所用菌株在中性偏碱(pH值7和8)条件下菌丝生长更快和孢子萌发率更高,而上述研究则多认为中性或偏酸环境更适合菌丝生长和孢子萌发;供试菌株在pH值7时产孢量最高,而来自草坪草和牛筋草的菌株需要偏碱的条件(pH值8)[8-11]。此外,本研究表明,最适合玉米麦根腐平脐蠕孢菌丝生长的氮源是硝酸钠,而尿素、硝酸铵、硫酸铵、氯化铵等不利于该菌生长,但杨叶等[11]认为硝酸钠对菌丝生长有抑制作用,张婕等[9]认为硝酸铵、硫酸铵、氯化铵均有利于菌丝生长。有研究表明,麦根腐平脐蠕孢在人工培养基上极易产生变异[22-23]。在自然界中,随着病原菌与不同寄主的长期协同进化,某些有利于病原菌致病的变异有可能被保存下来,进而使病原菌发展成不同的寄生专化型[24]。本研究所用菌株与已报道菌株差异较大的生物学特性有可能是不同寄主专化型所致,需在分子生物学水平进一步比较分析,并测定不同来源菌株的交互致病能力才能进一步证实。
本研究测定了8种杀菌剂对玉米叶斑病菌麦根腐平脐蠕孢的毒力。所用药剂分为三唑类(戊唑醇和苯醚甲环唑)、吡咯类(咯菌腈)、咪唑类(咪鲜胺)、苯并咪唑类(甲基硫菌灵)、甲氧基丙烯酸酯类(吡唑醚菌酯和嘧菌酯)和二甲酰亚胺类(异菌脲)。试验结果表明,三唑类的戊唑醇和吡咯类的咯菌腈对供试菌株菌丝生长具有较强的抑制作用,同时咯菌腈对孢子的萌发也有一定的抑制作用。在张海珊等[13]的研究结果中,戊唑醇对菌丝生长的抑制作用略逊于苯醚甲环唑,而本研究中戊唑醇的效果比苯醚甲环唑高10倍左右,这种差异可能与不同来源菌株对药剂的敏感性不同有关。根据病原菌菌丝生长和孢子萌发对温度的要求以及田间病害发生的调查结果,理论上采用种子包衣即可有效控制苗期的发病高峰,而戊唑醇和咯菌腈是常用的种子处理剂,若在田间试验得到进一步证实,则可能成为防治麦根腐平脐蠕孢引起的玉米叶斑病的首选药剂,在该病的防治中有较大的应用潜力。
[1] Manghwar H, Hussain A, Ullah A, Gul S, Shaban M, Khan A H, Ali M, Sani S G A S, Chaudhary H J, Munis M F H. Expression analysis of defense related genes in wheat and maize against Bipolaris sorokiniana[J]. Physiological and Molecular Plant Pathology, 2018, 103: 36-46. doi:10.1016/j.pmpp.2018.04.002.
[2] Sultana M S, Adhikary S K, Islam M M, Rahman S M M. Evaluation of pathogenic variability based on leaf blotch disease development components of Bipolaris sorokiniana in Triticum aestivum and agroclimatic origin[J]. Plant Pathology Journal, 2018, 34(2):93-103. doi: 10.5423/PPJ.OA.08.2017.0175.
[3] Viani A, Sinha P, Sharma T, Bhar L M. A model for forecasting spot blotch disease in wheat[J]. Australasian Plant Pathology, 2017, 46(6):601-609. doi: 10.1007/s13313-017-0514-z.
[4] Agostinetto L, Casa R T, Bogo A, Sachs C, Souza C A, Reis E M, Cunha I C. Barley spot blotch intensity, damage, and control response to foliar fungicide application in southern Brazil[J]. Crop Protection, 2015, 67:7-12. doi: 10.1016/j.cropro.2014.09.012.
[5] 张德珍, 李鹏昌, 陈晓霞, 王彩霞, 于金凤. 山东省小麦根腐病病原菌的分离鉴定[J]. 植物保护学报, 2016, 43(2):233-240. doi: 10.13802/j.cnki.zwbhxb.2016.02.008.
Zhang D Z, Li P C, Chen X X, Wang C X, Yu J F. Isolation and identification of the pathogens causing wheat common root rot in Shandong Province[J]. Journal of Plant Protection, 2016, 43(2):233-240.
[6] 刘露. 雅安市玉米叶斑病的危害及小型叶斑病的病原研究[D]. 雅安: 四川农业大学, 2012.
Liu L. Study on pathogen of small leaf spot disease and the harm of leaf spot disease on maize in Ya′an[D]. Ya′an: Sichuan Agricultural University, 2012.
[7] 郭宁, 倪璇, 石洁, 马井玉, 薛春生, 陈捷. 玉米麦根腐平脐蠕孢叶斑病的发生与病原鉴定[J]. 植物病理学报, 2017, 47(1): 1-8. doi: 10.13926/j.cnki.apps.000049.
Guo N, Ni X, Shi J, Ma J Y, Xue C S, Chen J. The occurrence and pathogen identification of leaf spot on maize[J].Acta Phytopathologica Sinica, 2017, 47(1): 1-8.
[8] 何苏琴, 荆卓琼, 丁文娇, 赵桂琴, 金涛. 西藏秋播燕麦苗期褐斑病病原鉴定及生物学特性研究[J]. 草原与草坪, 2011, 31(5): 30-33. doi: 10.13817/j.cnki.cyycp.2011.05.006.
He S Q, Jing Z Q, Ding W J, Zhao G Q, Jin T. Identification and biological characteristics of pathogen of oat brown leaf spot Tibetan[J]. Grassland and Turf, 2011, 31(5): 30-33.
[9] 张婕, 迟明亮, 刘淑艳. 草坪草离蠕孢叶枯病菌生物学特性的研究[J]. 菌物研究, 2009, 7(2): 89-93. doi: 10.3969/j.issn.1672-3538.2009.02.006.
Zhang J, Chi M L, Liu S Y. Biological characteristics of the pathogen of turfgrass Bipolaris leaf spot[J]. Journal of Fungal Research, 2009, 7(2): 89-93.
[10] 刘正坪, 王立新, 李荣禧, 刘彩凤, 李永杰. 小麦根腐病菌鉴定及其生物学特性测定[J]. 华北农学报, 2002, 17(2): 44-48. doi: 10.3321/j.issn:1000-7091.2002.02.010.
Liu Z P, Wang L X, Li R X, Liu C F, Li Y J. Identification and biological character test of wheat common rot pathogen[J]. Acta Agriculturae Boreali-Sinica, 2002, 17(2): 44-48.
[11] 杨叶, 王兰英, 胡美姣. 牛筋草离孺孢生物学特性及代谢产物活性测定[J]. 微生物学通报, 2009, 36(5): 666-671. doi:10.13344/j.microbiol.china.2009.05.019.
Yang Y, Wang L Y, Hu M J. Biological characteristics and herbicidal activity of metabolites produced by Bipolaris sorokiniana from Eleusine indica[J]. Microbiology, 2009, 36(5): 666-671.
[12] 袁胜亮, 刘峰, 张娜.6种杀菌剂对小麦叶斑根腐病菌的毒力测定[J]. 中国农学通报, 2011, 27(15), 273-276.
Yuan S L, Liu F, Zhang N. Toxicity assay of several chemical fungicides against pathogen of wheat root rot[J]. Chinese Agricultural Science Bulletin, 2011, 27(15): 273-276.
[13] 张海珊, 章东方, 严丹侃, 顾江涛, 张勇. 小麦蠕孢菌叶枯病菌室内药剂筛选[J]. 安徽农业科学, 2013, 41(5): 1945, 2014. doi: 10.3969/j.issn.0517-6611.2013.05.024.
Zhang H S, Zhang D F, Yan D K, Gu J T, Zhang Y. Indoor fungicide screening of Helminthosporium leaf blotch on wheat[J]. Journal of Anhui Agricultural Sciences, 2013, 41(5): 1945, 2014.
[14] 刘振宇, 季延平, 吴玉柱, 刘殷. 药剂对两种草坪草病害病原菌的抑菌效果[J]. 农药, 2002, 43(9): 29-31. doi: 10.3969/j.issn.1006-0413.2002.09.016.
Liu Z Y, Ji Y P, Wu Y Z, Liu Y. Inhibition effect of fungicides on two pathogen of turfgrass diseases: Rhizoctonia solani and Bipolaris sorokiniana[J]. Pesticides, 2002, 43(9): 29-31.
[15] 王春明, 韩青梅, 黄丽丽, 康振生. 3种杀菌剂对小麦黑胚病菌的毒力测定及病害防治作用[J]. 西北农林科技大学学报 (自然科学版), 2006, 34(7): 55-60. doi: 10.3321/j.issn:1671-9387.2006.07.013.
Wang C M, Han Q M, Huang L L, Kang Z S. Control of 3 fungicides against wheat black point in vitro and in vivo[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2006, 34(7): 55-60.
[16] 李东臣. 山东德州市小麦主要病害防治技术研究[D]. 泰安: 山东农业大学, 2007. doi:10.7666/d.y1374621
Li D C. Research in technology to control major wheat diseases in Dezhou City Shandong Province[D]. Taian: Shandong Agricultural University, 2007.
[17] 梁萍, 宁平, 简峰, 黄艳花, 王露儒, 陈立和. 黄脉爵床棒孢霉叶斑病病原菌及其生物学特性鉴定[J]. 植物病理学报, 2018, 48(6):758-765. doi:10.13926/j.cnki.apps.000236.
Liang P, Ning P, Jian F, Huang Y H, Wang L R, Chen L H. Identification and biological characteristics of Corynespora cassiicola causing leaf spot on Sanchezia nobilis[J]. Acta Phytopathologica Sinica, 2018, 48(6): 758-765.
[18] 徐建强, 杨改凤, 田娟, 车志平, 康业斌. 三种杀菌剂对牡丹红斑病病菌分生孢子形成和萌发的影响[J]. 植物保护学报, 2016, 43(5): 850-857. doi: 10.13802/j.cnki.zwbhxb.2016.05.020.
Xu J Q, Yang G F, Tian J, Che Z P, Kang Y B. Effects of carbendazim, tebuconazole and azoxystrobin on sporulation and conidial germination of Cladosporium paeoniae causing tree peony red spot[J]. Journal of Plant Protection, 2016, 43(5): 850-857.
[19] 刘树森, 胡清玉, 杨扬, 李坡, 马红霞, 石洁. 培养条件及杀菌剂对玉米穗腐病菌可可毛色二孢生长的影响[J]. 热带作物学报, 2018, 39(8): 1611-1617. doi: 10.3969/j.issn.1000-2561.2018.08.021.
Liu S S, Hu Q Y, Yang Y, Li P, Ma H X, Shi J. Effects of culture conditions and fungicides on growth of Lasiodiplodia theobromae causing maize ear rot[J]. Chinese Journal of Tropical Crops, 2018, 39(8): 1611-1617.
[20] 高杨杨, 禾丽菲, 李北兴, 林琎, 慕卫, 刘峰. 山东省辣椒上尖孢炭疽复合种对吡唑醚菌酯的敏感基线及吡唑醚菌酯增效配方筛选[J]. 农药学学报, 2017, 19(6): 701-707. doi: 10.16801/j.issn.1008-7303.2017.0096.
Gao Y Y, He L F, Li B X, Lin J, Mu W, Liu F. Baseline sensitivity to pyraclostrobin of Colletotrichum acutatum species complex collected from chili in Shandong Province and the screening of synergistic formula[J]. Chinese Journal of Pesticide Science, 2017, 19(6): 701-707.
[21] 刘欣, 王明爽, 梅秀凤, 姜丽英, 韩国兴, 李红叶. 柑橘黑点病菌种群对代森锰锌的敏感性评价及其替代药剂的筛选[J]. 植物保护学报, 2018, 45(2): 373-381. doi: 10.13802/j.cnki.zwbhxb.2018.2016175.
Liu X, Wang M S, Mei X F, Jiang L Y, Han G X, Li H Y. Sensitivity evaluation of Diaporthe citri populations to mancozeb and screening of alternative fungicides for citrus melanose control[J]. Journal of Plant Protection, 2018, 45(2): 373-381.
[22] 马桂珍. 麦根腐平脐蠕孢病菌的菌落变异研究[J]. 河北农业技术师范学院学报, 1997, 11(1): 38-41.
Ma G Z. Study on the bacterial colony dissociation of Bipolaris sorokiniana[J]. Journal of Hebei Agrotechnical Teachers College, 1997, 11(1): 38-41.
[23] 袁丽红, 陆家云. 麦根腐平脐蠕孢菌株变异及致病力分化研究[J]. 南京农业大学学报, 1992, 15(2): 45-50. doi: 10.7685/j.issn.1000-2030.1992.02.008.
Yuan L H, Lu J Y. Studies on strain variations and pathological differentiation of Bipolaris sorokiniana[J]. Journal of Nanjing Agricultural University, 1992, 15(2):45-50.
[24] Kumar J, Schäfer P, Hückelhoven R, Langen G, Baltruschat H, Stein E, Nagarajan S, Kogel K H. Bipolaris sorokiniana, a cereal pathogen of global concern: cytological and molecular approaches towards better control[J]. Molecular plant pathology, 2002, 3(4): 185-195. doi: 10.1046/j.1364-3703.2002.00120.x.