无花果(Ficus carica L.)为桑科(Moraceae)无花果属(Ficus)植物,原产于亚热带地区的阿拉伯半岛南部[1],是人类最早改良栽培的果树之一[2],因雌雄异花,隐于囊状总花托内,外观只见果而不见花,故名无花果[3]。因其具有较高药用价值和特殊的营养保健功能而受到人们的青睐,并被誉为“21世纪人类健康的守护神”[4-6]。虽然无花果对生长条件的要求并不严格,但容易受到环境影响,在抗旱、抗寒、耐盐碱等方面仍需要科学指导。
水分是植物生长发育必不可少的条件之一,目前,由于环境的变化,使果树的干旱缺水情况更加严重,极大地影响了果树的生长和水果的品质[7]。解决果树栽培中的干旱缺水问题,除了采取节水措施外,加强果树的抗旱机理研究,筛选抗旱性强的品种也是一个非常重要的途径[8]。干旱胁迫下,果树等木本植物的生理反应主要表现在叶片含水量、叶绿素、荧光特性、膜透性、渗透调节物质(MDA、可溶性糖、可溶性蛋白、脯氨酸)、酶活性(SOD、POD、CAT)、根系活力等的变化[9-10]。现阶段无花果的抗逆研究主要集中于抗寒和耐盐等方面,如袁方等[11]采用电导法测定了不同品种无花果的抗寒性;尤超等[12]研究了不同品种无花果的耐盐特性,未涉及无花果抗旱生理的研究,本研究通过测定不同品种无花果在不同程度干旱胁迫下各项生理指标,研究无花果抗旱机理,并利用隶属函数法对其抗旱性进行综合评价,为无花果抗旱品种的选择提供理论依据。
1 材料和方法
1.1 试验材料
试验材料为波姬红、玛斯义·陶芬、中国紫果、青皮4个无花果品种,选取长势一致的1年生扦插苗置于口径为27 cm的塑料花盆中,盆土为营养土加田园土(比例1∶1)混合而成,每盆1株,放置于四川农业大学成都校区园艺学院塑料大棚内,正常培养。
1.2 试验设计
试验设置5个程度的干旱处理,分别为正常供水CK(田间持水量的70%~75%)、轻度干旱LD(田间持水量的50%~55%)、中度干旱MD(田间持水量的40%~45%)、重度干旱SD(田间持水量的30%~35%)、极度干旱ED(田间持水量的20%~25%),以单株为处理,每处理4次重复。于2018年6月进行干旱胁迫,先充分浇水,使每盆土壤含水量一致,然后等其自然落干,等土壤含水量达到试验要求后,每天上午8点用称质量法以及土壤含水量测量仪将土壤干旱程度共同控制在设定范围内;胁迫第14天进行叶绿素荧光特性的测定后采样,选取植株顶端向下第2~3的成熟叶片,采样后立即将样品用液氮冷冻后置于-80 ℃保存、待测。
1.3 生理指标测定方法
叶片相对含水量:采用烘干法测定;叶绿素含量:采用95%乙醇浸提法测定[13];叶绿素荧光特性:采用PAM-2100调制式叶绿素荧光仪测定[14];相对电导率:采用电导率仪测定;丙二醛(MDA)含量:采用硫代巴比妥酸(TAB)法测定;根系活力:采用四氮唑还原法测定;超氧化物歧化酶(SOD)活性:采用氮蓝四唑(NBT)光还原法测定;过氧化物酶(POD)活性:采用愈创木酚法测定;过氧化氢酶(CAT)活性:采用磷酸缓冲液法测定;可溶性糖(SS)含量:采用蒽酮比色法测定;可溶性蛋白(SP)含量:采用考马斯亮蓝法测定;游离脯氨酸(Pro)含量:采用磺基水杨酸法测定[15]。以上指标均3次重复取平均值。
1.4 数据处理
所测得数据用Excel 2010软件进行整理,用SPSS进行显著性分析,采用隶属函数法对4种无花果的抗旱性进行综合评价。当所测指标与抗旱性成正相关时,隶属函数值计算公式为:U(X)=(X-Xmin)/(Xmax-Xmin);当所测指标与抗旱性成负相关时,计算公式为:U(X)=(1-(X-Xmin)/(Xmax-Xmin)),求出每个品种的平均隶属函数值,数值越大,表明该品种抗旱性越强[16]。
2 结果与分析
2.1 干旱胁迫对4个无花果品种根系活力的影响
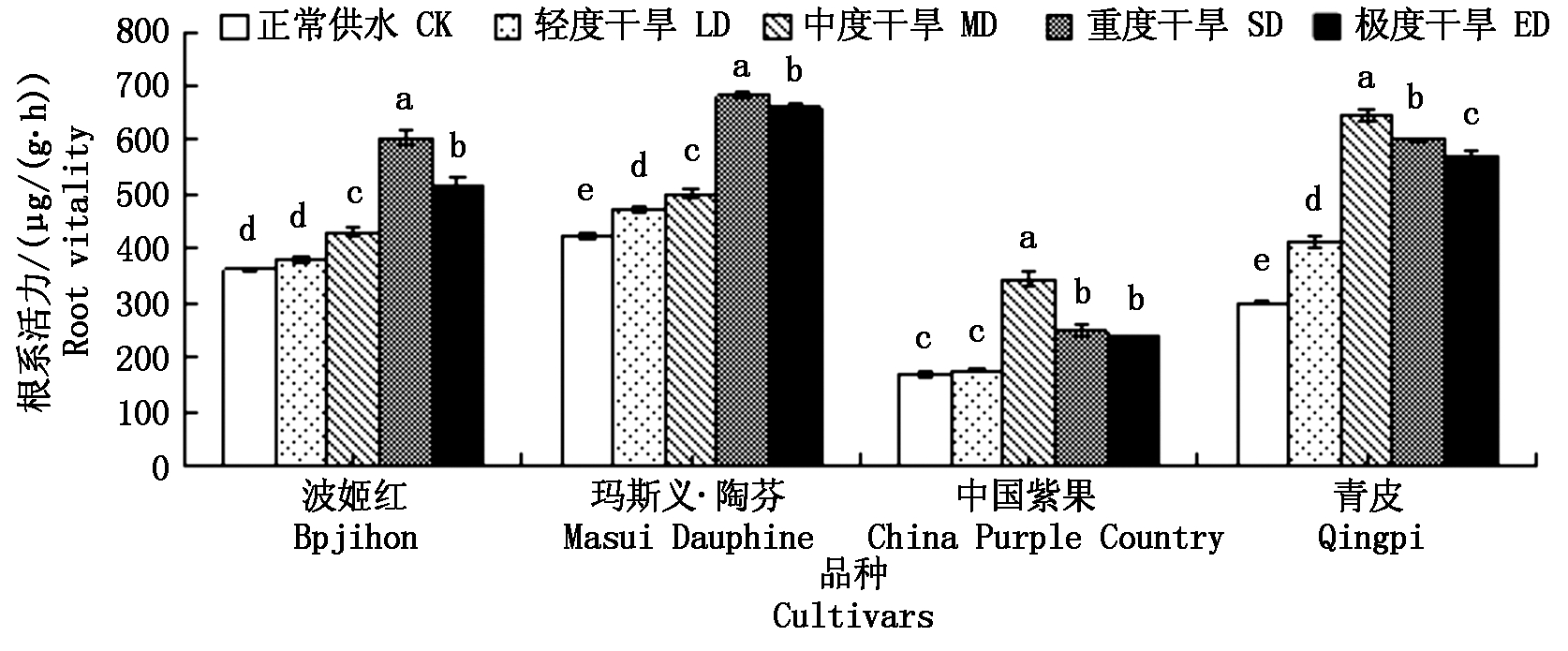
由图1可知,随着土壤水分的减少,4个品种的根系活力变化趋势均为先增加后减少。波姬红、玛斯义·陶芬在重度胁迫时出现较大增幅,且此时根系活力最大,根系活力分别上升了241.52,259.09;中国紫果,青皮在中度胁迫时出现较大增幅,且此时根系活力达到最大,根系活力分别上升了176.15,344.29。4个品种出现根系活力峰值后,都有下降趋势,但与对照相比,差异仍显著。
不同小写字母代表5 种干旱处理间差异显著(P <0. 05)。图2-7同。
Different lowercase letters represent significant differences among the five drought treatments (P<0.05). The same as Tab.2-7.
图1 干旱胁迫对4个无花果品种根系活力的影响
Fig.1 Effect of drought stress on root activity of four Fig cultivars
2.2 干旱胁迫对4个无花果品种叶片相对含水量的影响
由图2可知,随着干旱程度的增加,4个品种无花果的叶片相对含水量都呈下降趋势,其中,中国紫果下降最为显著,在轻度干旱下迅速下降到60.71%,在中度干旱下为其余3个品种波姬红、 玛斯义·陶芬、青皮在极度干旱下的叶片相对含水量分别为65.19%,66.33%,57.99%,相比对照分别下降了23.40,21.79,27.20百分点。
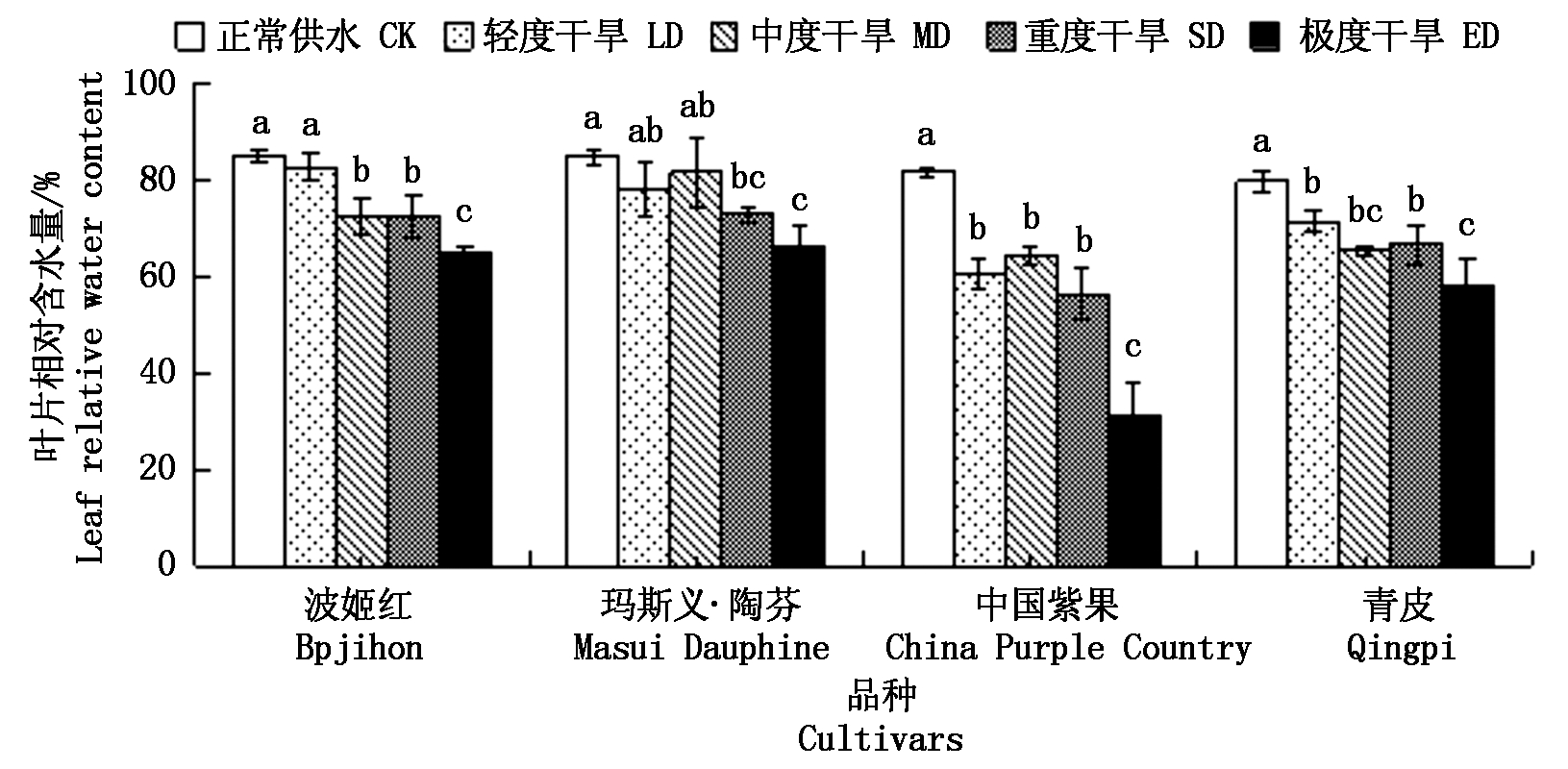
图2 干旱胁迫对4个无花果品种叶片相对含水量的影响
Fig.2 Effect of drought stress on relative water content of leaves of four fig cultivars
2.3 干旱胁迫对4个无花果品种叶绿素含量的影响
由图3可知,随着干旱程度的增加,4个无花果品种叶绿素总含量均显著下降,在极度干旱时表现为最低,其中,波姬红、玛斯义·陶芬、中国紫果均在轻度干旱时出现较大降幅,相比对照分别下降了21.03%,10.82%,11.06%,青皮叶绿素总含量在重度干旱前的降低幅度都比较小,在干旱胁迫达到极度时出现较大降幅,相比对照降低了14.17%,同时观察到4个品种的叶片在极度干旱时都出现大部分变黄脱落的情况,说明在受到干旱时无花果叶片的叶绿素合成开始受阻,随着干旱程度的增加叶片叶绿素的分解也加快。
2.4 干旱胁迫对4个无花果品种叶绿素荧光特性的影响
Fv/Fm和Y(Ⅱ)这2个参数表示的都是 PSⅡ将吸收的光能转化成化学能的效率。由图4可知,在正常情况下4个品种的Fv/Fm值和Y(Ⅱ)值基本都在同一水平,随着干旱程度的增加,波姬红Fv/Fm值轻微下降,变化幅度较小,Y(Ⅱ)值在重度干旱下大幅度下降,其余3个品种的Fv/Fm值和Y(Ⅱ)值变化都非常显著,其中玛斯义·陶芬的Fv/Fm值随着干旱程度的增加显著下降,在极度干旱下达到最低值0.77,相比对照组下降幅度为4.76%, Y(Ⅱ)值在轻度干旱时无明显变化,在中度干旱时出现明显下降,下降幅度为17.71%,重度和极度干旱时下降幅度分别47.20%,47.19%;中国紫果和青皮在轻度干旱时Fv/Fm值出现明显下降,在极度时达到最低,相比对照组下降幅度分别为5.96%,2.67%,在中度干旱时Y(Ⅱ)值出现明显下降,下降幅度分别为66.90%,37.85%。
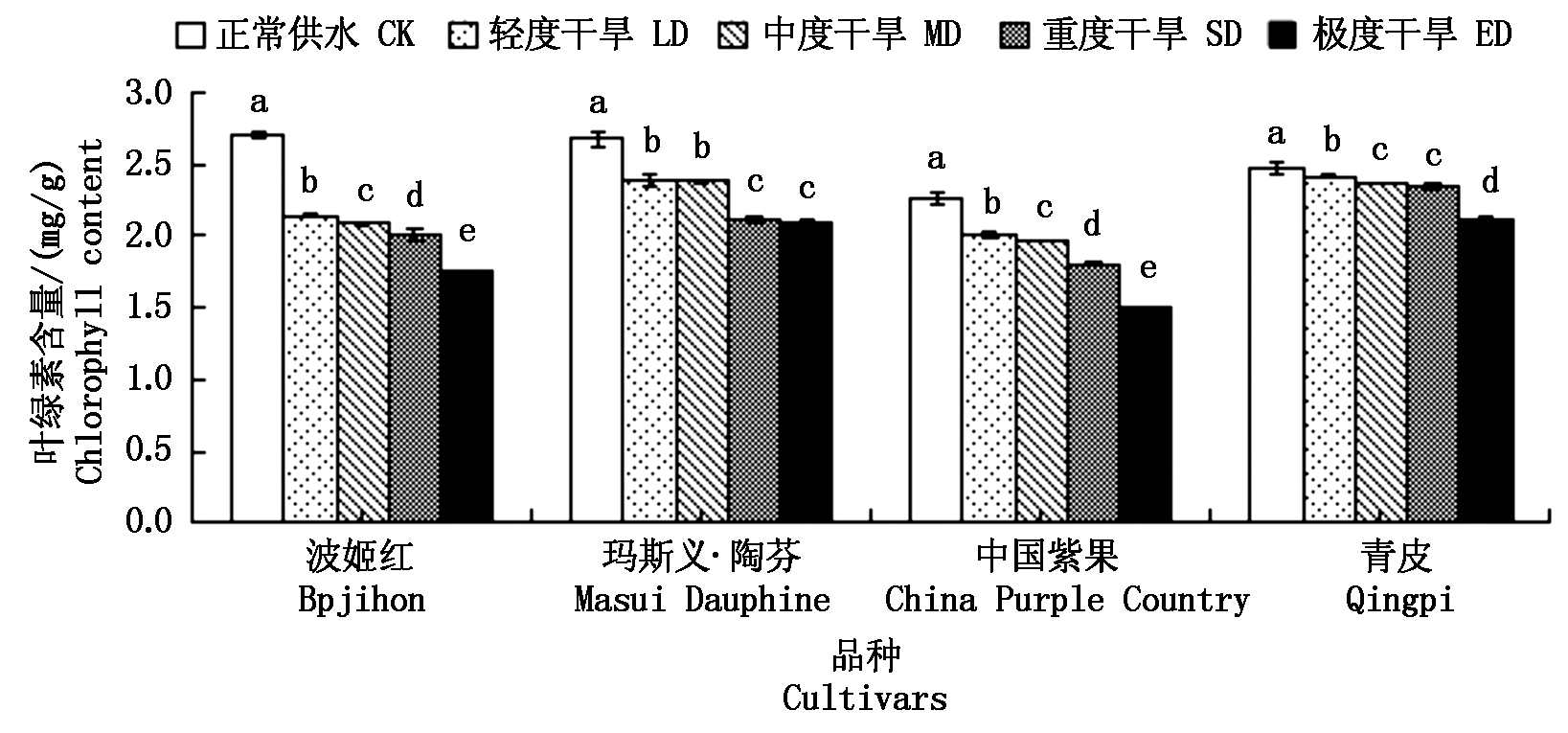
图3 干旱胁迫对4个无花果品种叶绿素总含量的影响
Fig.3 Effect of drought stress on total chlorophyll content of four fig cultivars

图4 干旱胁迫对4个无花果品种叶绿素荧光特性的影响
Fig.4 Effect of drought stress on chlorophyll fluorescence characteristics of four fig cultivars
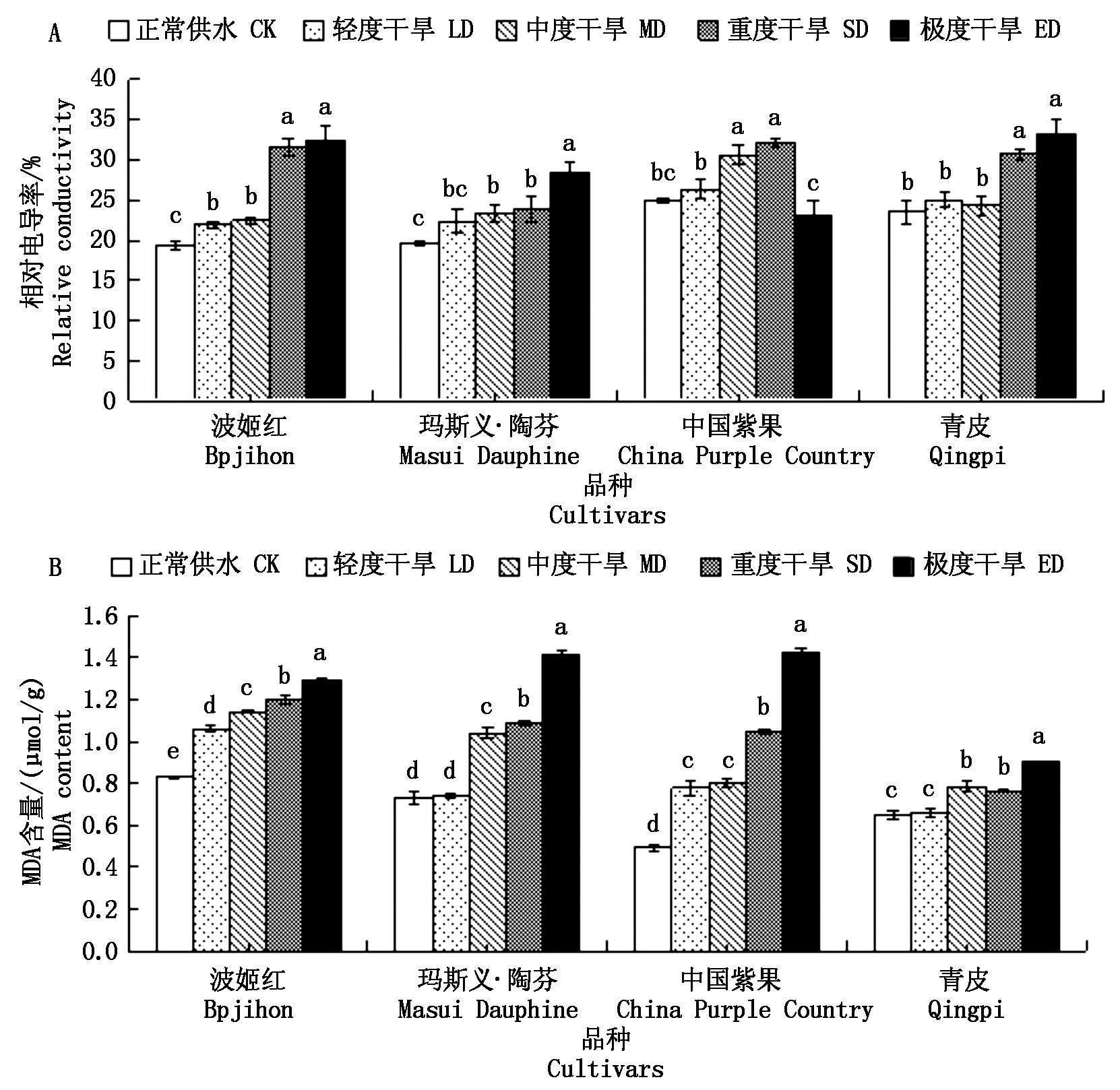
图5 干旱胁迫对4个无花果品种叶片电导率和MDA含量的影响
Fig.5 Effect of drought stress on leaf conductivity and MDA content of four fig cultivars
2.5 干旱胁迫对4个无花果品种叶片电导率和MDA含量的影响
由图5可知,随着干旱胁迫程度的加剧,相对电导率和MDA含量总体呈上升趋势,波姬红和青皮在重度干旱时上升幅度较大,分别为12.18%,7.19%;中度、轻度胁迫和对照之间差异不显著。玛斯义·陶芬在极度干旱时上升8.77百分点,上升幅度较大;重度、中度、轻度胁迫之间差异不显著。中国紫果在重度干旱处理下出现上升峰值,相对电导率相比对照上升了7.18百分点,极度干旱处理下反而呈下降趋势,相比重度处理下降了8.96百分点,相比对照下降了1.78百分点。随着干旱程度的加重,4个无花果品种的MAD含量均显著上升,并且都在极度干旱时达到最大值,其中波姬红和青皮上升比较平缓,在极度干旱时分别增加了0.46,0.25,而玛斯义·陶芬在轻度干旱时变化不明显,在中度和极度干旱时均出现较大增幅,分别为42.67%,29.36%,中国紫果在轻度和极度时出现较大增幅,并且在极度干旱时达到4个品种的最大值1.42,同时中国紫果在正常供水的情况下MDA含量也比其他3个品种低。
2.6 干旱胁迫对4个无花果品种叶片渗透调节物质的影响
由图6可知,4个品种的可溶性糖含量变化总体呈上升趋势,其中,中国紫果可溶性糖含量在重度胁迫时上升最多,为2.41 mg/g,且各处理间差异显著;波姬红在重度胁迫下出现较大涨幅,相比中度胁迫上升了0.93 mg/g,轻度与中度胁迫之间差异不显著,重度与极度胁迫之间无显著差异;玛斯义·陶芬在中度与重度胁迫下出现2次较大涨幅,分别为0.68,1.15 mg/g,但对照处理与轻度胁迫之间差异不显著,重度与极度胁迫之间无显著差异;青皮在轻度胁迫处理下出现最大涨幅,相比对照处理上升了1.59 mg/g,但各处理间差异均不显著。随干旱胁迫程度的加重,青皮的可溶性蛋白含量呈先下降再升高的趋势,但各处理间差异不显著;玛斯义·陶芬的各个处理的可溶性蛋白含量随干旱胁迫程度加深而降低,极度胁迫时与对照相比分别下降了0.96,1.51 mg/g,中国紫果的轻度、中度和重度胁迫处理间无显著差异。4个无花果品种的Pro含量总体呈上升趋势且与对照差异显著,波姬红和中国紫果在重度胁迫时Pro含量最高,相比对照组分别上升了98.71,50.13 mg/g,且各处理间差异显著;青皮在重度胁迫时Pro含量最高,相比对照组上升了80.9 mg/g,但轻度与中度胁迫间差异不显著;玛斯义·陶芬的Pro含量随干旱胁迫程度加深而增加,极度胁迫时与对照相比上升了53.77 mg/g。
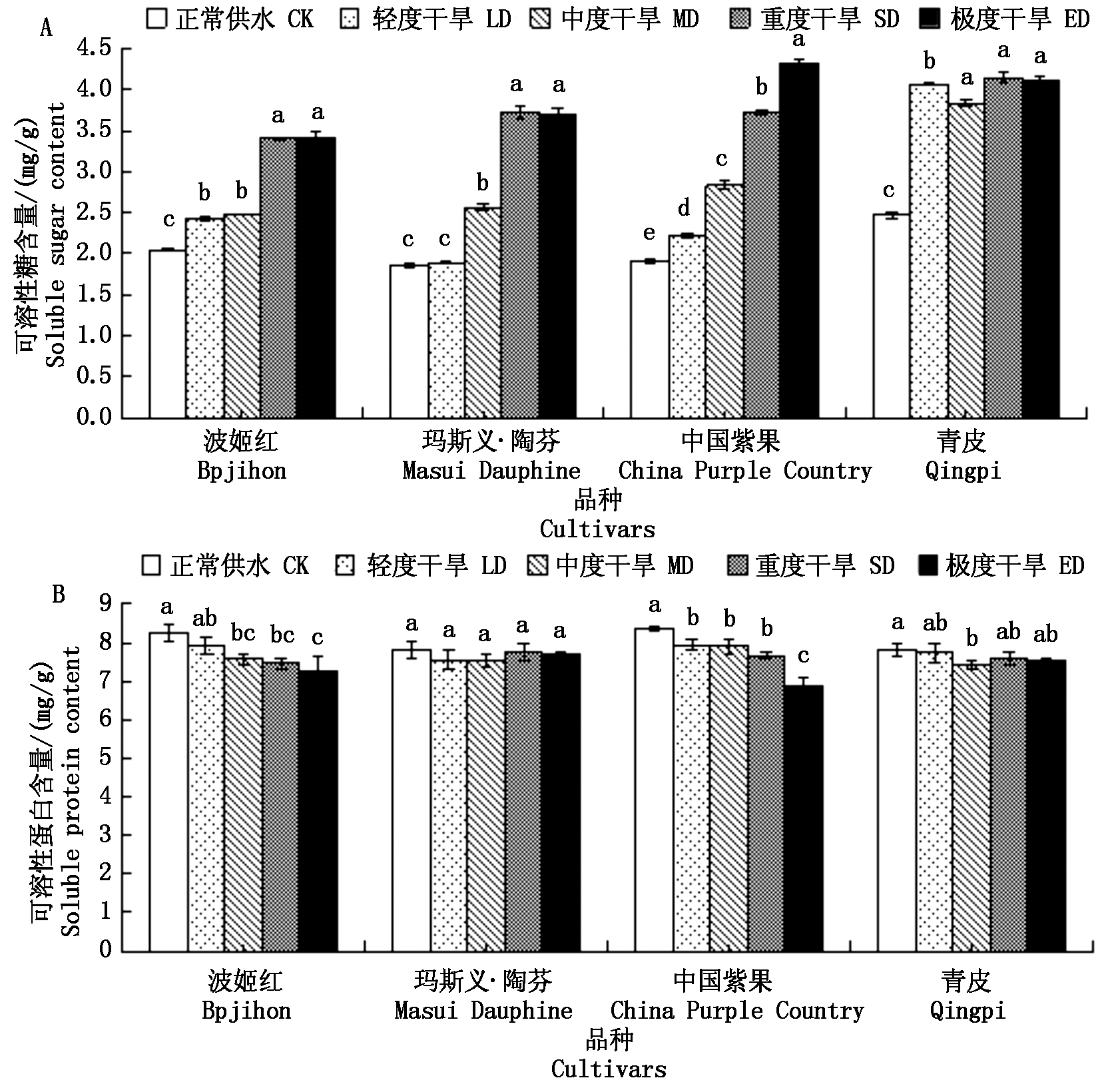
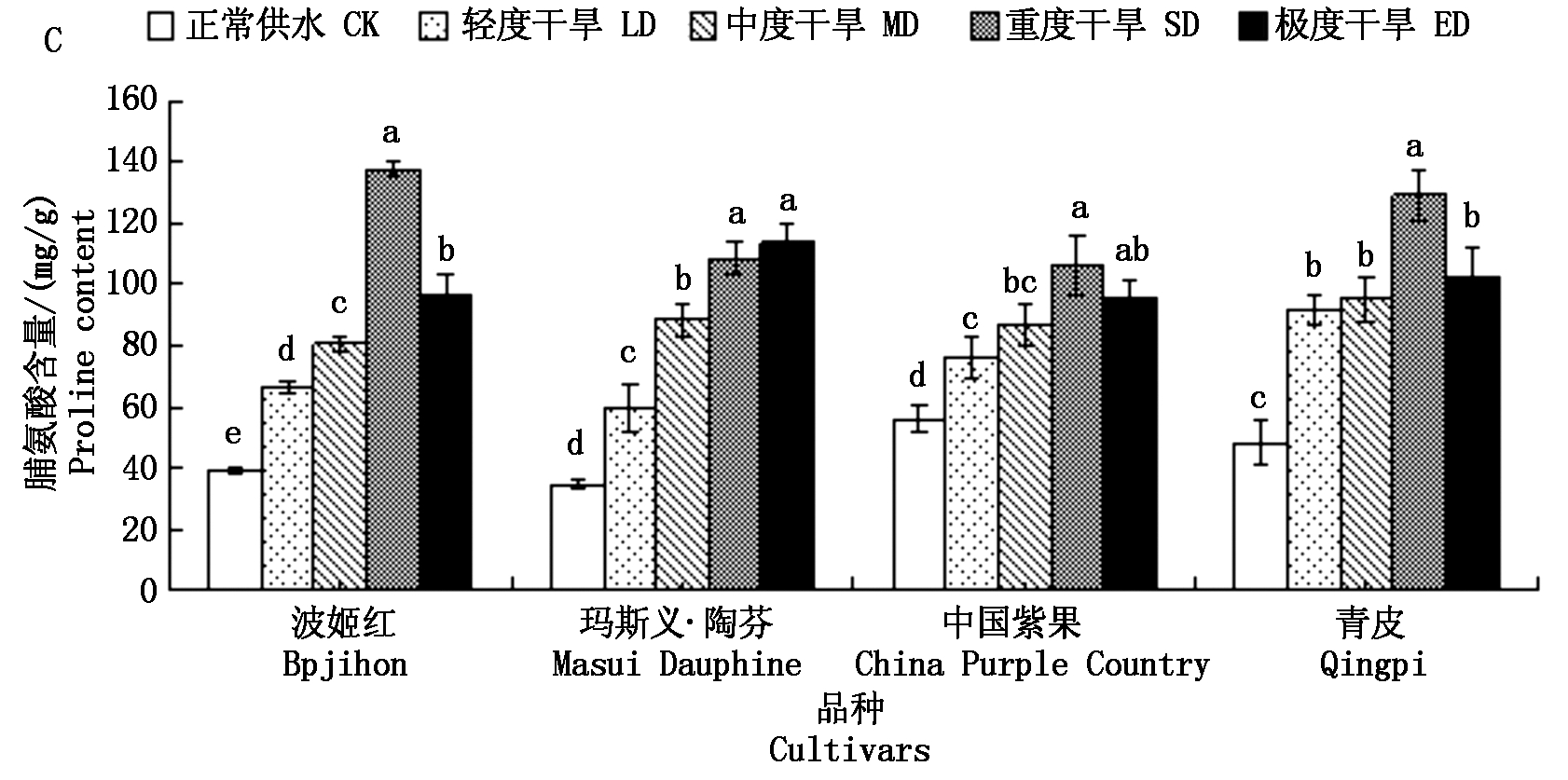
图6 干旱胁迫对4个无花果品种叶片渗透调节物资的影响
Fig.6 Effects of drought stress on osmotic adjustment materials in leaves of four fig cultivars
2.7 干旱胁迫对4个无花果品种叶片抗氧化酶活性的影响
由图7可知,随着干旱程度增加,4个品种的SOD活性(以鲜质量计)变化趋势均为先增加后减少。波姬红、中国紫果和青皮3个品种在中度胁迫时SOD活性最大,SOD活性分别上升了31.22,47.80,72.84 U/(g·min) ;玛斯义·陶芬在轻度胁迫时SOD活性达到最大,上升了75.8 U/(g·min)。青皮在极度干旱处理下,SOD活性相比对照下降了12.76 U/(g·min),表明青皮的SOD活性在极度干旱胁迫下受到抑制。4个胁迫处理的POD活性(以鲜质量计)变化趋势也为先升高后降低。波姬红和玛斯义·陶芬在重度干旱处理下POD活性最大,相比对照分别上升了634.28,568.95 U/(g·min);青皮在中度干旱时POD活性达到最大,相比对照上升了97.41 U/(g·min),而中国紫果在轻度干旱时POD活性就已最大,相比对照分别上升了173.17 U/(g·min)。波姬红、中国紫果和青皮在极度干旱处理下,POD活性相比对照均下降,分别为475.07,484.03,361.20 U/(g·min),表明3个品种无花果的POD活性在极度干旱胁迫下均受到抑制。CAT活性变化趋势也呈现“升高-降低-升高”的变化,其中,中国紫果在重度胁迫下CAT活性上升最大,为21.94 U/(g·min)。
图7 干旱胁迫对4个无花果品种叶片抗氧化酶活性的影响
Fig.7 Effects of drought stress on antioxidant enzyme activities in leaves of four fig cultivars
2.8 抗旱性综合评价
植物抗旱性是一个复合性状,单一指标并不能说明抗旱性强弱,以平均隶属函数值作为无花果抗旱性强弱综合评价标准,平均值越大说明抗旱性越强,由表1可知,4个无花果品种的抗旱能力从大到小为波姬红>玛斯义·陶芬>青皮>中国紫果。
表1 干旱胁迫对4个无花果品种13个
生理生化指标平均隶属函数值
Tab.1 Average subordinate function values of
13 physiological and biochemical indexes
of four fig varieties under drought stress
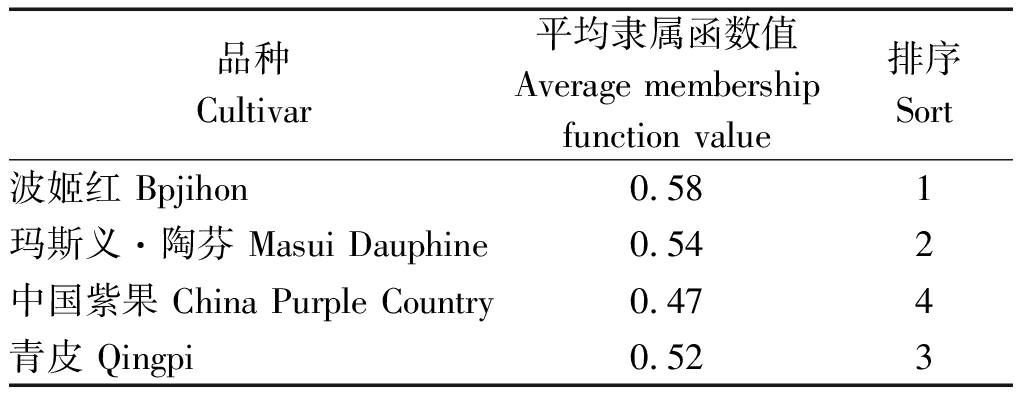
品种Cultivar平均隶属函数值Average membershipfunction value排序Sort波姬红 Bpjihon0.581玛斯义·陶芬 Masui Dauphine0.542中国紫果 China Purple Country0.474青皮 Qingpi 0.523
3 讨论
3.1 无花果抗旱性与根系活力和叶片相对含水量的关系
植物根系最早感受逆境信号,根系活力大小反映了根系代谢能力强弱,直接影响植株的抗逆性[17]。本试验可以发现,无花果根系活力受干旱的影响较大,其中波姬红和玛斯义·陶芬变化一致,随着干旱程度的增加而先增后减,在重度时达到最大;中国紫果和青皮变化一致,在中度干旱时达到最大,可能是由于干旱程度超过其应激限度,根系遭到破坏,所以根系活力出现降低的情况;同时可以发现,波姬红、玛斯义·陶芬、青皮3个品种的根系活力比中国紫果的平均水平要高,说明中国紫果根系呼吸和吸收能力可能相对其他3个品种较弱。叶片相对含水量是衡量植物耐旱能力的重要生理指标,反映植物组织水分亏损程度[18]。本研究结果表明,4个无花果品种随着干旱程度的增加,叶片相对含水量总体呈下降趋势,但玛斯义·陶芬和中国紫果在中度干旱时有略微增加,这可能是由于其为适应干旱环境而提高了对土壤水分的吸收并减少组织水分的亏损有关。
3.2 无花果抗旱性与光合系统的关系
光合作用是果树从外界获取能量的重要途径,而叶绿素是光合作用过程中最重要的光合色素,干旱胁迫会抑制叶绿素的合成并加快叶绿素的分解[19],本研究中,4个无花果品种的叶绿素总含量都不断下降,说明随着干旱程度的增加,无花果的光合产量不断减少,这与王丹等[20]在枇杷上的研究结果相似,其中,中国紫果2个指标下降都非常显著,也说明该品种的抗旱性可能相对较弱。随着叶绿素荧光技术的发展成熟,已有大量研究表明其可以用来快速、无损伤的对植物光合作用进行研究[21],本试验测定PSⅡ最大量子产量(Fv/Fm)和实际量子产量(Y(Ⅱ))的结果显示,4个品种Fv/Fm值和Y(Ⅱ)值都表现为不同程度的下降,在极度干旱时达到最低,表明随着干旱程度的增加,4个无花果品种的光合系统受到不同程度的损伤,光能转化成化学能的效率降低,在极度干旱下光系统功能遭到了严重的破坏。
3.3 无花果抗旱性与细胞膜透性和渗透调节物质的关系
干旱胁迫会造成细胞膜过氧化,使细胞膜选择透过性降低或丧失,细胞内大量离子外渗,导致组织浸出液的相对电导率升高,MDA是膜脂过氧化过程中的一种重要产物,产生之后会加深对细胞膜的损伤程度,从而反映出植物的逆境伤害程度,是检测膜损伤程度的公认指标[22]。本试验所测定的相对电导率和MDA含量结果表示,4个无花果品种的细胞渗透率都随着干旱胁迫程度的增加而增加,而中国紫果在重度干旱时就达到最大,表明中国紫果在重度干旱时叶片细胞膜受到损伤最大;MDA含量也出现显著变化,4个品种均在极度干旱时达到最大,并且玛斯义·陶芬和中国紫果在极度干旱时出现较大幅度的增加,由于无花果本身具有一定的抗旱性,所以很有可能在重度干旱下无花果叶片内大量累积活性氧,细胞膜系统主动防御遭受损伤。
在干旱胁迫下,植物通过提高渗透调节物质细胞溶质浓度,从而降低渗透势、维持植物体内渗透平衡、缓解脱水胁迫、保护细胞结构完整,以此增强植物的抗旱能力[23]。SS、SP和Pro均是植物组织内重要的渗透调节物质,是植物响应干旱胁迫的基本特征。本研究结果表明,随着干旱程度的增加,SS含量显著上升,与SP和Pro相比表现出一定的滞后性,表明无花果叶片的SS含量是干旱胁迫代谢系统中最主要的渗透调节物质,这与周自云等[24]对酸枣的研究结果一致。在干旱胁迫下,蛋白质的合成受到抑制,并且干旱胁迫会诱导蛋白质降解,4个品种无花果的SP含量变化较平缓,有的还出现下降趋势,这表明无花果叶片的SP对干旱胁迫代谢系统不敏感。Pro具有偶极性,表现在其亲水端与水分子结合,疏水端与蛋白质连接,从而使蛋白质通过Pro束缚更多的水,所以植物体内脯氨酸含量在一定程度上反映其体内的水分状况[25],因而可以作为植物缺水情况的参考性生理指标[25]。本研究结果表明,随着干旱胁迫程度的增加,无花果的脯氨酸含量显著增加,在重度或者极度时达到最大值,说明无花果的抗旱性与其叶片中的脯氨酸含量有很大的关系。
3.4 无花果抗旱性与抗氧化酶系统的关系
SOD是抵御氧化损伤的第一道防线,可通过Haber-Weiss反应清除植物体内多余的超氧阴离子,而POD和CAT则进一步将H2O2分解为H2O和O2,清除活性氧物质并减轻膜脂过氧化造成的伤害,维持植物体内的活性氧离子代谢的动态平衡[26],所以SOD、POD、CAT作为植物体内清除活性氧自由基的3种关键酶,是衡量植物抗旱性的关键指标。本研究结果表明,随着干旱程度的加重,4个品种的SOD、POD、CAT活性均呈现升高后降低的趋势,其中SOD活性变化相对稳定,波姬红、中国紫果和青皮都在中度干旱时就达到峰值,其后随着干旱程度的增加而受到抑制,玛斯义·陶芬在轻度干旱时显著升高达到峰值,然后保持相对稳定,说明玛斯义·陶芬在受到干旱前期SOD就积极响应增强其抗氧化能力。4个无花果品种的POD虽都呈先升后降的趋势,但不同品种的POD活性水平不一样且比SOD和CAT活性高很多,其中波姬红POD活性平均水平表现为最高,依次是玛斯义·陶芬、中国紫果、青皮,说明在受到干旱时,POD对无花果的抗旱性起主要作用且各品种的POD作用大小不一样。CAT的变化对无花果的抗旱性影响相对较小,主要在重度干旱时达到峰值,说明CAT主要在干旱加重的时候发挥作用,玛斯义·陶芬在中度胁迫时达到峰值,与SOD变化一致,说明玛斯义·陶芬的SOD和CAT能在轻度干旱时协同响应干旱。以上结果表明,干旱胁迫下无花果叶片通过抗氧化酶的协同作用共同抵御自由基造成的损伤。
综上所述,无花果在干旱胁迫下可以通过提高根系活力,提高抗氧化酶的活性和增加渗透调节物质等措施来减少干旱胁迫所带来的伤害,但在重度或极度干旱时,超出了无花果的耐性阈值,会出现降低的情况,这与大多数植物抗逆研究结果一致。叶片相对含水量、叶绿素含量及叶绿素荧光特性等指标在轻度干旱时就出现下降的情况,说明干旱会影响无花果体内水分利用率和叶绿素的含量,从而影响无花果的光合作用,并且试验中可以观察到随着干旱程度的增加,各品种无花果叶片也出现逐渐变黄的现象;而细胞膜透性和膜质过氧化物呈上升趋势,说明干旱对无花果细胞膜系统有着很大的影响。同时,不同品种在不同程度的干旱下也表现出不同反应,抗旱性强的品种主要表现在根系活力、叶绿素荧光特性及抗氧化酶活性上,比如抗旱性较强的波姬红根系活力明显高于抗旱性弱的中国紫果,POD活性也明显高于其他品种,但叶绿素含量、渗透调节物质等指标的改变却表现出与品种间抗旱性强弱相反的结果,说明以单一指标当作判定标准来进行无花果抗旱性综合评价是不准确的,应使用隶属函数法,综合分析多项指标得出综合评价结果。本研究结果表明,4个无花果品种的平均隶属函数值存在一定差异,可以直接反映出各品种抗旱能力的强弱,分析得到抗旱性相对较强的波姬红以及玛斯义·陶芬有望发展推广至干旱地区,增加经济效率。
[1] Kislev M E, Hartmann A, Bar-Yosef O. Early domesticated fig in the Jordan Valley[J]. Science, 2006,312(5778):1372-1374. doi:10.1126/science.1125910.
[2] Gaughran E R L. Ficin: history and Present status[J]. Quarterly Journal of Crude Drug Research, 1976, 14(1):1-21.doi: 10.3109/13880207609081900.
[3] 张大海, 徐林, 谢彩梅,阿曼古丽. 无花果品种资源及生产现状[C]//中国农业科学院多年生和无性繁殖作物种植资源共享试点研讨会.北京:中国农业科学院,2005.
Zhang D H, Xu L, Xie C M, Oman G L. The status and production status of fig varieties[C]//Pilot workshop on planting resources sharing of perennial and asexual reproduction crops of Chinese Academy of Agricultural Sciences.Beijing:Chinese Academy of Agricultural Sciences, 2005.
[4] 翟进升. 无花果医疗保健作用研究概况[J]. 阜阳师范学院学报(自然科学版), 1999,19(2):14-15,18.
Zhai J S. About the research on effects of medical treatment and health protection of fig [J]. Journal of Fuyang Teachers College(Natural Science), 1999, 19(2): 14-15,18.
[5] 李连庆, 张建国, 马凯. 无花果的栽培利用及开发前景[J]. 四川果树, 1997(1):23-24.
Li L Q, Zhang J G, Ma K. Cultivation and utilization of fig and its development prospects[J]. Sichuan Fruit Tree, 1997(1):23-24.
[6] 高文胜. 21世纪人类康健的守护神——无花果[J]. 农业知识, 2016(4):41-44.doi: 10.3969/j.issn.1000-8241.2016.04.023
Gao W S. The patron saint of human health in the 21st century-fig [J]. Agricultural Knowledge, 2016(4): 41-44.
[7] 李敏, 马悦荣. 高温干旱对果树生长发育的影响及防护措施[J]. 果农之友, 2006(9):16.
Li M, Ma Y R. Effects of high temperature and drought on growth and development of fruit trees and protective measures[J]. Friends of Fruits and Farmers, 2006(9):16.
[8] 唐梁楠. 提高果树抗旱力的方法[J]. 应用科技, 1998(7):20.
Tang L N. Methods for improving drought resistance of fruit trees[J]. Applied Science and Technology, 1998(7):20.
[9] Carvalho R F, Campos M L, Azevedo R A. The role of phytochrome in stress tolerance[J]. J Integr Plant Biol, 2015, 53(12):920-929. doi: 10.1111/j.1744-7909.2011.01081.x.
[10] 付士磊, 周永斌, 何兴元, 陈玮. 干旱胁迫对杨树光合生理指标的影响[J]. 应用生态学报, 2006,17(11):2016-2019.
Fu S L, Zhou Y B, He X Y, Chen W. Effects of drought stress on photosynthetic physiological indexes of Populus pseudo-simonii [J]. Chinese Journal of Applied Ecology, 2006, 17(11):2016-2019.
[11] 袁方, 苏卫国, 张振玲. 不同无花果品种抗寒性的测定[J]. 安徽农业科学, 2014(14):4183-4184, 4285. doi:10.3969/j.issn.0517-6611.2014.14.006.
Yuan F, Su W G, Zhang Z L. Determination of cold tolerance of different varieties of figs [J]. Anhui Agricultural Sciences, 2014(14):4183-4184, 4285.
[12] 尤超, 沈虹, 张营营, 程芳梅, 孙锦, 郭世荣. 不同无花果品种耐盐性与生理生化特征研究[J]. 中国农学通报, 2017,33(1):64-71.
You C, Shen H, Zhang Y Y, Cheng F M, Sun J, Guo S R. Salt tolerance and physiological-biochemical characteristics of different fig cultivars[J]. Chinese Agricultural Science Bulletin, 2017, 33(1): 64-71.
[13] Lichtenthaler H K, Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J]. Analysis, 1983, 5(11):591-592. doi: 10.1042/bst0110591.
[14] 唐敏, 翟秀明, 姚永红, 侯渝嘉, 邬秀宏, 黄尚俊. 不同茶树品种(系)叶绿素荧光参数季节性差异研究[J]. 西南农业学报, 2015,28(1):79-83. doi: 10.16213/j.cnki.scjas.2015.01.014.
Tang M, Zhai X M, Yao Y H, Hou Y J, Wu X H, Huang S J. Research on seasonal variations of chlorophyll fluorescence parameter of different tea cultivars (lines) [J]. Southwest China Journal of Agricultural Sciences, 2015, 28(1): 79-83.
[15] 李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2012.
Li H S. Modern plant physiology[M]. Beijing: Higher Education Press, 2012.
[16] 高晓宁, 赵冰, 刘旭梅, 黄文梅. 4个杜鹃花品种对干旱胁迫的生理响应及抗旱性评价[J]. 浙江农林大学学报, 2017,34(4):597-607. doi: 10.11833/j.issn.2095-0756.2017.04.005.
Gao X N, Zhao B, Liu X M, Huang W M. Physiological response to drought stress and drought resistance evaluation of four Rhododendron cultivars [J]. Journal of Zhejiang A and F University, 2017, 34(4): 597-607.
[17] 杨洪强, 贾文锁, 张大鹏. 植物水分胁迫信号识别与转导[J]. 植物生理学报, 2001,37(2):149-154.
Yang H Q, Jia W S, Zhang D P. Plant signal perception and transduction response to water stress [J]. Chinese Journal of Plant Physiology, 2001, 37(2):149-154.
[18] 董丽华. 草地早熟禾不同品种抗旱性研究[D]. 银川:宁夏大学, 2005. doi: 10.7666/d.y842799.
Dong L H. Study on drought resistance of different varieties of kentucky bluegrass [D]. Yinchuan:Ningxia University, 2005.
[19] Ögren E. Evaluation of chlorophyll fluorescence as a probe for drought stress in willow leaves[J]. Plant Physiol, 1990, 93(4):1280-1285. doi: 10.1104/pp.93.4.1280.
[20] 王丹, 龚荣高, 荣毅. 干旱胁迫对枇杷生理特性及生长的影响[J]. 西北植物学报, 2016,36(7):1399-1407. doi: 10.7606/j.issn.1000-4025.2016.07.1399.
Wang D, Gong R G, Rong Y. Physiological characteristic and growth of loquat under drought stress[J]. Acta Botanica Sinica, 2016, 36(7):1399-1407.
[21] 李钦夫, 李征明, 纪建伟, 邹秋滢, 于辉. 叶绿素荧光动力学及在植物抗逆生理研究中的应用[J]. 湖北农业科学, 2013,52(22):5399-5402. doi: 10.3969/j.issn.0439-8114.2013.22.003.
Li Q F, Li Z M, Ji J W, Zou Q Y, Yu H. Applications of chlorophyll fluorescence kinetics in the physiological resistance studies of plant [J]. Hubei Agricultural Sciences, 2013,52(22):5399-5402.
[22] Hodges D M, Delong J M, Forney C F, Prange, R K. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999, 207(4):604-611.doi: 10.2307/23385611.
[23] 杨涓, 许兴. 盐胁迫下植物有机渗透调节物质积累的研究进展[J]. 农业科学研究, 2003,24(4):86-91.doi: 10.3969/j.issn.1673-0747.2003.04.022.
Yang W, Xu X. Progress of research on accumulation of osmotic substance under salt-stress in plants [J]. Journal of Agricultural Sciences, 2003, 24(4):86-91.
[24] 周自云, 梁宗锁, 李硕, 来威峰. 干旱-复水对酸枣相对含水量、保护酶及光合特征的影响[J]. 中国生态农业学报, 2011,19(1):93-97.doi: 10.3724/SP.J.1011.2011.00093.
Zhou Z Y, Liang Z S, Li S, Lai W F. Effect of water stress and re-watering on relative water content, protective enzyme and photosynthetic characteristics of wild jujube[J]. Chinese Journal of Eco-Agriculture, 2011, 19(1):93-97.
[25] 赵春桥, 陈敏, 侯新村, 朱毅, 武菊英, 范希峰. 干旱胁迫对柳枝稷生长与生理特性的影响[J]. 干旱区资源与环境, 2015,29(3):126-130.doi: 10.13448/j.cnki.jalre.2015.092.
Zhao C Q, Chen M, Hou X C, Zhu Y, Wu J Y, Fan X F. Effect of drought stress on the growth and physiological characteristics of Panicum virgatum L. [J]. Journal of Arid Land Resources and Environment, 2015, 29(3):126-130.
[26] Naya M J, Pereboom D, Ortego J, Alda J O, Lanas A. Superoxide anions produced by inflammatory cells play an important part in the pathogenesis of acid and pepsin induced oesophagitis in rabbits[J]. Gut, 1997, 40(2):175-181.doi: 10.1136/gut.40.2.175.