WRKY蛋白家族是植物中所特有的一类转录因子,在其N端一般存在由60个氨基酸组成的DNA结合域,其中包含有WRKYGQK保守序列(因此被称为WRKY结构域)和一个锌指结构域(CX4-5CX22-23HXH或CX7CX23HXC)[1]。在对靶标基因进行调控时,WRKY蛋白与顺势作用元件中的W-box(C/T)TGAC(C/T)或W盒(TGAC(C/T))进行特异性识别和结合,来调节目的基因的转录,从而实现其生物学功能[2-3]。WRKY蛋白可参与调控植物的生长发育、次生代谢物的合成及生物与非生物胁迫的过程[4-8]。在水稻的基因组中鉴定出100多个WRKY基因的存在[9],发现它们参与调控了水稻对生物和非生物胁迫的响应,水稻的生长发育、形态建成,与SA、JA、GA、ET等激素信号途径的相互作用[10]。为了探明OsWRKY76是否参与调控水稻系统获得抗性,阐明OsWRKY76的功能,本试验根据其cDNA序列,构建了发夹型结构的RNA干扰(RNA interference, RNAi)载体,并转化水稻,获得了沉默株系,为后续的研究奠定了基础。
1 材料和方法
1.1 试验材料
以粳稻品种 Kitaake(Kit)为试验材料,温室中种植,27~32 ℃的自然光下生长。
1.2 载体与试剂
试验中所用的克隆载体为改造的pENTR-D TOPO 载体(Invitrogen)-L16,即在pENTR-D TOPO载体的attL1后人为加入一段多克隆位点。所用双元表达载体GVG-TA7002的启动子为受地塞米松诱导的启动子,Ubi C1300为组成型表达载体,均与pENTR载体兼容,可通过LR反应将目的片段重组到双元表达载体中。
LR ClonaseTM Ⅱ Enzyme Mix 购自Invitrogen公司;TRIzol试剂、RNA反转录试剂盒Prime Script TM 1st Strand cDNA Synthesis Kit、Ex Taq DNA Polymerase、T4 DNA ligase、限制性内切酶、碱性磷酸酶 SAP、RNase A 等均购自TaKaRa 公司; 质粒提取试剂盒及琼脂糖凝胶回收试剂盒等购自天根生化科技有限公司; pEASY-T1克隆载体购自全式金生物科技有限公司;卡那霉素(Kan)、利福平(Rif)等抗生素均购自美国Amerisco公司;其他药品及试剂均为国产分析纯。
1.3 试验方法
1.3.1 总RNA提取及反转录 剪取水稻叶片,用TRIzol法提取总RNA,反转录成cDNA。
1.3.2 OsWRKY76-300片段的克隆 根据OsWRKY76的cDNA序列设计引物,OsWRKY76-5′(TGAATTCTG CCTCGACCTCTGCGTC)和OsWRKY76-3′(TCTGCAG CCGTCTCCATGCTCTCCCT),以cDNA为模板扩增长度为300 bp的片段。引物上分别添加EcoRⅠ和PstⅠ酶切位点,用于后续克隆。将OsWRKY76-300片段克隆到pEASY-T1载体,转化大肠杆菌DH10B感受态细胞,37 ℃过夜培养后,挑取单克隆鉴定。
1.3.3 GUS片段的克隆 GUS片段的克隆以实验室已有的含GUS基因的载体GUS-Ubi-AH27为模板,用引物GUS-5′(TGAATTCATGAAGATGACTTA CG),GUS-3′(TGAATTCGGTTCAGGCACAGCACA)扩增长度为500 bp的GUS片段(GUS 500),引物上均添加EcoRⅠ酶切位点,方便后续克隆。将GUS 500片段克隆到pEASY-T1载体,转化大肠杆菌DH10B感受态细胞,选取单克隆进行鉴定。
1.3.4 OsWRKY76-300 RNAi载体的构建 将OsWRKY76-300-pEASY T1克隆载体用EcoRⅠ和PstⅠ双酶切,胶回收酶切产物;将GUS-pEASY T1克隆载体用EcoRⅠ酶切,胶回收酶切产物,用于后续RNA干扰载体中OsWRKY76-300 2个反向重复片段之间的连接物。再用PstⅠ单酶切pENTR L16,用碱性磷酸酶SAP处理,去除5′末端的磷酸基团,防止载体自连。将OsWRKY76-300分别与GUS 500、L16载体连接,构建dsWRKY76 pENTR L16克隆载体。dsWRKY76 pENTR L16转化DH10B,选取阳性单克隆进行鉴定。
利用Gateway重组技术,将dsWRKY76 pENTR L16载体中的插入片段(由GUS片段连接的OsWRKY76-300反向重复片段)通过LR反应重组到诱导型双元表达载体GVG-TA7002和组成型双元表达载体Ubi-C1300中,转化大肠杆菌DH10B,挑取单克隆鉴定。
1.3.5 诱导型RNAi载体转化水稻 采用冻融法将诱导型RNAi载体转化农杆菌EHA105感受态细胞,利用农杆菌介导法转化水稻Kit获得转基因株系。
1.3.6 转化株系OsWRKY76表达量检测 用100 μmol/L的地塞米松叶面喷施水稻,8 h后取样,提取水稻总RNA,反转录为cDNA。利用引物OsWRKY76-R(CCGGACCTCAAGGAGGTGTG)和OsWRKY76-L(CTAGAATTCGGGCAGCTTCTGGA)通过RT-qPCR分析OsWRKY76表达量,反应程序如下:94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环。
2 结果与分析
2.1 OsWRKY76序列分析
OsWRKY76基因cDNA序列全长984 bp,编码327个氨基酸,预计分子量34.8 ku,预计等电点8.26。根据NCBI网站上预测并分析OsWRKY76具有明显的DNA结合结构域,位于165-225个氨基酸,见图1。
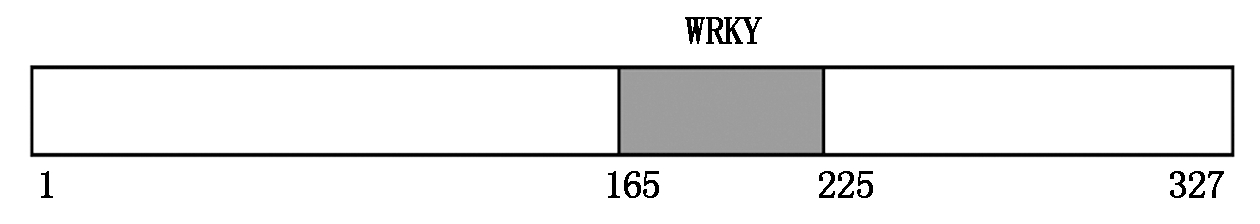
图1 WRKY76结构
Fig.1 Structures of rice WRKY76
2.2 OsWRKY76-300的克隆与鉴定
PCR扩增OsWRKY76-300片段,获得了预期大小的条带(图2),将目的片段克隆到pEASY T1载体,测序结果显示获得了正确的片段。
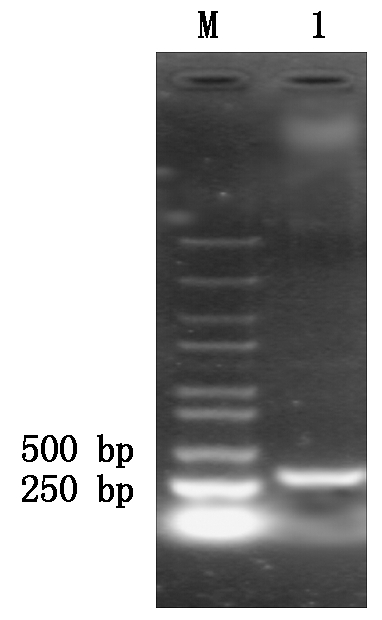
M.DL5000分子量标记;1.扩增的OsWRKY76-300片段。 M.DL5000 molecular weight marker; 1.The amplified fragment of OsWRKY76-300.
图2 OsWRKY76-300片段的PCR扩增结果
Fig.2 PCR amplification results of OsWRKY76-300 fragment
2.3 GUS片段的克隆与鉴定
以含GUS基因的载体GUS-Ubi-AH27为模板,扩增GUS 500片段,结果显示获得了预期大小的片段(图3-A)。将目的片段克隆到pEASY T1载体,用EcoR Ⅰ 进行酶切鉴定,结果见图3-B,产生3 928 bp (pEASY T1载体)和500 bp左右的条带,与预期结果一致。
2.4 OsWRKY76 RNAi载体的构建
用EcoRⅠ和PstⅠ将OsWRKY76-300片段从OsWRKY76-300-pEASY T1载体中切出,用EcoRⅠ将GUS 500片段从GUS-pEASY T1载体中切出,pENTR L16载体用PstⅠ酶切后进行脱磷酸处理,将OsWRKY76-300、GUS 500与pENTR L16载体连接,构建dsWRKY76 pENTR L16克隆载体,见图4。构建好的载体用EcoRⅠ和PstⅠ酶切鉴定,结果见图5,产生了2 628(L16),500,300 bp左右的条带,与预期结果一致。
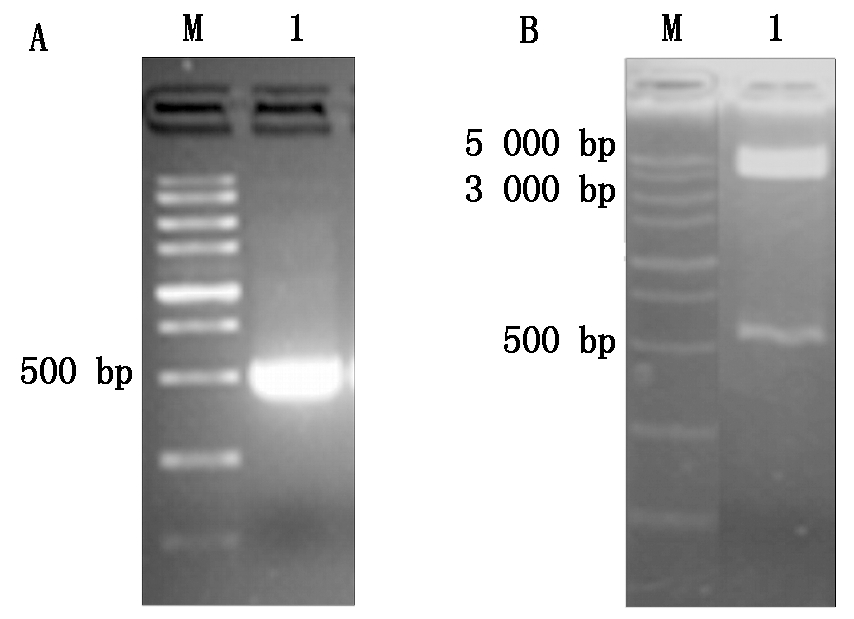
M. DL5000分子量标记;A.GUS 500片段PCR扩增电泳图:1.GUS 500的扩增片段;B.GUS 500-pEASY T1酶切鉴定结果:1.GUS 500-pEASY T1质粒载体经过EcoR Ⅰ单酶切鉴定图谱。
M.DL5000 molecular weight marker; A.PCR amplification result of GUS 500 fragment: 1.Amplified fragment of GUS; B.Enzyme digestion result of GUS 500-pEASY T1: 1.Result of GUS 500-pEASY T1 vector after digestion with EcoR Ⅰ.
图3 GUS 500片段的PCR扩增与鉴定结果
Fig.3 PCR amplification and identification results of GUS 500 fragment
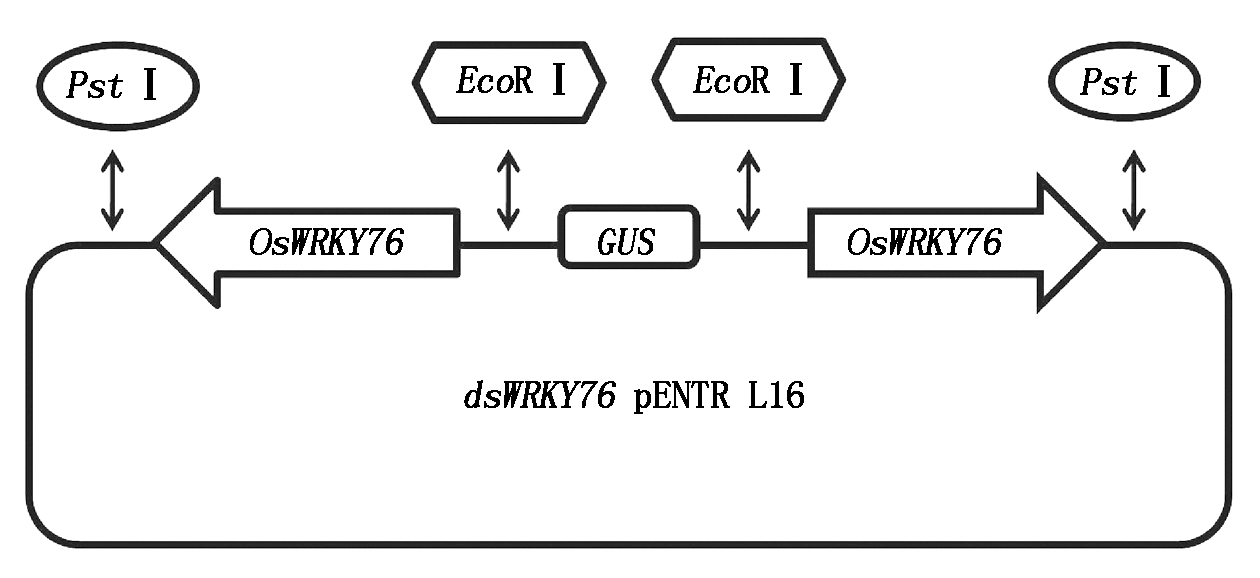
图4 dsWRKY76 pENTR L16干扰载体的构建
Fig.4 Construction of RNAi vector for dsWRKY76 pENTR L16
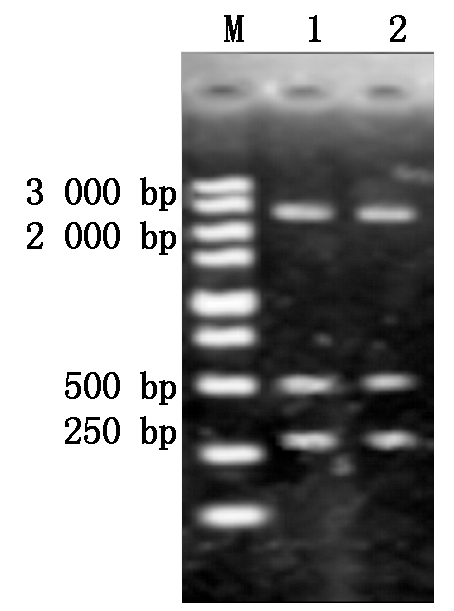
M.DL5000分子量标记;1,2.dsWRKY76 pENTR L16经EcoR Ⅰ和Pst Ⅰ酶切后产生的2 628,500,300 bp大小的片段.
M.The molecular weight marker of DL5000; 1,2.The 2 628,500,300 bp fragments of dsWRKY76 pENTR L16 after digestion with EcoR Ⅰ and Pst Ⅰ, respectively.
图5 dsWRKY76 pENTR L16酶切鉴定图谱
Fig.5 Enzyme digestion result of dsWRKY76 pENTR L16
利用Gateway重组技术,将dsWRKY76 pENTR L16中的插入片段重组到诱导型双元载体GVG-TA7002和组成型双元载体Ubi-C1300中,用SpeⅠ和XhoⅠ对dsWRKY76-GVG-TA7002进行双酶切鉴定;用PstⅠ对dsWRKY76-Ubi-C1300进行酶切鉴定。结果见图6,重组质粒dsWRKY76-GVG-TA7002酶切后产生2条带,1条为GVG-TA7002载体片段,大小为10 kb,由于WRKY76序列中在170 bp左右有XhoⅠ的酶切位点,所以产生第2条带大小约为800 bp。重组质粒dsWRKY76-Ubi-C1300酶切后产生3条带,第1条为Ubi-C1300载体片段,Ubi-C1300载体在2 kb处有PstⅠ酶切位点,所以产生了第2条带,大小约为2 kb,第3条带为dsWRKY76片段,大小约为1 kb。说明2种载体都构建成功。
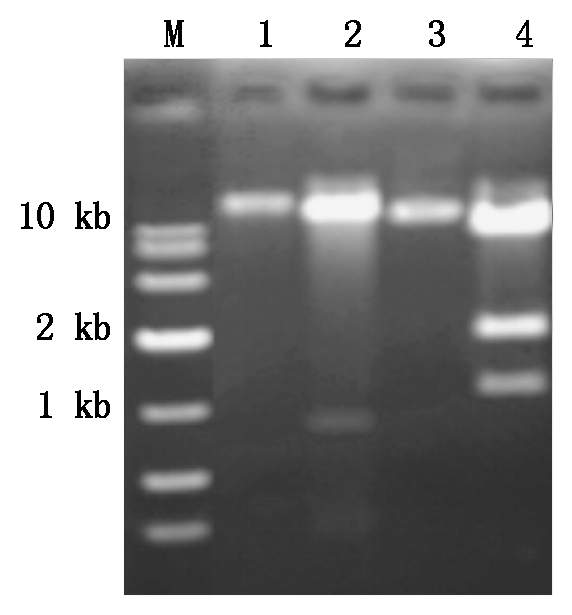
M.DL10000分子量标记;1.未经酶切的WRKY76-GVG-TA7002质粒;2.酶切后的WRKY76-GVG-TA7002;3.未经酶切的WRKY76-Ubi-C1300;4.酶切后的WRKY76-Ubi-C1300。
M.The molecular weight marker of DL10000; 1.WRKY76-GVG-TA7002 plasmid; 2.WRKY76-GVG-TA7002 after enzyme digestion; 3.WRKY76-Ubi-C1300 plasmid; 4.WRKY76-Ubi-C1300 after enzyme digestion.
图6 WRKY76-GVG-TA7002和 WRKY76-Ubi-C1300酶切鉴定图谱
Fig.6 Enzyme digestion results of WRKY76- GVG-TA7002 and WRKY76-Ubi-C1300
2.5 OsWRKY76沉默株系的获得
将WRKY76-GVG-TA7002转化水稻,得到7个转化株系,对其进行OsWRKY76基因表达水平检测,结果显示(图7),其中dsWRKY76-2和dsWRKY76-7株系中OsWRKY76的表达量与未转基因的对照相比具有显著差异,表达量分别为对照组的16.2%,20.2%,表明成功获得了2个沉默株系。
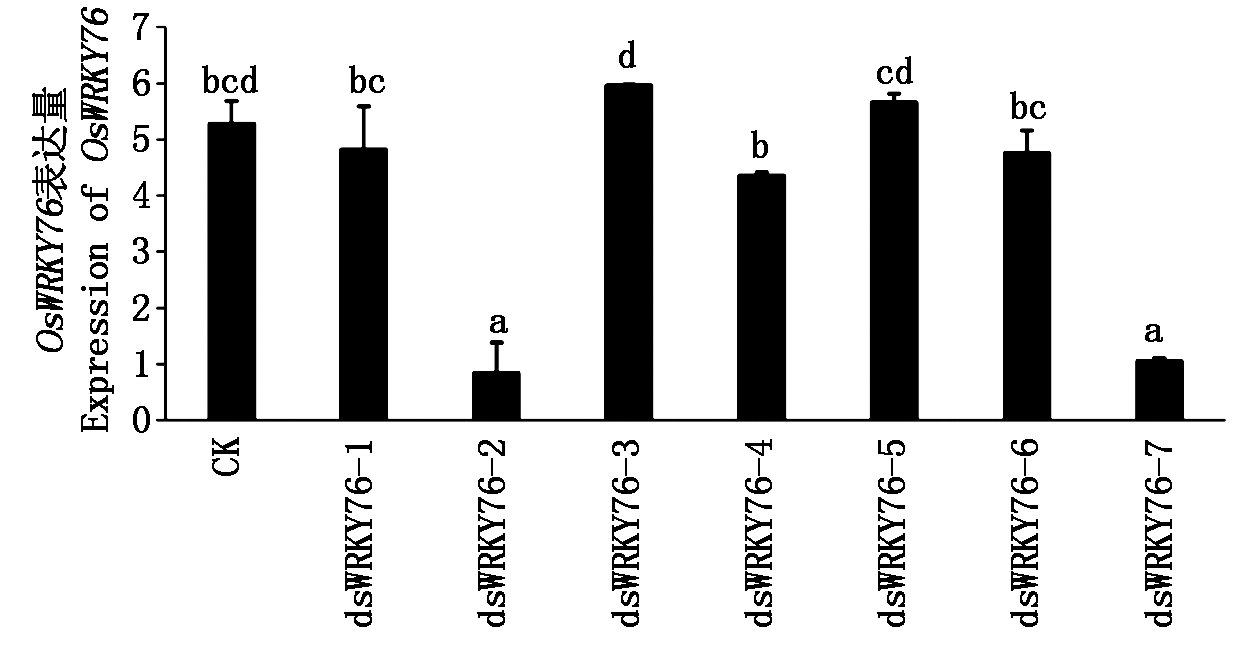
不同小写字母表示差异显著(P<0.05)。 Lowercase letters indicate significant difference(P<0.05).
图7 RT-qPCR 检测OsWRKY76表达量
Fig.7 Expression level of OsWRKY76 by RT-qPCR
3 讨论
WRKY转录因子在植物防御病原体的攻击中起到了非常重要的作用。在对水稻白叶枯病菌Xoo(Xanthomonas oryzae pv.)的免疫应答中,OsWRKY45和OsWRKY72能够直接结合SRWD1(Salt responsive WD40 protein 1)的启动子W-box,并分别通过与DELLA SLR1蛋白的相互作用激活或抑制SRWD1,调节水稻对Xoo病原菌的抗性[11]。OsWRKY68可以直接结合PR1b W-box启动子来促进免疫应答[12]。过表达OsWRKY51可增强对Xoo的抗性[13]。在稻瘟病菌(Magnaporthe oryzae)感染下,OsWRKY13和OsWRKY45-2通过与其启动子W-box和类W-box序列结合来调节彼此的表达以应对生物胁迫[14]。过量表达OsWRKY67可以增强对叶瘟(Leaf blast)、穗瘟(Panicle blast)和细菌性枯萎病(Bacterial blight)的抗病性[15]。水稻中的OsNH3(NPR1 homologue 3)是系统获得抗性中的关键因子NPR1的旁系同源物,过量表达OsNH3可以大幅提高PR基因的表达,增强对水稻白叶枯病Xoo的抗性[16-17]。对于OsWRKY76是否直接与OsNH3结合,激活相关抗病基因的表达,还有待进一步的试验研究。
大多数关于WRKY家族的研究中,较常用的手段是构建过表达载体转化植株,得到过表达植株进行研究,如辣椒CaWRKY1过表达可加速超敏反应[18];棉花GhWRKY15在烟草中过表达可增强对真菌以及病毒的抗性[19];将杨树的PtrWRKY73在白杨中过表达可提高对黑斑病菌(M. brunnea f. sp. multigermtubi)的抗性[20];过表达OsWRKY76可导致对稻瘟病的易感性急剧增加,对冷胁迫的耐受性提高[21]。对于利用RNA干扰技术验证WRKY相关功能的试验却鲜有报道。
RNAi作为反向遗传学研究的一种手段,有着特异的机制和简单的试验操作过程,在多个领域有着广泛的应用前景[22]。本研究在构建RNAi载体时选用了组成型表达和诱导型表达2种不同的载体,用组成型表达的载体将会持续沉默相关基因,若此基因为生长发育所必需,则一般情况下不容易得到转化沉默植株。因此,笔者又同时构建了诱导型表达的载体,只有用诱导物处理后才会诱导相关基因的沉默。因诱导物具有高度专一性,可以人为调控基因的表达状态,并且对植物本身来说是低毒或无毒的[23],能够比较容易地获得转化沉默株系。在本研究中,通过RNA干扰技术获得了OsWRKY76的诱导型沉默株系,为进一步研究该基因是否参与调控系统获得抗性提供了前期基础。
[1] Jing J J,Ma S H, Ye N H, Jiang M, Cao J S, Zhang J H. WRKY transcription factors in plant responses to stresses[J].Journal of Integrative Plant Biology, 2017, 59(2): 86-101. doi:10.1111/jipb.12513.
[2] Fukushima S, Mori M, Sugano S, Takatsuji H. Transcription factor WRKY62 plays a role in pathogen defense and hypoxia-responsive gene expression in rice[J].Plant Cell Physiol, 2016, 57(12): 2541-2551. doi:10.1093/pcp/pcw185.
[3] Taciane F, Vivian V E, Woyann L G, Busanello C, Maia L C D, Oliveria A C D. Can WRKY transcription factors help plants to overcome environmental challenges?[J].Genetics and Molecular Biology, 2018, 41(3):533-544. doi: 10.1590/1678-4685-GMB-2017-0232.
[4] 冉昆, 王少敏, 魏树伟, 王宏伟. 植物非生物胁迫相关的WRKY转录因子研究进展[J]. 青岛农业大学学报(自然科学版), 2014, 31(3): 217-224. doi: 10.3969/J.ISSN.1674-148X.2014.03.014.
Ran K, Wang S M, Wei S W, Wang H W. Research advances on WRKY transcription factors in plant abiotic stresses[J]. Journal of Qingdao Agricultural University(Natural Science Edition), 2014, 31(3): 217-224.
[5] Schluttenhofer C, Yuan L. Regulation of specialized metabolismby WRKY transcription factors[J].Plant Physiol, 2015, 167(2):295-306. doi:10.1104/pp.114.251769.
[6] Phukan U J, Jeena G S, Shukla R K. WRKY transcription factors: molecular regulation and stress responses in plants[J].Front Plant Sci,2016, 760(7):1-14. doi:10.3389/fpls.2016.00760.
[7] Cui J, Xu P S, Meng J, Li J B, Jiang N, Luan Y S. Transcriptome signatures of tomato leaf induced by Phytophthora infestans and functional identifcation of transcription factor SpWRKY3[J].Theoretical and Applied Genetics, 2018, 131(4): 787-800. doi:10.1007/s00122-017-3035-9.
[8] Viana V E, Marini N, Busanello C, Pegoraro C, Fernando J A, Maia L C D, Dliveira A C D. Regulation of rice responses to submergence by WRKY transcription factors[J].Biologia Plantarum, 2018, 62 (3): 551-560. doi:10.1007/s10535-018-0806-3.
[9] Eulgem T, Rushton P J, Robatzek S,Somssich I E. The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science, 2000, 5(5):199-206. doi: 10.1016/S1360-1385(00)01600-9.
[10] 郑超, 郑二松, 王栩鸣, 李冬月, 杨勇, 余初浪, 周洁, 严成其, 陈剑平. 水稻WRKY转录调控因子研究进展[J]. 生物技术通讯, 2018, 29(2):286-294. doi: 10.3969/j.issn.1009-0002.2018.02.026.
Zheng C, Zheng E S, Wang X M, Li D Y, Yang Y, Yu C L, Zhou J, Yan C Q, Chen J P. Research progress on rice WRKY transcription factors[J]. Letters in Biotechnology, 2018, 29(2):286-294.
[11] Xie C M, Zhang G, Zhang Y M, Song X G, Guo H Y, Chen X Y, Fang R X. SRWD1, a novel target gene of DELLA and WRKY proteins, participatesin the development and immune response of rice (Oryza sativa L.)[J].Sci Bull, 2017, 62(24): 1639-1648. doi:10.1016/j.scib.2017.12.002.
[12] Yang S, Zhou L, Miao L Y, Shi J N, Sun C Q, Fan W, Lan J P, Chen H, Liu L J, Dou S J, Liu G Z, Li L Y. The expression andbinding properties of the rice WRKY68 protein in the Xa21-mediated resistance response to Xanthomonas oryzae pv. Oryzae[J].J Integr Agric, 2016, 15(11): 2451-2460. doi:10.1016/s2095-3119(15)61265-5.
[13] Hwang S H, Kwon S I, Jang J Y, Fang I L, Lee H, Choi C H, Park S, Ann I I, Bae S C, Hwang D J. OsWRKY51, a rice transcription factor, functions as a positive regulator in defense responseagainst Xanthomonas oryzae pv. Oryzae[J].Plant Cell Rep, 2016, 35(9):1975-1985. doi:10.1007/s00299-016-2012-0.
[14] Cheng H T, Liu H B, Deng Y, Xiao J H, Li X H, Wang S P. The WRKY45-2WRKY13 WRKY42 transcriptional regulatory cascade is required for rice resistance to fungal pathogen[J]. Plant Physiol, 2015, 167(3): 1087-1099. doi:10.1104/pp.114.256016.
[15] Liu Q, Li X, Yan S J, Yu T, Yang J Y, Dong J F, Zhang S H, Zhao J L, Yang T F, Mao X X, Zhu X Y, Liu B. OsWRKY67 positively regulates blast and bacteria blight resistance by direct activation of PR genes in rice[J].BMC Plant Biology, 2018, 18(1):257. doi:10.1186/s12870-018-1479-y.
[16] 白薇. 水稻系统获得抗性相关基因的分子研究[D].呼和浩特:内蒙古农业大学, 2010. doi:10.7666/d.d198026.
Bai W. Molecular study of genes associated with systemic aquired resistance in rice[D].Hohhot:Inner Mongolia Agricultural University, 2010.
[17] Bai W, Chern M, Ruan D, Canlas P E, Sze-to W H, Ronald P C.Enhanced disease resistance and hypersensitivity to BTH by introduction of an NH1/OsNPR1 paralog[J].Plant Biotechnology Journal, 2011, 9 (2): 205-215. doi:10.1111/j.1467-7652.2010.00544.x.
[18] Oh S K, Baek K H, Park J M, Yi S Y, Yu S H, Choi S K D. Capsicum annuum WRKY protein CaWRKY1 is a negative regulator of pathogen defense[J].New Phytologist, 2010, 177(4):977-989. doi: 10.1111/j.1469-8137.2007.02310.x.
[19] Yu F F, Huaxia Y F, Lu W J, Wu C G, Cao X C, Guo X Q. GhWRKY15, a member of the WRKY transcription factor family identified from cotton ( Gossypium hirsutum L.), is involved in disease resistance and plant development[J].BMC Plant Biology, 2012, 12(1):144. doi:10.1186/1471-2229-12-144.
[20] Jiang Y Z, Duan Y J, Yin J, Ye S L, Zhu J R, Zhang F Q, Lu W X, Fan D, Luo K M. Genome-wide identification and characterization of the Populus WRKY transcription factor family and analysis of their expression in response to biotic and abiotic stresses[J].Journal of Experimental Botany, 2014, 65(22):6629-6644. doi: 10.1093/jxb/eru381.
[21] Yokotani N, Sato Y, Tanabe S, Chujo T, Shimizu T, Okada K, Yamane H, Shimono M, Sugano S, Takatsuji H, Kaku H, Minami E, Nishizawa Y. WRKY76 is a rice transcriptional repressor playing opposite roles in blast disease resistance and cold stress tolerance[J].Journal of Experimental Botany, 2013, 64(16):5085-5097. doi:10.1093/jxb/ert298.
[22] 张蕾. 植物RNA干扰技术的研究进展及应用前景[J]. 农业开发与装备, 2017(5): 44. doi: 10.3969/j.issn.1673-9205.2017.05.036.
Zhang L. Research progress and application prospect of plant RNA interference technology[J]. Agricultural Development and Equipment, 2017(5):44.
[23] Gatz C, Lenk I. Promoters that respond to chemical inducers trends plant[J].Trands in Plant Science,1998, 3(9): 352-358. doi:10.1016/S1360-1385(98)01287-4.
