生菜营养价值丰富、市场需求量大,传统露地和日光温室栽培的生菜无论从产量还是品质上都不能满足人们日益增长的需求[1]。无土栽培生菜克服了土地的各种限制,扩展了农业生产空间,没有减少初级代谢和次生代谢营养物质种类,有效杜绝了有害物质的吸收积累,也避免了有土栽培极易携带的各种病原物,更为重要的是,无土栽培可通过营养液组分、光环境及温度等环境条件的一体化调控,提高作物中有益物质的含量[2]。通过工厂化栽培生菜,实现了自动化和标准化,确保了营养品质,水培生菜栽培条件的优化集中于其产量的提高和功能性养分的积累[3]。不同的光照强度影响生菜中重要化学物质的组成,例如花青素、类胡萝卜素、叶绿素、酚类和抗坏血酸等[4]。相比绿叶生菜,紫叶生菜的优势在于叶片内花青素、总酚、类黄酮等次生代谢物质含量较高[5]。花青素除了具备很强的抗氧化能力,在改善视力、预防高血压、预防眼部疲劳等方面也有极大的功效,其营养价值高于普通绿叶生菜,市场前景较好,是未来蔬菜品种的发展方向。
植物工厂主要是通过控制设施内高精度的环境来实现周年作物连续生产,具有环境智能可控、水肥管理一体化和周年生产的优势,能够全年稳定种植,通过改善和调节设施内各种环境,提高作物的产量和品质,生产出洁净无污染的蔬菜[6],近些年来在我国得到了快速发展。光为植物生长发育最重要的环境因子之一,光照强度和光质对植物的形态学、矿质营养、光合作用和生理代谢均有显著的影响[7]。近年来新崛起的发光二极管(Light emitting diode,LED)作为第四代照明光源,被认为是21世纪农业与生物领域最有前途的人工光源,具有良好的发展前景[8]。在全球能源短缺的背景下,不同波长的LED光因其节能高效的特征越来越多地被应用在研究植物形态建成、光合作用、生长发育、作物抗性、果蔬贮藏保鲜以及植物活性物质积累等方面[9]。
LED智能植物工厂已成为业界公认的植物工厂的发展方向,相关研究多聚焦在不同光质对生菜、辣椒、番茄、茄子和南瓜等植物的影响方面,目前,光照强度对植物的影响研究大多数集中在自然光下弱光及强光对植物各个方面的影响[10-11],然而植物工厂中不同光照强度对植物的影响研究却较少。因此,在植物工厂内,以紫叶生菜为对象,研究不同红蓝LED光照强度对紫叶生菜生长、营养品质以及光合特性的影响,以期为紫叶生菜优质高效生产的光照强度管理提供理论依据和技术参数。
1 材料和方法
1.1 试验材料
采用的生菜品种为紫罗莎,属紫叶散叶生菜,种子购自山东寿光禾之源种子公司。
1.2 试验方法
试验于2018年12月-2019年4月在河南农业大学科教园区植物工厂内进行。紫叶生菜播种于规格为(L)25 mm×(W)25 mm×(H)40 mm的岩棉块(Grodan,荷兰)中,育苗在日光温室中,待幼苗长出第1片真叶后浇灌1/2倍的山崎生菜营养液,约20 d达到两叶一心时,选取生长一致的健壮幼苗,采用水培方式移栽到植物工厂水培槽上的种植托盘中。栽培槽的规格为(L)1 800 mm×(W)650 mm×(H)100 mm,由栽培床和种植托盘构成,栽培床用来盛放营养液,种植托盘用来固定紫叶生菜幼苗,每个种植托盘可均匀固定65株紫叶生菜幼苗。为探讨不同红蓝LED光照强度对紫叶生菜生长及营养品质的影响,设置LED板距离栽培槽定植板40 cm,红蓝复合光由红色与蓝色LED光以1∶1组合获取,其红光的峰值波长为640 nm,蓝光的峰值波长为450 nm(光谱图见图1)。本试验中红蓝LED总光照强度分别设为50 μmol/(m2·s)(RB50)、100 μmol/(m2·s)(RB100)、150 μmol/(m2·s)(RB150)和200 μmol/(m2·s)(RB200),光量子密度在LED灯板下方25 cm处用PLA-20光谱分析仪(远方光电)测量所得。植物工厂内昼夜温度为(24±2)℃/(18±2)℃,湿度为(60±10)%,光周期为14 h/d,CO2浓度为(400±20)μmol/mol,营养液采用山崎叶用莴苣配方[12],EC值1.6~1.8 mS/cm,pH值5.5~6.5。定植后15,20,25,30 d,从每个处理中随机选取3株紫叶生菜进行指标测定,定植后30 d进行采收,每个处理3次重复。
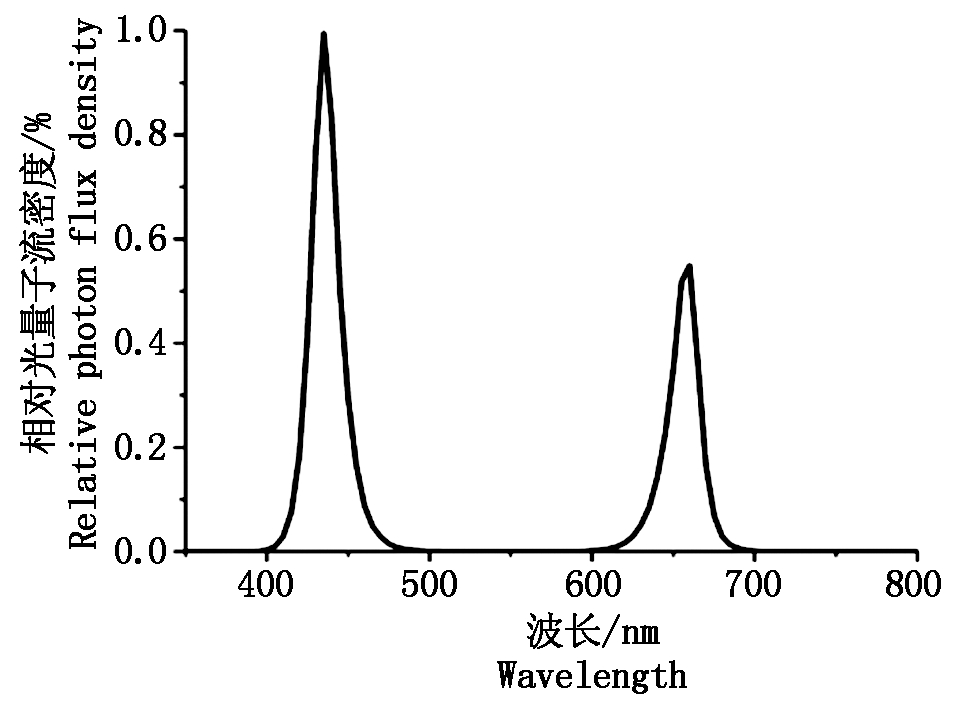
图1 红蓝LED光源相对光谱图
Fig.1 Spectrogram figures of red and blue LED light source
1.3 项目测定
用直尺测量并记录紫叶生菜株高,用游标卡尺测量紫叶生菜茎粗,用百分之一电子天平测定地上部鲜质量,用万分之一电子天平测定地上部干质量。采用95%乙醇浸提法测定叶绿素及类胡萝卜素含量[13];叶片花青素采用1%盐酸-甲醇溶液浸提法测定[14];用蒽酮比色法测定可溶性糖含量[15];用考马斯亮蓝法测定可溶性蛋白含量[15];用分光光度计法测定维生素C含量[14];用水杨酸比色法测定硝酸盐含量[16];超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法测定[17];过氧化氢酶(CAT)、过氧化物酶(POD)活性和丙二醛(MDA)含量采用分光光度法测定[18];叶片净光合速率、气孔导度、胞间CO2浓度、蒸腾速率用LI-6400XT便携式光合仪( LI-COR,美国) 测定。
1.4 数据分析
采用Microsoft Excel 2013和SPSS 17.0软件进行数据分析和作图,并对不同处理的平均值进行多重比较,用最小显著差数法(LSD)进行差异显著性(P<0.05)分析。
2 结果与分析
2.1 不同光照强度对紫叶生菜生长指标的影响
为了研究不同光照强度对紫叶生菜地上部生长指标的影响,对紫叶生菜的株高、茎粗、叶片数、鲜质量和干质量进行测定。由表1和图2可知,不同光照强度处理下紫叶生菜的生长指标存在显著差异,随着光照强度的增加,总体上茎粗、叶片数、鲜质量和干质量均增加。RB50处理下株高显著高于RB100、RB200处理,但与RB150处理并无显著性差异。RB150处理下的茎粗、鲜质量和干质量显著高于其他各处理,RB100与RB200处理下茎粗、鲜质量和干质量并无显著性差异,但显著高于RB50。由此可见,适当增加光照强度有利于紫叶生菜的地上部生长。
表1 不同光照强度对紫叶生菜地上部生长的影响
Tab.1 Effects of different light intensities on the growth of purple leaf lettuce
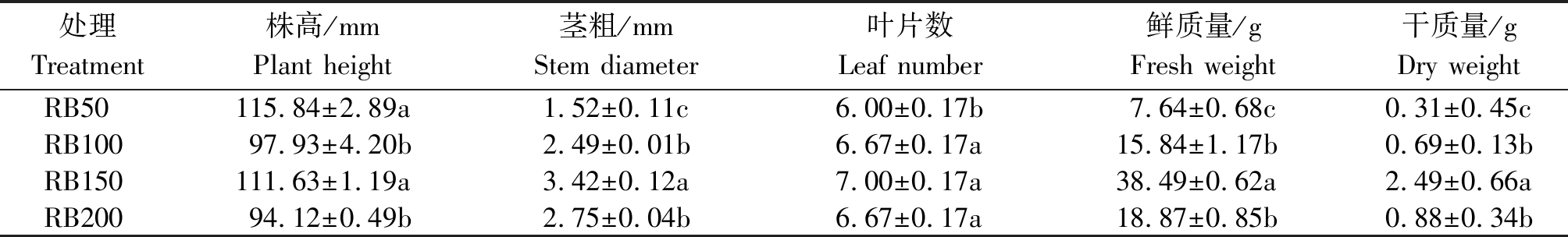
处理Treatment株高/mmPlant height茎粗/mmStem diameter叶片数Leaf number鲜质量/gFresh weight干质量/gDry weightRB50115.84±2.89a1.52±0.11c6.00±0.17b7.64±0.68c0.31±0.45cRB10097.93±4.20b2.49±0.01b6.67±0.17a15.84±1.17b0.69±0.13bRB150111.63±1.19a3.42±0.12a7.00±0.17a38.49±0.62a2.49±0.66aRB20094.12±0.49b2.75±0.04b6.67±0.17a18.87±0.85b0.88±0.34b
注:同列不同字母表示处理间差异显著(P<0.05)。表2同。
Note: Different letters in the same column mean significant difference at 0.05 level. The same as Tab.2.

图2 不同光照强度对紫叶生菜生长形态的影响
Fig.2 Effects of different light intensities on the growth of purple leaf lettuce
2.2 不同光照强度对紫叶生菜光合色素含量的影响
为了研究不同光照强度对紫叶生菜光合色素含量的影响,测量了紫叶生菜的叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量。如表2所示,在RB200处理下,紫叶生菜的叶绿素a和叶绿素总量最高,显著高于其他处理。在RB150处理下,紫叶生菜的叶绿素a、叶绿素b和叶绿素总量最低,而类胡萝卜素含量最高且显著高于RB100、RB200处理。由此说明,RB200处理可促进紫叶生菜叶绿素a、叶绿素b 和叶绿素总量的提高,从而促进光合色素的积累和光合作用的进行。
表2 不同光照强度对紫叶生菜光合色素含量的影响
Tab.2 Effects of different light intensities on photosynthetic pigment contents of purple leaf lettuce mg/g

处理Treatment叶绿素aChla content叶绿素bChlb content叶绿素总量Chl(a+b) content类胡萝卜素CarotenoidRB500.63±0.07b0.16±0.01ab0.78±0.08b0.31±0.02abRB1000.53±0.05bc0.13±0.01bc0.65±0.06bc0.27±0.02bRB1500.39±0.02c0.10±0.01c0.49±0.03c0.35±0.02aRB2000.91±0.02a0.19±0.01a1.10±0.02a0.27±0.03b
2.3 不同光照强度对紫叶生菜光合特性的影响
为了研究不同光照强度对紫叶生菜光合特性的影响,测量了紫叶生菜的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率。由图3可知,随着紫叶生菜的生长,各个光合特性指标与定植时间呈明显的负相关性。即随着定植时间的增加,净光合速率、气孔导度、胞间CO2浓度和蒸腾速率均整体减少。定植后25 d和30 d,RB200处理下的净光合速率、气孔导度和蒸腾速率均显著高于其他各个处理。胞间CO2浓度与净光合速率的变化具有相反趋势。定植后25 d和30 d,各处理下的胞间CO2浓度大小为RB50>RB100>RB150>RB200,RB50处理下胞间CO2浓度最高,但与RB100处理并无显著差异。

不同字母表示处理间差异显著(P<0.05)。图4-5同。 Different letters mean significant difference at 0.05 level.The same as Fig.4-5.
图3 不同光照强度对紫叶生菜光合特性的影响
Fig.3 Effects of different light intensities on the photosynthetic characteristics of purple leaf lettuce
2.4 不同光照强度对紫叶生菜营养品质的影响
为了研究不同光照强度对紫叶生菜营养品质的影响,测量了紫叶生菜的可溶性糖、可溶性蛋白、维生素C、花青素和硝酸盐含量。由图2,4可以看出,紫叶生菜的营养品质与光照强度具有明显的正相关性,即随着光照强度的增加,可溶性糖、可溶性蛋白、维生素C和花青素含量均呈现上升趋势。在RB200处理下,紫叶生菜的可溶性糖、可溶性蛋白、维生素C和花青素含量最高,RB50处理含量最低。RB200处理下的可溶性糖和维生素C含量显著高于其他各处理,可溶性蛋白含量比RB50和RB100处理增加80.30%和40.64%,花青素含量比RB50处理增加51.5倍,但可溶性蛋白和花青素含量与RB150处理无显著性差异。RB50处理下硝酸盐含量最高,比RB100、RB150和RB200处理显著增加约3倍,其余各个处理间并无显著性差异。
综合来看,收获期RB200处理的可溶性糖、可溶性蛋白、维生素C和花青素含量最高,硝酸盐含量最低,RB150处理次之。由此说明,增加光照强度能逐步提高紫叶生菜的营养品质。
2.5 不同光照强度对紫叶生菜抗氧化能力的影响
为了研究不同光照强度对紫叶生菜抗氧化能力的影响,测量了紫叶生菜的SOD、CAT、POD活性和MDA含量。由图5可知,定植20 d和25 d,总体上紫叶生菜在RB150处理下SOD、CAT和POD活性最高,显著高于RB50和RB100。定植后25 d,RB150的SOD和CAT活性最高,RB50活性最低,RB150处理显著高于其他各处理。定植后20 d,RB150的POD活性最高,RB50活性最低;定植后25 d,RB150的POD活性显著高于RB50和RB100,与RB200并无显著差异。定植后15 d和25 d,RB150处理下MDA含量最高,显著高于RB50和RB100,与RB200并无显著差异。综合来看,在定植后25 d,RB150处理下的SOD、CAT和POD活性最高,MDA含量也有所提升,抗氧化能力最强。
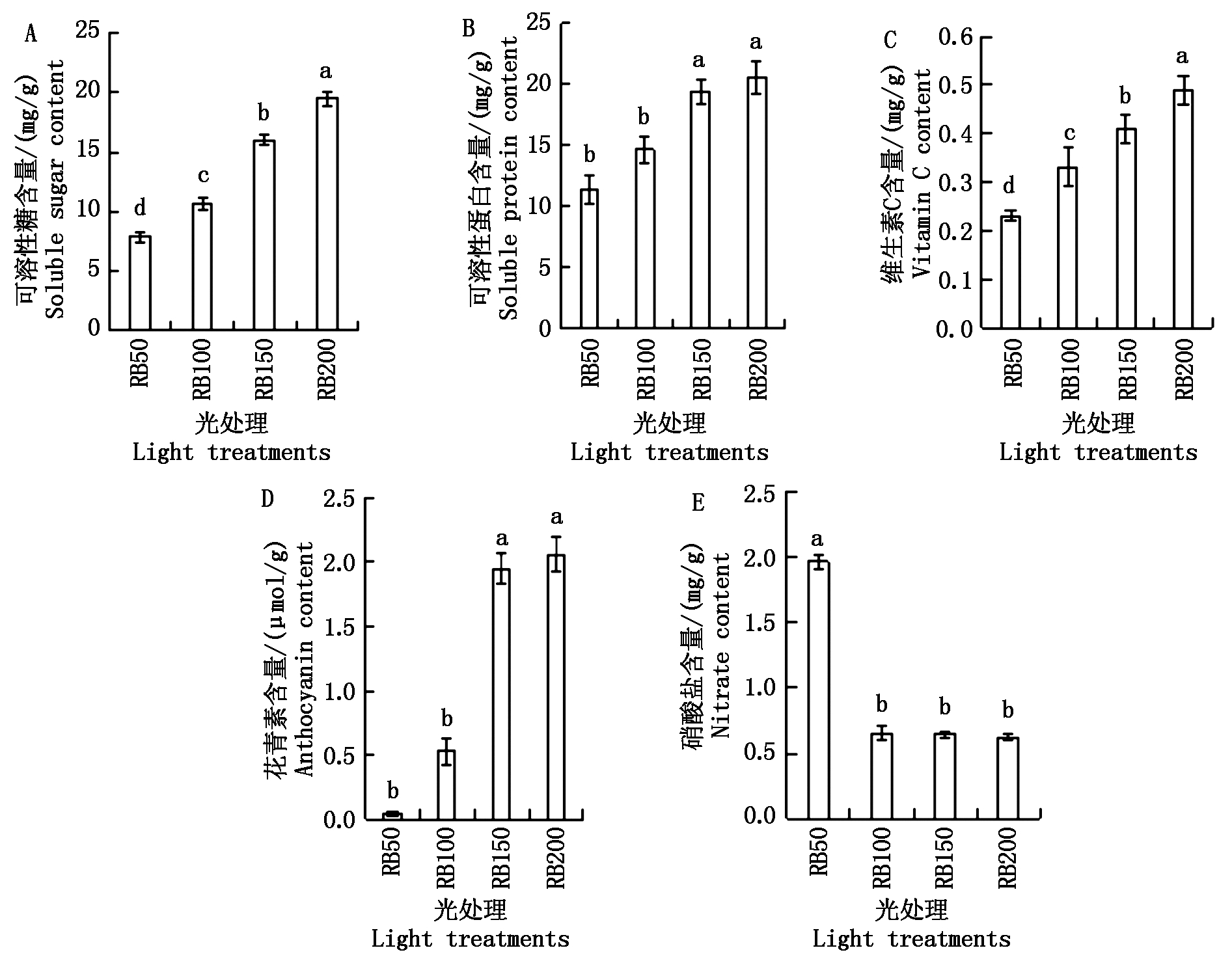
图4 不同光照强度对紫叶生菜营养品质的影响
Fig.4 Effects of different light intensities on the nutritional quality of purple leaf lettuce
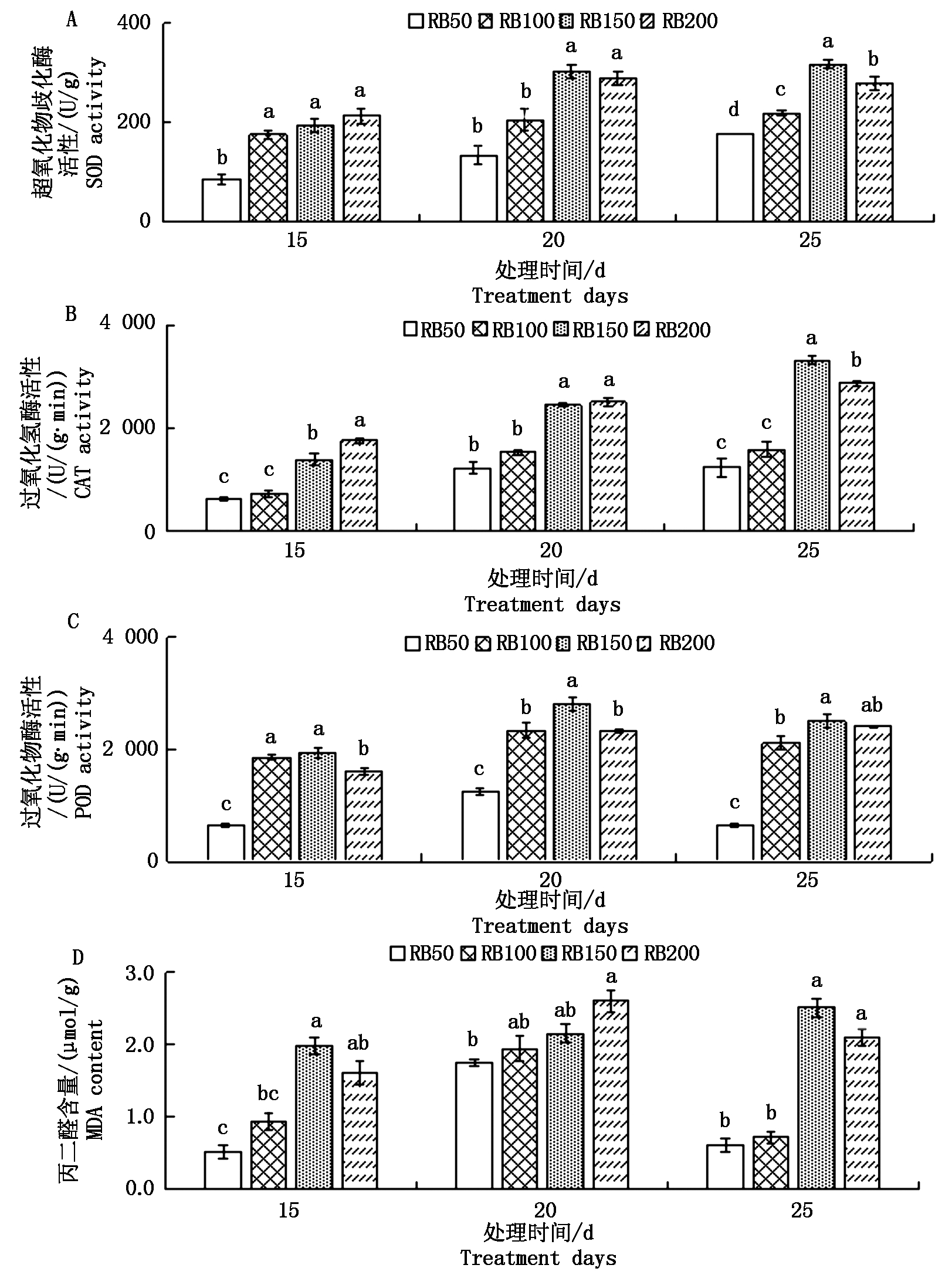
图5 不同光照强度对紫叶生菜抗氧化能力的影响
Fig.5 Effects of different light intensities on the antioxidant activity of purple leaf lettuce
3 结论与讨论
光照强度对植物的生长和发育是一个不可缺少的自然因素,光照是否充足,直接影响到植物能否产生充足的营养物质供给器官的生长,过强或过弱的光照强度对植物的生长发育、生理生化、形态结构、产量和品质等方面都有不利影响。光照强弱影响着植物光形态的建成和叶绿素的含量。研究发现,随着光照强度的减弱,植株变高,茎粗变小,叶数变少,叶面积变大,叶片变薄[19]。本试验中,随着光强的降低,紫叶生菜出现明显的徒长现象。叶绿素a、叶绿素b和叶绿素a+b 增加,叶绿素a/b 降低,是植物适应弱光环境的表现[20]。本试验中,一定范围内随着光强的降低,叶绿素含量增加,有利于植物捕获较多的光能,而叶绿素b含量的增加有助于增强紫叶生菜对弱光环境的适应能力。研究表明,叶绿素含量的提高可以增加用于吸收光能的集光色素蛋白的相对含量,从而提高光能利用率[21]。
光合作用是影响植物生长的关键因素之一,植物生命活动的有机物质都来源于光合作用[22]。光合特征参数变化是植物光能利用效率的反映,本试验中随着紫叶生菜的生长,净光合速率下降,而胞间CO2浓度与气孔导度也有下降趋势。前人研究显示,植物在弱光和强光条件下,随着净光合速率下降,胞间CO2浓度与气孔导度也下降,主要是由于气孔限制了光合作用[23],这与本试验结果一致。蒸腾作用的强弱可以反映出植物体内水分代谢的状况或对水分利用的效率[22]。本试验中,随着光照强度的升高,紫叶生菜的净光合速率、气孔导度及蒸腾速率逐渐增加,说明增加光照强度有利于生菜进行光合作用。
随着人们生活品质的提升,不断追求更营养、更健康、更天然的蔬菜产品,其营养品质指标显得至关重要。可溶性糖通过调节植物组织的渗透势以降低冰点来维持细胞膜的完整性[24],因为弱或者强光照抑制了植物叶绿素的形成,降低了光合作用,而叶片的呼吸作用却没有减弱,从而导致可溶性糖的积累减少。可溶性蛋白是光合作用的产物之一,是植物代谢的主要调控物质,其含量的变化反映了植物合成和分解代谢的能力[25],强光造成光合作用增强,而使光合产物的合成能力上升,可溶性蛋白相应增加。本试验中,随着光照强度的增加,可溶性糖和可溶性蛋白含量显著增加,这可能是由于光照强度增强,有利于糖分和其他干物质的积累,糖分含量的增加导致可溶性固形物含量也相应增加。维生素C又叫抗坏血酸,它影响胶原蛋白的形成,可促进骨骼和牙齿的生长,参与人体内多种氧化还原反应[26]。本试验中,在RB200处理下,紫叶生菜的维生素C含量显著高于其他处理。有可能是强光下紫叶生菜叶片的光合速率升高,叶片制造的光合产物量增加,同时光合产物输出比例增加,从而影响糖、维生素C等物质相关代谢酶的活性。光是影响植物花青素生物合成的最重要的环境因素之一,通常诱导花色素苷合成需要高光强度。研究表明,花青素含量随着光照强度的增加呈上升趋势,而光照强度弱,会使花青苷合成的有关基因不能活化,导致对编码花色素苷生物合成途径的酶基因产生抑制,从而使花青素总量减少[27]。Capitata的叶片在40 μmol/(m2·s)下呈绿色,但在100 μmol/(m2·s)的较高光强度处理时呈现红色[28]。这证明红叶莴苣中花青素积累需要一定程度的光照强度,与本研究结果一致。在本研究中,RB150和RB200处理下花青素含量显著高于RB50和RB100处理,可能是随着光照强度的增加,糖苷代谢在花青素积累中起重要作用。蔬菜中硝酸盐的含量与光强呈负相关,强光下植株的硝酸还原酶含量较高,有较高的氮素同化能力[28]。本试验中,随着光照强度的提高,可能硝酸还原酶的活性升高,造成硝酸盐在紫叶生菜叶片中的累积减少。
植物在自身新陈代谢过程和逆境胁迫下会产生大量活性氧分子,如果植物没有足够的能力清除这些活性氧分子,就会造成植物体质膜系统的伤害,影响植物的生长[29]。SOD、CAT和POD作为植物体内重要的保护酶,其活性高低能反映出植物的生理活性状况[30]。本试验中,在定植后20 d和25 d,RB150处理下的SOD、CAT和POD活性最高。表明在适宜光强的处理下,SOD、CAT和POD可以共同作用不断清除细胞的活性氧,使其处于较低水平,减少细胞出现膜脂过氧化的情况。前人通过对樱桃番茄的研究发现,随着光照强度的增强,CAT 和 POD活性呈现增大趋势[31]。活性氧动态平衡受到细胞中SOD和POD在内的防御酶调控,植物感染病原菌后SOD活性和 POD活性迅速加强,有利于活性氧的清除,起到保护细胞的作用[10]。刘会宁等[32]通过对5个欧亚种葡萄品种感染霜霉病后SOD、CAT和POD活性的研究发现,不同品种感病后酶活性的变化趋势不同,一般来讲酶活性越高,品种抗病性越强。吴晓丽等[33]通过对花椰菜抗病和感病品种接种黑腐病菌后SOD、POD等酶活性的研究得知,抗病品种具有更强的抗黑腐病能力和抗氧化能力。然而,不同光照强度下紫叶生菜抗氧化酶活性的调节机制还需要进一步的研究。
综上,在RB200处理下,紫叶生菜的净光合速率和花青素、可溶性蛋白、可溶性糖、维生素C含量较高且硝酸盐含量较低,这表明光照强度较高时有利于紫叶生菜品质的提高。在RB150处理下,紫叶生菜具有较高产量,抗氧化活性比较好。因此,可根据生产过程中的不同需求,通过控制植物工厂中光照强度,使得紫叶生菜的光合速率较高并具有优良品质。
[1] 方舒玲. 光强和营养液浓度对水培生菜生长及养分利用效率的影响[D].杨凌:西北农林科技大学, 2018.
Fang S L. Effect of light intensity and nutrient solution concentration on growth and nutrient use efficiency of hydroponic lettuce[D]. Yangling:Northwest of Agriculture and Forestry Science and Technology University, 2018.
[2] Palermo M, Paradiso R, De Pascale S, Fogliano V. Hydroponic cultivation improves the nutritional quality of soybean and its products[J]. Journal of Agricultural and Food Chemistry, 2011, 60(1): 250-255. doi:10.1021/jf203275m.
[3] Touliatos D, Dodd I C, Mcainsh M. Vertical farming increases lettuce yield per unit area compared to conventional horizontal hydroponics[J]. Food and Energy Security, 2016, 5(3): 184-191. doi:10.1002/fes3.83.
[4] Kurihara K. Glutamate: from discovery as a food flavor to role as a basic taste (umami)[J]. The American Journal of Clinical Nutrition, 2009, 90(3): 719-722. doi:10.3945/ajcn.2009.27462D.
[5] 高勇,李清明,刘彬彬,厉书豪,艾希珍,魏珉,张大龙.不同光质配比对紫叶生菜光合特性和品质的影响[J].应用生态学报, 2018, 29(11): 3649-3657. doi:10.13287/j.1001-9332.201811.024.
Gao Y, Li Q M, Liu B B, Li S H, Ai X Z, Wei M, Zhang D L. Effects of light quality ratio on photosynthetic characteristics and quality of purple lettuce[J]. Chinese Journal of Applied Ecology, 2018, 29(11): 3649-3657.
[6] 刘文科,刘义飞.LED智能植物工厂光配方构建与应用[J].中国照明电器, 2017(10): 1-3. doi:10.3969/j.issn.1002-6150.2017.10.001.
Liu W K, Liu Y F. Establishment and application of light recipes for intelligent plant factory with LED lighting[J]. China Light and Lighting, 2017 (10): 1-3.
[7] 张欢,徐志刚,崔瑾,谷艾素,郭银生. 光质对番茄和莴苣幼苗生长及叶绿体超微结构的影响[J]. 应用生态学报, 2010, 21(4): 959-965. doi:10.13287/j.1001-9332.2010.0144.
Zhang H, Xu Z G, Cui J, Gu A S, Guo Y S. Effects of light quality on the growth and chloroplast ultrastructure of tomato and lettuce seedling[J]. Chinese Journal of Applied Ecology, 2010, 21 (4): 959-965.
[8] 崔瑾,徐志刚,邸秀茹.LED在植物设施栽培中的应用和前景[J].农业工程学报, 2008, 24(8): 249-253. doi:10.3321/j.issn:1002-6819.2008.08.055.
Cui J, Xu Z G, Di X R. Applications and prospects of light emitting diode in plant protected culture[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24 (8): 249-253.
[9] Ma G, Zhang L C, Setiawan C K, Yamawaki K, Asai T, Nishikawa F, Maezawa S, Sato H, Kanernitsu N, Kato M. Expression of red and blue LED light irradiation on ascorbate content and expression of genes related to ascorbate metabolism in postharvest broccoli[J]. Postharvest Biology and Technology, 2014, 94: 97-103. doi: 10.1016/j.postharvbio.2014.03.010.
[10] 杨璐,赵天宏. UV-B辐射增强对大豆根系活性氧代谢及抗氧化系统的影响[J].华北农学报, 2018, 33(5): 174-180. doi:10.7668/hbnxb.2018.05.024.
Yang L, Zhao T H. The effect of enhanced UV-B radiation on soybean root′s activate oxygen metabolism and antioxidative system[J]. Acta Agriculturae Boreali-Sinica, 2018, 33(5): 174-180.
[11] 赵磊,杨延杰,林多.光照强度对蒲公英光合特性及品质的影响[J].园艺学报, 2007, 34(6): 1555-1558. doi:10.3321/j.issn:0513-353x.2007.06.036.
Zhao L, Yang Y J, Lin D. Effects of light intensity on photosynthetic characteristics and quality of Taraxacum mongolicum[J]. Acta Horticulturae Sinica, 2007, 34 (6): 1555-1558.
[12] 张涛. 不同LED光质和组配对叶用莴苣生理基础及营养品质的影响[D].郑州:河南农业大学,2018.
Zhang T. Effects of different LED light quality and ratios of LED on the physiological basis and nutritional quality of lettuce[D]. Zhengzhou:Henan Agricultural University, 2018.
[13] Wellburn A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J]. Journal of Plant Physiology,1994,144(3), 307-313. doi:10.1016/S0176-1617(11)81192-2.
[14] 曹建康. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2006.
Cao J K. Guidance for postharvest physiological and biochemical experiments of fruits and vegetables [M]. Beijing: China Light Industry Press, 2006.
[15] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000.
Li H S. Principle and technology of plant physiology and biochemistry experiments [M]. Beijing:Higher Education Press, 2000.
[16] Zhang X, He D X, Niu G H, Yan Z N, Song J. Effects of environment lighting on the growth, photosynthesis, and quality of hydroponic lettuce in a plant factory[J]. International Journal of Agricultural and Biological Engineering, 2018, 11(2):33-40. doi:10.25165/j.ijabe.20181102.3420.
[17] 沈文飚, 徐朗某,叶茂炳,张荣铣. 氮蓝四唑光化还原法测定超氧化物歧化酶活性的适宜条件[J]. 南京农业大学学报, 1996, 19(2): 101-102. doi:10.7685/j.issn.1000-2030.1996.02.021.
Shen W X, Xu L L, Ye M B, Zhang R X. The suitable conditions for the determining SOD activity by nitro blue tetrazolium(NBT) photoreduction method[J].Journal of Nanjing Agricultural University, 1996, 19(2): 101-102.
[18] 廖丹,杨烨,李青耘,谢姗姗,王静. 测定过氧化氢酶活性的分光光度法的建立及验证[J].中国生物制品学杂志, 2015,28(4): 418-421, 425. doi:10.13200/j.cnki.cjb.000861.
Liao D, Yang Y, Li Q Y, Xie S S, Wang J. Development and verification of spectrophotometry for determination of catalase activity[J]. Chinese Journal of Biologicals, 2015,28(4): 418-421, 425.
[19] Kitaya Y, Xiao L, Masuda A, Ozawa T, Tsuda M, Omasa K. Effects of temperature, photosynthetic photon flux density, photoperiod and O2 and CO2 concentrations on growth rates of the symbiotic dinoflagellate, Amphidinium sp.[J]. Journal of Applied Phycology, 2008, 20(5):737-742. doi: 10.1007/s10811-008-9331-7.
[20] 刘振威,高佳,孙丽,赵润州.南瓜叶片叶绿素含量与净光合速率的关系[J].河南科技学院学报(自然科学版), 2008, 36(4): 27-29. doi:10.3969/j.issn.1673-6060-B.2008.04.009.
Liu Z W, Gao J, Sun L, Zhao R Z. Relation between chlorophyll content of pumpkin leaf and net photosynthesis rate[J]. Journal of Henan University of Science and Technology (Natural Science Edition), 2008, 36 (4): 27-29.
[21] 刘文海,高东升,束怀瑞.不同光强处理对设施桃树光合及荧光特性的影响[J].中国农业科学, 2006, 39(10): 2069-2075. doi:10.3321/j.issn:0578-1752.2006.10.018.
Liu W H, Gao D S, Shu H R. Effects of different photon flux density on the characteristics of photosynthesis and chlorophyll fluorescence of peach trees in protected culture[J]. Scientia Agricultura Sinica, 2006, 39 (10): 2069-2075.
[22] Nhut D T, Takamura T, Watanabe H, Okamoto K, Tanaka M. Responses of strawberry plantlets cultured in vitro under superbright red and blue light-emitting diodes (LEDs)[J]. Plant Cell,Tissue and Organ Culture, 2003, 73(1): 43-52. doi:10.1023/A:1022638508007.
[23] 石凯,李泽,张伟建,何潇,曾艳玲,谭晓风.不同光照对油桐幼苗生长、光合日变化及叶绿素荧光参数的影响[J].中南林业科技大学学报, 2018, 38(8): 35-42, 50. doi:10.14067/j.cnki.1673-923x.2018.08.006.
Shi K, Li Z, Zhang W J, He X, Zeng Y L, Tan X F. Influence of different light intensity on the growth, diurnal change of photosynthesis and chlorophyll fluorescence of tung tree seedling[J]. Journal of Central South University of Forestry & Technology, 2018, 38 (8): 35-42, 50.
[24] 宋雅欣,马茂亭,安志装,赵同科.有机无机肥料配施对大棚辣椒与番茄产量及品质的影响[J].华北农学报, 2017, 32(2): 211-216. doi:10.7668/hbnxb.2017.02.031.
Song Y X, Ma M T, An Z Z, Zhao T K. Effect of combined application of organic and inorganic fertilizers on the yield and quality of pepper and tomato in greenhouse[J]. Acta Agriculturae Boreali-Sinica, 2017, 32(2): 211-216.
[25] 段辉国,王彬,黄作喜,李彩霞,赵泽名.壳聚糖对青稞种子萌发和幼苗生理指标的影响[J].河南农业科学, 2014, 43(3): 16-19. doi:10.3969/j.issn.1004-3268.2014.03.004.
Duan H G, Wang B, Huang Z X, Li C X, Zhao Z M. Effects of chitosan on seed germination and seedling physiological index of hulless barley[J]. Journal of Henan Agricultural Sciences, 2014, 43(3): 16-19.
[26] 苏苑君,王文娥,胡笑涛,王瑞,张栋,乔源.氮对水培生菜营养液元素动态变化及产量与品质的影响[J].华北农学报, 2016, 31(3): 198-204. doi:10.7668/hbnxb.2016.03.029.
Su Y J, Wang W E, Hu X T, Wang R, Zhang D, Qiao Y. Effects of different nitrogen levels on the nutrient elements dynamic change, yield and quality of hydroponic lettuce[J]. Acta Agriculturae Boreali-Sinica, 2016, 31(3): 198-204.
[27] Zhang Y Z, Xu S Z, Cheng Y W, Peng Z F, Han J M. Transcriptome profiling of anthocyanin-related genes reveals effects of light intensity on anthocyanin biosynthesis in red leaf lettuce[J]. PeerJ, 2018, 6(4): e4607. doi:10.7717/peerj.4607.
[28] 王雪,张阔,孙志梅,苗泽兰,刘欢,马文奇.氮素水平对萝卜干物质累积特征及源库活性的影响[J].中国农业科学, 2014, 47(21): 4300-4308. doi:10.3864/j.issn.0578-1752.2014.21.015.
Wang X, Zhang K, Sun Z M, Miao Z L, Liu H, Ma W Q. Effects of nitrogen levels on characteristics of dry matter accumulation and source-sink activities of radis[J]. Scientia Agricultura Sinica, 2014, 47 (21): 4300-4308.
[29] 王建华,刘鸿先,徐同.超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989(1): 1-7. doi:10.13592/j.cnki.ppj.1989.01.001.
Wang J H, Liu H X, Xu T. The role of superoxide dismutase (SOD) in stress physiology and senescence physiology of plant[J]. Plant Physiology Communications, 1989 (1): 1-7.
[30] Pérez-Clemente R M, Montoliu A, Vives V, López-Climent M F, Gómez-Cadenas A. Photosynthetic and antioxidant responses of Mexican lime (Citrus aurantifolia) plants to Citrus tristeza virus infection[J]. Plant Pathology, 2015, 64(1):16-24. doi:10.1111/ppa.12241.
[31] 刘晓英,焦学磊,徐志刚,常涛涛.不同红蓝LED光照强度对樱桃番茄幼苗生长和抗氧化酶活性的影响[J].南京农业大学学报, 2015, 38(5): 772-779. doi:10.7685/j.issn.1000-2030.2015.05.011.
Liu X Y, Jiao X L, Xu Z G, Chang T T. Effects of different red and blue LED light intensity on growth and antioxidant enzyme activity of cherry tomato seedlings[J]. Journal of Nanjing Agricultural University, 2015, 38 (5): 772-779.
[32] 刘会宁,廖庆刚. 5个欧亚种葡萄品种感染霜霉病后4种酶活性的变化[J].长江大学学报(自科版), 2018, 15(14): 6-9,12. doi:10.16772/j.cnki.1673-1409.2018.14.002.
Liu H N, Liao Q G. Change of four kinds of enzyme activity in 5 varieties of Eurasian grape after infected by downy mildew[J]. Journal of Yangtze University(Natural Science Edition), 2018, 15(14): 6-9,12.
[33] 吴晓丽,李建民,段留生,田晓莉,王保民,何钟佩,李召虎.花椰菜幼苗叶片抗氧化酶系统与抗黑腐病关系的研究[J]. 植物病理学报, 2005, 35(6):509-513. doi:10.3321/j.issn:0412-0914.2005.06.005.
Wu X L, Li J M, Duan L S, Tian X L, Wang B M, He Z P, Li Z H. Changes of anti-oxidant system in cauliflower seedlings inflected by black rot and their relationships with the resistance to black rot[J]. Acta Phytopathologica Sinica, 2005, 35(6):509-513.
