近年来,极端天气肆虐全球。我国长江中下游双季早稻种植区低温冷害频发,如每年3-4月出现的“倒春寒”,气温骤降、阴雨连绵,造成水稻烂芽、烂秧、死苗而减产。低温冷害是一种重要的非生物逆境伤害,它严重干扰作物的生理代谢,导致植株生长和发育不良,最终造成作物减产甚至绝收,给南方早稻生产带来较大威胁。
东乡野生稻耐冷性极强,能够在武汉-12.8 ℃的条件下安全越冬[1],目前已成为水稻耐冷性机理研究的重要材料和育种的优异种质资源[2]。有关研究表明,东乡野生稻的耐冷性是由多基因控制的数量性状[3-4],并且先后在多条染色体上发现与耐冷性相关的QTL [5-6],但是,由于东乡野生稻的遗传性状野生性强,以及研究方法和实验仪器设备的局限性,其耐冷性的遗传机理研究进展缓慢。蛋白质是基因表达的产物,是一切生命功能的最终执行者,蛋白质组学可从全息化的视角研究作物对环境应答的机制[7]。
本项目以东乡野生稻(来源于江西省农科院水稻所)和冷敏感品种中嘉早17为研究材料[8-9],利用iTRAQ技术对水稻幼苗响应低温胁迫的根系蛋白质组进行研究,以期发现与低温冷害相关的蛋白质或基因,为进一步阐述水稻耐冷机理及耐冷基因的挖掘提供理论依据,同时也有助于在生产上培育出耐冷性强的水稻材料或品种。
1 材料和方法
1.1 试验材料
以强耐冷材料东乡野生稻(W)和冷敏感材料中嘉早17(Z)为供试材料。
1.2 样品处理
生理指标样品处理:将生长一致的三叶一心期苗于5 ℃低温处理,分别于处理0,1,2,3 d测定幼苗的根系活力、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。
蛋白质样品处理:将生长一致的三叶一心期苗进行25 ℃的常温(CK)和5 ℃的低温(L)处理,重复3次,处理3 d后取下根系立即用液氮处理并置于-70 ℃冰箱中保存备用。
1.3 试验方法
1.3.1 生理指标测定 各项生理指标参照王学奎[10]的方法测定,即用氯化三苯基四氮唑(TTC)测定根系活力,用愈创木酚法测定POD活性,用氮蓝四唑法测定SOD活性,用硫代巴比妥酸测定MDA含量。
1.3.2 蛋白质样品制备 称取根系1 g,剪碎,放入研钵,加入适量的聚乙烯吡咯烷酮和液氮进行研磨,将粉末转移到10 mL离心管中,加入适量的含0.07%β-巯基乙醇的三氯乙酸-丙酮溶液(1∶9),混匀后置于-20 ℃冰箱中沉淀至少2 h,于4 ℃、15 000 r/min离心30 min,去上清,加入80%丙酮(含0.07% β-巯基乙醇)重悬沉淀,按上述条件离心,重复多次,至上清为无色,沉淀经真空干燥成蛋白质干粉,于-80 ℃保存。称取适量的蛋白质干粉,加入蛋白质裂解液(8 mol/L尿素、65 mmol/L二硫苏糖醇、40 mmol/L Tris、4%CHAPS),于25 ℃水浴超声溶解30 min,18 000 r/min离心15 min取上清,采用Bradford法进行蛋白质定量,进行SDS-PAGE电泳,判断iTRAQ质谱定量实验可行性。
1.3.3 蛋白质酶解和标记 取200 μg蛋白质样品,加入200 μL UA Buffer(8 mol/L尿素、150 mmol/L Tris HCl、pH值8.0),充分混匀,转移到10K超滤离心管中,12 000 r/min离心15 min,弃滤液,重复1次。加入100 μL IAA,600 r/min振荡1 min,25 ℃避光放置30 min,12 000 r/min离心10 min,弃滤液,加入100 μL UA Buffer,12 000 r/min离心10 min,重复2次。加入100 μL Dissolution Buffer, 12 000 r/min离心10 min,重复2次。加入40 μL Trypsin Buffer,600 r/min振荡1 min,于37 ℃放置约17 h。各组样品肽段分别取80 μg,按照AB公司试剂盒(AB SCIEX)进行iTRAQ标记。随机取3次生物学重复中的2次进行标记。
1.3.4 色谱SCX分级及质谱分析 利用AKTA Purifier 100蛋白纯化系统对标记后的肽段进行SCX预分级,收集洗脱组分约33份,根据色谱图合并成10份,冷冻抽干后C18脱盐。样品采用毛细管高效液相色谱进行分离,利用Q-Exactive质谱仪进行质谱检测。
1.3.5 数据处理及生物信息学分析 原始质谱数据RAW文件利用Mascot 2.2版本进行查库,采用软件Proteomo Discoverer 1.4对肽段报告离子峰强度进行定量分析。可信蛋白为Peptide FDR≤0.01且肽段数≥1。在可信蛋白基础上,选择P≤0.05,差异倍数<0.83或>1.2为差异表达蛋白。对鉴定的蛋白质进行GO功能富集分析和KEGG分析。
1.3.6 qRT-PCR验证 选择部分差异表达蛋白进行mRNA表达水平上的验证。提取根系总RNA,以经过DNAse处理后的总RNA为模板,使用鼎国反转录试剂盒进行cDNA合成。从NCBI获取目的基因mRNA全长序列,利用Primer Blast软件设计引物,引物序列见表1。以肌动蛋白-1(Actin-1)基因作为内参基因。PCR循环参数为:95 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环。
表1 荧光定量PCR引物信息
Tab.1 Primers for qRT-PCR

蛋白质名称Protein name引物序列(5′-3′)Primer sequence(5′-3′)GenBank登录号GenBank accession number天冬氨酸蛋白酶猪笼草蛋白酶1GAAGCTTGCAGCAGGAGAACXM_015757651.1Aspartic proteinase nepenthesin-1ATCGAAGTAGGCCAGATCGC非特异性脂质转移蛋白3GATCATCTCCCATCTCCGGCXM_015759942.1Non-specific lipid-transfer protein 3TGAGCAAAGCTGTCGAGGAG铜转运蛋白ATX1TTGTGCTCAGGGTTGGGATGXM_015792604.1Copper transport protein ATX1AAACGGTCTGAAGAACGGCA丝氨酸脱羧酶1GAAGGAGGTCCAGAAGTGCCXM_015771197.1Serine decarboxylase 1TTGTCGATGGTCACACTGGG肌动蛋白-1ATCGTTACACGTACGCCTCGXM_015784227.1Actin-1CCAGCAAAACCTGCCTTGAC
2 结果与分析
2.1 低温处理对水稻苗期根系的生理指标影响
从图1可知,随着处理天数的增加,只有SOD酶活性在东乡野生稻和中嘉早17中的变化总趋势表现一致,即随着处理天数的增加,SOD酶活性先显著增加再下降,但是中嘉早17在第3天下降得更显著。在根系活力变化图中,中嘉早17的根系活力随着处理天数的增加均显著下降,而东乡野生稻的根系活力在前2 d呈显著下降趋势,在第3天却稍有增长。在POD酶活性变化图中,东乡野生稻和中嘉早17的根系POD酶活性在前2 d呈现相反的变化趋势,即东乡野生稻根系POD酶活性先降低再增加,中嘉早17根系POD酶活性先增加再降低。在MDA含量变化图中,处理前2 d均呈现增长趋势(东乡野生稻的增长幅度很慢),但在第3天,东乡野生稻略微下降,而中嘉早17呈显著增长。因此,5 ℃低温处理影响东乡野生稻和中嘉早17的根系生理指标,且在低温处理第3天,2个材料间已出现明显差异。
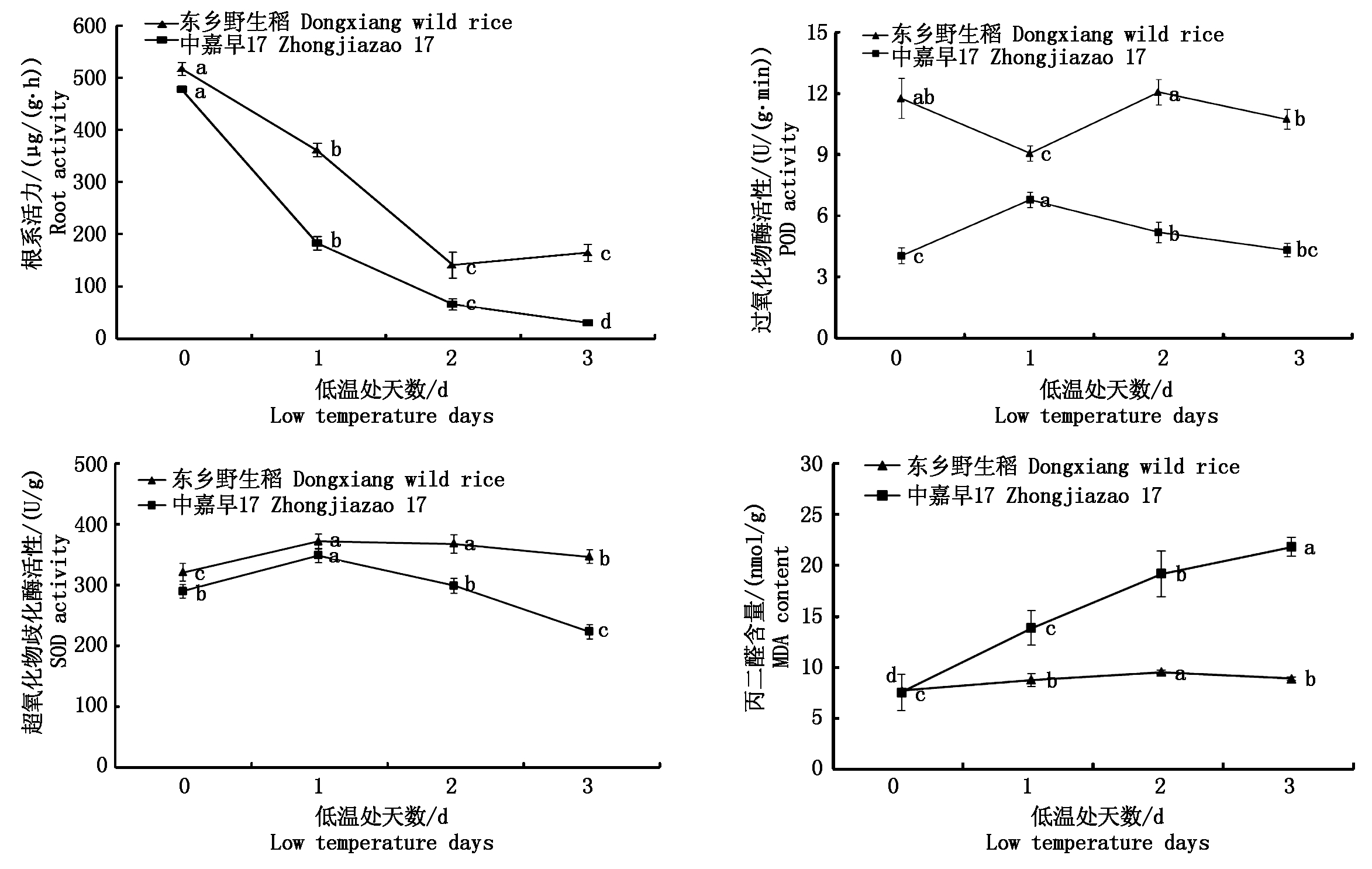
不同小写字母表示同一品种不同处理之间差异显著(P<0.05)。 Different lowercases indicate that the difference between the different treatments of the same variety at the 0.05 level is significant.
图1 低温胁迫对水稻根系生理指标的影响
Fig.1 Effects of physiological indexes in rice roots under cold stress
2.2 低温胁迫对水稻苗期根系的蛋白质组分析
2.2.1 根系差异表达蛋白的鉴定结果 通过比较常温与低温处理下苗期根系蛋白质组,共获得可信肽段数12 673条,鉴定的蛋白数量为3 346个。在WCK-WL中,差异表达蛋白质共167个,上调表达的蛋白质61个,下调表达的蛋白质106个;在ZCK-ZL中,差异表达的蛋白质共261个,上调表达的蛋白质122个,下调表达的蛋白质139个。在东乡野生稻和中嘉早17中均发生显著性差异表达的蛋白质有29个,其中,表达趋势相同(均上调或下调表达)的蛋白质有19个,表达趋势相反的有10个(表2)。
表2 根系差异表达蛋白质信息
Tab.2 Information of differentially expressed proteins in roots

蛋白质名称Protein name登录号Accession东乡野生稻Dongxiang wild rice中嘉早17Zhongjiazao 17表达情况Expression pattern差异倍数Fold change表达情况Expression pattern差异倍数Fold change富含亮氨酸重复/伸展蛋白2 Q5ZDH9↓0.60↓0.45Leucine-rich repeat extensin-like protein 2二氢硫辛酸脱氢酶 Dihydrolipoyl dehydrogenaseB8AYG2↓0.77↓0.74泛素受体RAD23b Ubiquitin receptor RAD23bA0A0P0VFL2↓0.75↓0.7921 ku 蛋白 21 ku proteinQ0JFG1↓0.76↓0.71Ⅲ型过氧化物酶117 Class Ⅲ peroxidase 117Q5U1H6↓0.75↓0.72草酸辅酶A连接酶 Oxalate-CoA ligaseQ7XPV4↓0.65↓0.65表达蛋白 Expressed proteinQ10MJ2↓0.67↓0.54氨基酸透性酶BAT1同源物 Amino-acid permease BAT1 homologB9EXZ6↑1.66↑1.81GNOM蛋白 GNOM proteinQ6YWF5↑1.61↑1.42胞浆铁硫蛋白组装1同源物 Q6YVM7↑1.63↑2.38Cytosolic iron-sulfur protein assembly protein CIAO1 homolog糖基转移酶 GlycosyltransferaseQ0J2P3↑1.21↑1.32RNA结合蛋白Y14A RNA-binding protein Y14A-likeQ0DKW1↑1.28↑1.49脱水蛋白13(片段) Dehydrin 13 (Fragment)A6N0L2↑1.22↑1.24丝氨酸/苏氨酸蛋白激酶SAPK3 A0A0P0XXV0↑1.22↑1.33Serine/threonine-protein kinase SAPK3铜转运蛋白ATX1 Copper transport protein ATX1Q6ZCF3↑1.24↓0.67丝氨酸脱羧酶1 Serine decarboxylase 1Q6ESZ9↑1.33↓0.79非特异性脂质转移蛋白3 Non-specific lipid-transfer protein 3A2ZAS9↓0.78↑1.22丝氨酸/苏氨酸蛋白磷酸酶 Serine/threonine-protein phosphataseB9FME2↓0.78↑1.43天冬氨酸蛋白酶猪笼草蛋白酶1 Aspartic proteinase nepenthesin-1Q8LNN1↓0.74↑1.47细胞数目调节蛋白10 Cell number regulator 10Q850Y8↓0.68↑1.25DNA复制执照因子MCM5(片段) A0A0K1NZY1↓0.57↑1.51DNA replication licensing factor MCM5 (Fragment)纤维素合酶(片段) Cellulose synthase (Fragment)A0A0P0WIK8↓0.72↑1.27假设蛋白P0046E05.18-1 Hypothetical protein P0046E05.18-1Q5JN54↓0.74↑1.30未知蛋白 Uncharacterized proteinQ0IT26↓0.74↓0.38未知蛋白 Uncharacterized proteinQ0IUM2↓0.77↓0.45未知蛋白 Uncharacterized proteinA2YQW2↓0.73↓0.68未知蛋白 Uncharacterized proteinA2WZK9↑1.28↓0.71未知蛋白 Uncharacterized proteinA2YMC9↑1.33↑1.70未知蛋白 Uncharacterized proteinB8BLU8↑2.42↑1.91
注:↑.表达上调;↓.表达下调。
Note:↑. Up-regulated expression; ↓.Down-regulated expression.
2.2.2 根系差异表达蛋白的生物信息学分析 为进一步了解差异蛋白质的功能,对它们进行了独立的GO功能富集分析。在WCK-WL中,差异蛋白质主要参与代谢、细胞和单机体等生物过程,分别占62.9%,46.7%和43.1%;主要涉及细胞、细胞部分和细胞器等细胞组分,分别占42.5%,41.3%和31.7%;主要在催化活性和结合两方面上发挥分子功能,分别占50.9%和49.7%。在ZCK-ZL中,差异蛋白质也主要参与代谢、细胞和单机体等生物过程,分别占58.6%,55.9%和47.1%;主要涉及细胞、细胞部分和细胞器等细胞组分,分别占44.1%,43.7%和28.7%;主要在结合和催化活性上发挥分子功能,分别占44.8%和36.8%。
KEGG富集分析发现,在WCK-WL中,差异蛋白质共涉及代谢途径(18.0%)、次级代谢产物生物合成(12.6%)、碳代谢(6.6%)等58条代谢通路;在ZCK-ZL中,差异蛋白质共涉及代谢途径(14.6%)、次级代谢产物生物合成(6.1%)、内吞(4.2%)和碳代谢(4.2%)等63条代谢通路。
2.2.3 qRT-PCR分析验证 为了检测低温胁迫下根系差异表达蛋白编码基因在转录水平上的表达模式,本研究随机选取了4个差异表达蛋白进行qRT-PCR验证。图2表明,低温胁迫下,水稻根系蛋白质表达水平与转录水平上的表现不完全一致。在东乡野生稻和中嘉早17中,天冬氨酸蛋白酶猪笼草蛋白酶1和非特异性脂质转移蛋白3在转录水平和蛋白质水平上的变化趋势表现一致。铜转运蛋白ATX1和丝氨酸脱羧酶1在翻译水平与转录水平上表现不一致,这可能与水稻根系在低温胁迫下发生的RNA剪接和翻译后修饰等过程有关。
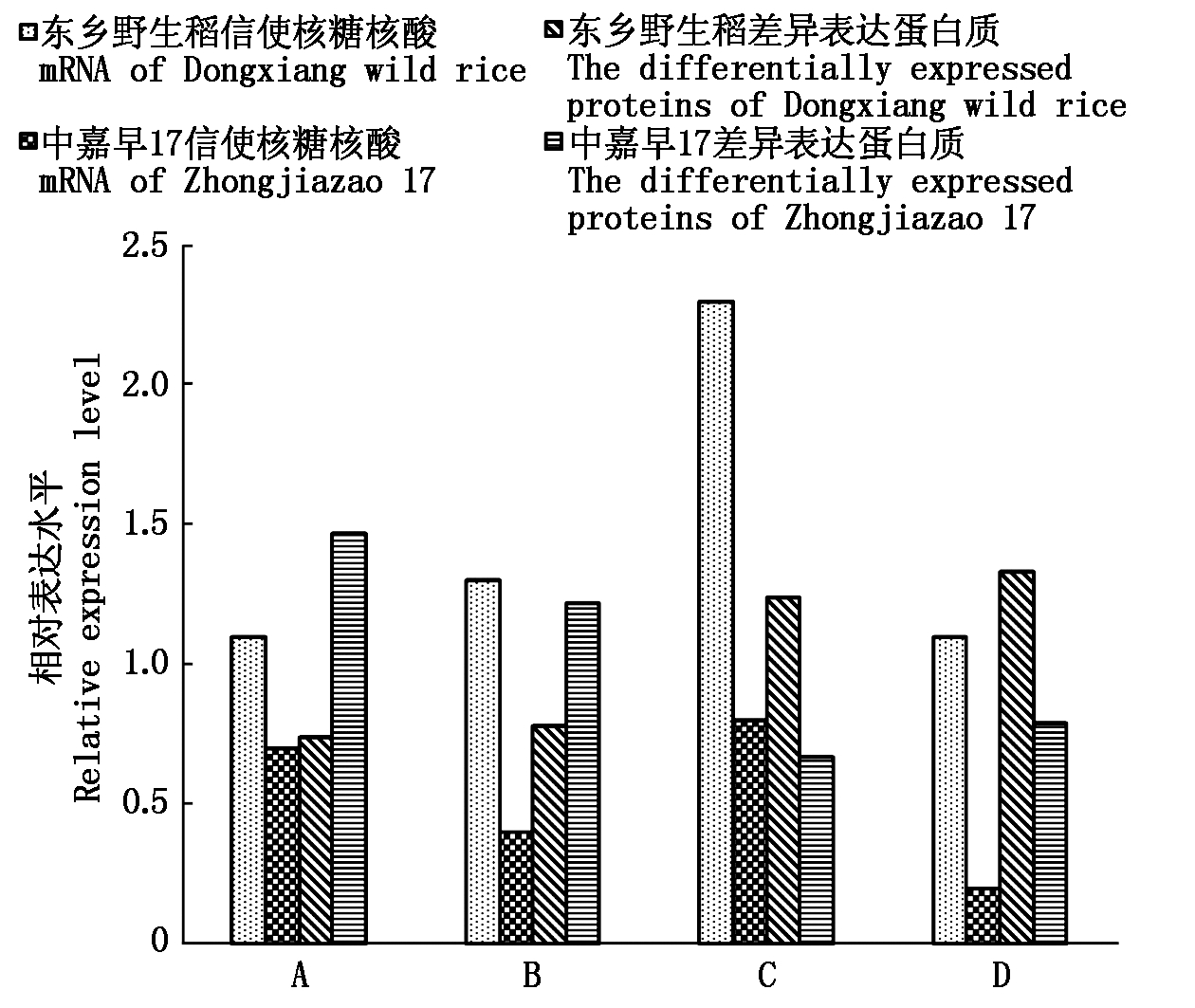
A.天冬氨酸蛋白酶猪笼草蛋白酶1; B.非特异性脂 质转移蛋白3;C.铜转运蛋白ATX1;D.丝氨酸脱羧酶1。 A.Aspartic proteinase nepenthesin-1; B.Non-specific lipid-transfer protein 3; C.Copper transport protein ATX1; D.Serine decarboxylase 1.
图2 差异蛋白质与其对应mRNA表达变化情况
Fig.2 mRNA and protein expression levels of differentially expression protein
3 结论与讨论
作物遭受低温胁迫时,可通过改变植株体内相关代谢通路或者调节相关蛋白质的表达水平降低或者修复低温造成的损伤,以维持低温胁迫下正常的生理活动。脱水蛋白(Dehydrin)是一类亲水蛋白,在处于逆境胁迫的植株中大量表达,以提高植株的抗逆性[11]。低温胁迫下,脱水蛋白能够稳定植物细胞和大分子化合物的结构,具有抗冻和清除活性氧等功能[12]。GNOM蛋白(GNOM protein)参与植物主根及侧根的生长发生过程[13]。低温胁迫下,GNOM蛋白的大量表达有利于维持植株的根系生长。丝氨酸/苏氨酸蛋白激酶(Serine/threonine-protein kinase)是催化丝氨酸或苏氨酸残基磷酸化的一类酶,在植株响应逆境胁迫、细胞信号传导、物质运输和生理代谢等方面具有重要作用[14-15]。糖基转移酶(Glycosyltransferase)通过催化作用将糖基转移到特异受体上,糖基化受体将进一步参与植株的生长发育、物质合成及逆境胁迫反应[16]。氨基酸透性酶BAT1同源物(Amino-acid permease BAT1 homolog)是一类与BAT1具有相同或相似功能的氨基酸透性酶,负责植物体内氨基酸的转运[17]。胞浆铁硫蛋白组装1同源物(Cytosolic iron-sulfur protein assembly protein CIAO1 homolog)是一类与CIAO1具有相同或相似功能的组装蛋白,参与铁硫簇的组装[18]。低温胁迫下,丝氨酸/苏氨酸蛋白激酶、糖基转移酶、氨基酸透性酶BAT1同源物和胞浆铁硫蛋白组装1同源物等蛋白在东乡野生稻和中嘉早17中表达量均上调,表明这些蛋白质易受低温胁迫因子的诱导,对维持低温胁迫下水稻苗期根系的正常生长有着重要作用。
作物遭受低温冷害时,细胞内物质合成受阻、生理代谢紊乱、植株生长不良,严重时导致植株死亡。富含亮氨酸重复/伸展蛋白(Leucine-rich repeats/exetensins)是一类富含亮氨酸重复结构域的伸展蛋白,是植物细胞壁中的一类结构蛋白,对加固细胞壁和抵御逆境反应有着重要作用[19]。二氢硫辛酸脱氢酶(Dihydrolipoyl dehydrogenase)是催化丙酮酸转变为乙酰辅酶A的核心酶之一,是影响植株体内TCA循环和脂肪酸代谢的重要酶[20]。泛素受体RAD23b(Ubiquitin receptor RAD23b)可能与植株损伤DNA的修复有关[21]。Ⅲ型过氧化物酶(Class Ⅲ peroxidase)是植物特有的一类过氧化物酶,能够清除H2O2、胺类、酚类等毒性物质,在抗逆反应过程中发挥重要作用[22]。草酸辅酶A连接酶(Oxalate-CoA ligase)在草酸降解途径中起着重要作用,参与植株体内病虫害防御、重金属胁迫及钙离子浓度、渗透压和pH值调节[23]。低温胁迫下,上述几种蛋白质在东乡野生稻和中嘉早17中表达量上调,可能与水稻苗期根系遭受低温冷害造成部分机体功能下降有关,如根系活力随着低温处理天数的增加而下降。
铜转运蛋白(Copper transporter)负责植物体内Cu离子的吸收、利用和分布,维持植物体内Cu离子的动态平衡,调控植株的生长发育[24]。最适浓度的Cu离子能够提高植株的抗逆能力,增强作物的抗逆性。低温胁迫下,耐冷性强的东乡野生稻苗期根系中铜转运蛋白表达上调,表明该蛋白可能参与了东乡野生稻抵御低温环境过程。丝氨酸脱羧酶(Serine decarboxylase)催化丝氨酸生成乙醇胺[25]。乙醇胺衍生物如N-酰基乙醇胺在逆境胁迫下参与植物的细胞防御,增强抗逆能力。低温胁迫下,丝氨酸脱羧酶在东乡野生稻苗期根系中表达上调,而在冷敏感品种中嘉早17中表达下调,表明丝氨酸脱羧酶也直接或者间接的参与了东乡野生稻抵抗低温环境过程。因此,这2种蛋白质对提高水稻的耐冷性可能有着重要的作用。
非特异性脂质转移蛋白(Non-specific lipid-transfer protein)是植物体内进行脂质转移的小分子碱性蛋白,其广泛参与植物病虫害防御、角质层合成、信号传导等多种生物学功能[26]。丝氨酸/苏氨酸蛋白磷酸酶(Serine/threonine-protein phosphatase)是催化蛋白质底物丝氨酸或苏氨酸残基去磷酸化的主要酶类,与丝氨酸/苏氨酸蛋白激酶协同催化蛋白质的可逆磷酸化,共同调控植物体内信号转导和各种生理过程。天冬氨酸蛋白酶猪笼草蛋白酶1(Aspartic proteinase nepenthesin-1)具有天冬氨酸蛋白酶类的典型特征,参与植物蛋白质的加工和降解、细胞程序性死亡、抗病抗逆性等过程。细胞数目调节蛋白(Cell number regulator)通过控制细胞数量来调控作物、器官的大小,决定作物的产量。CNR1与植株和器官的大小呈负相关,CNR2与植株的生长活力呈负相关[27]。低温胁迫下,这几种蛋白质在耐冷性强的东乡野生稻苗期根系中表达下调,而在中嘉早17中表达上调,表明这些蛋白质可能与水稻苗期根系受低温损伤的程度有关,即损伤越严重,蛋白质表达量越高。因此,低温环境下,减少或者抑制这些蛋白质的表达可能会减轻低温对水稻苗期根系的伤害。
综上,低温胁迫下,耐冷材料东乡野生稻和冷敏感水稻品种中嘉早17的苗期根系均有大量蛋白质发生了差异表达,这些差异表达的蛋白质中,有的是为了维持水稻的正常生长而上调表达,有的是因为水稻受低温损伤造成机体功能下降而表达下调。另外,有些蛋白质在东乡野生稻和中嘉早17中的表达趋势不同,这可能与2种水稻的耐冷性差异有关,对这些蛋白质及相关代谢途径的进一步研究将有助于对水稻耐冷基因的挖掘以及耐冷机理的阐述。
[1] 陈大洲, 肖叶青, 赵社香, 熊焕金, 皮勇华, 罗利军. 东乡野生稻苗期和穗期的耐寒性研究[J]. 江西农业学报, 1996, 8(1):1-6. doi:10.19386/j.cnki.jxnyxb.1996.01.001.
Chen D Z, Xiao Y Q, Zhao S X, Xiong H J, Pi Y H, Luo L J. Study on the cold tolerance of Dongxiang wild rice at stage of seedling and heading [J]. Acta Agriculturae Jiangxi, 1996,8(1):1-6.
[2] 陈大洲, 张巴克, 熊文华. 东乡野生稻种质资源研究与利用进展[J]. 江西农业学报, 2008, 20(12):12-16, 19. doi:10.19386/j.cnki.jxnyxb.2008.12.005.
Chen D Z, Zhang B K, Xiong W H. Advance in research and application of Dongxiang wild rice germplasm resources [J]. Acta Agriculturae Jiangxi, 2008,20(12):12-16, 19.
[3] 陈大洲, 钟平安, 肖叶青, 黄英金, 谢建坤. 利用SSR标记定位东乡野生稻苗期耐冷性基因[J]. 江西农业大学学报(自然科学版), 2002, 24(6):753-756. doi:10.13836/j.jjau.2002173.
Chen D Z, Zhong P A, Xiao Y Q, Huang Y J, Xie J K. Identification of QTLs for cold tolerance at seedling stage in Dongxiang wild rice(Oryza rufipogon Griff.)by SSR markers [J]. Acta Agriculturae Universitatis Jiangxiensis, 2002,24(6):753-756.
[4] 简水溶, 万勇, 罗向东, 方军, 储成才, 谢建坤. 东乡野生稻苗期耐冷性的遗传分析[J]. 植物学报, 2011, 46(1):21-27. doi:10.3724/SP.J.1259.2011.00021.
Jian S R, Wan Y, Luo X D, Fang J, Chu C C, Xie J K. Genetic analysis cold tolerance at the seedling stage in Dongxiang wild rice(Oryza rufipogon) [J]. Chinese Bulletin of Botany, 2011,46(1):21-27.
[5] 夏瑞祥, 肖宁, 洪义欢, 张超, 苏琰, 张小蒙, 陈建民. 东乡野生稻苗期耐冷性的QTL定位[J]. 中国农业科学, 2010, 43(3):443-451. doi:10.3864/j.issn.0578-1752.2010.03.001.
Xia R X, Xiao N, Hong Y H, Zhang C, Su Y, Zhang X M, Chen J M. QTLs mapping for cold tolerance at seedling stage in Dongxiang wild rice (Oryza rufipogon Griff.) [J]. Scientia Agricultura Sinica, 2010,43(3):443-451.
[6] 钱熀俊. 东乡野生稻qRC10-2耐冷基因的功能研究[D]. 扬州:扬州大学, 2005.
Qian H J. Characterization of qRC10-2,a major cold tolerant QTL from Dongxiang wild rice[D].Yangzhou:Yangzhou University, 2005.
[7] 邵彩虹, 唐秀英, 李明心, 李瑶, 王萍, 陈金, 谢金水. 6-苄基腺嘌呤延缓水稻衰亡效应的蛋白质组学分析[J]. 华北农学报, 2014, 29(1):14-19. doi:10.7668/hbnxb.2014.01.003.
Shao C H, Tang X Y, Li M X, Li Y, Wang P, Chen J, Xie J S. Proteomics analysis of mechanism of 6-benzyl adenine deferring contabescence of rice [J]. Acta Agriculturae Boreali-sinica, 2014,29(1):14-19.
[8] 肖宇龙, 钟家有, 胡启锋, 林洪鑫, 王晓玲, 雷建国, 王智权, 余传元. 江西省早稻主栽品种苗期耐冷性鉴定[J]. 江西农业学报, 2014, 26(1):53-55. doi:10.3969/j.issn.1001-8581.2014.01.015.
Xiao Y L, Zhong J Y, Hu Q F, Lin H X, Wang X L, Lei J G, Wang Z Q, Yu C Y. Identification of cold tolerance of mainly-cultivated early rice varieties at seedling stage in Jiangxi Province [J]. Acta Agriculturae Jiangxi, 2014,26(1):53-55.
[9] 赵杨, 邹应斌. 4个早稻品种苗期低温胁迫的耐寒性比较[J]. 作物研究, 2014, 28(6):581-584. doi:10.3969/j.issn.1001-5280.2014.06.01.
Zhao Y, Zou Y B. Comparsion of cold-tolerance in the seedling stage among different rice variaties under chilling stress [J]. Crop Research, 2014,28(6):581-584.
[10] 王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2005.
Wang X K. Principles and techniques of plant physiological biochemical experiment[M]. Beijing:Higher Education Press,2005.
[11] López C, Banowetz G M, Peterson C J, Kronstad W E.Dehydrin expression and drought tolerance in seven wheat cultivars[J].Crop Science,2003,43(2):577-582.doi:10.2135/cropsci2003.0577.
[12] Vaseva I I, Anders I, Yuperlieva-Mateeva B, Nenkova R, Kostadinova A, Feller U.Dehydrin expression as a potential diagnostic tool for cold stress in white clover[J].Plant Physiology and Biochemistry,2014,78:43-48.doi:10.1016/j.plaphy.2014.02.014.
[13] Guo J Z, Wei J, Xu J, Sun M X.Inducible knock-down of GNOM during root formation reveals tissue-specific response to auxin transport and its modulation of local auxin biosynthesis[J].Journal of Experimental Botany,2014,65(4):1165-1179.doi:10.1093/jxb/ert475.
[14] Wang Y L, Wan B, Li D W, Zhou J, Li R W, Bai M R, Chen F, Yu L.BRSK2 is regulated by ER stress in protein level and involved in ER stress-induced apoptosis[J].Biochemical and Biophysical Research Communications,2012,423(4):813-818.doi:10.1016/j.bbrc.2012.06.046.
[15] Shao Y, Qin Y, Zou Y J, Ma F W.Genome-wide identification and expression profiling of the SnRK2 gene family in Malus prunifolia[J].Gene,2014,552(1):87-97.doi:10.1016/j.gene.2014.09.017.
[16] Babst B A, Chen H Y, Wang H Q, Payyavula R S, Thomas T P, Harding S A, Tsai C J.Stress-responsive hydroxycinnamate glycosyltransferase modulates phenylpropanoid metabolism in Populus[J].Journal of Experimental Botany,2014,65(15):4191-4200.doi:10.1093/jxb/eru192.
[17] Hunt E, Gattolin S, Newbury H J, Bale J S, Tseng H M, Barrett D A, Pritchard J.A mutation in amino acid permease AAP6 reduces the amino acid content of the Arabidopsis sieve elements but leaves aphid herbivores unaffected[J].Journal of Experimental Botany,2010,61(1):55-64.doi:10.1093/jxb/erp274.
[18] Landry A P, Duan X W, Huang H, Ding H G.Iron-sulfur proteins are the major source of protein-bound dinitrosyl iron complexes formed in Escherichia coli cells under nitric oxide stress[J].Free Radical Biology and Medicine,2011,50(11):1582-1590. doi:10.1016/j.freeradbiomed.2011.03.005.
[19] Matsushima N, Tanaka T, Enkhbayar P, Mikami T, Taga M, Yamada K, Kuroki Y.Comparative sequence analysis of leucine-rich repeats (LRRs) within vertebrate toll-like receptors[J].BMC Genomics,2007,8:124-143.doi:10.1186/1471-2164-8-124.
[20] Timm S, Wittmi M, Gamlien S, Ewald R, Florian A, Frank M, Wirtz M, Hell R, Fernie A R, Bauwe H.Mitochondrial dihydrolipoyl dehydrogenase activity shapes photosynthesis and photorespiration of Arabidopsis thaliana[J].Plant Cell,2015,27(7):1968-1984.doi:10.1105/tpc.15.00105.
[21] Farmer L M, Book A J, Lee K H, Lin Y L, Fu H Y, Vierstra R D.The RAD23 family provides an essential connection between the 26S proteasome and ubiquitylated proteins in Arabidopsis[J].The Plant Cell,2010,22(1):124-142.doi:10.1105/tpc.109.072660.
[22] Mei W Q, Qin Y M, Song W Q, Li J, Zhu Y X.Cotton GhPOX1 encoding plant class Ⅲ peroxidase may be responsible for the high level of reactive oxygen species production that is related to cotton fiber elongation[J].Journal of Genetics and Genomics,2009,36(3):141-150. doi:10.1016/S1673-8527(08)60101-0.
[23] 蔡晓锋, 徐晨曦, 王小丽, 葛晨辉, 王全华. 植物中的草酸:合成、降解及其积累调控[J]. 植物生理学报, 2015, 51(3):267-272.doi:10.13592/j.cnki.ppj.2014.0526.
Cai X F, Xu C X, Wang X L, Ge C H, Wang Q H. The oxalic acid in plants:biosynthesis,degradation and its accumulation regulation [J]. Acta Phytophysiologica Sinica, 2015,51(3):267-272.
[24] Andrés-Col s N, Perea-García A, Puig S, Pe
s N, Perea-García A, Puig S, Pe arrubia L.Deregulated copper transport affects Arabidopsis development especially in the absence of environmental cycles[J].Plant Physiology,2010,153(1):170-184.doi:10.1104/pp.110.153676.
arrubia L.Deregulated copper transport affects Arabidopsis development especially in the absence of environmental cycles[J].Plant Physiology,2010,153(1):170-184.doi:10.1104/pp.110.153676.
[25] Yunus I S, Liu Y C, Nakamura Y.The importance of SERINE DECARBOXYLASE1 (SDC1) and ethanolamine biosynthesis during embryogenesis of Arabidopsis thaliana[J].The Plant Journal,2016,88(4):559-569.doi:10.1111/tpj.13278.
[26] 郜刚, 任彩虹, 金黎平, 谢开云, 屈冬玉. 马铃薯非特异性脂质转移蛋白基因StLTPa1的克隆和表达[J]. 作物学报, 2008, 34(9):1510-1517. doi:10.3724/SP.J.1006.2008.01510.
Gao G, Ren C H, Jin L P, Xie K Y, Qu D Y. Cloning,expression and characterization of a non-specific lipid transfer protein gene from potato [J]. Acta Agronomica Sinica, 2008,34(9):1510-1517.
[27] Guo M, Rupe M A, Dieter J A, Zou J J, Spielbauer D, Duncan K E, Howard R J, Hou Z L, Simmons C R.Cell number regulator1 affects plant and organ size in maize:implications for crop yield enhancement and heterosis[J]. The Plant Cell,2010,22(4):1057-1073.doi:10.1105/tpc.109.073676.
