单倍体技术是现代商业化育种的重要手段之一,对作物遗传育种具有重要意义[1]。黄瓜未受精子房培养是获得单(双单)倍体植株的重要途径,已在育种实践中规模化应用,但在应用中存在基因型差异大、胚胎诱导率及植株再生率较低的问题。研究黄瓜未受精子房培养(离体雌核发育)胚胎发育的分子机制,获得黄瓜未受精子房培养胚胎发育的关键基因,可以为进一步优化完善黄瓜未受精子房培养技术提供理论依据。有关黄瓜未受精子房培养的研究报道,较多围绕基因型、激素种类及浓度、培养方法等影响因素对黄瓜离体雌核胚胎发育的影响,旨在建立相应的培养技术体系。波兰学者Gémes-Juhász等[2]对6种不同基因型的黄瓜进行了取材时期和预处理方式的研究,发现热处理可以提高最适发育阶段雌核发育的频率,最高单倍体植株再生频率为7.1%。杜胜利等[3]通过对子房大小、激素种类及浓度等影响因素进行系统研究,成功研制华北刺瘤型黄瓜未受精子房培养技术,已规模化应用。王烨等[4]通过黄瓜未受精胚珠离体培养获得单倍体植株。有关黄瓜未受精子房培养胚胎发育分子机制研究较少:杜胜利等[5]在雌核发育与非雌核发育过程中,未受精子房培养早期POD酶活性急剧上升,IAA和ABA含量明显下降[5];Wei等[6]对不同基因型多胺含量变化进行了比较研究,发现离体雌核发育高频材料游离态spd+spm、结合态spd+spm含量均较高,总多胺含量较高,多胺组分及含量变化是离体雌核发育启动过程的重要特征;韩毅科等[7]应用IEF-SDS-PAGE技术对雌核发育早期蛋白表达进行研究,发现11个特异多肽点,其可能在胚胎启动阶段对细胞功能或组织的形态建成起重要作用。应用基因表达谱芯片,从转录组水平研究黄瓜未受精子房培养胚胎发育早期基因表达,揭示黄瓜离体雌核发育的分子机制,相关研究内容未见报道。本研究应用黄瓜未受精子房培养胚胎发育高频基因型材料与低频基因型材料,分别提取胚珠部位总RNA,采用基因芯片方法,从基因表达方面研究与黄瓜未受精子房培养胚胎发育早期紧密相关的基因,揭示黄瓜离体雌核胚胎发育机制,为进一步优化提高黄瓜未受精子房培养技术提供理论依据。
1 材料和方法
1.1 试验材料
以未受精子房培养过程中胚胎发生率差异筛选极端材料:高频基因型材料W7(未受精子房离体培养胚胎发生率为50%,华北刺瘤类型材料)和低频基因型材料D03-3(未受精子房离体培养胚胎发生率为0,荷兰光滑型材料)为供体材料,进行未受精子房培养。
1.2 黄瓜未受精子房的离体培养与胚珠剥离
采集开花前1~2 d的黄瓜雌花,去掉果柄和花冠,75%乙醇和次氯酸钠溶液对子房表面进行灭菌,子房横/纵切后,接种于诱导培养基中,置于25 ℃培养室、光照/黑暗16 h/8 h条件下培养。在培养的0,2,4,6 d,在体式显微镜下分别剥取不同基因型材料的胚珠,放入-80 ℃冰箱中保存备用。
1.3 RNA提取
采用TRIzol法提取总RNA。取混合材料约100 mg,在装有液氮的研钵中并于冰上研磨,加入1 mL TRIzol继续研磨,待TRIzol融化后振荡并离心;取上清液加入氯仿,振荡、静置、离心;取上清液加入等体积的高盐和异丙醇,混匀离心;吸出残液,75%乙醇洗涤沉淀,再用RNase-free水溶解沉淀;加入DNaseⅠ、RRI等置于37 ℃水浴锅中30 min;加入氯仿、水饱和酚反复抽提2次;取上清液加入醋酸钠、无水乙醇沉淀置于-20 ℃冰箱沉淀过夜;次日,用75%乙醇洗涤沉淀,再用RNase-free水溶解沉淀备用。
1.4 基因芯片杂交及数据分析
1.4.1 基因芯片杂交 以高频基因型W7为材料,分别剥取未受精子房培养0,2,4,6 d的胚珠,提取总RNA,每一时期随机选择20个子房,基因表达谱所用芯片为定制的规格为12×135 K的 ArrayRoche NimbleGen芯片,芯片探针的标准长度为60 mer,依据美国能源部在Phytozome网站上公布的基因序列设计。芯片杂交试验及数据处理由北京博奥生物技术有限公司完成主要杂交过程如下:
①用 RNA clean-up试剂对各样品总RNA进行过柱纯化,用分光光度计定量,甲醛变性胶电泳质检;②用SuperScriptⅡ 反转录酶将总RNA反转录为相应的单链cDNA,并在DNase Polymerase Ⅰ的作用下合成双链DNA;③以cDNA为模板,利用T7 Enzyme Mix体外转录合成cRNA,然后纯化定量;④取5 μg cRNA,用CbcScript酶,Random Primer 进行反转录,反转录产物用PCR NucleoSpin Extract Ⅱ Kit(MN) 纯化;⑤取上述反转录产物,以Random Primer 为引物进行Klenow 酶标记,标记产物用PCR NucleoSpin Extract Ⅱ Kit(MN) 纯化;⑥将标记好的样品与杂交Buffer(3×SSC,0.2%SDS,50×Denhart′s,25%甲酰胺)混匀后,注到已经与相应mixer黏合的芯片上,采用Roche NimbleGen Hybridization System 12 杂交仪42 ℃杂交14~16 h。杂交结束后,去除mixer,分别用不同洗液清洗芯片,甩干,扫描;⑦使用Roche-NimbleGen MS200扫描仪扫描芯片;采用NimbleScan进行图像分析,将图像信号转换为数字信号。
1.4.2 数据分析 差异基因表达分析采用SAM软件,对相邻离体培养时期差异基因数量进行两两对比分析,① 离体培养2 d(试验组UP2)和离体培养 0 d(对照组UP0),以下表示方法相同;② UP4和 UP2;③ UP6和 UP4。
差异基因筛选采用倍数变化比较,倍数计算以离体培养0 d为起点,将3个不同培养时期基因表达量作两两对比(即UP2和 UP0, UP4和 UP2, UP6和 UP4)分析,分别得出倍数(Ratio)变化,数据经log2 处理,分析3组之间的倍数变化及变化模式。
差异基因的富集分析应用在线数据库进行,差异基因功能注释参照拟南芥蛋白质数据库、GenBank中非冗余蛋白数据库以及Phytozome网站。
1.5 实时荧光定量分析
分别提取高频基因型和低频基因型材料4个离体培养时期未受精子房胚珠总RNA,在MLV-RTase和引物Oligo(dT)的作用下合成单链cDNA,反转录程序采用二步法,反应程序为:70 ℃ 5 min,25 ℃ 5 min,42 ℃ 60 min,80 ℃ 20 min,所用PCR仪为Bio-Rad S1000。qPCR采用20 μL体系,反应程序:95 ℃ 3 min;95 ℃ 10 s,58~60 ℃ 30 s,40个循环;溶解曲线温度为:55~95 ℃ 10 s,81个循环。实时荧光定量试验选择TUA作为内参基因。qPCR引物设计使用软件Primer primer 5.0,引物合成由上海生工生物工程有限公司完成。qPCR仪为Bio-Rad CFX connect。每个反应体系进行3次生物学重复和3次技术重复。qPCR数据采用2-ΔΔCt法进行分析,对得到的2-ΔΔCt 数据进行log2 处理。
2 结果与分析
2.1 黄瓜离体雌核发育转录组差异表达基因分析
应用基因芯片对26 147个基因的表达量进行测定,应用SAM软件对相邻离体培养时期基因表达量进行差异分析,基因表达量的对比分析采用倍数(Ratio)关系表示,上调基因为Ratio≥2,表达量差异大于2倍,试验组的表达量高于对照组;下调基因为Ratio≤0.5,即表达量差异大于2倍,试验组的表达量小于对照组;无差异表达基因为0.5≤Ratio≤2。共有8 858个基因发生了差异变化,其中上调表达基因4 366个,下调表达基因4 492个。
UP2 vs UP0 差异基因数目为5 760个,无差异基因数目为20 387个;UP4 vs UP2 差异基因数目为2 405个,无差异基因数目为23 472个;UP6 vs UP4 差异基因数目为693个,无差异基因数目为25 454个。对每一组差异表达的基因数量根据上调表达与下调表达进行分类统计,如图1所示。
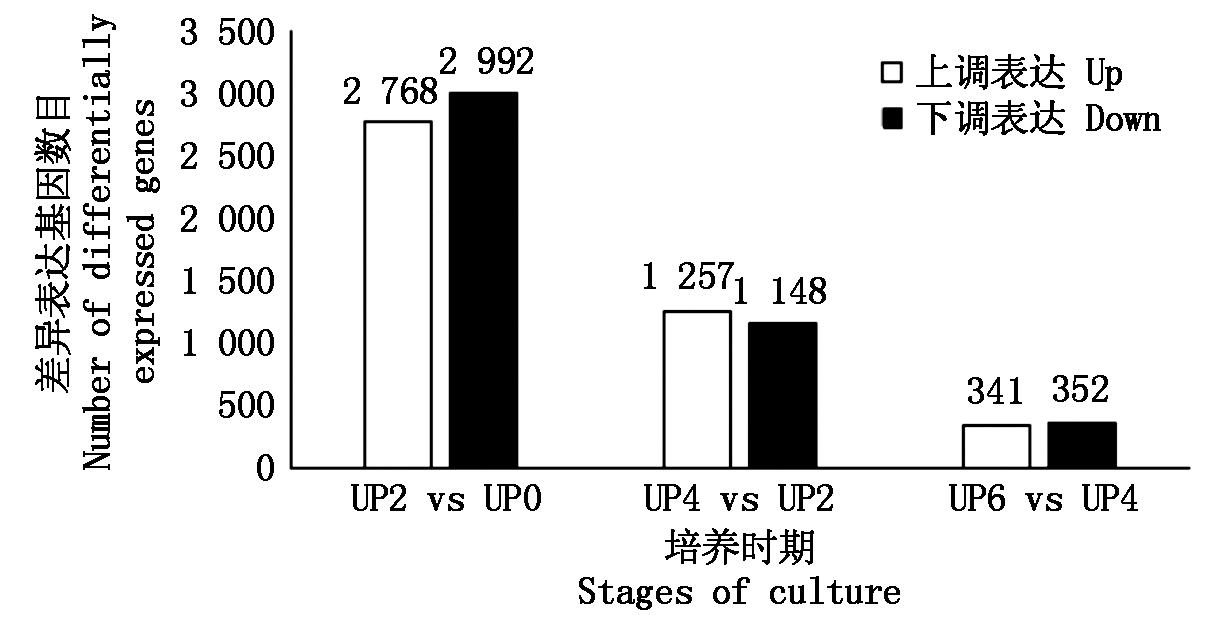
图1 不同离体培养时期两两对比 的差异表达基因数目比较
Fig.1 Number comparison of differentially expressed genes among different stages of culture
对3组差异分析数据中所有的上调表达基因和下调表达基因进行维恩图解,由图2可以看出,在所有上调基因中,有2 644,1 135,205个基因分别在某一个离体培养时期特异表达;有51,65,63个基因分别在某2个离体培养时期特异表达;有8个基因在连续3个离体培养时期特异表达。在所有的下调基因中,有2 805,1 062,171个基因分别在某一个离体培养时期特异表达;有45,39,140个分别在某2个离体培养时期特异表达;有2个基因在连续3个离体培养时期特异表达。
8个连续上调的基因,其功能主要包括白细胞介素-1受体激酶、大亚基核糖体蛋白、木葡聚糖转移酶、水通道蛋白、细胞色素P450、三磷酸酶、过氧化物酶等,涉及的主要代谢途径有嘌呤代谢,苯丙氨酸代谢,物质跨膜运输、细胞凋亡、Toll-like信号代谢通路、苯并恶嗪类物质合成等。
2.2 差异表达基因的GO功能注释及分类
2.2.1 所有差异表达基因的GO功能注释及分类 对所有的差异表达基因做了GO功能注释和分类统计,生物过程一类共有2 263个差异表达基因被注释上了GO功能,进一步对所有被注释上GO生物过程功能的差异基因进行了分类(图3)。涉及物质运输、磷酸化与脱磷酸化代谢过程差异表达基因最多;其次为响应刺激类的差异表达基因,占13%,主要包括响应信号、物质刺激的差异表达基因,约占6%,响应胁迫刺激的差异表达基因,约占4%,响应激素刺激的差异表达基因,约占3%。这几类刺激的响应有可能是关系到黄瓜离体雌核发育过程中的重要途径,是影响离体雌核胚胎发育的关键因素。
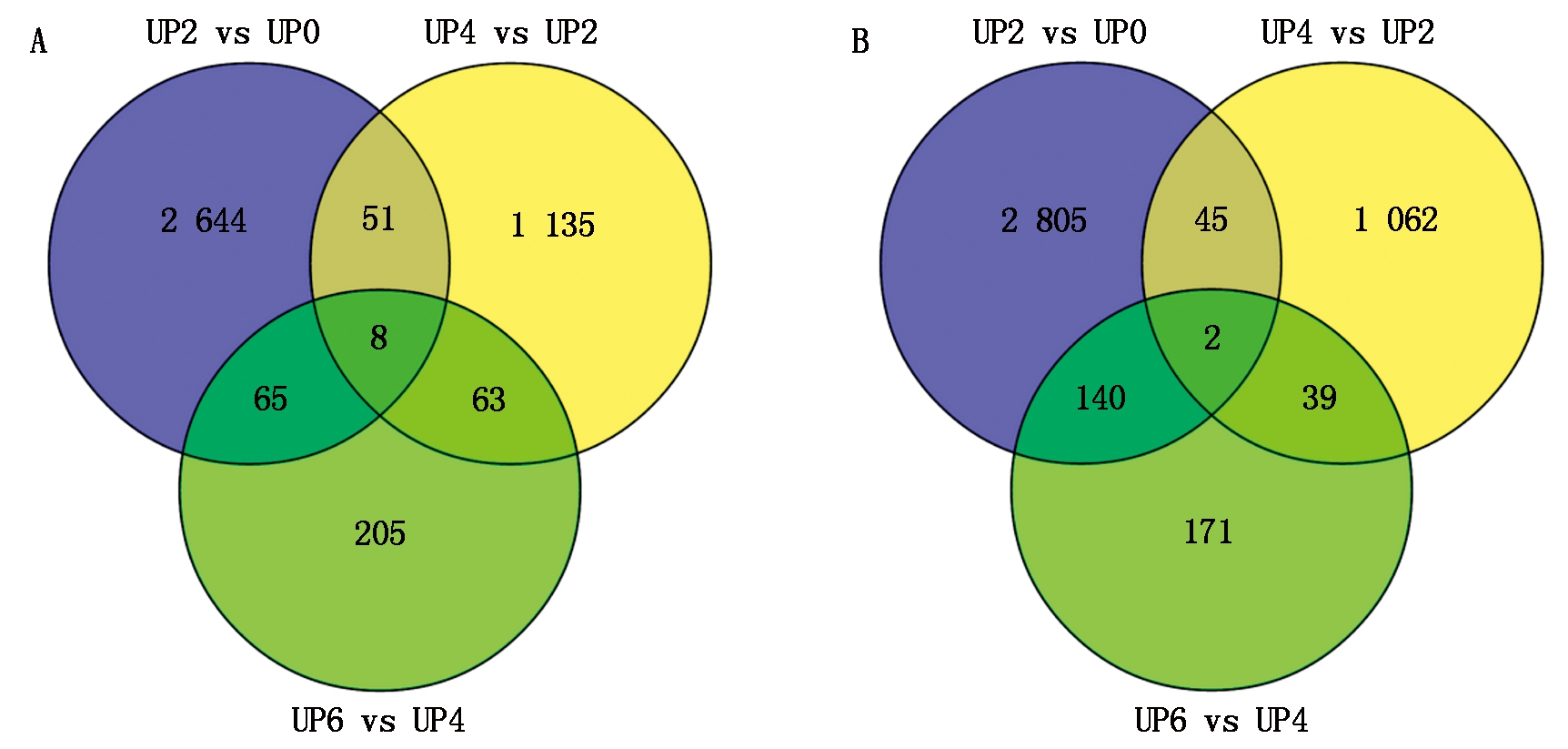
A表示3组中所有上调基因在不同离体培养时期的数目;B表示所有下调基因在不同离体培养时期的数目。 A indicates the number of up regulated genes among groups of different stages of culture; B indicates the number of down regulated genes among groups of different stages of culture.
图2 三组两两对比后的差异表达基因维恩图
Fig.2 Venn diagram of 3 group of differentially expressed genes
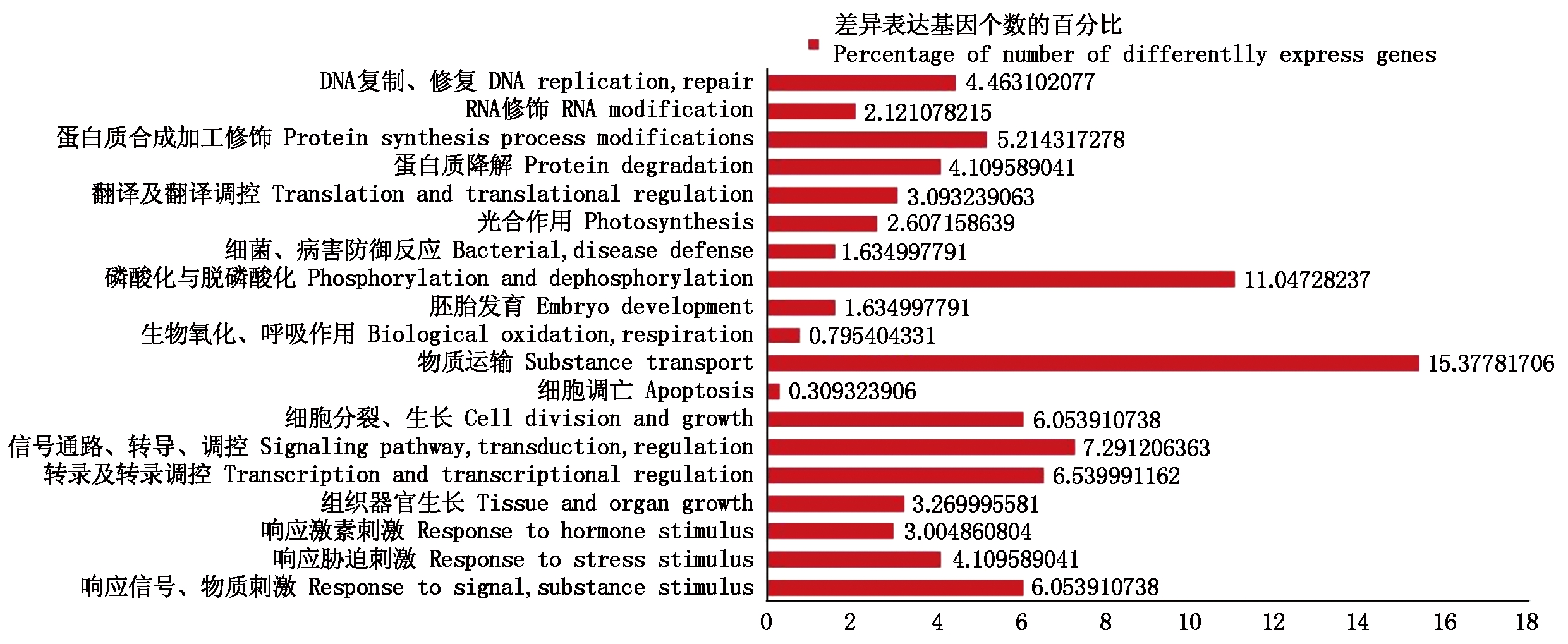
图3 差异表达基因生物过程GO功能分类
Fig.3 GO functional analysis of differentially expressed genes
2.2.2 激素相关的差异表达基因的GO功能注释及分类 进一步对与激素相关的116个差异表达基因进行分类分析(图4),发现响应脱落酸刺激的基因最多,占24.1%,其次是参与生长素信号转导途径的差异表达基因占20.7%,而响应生长素刺激、水杨酸刺激以及其他激素刺激的差异表达基因也比较多。表明这些差异表达基因在黄瓜离体雌核发育的不同时期发挥了关键作用。
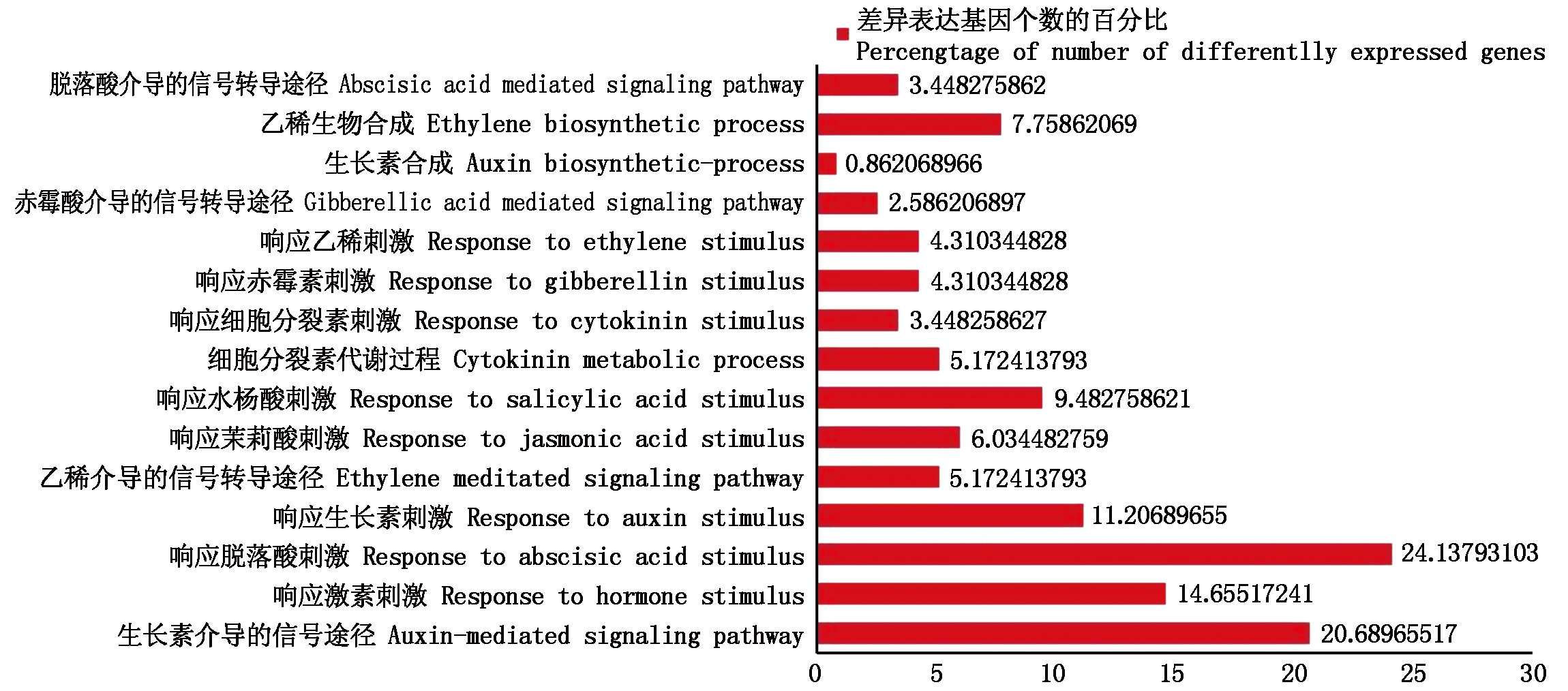
图4 激素相关的差异表达基因的GO功能分类
Fig.4 GO functional analysis of hormone related differentially expressed genes
2.2.3 激素代谢途径相关的差异基因代谢通路富集分析 针对激素相关的差异表达基因进行了代谢通路富集分析(图5),找出了2条与激素相关的代谢路径,即植物激素信号转导途径和玉米素合成途径。其中植物激素信号转导途径包括生长素信号转导途径及其合成、细胞分裂素信号转导途径、赤霉素信号转导途径、脱落酸信号转导途径、乙烯合成、水杨酸及茉莉酸代谢和植物激素油菜类内酯的代谢等途径,而玉米素合成途径涉及萜类化合物的生物合成,参与其代谢途径的差异表达基因大多涉及相关糖代谢中反应酶,如脱氢酶、转移酶等。

图5 激素代谢途径差异表达基因KEGG Pathway分析图
Fig.5 KEGG Pathway analysis of differentially expressed hormone metabolism genes
从3个方面对黄瓜离体雌核发育早期差异表达基因进行了分析和筛选:①所有上调基因的维恩图解中,筛选出连续在3个不同离体培养时期都上调表达的8个差异基因;②从响应刺激类相关的差异表达基因中,分析并筛选了与响应激素刺激相关的差异表达基因116个,与响应胁迫刺激相关的差异表达基因194个,与响应信号及物质刺激的差异表达基因88个;③还有针对性的研究了GO生物过程中与胚胎发育有特异性关系的50个差异表达基因。共筛选出456个差异表达基因。
2.3 倍数变化模式角度进一步分析差异表达基因
黄瓜离体雌核发育在培养的前6 d已经启动,在此阶段重点关注两类基因:基因表达倍数变化总体成上调趋势;无显著差异表达基因中有重要功能的基因。UP6 和 UP0这2组对比后的倍数经log2 处理后,筛选出其倍数(Ratio)大于0的所有差异表达基因,此次筛选从456个差异表达基因中共得到192个差异表达基因,且在第6天时基因的表达与0 d相比呈上调趋势。对这192个差异表达基因的倍数变化模式进行分类统计,共得出8种变化模式,如图6差异表达基因的倍数变化可划分为以下3种:
存在明显拐点:模式图type A、type B、 type E、 type F,其中type A、type E差异表达基因倍数变化为先上升再下降,type B、type F差异表达基因倍数变化呈现先下降再上升。无明显拐点:模式图type C、type D、 type G,其中type C差异表达基因倍数变化呈上升趋势,type D、type G差异表达基因倍数变化呈下降趋势。倍数变化不大:模式图type H,即在不同培养时期基因表达量变化无显著差异。
与离体培养0 d的基因表达相比,模式图type A、type B、type C在某单个离体培养时期上调表达的基因;模式图type D、type E、type F在某2个培养时期上调表达的基因;模式图type G在连续3个培养时期都上调表达的基因;模式图type H无显著差异表达的基因。
根据基因表达倍数变化分类图,以及重点挑选上调表达显著的基因以及无显著差异表达基因中有重要功能的基因,做进一步表达分析,最终确定了47个基因,见表1。
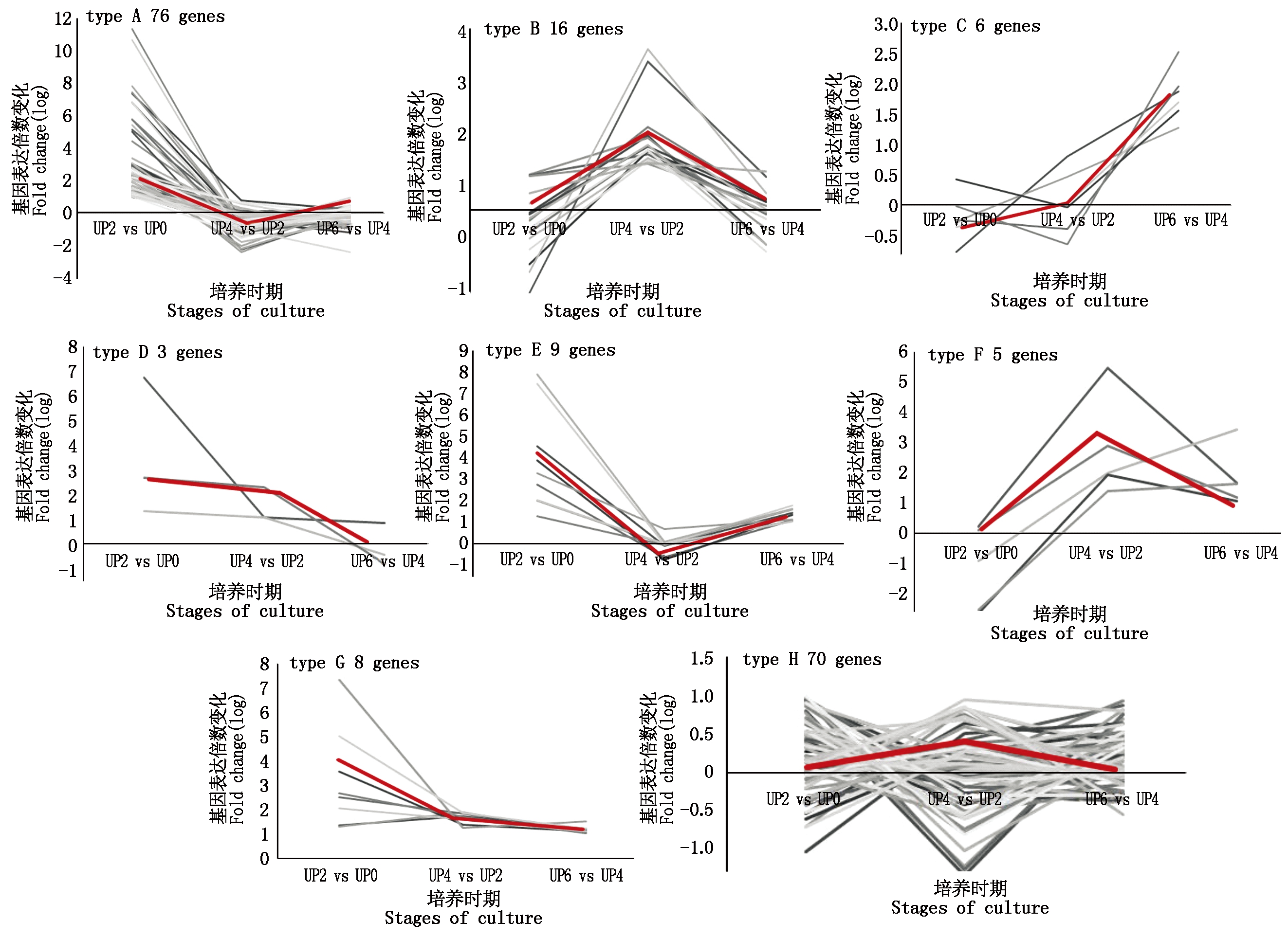
图6 差异表达基因的倍数变化模式图
Fig.6 Variation pattern of magnification ratio of differential expressed genes
表1 筛选出的各类差异表达基因
Tab.1 Selected deferentially expressed genes of different types
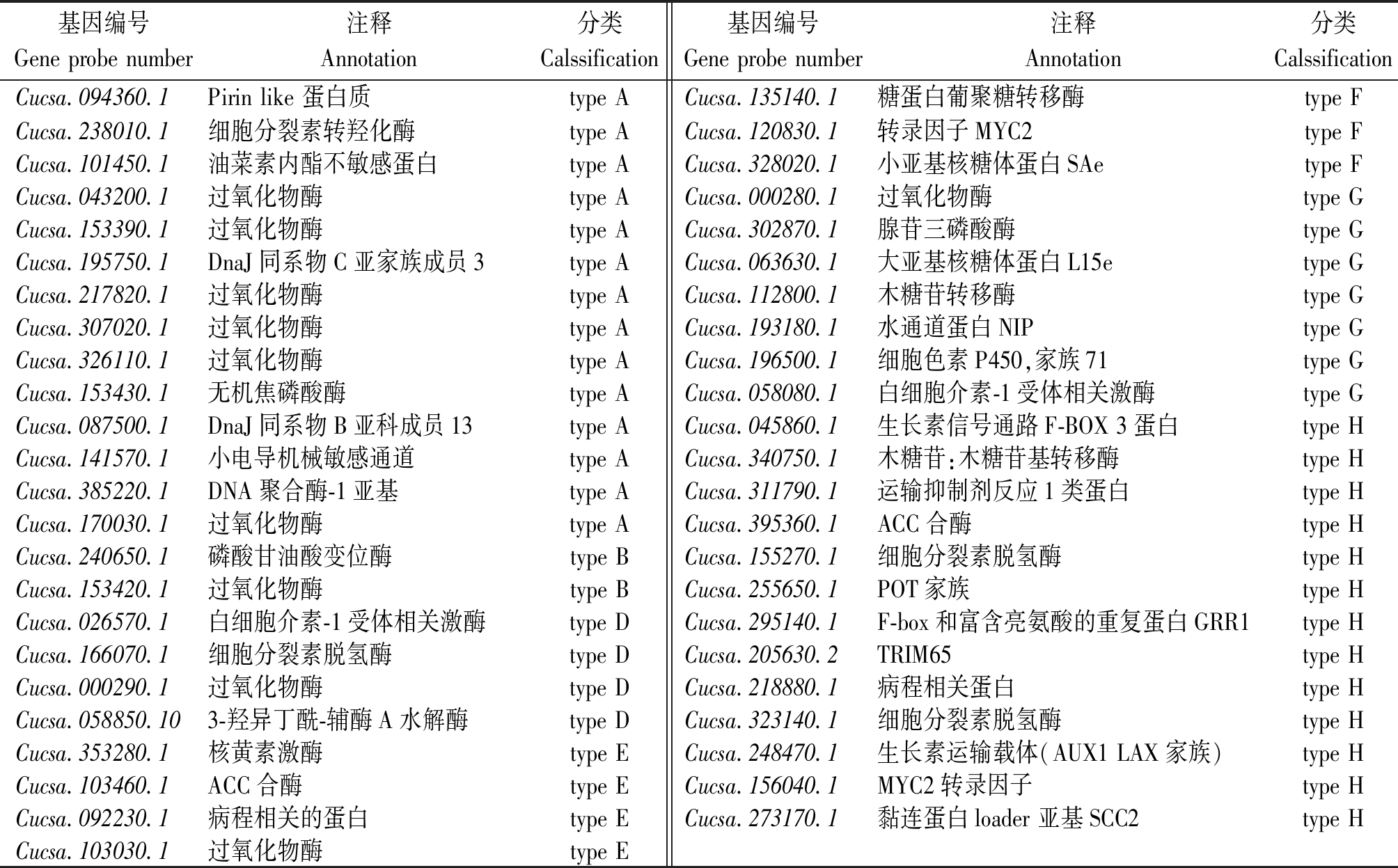
基因编号Gene probe number注释Annotation分类Calssification基因编号Gene probe number注释Annotation分类CalssificationCucsa.094360.1Pirin like 蛋白质type ACucsa.135140.1糖蛋白葡聚糖转移酶type FCucsa.238010.1细胞分裂素转羟化酶type ACucsa.120830.1转录因子MYC2type FCucsa.101450.1油菜素内酯不敏感蛋白type ACucsa.328020.1小亚基核糖体蛋白SAetype FCucsa.043200.1过氧化物酶type ACucsa.000280.1过氧化物酶type GCucsa.153390.1过氧化物酶type ACucsa.302870.1腺苷三磷酸酶type GCucsa.195750.1DnaJ同系物C亚家族成员3type ACucsa.063630.1大亚基核糖体蛋白L15etype GCucsa.217820.1过氧化物酶type ACucsa.112800.1木糖苷转移酶type GCucsa.307020.1过氧化物酶type ACucsa.193180.1水通道蛋白NIPtype GCucsa.326110.1过氧化物酶type ACucsa.196500.1细胞色素P450,家族71type GCucsa.153430.1无机焦磷酸酶type ACucsa.058080.1白细胞介素-1受体相关激酶type GCucsa.087500.1DnaJ同系物B亚科成员13type ACucsa.045860.1生长素信号通路F-BOX 3蛋白type HCucsa.141570.1小电导机械敏感通道type ACucsa.340750.1木糖苷:木糖苷基转移酶type HCucsa.385220.1DNA聚合酶-1亚基type ACucsa.311790.1运输抑制剂反应1类蛋白type HCucsa.170030.1过氧化物酶type ACucsa.395360.1ACC合酶type HCucsa.240650.1磷酸甘油酸变位酶type BCucsa.155270.1细胞分裂素脱氢酶type HCucsa.153420.1过氧化物酶type BCucsa.255650.1POT家族type HCucsa.026570.1白细胞介素-1受体相关激酶type DCucsa.295140.1F-box和富含亮氨酸的重复蛋白GRR1type HCucsa.166070.1细胞分裂素脱氢酶type DCucsa.205630.2TRIM65type HCucsa.000290.1过氧化物酶type DCucsa.218880.1病程相关蛋白type HCucsa.058850.103-羟异丁酰-辅酶A水解酶type DCucsa.323140.1细胞分裂素脱氢酶type HCucsa.353280.1核黄素激酶type ECucsa.248470.1生长素运输载体(AUX1 LAX家族)type HCucsa.103460.1ACC合酶type ECucsa.156040.1MYC2转录因子type HCucsa.092230.1病程相关的蛋白type ECucsa.273170.1黏连蛋白loader 亚基SCC2type HCucsa.103030.1过氧化物酶type E
表中所列基因主要为:激素相关基因,主要包括玉米素合成途径中的细胞分裂素脱氢酶、细胞分裂素羟化酶相关基因,与脱落酸信号转导途径相关的脱落酸受体蛋白相关基因,乙烯合成途径中的关键酶和限速酶-ACC合酶相关基因以及与生长素信号转导途径相关的生长素信号蛋白及生长素运输蛋白有关的基因等;编码转录因子,主要包括2个MYC2家族成员;其他酶类,包括与生长素信号转导途径相关的丝氨酸苏氨酸激酶,与氧化胁迫相关的过氧化物酶以及相关代谢中的转移酶、聚合酶类;离子通道蛋白、水通道蛋白等。
2.4 实时荧光定量分析
2.4.1 总RNA提取 从上述47个基因中挑选了与激素、响应胁迫、响应信号刺激、胚胎发育等相关的22个基因进行实时荧光定量验证。以离体雌核发育高频、低频基因型材料为供体材料,分别在培养0,2,4,6 d时剥取胚珠进行总RNA提取。RNA提取的电泳结果如图7,从电泳图中可以看出,8个样品的RNA中28S的亮度约为18S的2倍,且条带清晰无明显拖尾和弥散,其质量和完整性较好,可以进行后续试验。
2.4.2 数据验证 本次试验总共对22个相关基因进行了实时荧光定量验证,从中筛选出不同离体培养时期高频型和低频型在倍率变化上有较大差异的8个基因。如图8所示,8个基因在离体培养2,4,6 d与0 d对比后的芯片数据与qPCR数据的对比结果。
从左至右分别为高频型0,2,4,6 d,低频型0,2,4,6 d。 From left to right indicates RNA from ovules of 0, 2,4 and 6 d of culture both high and low efficiency genotypes respectively.
图7 总RNA电泳图
Fig.7 Electrophoresis of total RNA
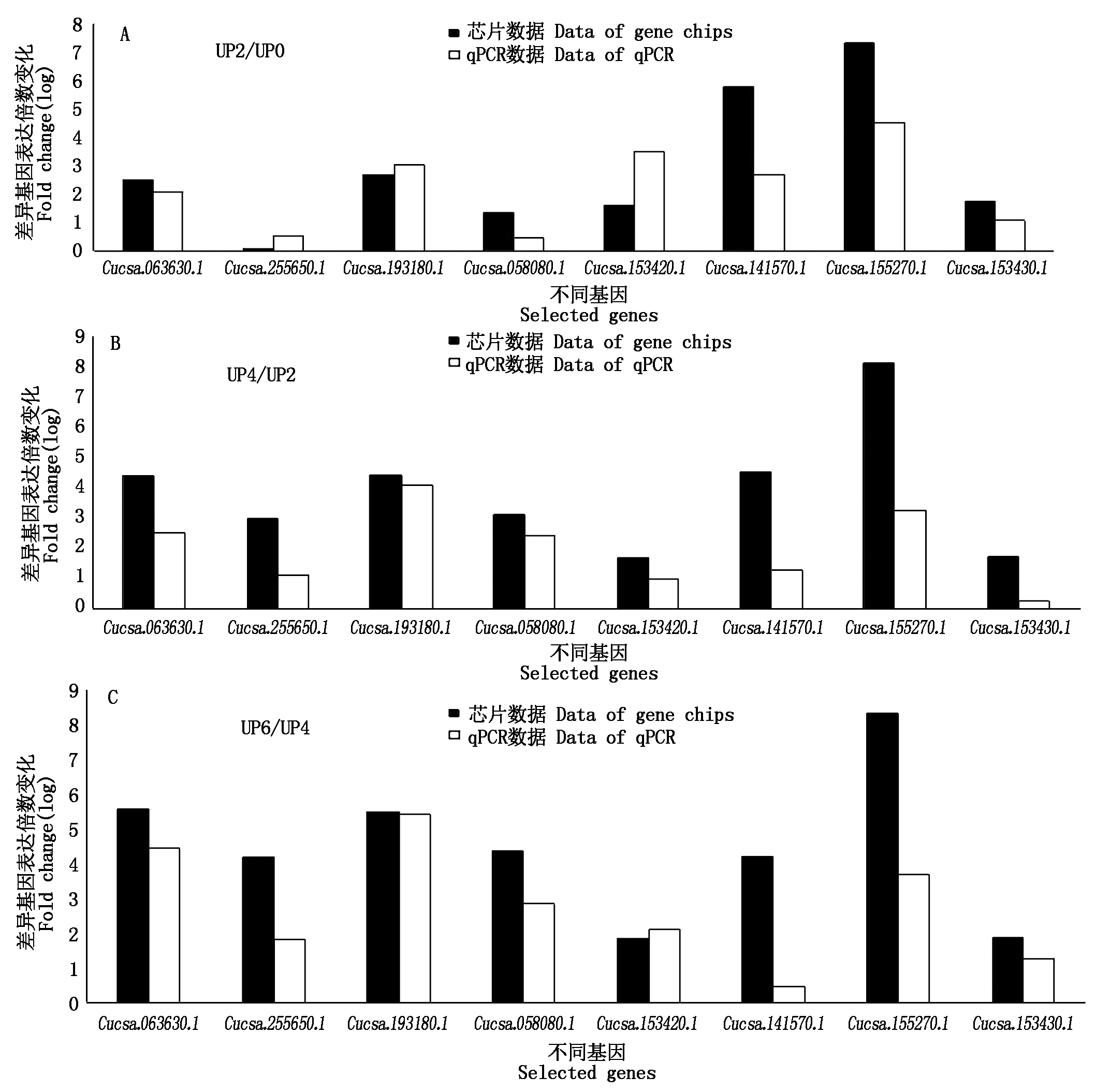
图8 芯片数据与qPCR数据对比验证结果
Fig.8 Contrast test on the qPCR results with chip data
所选出的8个基因整体都呈上调表达趋势,与相应天数的芯片数据对比显示,qPCR数据与芯片数据的基因倍数变化趋势基本一致,说明芯片数据结果真实有效。
2.4.3 差异表达基因的实时荧光定量分析 对筛选出的8个关键基因,分别以高、低频基因型为材料,进行未受精子房胚珠部位不同培养时期的差异表达分析。采用离体培养2,4,6 d与0 d对比后的qPCR倍数变化进行数据分析,数据经log2处理,见图9。
从图中可以看出:与激素相关的3个基因Cucsa.255650.1、Cucsa.063630.1、Cucsa.155270.1在高频型和低频型之间有较大差异。基因Cucsa.255650.1与响应茉莉酸、水杨酸和脱落酸刺激有关,其在高频型胚珠中的表达量总体上升,而在低频型中除在4 d时有所上升外,在2,6 d均为下降,并且总体呈下降趋势。Cucsa.063630.1表达产物是一种与植物生长素诱导相关的蛋白,其在高频型中也是呈总体上升的趋势,与低频型的主要差异是在第6天。Cucsa.155270.1与玉米素合成途径相关,其主要表达产物是细胞分裂素脱氢酶,其在高频型中一直处于高量表达,而在低频型中呈逐渐下降的趋势。与POD酶相关的基因有2个,分别是Cucsa.153420.1和Cucsa.153430.1。结果显示,这2种基因在高频型离体培养的前6 d表达量都比较高,尤其在前2 d的表达量急剧上升,而在低频型中呈下调表达或表达量低。另外KEGG通路分析显示,这2种酶还参与了苯丙氨酸代谢途径、甲烷代谢途径、苯丙素合成途径,GO分子功能还表明其参与亚铁血红素结合以及金属离子的结合。另外3个相关基因:Cucsa.193180.1基因在高频型中前6 d连续上调表达,而在低频型中第6天下调表达,此基因为水通道蛋白NIP家族的NIP Ⅱ亚家族基因NIP 5-1,GO生物过程功能显示其主要响应含硼酸盐、亚砷酸盐等含硼、砷物质。Cucsa.058080.1基因在高频型前6 d中连续上调表达,而在低频型中第6天呈现下调表达,此基因与苏氨酸-丝氨酸蛋白激酶(STK)相关。Cucsa.141570.1基因在高频型的前6 d上调表达,而低频型中除第4天上调表达外,第2天和第6天均为下调表达,总体上为下调表达,此基因主要参与机械敏感性离子通道过程,与感受和传递细胞内外信号有关。

纵坐标大于0代表基因上调表达,纵坐标小于0代表基因下调表达。 Longitudinal axis value greater than 0 indicates gene up regulation whereas longitudinal axis value less than 0 indicates gene down regulation.
图9 差异表达基因的实时荧光定量分析
Fig.9 Real-time fluorescent quantitative PCR of key differentially expressed genes
3 结论与讨论
本研究以黄瓜未受精子房培养高频基因型与低频基因型胚珠部位为材料,进行离体雌核发育早期基因的表达差异研究,获得早期差异表达基因8 858个,其中上调表达基因4 366个,被注释上GO生物过程功能的差异基因2 263个,主要涉及物质运输、磷酸化与脱磷酸化等代谢过程,说明离体雌核胚胎发育过程与体细胞胚胎发育过程类似,需要糖、蛋白、核酸等物质参与,胚胎建成过程中与细胞功能、组织形态建成及生理生化密切相关[8]。
体细胞胚胎发生被认为是研究植物早期发育调控和形态发生的模式系统,已通过胡萝卜、紫花苜蓿、菊苣、松柏等体外培养体系对体细胞胚发生途径的分子发生机制进行了深入研究,鉴定了在体细胞胚发生不同阶段表达的基因,主要包括响应胁迫应答基因(热激蛋白基因[9-10]、抗氧化酶类[11-12])、响应激素刺激基因(受生长素调控的基因[13]、ABA诱导系统相关基因[14-17])、信号转导相关基因(钙调素蛋白[18]、蛋白激酶[19-20]、应答激酶[21-23])等。植物游离小孢子培养在农作物单倍体育种中已成为研究的热点之一,研究者从细胞形态学、代谢组分及分子水平对小孢子胚胎发生的机制进行了研究,分离鉴定了多个与胚胎发育相关的基因,主要包括在胚性小孢子时期表达的基因,EcMt[24]、NtEPc[25]、热激蛋白基因[26]等;多细胞结构过程中表达的基因,BBM[27]、AGL15[28]、SERK[29]等。
本研究重点针对响应激素刺激、胁迫应答、信号转导等方面的差异表达基因进行筛选。筛选出的重要基因包含:生长素和细胞分裂素诱导合成相关的2个基因Cucsa.063630.1 和Cucsa.155270.1,在离体培养过程中在高频型胚珠中表达量高,呈总体上升的趋势,而在低频型胚珠中表达量低,基本呈下降趋势,推测其可能为黄瓜离体雌核早期胚胎发育中与激素代谢相关的重要基因。
参与过氧化物酶表达的2个基因,其在前6 d处于上调表达,而且在离体培养的第2天表达量急剧升高,代谢通路分析显示这2个基因参与苯丙氨酸代谢途径、甲烷途径以及苯丙素合成途径。这几类代谢过程是植物代谢中的次生代谢,其产物是细胞生命活动或植物生长发育正常运行的非必需的小分子化合物,苯丙氨酸代谢途径中的限速酶苯丙氨酸转氨酶(PAL)研究较早、较多,在植物响应机械损伤过程中诱导表达,切口部位PAL活性增加、切口褐化,激素刺激也可诱导其表达[26]。本研究中参与苯丙氨酸代谢途径的基因在胚胎发育早期高表达,推测其与机械损伤及激素诱导有关。
本研究发现一个与水通道蛋白相关的基因,属于NIP家族成员。研究表明,NIPⅡ家族中的AtNIP 5;1和AtNIP6;1具有运输硼的功能[30-31]。推测本试验发现的NIP基因可能与含硼物质的运输有关。在植物代谢方面,硼作为生长素调节的辅助因子,对生长素代谢途径有一定影响[32]。此基因在黄瓜离体雌核发育的早期过程中表达活跃,可能与胚胎发育过程中含硼物质参与细胞组分构建、相关激素代谢以及抵抗胁迫环境等因素有关。
本试验还发现一个植物体细胞胚胎发育受体蛋白激酶类基因,为受体苏氨酸-丝氨酸蛋白酶(STK)类基因。此类蛋白激酶的一个关键作用就是参与抵抗外界环境胁迫,如低温、干燥、盐胁迫等[33]。除此之外,在拟南芥的研究中已经发现并证实了20多个与STK相关的基因,不仅参与胁迫环境应答,还响应脱落酸、水杨酸等激素刺激相关的代谢[34]。此基因在高频型前6 d中一直呈现上调表达,而低频型在第6天则呈现下调表达,因此,推测此基因在胚胎发育早期过程中,参与STK对外界胁迫的应答方面有一定联系。
本研究筛选到的重要基因还包含与蛋白质的合成、磷酸化等相关基因:Cucsa.058850.10为线粒体3-羟基异丁酰基-CoA水解酶、Cucsa.063630.1为大亚基核糖体蛋白L15e、 Cucsa.302870.1为三磷酸酶基因;与淀粉合成相关基因:Cucsa.112800.1为木葡萄糖基转移酶、与细胞分裂相关基因Cucsa.273170.1为黏连蛋白SCC2、与病原体相关蛋白Cucsa.218880.1。在对不同作物游离小孢子培养胚胎发生的分子机理研究中,均有同类基因被发现,这些基因与小孢子胚胎发生中蛋白质降解、淀粉合成、启动孢子体途径的细胞分裂等过程相关。
[1] 陈绍江, 黎亮, 李浩川, 徐晓炜. 玉米单倍体育种技术[M]. 北京:中国农业大学出版社, 2009.
Chen S J, Li L, Li H C, Xu X W. Maize haploid breeding technology[M]. Beijing: China Agricultural University Press, 2009.
[2] Gémes-Juh sz A, Balogh P, Ferenczy A, Krist
sz A, Balogh P, Ferenczy A, Krist f Z. Effect of optimal stage of female gametophyte and heat treatment on in vitro gynogenesis induction in cucumber (Cucumis sativus L.)[J]. Plant Cell Reports, 2002, 21(2):105-111. doi:10.1007/s00299-002-0482-8.
f Z. Effect of optimal stage of female gametophyte and heat treatment on in vitro gynogenesis induction in cucumber (Cucumis sativus L.)[J]. Plant Cell Reports, 2002, 21(2):105-111. doi:10.1007/s00299-002-0482-8.
[3] 杜胜利, 魏爱民, 魏惠军, 王艳飞, 霍振荣, 马德华. 利用生物技术创造黄瓜育种新材料方法研究[J]. 天津科技, 2001(2):64. doi:10.14099/j.cnki.tjkj.2001.02.029.
Du S L, Wei A M, Wei H J, Wang Y F, Huo Z R, Ma D H. Study on the method of creating new materials for cucumber breeding by using biotechnology[J]. Tianjin Science and Technology, 2001(2):64.
[4] 王烨, 顾兴芳, 张圣平, 苗晗. 黄瓜未受精胚珠离体培养及单倍体植株再生[J]. 园艺学报, 2015, 42(11):2174-2182. doi:10.16420/j.issn.0513-353x.2014-1074.
Wang Y, Gu X F, Zhang S P, Miao H. Studies on haploid plant induction via in vitro unfertilized ovule culture of cucumber[J]. Acta Horticulturae Sinica, 2015, 42(11): 2174-2182.
[5] 杜胜利, 韩毅科, 丛颖, 魏爱民, 侯锋, 陈启民. 黄瓜离体雌核发育的过程及早期生化变化研究[J].南开大学学报(自然科学版), 2003, 36(2): 27-30. doi:10.3969/j.issn.0465-7942.2003.02.005.
Du S L, Han Y K, Cong Y, Wei A M, Hou F, Chen Q M. Histological and early biochemical aspects in cucumber in vitro gynogenesis[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis(Natural Science Edition), 2003, 36(2):27-30.
[6] Wei A M, Du S L, Han Y K, Liu N, Zhang G H. A study on the relationship between cucumber gynogenesis and content of ovary hormones and polyamines[J]. Acta Horticulturae, 2010, 871(871): 625-630. doi:10.17660/ActaHortic.2010.871.86.
[7] 韩毅科, 杜胜利, 魏爱民, 高述民, 张桂华, 陈启民. 黄瓜离体雌核发育早期的特异蛋白研究[J]. 南开大学学报(自然科学版), 2006, 39(6):1-5. doi:10.3969/j.issn.0465-7942.2006.06.001.
Han Y K, Du S L, Wei A M, Gao S M, Zhang G H, Chen Q M. Studies on specific proteins during early stage of cucumber in vitro gynogenesis[J].Acta Scientiarum Naturalium Universitatis Nankaiensis(Natural Science Edition), 2006, 39(6):1-5.
[8] 潘晓, 徐春香, 陈厚彬. 植物体细胞胚胎发生的研究进展[J]. 江西农业学报, 2009, 21(10):103-107.doi: 10.19386/j.cnki,jxnyxb.2009.10.032.
Pan X, Xu C X, Chen H B. Research advances in plant somatic embryogenesis[J]. Acta Agriculturae Jiangxi, 2009, 21(10):103-107.
[9] Kitamiya E, Suzuki S, Sano T, Nagata T. Isolation of two genes that were induced upon initiation of somatic embryogenesis on carrot hypocotyls by high concentrations of 2, 4-D[J]. Plant Cell Reports, 2000, 19(6):551-557. doi:10.1007/s002990050772.
[10] Fowler M R, Ong L M, Russinova E, Atanassov A I, Scott N W, Slater A, Elliott M C. Early changes in gene expression during direct somatic embryogenesis in alfalfa revealed by RAP-PCR[J]. Journal of Experimental Botany, 1998, 49(319):249-253. doi:10.1093/jxb/49.319.249.
[11] Papadakis A K, Roubelakis-Angelakis K A. Oxidative stress could be responsible for the recalcitrance of plant protoplasts[J]. Plant Physiol Biochem, 2002, 40(6-8): 549-559. doi:10.1016/s0981-9428(02)01423-7.
[12] Zhang S G, Han S Y, Yang W H, Wei H L, Zhang M, Qi L W. Changes in H2O2 content and antioxidant enzyme gene expression during the somatic embryogenesis of Lartx leptolepis[J]. Plant Cell, Tissue and Organ Culture, 2010, 100(1): 21-29. doi:10.1007/s11240-009-9612-0.
[13] Padmanabhan K, Cantliffe D J, Koch K E. Auxin-regulated gene expression and embryogenic competence in callus cultures of sweet potato, Ipomoea batata(L.) Lam[J]. Plant Cell Reports, 2001, 20(3):187-192. doi:10.1007/s002990000306.
[14] Leal I, Misra S. Molecular cloning and characterization of a legumin-like storage protein cDNA of Douglas fir seeds[J]. Plant Molecular Biology, 1993, 21(4):709-715. doi:10.1007/BF00014555.
[15] Yang H P, Saitou T, Komeda Y, Harada H, Kamada H. Late embryogenesis abundant protein in Arabidopsis Thaliana homologous to carrot ECP31[J]. Physiologia Plantarum, 1996, 98(3):661-666. doi:10.1111/j.1399-3054.1996.tb05724.x.
[16] Zhu C F, Hiroshi K, Hiroshi H, He M Y, Hao S. Isolation and characterization of a cDNA encoded an embryogenic cell protein-63 related to embryogenesis from carrot[J]. Acta Botanica Sinica, 1997, 39(12):1091-1098.
[17] Yang H P, Saitou T, Komeda Y, Harada H, Kamada H. Arabidopsis thaliana ECP63 encoding a LEA protein is located in chromosome 4[J]. Gene, 1997, 184(1):83-88. doi:10.1016/S0378-1119(96)00578-1.
[18] Suprasanna P, Desai N S, Nishanth G, Ghosh S B, Laxmi N, Bapat V A. Differential gene expression in embryogenic, non-embryogenic and desiccation induced cultures of sugarcane[J]. Sugar Tech, 2004, 6(4):305-309. doi:10.1007/bf02942513.
[19] Lindzen E, Choi J H. A carrot cDNA encoding an atypical protein kinase homologous to plant calcium-dependent protein kinases[J]. Plant Molecular Biology, 1995, 28(5):785-797. doi:10.1007/BF00042065.
[20] Daveletova S, Mész ros T, Miskolczi P, Oberschall A, Török K, Magyar Z, Dudits D, De
ros T, Miskolczi P, Oberschall A, Török K, Magyar Z, Dudits D, De k M. Auxin and heat shock activation of a novel member of the calmodulin like domain protein kinase gene family in cultured alfalfa cells[J]. Journal of Experimental Botany, 2001, 52(355):215-221. doi:10.1093/jexbot/52.355.215.
k M. Auxin and heat shock activation of a novel member of the calmodulin like domain protein kinase gene family in cultured alfalfa cells[J]. Journal of Experimental Botany, 2001, 52(355):215-221. doi:10.1093/jexbot/52.355.215.
[21] Shah K, Jr T W J G, Erp H V, Valérie Hecht, Vries S C D. Subcellular localization and oligomerization of the Arabidopsis thaliana somatic embryogenesis receptor kinase 1 protein[J]. Journal of Molecular Biology, 2001, 309(3):641-655. doi:10.1006/jmbi.2001.4706.
[22] Hecht V, Vielle-Calzada J P, Hartog M V, Schmidt E D L,Boutilier K, Grossniklaus U, Vries S C D. The Arabidopsis Somatic embryogenesis receptor kinase-1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture[J]. Plant Physiology, 2001, 127(3):803-816. doi:10.1104/pp.127.3.803.
[23] Komamine A, Murata N, Nomura K. Mechanisms of somatic embryogenesis in carrot suspension cultures morphology, physiology, biochemistry, and molecular biology[J]. In Vitro Cellular & Developmental Biology Plant, 2005, 41(1):6-10. doi:10.1079/IVP2004593.
[24] Reynolds T L. Effects of calcium on embryogenic induction and the accumulation of abscisic acid and an early cysteine-labeled metal-lothionein gene in androgenic microspores of Triticum aestivum[J]. Plant Science, 2000, 150(2): 201-207. doi:10.1016/s0168-9452(99)00187-9.
[25] Kyo M, Miyatake H, Mamezuka K, Amagata K. Cloning of cDNA encoding NtPEc, a marker protein for the embryogenic differentiation of immature tobacco pollen grains cultured in vitro[J]. Plant and Cell Physiology, 2000, 41(2):129-137.doi:10.1093/pcp/41.2.129.
[26] Sabehat A, Lurie S, Weiss D. Expression of small heat-shock proteins at low temperatures. A possible role in protecting against chilling injuries[J]. Plant Physiology, 1998, 117(2):651-658.doi:10.1104/pp.117.2.651.
[27] Boutilier K. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryogenic growth[J]. The Plant Cell, 2002, 14(8):1737-1749. doi:10.1005/tpc.001941.
[28] Perry S E, Lehti M D, Fernandez D E. The MADS-domain protein AG-AMOUS-like 15 accumulates in embryonic tissues with diverse origins[J]. Plant Physiology, 1999, 120(1):121-129.doi:10.1104/pp.120.1.121.
[29] Baudino S, Hansen S, Brettschneider R, Hecht V F G, Dresselhaus T, Lörz H, Dumas C, Rogowsky P M. Molecular characterisation of two novel maize LRR receptor-like kinases, which belong to the SERK gene family[J]. Planta, 2001, 213(1):1-10. doi:10.2307/23386208.
[30] Takano J, Wada M, Ludewig U, Schaaf G, von Wiren N, Fujiwara T. The Arabidopsis major intrinsic protein NIP5;1 is essential for efficient boron uptake and plant development under boron limitation[J]. The Plant Cell, 2006, 18(6): 1498-1509. doi:10.1105/tpc.106.041640.
[31] Tanaka M, Wallace I S, Takano J, Roberts D M, Fujiwara T. NIP6;1 is a boric acid channel for preferential transport of boron to growing shoot tissues in Arabidopsis[J]. The Plant Cell, 2008, 20(10): 2860-2875. doi:10.1105/tpc.108.058628.
[32] Li C J, Pfrffer H, Dannel F, Römheld V, Bangerth F. Effects of boron starvation on boron compartmentation and possibly hormone-mediated elongation growth and apical dominance of pea(Pisum sativum ) plants[J]. Physiologia Plantarum, 2001, 111(2):212-219. doi:10.1034/j.1399-3054.2001.1110212.x.
[33] Schenk P W, Snaar-Jagalska B E. Signal perception and transduction: the role of protein kinases [J]. Biochimica Et Biophysica Acta, 1999, 1449(1): 1-24. doi:10.1016/S0167-4889(98)00178-5.
[34] Rudrabhatla P, Reddy M M, Rajasekharan R. Genome-wide analysis and experimentation of plant serine/threonine/tyrosine-specific protein kinases[J]. Plant Molecular Biology, 2006, 60(2): 293-319. doi:10.1007/s11103-005-4109-7.
