株高和叶片是水稻(Oryza sativa)生物产量承载者,也是理想株型育种的主要指标,与产量密切相关[1-3]。株高过高易引起植株倒伏而减产,较小的叶片面积导致光合产物供给不足也会导致产量降低,合理株高和叶面积有利于高效利用光能,进而提高水稻的产量和品质[4]。超高产水稻和超级稻育种主要利用理想株型与杂种优势相结合的技术路线,株型改良始终是水稻育种工作的主线,株型优化是超高产育种的基础[5]。因此,鉴定和利用水稻株高和叶片性状调控的主效基因/QTL对培育水稻高产理想株型品种具有重要意义。
肥料(尤其是氮肥)在水稻高产栽培中起着关键作用,随着氮肥用量的不断增加,稻谷产量在不断增加,而氮肥利用率却在明显下降,稻田氮肥利用率仅为30%左右[6-8]。氮肥的不合理施用和氮高效品种的缺乏,导致大部分氮素通过挥发、径流等方式流失,造成了严重的环境污染,间接影响人体健康[6-7]。氮素利用效率的遗传改良,进而提高水稻氮素利用效率,是保持高产,降低氮肥投入、生产成本和减轻环境污染的有效途径[9-10]。近年来,研究者对水稻氮素利用相关性状进行分子遗传机理研究,共鉴定了250个QTL[11-14],不均匀的分布于12条染色体上,与产量QTL相比甚少(http://www.gramene.org;http://qtaro.abr.affrc.go.jp/qtab/table)。不同氮素环境下QTL表达存在显著差异,共性表达的QTL相对较少,Zhang等[8]在第12染色体上鉴定到1个与缺氮耐性相关的主效QTL TOND1,该基因能增加缺氮耐性,研究发现27.3%籼稻品种含有TOND1,72.7%的籼稻品种和全部粳稻品种没有TOND1等位基因;Wei等[9]在不同施氮水平下,共检测到39个相关的QTL,产量与氮素利用效率相关的QTL在1,2,7,11号染色体上相互重叠;冯跃等[12]在不同施氮水平下,鉴定了21个株高和抽穗期的QTL,其中仅有4个QTL共性表达。同一品种在不同肥素水平下株高和叶片等产量相关性状存在明显变化,具有明显的环境特异表达规律,而有关其遗传机制的研究报道甚少[12, 15]。鉴于此,本研究以中优早8和丰锦杂交衍生的RIL群体为试验材料,在不同氮素水平下对株高和叶片性状进行QTL分析,以期鉴定稳定表达的氮高效主效QTL,丰富水稻氮素利用效率和株型性状分子育种的理论基础。
1 材料和方法
1.1 试验材料
以典型粳稻品种丰锦(Toyonishiki,TK)和高产籼稻品种中优早8(Zhongyouzao 8,ZYZ8)杂交衍生的籼粳交重组自交系(Recombinant inbred lines,RILs)群体为试验材料,包含153个株系。
1.2 田间试验与性状测定
试验于2015年在沈阳农业大学试验基地进行,单苗栽插,行株距为30 cm×13.3 cm,每系4行,常规田间管理。耕层土壤(0~20 cm)含有机质29.8 g/kg、全氮2.16 g/kg、碱解氮84.5 mg/kg、全磷2.8 g/kg、速效磷38.3 mg/kg、全钾34.0 g/kg、速效钾138.7 mg/kg。田间试验分施氮(N+)和不施氮(N-) 2个处理,施氮处理施入纯氮150 kg/hm2 (以尿素形态施入)、过磷酸钙375 kg/hm2、氯化钾225 kg/hm2,50%的氮肥、全部的磷、钾肥在移栽前1 d作为基肥施入,20%,20%,10%的氮肥作为返青、分蘖和穗粒肥分段施入。成熟期,每个株系取中间行10株,测定主茎的株高、剑叶长和剑叶宽,计算剑叶面积;以不施氮素与施氮素性状差值作为氮素敏感性指标,评价氮素水平的响应情况,2次重复,取均值分析。
1.3 QTL分析
QTL定位图谱共包括227个标记,覆盖水稻基因组为1 671.3 cM,标记间平均距离为9.77 cM,每条染色体平均标记数为18.9个,由Yao等[16]2017年构建完成。采用Wang等[17] QTL IciMapping v4.0的完备复合区间作图(ICIM)方法进行QTL定位。LOD阈值设为2.50,当实际LOD值大于LOD阈值时,就认为该区段存在1个QTL,估算每个QTL的加性效应值和贡献率大小,并采用ICIM-EPI进行上位性分析。QTL的命名遵循McCouch等[18]命名原则。
2 结果与分析
2.1 表型分析
2种施氮水平下,中优早8和丰锦的株高和叶片性状均存在显著或极显著差异;正常施氮水平下,亲本和RILs群体的株高和叶片性状值均明显高于不施氮处理(剑叶长除外),双亲在2种氮素水平下株叶形态性状差值存在显著或极显著差异,中优早8在2 种氮素水平下性状差值显著或极显著高于丰锦的性状差值, 表明丰锦对低氮水平的敏感程度远小于中优早8。2种施氮水平下,RILs群体中不同株系株高和叶片性状存在较大幅度的变异,株高和叶片性状呈现双向超亲分离,多数性状的峰度和偏度值接近于1.00,近似于连续的正态分布。这表明,氮素水平对株叶性状存在显著影响,不同氮素水平下株高和叶片性状均为多基因控制的数量性状,符合QTL作图的要求(表1)。
表1 不同施肥水平下株高和叶片性状在RILs群体中的分布
Tab.1 Distribution of plant height and leaf traits in RILs populations at different N level
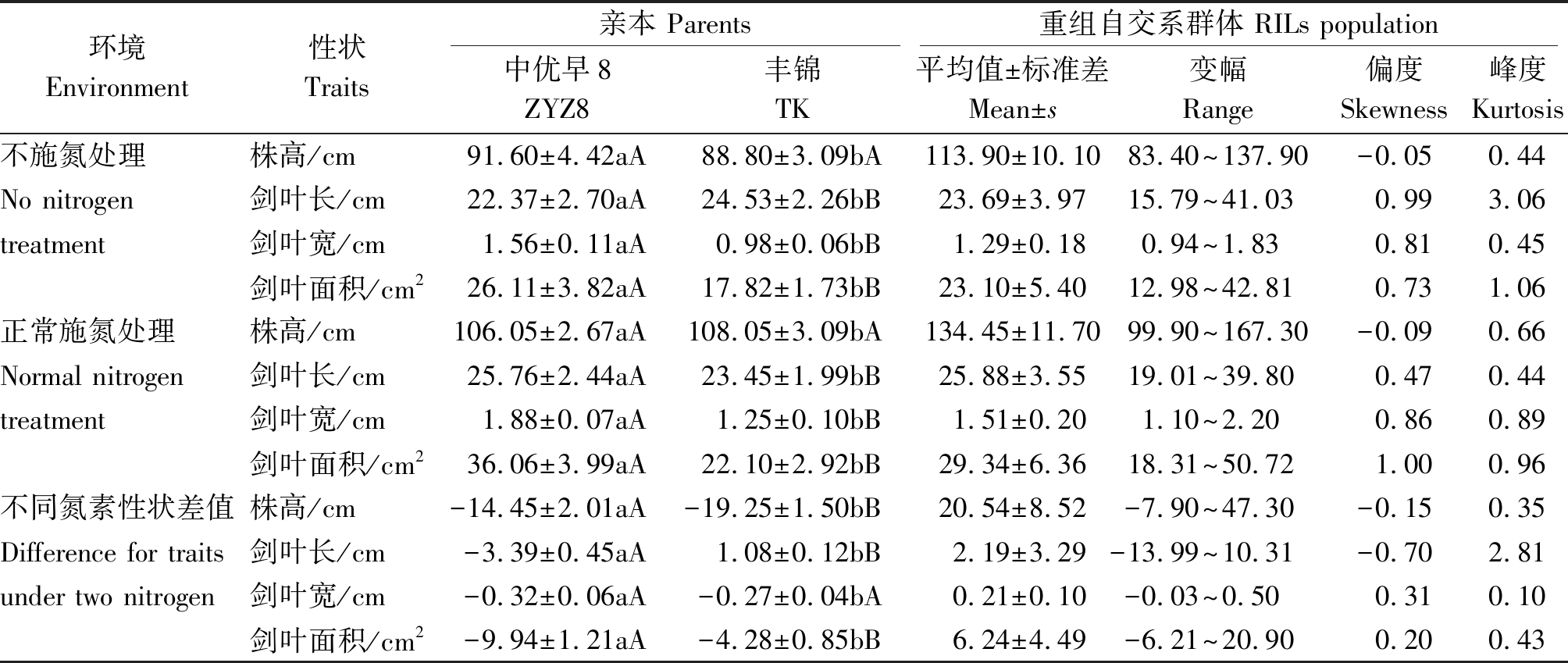
环境Environment性状Traits亲本 Parents重组自交系群体 RILs population中优早8ZYZ8丰锦TK平均值±标准差Mean±s变幅Range偏度Skewness峰度Kurtosis不施氮处理株高/cm91.60±4.42aA88.80±3.09bA113.90±10.1083.40~137.90-0.050.44No nitrogen剑叶长/cm22.37±2.70aA24.53±2.26bB23.69±3.9715.79~41.030.993.06 treatment剑叶宽/cm1.56±0.11aA0.98±0.06bB1.29±0.180.94~1.830.810.45剑叶面积/cm226.11±3.82aA17.82±1.73bB23.10±5.4012.98~42.810.731.06正常施氮处理株高/cm106.05±2.67aA108.05±3.09bA134.45±11.7099.90~167.30-0.090.66Normal nitrogen剑叶长/cm25.76±2.44aA23.45±1.99bB25.88±3.5519.01~39.800.470.44treatment剑叶宽/cm1.88±0.07aA1.25±0.10bB1.51±0.201.10~2.200.860.89剑叶面积/cm236.06±3.99aA22.10±2.92bB29.34±6.3618.31~50.721.000.96不同氮素性状差值株高/cm-14.45±2.01aA-19.25±1.50bB20.54±8.52-7.90~47.30-0.150.35Difference for traits剑叶长/cm-3.39±0.45aA1.08±0.12bB2.19±3.29-13.99~10.31-0.702.81 under two nitrogen剑叶宽/cm-0.32±0.06aA-0.27±0.04bA0.21±0.10-0.03~0.500.310.10剑叶面积/cm2-9.94±1.21aA-4.28±0.85bB6.24±4.49-6.21~20.900.200.43
注: 不同小写字母和大写字母分别表示显著和极显著差异。
Note:Different lowercase and uppercase letters represent significant and extremely significant differences, respectively.
相关分析表明,株高和叶片相关性状在不同施氮水平处理间呈极显著正相关,相关系数分别为0.739,0.618,0.866,0.724(表2) 。不同氮素水平下,株高与叶片性状间均存在显著或极显著正相关关系,不施氮水平的相关系数稍大于施氮水平;叶长与叶宽呈现显著或极显著正相关关系,叶长和叶宽与叶面积呈现极显著正相关关系,相关系数分别为0.798和0.722,0.766和0.787。这表明,不同氮素水平下,RILs群体各株系的株高和叶片性状具有较高的遗传力,水稻植株各性状对氮素存在协调变化的规律和协同响应氮素胁迫。
表2 不同施氮水平RILs群体株高和叶片性状间的相关系数
Tab.2 Correlation coefficients between plant height and leaf traits of the RILs population under two N levels
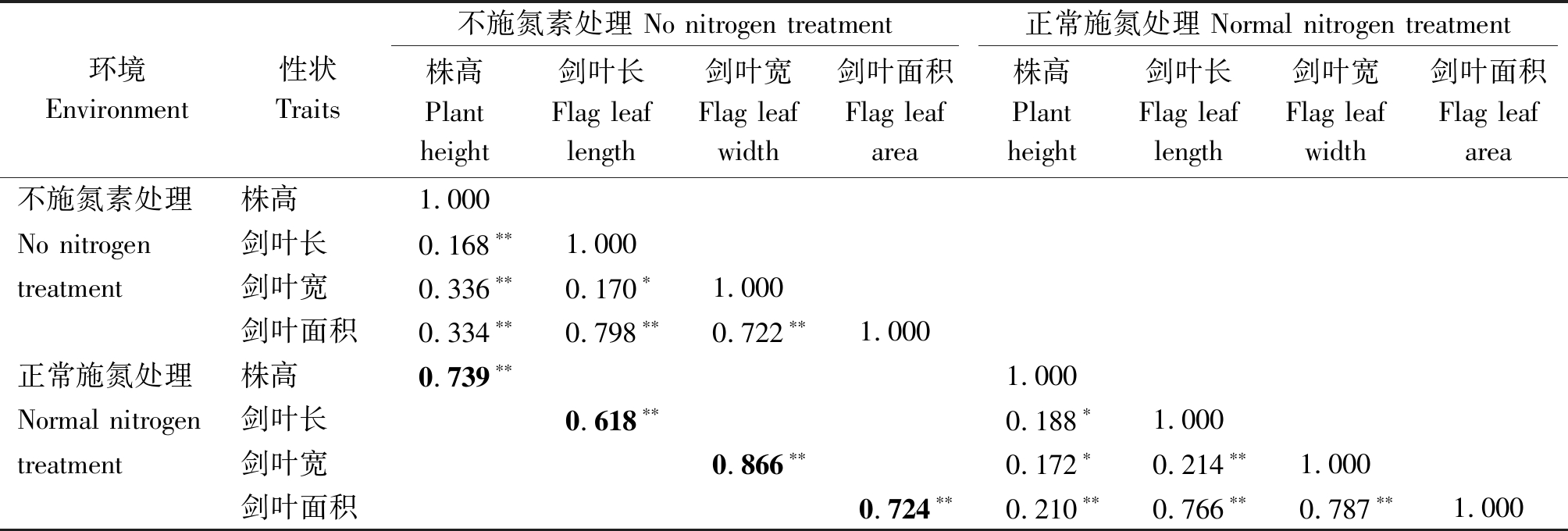
环境Environment性状Traits不施氮素处理 No nitrogen treatment正常施氮处理 Normal nitrogen treatment株高Plant height剑叶长Flag leaf length剑叶宽Flag leaf width剑叶面积Flag leaf area株高Plant height剑叶长Flag leaf length剑叶宽Flag leaf width剑叶面积Flag leaf area不施氮素处理株高1.000No nitrogen剑叶长0.168∗∗1.000 treatment剑叶宽0.336∗∗0.170∗1.000剑叶面积0.334∗∗0.798∗∗0.722∗∗1.000正常施氮处理株高0.739∗∗1.000Normal nitrogen剑叶长0.618∗∗0.188∗1.000treatment剑叶宽0.866∗∗0.172∗0.214∗∗1.000剑叶面积0.724∗∗0.210∗∗0.766∗∗0.787∗∗1.000
注:加粗表示2个环境间的相关系数;*和**分别表示0.05 和0.01的显著水平。
Note: Bold font represents the correlation between different environments; *and ** represent significant differences at 5% and 1% level, respectively.
2.2 QTL分析
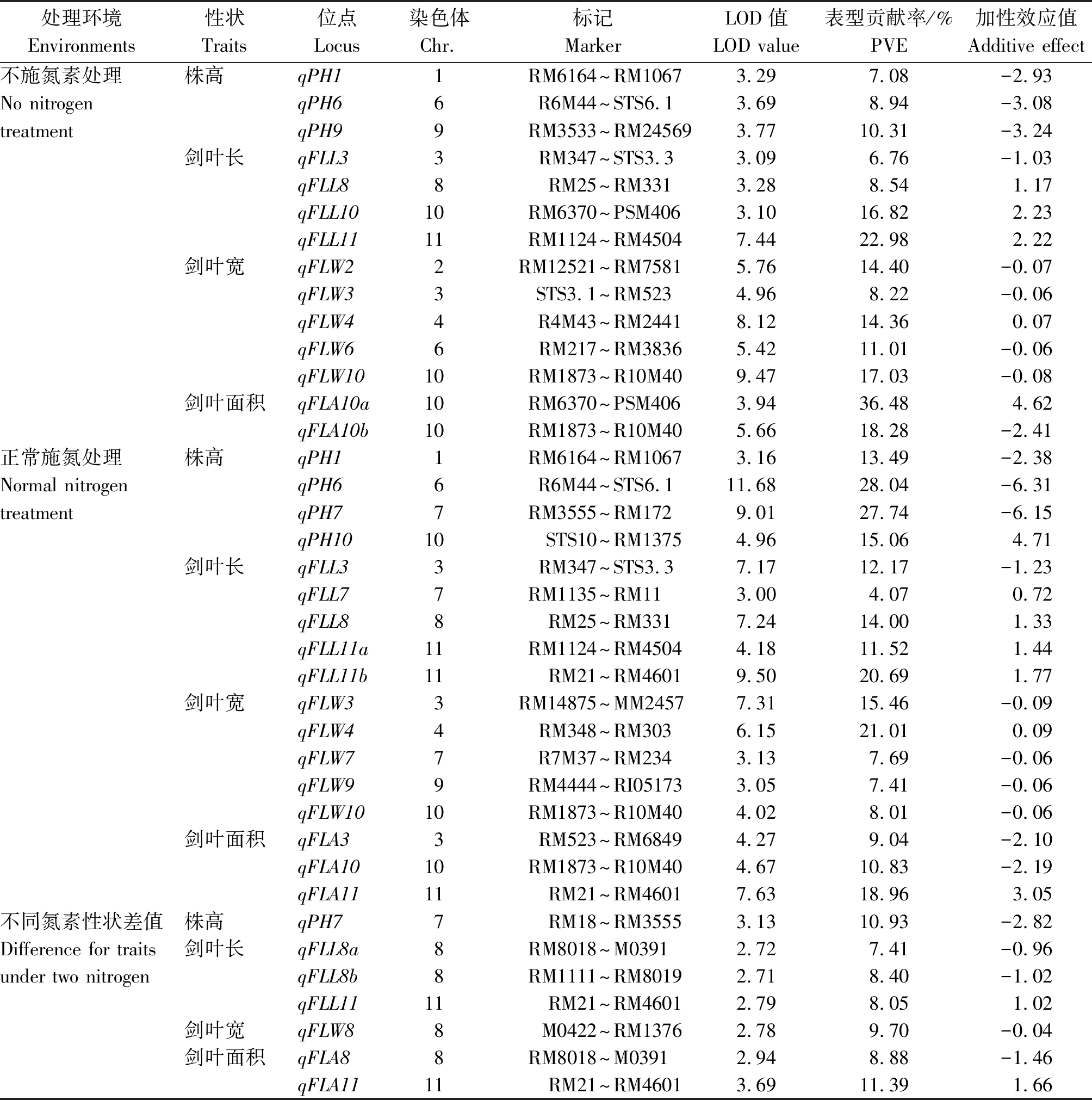
共检测到38个控制水稻株高和叶片性状的QTL,LOD值介于2.71~11.68,单个QTL可解释的表型变异介于4.07%~36.48%,加性效应值介于-6.31~4.71。相关分布于10条染色体上的17个染色体区域,其中9个QTL在不同氮素水平下稳定表达(表3、图1)。不施氮处理下检测到14个QTL,分布于9条染色体上的12个染色体区域;施氮处理下检测到17个QTL,分布于9条染色体上的15个染色体区域,检测到7个影响2种氮素株高和叶片性状差值的QTL;其中仅9个相关的QTL在2种供氮水平下被检测到,分别位于第1,3,4,6,8,10号染色体上的8个染色体区域(表3、图 1)。
株高:共检测到8个控制株高的QTL,不施氮和施氮处理下分别检测到3,4个,同时检测到1个影响差值的QTL,分别位于第1,6,7,9,10号染色体上,单一QTL解释表型变异介于7.08%~28.04%。位于第1和第6染色体上的qPH1和qPH6能在2个氮素水平下共位表达,其中qPH6的贡献率和效应值较大,增效等位基因均来自中优早8,qPH7、qPH9和qPH10仅在单一氮素环境下被检测到;此外,在第7染色体上检测到1个影响不同氮素下株高差值的QTL qPH7,解释10.93%的表型变异。
剑叶长:检测到12个调控剑叶长相关的QTL,分别检测到4,5,3个影响不施氮、施氮和2种氮素差值相关的QTL,分布于第3,7,8,10,11号染色体上,LOD介于2.71~9.50,单个QTL表型贡献率介于4.07%~22.98%,加性效应值在-1.23~2.23。qFLL3、qFLL8和qFLL11能在2个施氮水平环境中被检测到,其中qFLL8和qFLL11的增效等位基因来自丰锦,能增加叶片的长度,qFLL3增效等位基因来自中优早8,不同施氮水平下均使叶片变短;检测到3个2种氮素水平下差值相关的QTL,其中qFLL8b的贡献率和效应值较大。
表3 株高和叶片性状的QTL定位
Tab.3 QTL for plant height and leaf traits in RIL populations
处理环境Environments性状Traits位点Locus染色体Chr.标记MarkerLOD值LOD value表型贡献率/%PVE加性效应值Additive effect不施氮素处理株高qPH11RM6164~RM10673.297.08-2.93No nitrogenqPH66R6M44~STS6.13.698.94-3.08 treatmentqPH99RM3533~RM245693.7710.31-3.24剑叶长qFLL33RM347~STS3.33.096.76-1.03qFLL88RM25~RM3313.288.541.17qFLL1010RM6370~PSM4063.1016.822.23qFLL1111RM1124~RM45047.4422.982.22剑叶宽qFLW22RM12521~RM75815.7614.40-0.07qFLW33STS3.1~ RM5234.968.22-0.06qFLW44R4M43~RM24418.1214.360.07qFLW66RM217~RM38365.4211.01-0.06qFLW1010RM1873~R10M409.4717.03-0.08剑叶面积qFLA10a10RM6370~PSM4063.9436.484.62qFLA10b10RM1873~R10M405.6618.28-2.41正常施氮处理株高qPH11RM6164~RM10673.1613.49-2.38Normal nitrogenqPH66R6M44~STS6.111.6828.04-6.31 treatmentqPH77RM3555~RM1729.0127.74-6.15qPH1010STS10~RM13754.9615.064.71剑叶长qFLL33RM347~STS3.37.1712.17-1.23qFLL77RM1135~RM113.004.070.72qFLL88RM25~RM3317.2414.001.33qFLL11a11RM1124~RM45044.1811.521.44qFLL11b11RM21~RM46019.5020.691.77剑叶宽qFLW33RM14875~MM24577.3115.46-0.09qFLW44RM348~RM3036.1521.010.09qFLW77R7M37~RM2343.137.69-0.06qFLW99RM4444~RI051733.057.41-0.06qFLW1010RM1873~R10M404.028.01-0.06剑叶面积qFLA33RM523~RM68494.279.04-2.10qFLA1010RM1873~R10M404.6710.83-2.19qFLA1111RM21~RM46017.6318.963.05不同氮素性状差值株高qPH77RM18~RM35553.13 10.93 -2.82 Difference for traits剑叶长qFLL8a8RM8018~M03912.72 7.41 -0.96 under two nitrogenqFLL8b8RM1111~RM80192.71 8.40 -1.02 qFLL1111RM21~RM46012.79 8.05 1.02 剑叶宽qFLW88M0422~RM13762.789.70-0.04剑叶面积qFLA88RM8018~M03912.94 8.88 -1.46 qFLA1111RM21~RM46013.69 11.39 1.66
剑叶宽:共检测到11个影响剑叶宽相关QTL,分布于第2,3,4,6,7,8,9,10号染色体上,仅qFLW4和qFLW10能在不同氮素水平下稳定表达;其中位于第4染色体的qFLW4表型贡献率和加性效应值较大,单一QTL分别解释14.36%,21.01%的表型变异,是一个稳定表达的主效QTL;位于第10染色体的qFLW10,解释17.03%,8.01%的表型变异,增效等位基因来自中优早8,具有增加叶宽的效应;检测到1个影响2种氮素水平下剑叶宽差值相关的QTL qFLW8,可解释9.70%的表型变异。
剑叶面积:共检测到7个调控剑叶面积的QTL,分别检测到2,3,2个不施氮、施氮及差值相关的QTL,分布于第3,8,10,11号染色体上,单个QTL贡献率介于8.88%~36.48%,加性效应值介于-2.41~4.62。仅qFLA10在2个施氮水平下共位表达,表型贡献率分别为18.28%,10.83%,增效等位基因来自中优早8,能增加叶面积,qFLA10a、qFLA3和qFLA11只能在单一环境下被检测到;检测到影响不同氮素水平下剑叶面积差值相关的QTL 2个,分别位于第8,11号染色体上。

![]() 、
、![]() 、
、![]() 分别表示N-和N+环境检测到QTL及不同氮素性状差值相关的QTL。
分别表示N-和N+环境检测到QTL及不同氮素性状差值相关的QTL。 ![]() ,
,![]() and
and ![]() represent for these QTL was detected under N-, N+ level environment and difference between N+ and N- levels, respectively.
represent for these QTL was detected under N-, N+ level environment and difference between N+ and N- levels, respectively.
图1 控制株高和叶片性状的QTL在染色体上的分布
Fig.1 Chromosome location of putative QTL for plant height and leaf traits
2.3 上位性互作分析
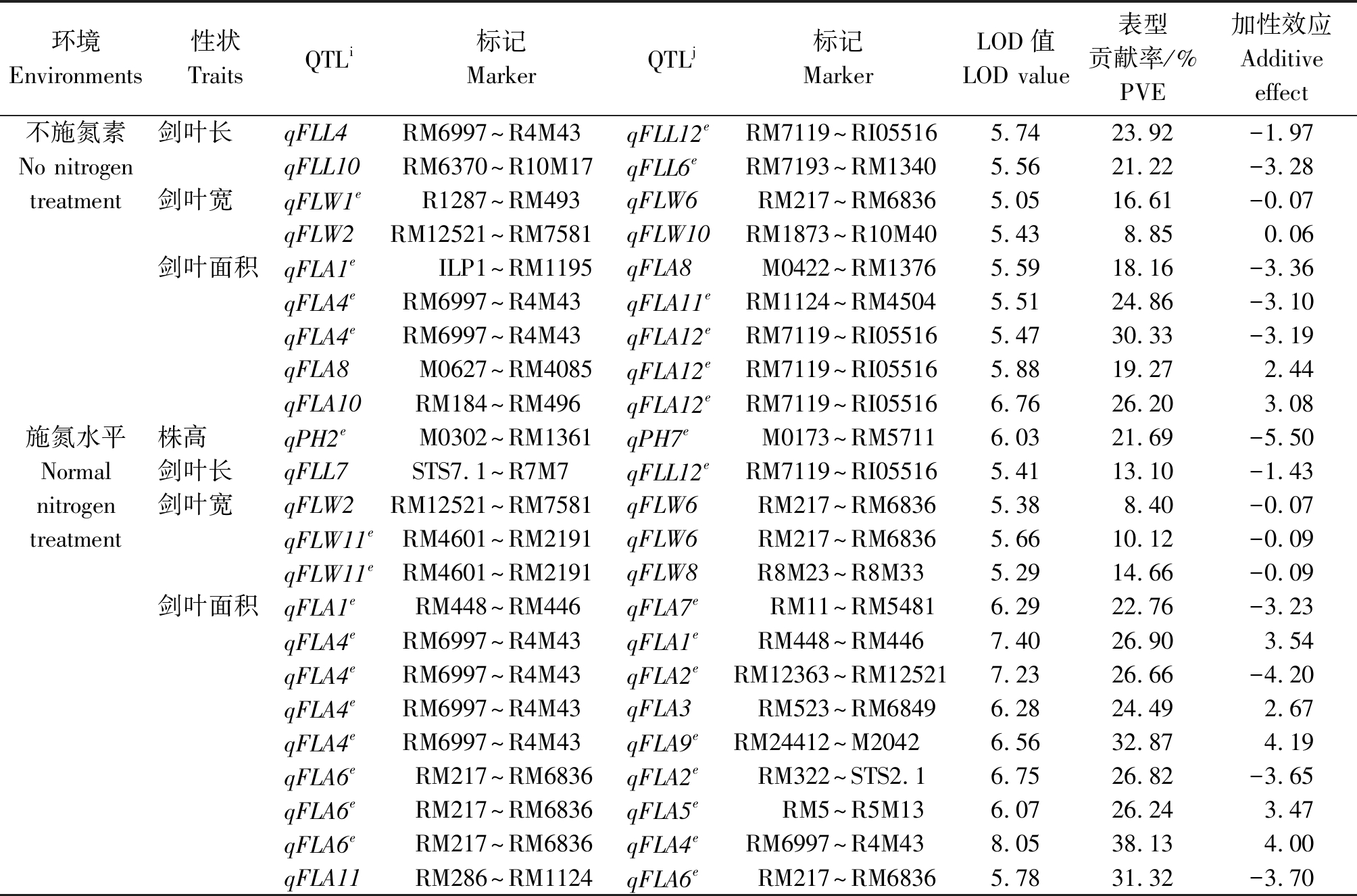
共检测到23个株高和剑叶性状上位性互作位点,分布于第1~12号染色体上(表4)。不施氮素处理检测到9个相关上位性互作QTL,检测到2对剑叶长相关的上位性互作位点,分别存在于主效QTL qFLL4与qFLL12e、主效QTL qFFL10与qFLL6e之间,贡献率相对较大,单一互作QTL解释23.92%,21.22%的表型变异;检测到2对调控剑叶宽上位性互作QTL,分布于第1,2,6,10号染色体上,第2染色体的主效QTL qFLW2与第6染色体的qFLW6存在上位性效应;检测到5对剑叶面积上位性互作QTL,分布于第1,4,8,10,12号染色体上,位于第12染色体RM7119~RI05516区段对第4,8和10号染色体相应区间上位性效应明显,可解释19.27%~30.33%的表型变异,主效QTL qFLA8、qFLA10和qFLA11也参与上位性互作。施氮处理下检测到1对影响株高的上位性互作位点,第2染色体M0302~RM1361区间与第7染色体M0173~RM5711区间存在明显的上位性互作效应,表型贡献率和效应值分别为21.69%和-5.50;在第7染色体STS7.1~R7M7区间与第12染色体RM7119~RI05516区间检测到1个调控剑叶长的上位性互作位点,此互作位点具有缩短叶长的效应;检测到3对调控叶宽的互作QTL,分布于第2,6,8,11染色体上,其中第11染色体RM4601~RM2191区间与第8染色体R8M23~R8M33区间的互作效应明显,可解释14.66%的表型变异;检测到9对影响剑叶面积相关的上位性互作QTL,分布在第1,2,3,4,5,6,7,9,11染色体上,其中第4染色体的RM6997~R4M43区间的qFLA4e与第1,2,3,6,9染色体的相应区间存在明显的上位性互作效应,第6号染色体的RM217~RM6836区间的qFLA6e与第4,5号染色体相关区间存在明显互作效应,均能明显增减剑叶面积。这表明,株高和叶片性状受多个上位性互作QTL调控,上位性互作也是调控株型性状的重要遗传组成,上位性互作既可以存在于加性效应QTL间,也可存在于加性效应QTL与非加性效应位点间,还可能存在于非加性效应位点间。
表4 水稻株高和叶片性状的上位性互作QTL及效应估算
Tab.4 Epistasis QTL and effects for plant height and flag leaf traits
环境Environments性状TraitsQTLi标记MarkerQTLj标记MarkerLOD值LOD value表型贡献率/%PVE加性效应Additive effect不施氮素剑叶长qFLL4RM6997~R4M43qFLL12eRM7119~RI055165.7423.92-1.97No nitrogenqFLL10RM6370~R10M17qFLL6eRM7193~RM13405.5621.22-3.28treatment剑叶宽qFLW1eR1287~RM493qFLW6RM217~RM68365.0516.61-0.07qFLW2RM12521~RM7581qFLW10RM1873~R10M405.438.850.06剑叶面积qFLA1eILP1~RM1195qFLA8M0422~RM13765.5918.16-3.36qFLA4eRM6997~R4M43qFLA11eRM1124~RM45045.5124.86-3.10qFLA4eRM6997~R4M43qFLA12eRM7119~RI055165.4730.33-3.19qFLA8M0627~RM4085qFLA12eRM7119~RI055165.8819.272.44qFLA10RM184~RM496qFLA12eRM7119~RI055166.7626.203.08施氮水平株高qPH2eM0302~RM1361qPH7eM0173~RM57116.0321.69-5.50Normal 剑叶长qFLL7STS7.1~R7M7qFLL12eRM7119~RI055165.4113.10-1.43nitrogen剑叶宽qFLW2RM12521~RM7581qFLW6RM217~RM68365.388.40-0.07treatmentqFLW11eRM4601~RM2191qFLW6RM217~RM68365.6610.12-0.09qFLW11eRM4601~RM2191qFLW8R8M23~R8M335.2914.66-0.09剑叶面积qFLA1eRM448~RM446qFLA7eRM11~RM54816.2922.76-3.23qFLA4eRM6997~R4M43qFLA1eRM448~RM4467.4026.903.54qFLA4eRM6997~R4M43qFLA2eRM12363~RM125217.2326.66-4.20qFLA4eRM6997~R4M43qFLA3RM523~RM68496.2824.492.67qFLA4eRM6997~R4M43qFLA9eRM24412~M20426.5632.874.19qFLA6eRM217~RM6836qFLA2eRM322~STS2.16.7526.82-3.65qFLA6eRM217~RM6836qFLA5eRM5~R5M136.0726.243.47qFLA6eRM217~RM6836qFLA4eRM6997~R4M438.0538.134.00qFLA11RM286~RM1124qFLA6eRM217~RM68365.7831.32-3.70
注:e.上位性QTL;i,j.分别表示上位性互作的不同染色体QTL位点。
Note:e.Epistasis QTL; i,j. Epistatic interaction QTL from the different chromosome locus, respectively.
3 讨论与结论
氮素在粮食生产中起着至关重要的作用,长期大量施用氮素也带来了粮食生产成本提高、氮素利用率降低和环境污染等负面效应[7-10]。利用分子生物学技术改良高产水稻品种氮素利用效率,培育养分高效吸收和利用的高产品种,是降低氮肥投入、生产成本和减轻环境污染的有效途径之一。因此,如何提高作物氮素吸收利用率已成为育种家和分子生物学家研究热点与重要目标之一[11-15, 19-21]。不同水稻品种的氮素吸收利用效率和低氮耐性上存在显著的基因型差异,籼稻吸收氮素能力较强,而粳稻相对较弱[22];付景等[23]研究表明,超级稻品种无论在低氮还是在高氮水平均能获得较高产量,在高氮水平下更有利于其生理和产量优势的发挥。本研究发现低氮水平下双亲株高和叶片性状均有所降低,中优早8各性状的降幅明显小于丰锦,中优早8的株高与叶片性状对低氮的响应程度高于丰锦;不同氮素水平下RILs群体各株系的株高和叶片性状存在明显变化,不同施氮水平各性状呈显著或极显著正相关,这表明不同基因型株系对氮素的响应存在一定差异,株高和叶片性状具有较高的遗传力,水稻植株各营养器官协同响应氮素胁迫,这与前人结果相似[20, 24-25]。
株高和叶片性状均属于典型的数量性状,受数量基因和环境共同控制,不同群体检测到的QTL数量和效应不同,相同QTL在不同发育时期和不同环境下的检测结果也不尽相同[25-27]。同时,近年来已有一些关于水稻氮素利用相关的QTL研究,定位的氮素吸收利用率相关的QTL主要分布在第1,2,4,6 染色体上[27-29]。高易宏等[28]通过GWAS研究表明,叶宽性状受氮素影响显著,鉴定到20个与低氮响应有关的SNP位点,8个位点与高氮响应有关,其中OsATG参与高氮素水平响应,LOC_Os12g25660基因在高氮和低氮水平下均能稳定参与调控叶片宽度;吕海霞等[29]在不同氮素水平下对产量性状进行QTL分析,共定位到54个QTLs,仅有6个在2种氮水平下同时检测到,第2,6,10,11染色体存在多效性QTL区域,可能是一因多效或紧密连锁的基因的效应;冯跃等[12]在第7,8染色上检测到同时控制2种氮水平下株高和抽穗期的QTL,相关位点贡献率较大,相关区域富含关键的氮代谢基因;Lian等[30]在不同氮水平下对苗期氮素吸收利用相关的QTL进行分析,研究表明,共位表达的QTL数目较少,不同氮素水平下苗期氮素吸收利用的遗传机制不同;An等[31]检测到16个氮吸收相关的QTL,苗期与田间氮吸收相关性状的QTL存在一致性;曾威等[32]研究表明,不同生育时期氮素利用效率存在动态变化,不同时期调控氮素吸收利用的相关位点不同,4个时期共检测到16个相关位点,仅1个位点稳定表达。本研究在2种氮水平下,共检测到31个株高和叶片性状的QTL,不施氮和施氮水平下分别检测到14,17个QTL,分布于10条染色体上的17个染色体区域,其中9个QTL在不同氮素水平下稳定表达。这表明,控制株高与叶片性状的QTL与施氮水平间存在明显的互作效应,不同氮素供给环境下基因的表达存在明显差异。其中,第8 染色体 RM25~RM331区间检测到控制叶长的QTL在2种氮水平下均能稳定表达,增效等位基因均来自亲本丰锦,受环境影响较小,是1个新鉴定的氮素环境相对钝感的主效应QTL;第10染色体的RM6370~PSM406和RM467~RM271染色体区域分别检测到1个新的不同氮素水平下稳定表达的QTL簇(qFLLA10和qFLWA10),参与调控剑叶宽和剑叶面积,具有明显的延伸叶片宽度和叶片面积的功能,增效等位基因来自中优早8。检测到7个性状差值相关的QTL位点,分布于第7,8,11号染色体上,主要集中分布于主效QTL簇所在区域,与不同氮素下QTL存在明显遗传重叠现象,这表明差值相关的QTL与氮素水平响应存在明显关系。此外,检测到23个上位性效应相关的QTL,这些上位性互作可以存在于主效QTL簇、加性效应或非加性效应QTL间,是调控株型性状的重要遗传组成。
本研究在第4染色体上检测到1个不同氮素水平下稳定表达的调控叶宽的主效QTL qFLW4,解释14.36%和21.01%的表型变异,与标记RM348连锁,增效等位基因来自丰锦,使叶片变窄,这与前人鉴定的窄叶相关基因NAL1、qFLW4、qCTH4、LSCHL4和qSPAD4位置相近(http://www.ricedata.cn/gene/list/154.htm),推测该区域存在1个能同时调控叶片形态与生理性状的主效QTL簇。施氮环境条件下在第7号染色体检测到主效QTL簇qPHLW7 (qPH7、qFLL7和qFLW7),这与前人在第7染色体长臂末端均检测到qPH7、qPL7和qPHL7位置相近[5, 26, 33-34];本研究检测到的qPHLW7贡献率和加性效应均相对较大,可能是1个紧密连锁的QTL簇,也可能是一因多效,推测该区域与株高、穗长和剑叶长的生长发育相关,这表明该区间有利遗传因子的客观存在性和品种自然更替中存在无意识的选择性,能在不同群体和环境被检测到,对生态环境相对钝感,具有较大的育种利用价值。研究结果将有助于更全面地剖析株高和叶片性状在不同施氮水平下的遗传基础,同时沈阳农业大学水稻所分子育种课题组将通过构建次级群体进一步解析相关主效QTL,利用QTL紧密连锁标记进行辅助选择,培育氮素高效吸收利用的优异品系。
[1] 王一平,曾建平,郭龙彪,邢永忠,徐才国,梅捍卫,应存山,罗利军. 水稻顶部三叶与穗重的关系及其QTL分析[J]. 中国水稻科学,2004,19(1):13-20.
Wang Y P, Zeng J P, Guo L B, Xing Y Z, Xu C G, Mei H W, Ying C S, Luo L J. QTL and correlation analysis on characters of top three leaves and panicle weight in rice(Oryza sativa)[J]. Chinese Journal of Rice Science, 2004, 19(1): 13-20.
[2] 刘传光,张桂权,周汉钦,冯道基,郑海波. 华南地区常规籼稻品种产量和株型性状的遗传改良[J]. 中国农业科学,2010,43(19):3901-3911.doi:10.3864/j.issn.0578-1752.2010.19.001.
Liu C G, Zhang G Q, Zhou H Q, Feng D J, Zheng H B. Genetic improvement of yield and plant-type traits of inbred Indica rice cultivars in South China[J]. Scientia Agricultura Sinica, 2010, 43(19):3901-3911.
[3] 姜树坤,张喜娟,黄成,邢亚南,郑旭,徐正进,陈温福. 基于粳稻F2和F2∶6群体的连锁图谱及剑叶性状QTL比较分析[J]. 中国水稻科学,2010,24(4):372-378. doi:10.3969/j.issn.1001-7216.2010.04.007.
Jiang S K, Zhang X J, Huang C, Xing Y N, Zheng X, Xu Z J, Chen W F. Comparison of genetic linkage map and QTLs controlling flag leaf traits based on F2 and F2:6 populations derived from Japonica rice[J]. Chinese Journal of Rice Science, 2010, 24(4):372-378.
[4] 樊叶杨,庄杰云,李强,Sala F, 郑康乐. 水稻株高QTL分析及其与产量QTL的关系[J]. 作物学报,2001,27(6):915-922. doi:10.3321/j.issn:0496-3490.2001.06.038.
Fan Y Y, Zhuang J Y, Li Q, Sala F, Zheng K L. Analysis of quantitative trait loci(QTL) for plant height and the relation between these QTL and QTL for yield traits in rice[J]. Acta Agronomica Sinica, 2001, 27(6): 915-922.
[5] 陈温福,徐正进,张龙步,张文忠,马殿荣. 北方粳型稻超高产育种理论与实践[J]. 中国农业科学, 2007,40(5):869-874.doi:10.3321/j.issn:0578-1752.2007.05.001.
Chen W F, Xu Z J, Zhang L B, Zhang W Z, Ma D R. Theories and practices of breeding Japonica rice for super high yield[J]. Scientia Agricultura Sinica, 2007, 40(5): 869-874.
[6] Peng S B, Buresh R J, Huang J L, Yang J C, Zou Y B, Zhong X H, Wang G H, Zhang F S. Strategies for overcoming low agronomic nitrogen use efficiency in irrigated rice systems in China[J]. Field Crops Research, 2006, 96(1):37-47. doi:10.1016/j.fcr.2005.05.004.
[7] 林海建, 张志明,张永中,高世斌,潘光堂. 作物氮、磷、钾利用相关性状的QTL 定位研究进展[J]. 植物营养与肥料学报,2010, 16(3):732-743. doi:10.11674/zwyf.2010.0332.
Lin H J, Zhang Z M, Zhang Y Z, Gao S B, Pan G T. Advancement of QTL analysis for traits associated to N, P and K utilization[J].Journal of Plant Nutrition and Fertilizers, 2010, 16(3): 732-743.
[8] Zhang Y J, Tan L B, Zhu Z F, Yuan L X, Xie D X, Sun C Q. TOND1 confers tolerance to nitrogen deficiency in rice[J]. The Plant Journal, 2015, 81(3):367-376. doi:10.1111/tpj.12736.
[9] Wei D, Cui K H, Ye G Y, Pan J F, Xiang J, Huang J L, Nie L X. QTL mapping for nitrogen-use efficiency and nitrogen-deficiency tolerance traits in rice[J]. Plant and Soil, 2012, 359(1-2): 281-295. doi:10.1007/s11104-012-1142-6.
[10] 张卫峰,马林,黄高强,武良, 陈新平, 张福锁. 中国氮肥发展、贡献和挑战[J]. 中国农业科学,2013,46(15):3161-3171. doi:10.3864/j.issn.0578-1752.2013.15.010.
Zhang W F, Ma L, Huang G Q, Wu L, Chen X P, Zhang F S. The development and contribution of nitrogenous fertilizer in China and challenges faced by the country[J]. Scientia Agricultura Sinica, 2013, 46(15): 3161-3171.
[11] Feng Y, Zhai R R, Lin Z C, Cao L Y, Wei X H, Cheng S H. Quantitative trait locus analysis for rice yield traits under two nitrogen levels[J]. Rice Science, 2015, 22(3): 108-115. doi:10.1016/j.rsci.2015.05.014.
[12] 冯跃,翟荣荣,曹立勇,林泽川,魏兴华,程式华. 不同施氮水平下水稻株高与抽穗期的QTL 比较分析[J]. 作物学报,2011,37(9):1525-1532. doi:10.3724/SP.J.1006.2011.01525.
Feng Y, Zhai R R,Cao L Y,Lin Z C,Wei X H, Cheng S H. QTL analysis for plant height and heading date in rice under two nitrogen levels[J]. Acta Agronomica Sinica, 2011, 37(9): 1525-1532.
[13] Zhao C F, Zhou L H, Zhang Y D, Zhu Z, Chen T, Zhao Q Y, Yao S, Yu X, Wang C L. QTL mapping for seedling traits associated with low-nitrogen tolerance using a set of advanced backcross introgression lines of rice[J]. Plant Breeding, 2014, 133(2): 189-195. doi:10.1111/pbr.12123.
[14] 张晓果,王丹英,计成林,徐春梅,陈松,章秀福.水稻氮素吸收利用研究进展[J]. 中国稻米,2015,21(5):13-19. doi:10.3969/j.issn.1006-8082.2015.05.003.
Zhang X G, Wang D Y, Ji C L, Xu C M, Chen S, Zhang X F. Nitrogen absorption and utilization on rice[J]. China Rice, 2015,21(5): 13-19.
[15] 杨树明,曾亚文,王荔,杜娟,普晓英,杨涛. 不同生长环境下水稻氮、磷、钾利用相关性状的QTL定位分析[J]. 植物营养与肥料学报,2015,21(4):823-835. doi:10.11674/zwyf.2015.0401.
Yang S M, Zeng Y W, Wang L, Du J, Pu X Y, Yang T. Identification of QTL traits on N, P and K utilization in rice under different growth environments[J]. Journal of Plant Nutrition and Fertilizers, 2015, 21(4):823-835.
[16] Yao X Y, Wang J Y, Liu J, Zhang J, Ren C Y, Ma D R, Xu H, Xu Z J. Mapping quantitative trait loci associated with starch paste viscosity in rice(Oryza sativa L.) under different environmental conditions[J]. Plant Breeding, 2017, 136(5):591-602. doi:10.1111/pbr.12505.
[17] Wang J K, Li H H, Zhang L Y, Meng L. QTL ICI Mapping V4.1[EB/OL]. http://www.isbreeding.net, 2016.
[18] McCouch S R, Cho Y G, Yano M, Paul E, Blinstrub M, Morishima H, Kinoshita T. Report on QTL nomenclature[J]. Rice Genet Newsletter, 1997, 14(11):11-13.
[19] 赵春芳,赵凌,张亚东,陈涛,赵庆勇,朱镇,周丽慧,姚姝,王才林. 水稻苗期耐低氮相关性状的QTL定位[J]. 华北农学报,2015,30(6):1-7. doi:10.7668/hbnxb.2015.06.001.
Zhao C F, Zhao L, Zhang Y D, Chen T, Zhao Q Y, Zhu Z, Zhou L H, Yao S, Wang C L. QTL mapping for seedling traits related to low nitrogen tolerance in rice[J]. Acta Agriculturae Boreali-Sinica, 2015, 30(6):1-7.
[20] 李亚非,黎毛毛,曹桂兰,韩龙值. 水、旱稻氮高效QTL定位及其表达的遗传背景效应研究[J]. 中国农业科学,2010,43(21):4331-4340. doi:10.3864/j.issn.0578-1752.2010.21.001.
Li Y F, Li M M, Cao G L, Han L Z. Effects of genetic background on expression of QTL for nitrogen efficiency in irrigated rice and upland rice[J]. Scientia Agricultura Sinica,2010,43(21):4331-4340.
[21] 冯跃,翟荣荣,林泽川,曹立勇,魏兴华,程式华. 不同供氮水平下水稻产量性状的QTL分析[J]. 中国水稻科学,2013,27(6):577-584.doi:10.3969/j.issn.1001-7216.2013.06.003.
Feng Y, Zhai R R, Lin Z C, Cao L Y, Wei X H, Cheng S H. QTL analysis for yield traits in rice under two nitrogen levels[J]. Chinese Journal of Rice Science, 2013, 27(6): 577-584.
[22] 龚金龙,邢志鹏,胡雅杰,张洪程,戴其根,霍中洋,许轲,魏海燕,高辉. 籼、粳超级稻氮素吸收利用与转运差异研究[J]. 植物营养与肥料学报,2014,20(4):796-810. doi:10.11674/zwyf.2014.0402.
Gong J L, Xing Z P, Hu Y J, Zhang H C, Dai Q G, Huo Z Y, Xu K, Wei H Y, Gao H. Differences of nitrogen uptake, utilization and translocation between Indica and Japonica super rice[J].Journal of Plant Nutrition and Fertilizers, 2014, 20(4): 796-810.
[23] 付景, 王志琴, 袁莉民, 王学明,杨建昌. 施氮量对超级稻产量和一些生理性状的影响[J]. 中国水稻科学, 2014, 28(4):391-400. doi: 10.3969/j.issn.1001-7216.2014.04.008.
Fu J, Wang Z Q, Yuan L M, Wang X M, Yang J C. Effect of nitrogen rates on grain yield and some physiological traits of super rice[J]. Chinese Journal of Rice Science, 2014, 28(4):391-400.
[24] Wei D, Cui K H, Pan J F, Ye G Y, Xiang J, Nie L X, Huang J L.Genetic dissection of grain nitrogen use efficiency and grain yield and their relationship in rice[J]. Field Crops Research, 2011, 124(3): 340-346. doi:10.1016/j.fcr.2011.07.003.
[25] 唐江云,张涛,蒋开锋,杨莉,杨乾华,万先齐,曹应江,游书梅,郑家奎. 利用基础导入系群体定位氮胁迫下水稻产量性状QTL[J]. 农业生物技术学报,2011,19(6):996-1002.doi:10.3969/j.issn.1674-7968.2011.06.003.
Tang J Y, Zhang T, Jiang K F, Yang L, Yang Q H, Wan X Q, Cao Y J, You S M, Zheng J K. Identification of QTL for yield traits of low nitrogen stress by using introgression lines of rice[J]. Journal of Agricultural Biotechnology, 2011, 19(6): 996-1002.
[26] 姚晓云,李清,刘进,姜树坤,杨生龙,王嘉宇,徐正进.不同环境下水稻株高和穗长的QTL分析[J]. 中国农业科学,2015,48(3):407-414. doi:10.3864/j.issn.0578-1752.2015.03.01.
Yao X Y, Li Q, Liu J, Jiang S K, Yang S L, Wang J Y, Xu Z J. Dissection of QTLs for plant height and panicle length traits in rice under different environment[J].Scientia Agricultura Sinica, 2015, 48(3): 407-414.
[27] Liu R X, Zhang H, Zhao P, Zhang Z X, Liang W K, Tian Z G, Zheng Y L. Mining of candidate maize genes for nitrogen use efficiency by integrating gene expression and QTL data[J]. Plant Molecular Biology Reporter, 2012,30(2):297-308. doi:10.1007/s11105-011-0346-x.
[28] 高易宏,燕金香,涂政军,冷语佳,陈龙,黄李超,代丽萍,张光恒,朱丽,胡江,任德勇,郭龙彪,钱前,王丹英,曾大力. 不同氮处理下水稻剑叶叶宽的全基因组关联分析[J]. 中国农业科学,2017,50(14):2635-2646. doi:10.3864/j.issn.0578-1752.2017.14.001.
Gao Y H, Yan J X, Tu Z J, Leng Y J, Chen L, Huang L C, Dai L P, Zhang G H, Zhu L, Hu J, Ren D Y,Guo L B, Qian Q, Wang D Y, Zeng D L. Genome-wide association analysis on flag leaf width under different nitrogen levels in rice[J]. Scientia Agricultura Sinica, 2017, 50(14): 2635-2646.
[29] 吕海霞,周广生,丁泽红,孙永建,余四斌.水稻染色体片段代换系对氮反应的QTL分析[J]. 分子植物育种,2010,8(6):1074-1081. doi:10.3969/mpb.008.001074
Lü H X,Zhou G S, Ding Z H, Sun Y J, Yu S B. QTL Identification for nitrogen responses in rice chromosomal segment substitution lines[J]. Molecular Plant Breeding, 2010, 8(6): 1074-1081.
[30] Lian X M, Xing Y Z, Yan H, Xu C G, Li X H, Zhang Q F. QTL for low nitrogen tolerance at seedling stage identified using a recombinant inbred line population derived from an elite rice hybrid[J]. Theoretical and Applied Genetics, 2005, 112(1): 85-96. doi:10.1007/s00122-005-0108-y.
[31] An D G, Su J Y, Liu Q Y, Zhu Y G, Tong Y P, Li J M, Jing R L, Li B, Li Z S. Mapping QTL for nitrogen uptake in relation to the early growth of wheat(Triticum aestivum L.) [J]. Plant and Soil, 2006, 284(1-2):73-84. doi:10.1007/s11104-006-0030-3.
[32] 曾威,白建江,张才辉,杨瑞芳,方军,朴钟泽,石英尧. 水稻氮素利用效率相关性状的动态QTL分析[J]. 江苏农业科学,2016,44(4): 110-114.doi:10.15889/j.issn.1002-1302.2016.04.028.
Zen W, Bai J J, Zhang C H, Yang R F, Fang J, Pu Z Z, Shi Y R. Dynamic QTL analysis of nitrogen use efficiency related traits in rice(Oryza sativa L.) [J].Jiangsu Agricultural Sciences, 2016, 44(4): 110-114.
[33] 郭小蛟,张涛,蒋开锋,杨莉,曹应江,杨乾华,游书梅,万先齐,罗婧,李昭祥,高磊,郑家奎. 水稻籼粳交F8、F2群体穗长QTL 比较分析[J]. 中国农业科学,2013,46(23):4849-4857. doi:10.3864/j.issn.0578-1752.2013.23.001.
Guo X J, Zhang T, Jiang K F, Yang L, Cao Y J, Yang Q H, You S M, Wan X Q, Luo J, Li Z X, Gao L, Zheng J K. Comparison of panicle length QTL based on F2 and F8 populations derived from rice subspecies cross[J]. Scientia Agricultura Sinica, 2013, 46(23): 4849-4857.
[34] 赵建国,蒋开锋,杨莉,杨乾华,万先齐,曹应江,游书梅,罗婧,张涛,郑家奎. 水稻产量相关性状QTL定位[J]. 中国水稻科学,2013,27(4):344-352. doi:10.3969/j.issn.1001-7216.2013.04.002.
Zhao J G, Jiang K F, Yang L, Yang Q H, Wan X Q, Cao Y J, You S M, Luo Q, Zhang T,Zheng J K.QTL mapping for yield related components in a RIL population of rice[J].Chinese Journal of Rice Science, 2013, 27(4): 344-352.
