敖汉细毛羊是我国非常典型的一种细毛羊,它主要集中分布在我国的东北部一些地区。论羊毛品质,与其他羊的羊毛相比存在着相当大的优势[1]。毛囊的生长发育后期形成羊的被毛,对于羊毛的产量也是由毛囊的组织结构来控制的[2]。羊毛的粗细、生产量以及形状的变化离不开对毛囊的发育规律和结构特征的研究[3]。现在对成年绵羊以及出生后绵羊的毛囊研究已经相当成熟,Stenn等[4]在成年绵羊身上对毛囊的生长变化进行了研究,得到毛囊的生长呈现出周期性。柳楠等[5]在对敖汉细毛羊不同发育时期对毛囊生长发育的变化进行了研究,同时也对羊毛的粗细、长短等相关方面进行了研究。目前,对羊毛的研究主要聚焦在通过毛囊的发育来研究对羊毛的生成影响,很少通过研究控制这些性状的主要通路以及关键基因的作用,因此对基因以及通路的研究显得尤为重要。
BMPs蛋白具有分泌功能,不仅能使软骨和骨形态发生变化[6-7],还能够调控胚胎的发育,尤其是在皮肤附属物的形成和分化中均发挥了重要的作用[7]。许多研究报道,BMPs可以在多个组织器官中进行表达,有生殖器官像卵巢、前列腺等,还有皮肤及其衍生物等。尤其重要的是,BMPs可以对毛囊的发育进行调控,在调控的信号通路中每个信号分子都有着各自的不同,有些信号分子对毛囊表现出抑制作用有些则表现出促进作用[8-10]。前人对BMP4也有过相关的研究,毛青青等[11]通过小鼠的体内代谢对BMP4基因调控研究,从而初步的推断出BMP4是皮肤和毛囊发育中一个比较关键性的基因。依据信号通路的分类,BMP4也是TGF-β信号通路中的承前启后的关键基因[11],BMP4不仅促进smad5的表达同时也可以反作用于TGF通路中某些基因的表达,BMP4不仅仅是在BMP信号通路中进行调控相对应的上下游信号分子,还在TGF通路中控制调节一些信号,对生殖发育、细胞增殖、分化等起到关键性作用[7-12],因此研究此基因显得尤为重要。
目前,对BMP4基因与皮肤毛囊关系的研究主要集中在绒山羊和小鼠身上,且研究主要集中在分子水平上,还有一些是与皮肤毛囊无关的研究,像骨的调节、繁殖等,还未发现在细胞水平上来验证BMP4的功能。所以本研究通过对真核表达载体的构建以及转染成纤维细胞对BMP4基因的表达进行分析。结果显示,质粒构建成功且BMP4基因转染成纤维细胞后过表达。可为以后更深层次的研究提供坚实的基础。
1 材料和方法
1.1 试验材料
选取健康敖汉细毛羊的30日龄胎羊(由青岛畜牧所奥特种羊场提供)。
1.2 试剂及仪器
pcDNA3.1质粒、EcoRⅠ、KpnⅠ限制性内切酶等均购自青岛鑫宇恒一科技有限公司。Redbio CFX ConnectTM荧光定量PCR等均购自Bio-Rad[13]。
1.3 真核表达载体构建
1.3.1 设计引物 参考绵羊BMP4基因组(GenBank登录号为NM-001110277.1)CDS区序列进行上下游引物的设计,同时在上下游引物的5′端处加上EcoRⅠ、KpnⅠ酶切位点[13]。
上游引物:5′-CCGAATTTGGAAGTCCTAAAT GATCCTG-3′;下游引物:5′-CGGGGTACCGGCATCA GCCATCCCACATTC-3′。进行PCR扩增获得目的片段,扩增体系为:25 μL,分别为:cDNA 1 μL,上下游引物各1 μL,GreeMix 23 μL。
1.3.2 T克隆 PCR扩增结束之后对目的片段进行胶回收,后与pGM-T载体进行连接,连接体系:T4 DNA连接酶2 μL;T4 DNA连接酶Buffer 1 μL;pGM-T载体2 μL;目的片段5 μL;具体步骤见pGM-T克隆试剂盒。将pGM-T连接液转化DH5ɑ感受态细胞,摇菌,培养12 h后送生工公司测序[13-14]。
1.3.3 BMP4基因与pcDNA3.1连接 对重组pGM-T-BMP4及pcDNA3.1这2个载体均进行EcoR Ⅰ、KpnⅠ双酶切,酶切体系:EcoR Ⅰ1 μL;KpnⅠ1 μL;pGM-T-BMP4和pcDNA3.1 各4 μL;Buffer 1 μL ddH2O 39 μL;利用切胶回收试剂盒对BMP4基因和pcDNA3.1进行胶回收,回收以后对BMP4基因和pcDNA3.1进行连接,其体系:BMP4 5 μL,pcDNA3.1 3 μL,T4 DNA 1 μL、Buffer 1 μL,混匀后在22 ℃金属浴中加热2 h,再到16 ℃加热 3 h,后再进行转化摇菌,对获得的菌液利用PCR进行鉴定,对阳性组进行测序准确鉴定[13],并利用OZNA质粒提取试剂盒提取重组质粒[13-14]。
1.4 敖汉细毛羊成纤维细胞培养
取30日龄胎羊只留躯干将其处理成1.0~1.5 mm3大小,滴利用胎牛血清进行培养(37 ℃,5.0% CO2)。24 h后需要换培养液,并对细胞的形态进行观察。当细胞密度大约在95%时需要对细胞进行传代培养,按照1∶3比例进行,传代后继续对细胞进行培养等待后续的传代[14-15]。
1.5 细胞瞬时转染
用Lipofectamine2000对细胞进行瞬时转染,需要脂质体20 μL,不含双抗的培养液480 μL,超净台内放置5 min对脂质体进行孵育。后进行转染,转染的体系为pcDNA3.1-BMP4 40 μL,DMEM(不含双抗)460 μL,对照组中不含重组表达载体,37 ℃继续培养。
1.6 转染细胞的mRNA检测
对转染成功的成纤维细胞进行BMP4基因mRNA的定量检测,利用TRIzol(Roche)对培养皿中的细胞进行裂解,提取细胞中的RNA并对浓度、纯度进行检测[13],后反转录成cDNA。利用敖汉细毛羊BMP4和内参基因GAPDH的序列,设计BMP4和GAPDH的RT-PCR引物序列如表1所示。
表1 引物信息
Tab.1 Primers information

基因Gene引物序列 (5′→3′)Primer sequence引物大小/bpPrimer size退火温度/℃Annealing temperatureBMP4F:GTGTTGGACTGGAATGCATGTC11558R:GCTTGCTTCAGGAGTGCTGCTCGGAPDH F:ATGTGCTAGCGTACAGTCA12860R:AGCACATACACTCGACCACG
实时荧光定量PCR程序按照实验室已设定好的模式,退火温度为58 ℃。样品需要进行3次生物学重复,采用Ct(2-ΔΔCt)值法计算BMP4基因mRNA的相对表达量。利用SPSS 19.0对数据进行差异显著性分析,结果以P<0.01作为差异极显著性判断标准[16]。
1.7 Western Blotting检测BMP4基因蛋白表达
首先对细胞中的蛋白进行提取,制作胶块进行点样,用β-actin作为内参对照,220 V进行电泳。后对电泳的蛋白进行转膜,转膜后对蛋白用5% BSA 2 h进行封闭;对蛋白进行封闭之后用一抗二抗进行孵育,一抗按照1∶2 000比例稀释,4 ℃孵育12 h;山羊抗兔的二抗按相同的比例稀释,在摇床上均匀孵育1.5 h;后利用1∶1比例的曝光液在暗室中进行曝光上机拍照。用ImageJ 对所得蛋白条带进行灰度值分析,对灰度值进行t检验[17]。
2 结果与分析
2.1 BMP4目的片段扩增
用cDNA做模板进行普通PCR,来扩增获得BMP4目的基因片段。用电泳鉴定其结果如图1所示,电泳跑出的条带明亮无杂带,且产物大小为1 230 bp左右,与已知的目的基因片段长度相同,胶回收明亮条带用于后续的试验。
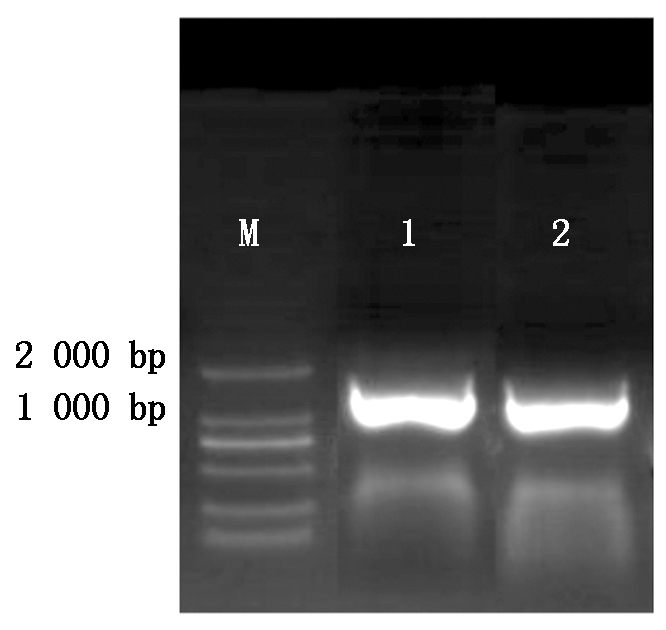
M.2000 Marker;1-2.BMP4基因扩增条带(1 230 bp)。 M.2000 Marker;1-2.BMP4 gene amplification bands(1 230 bp).
图1 BMP4基因PCR扩增
Fig.1 BMP4 target gene amplification
2.2 pGM-T-BMP4测序鉴定
对胶回收获得的BMP4目的片段与pGM-T载体连接之后转至DH5α中,摇菌使细菌进行大量复制,同时获得大量BMP4-pGM-T载体,将获得的BMP4-pGM-T用DNAMAN将测序结果与BMP4的已知CDS区进行比对,比对发现没有碱基发生突变,与参考的序列完全一致(图2),可继续下一步的表达载体的构建。

图2 TA克隆测序对比鉴定
Fig.2 Cloning sequencing comparison identification
2.3 pGM-T-BMP4的电泳鉴定及提取
将构建好的pGM-T-BMP4利用去内毒素质粒提取试剂盒提取出来,并进行电泳检测(图3),已知BMP4片段大小为1 230 bp,pGM-T载体序列大小为3 489 bp,连接相加为4 719 bp。图上的条带位置在4 719 bp左右,与已知大小相符合,结果证明pGM-T-BMP4连接提取成功,可用于后续的酶切试验。
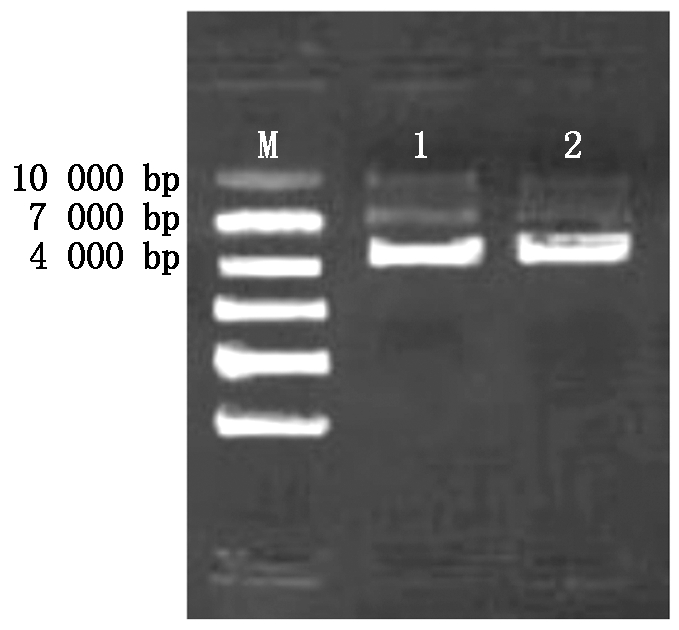
M.10000 Marker;1-2.克隆载体提取后电泳产物(4 719 bp). M.10000 Marker;1-2.Electrophoresis products were extracted from cloned vectors(4 719 bp).
图3 克隆载体的鉴定PCR扩增
Fig.3 Identification of cloning vectors-PCR amplification
2.4 pGM-T-BMP4及pcDNA3.1载体双酶切
对pGM-T-BMP4和pcDNA3.1载体分别进行双酶切。切成三部分分别为:BMP4目的基因、pGM-T直链、pcDNA3.1直链,对BMP4目的基因和pcDNA3.1直链进行胶回收。结果如图4所示,1-2:对pGM-T-BMP4的EcoRⅠ、KpnⅠ双酶切,下部为BMP4,位置大约在1 230 bp处,上部是pGM-T载体位置大约在3 489 bp处,与已知序列的大小相符合。3-4:对pcDNA3.1的双酶切,位置大约在5 428 bp处,与已知质粒序列大小相符合。因此,1-4可进行BMP4与pcDNA3.1的连接。
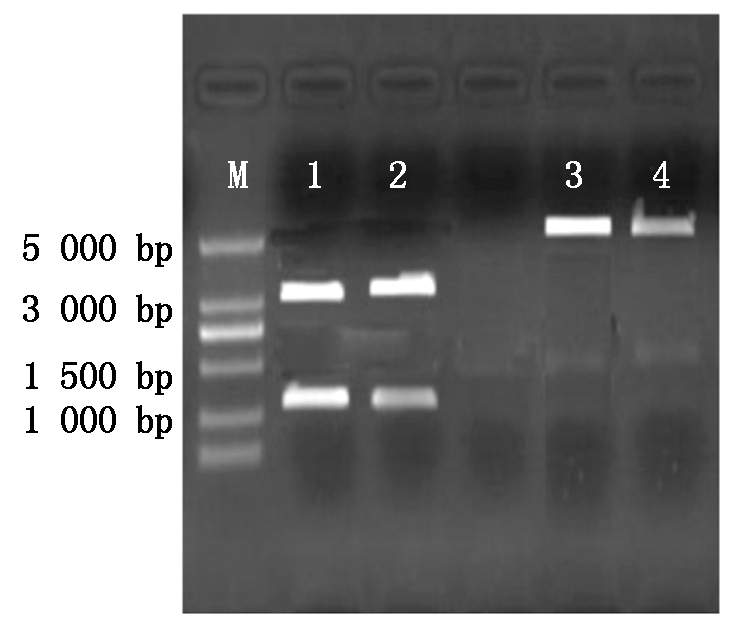
M.5000 Marker;1-2.克隆载体EcoR Ⅰ、KpnⅠ双酶切; 3-4.pcDNA3.1载体EcoR Ⅰ、KpnⅠ双酶切。 M.5000 Marker;1-2.Cloning vector EcoR Ⅰ,Kpn Ⅰ double digests ; 3-4.pcDNA3.1 vector EcoR Ⅰ,Kpn Ⅰdouble digests.
图4 克隆载体及pcDNA3.1载体双酶切
Fig.4 Cloning vector and pcDNA3.1 vector double digestion
2.5 重组pcDNA3.1-BMP4的构建及鉴定
对胶回收的BMP4目的基因和直链pcDNA3.1进行连接,后进行转化摇菌使重组质粒大量复制,进行菌液PCR鉴定,如图5所示图中单一明亮的条带大约在1 230 bp处,与已知目的基因序列大小相符合,鉴定得到BMP4与pcDNA3.1连接成功。
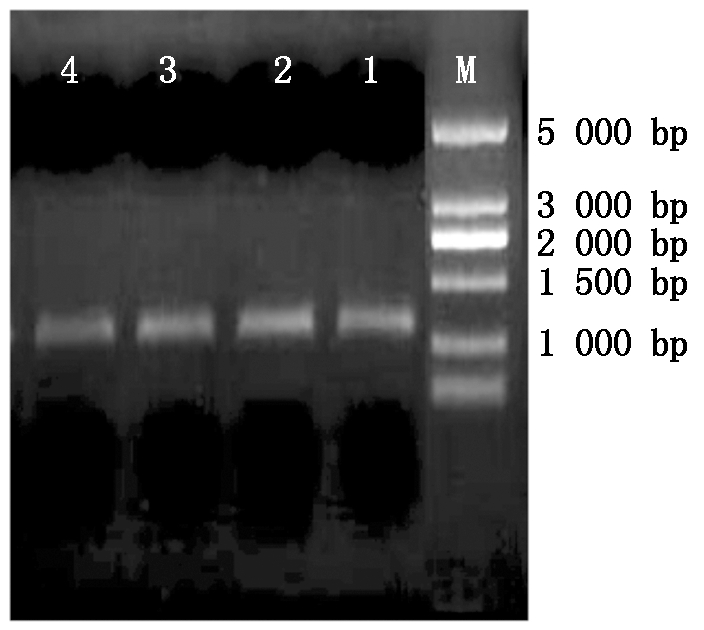
M.5000 Marker;1-4.菌液PCR。 M.5000 Marker;1-4.Bacteria solution PCR.
图5 表达载体pcDNA3.1的鉴定PCR扩增
Fig.5 Identification of the expression vector pcDNA3.1 by PCR amplification

图6 表达载体菌液的测序比对
Fig.6 Sequencing alignment of expression vector bacterial solution
2.6 pcDNA3.1-BMP4菌液测序鉴定
对pcDNA3.1-BMP4菌液进行碱基序列的测序,测序的结果用和已知的BMP4基因的序列进行比对(图6),BMP4构建到pcDNA3.1上后碱基没有发生任何突变,并且在pcDNA3.1上能够稳定的存在。说明BMP4成功连接到了pcDNA3.1载体中,可进行下一步的转染。
2.7 细胞观察
2.7.1 原代细胞观察 对原代细胞的生长情况进行观察,成纤维细胞大约在24 h时开始贴壁,可以观察到细胞从组织块的周围开始游出,形状上表现为圆形、梭形,同时也可以用肉眼观察到许多游离的组织。培养至第4天,培养皿的底部细胞达到了约95%,此时即可对细胞进行传代(图7)。

图7 成纤维细胞原代培养(×100)
Fig.7 Primary culture of fibroblasts(×100)
2.7.2 传代细胞观察 当细胞密度达到95%左右时对细胞进行传代,经过3次的传代后培养皿中的细胞只剩成纤维细胞。从生长速度来看传代后细胞的生长速度先是比较缓慢,大约在12 h后生长速度会明显加快(图8)。
2.8 RT-PCR检测BMP4基因mRNA的表达
首先对RT-PCR的引物进行验证,PCR扩增之后进行电泳,电泳结果如图9所示,结果表明,荧光定量的引物扩增出的目的条带明亮无杂带,GAPDH扩增产物大约在128 bp处,BMP4扩增产物大约在112 bp处,与已知的GAPDH、BMP4序列大小一致,因此设计的荧光定量引物可用于BMP4基因mRNA的定量。
图8 成纤维细胞传代培养(×100)
Fig.8 Fibroblast subculture(×100)
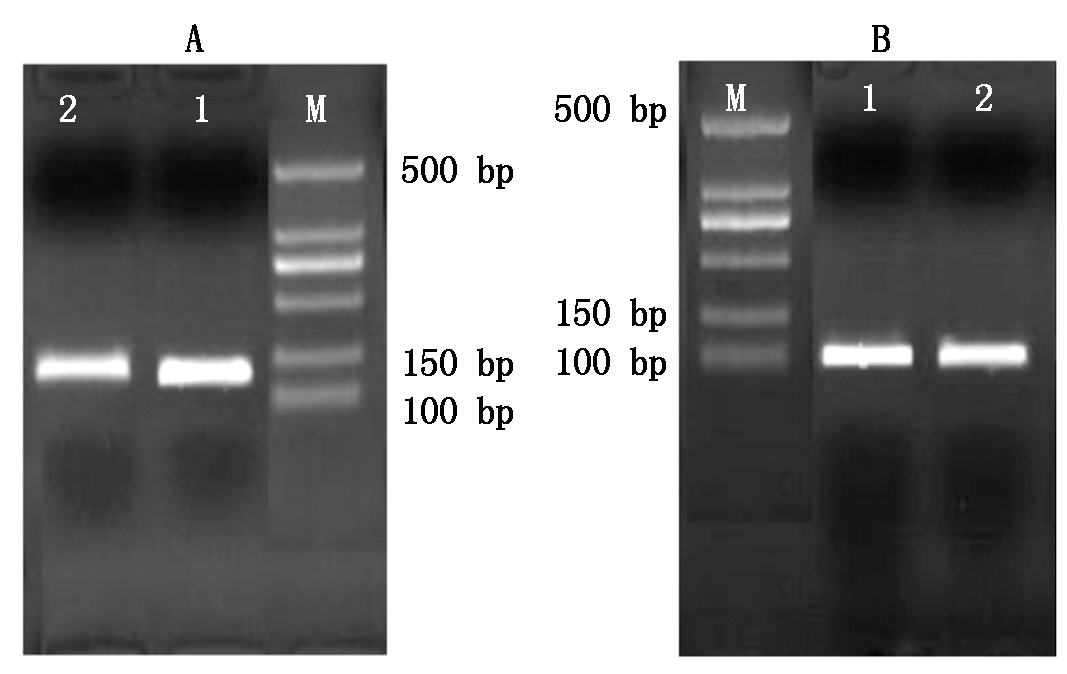
M.500 Marker;1-2.内参基因GAPDH扩增条带(A); M.500 Marker;1-2.目的基因BMP4扩增条带(B)。 M.500 Marker;1-2.Reference genes GAPDH(A); M.500 Marker;1-2.Desired gene BMP4 amplification bands(B).
图9 内参基因GAPDH(A)目的基因BMP4扩增产物(B)
Fig.9 Internal reference gene GAPDH (A) target gene BMP4 amplification product(B)
图10是目的基因BMP4和内参基因GAPDH的扩增曲线、熔解曲线,曲线集中,有且只有一个峰值,此结果可以表明在进行荧光定量PCR时设计的荧光定量引物特异性很高,能够扩增得到特定的目的片段。对转染的细胞和未进行转染的细胞mRNA表达量数据进行分析,可以得到BMP4基因经过表达载体构建转染成纤维细胞后mRNA表达量明显升高,且与未转染的对照组之间表现出极显著差异(P<0.01)(图11)。

图10 BMP4和GAPDH溶解曲线峰值图(A)和扩增曲线图(B)
Fig.10 BMP4 and GAPDH dissolution curve peak map(A) and amplification curve(B)
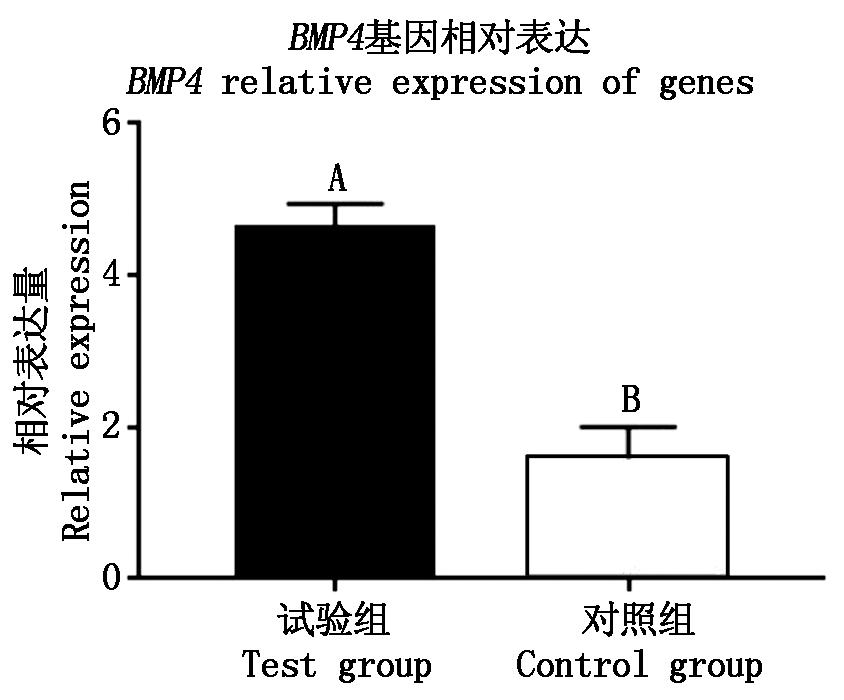
不同大写字母表示差异极显著(P<0.01)。图13同。 The different capital letters indicate that the difference is extremely significant(P<0.01).The same as Fig.13.
图11 BMP4基因mRNA相对表达量
Fig.11 Relative expression of BMP4 gene mRNA
2.9 BMP4基因蛋白表达的检测
对BMP4基因表达的蛋白进行Western Blot验证,试验结果显示,经过表达载体构建且转染后的成纤维细胞中BMP4基因蛋白条带要明显亮于未进行转染的对照组(图12),利用ImageJ对蛋白条带进行分析后对得到的数据进行差异显著性分析,分析得试验组BMP4基因蛋白表达量极显著高于对照组(图13)(P<0.01)。
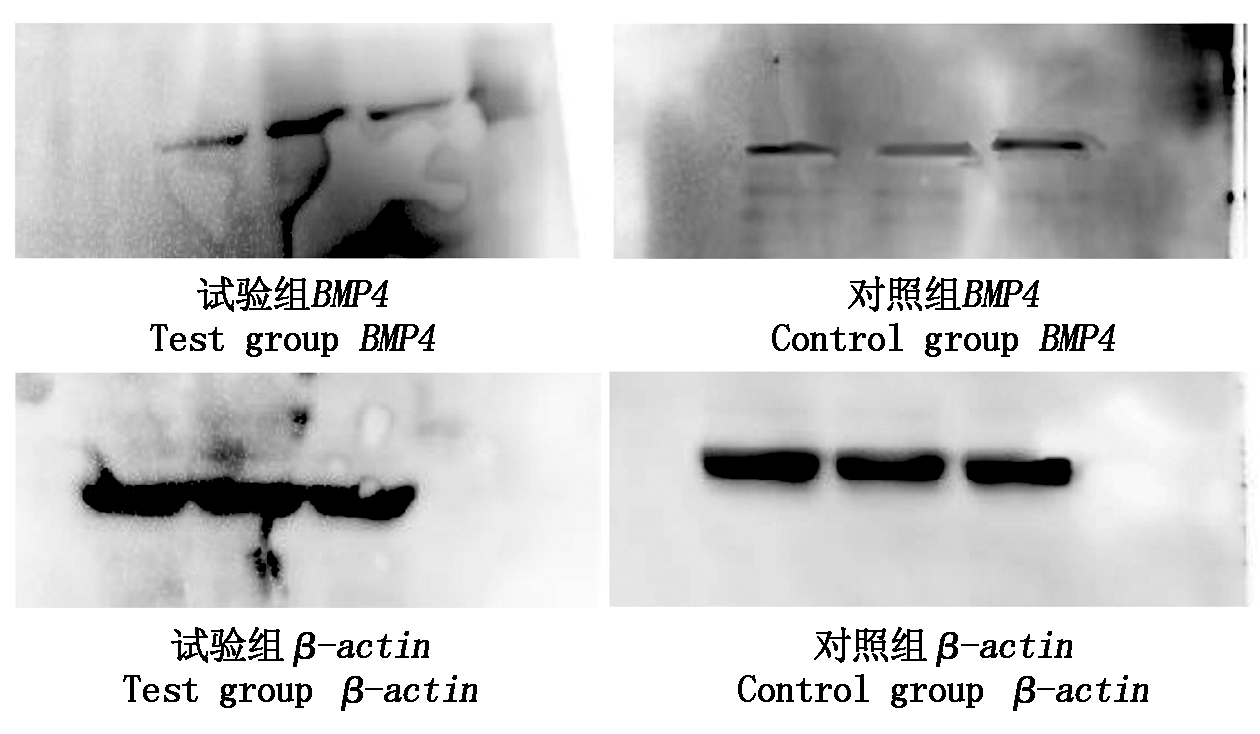
图12 BMP4基因表达蛋白条带
Fig.12 BMP4 gene expression protein band
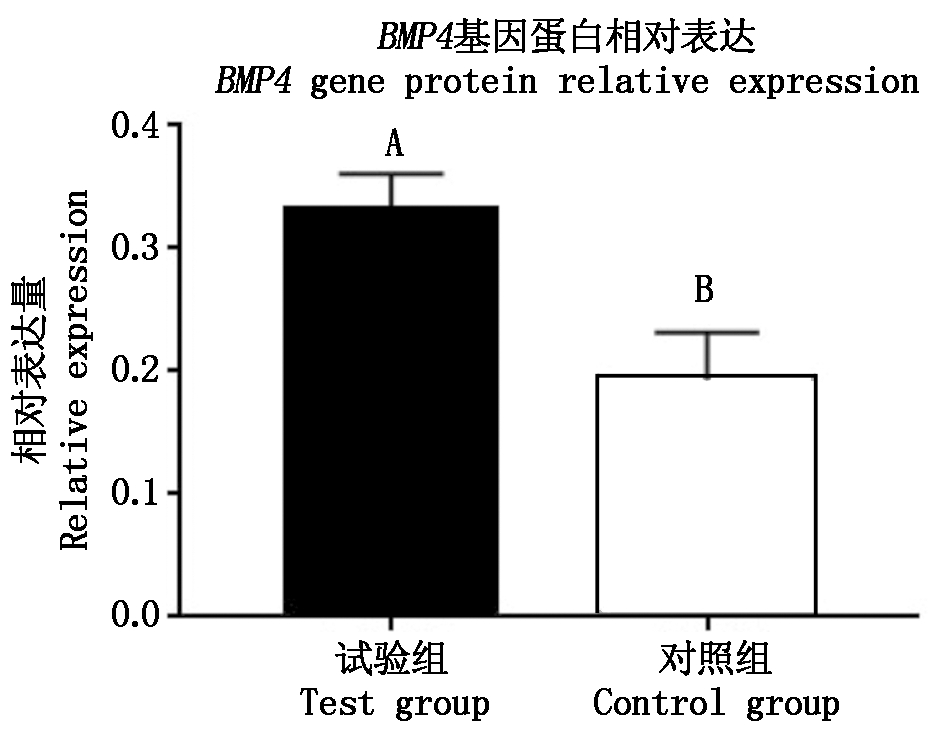
图13 BMP4基因蛋白相对表达量
Fig.13 BMP4 gene protein relative expression
3 讨论与结论
目前有很多的基因和转录因子在毛囊发育的过程中扮演着重要的角色,其中有Wnt通路[18-19]、TGF-β超家族[20-21]通路、各类生长因子[22]、BMPs及其受体[23]等。前人已有研究表明,BMP4基因是影响毛囊发育的一个关键性基因。有研究结果表明[11],利用小鼠来研究BMP4基因可以在小鼠的毛囊形成时期以及出生后毛囊周期循环过程均有明显的表达[24],利用BMP4的正常表达可以进一步验证了之前的推断。同时利用基因敲除技术对BMP4基因的受体进行特异性的敲除来研究外部毛发的形态是否发生了改变间接的去证明BMP4在毛囊发育过程中的重要作用[25]。因此,目前在小鼠、山羊等身上研究BMP4与毛囊发育之间的关系时,都是通过质粒的构建或者敲除BMP4基因来间接分析该基因在毛囊发育中的作用[26]。有原位杂交试验结果发现,BMP4基因在内蒙古绒山羊的表达和BMP2基因表达方向一致,均是在休止期的皮肤中高表达[27],从而在皮肤毛囊发育中处于休止期时起到了关键性作用。通过在小鼠、山羊等身上的研究初步推断,BMP4基因在敖汉细毛羊身上也可能参与毛囊发育,并且对毛囊的发育起到抑制作用。
本研究选择成纤维细胞作为研究工具的原因在于成纤维细胞生长力、活力都比较强,容易获得,有利于瞬时转染。目前,没有通过载体的构建对BMP4 基因功能进行验证的相关报道,本试验很好地起到补充作用。本研究主要是通过比较成熟的载体构建技术对BMP4 基因进行了载体的构建并将其转染到成纤维细胞中,之后对此基因在mRNA水平上和蛋白水平进行定量定性分析,为下一步个体水平的研究提供基础。同时经过转染后的BMP4基因,mRNA达量明显的升高, 通过NCBI上查阅到BMP4表达的蛋白大小为45 ku,利用WB进行了验证对比,结果一致。经过显色曝光后,肉眼初步可以判断到试验组蛋白条带明显比空白对照组的条带明显的黑、宽且。用ImageJ分析灰度值,试验组的蛋白相对表达灰度值明显高于对照组。这从蛋白水平上对BMP4基因进行了验证。对BMP4基因进功能验证不仅仅是对此基因的研究同时也会帮助此信号通路中其他基因的研究,BMP4基因过表达,可能会影响它直接控制受体、smad类等因子。相反,BMP4基因表达被抑制,也会引起一系列的连锁反应。对BMP4基因功能进行验证也为以后的个体水平上的研究提供了一定的参考,极大希望的解决绵羊羊毛生长的问题。
通过对BMP4基因表达载体的构建以及对基因mRNA和蛋白水平的检测得出BMP4基因过表达,mRNA表达量和蛋白的表达量极显著高于对照组,为进一步研究此基因的功能奠定了基础。
[1] 柳楠,王春亮,贺建宁,程明,刘开东,刘积凤,赵金山.敖汉细毛羊不同部位皮肤毛囊发育及形态结构研究[J].中国畜牧杂志,2015,51(17):1-5.doi:10.3969/j.issn.0258-7033.2015.17.001.
Liu N, Wang C L, He J N, Cheng M, Liu K D, Liu J F, Zhao J S. Study on skin hair follicle development and morphological of different boby parts of AoHan fine wool sheep[J].Chin J Anim Sci,2015,51(17):1-5.
[2] Hardy M H, Lyne A G. The pre-natal development of wool follicles in Merino sheep[J]. Division Anim Health Prod, 1956, 9(3): 423-441.doi:10.1071/BI9560423.
[3] 吴瑜瑜,岳耀敬,郭婷婷,王天翔,郭健,李桂英,韩吉龙,杨敏,刘建斌,孙晓萍,李范文,何玉琴,杨博辉.中国超细毛羊(甘肃型)胎儿皮肤毛囊发育及其形态结构[J].中国农业科学,2013, 46(9): 1923-1931.doi:10.3864/j.issn.0578-1752.2013.09.020.
Wu Y Y, Yue Y J, Guo T T, Wang T X, Guo J, Li G Y, Han J L, Yang M, Liu J B, Sun X P, Li F W, He Y Q, Yang B H.Study on fetal skin hair follicle development and morphological of China super-fine merino(Gansu type)[J].Scientia Agricultura Sinica,2013, 46(9): 1923-1931.
[4] Stenn K S, Paus R. Controls of hair follicle cycling[J]. Physiol Rev, 2001, 81(1): 449-494.doi:10.1152/physrev.2001.81.1.449.
[5] 柳楠,卜然,贺建宁,程明,刘开东,刘积凤,赵金山. Hox基因家族对细毛羊羊毛性状影响的研究[J]. 中国畜牧杂志,2014, 50(23): 6-10.doi:10.3969/j.issn.0258-7033.2014.23.002.
Liu N, Pu R, He J N, Cheng M, Liu K D, Liu J F, Zhao J S.Effect of Hox gene family on wool traits of Fine-wool sheep[J].Chin J Anim Sci,2014, 50(23): 6-10.
[6] Stenn K S. Molecular in sights into the hair follicle and its pathology: A review of recent developments[J].International Journal of Dermatology,2013,42(3):40-43.doi:10.1046/j.1365-4362.2003.01726.x.
[7] 李荣.内蒙古绒山羊BMP4、BMPR1B 基因cDNA的克隆及 BMPR1B在皮肤毛囊中的表达[D]. 呼和浩特:内蒙古农业大学,2007.
Li R.Cloning of BMP4 and BMPR1B gene cDNA from Inner Mongolia cashmere goat and expression of BMPR1B in skin hair follicle[D]. Hohhot: Inner Mongolia Agricultural University, 2007.
[8] Halloy J, Bernard B A, Loussouarn G, Goldbeter A. Modeling the dynamics of human hair cycles by a follicular automaton [J]. Biophysics, 2000, 97(15): 8328-8333.doi:10.1073/pnas.97.15.8328.
[9] Van Exan R J, Hardy M H. A spatial relationship between innervation and the early differentiation of vibrissa folicles in the embryonic mouse[J]. Journal of Anatomy, 1981, 131(4): 643-656.
[10] 吴江鸿,张文广,李金泉,闫祖威.内蒙古绒山羊毛囊发育不同时期皮肤中BMP4基因的表达[J]. 黑龙江畜牧兽医, 2009, 23(12): 35-36. doi:10.3969/j.issn.1004-7034.2009.12.015.
Wu J H, Zhang W G, Li J Q,Yan Z W.Expression of BMP4 gene in skin of different stages of fluffy hair follicle development in Inner Mongolia[J].Heilongjiang Animal Science and Veterinary Medicin, 2009, 23(12): 35-36.
[11] 毛青青,代蓉,沈思军,郭洪,万鹏程,周平,石国庆.BMP4对小鼠毛囊数量的影响[J]. 西北农业学报, 2012, 21(5):13-17.doi:10.3969/j.issn.1004-1389.2012.05.003.
Mao Q Q, Dai R,Shen S J, Guo H, Wan P C, Zhou P, Shi G Q. Influence of BMP4 on of hair follicles quantiy of mice[J].Acta Agriculturae Boreali-occidentalis Sinica, 2012, 21(5):13-17.
[12] 陈晓军, 钟发刚, 罗淑萍,王新华.多浪羊BMPR-1B基因多态性的初步研究[J]. 新疆农业科学,2004, 41(1): 6-9.doi:10.3969/j.issn.1001-4330.2004.01.002.
Chen X J, Zhong F G, Luo S P, Wang X H. The primary studies on polymorphism of BMPR-1B Gene of Duolang sheep[J].Xinjiang Agricultural Sciences,2004, 41(1): 6-9.
[13] 张梦瑶,杨峰,刘开东,刘积凤,柳楠,贺建宁.敖汉细毛羊Hoxa5基因重组质粒的构建及其在成纤维细胞中表达量的研究[J].中国兽医杂志,2018,54(10):25-29,35.
Zhang M Y, Yang F, Liu K D, Liu J F, Liu N, He J N.Construction of Hoxa5 gene recombinant plasmid and its expression in fibroblasts[J].Chinese Journal of Veterinary Medicine,2018,54(10):25-29,35.
[14] 张梦瑶,杨峰,刘开东,程明,王国义,刘积凤,柳楠,贺建宁.敖汉细毛羊DKK1基因重组质粒的构建及其在成纤维细胞中表达量的研究[J].中国畜牧兽医,2018,45(1):131-139.
Zhang M Y, Yang F, Liu K D, Cheng M, Wang G Y, Liu J F, Liu N, He J N.Construction of recombinant plasmid of DKK1 gene from shuhan fine wool sheep and its expression in fibroblasts[J].China Animal Husbandry and Veterinary Medicine,2018,45(1):131-139.
[15] 周建大. 原代成体皮肤角质形成细胞、成纤维细胞的培养和转基因研究[D].长沙:中南大学,2004.
Zhou J D.Culture and transgenic study of primary adult keratinocytes and fibroblasts[D].Changsha:Central South University,2004.
[16] 张梦瑶,杨峰,刘开东,刘积凤,贺建宁,柳楠.利用同源重组技术构建DKK1/BMP4真核表达载体及共转染成纤维细胞表达的研究[J].华北农学报,2018,33(5):117-124.doi:10.7668/hbnxb.2018.05.017.
Zhang M Y, Yang F, Liu K D, Liu J F, He J N, Liu N.Construction of eukaryotic expression vector of DKK1/BMP4 gene by homologous recombination and its expression fibroblasts[J].Acta Agriculturae Boreali-Sinica, 2018,33(5):117-124.
[17] 王小佳,贺建宁,程明,刘开东,柳楠.BMP4基因在细毛羊肩部皮肤的表达及其与毛囊密度的关联分析[J].黑龙江畜牧兽医,2016(10):95-98,293.
Wang X J, He J N, Cheng M, Liu K D, Liu N. Association analysis between BMP4 gene expression in the shoulder skin of fine wool sheep and the hair follicle density[J].Heilongjiang Animal Science and Veterinary Medicin, 2016(10):95-98,293.
[18] Millar S E, Willert K, Salinas P C, Roelink H, Nuss R, Sussman D J, Barsh G S. WNT signaling in the control of hair growth and structure[J]. Developmental Biology,1999,207(1):133-149. doi:10.1006/dbio.1998.9140.
[19] Bazzi H, Fantauzzo K A, Richardson G D, Jahoda C A B, Christiano A M. The Wnt inhibitor, Dickkopf 4, is induced by canonical Wnt signaling during ectodermal appendage morphogenesis[J]. Developmental Biology,2007,305(2):498-507.doi:10.1016/j.ydbio.2007.02.035.
[20] Klopcic B, Maass T, Meyer E, Lehr H A, Metzger D, Chambon P, Mann A, Blessing M. TGF-β superfamily signaling is essential for tooth and hair morphogenesis and differentiation[J]. European Journal of Cell Biology,2007,86(11-12):781-799. doi:10.1016/j.ejcb.2007.03.005.
[21] Li A G, Koster M I, Wang X J. Roles of TGFβ signaling in epidermal/appendage development[J]. Cytokine and Growth Factor Reviews,2003,14(2): 99-111.doi:10.1016/s1359-6101(03)00005-4.
[22] Richardson G D,Bazzi H,Fantauzzo K A,Waters J M,Crawford H,Hynd P,Christiano A M,Jahoda C A B. KGF and EGF signalling block hair follicle induction and promote interfollicular epidermal fate in developing mouse skin[J]. Development(Cambridge),2009,136(13): 2153-2164. doi:10.1242/dev.031427.
[23] Fliniaux I, Mikkola M J, Lefebvre S, Thesleff I. Identification of dkk4 as a target of Eda-A1/Edar pathway reveals an unexpected role of ectodysplasin as inhibitor of Wnt signalling in ectodermal placodes[J]. Developmental Biology,2008,320(1) :60-71.doi:10.1016/j.ydbio.2008.04.023.
[24] Botchkarev V A,Botchkareva N V,Sharov A A,Gilchrest B A,Funa K,Huber O. Modulation of BMP signaling by noggin is required for induction of the secondary(nontylotrich) hair follicles[J]. Journal of Investigative Dermatology,2002,118(1):3-10.doi:10.1046/j.1523-1747.2002.01645.x.
[25] Andl T,Ahn K,Kairo A,Chu E Y,Wine-Lee L,Reddy S T,Croft Nirvana J,Cebra-Thomas J A,Metzger D,Chambon P,Lyons K M,Mishina Y,Seykora J T,Crenshaw E B,Millar S E. Epithelial Bmpr1a regulates differentiation and proliferation in postnatal hair follicles and is essential for tooth development[J]. Development,2004,131(10):2257-2268. doi:10.1242/dev.01125.
[26] Van E R J,Hardy M H. A spatial relationship between innervation and the early differentiation of vibrissa follicles in the embryonic mouse[J]. Journal of Anatomy,1980,131(Pt4): 643-656.doi:10.1007/BF00301823.
[27] 苏蕊,李金泉,张文广,尹俊,赵珺,常子丽.骨形态发生蛋白2(BMP2)基因在内蒙古绒山羊不同时期皮肤毛囊中的表达[J].中国农业科学,2008,41(2):559-563. doi:10.3864/j.issn.0578-1752.2008.02.033.
Su R, Li J Q, Zhang W G, Yi J, Zhao J, Chang Z L. The expression of BMP2 in the skin and hair follicles from different stage in Inner Mongolian cashmere goats[J].Scientia Agricultura Sinica,2008,41(2): 559-563.
