碳水化合物对糖蛋白和糖脂的修饰涉及多种生物学过程,包括蛋白质稳定性的维持、细胞识别、信号传导、免疫应答等重要过程。碳水化合物在个体间及物种间修饰的差异,产生了一种免疫自我识别的机制[1]。异种器官移植过程中所产生的一系列免疫排斥反应便与这种免疫自我识别机制密切相关。例如人类和其他灵长类动物不产生α-1,3-galactose(αGal)这种末端半乳糖的寡糖,而其他哺乳动物却可合成末端αGal多糖,当猪到灵长类动物异种器官移植时,灵长类动物受体会开启免疫自我识别而产生高水平的抗Gal抗体,这是主要的异种器官移植的免疫屏障[2-4]。Sda(Sid)抗原是一种与任何其他已知血型系统无关的新抗原,Sda抗原的免疫显性聚糖为N-乙酰-D-半乳糖胺(GalNAc),是一种潜在的异种抗原,在抗体介导的排斥反应中起重要作用[5]。Byrne等[6-7]在猪到非人灵长类动物器官移植的探索时发现,非人灵长类动物异种移植后产生的抗体是针对一系列猪内皮细胞蛋白质和由猪B4GALNT2基因产生的聚糖[8],而β1,4GalNAcT-Ⅱ在异种移植中可能参与抗体依赖性排斥反应,揭示β1,4GalNAcT-Ⅱ是一种诱导非人灵长类动物受体产生排斥反应的非Gal抗原[5,9]。
B4GALNT2属于N-乙酰氨基半乳糖转移酶(N-acetylgalactosaminyltransferases,GalNAc-Tases)家族,该家族是一类非常重要的催化氧糖基化的初始酶,主要负责将供体二磷酸尿苷N-乙酰半乳糖胺(UDP-GalNAc)上的GalNAc基团转移至受体蛋白,与多肽链特定序列中的Ser或Thr羟基结合,从而构成O-聚糖[10]。目前已知该家族至少有14个成员,分别为GalNAc-T1-T14,各酶在多种组织中的分布和表达不同,功能也不尽相同。在对Sda抗原合成的研究中发现,该家族成员B4GALNT2是催化合成Sda抗原的关键酶,可催化N-乙酰半乳糖胺的末端添加到唾液酸修饰的半乳糖胺进而形成Sda血型抗原(GalNAcβ4[Neu5Acα2,3]Galβ4GlcNAcβ3Gal)[11]。有研究认为,通过免疫抑制可显著影响诱导抗体应答的T细胞水平,从而降低T细胞依赖性和特异性,这对研究缺乏多种异种糖基合成的供体猪具有很大的前景[9]。
长期以来,ABH血型抗原在个体间表达的差异是难以进行输血以及异种器官移植的主要原因。不表达特定ABH抗原的个体会受到肠道菌群的刺激,产生针对该聚糖的抗体,这种预先形成的抗体可诱导溶血反应,也可促进与ABH血型不相容的移植物的超急性排斥反应或者加速同种异体移植物的排斥反应[1]。Sda血型抗原与ABH血型抗原都属于一类糖蛋白,两者作用机制相似,Sda血型抗原并不只特定存在于红细胞表面,还存在于移植肝的血管和肝窦的内皮细胞表面以及胆管上皮细胞表面。对猪B4GALNT2基因座的基因工程实验证实了非人灵长类动物和人类抗体对B4GALNT2抗原具有依赖性,虽然Sda血型对输血没有显著的排斥风险,但非人灵长类动物中观察到的诱导抗体应答以及癌症疫苗接种研究的结果表明,猪血管内皮细胞中B4GALNT2的表达可能对人类具有免疫原性[12]。
近交系动物不仅遗传背景相似,还具有遗传一致性和反应均一性等特点[13],经基因改造后与人类的组织可具有较大的生物相容性[14]。BMI是遗传背景清楚且基因高度纯合的大型哺乳类动物近交系,其在异种器官移植方面具有重要的研究和应用价值[15-19]。本试验克隆了免疫排斥相关基因B4GALNT2并研究了其在BMI中的mRNA和蛋白表达情况,利用生物信息学方法分析了其编码的蛋白质的基本结构和功能特征,为进一步探索B4GALNT2在猪-人异种器官移植中的作用机制提供了试验依据。
1 材料和方法
1.1 试验材料和主要试剂
屠宰3只BMI,耳号为413、417和0847(昆明原种猪场),对15个重要组织进行采样,得到的(心、肝、脾、肺、肾、皮肤、回肠、盲肠、大脑、脊髓、淋巴结、扁桃体、肾上腺、甲状腺、颌下腺)样品速冻于液氮,后置于-80 ℃超低温冰箱保存。从北京宝日医生物技术公司购置M-MLV逆转录酶、Ex Taq酶、SYBR®Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)荧光定量试剂、pMD18-T载体,以及β-Tubulin(2H4):鼠一抗(艾比玛特生物医药公司,上海),β-1,4-GalNAc-T2(Q-12)鼠一抗(Sauta Cruz公司,美国),羊抗鼠二抗(KPL公司,美国)等试剂。
1.2 总RNA提取和第一链cDNA合成
分别从BMI 15个组织中提取总RNA,经BioPhotometer核酸蛋白仪测定并电泳鉴定合格的RNA反转录为cDNA第一链,参考GenBank猪B4GALNT2 mRNA序列(AY271355),利用Premier 6.0和Oligo 7软件设计3对特异引物,引物的名称和序列、产物序列长、作用等信息见表1。
表1 引物列表
Tab.1 List of primers

名称Name序列(5′-3′)Sequences产物序列长/bpLength of product sequence作用RoleB4GALNT2-F1GCGGGATTAAGGATGACTTCGT1 773序列克隆B4GALNT2-R1GATGGAAACACCGCCGTAAB4GALNT2-F2ACTACCCAGACCTGACGGTGAT167荧光定量B4GALNT2-R2ATCGTCCACCCAGAGCACATATTGAPDH-FCCTTCATTGACCTCCACTACATGGT183内参基因GAPDH-RCCACAACATACGTAGCACCAGCATC
1.3 PCR扩增及基因克隆
使用引物 F1/R1(表1),cDNA为模板,进行PCR。PCR扩增体系25 μL:ddH2O 5.75 μL、2×GC Buffer Ⅰ 12.5 μL、dNTPs(2.5 mmol/L)4 μL、引物 F/R(10 μmol/L)各0.5 μL、模板(50 ng/μL) 1.5 μL、Ex Taq酶(5 U/μL) 0.25 μL。PCR运行条件设置:预变性(94 ℃,5 min);变性(94 ℃,30 s),退火(56 ℃,40 s),延伸(72 ℃,2 min),35次循环;后延伸(72 ℃,10 min)。电泳检测扩增产物合格后,将目的条带回收纯化,连接克隆载体pMD18-T,转化、复苏、培养,挑取阳性单菌落,菌液PCR及测序鉴定。
1.4 多组织mRNA荧光表达谱检测
选取GAPDH基因作为内参进行对照,使用引物F2/R2和GAPDH-F/GAPDH-R(表1)通过qPCR分析15个组织中B4GALNT2基因的mRNA水平。扩增体系20 μL:无RNAase ddH2O 6.4 μL、2×SYBR Green 10 μL、引物 F2/R2(10 μmol/L)各0.8 μL、cDNA模板 2 μL。运行程序:预变性(95 ℃,2 min);变性(95 ℃,15 s),退火(60 ℃,15 s),延伸(72 ℃,20 s),40次循环;采集荧光信号20 min。每个样本重复3次,设置NTC,采用2-ΔΔCt法分析数据结果。
1.5 B4GALNT2蛋白Western Blotting分析
制备15种组织的蛋白样品,以β-tubulin(54 ku)为内参蛋白进行Western Blotting分析。蛋白样品浓度测定后,经过SDS-PAGE电泳、转膜、暗室曝光和胶片处理等一系列蛋白免疫印迹试验流程,得到最终试验结果。
1.6 生物信息学分析
关于B4GALNT2蛋白质的分子质量(Mw)和等电点(pI)等理化特征的预测,以及CDS预测、蛋白序列推导等均通过在线软件DNAStar来完成;B4GALNT2蛋白质的保守结构域、跨膜螺旋和信号肽的预测,分别借助CDART、TMHMM、SignalP 4.1预测网站完成;B4GALNT2蛋白质的二级结构和三级结构预测则通过SOPMA和SWISS-MODEL得到。将NCBI BlastP获取的5个不同物种(牛、绵羊、人、大鼠和小鼠)的B4GANLT2蛋白序列,利用DNAStar、ClustalX和MEGA 7.0软件与BMI B4GALNT2蛋白序列(ANH21179.1)进行同源比对及构建系统进化树。
2 结果与分析
2.1 B4GALNT2基因PCR扩增
F1/R1扩增的B4GALNT2基因的完整编码区(CDS)及部分非编码区(UTR)序列,片段大小为1 773 bp,与预期一致,电泳结果见图1。对PCR产物原液和克隆后提取的阳性质粒进行双向测序,获得的BMI B4GALNT2的CDS序列长1 509 bp,GenBank登录号为KU358546。
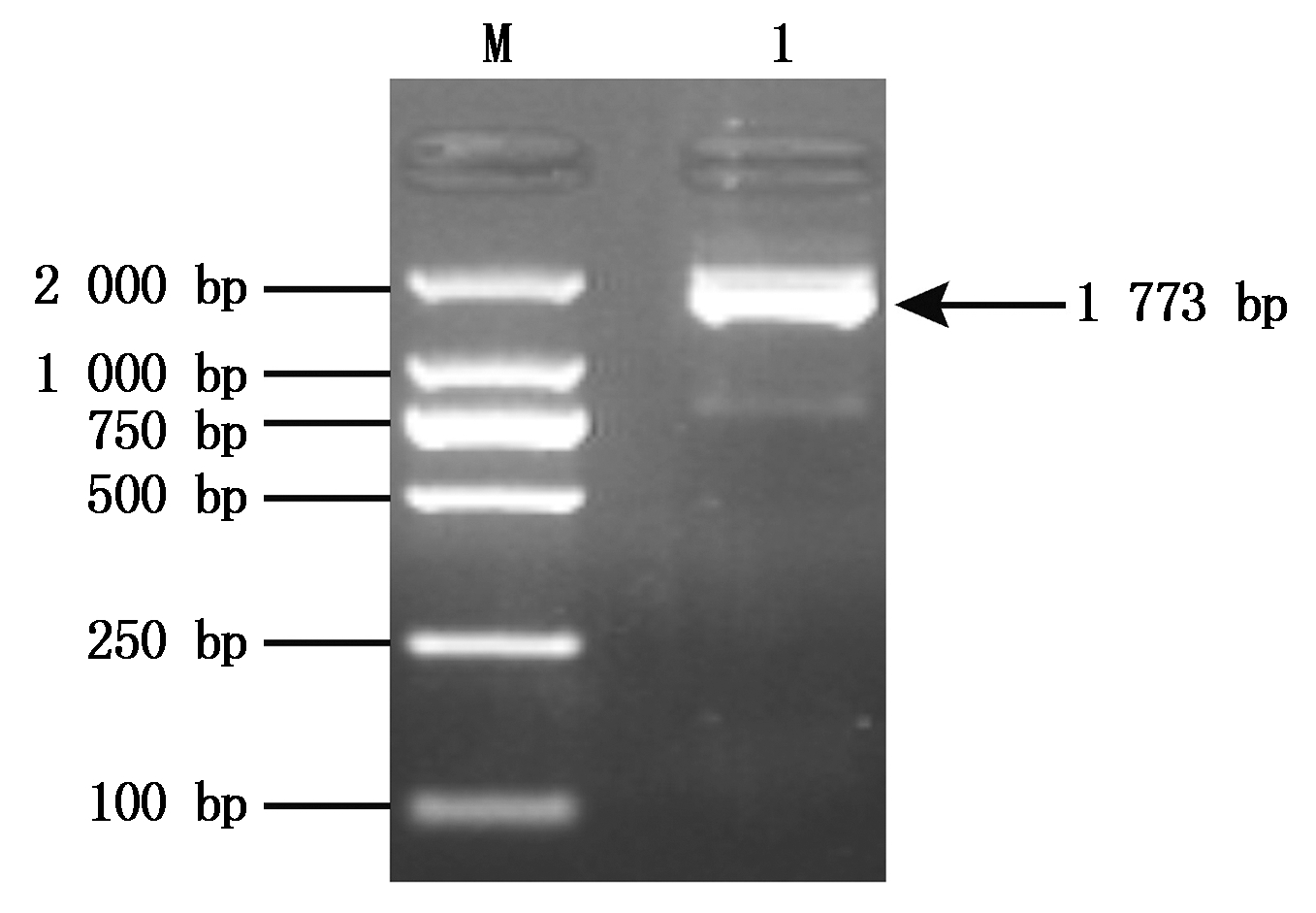
M.DNA相对分子质量标准DL2000; 1.引物F1/R1扩增的PCR产物。 M. Marker-DL2000; 1.PCR product amplified by primers F1/R1.
图1 BGALNT2基因PCR结果
Fig.1 The PCR result of BGALNT2
2.2 多组织mRNA荧光表达谱
经过对qPCR检测结果的分析,B4GALNT2基因在15种组织中mRNA的表达情况见图2。相对于内参GAPDH基因的表达水平,发现B4GALNT2 mRNA在各组织中的表达均存在差异,其中在扁桃体、肺脏、淋巴结和脾脏中表达较高,且表达量极显著高于盲肠、颌下腺等其他组织(P<0.01)。
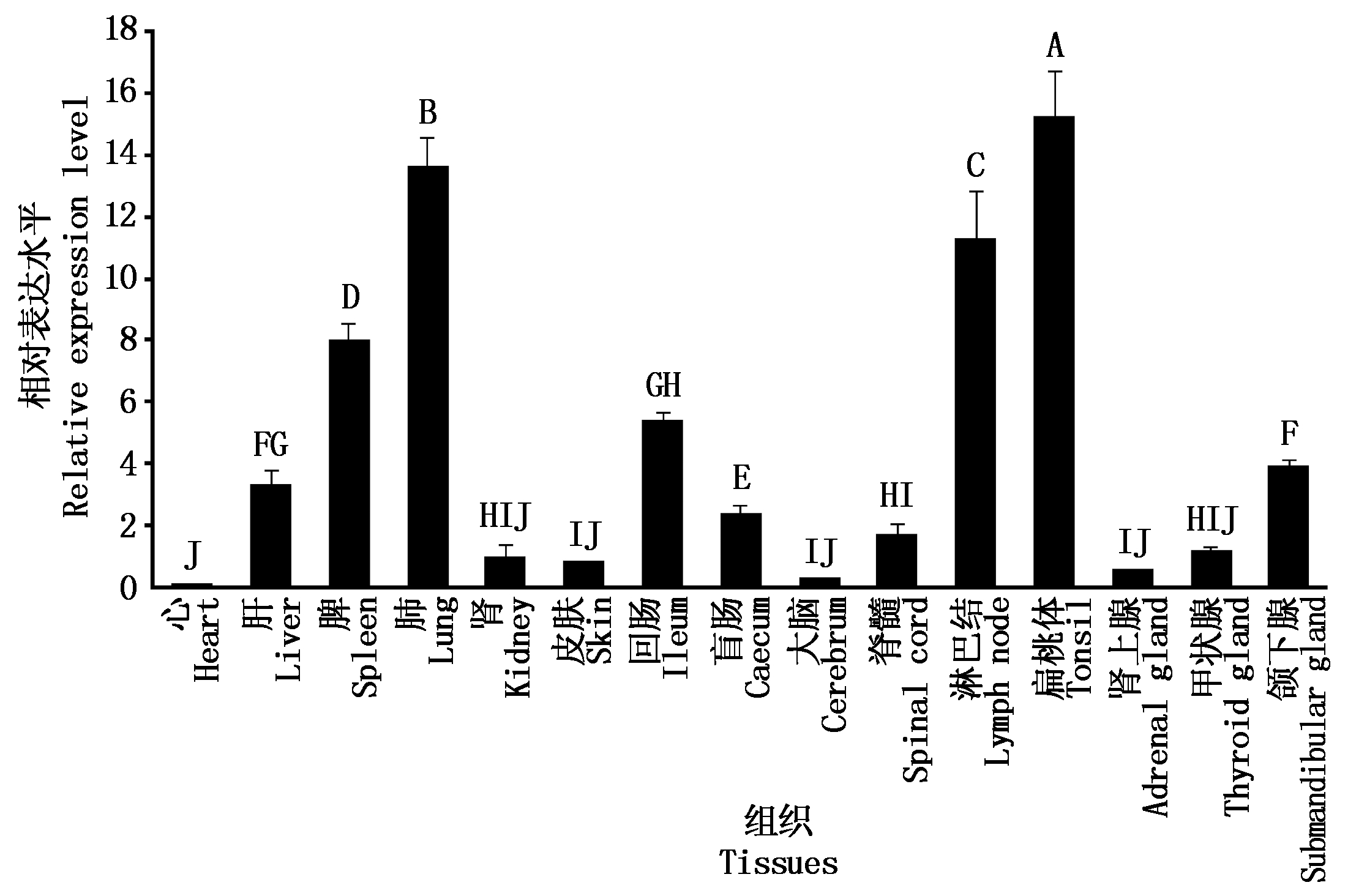
不同大写字母表示差异极显著(P<0.01)。 Different capital letters mean extremely significant difference (P<0.01).
图2 BMI B4GALNT2基因多组织表达谱
Fig.2 The mRNA expression profile 27 tissues of BMI B4GALNT2 gene
2.3 Western Blotting检测结果
利用Western Blotting检测分析得到B4GALNT2蛋白在15种组织中的表达情况。结果表明,BMI B4GALNT2蛋白在各组织中的差异表达,相对于内参蛋白β-tubulin,在扁桃体、肾上腺、盲肠、肾脏和甲状腺中表达较高,并且扁桃体、肾上腺、盲肠3种组织中的表达量极显著高于其他组织,见图3。
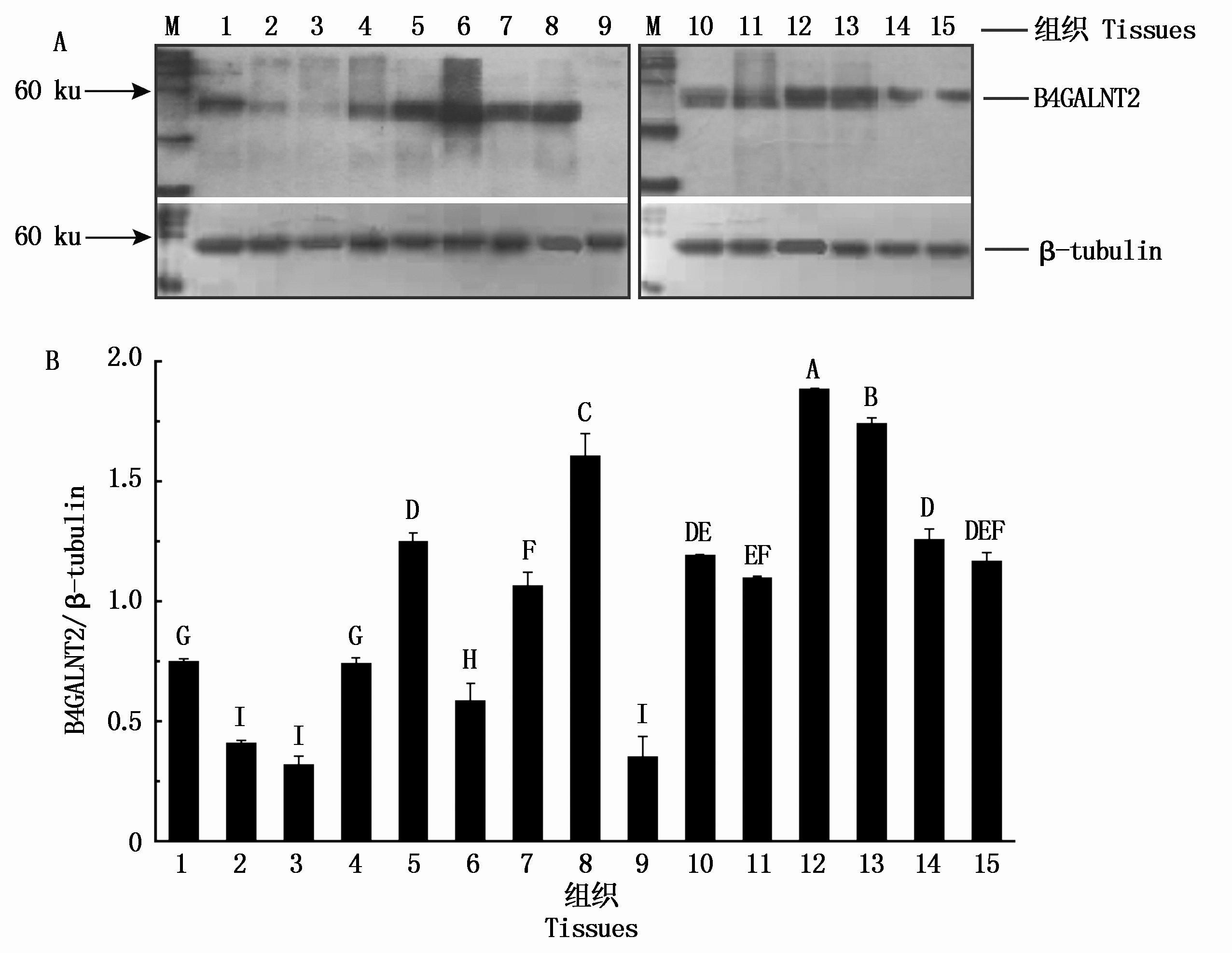
M. EasySee Western Marker(25~90 ku);1.心脏;2.肝脏;3.脾脏;4.肺脏;5.肾脏;6.皮肤;7.回肠;8.盲肠;9.大脑; 10.脊髓;11.淋巴结;12.扁桃体;13.肾上腺;14.甲状腺;15.颌下腺;不同大写字母表示差异极显著(P<0.01)。 M.EasySee Western Marker(25-90 ku);1.Heart; 2.Liver; 3.Spleen; 4.Lung; 5.Kidney; 6.Skin; 7.Ileum; 8.Caecum; 9.Cerebrum; 10.Spinal cord;11.Lymph node; 12.Tonsil; 13.Adrenal gland; 14.Thyroid gland; 15.Submandibular gland; Different capital letters mean extremely significant difference(P<0.01).
图3 BMI B4GALNT2蛋白Western Blotting表达结果
Fig.3 The Western Blotting expression level of BMI B4GALNT2 protein
2.4 B4GALNT2基因生物信息学分析
2.4.1 B4GALNT2基因序列及其编码氨基酸 获得的BMI B4GALNT2基因CDS序列长1 509 bp,编码502个氨基酸(图4),无信号肽序列,9-31 AA处含有1个跨膜螺旋结构,蛋白质分子质量56.73 ku,等电点为6.24。

ATG.起始密码子;*.终止密码子;上一行字母为编码区序列,对应的下一行为其编码的氨基酸序列; 横线是Glyco tranf GTA type保守结构域(272-364 AA);阴影为跨膜结构。 ATG.Start codon; *.Stop codon; The letters of upper line are CDS, and those of the corresponding line are amino acid sequences; The Glyco tranf GTA type conserved domains are underlined(272-364 AA) ; The transmembrane structure is shaded.
图4 BMI B4GALNT2基因编码序列及氨基酸序列
Fig.4 The coding sequence and amino acids of BMI B4GALNT2 gene
2.4.2 B4GALNT2蛋白质疏水性和保守结构域 BMI B4GALNT2蛋白经ProtScale分析,其最大疏水值为3.244,最小疏水值为-2.256,分别处于第18位氨基酸和第116位氨基酸处,N端和C端均亲水。NCBI服务器CDART-BLAST预测的B4GALNT2蛋白的保守结构域见图5,其中272-364 AA属于Glyco_tranf_GTA_type超家族成员。
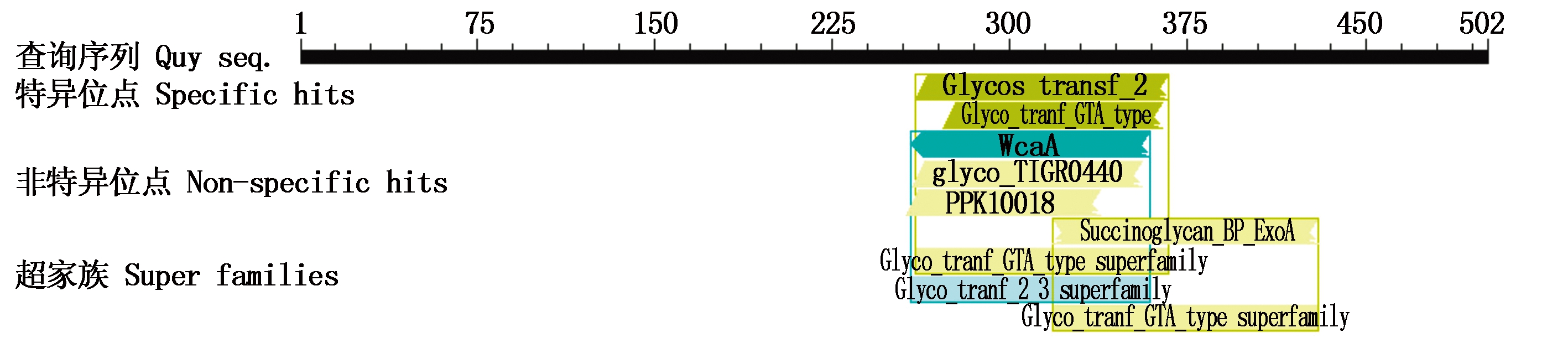
图5 BMI B4GALNT2蛋白质保守结构域
Fig.5 The conserved domain of BMI B4GALNT2 protein
2.4.3 B4GALNT2蛋白质跨膜结构 利用TMHMM程序预测的B4GALNT2蛋白质跨膜结构(图6),存在1个9-31 AA的跨膜螺旋结构。
2.4.4 B4GALNT2蛋白质二级和三级结构 利用SOPMA程序预测的BMI B4GALNT2蛋白质二级结构,其中含α螺旋167 AA(33.27%),延伸链结构96 AA(19.12%),β转角50 AA(9.96%),无规则卷曲189 AA(37.65%)。通过SWISS-MODEL在线自动同源建模系统,试图寻找与BMI B4GALNT2蛋白相似度高的三级结构模型。结果该系统提供了2个预测模板,模板1为2z87.1.A,一种软骨素合酶,蛋白序列一致性为19.61%,覆盖BMI B4GALNT2蛋白的254-459 AA,覆盖率为41%;模板2为6h1j.1.C,一种可能的ss-1,3-N-乙酰葡糖氨基转移酶,蛋白序列一致性为17.28%,覆盖BMI B4GALNT2蛋白的256-458 AA,覆盖率38%。
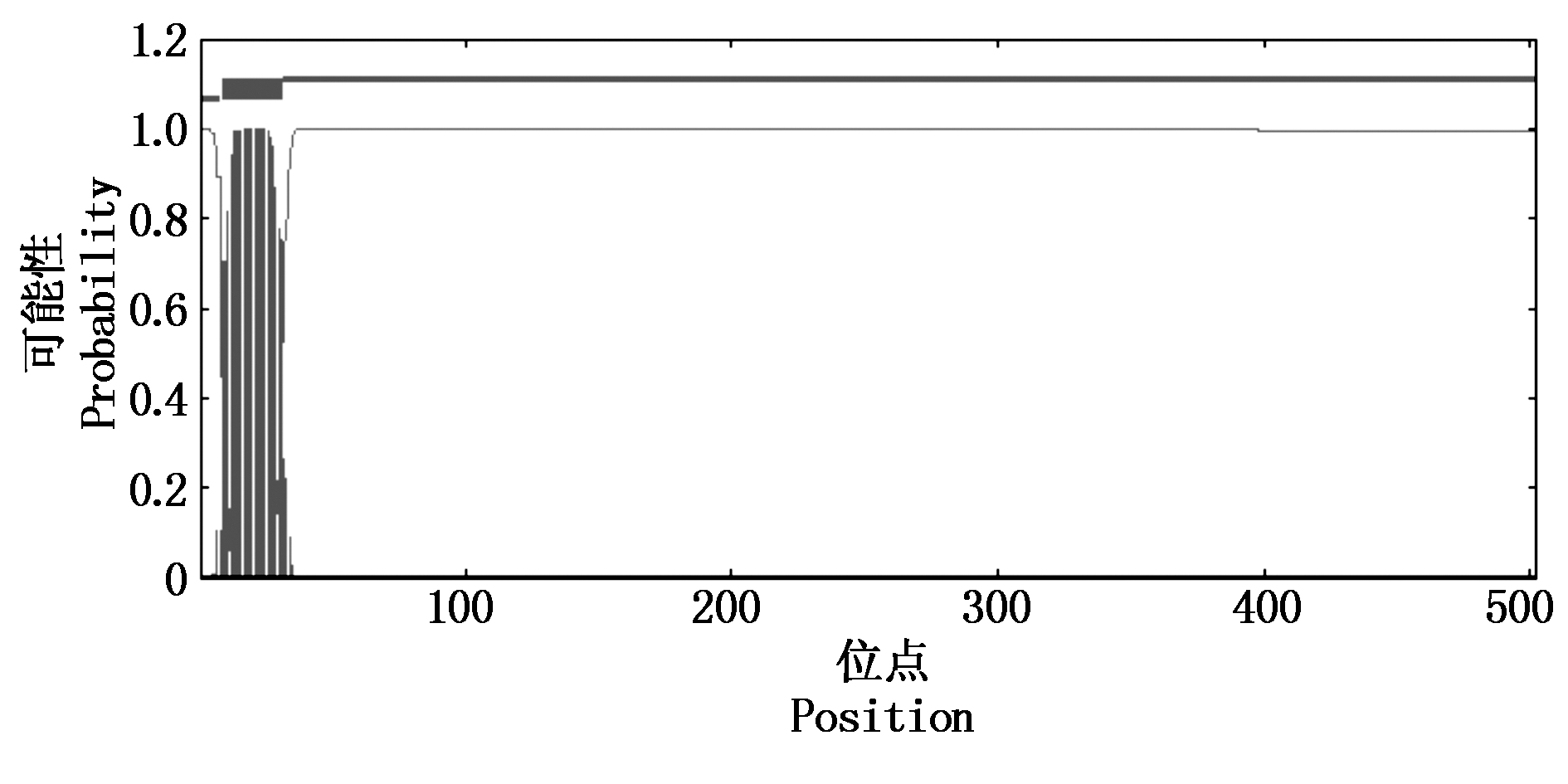
图6 利用TMHMM程序预测的 BMI B4GALNT2蛋白的跨膜结构域
Fig.6 The transmembrane structure of BMI B4GALNT2 protein predicted by TMHMM
2.4.5 B4GALNT2蛋白质序列多物种相似度计算及系统进化分析 BMI B4GALNT2氨基酸序列与下列5种物种:牛Cattle(XP_010814492)、羊Sheep(AGF33390)、人Human(NP_001152859)、大鼠Rat(XP_006220879)和小鼠Mouse(NP_032107)氨基酸序列相似度达到77.9%,75.9%,75.3%,69.3%,69.1%(图7-A)。基于上述物种氨基酸序列同源性,构建系统进化树以揭示各物种间的进化关系,结果表明共分为三大类:BMI与牛和羊聚为一类,而后与人聚为一类,大鼠与小鼠聚为一类(图7-B)。
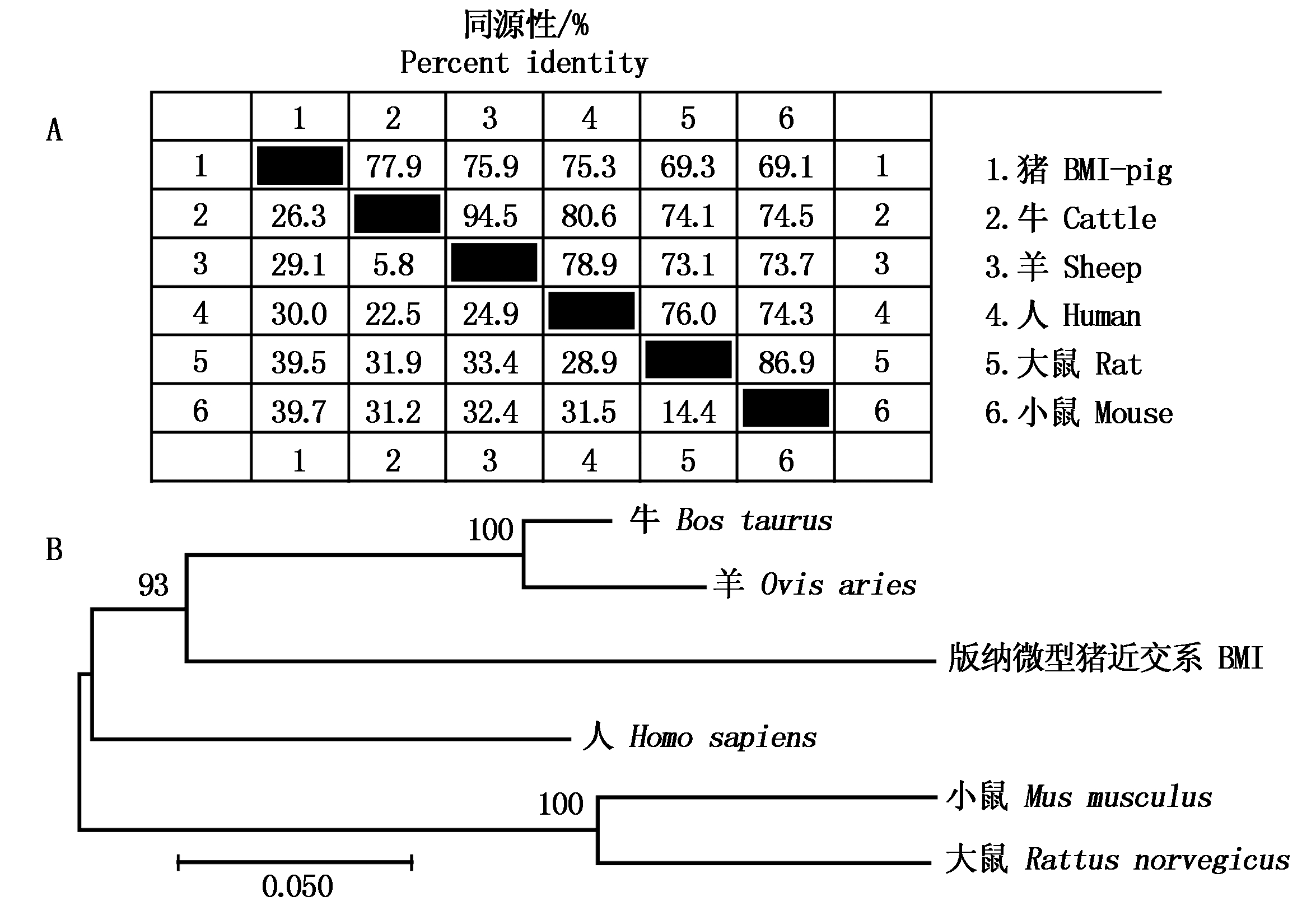
图7 BMI B4GALNT2同源性分析和系统进化树
Fig.7 The homologous analysis and the phylogenetic tree of BMI B4GALNT2
3 讨论
N-乙酰氨基半乳糖转移酶(GalNAc-Tases)家族成员,参与黏蛋白氧糖基化过程,氧糖基化蛋白主要见于分泌液中的糖蛋白,俗称粘蛋白,与细胞的识别、细胞黏附、免疫、肿瘤转移、精卵结合及细胞凋亡等生命过程密切相关[10,20]。组织血型抗原Sda也是一种氧糖基化蛋白,在红细胞及多种组织中都有表达,虽然Sda血型对输血没有显著排斥风险,但在猪到人的异种器官移植过程中,猪血管中B4GALNT2的表达可能使人产生免疫排斥反应。除免疫排斥外,Sda抗原还参与癌细胞分化、转化,小鼠毒性T淋巴细胞的溶解,以及血管性血友病因子(von Willebrand factor,vWf)循环半衰期的调节等过程[21-22]。近年来关于猪B4GALNT2基因及其蛋白的研究报道逐渐增多,在猪至狒狒心脏异种移植IgG受体的筛选中检测到了猪B4GALNT2基因[6,23],在猪大肠黏膜中检测到了β1,4GalNAcT-Ⅱ酶活性并在猪原始生殖细胞中检测到了Sda抗原[24-25]。敲除猪细胞中的B4GALNT2基因可清除Sda抗原上的GalNAc基团,进而降低人血清抗体与猪细胞的结合[5]。B4GALNT2基因在猪内皮细胞中表达并显示出广泛分布的表达模式[1],有学者认为,使用猪主动脉内皮细胞(PAEC)膜蛋白质组学分析和PAEC cDNA文库筛选方法可能有助于异种移植物排斥的免疫原性非Gal靶抗原的鉴定[6,26]。Byrne等[1]研究显示,在受到大量免疫抑制的受体中,诱导的非Gal抗体应答与结合了HEK-B4T细胞的抗体之间存在相关性,特别是在人类HEK-B4T细胞中表达猪B4GALNT2基因,导致与抗Sda抗体的反应性增加,甚至会使补体介导的裂解敏感性增强20倍,进一步说明B4GALNT2与异种移植免疫排斥相关。
本研究首次获得了BMI B4GALNT2基因CDS全长序列,包含1 509 bp,编码502个氨基酸。在用荧光定量技术确定mRNA多组织表达谱时,由于单引物跨内含子并不能完全避免扩增基因组序列,从而减除基因组DNA对mRNA表达的影响,因此本研究设计了上下游引物同时跨越内含子的荧光定量引物,荧光定量PCR结果显示BMI B4GALNT2 mRNA在多种组织中广泛表达,其中在扁桃体、肺脏、淋巴结和脾脏中表达相对较高。Western Blotting检测显示BMI B4GALNT2蛋白在扁桃体、盲肠、肾脏和甲状腺中表达相对较高。结合以上两项试验结果可以初步推断,B4GALNT2基因的表达主要集中于免疫相关组织。本研究中Western Blotting在蛋白水平的检测结果与荧光定量PCR的mRNA表达结果存在一定差异,而这种差异的存在很可能是基因在先后经历转录和翻译2个过程中的表达量不同所造成的,具体机制还有待进一步研究[27]。
本研究预测的B4GALNT2在9-31 AA处含有1个跨膜螺旋结构,属于跨膜蛋白,其N端和C端均亲水,与人B4GALNT2蛋白研究结果相类似[28]。跨膜蛋白是存在于生物膜系统中的一种特殊蛋白,作为生物膜的主要组分,它们参与细胞及组织内外环境中频繁的信息传递和物质交换,在生物体的生命活动中具有重要作用[29]。B4GALNT2是GalNAc-T家族成员之一,GalNAc-T家族属于Ⅱ型单通道跨膜蛋白,其氨基酸的N端处于胞质中,包含一个15-25 AA氨基酸的穿膜锚定结构域,通过一个茎部与C端深入高尔基体管腔内大于450 AA的催化区相连接,这种结构可能在高尔基复合体内参与和其他蛋白质协调的相互作用,或者辅助催化结构域在高尔基体中的伸展,因此锚定结构域与糖基转移酶的定位有关[30]。
蛋白质序列及其结构的相似性使得蛋白质分子在进化过程中具有一定的保守性[31-32],因此,分析蛋白的保守结构域对于研究它们的功能是十分必要的,本研究对BMI B4GALNT2蛋白保守结构域预测结果表明272-364 AA属于Glyco_tranf_GTA_type超家族成员。蛋白质的二级结构不仅仅是蛋白质三级结构的组成单元,也是构成蛋白质复杂构象的重要基础[33]。BMI B4GALNT2蛋白质二级结构的预测结果表明,以无规则卷曲(37.65%)和α-螺旋(33.27%)结构为主。蛋白质三级结构即蛋白质的空间结构,决定其生物学功能,预测蛋白质的结构对认识其结构与功能的关系具有重要意义。目前,同源模建(Comparative Modeling)即比较模建是蛋白质结构预测的方法中最为成功的一种方法[34],通过SWISS-MODEL在线自动同源建模系统的分析预测,结果没有搜索到与猪B4GALNT2相似性较高的三级结构序列模板,系统只提供了2个蛋白序列一致性较低的预测模板,分别为2z87.1.A(相似性19.61%)和6h1j.1.C(相似性17.28%)。
BMI B4GALNT2与牛、羊、人、大鼠和小鼠氨基酸序列相似度较高,而序列相似度越高,同源性越高,亲缘关系就越近,6个物种的B4GALNT2氨基酸序列构建的分子系统进化树表明BMI与牛和羊聚为一类,都属于偶蹄目,而后与人聚为一类,大鼠与小鼠聚为一类,均为啮齿目。系统进化树结果与不同物种间基因序列相似度结果相符合。
[1] Byrne G W, Du Z J, Stalboerger P,Kogelberg H, McGregor C G A. Cloning and expression of porcine β1,4 N-acetylgalactosaminyl transferase encoding a new xenoreactive antigen [J]. Xenotransplantation, 2014, 21(6): 543-554. doi:10.1111/xen.12124.
[2] Galili U, Shohet S B, Kobrin E, Stults C L, Macher B A. Man, apes and old world monkeys differ from other mammals in the expression of alpha-Galactosyl epitopes on nucleated cells [J]. J Biol Chem, 1988, 263(33): 17755-17762.
[3] Byrne G W, McGregor C. Cardiac xenotransplantation: progress and challenges [J]. Curr Opin Organ Transplant, 2012, 17(2): 148-154. doi:10.1097/MOT.0b013e3283509120.
[4] McGregor C G A, Carpentier A, Lila N, Logan J S, Byrne G W. Cardiac xenotransplantation technology provides materials for improved bioprosthetic heart valves [J]. J Thorac Cardiovasc Surg, 2011, 141(1): 269-275. doi:10.1016/j.jtcvs.2010.08.064.
[5] Zhao C J,Cooper D K C, Dai Y F, Hara H, Cai Z M, Mou L S. The Sda and Cad glycan antigens and their glycosyltransferase, β1,4GalNAcT-Ⅱ, in xenotransplantation [J]. Xenotransplantation, 2018, 25(2): e12386. doi:10.1111/xen.12386.
[6] Byrne G W, Stalboerger P G, Du Z J, Davis T R, McGregor C G A. Identification of new carbohydrate and membrane protein antigens in cardiac xenotransplantation [J]. Transplantation, 2011, 91(3): 287-292. doi:10.1097/TP.0b013e318203c27d.
[7] Wang Z Y, Li P, Butler J, Blankenship R, Downey S, Montgomery J, Nagai S, Estrada J, Tector M, Tector A. Immunogenicity of renal microvascular endothelial cells from genetically modified pigs [J]. Transplantation,2016,100(3):533-537. doi:10.1097/TP.0000000000001070.
[8] Butler J R, Martens G R, Estrada J L, Reyes L M, Ladowski J M, Galli C, Perota A, Cunningham C M, Tector M, Tector A J. Silencing porcine genes significantly reduces human-anti-pig cytotoxicity profiles an alternative to direct complement regulation[J]. Transgenic Res, 2016, 25(5): 751-759. doi:10.1007/s11248-016-9958-0.
[9] Byrne G W, McGregor C G A, Breimer M E. Recent investigations into pig antigen and anti-pig antibody expression [J]. Int J Surg, 2015, 23(PtB): 223-228. doi:10.1016/j.ijsu.2015.07.724.
[10] 刘霜, 卢建远, 马力, 夏威, 胡亮, 罗斌, 杨珂伟, 字向东. 山羊B4GALNT2基因的cDNA克隆及组织表达研究 [J]. 畜牧与兽医, 2016, 48(1): 47-51.
Liu S, Lu J Y, Ma L, Xia W, Hu L, Luo B, Yang K W, Zi X D. The cDNA cloning and tissue expression of B4GALNT2 gene in goats [J]. Animal Husbandry & Veterinary Medicine, 2016, 48(1): 47-51.
[11] Bird G W G, Wingham J. Cad(super Sda) in a British family with eastern connections: a note on the specificity of the Dolichos biflorus lectin [J]. J Immunogenet, 1976, 3(5): 297-302. doi:10.1111/j.1744-313X.1976.tb00587.x.
[12] Byrne G, Ahmad-Villiers S, Du Z J, McGregor C. B4GALNT2 and xenotransplantation: A newly appreciated xenogeneic antigen [J]. Xenotransplantation, 2018, 25(5): e12394. doi:10.1111/xen.12394.
[13] 霍金龙,罗古月,张娟,张美,曾养志. 新型实验动物——近交系动物的应用前景 [J].世界农业, 2004(12):37-39,42. doi:10.3969/j.issn.1002-4433.2004.12.011.
Huo J L, Luo G Y, Zhang J, Zhang M, Zeng Y Z. New experimental animals-application prospects of inbred animals [J]. World Agriculture, 2004(12):37-39,42.
[14] Llore N, Bruestle K, Griesemer A. Xenotransplantation tolerance: applications for recent advances in modified swine[J].Curr Opin Organ Transplant,2018, 23(6): 642-648. doi:10.1097/MOT.0000000000000585.
[15] 霍金龙, 王配, 成文敏, 王淑燕, 曾养志. 版纳微型猪近交系性别决定基因(SRY)原核表达载体的构建及蛋白高效表达 [J]. 云南农业大学学报, 2012, 27(2): 198-202. doi:10.3969/j.issn.1004-390X(n).2012.02.011.
Huo J L, Wang P, Cheng W M, Wang S Y, Zeng Y Z. Construction of prokaryotic expression vector for sex-determining gene(SRY) of Banna mini-pig inbred line and its high efficient expression [J]. Journal of Yunnan Agricultural University, 2012, 27(2): 198-202.
[16] Zhang L, Yu P, Li S F, Zeng Y Z , Cheng J Q, Li Y P, Bu H. Variation of host cell tropism of porcine endogenous retroviruses expressed in Chinese Banna minipig inbred [J]. Intervirology, 2006, 49(4): 185-191. doi:10.1159/000090787.
[17] Zhang L, Yu P, Li S F, Li Y P, Cheng J Q, Bu H. In vivo screening of porcine endogenous retrovirus in Chinese Banna minipig inbred [J]. Transplant Proc, 2006, 38(7): 2261-2263. doi:10.1016/j.transproceed.2006.06.098.
[18] Zhang L, Li Y P, Jiang H, Liu J, Zeng Y Z, Cheng J Q. Comparison of hepatic coagulant, fibrinolytic, and anticoagulant functions between Banna mini-pig inbred line and humans [J]. Transplantation, 2005, 79(9): 1128-1131. doi:10.1097/00007890-200505150-00031.
[19] 霍金龙. 版纳微型猪近交系13个种质遗传特性候选基因的克隆、表达及功能预测 [D]. 昆明: 云南大学, 2012: 7.
Huo J L. Cloning, expression and functional prediction of 13 candidate genes on genetic characteristics of germplasm in banna mini-pig inbred line(BMI) [D]. Kunming: Yunnan University, 2012:7.
[20] Stwora-Wojczyk M M, Kissinger J C, Spitalnik S L, Wojczyk B S. O-glycosylation in Toxoplasm gondii: identification and analysis of a family of UDP-GalNAc: polypeptide N-acetylgalactosaminyltransferases [J]. Int J Parasitol, 2004, 34(3): 309-322. doi:10.1016/j.ijpara.2003.11.016.
[21] Dall′Olio F, Malagolini N, Chiricolo M, Trinchera M, Harduin-Lepers A. The expanding roles of the Sda/Cad carbohydrate antigen and its cognate glycosyltransferase B4GALNT2 [J]. Biochim Biophys Acta, 2014, 1840(1): 443-453. doi:10.1016/j.bbagen.2013.09.036.
[22] Rausch P, Steck N, Suwandi A, Seidel J A, Künzel S, Bhullar K, Basic M, Bleich A, Johnsen J M, Vallance B A, Baines J F, Grassl G A. Expression of the blood-group-related gene B4galnt2 alters susceptibility to salmonella infection[J]. PLoS Pathog, 2015, 11(7): e1005008. doi:10.1371/journal.ppat.1005008.
[23] Davila E, Byrne G W, LaBreche P T, McGregor H C, Schwab A K, Davies W R, Rao V P, Oi K, Tazelaar H D, Logan J S, McGregor C G A. T-cell responses during pig-to-primate xenotransplantation [J]. Xenotransplantation, 2006, 13(1): 31-40. doi:10.1111/j.1399-3089.2005.00258.x.
[24] Malagolini N, Dall′Olio F, Guerrini S, Serafini-Cessi F. Identification and characterization of the Sda β1,4,N-acetylgalactosaminyltransferase from pig large intestine [J]. Glycoconj J, 1994, 11(2): 89-95. doi:10.1007/BF00731148.
[25] Klisch K, Contreras D A, Sun X, Brehm R, Bergmann M, Alberio R. The Sda/GM2-glycan is a carbohydrate marker of porcine primordial germ cells and of a subpopulation of spermatogonia in cattle, pigs, horses and llama [J]. Reproduction, 2011, 142(5): 667-674. doi:10.1530/REP-11-0007.
[26] Byrne G W, Stalboerger P G, Davila E, Heppelmann C J, Gazi M H, McGregor H C, LaBreche P T, Davies W R, Rao V P, Oi K, Tazelaar H D, Logan J S, McGregor C G. Proteomic identification of non-Gal antibody targets after pig-to-primate cardiac xenotransplantation [J]. Xenotransplantation, 2008, 15(4): 268-276. doi:10.1111/j.1399-3089.2008.00480.x.
[27] 张霞, 秦彩艳, 霍海龙, 王淑燕, 王配, 潘伟荣, 张永云, 陈园园, 霍金龙. 猪-人异种移植相关基因CMAH的克隆、表达及功能生物信息学分析 [J]. 四川农业大学学报, 2018, 36(4): 507-513. doi:10.16036/j.issn.1000-2650.2018.04.013.
Zhang X, Qin C Y, Huo H L, Wang S Y, Wang P, Pan W R, Zhang Y Y, Chen Y Y, Huo J L. Cloning, expression and functional bioinformatics analysis of immune rejection candidate gene CMAH related to pig-human xenotransplantation in Banna mini-pig inbred line [J]. Journal of Sichuan Agricultural University, 2018, 36(4): 507-513.
[28] Montiel M D, Krzewinski-Recchi M A, Delannoy P, Harduin-Lepers A. Molecular cloning, gene organization and expression of the human UDP-GalNAc:Neu5Acalpha2-3Galbeta-R beta1,4-N-acetylgalactosaminyltransferase responsible for the biosynthesis of the blood group Sda/Cad antigen: evidence for an unusual extended cytoplasmic domain[J]. Biochem J, 2003, 373(2): 369-379. doi:10.1042/BJ20021892.
[29] 王晗. 跨膜蛋白折叠识别方法研究 [D]. 长春: 吉林大学, 2012: 7-8.
Wang H. Researches on transmembrane protein fold recognition [D]. Changchun: Jilin University, 2012: 7-8.
[30] 沈宏杰,吴士良. 多肽: N-乙酰氨基半乳糖转移酶的结构和特性 [J]. 生命的化学, 2004,24(6): 472-474. doi:10.3969/j.issn.1000-1336.2004.06.009.
Shen H J, Wu S L. Polypeptide: structure and properties of N-acetyl-galactosaminyl transferase [J]. Chemistry of Life, 2004,24(6): 472-474.
[31] 黄京飞, 刘敬全. 氨基酸残基可及性与蛋白质家族成员结构的保守性 [J]. 动物学研究, 1998, 19(2): 137-142.
Huang J F, Liu J Q. Amino acid residue accessibility and conservation of protein family member structure [J]. Zoological Research, 1998, 19(2): 137-142.
[32] Barford D, Jia Z C, Tonks N K. Protein tyrosine phosphatases take off [J]. Nat Struct Biol, 1995, 2(12): 1043-1053. doi:10.1038/nsb1295-1043.
[33] Kabseh W, Sander C. Dictionary of secondary structure pattern recognition of hydrogen-bonded and geometric features [J]. Biopolymers, 1983, 22(12): 2577-2637. doi:10.1002/bip.360221211.
[34] 张漫, 常延琦. 蛋白质三级结构预测方法简述 [J]. 中国动物检疫, 2005, 22(5): 36-37. doi:10.3969/j.issn.1005-944X.2005.05.018.
Zhang M, Chang Y Q. A brief introduction to the prediction methods of protein tertiary structure [J]. Chinese Journal of Animal Quaranine, 2005, 22(5): 36-37.
