小麦白粉病是由禾本科布氏白粉菌(Blumeria graminis f. sp. Tritici(Bgt))侵染小麦叶片,从而引起小麦产量与品质严重降低的一种重大病害,其发病范围遍布世界所有小麦种植区,在潮湿冷凉地区尤为严重[1]。充分挖掘与利用小麦本身的抗病基因,选育与推广抗病品种是抵抗病害的一种经济环保的有效手段[2]。但在小麦育种中常常使用品种间杂交,使新育成的品种遗传基础狭窄,抗源单一,缺乏对病害持久的抗性,其抗性会随着白粉菌生理小种的变异而很快丧失,造成病害的迅速扩展流行,严重制约着小麦的安全生产[3]。因此,从小麦野生种及近缘种中挖掘并导入新的抗病基因,增强栽培品种对病害的抵抗能力可以延缓病菌生理小种的变异,从而有效控制并降低小麦白粉病大范围的发生[4]。
迄今为止,国内外学者已在小麦的70余个位点上鉴定出100多个抗白粉病基因或QTLs[5],这些抗病基因分别来源于栽培小麦、野生小麦以及小麦的近缘物种。除与小麦亲缘关系较近的野生和栽培一粒小麦、二粒小麦、波斯小麦、硬粒小麦以及乌拉尔图小麦和粗山羊草外[6-8],现代育种研究中已有多个野生近缘物种成功用于小麦遗传改良,如山羊草、冰草、新麦草、黑麦、偃麦草、鹅冠草、簇毛麦、大赖草等[9]。其中,偃麦草属中的中间偃麦草因抗病、抗逆、抗虫、多花、优质及容易与小麦杂交等优点,被国内外学者广泛应用,已成为小麦近缘植物中不可多得的优良基因源[10]。
CH7015是利用普通小麦与八倍体小偃麦进行远缘杂交培育的小麦新种质,在苗期与成株期均免疫白粉病,且具有矮秆直立、株型紧凑、结实率高、籽粒饱满等优良农艺性状,是一个高抗白粉病的优异种质资源。本研究拟利用SSR标记和BSA(分离群组分析法)方法对感病材料台长29和CH7015构建的F1、F2、F2:3群体进行遗传分析,以明确CH7015中抗白粉病基因的数目及遗传方式,并对其抗病基因进行染色体定位,旨在为该基因的克隆及其更有效地利用于抗病育种提供理论依据。
1 材料和方法
1.1 试验材料
遗传分析及作图群体为CH7015与高感白粉病品种台长29构建的F1、F2、F2∶3及BC1;CH7015是以普通小麦晋太170与八倍体小偃麦TAI8335杂交后回交1次,再经系谱法选育的高代品系;台长29为普通小麦品种,高感小麦白粉病。
CH7015、晋太170、TAI8335、台长29均来自山西省农业科学院作物科学研究所;感病品种SY95-71[11]来自四川农业大学,用于活体繁殖白粉菌种及感病对照;白粉菌生理小种E09来自中国农业科学院植物保护研究所,用于遗传群体及亲本材料的苗期抗病鉴定。
1.2 试验方法
1.2.1 抗病性鉴定 苗期抗病性鉴定在人工气候室内进行。鉴定材料分别为:台长29、CH7015,台长29 × CH7015的F1、F2、BC1和F2∶3家系,以及CH7015的亲本TAI8335和晋太170。
将试验材料播种在12穴 × 6穴的育苗盘内,每个材料播种10粒,感病对照SY95-71播种于育苗盘的四角以及中间一排,共设3次重复。人工气候室内设置为:光照周期12 h/d,光照强度为6 000 lux,温度为有光21 ℃、无光16 ℃,相对湿度控制在75%左右。播种后保持土壤湿润,约10 d后,鉴定材料的第1片叶片完全展开时,用带有新鲜白粉菌孢子的活体麦苗均匀扫抹待鉴定材料,第2天再重复接种1次,保证充分接菌。继续培养12~15 d,当感病对照充分发病时,对材料的抗病性进行调查。根据叶片反应类型及白粉菌孢子生长情况记载材料的抗病性,参照盛宝钦[12]描述的记载标准,具体分为免疫(IF=0),近免疫(IF=0;),高抗(IF=1),中抗(IF=2),中感(IF=3),高感(IF=4)6个级别,其中,0~2级属于抗病型,3~4级属于感病型。
鉴定结果使用Microsoft Excel 2013进行整理汇总,使用SPSS 18.0计算抗、感分离比例,并进行χ2分离比适合度测验,最终推断CH7015中含有的抗白粉病基因数目和类型。
1.2.2 DNA的提取及抗感病池的建立 分别取台长29、CH7015及其F1、F2的幼嫩单株叶片,在液氮中冷冻后,在2.0 mL离心管中使用宁波新芝Scientz-48型高通量组织研磨器将叶片打成粉末状,采用SDS法提取基因组DNA[13]。
根据F2及F2∶3家系抗感病调查结果,选取10株纯合抗病植株(F2表型为0级和0;级,且其F2∶3家系植株全部为抗病),分别取其等量DNA混合建立抗病池;选取10株纯合感病植株(F2表型为4级且其F2∶3家系植株全部为感病),分别取其等量DNA混合建立感病池。
1.2.3 SSR引物及PCR扩增 用于群体筛选的分子标记来源于小麦基因数据库3.0(https://wheat.pw.usda.gov/GG3/)网站。选取分布于小麦21对染色体上的825对SSR引物,委托北京华大基因公司合成,加灭菌蒸馏水溶解后置于冰箱中-20 ℃保存。
使用MJ Research公司生产的PTC-200型PCR仪进行扩增,反应体系为15 μL:灭菌水7.45 μL,10×PCR Buffer 1.5 μL,1.5 mmol/μL引物1.8 μL,1 mmol/μL dNTP Mix 2 μL,5 U/μL Taq酶 0.75 μL,200 mmol/μL模板DNA 1.5 μL。PCR扩增程序为:94 ℃预变性3 min;94 ℃变性1 min,退火45 s,退火温度58 ℃左右(根据引物进行适当调整),72 ℃延伸1 min,共35个循环;72 ℃延伸5 min。
扩增产物加入5 μL Loading Buffer作为指示剂,混匀后使用8%聚丙烯酰胺凝胶电泳进行分离[14],恒压200 V,电泳时间60 min,银染显色照相后统计带型。
1.2.4 连锁分析及染色体定位 使用825对SSR引物在CH7015和台长29间进行PCR扩增,筛选有亲本间具有多态性的引物。利用筛选到的引物在抗病池和感病池间进行扩增,继续筛选在抗、感病池间表现出多态性的引物。将筛选出的多态性引物利用由10株纯合抗和10株纯合感的单株组成的小群体进行验证。在抗亲、抗池、抗病小群体都表现一致,且在感亲、感池、感病小群体也都表现一致的标记初步推断为抗病基因的连锁标记。将筛选出的引物对台长29×CH7015的全部F2单株DNA扩增,进行抗病基因连锁分析。获得的连锁标记使用中国春缺体-四体和双端体系进行染色体定位,以确定目标基因所在染色体位置。
用Mapmaker Exp 3.0[15-16]软件进行连锁分析,并计算SSR连锁标记与抗病基因的遗传距离,用MapDraw v2.1绘制遗传连锁图。
2 结果与分析
2.1 苗期鉴定结果与抗性遗传分析
利用白粉菌菌株E09对CH7015及其亲本TAI8335、晋太170进行苗期接种鉴定,结果表明,CH7015和TAI8335表现为免疫或近免疫(IT=0或0;),晋太170和感病对照SY95-71表现为高感白粉病(IT=4)。CH7015来源于组合“晋太170×2/TAI8335”的高代选系,TAI8335为利用普通小麦晋春5号和太原768与中间偃麦草杂交选育的八倍体小偃麦,由于TAI8335的小麦亲本晋春5号和太原768都高感白粉病[17],中间偃麦草则免疫白粉病,所以,CH7015的小麦亲本中都不含抗白粉病基因,其对白粉菌株E09的抗性可能来源于TAI8335或中间偃麦草。
利用白粉菌菌株E09对CH7015、台长29及其正反交F1、BC1群体进行苗期接种鉴定,结果如表1所示,CH7015和正反交F1所有植株均表现为免疫或近免疫(IT=0或0;),台长29表现为高感(IT=4),其F1全部表现为与CH7015相同的抗病反应,以台长29为回交亲本的BC1群体则呈现1∶1的分离比例。说明CH7015对白粉菌株E09的抗性由显性基因控制。
台长29 × CH7015的F2群体抗性鉴定结果表明,在388个鉴定植株中,有296个植株表现为抗病(IT=0~2),92个植株表现为感病(IT=3~4),χ2检验抗感分离比例符合3∶1的理论值(χ2= 0.17,P=0.68)。BC1回交群体中抗病单株为23个,感病单株为23个,卡方检验抗感分离比例符合1∶1的理论值(χ2=0.01,P=0.91)。
表1 CH7015、台长29及其遗传群体对白粉菌株E09的抗性反应
Tab.1 Resistance reaction to bgt E09 of CH7015, Taichang 29 and their generation groups
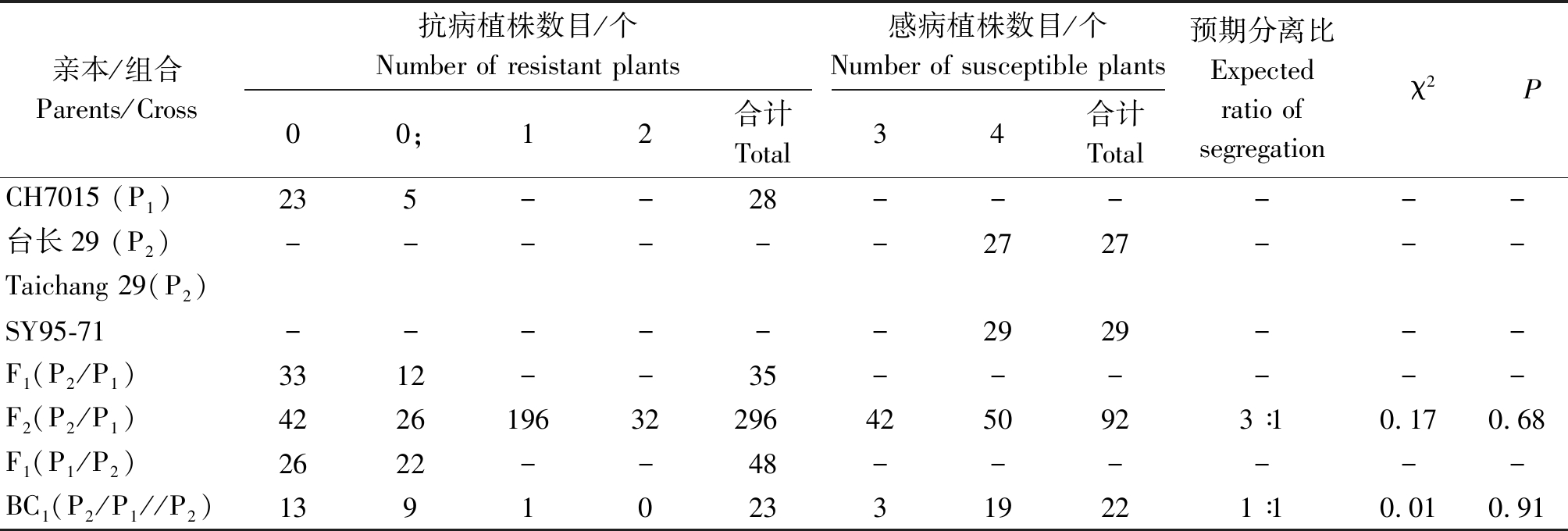
亲本/组合Parents/Cross抗病植株数目/个Number of resistant plants感病植株数目/个Number of susceptible plants00;12合计Total34合计Total预期分离比Expectedratio of segregationχ2PCH7015 (P1)235--28------台长29 (P2)------2727---Taichang 29(P2)SY95-71------2929---F1(P2/P1)3312--35------F2(P2/P1)4226196322964250923∶10.170.68F1(P1/P2)2622--48------BC1(P2/P1//P2)1391023319221∶10.010.91
综上分析认为,小麦新种质CH7015中的抗白粉病基因PmCH7015为1个显性核基因,其遗传方式符合孟德尔分离规律。
2.2 CH7015中抗白粉病基因的SSR标记分析
抗、感亲本筛选结果表明,在825对SSR引物中,共有326对在CH7015和台长29之间表现出多态性。进一步利用这326对引物在抗、感病池间进行筛选,结果发现,Xwmc68、Xgpw2328、Xgpw7272、Xwmc657、Xgpw4079等5对引物能在抗、感病池间表现出多态性,且多态性条带与其抗、感亲本一致。使用抗、感小群体进行验证后发现,它们可以在抗病小群体和抗病亲本之间与感病小群体和感病亲本之间分别扩增出相同的特异条带(图1)。因此,推断这5个标记与抗病基因PmCH7015连锁。
利用上述5个标记检测F2群体的388个单株DNA,结合F2和F2∶3群体的表现型分析,证实这5个标记均与抗病基因PmCH7015连锁。

M.Marker;PR.CH7015;PS.台长29;BR.抗病池;BS.感病池;R.纯合抗病株;S.纯合感病株;箭头指示特异扩增条带。 M.Marker;PR.CH7015;PS.Taichang 29;BR.Resistant bulk;BS.Susceptible bulk;R.Homozygous resistant plant; S.Homozygous susceptible plant; Arrows indicated the specifc bands.
图1 五对连锁标记在TC29×CH7015 F2群体中的扩增结果
Fig.1 Amplification results of five pairs of SSR linkage markers in the F2 populations of TC29/CH7015
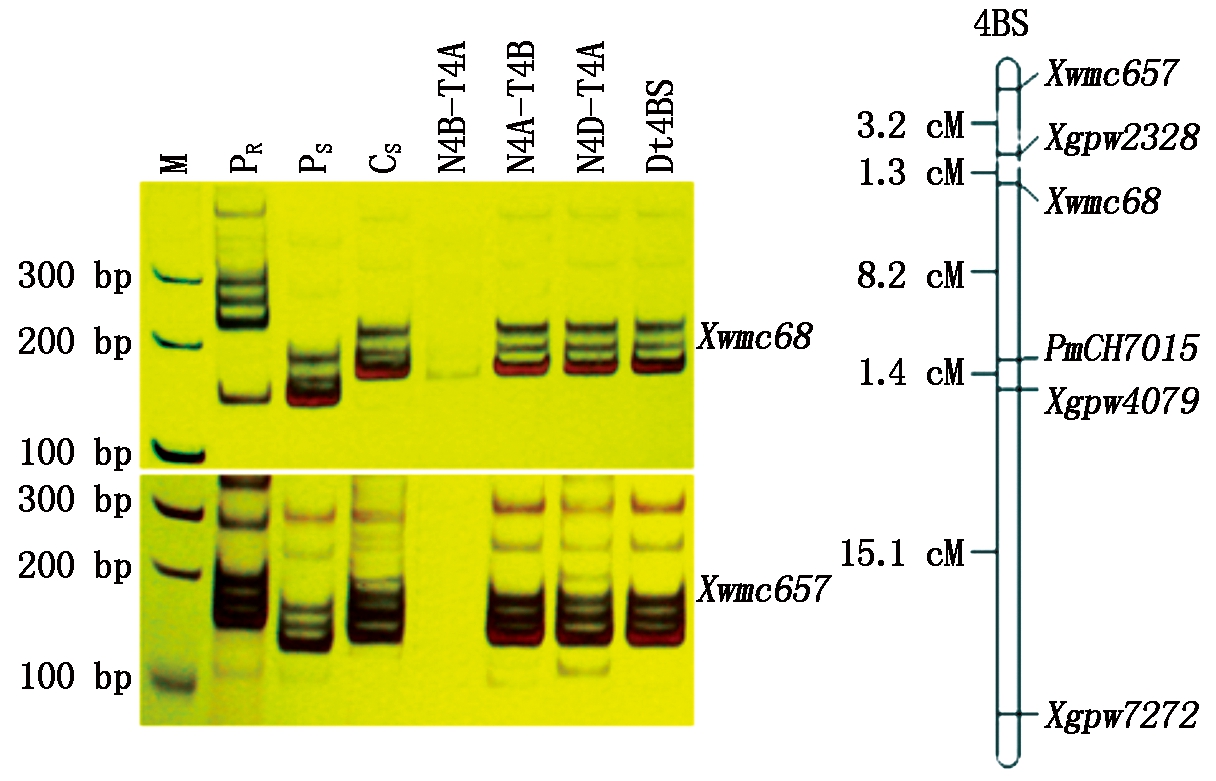
M.Marker; PR.CH7015;PS.台长29;CS.中国春;N4B-T4A,N4A-T4B,N4D-T4A.中国春缺体-四体N4BT4A,N4AT4B,N4DT4A;Dt4BS.中国春双端体Dt4BS。
M.Marker; PR.CH7015;PS.Taichang 29;CS.Chinese Spring;N4B-T4A,N4A-T4B,N4D-T4A.Nullisomic-tetrasomic lines;Dt4BS.Ditelosomoc Dt4BS.
图2 Xwmc68和Xwmc657的染色体定位 及抗白粉病基因PmCH7015的遗传连锁图谱
Fig.2 Chromosome location of SSR markers Xwmc68 and Xwmc657 in genetic linkage map of PmCH7015
2.3 抗白粉病基因PmCH7015的染色体定位及遗传连锁图谱构建
根据在Graingenes小麦基因数据库中查询5对连锁标记信息,结果发现,只有Xgpw2328同时位于4B、4D、5A染色体上,其余4个标记均被定位于Xgpw4079、Xwmc657、Xwmc68和Xgpw7272小麦4B染色体上。因此初步推断,PmCH7015位于4B染色体上。利用中国春缺体-四体和Dt4BS双端体系进行验证,结果发现,Xwmc68、Xwmc657可以在N4A-T4B、N4D-T4A和Dt4BS上扩增出预期条带,但在N4B-T4A上却扩增不出该目标条带,证明PmCH7015的连锁标记位于小麦4BS染色体上。
利用Mapmaker Exp 3.0计算遗传距离和MapDraw v2.1绘制遗传连锁图谱,结果显示,PmCH7015及其连锁标记的位置顺序为:Xwmc657、Xgpw2328、Xwmc68、PmCH7015、Xgpw4079和Xgpw7272,其遗传距离如图2所示,PmCH7015两侧连锁标记Xgpw4079和Xwmc68的遗传距离分别为1.4,8.2 cM。
3 讨论
中间偃麦草是小麦遗传改良中重要的野生近缘种,1950年以来,已将中间偃麦草的抗条纹花叶病、黄矮病、条锈病和白粉病等多种抗性导入普通小麦中[17-20],选育出了TAF46、中1、中2、中4、TE253等多个八倍体小偃麦。Chang等[21]利用中间偃麦草选育的八倍体小偃麦TAI8335兼抗白粉、条锈、叶锈等多种小麦主要病害。CH7015是以普通小麦晋太170与TAI8335杂交后回交一次,再经系谱法选育的高代品系。TAI8335的小麦亲本晋春5号、太原768和CH7015的小麦亲本晋太170均高感白粉病,而TAI8335与其野生亲本中间偃麦草则对白粉病表现为免疫。因此,初步推测PmCH7015来源于中间偃麦草。
国内外鉴定出的100多个正式命名的抗白粉病基因或QTLs中,只有定位于小麦7BS上的Pm40和2DL上的Pm43来源于中间偃麦草[22-23],还有一些来源于中间偃麦草尚未正式命名的抗白粉病基因,如位于7BS上的PmE、2DL上的PmYU25、2BS上的PmL962和4BL上的PmCH83等[24-27],这些抗病基因分别来源于中间偃麦草的J及JS染色体组。在PmCH7015的亲本TAI8335中含有1对S组、3对JS组、1对J组及2对J/S易位染色体,因此,尚无法推测PmCH7015来源于哪一个染色体组,这需要进一步寻找更多的证据才有可能获得最终结论。
本研究最终筛选出5个SSR标记,Xwmc657、Xgpw2328、Xwmc68、Xgpw4079和Xgpw7272,将PmCH7015定位在小麦4BS染色体上。在小麦的21条染色体中,除4D染色体外,其他染色体上均有抗白粉病基因分布,但在4B染色体上只有源于黑麦的Pm7位于4BL上[28],4BS上并无小麦抗白粉病基因的报道。因此,PmCH7015是一个新发现的抗白粉病基因位点。
种质资源的挖掘与利用是作物育种创新突破的重要前提。在已发现的抗白粉病基因中, Pm4、Pm8等虽然在小麦生产中得到广泛应用[29],但随着白粉菌小种的变异,这些抗病基因绝大多数已丧失抗性,仅凭现有的少数抗病基因很难实现抗源多样化,因此,仍需发掘新的抗病基因资源。CH7015是利用普通小麦与八倍体小偃麦进行远缘杂交培育的小麦新种质,在苗期与成株期均免疫白粉病,且具有矮秆直立、株型紧凑、结实率高、籽粒饱满等优良农艺性状,是一个高抗白粉病的优异种质资源,可用于小麦白粉病抗性改良。与抗病基因PmCH7015连锁的分子标记,亦可为抗病基因图位克隆与分子育种提供技术支撑。
[1] Tilman D, Balzer C, Hill J, Befort B L. Global food demand and the sustainable intensification of agriculture[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(50): 20260-20264. doi:10.1073/pnas.1116437108.
[2] 杨作民, 唐伯让, 沈克全, 夏先春. 小麦抗病育种的战略问题: 小麦对锈病和白粉病第二线抗源的建立和利用[J]. 作物学报, 1994, 20(4): 385-394.
Yang Z M, Tang B R, Shen K Q, Xia X C. Strategic issues in wheat disease resistance breeding: establishment and utilization of second-line resistance sources of wheat rust and powdery mildew[J]. Acta Agron Sin, 1994, 20(4): 385-394.
[3] 何中虎, 兰彩霞, 陈新民, 邹裕春, 庄巧生, 夏先春.小麦条锈病和白粉病成株抗性研究进展与展望[J].中国农业科学,2011,44(11):2193-2215. doi:10.3864/j.issn.0578-1752.2011.11.001.
He Z H, Lan C X, Chen X M, Zou Y C, Zhuang Q S, Xia X C. Progress and perspective in research of adult-plant resistance to stripe rust and powdery mildew in wheat[J]. Scientia Agricultura Sinica, 2011, 44(11): 2193-2215.
[4] 吴先华,罗培高,晏本菊,任正隆.小麦抗白粉病基因的定位及其在育种中的应用研究进展[J].植物保护科学,2006,22(5):346-351. doi:10.3969/j.issn.1000-6850.2006.05.090.
Wu X H, Luo P G, Yan B J, Ren Z L. Researches on powdery mildew resistant genes and its breeding in wheat[J]. Chinese Agricultural Science Bulletin, 2006, 22(5):346-351.
[5] 王振花, 刘伟, 徐志, 范洁茹, 彭云良, 周益林. 50个小麦生产及后备品种(系)的抗白粉病基因推导[J]. 植物保护, 2017,43(6):152-158. doi:10.3969/j.issn.0529-1542.2017.06.026.
Wang Z H, Liu W, Xu Z, Fan J R, Peng Y L, Zhou Y L. Postulation of wheat powdery mildew resistance genes in 50 wheat cultivars(lines)[J]. Plant Proteceion, 2017,43(6):152-158.
[6] Xu W G, Li C X, Hu L, Zhang L, Zhang J Z, Dong H B, Wang G S. Molecular mapping of powdery mildew resistance gene pmHNK in winter wheat(Triticum aestivum L.) cultivar Zhoumai 22[J]. Molecular Breeding, 2010,26(1):31-38.doi:10.1007/s11032-009-9374-8.
[7] Xie W L, Ben-David R, Zeng B, Distelfeld A, Röder M S, Dinoor A, Fahima T. Identification and characterization of a novel powdery mildew resistance gene PmG3M derived from wild emmer wheat, Triticum dicoccoides[J]. Theoretical Applied Genetics, 2012, 124(5): 911-922. doi:10.1007/s00122-011-1756-8.
[8] Huang J, Zhao Z H, Song F J, Wang X M, Xu H X, Huang Y, An D G, Li H J. Molecular detection of a gene effective against powdery mildew in the wheat cultivar Liangxing 66[J]. Molecular Breeding, 2012, 30(4): 1737-1745. doi:10.1007/s11032-012-9757-0.
[9] 钟冠昌,穆素梅,张正斌.麦类远缘杂交[M].北京:科学出版社,2003:29-193.
Zhong G C, Mu S M, Zhang Z B. Wheat crop wide crosses[M]. Beijing: Science Press, 2003: 29-193.
[10] Han F P, Liu B, Fedak G, Liu Z H. Genomic constitution and variation in five partial amphiploids of wheat-Thinopyrum intermedium as revealed by GISH, multicolor GISH and seed storage protein analysis[J]. Theoretical Applied Genetics, 2004, 109(5):1070-1076. doi:10.1007/s00122-004-1720-y.
[11] 杨足君, 舒焕麟, 李光蓉. 利用种子储藏蛋白电泳分析小麦材料SY95-71及其亲本的遗传变异[J]. 四川农业大学学报, 2000, 18(1): 7-10. doi:10.3969/j.issn.1000-2650.2000.01.003.
Yang Z J, Shu H L, Li G R. Genetic variations of seed storage protein in wheat line SY95-71 and its parents[J]. Journal of Sichuan Agricultural University, 2000, 18(1): 7-10.
[12] 盛宝钦. 用反应型记载小麦苗期白粉病[J]. 植物保护, 1988, 14(1): 49.
Sheng B Q. Powdery mildew at seedling stage of wheat was recorded by reaction type[J]. Plant Protection, 1988, 14(1): 49.
[13] Dellaporta S L,Wood J, Hicks J B. A plant DNA mini preparation: Version Ⅱ [J]. Plant molecular biology reporter, 1983, 1(4): 19-21. doi:10.1007/BF02712670.
[14] 王运斌, 江良荣, 黄荣裕, 黄育民,郑景生. 一种高效省本的非变性聚丙烯酰胺凝胶电泳银染法的建立:以水稻为例[J]. 福建稻麦科技, 2015(3): 4-8. doi:10.3969/j.issn.1008-9799.2015.03.003.
Wang Y B, Jiang L R, Huang R Y, Huang Y M, Zheng J S. A high-efficiency and low cost method of DNA silver staining in non-denaturant polycrylamide gel electrophoresis-an example based on rice[J]. Fujian Science and Technology of Rice and Wheat, 2015(3): 4-8.
[15] 邢光南, 赵团结, 盖钧镒. 关于Mapmaker/Exp遗传作图中标记分群和排序操作技术的讨论[J]. 作物学报, 2008, 34(2): 217-223. doi:10.3724/SP.J.1006.2008.00217.
Xing G N, Zhao T J, Gai J Y. Application technique of marker grouping and ordering in genetic linkage map construction using Mapmaker/Exp[J]. Acta Agronomica Sinica, 2008, 34(2): 217-223.
[16] 王竹林, 杨睿, 杨兴圣, 刘曙东,胡甘. Mapmaker 3.0和作图软件使用[J]. 实验室研究与探索, 2012, 31(11): 62-65. doi:10.3969/j.issn.1006-7167.2012.11.018.
Wang Z L, Yang R, Yang X S, Liu S D, Hu G. The use of Mapmaker 3.0 and mapping software[J]. Research and Exploration in Laboratory, 2012, 31(11): 62-65.
[17] Barloy D, Etienne C, Lemoine J, Ouen Y S, Jahier J, Banks P B M, Trottet M. Comparison of TAF46 and Zhong 5 resistances to Barley yellow dwarf virus from Thinopyrum intermedium in wheat[J]. Euphytica, 2003, 129(3): 361-369. doi:10.1023/a:1022260010187.
[18] 孙善澄. 小偃麦新品种与中间类型的选育途径、程序和方法[J]. 作物学报, 1981, 7(1): 51-58.
Sun S C. The approach and methods of breeding new varieties and new species from Agrotriticum hybrids[J]. Acta Agronomica Sinica, 1981, 7(1): 51-58.
[19] Liu S B, Wang H G, Zhang X Y, Li X F, Li D Y, Duan X Y, Zhou Y L. Molecular cytogenetic identification of a wheat-thinopyron intermedium(Host) barkworth DR dewey partial amphiploid resistant to powdery mildew[J]. Journal of Intergrative Plant Biology, 2005, 47(6): 726-733. doi:10.1111/j.1744-7909.2005.00051.x.
[20] Bao Y G, Li X, Liu S B, Cui F, Wang H G. Molecular cytogenetic characterization of a new wheat-Thinopyrum intermedium partial amphiploid resistant to powdery mildew and stripe rust[J]. Cytogenet and Genome Research, 2009, 126(4): 390-395. doi:10.1159/000266169.
[21] Chang Z J, Zhang X J, Yang Z J, Zhan H X, Li X, Liu C, Zhang C Z. Characterization of a partial wheat-Thinopyrum intermedium amphiploid and its reaction to fungal diseases of wheat[J]. Hereditas, 2010, 147(6):304-312.doi:10.1111/j.1601-5223.2010.02156.x.
[22] Luo P G, Luo H Y, Chang Z J, Zhang H Y, Zhang M, Ren Z L. Characterization and chromosomal location of Pm40 in common wheat: a new gene for resistance to powdery mildew derived from Elytrigia intermedium[J]. Theoretical Applied Genetics, 2009, 118(6): 1059-1064. doi:10.1007/s00122-009-0962-0.
[23] He R L, Chang Z J, Yang Z J, Yuan Z Y, Zhan H X, Zhang X J, Liu J X. Inheritance and mapping of a powdery mildew resistance gene Pm43 introgressed from Thinopyrum intermedium into wheat[J]. Theoretical and Applied Genetics, 2009, 118(6): 1173-1180. doi:10.1007/s00122-009-0971-z.
[24] Hati K M, Biswas A K, Bandyopadhyay K, Misra A K. Effect of post-methanation effluent on soil physical properties under a soybean-wheat system in a vertisol[J]. Journal of Plant Nutrition Soil Science, 2004, 167(5): 584-590. doi:10.1002/jpln.200321284.
[25] 马强, 罗培高, 任正隆, 蒋华仁, 杨足君. 两个抗小麦白粉病新基因的遗传分析与染色体定位[J]. 作物学报, 2007, 33(1): 1-8. doi:10.3321/j.issn:0496-3490.2007.01.001.
Ma Q, Luo P G, Ren Z L, Jiang H R, Yang Z J. Genetic analysis and chromosomal location of two new genes for resistance to powdery mildew in wheat(Triticum aestivum L.)[J]. Acta Agronomica Sinica, 2007, 33(1): 1-8.
[26] Shen X K, Ma L X, Zhong S F, Liu N, Zhang M, Chen W Q, Zhou Y L, Li H J, Chang Z J, Li X, Bai G H, Zhang H Y, Tan F Q, Ren Z L, Luo P G. Identification and genetic mapping of the putative Thinopyrum Intermedium derived dominant powdery mildew resistance gene PmL962 on wheat chromosome arm 2BS [J]. Theoretical Applied Genetics, 2015, 128(3): 517-528. doi:10.1007/s00122-014-2449-x.
[27] 孙翠花, 侯丽媛, 郭慧娟, 张晓军, 贾举庆, 李欣, 詹海仙, 畅志坚. 小麦-中间偃麦草隐形渗入系抗白粉病基因pmCH83的分子定位[J]. 作物学报, 2013, 39(12): 2107-2114. doi:10.3724/SP.J.1006.2013.02107.
Sun C H, Hou L Y, Guo H J, Zhang X J, Jia J Q, Li X, Zhan H X, Chang Z J. Molecular mapping of powdery mildew resistance gene pmCH83 in a putative wheat Thinopyrum intermedium cryptic introgression line[J]. Acta Agronomica Sinica, 2013, 39(12): 2107-2114.
[28] Friebe B, Heun M, Tuleen N, Zeller F J, Gill B S. Cytogenetically monitored transfer of powdery mildew resistance from rye into wheat[J]. Crop Science, 1994, 34(3): 621-625. doi:10.2135/cropsci1994.0011183X003400030003x.
[29] 周阳, 何中虎, 张改生, 夏兰琴, 陈新民, 高永超, 井赵斌,于广军. 1BL/1RS易位系在我国小麦育种中的应用[J]. 作物学报, 2004, 30(6): 531-535. doi:10.3321/j.issn:0496-3490.2004.06.003.
Zhou Y, He Z H, Zhang G S, Xia L Q, Chen X M, Gao Y C, Jing Z B, Yu G J. Utilization of 1BL/1RS translocation in wheat breeding in China[J]. Acta Agronomica Sinica, 2004, 30(6): 531-535.
