WRKY是植物中最大的一类转录因子家族之一,1994年在甘薯中发现第一个WRKY转录因子SPF1,随后在拟南芥[1]、水稻[2]、大麦[3]、黄瓜[4]、玉米[5]、棉花[6]、番茄[7]和小麦[8]中逐步有很多相关研究。WRKY家族成员都含有由60个氨基酸组成的WRKY结构域,其N端有保守的WRKYGQK序列(WRKY因此得名),C端包含锌指结构C2H2或C2HC[9]。
WRKY家族成员广泛地参与植物的生长发育与形态建成[10]。如AtWRKY44(即TTG2)是拟南芥中首次发现的与表皮毛和种皮发育相关的WRKY转录因子[11];AtWRKY6在拟南芥衰老的叶片内表达量显著提高,表明其参与叶片的衰老过程[12]。水稻中OsWRKY23的表达主要在根和衰老叶片中,说明其参与根和衰老叶片的表达调控[13];OsWRKY13、OsWRKY23、OsWRKY71、OsWRKY12、OsWRKY43、OsWRKY55与OsWRKY86 7个蛋白质在苗期表达量较低,随叶片的生长表达逐步增加,推测它们在叶片的正常生长过程中发挥作用[14]。
除了在植物正常生长中发挥作用外,WRKY转录因子还参与了植物的抗病过程。OsWRKY22敲除的水稻株系对稻瘟病菌感病,而过表达可增强稻瘟病抗性[15];OsWRKY71提升了转基因水稻对白叶枯病的抗性[16];过表达PtrWRKY89增加了杨树对黑斑病的抗性[17];TaWRKY70沉默增强了小麦对条锈菌的感病性[18]。WRKY转录因子通过其结构域与靶基因启动子区域的(T)(T)TGAC(C/T)序列(W-box)特异性结合,以调控下游基因的转录[19]。如OsWRKY53超表达的转基因水稻中,OsWRKY53特异性地结合在W盒序列元件上,诱导PBZ1、PR5、PR14、几丁质酶与过氧化物酶等防御相关基因的表达,提高水稻对稻瘟病的抗性[20];较未转基因水稻相比,OsWRKY80超表达水稻增强了病程相关基因ZB8、PBZ1的表达,表现出对稻瘟病较好的抗性[21];ZmWRKY79过表达的玉米原生质体依赖W-box或WLE顺式元件,增加了萜类植保素生物合成相关基因的表达,提高了植株抗生物胁迫能力[22]。上述结果说明,WRKY转录因子可以诱导防御相关基因的高水平表达,从而正调控水稻对稻瘟病的抗性反应。然而,谷子中关于WRKY转录因子在抗病反应中的相关研究尚无报道。
谷锈病(Uromyces setariae-italicae Yoshino)是谷子上的重要病害,常年减产10%~30%,流行年份植株倒伏、颗粒无收,严重影响着谷子的稳产和高产[23]。生产中利用抗锈品种是最经济有效的防治方法。但抗锈品种应用中易出现抗性丧失现象,因此,克隆抗锈基因、揭示抗锈机理对快速培育抗锈品种,延长品种使用寿命具有重要意义。WRKY是一类对植物生长发育、抗病反应具有重要作用的转录因子,拟南芥中AtWRKY29/22与水稻中同源基因OsWRKY03都参与了植物的防御反应[24-25],笔者对其在谷子中的同源基因SiWRKY03进行了系统研究,包括利用生物信息学软件分析了其生物学特征,采用Real-time PCR技术检测了SiWRKY03转录因子在谷子不同组织部位和抗谷锈病过程中的表达丰度变化,为探索WRKY成员的功能,了解谷子抗病机理提供试验数据。
1 材料和方法
1.1 试验材料及试剂
试验植物材料为谷子抗病材料十里香和感病材料豫谷1号,供试菌株为谷锈菌强毒性小种A57的单孢菌系93-5,均由河北省农林科学院谷子研究所植保室保存。十里香对谷锈菌单孢菌系93-5的侵染表现抗病反应,豫谷1号对93-5的侵染表现感病反应。
TRIzol试剂、cDNA第一链合成试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)购自赛默飞世尔(中国)科技公司;Real-time PCR使用的TB GreenTM Premix EX TaqTMⅡ购自TaKaRa;引物合成由苏州金唯智生物科技有限公司完成。
1.2 试验方法
1.2.1 试验材料处理 谷子发育过程中的不同组织部位取材:选取谷子品种豫谷1号孕穗期的根、茎、叶、穗4个部位进行样品采集,锡箔纸包裹置于液氮速冻后,于-80 ℃保存。叶片的谷锈菌接种处理与取材:选取21 d(四-五叶期)长势一致的十里香和豫谷1号的幼苗,采用新鲜的谷锈菌单孢菌系93-5制备的孢子悬浮液(浓度为1.0×105个/mL)对幼苗进行喷雾接种,分别于接种后0,12,24,36,48,72,96,120 h 8个时间点剪取叶片,锡箔纸包裹置于液氮速冻后,于-80 ℃保存。
1.2.2 谷子SiWRKY03蛋白生物信息学分析 利用Phytozome植物基因组网站(https://phytozome.jgi.doe.gov/pz/portal.html)下载的谷子豫谷1号参考基因组(Setaria italica v2.2),查找SiWRKY03(基因ID:Seita.5G233100)的CDS序列与蛋白质序列。利用NCBI的Conserved Domain Database(https://www.ncbi.nlm.nih.gov/cdd)预测SiWRKY03蛋白质的结构域;利用ExPASy-ProtParam tool(https://web.expasy.org/protparam/)对SiWRKY03蛋白质的理化性质进行分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)软件预测SiWRKY03蛋白的二级、三级结构;将SiWRKY03蛋白质序列在NCBI 中进行Protein Blast比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi),按照相似性程度高低选择来自10个物种的WRKY03的同源基因的蛋白质序列,采用Clustal X 2.0进行多重序列比对,利用MEGA 6以邻近法(Bootstrap设为1 000)构建系统进化树,分析其亲缘关系的远近。
1.2.3 谷子中SiWRKY03的实时荧光定量PCR检测与分析 采用TRIzol试剂提取不同处理条件下取材的谷子样品的总RNA,按照cDNA第一链合成试剂盒的说明书反转录得到cDNA,作为Real-time PCR的模板。
根据SiWRKY03的CDS序列,采用Primer Premier 5.0设计Real-time PCR引物:SiWRKY03-F(5′-AGAGCCAGCTGAAGAAGGTG-3′)/SiWRKY03-R(5′-CTTCATGCTGCTGCACTTGT-3′);选用谷子肌动蛋白基因Actin(Seita.8G043100.1)作为内参,设计Real-time PCR引物:Actin-F(5′-CGCATATGTGGCT CTTGACT-3′)/Actin-R(5′-GGGCACCTAAATCTCTCT GC-3′)。Real-time PCR反应体系为20 μL :10 μL TB GreenTM Premix Ex TaqTMⅡ、0.8 μL上下游引物、2 μL cDNA模板和6.4 μL灭菌双蒸水。反应程序为:95 ℃预变性30 s;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸32 s,共40个循环收集荧光信号。每个反应重复3次,Ct值取平均值,采用2-ΔΔCt法计算基因在不同样品中的相对表达量(表达倍数的阈值设定为>2,<0.5)。
2 结果与分析
2.1 SiWRKY03蛋白的结构特征
SiWRKY03基因的CDS序列全长为1 137 bp,共编码378个氨基酸(图1)。195-251氨基酸序列(WRKYGQK)为WRKY转录因子的保守结构序列,是一个DNA结合结构域,能特异性的与目标基因启动子区域的(T)(T)TGAC(C/T)序列(Wob)结合,以调控基因表达,主要参与植物的抗病防御、衰老和根毛的发育。

下划线代表SiWRKY03蛋白的保守结构域。 The underline represents the conservative domain of SiWRKY03 protein.
图1 SiWRKY03的氨基酸序列
Fig.1 The amino acid sequences of SiWRKY03
2.2 SiWRKY03基因的生物信息学分析
2.2.1 SiWRKY03基因编码蛋白质的理化性质 利用在线ExPASy-ProtParam tool对SiWRKY03编码蛋白质的理化性质进行分析,预测蛋白质分子质量为39.73 ku,pI为5.91,平均疏水性系数为-0.498,属于亲水性蛋白质。SiWRKY03基因编码378个氨基酸,其中丙氨酸(Ala)含量最高(17.7%),天冬酰胺(Asn)、异亮氨酸(Ile)和色氨酸(Trp)含量最低(分别是1.1%),带负电荷氨基酸(天冬氨酸(Asp)+谷氨酸(Glu))有52个,带正电荷氨基酸(精氨酸(Arg)+赖氨酸(Lys))46个。
2.2.2 SiWRKY03编码蛋白的二级、三级结构预测 利用SOPMA软件对SiWRKY03编码的蛋白质进行二级结构预测(图2-A),发现该蛋白的二级结构中无规则卷曲(Random coil)占52.65%、α-螺旋(Alpha helix)占34.13%、延伸链(Extended strand)占6.88%、β-转角(Beta turn)占6.35%。由此可见,SiWRKY03蛋白质的最大结构元件是无规则卷曲,最小的元件为β-转角。运用SWISS-MODEL软件对SiWRKY03蛋白质的三级结构进行预测与显示(图2-B),并将结果与二级结构预测结果进行比对,结果较为一致。
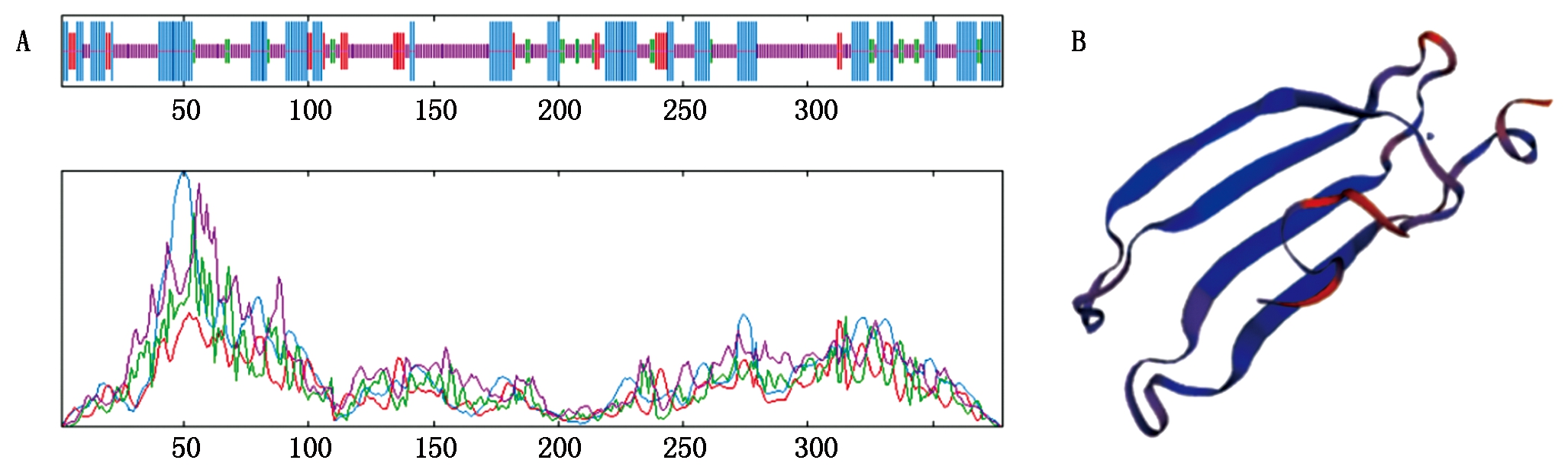
A.二级结构;B.三级结构。 A. Secondary structure; B.Tertiary structure.
图2 SiWRKY03蛋白的二级结构、三级结构预测
Fig.2 Secondary structure and tertiary structure prediction of SiWRKY03 protein
2.2.3 SiWRKY03同源性分析 把SiWRKY03编码的氨基酸序列在NCBI上进行Protein Blast比对,按照序列相似性程度选择了来自玉米、水稻、小麦、青稞、高粱、糜子、哈氏黍、二穗短柄草、Dichanthelium oligosanthes和大豆中的WRKY03同源基因的蛋白质序列构建系统进化树(图3)。结果表明,SiWRKY03与单子叶植物糜子(Panicum miliaceum,RLM93064.1)和哈氏黍(Panicum hallii,PAN29607.1)氨基酸序列的同源性最高(99%),其次是Dichanthelium oligosanthes(OEL17299.1),同源性为96%;与双子叶植物大豆(Glycine max,XP_003548638.1)同源性最低,仅为28%。
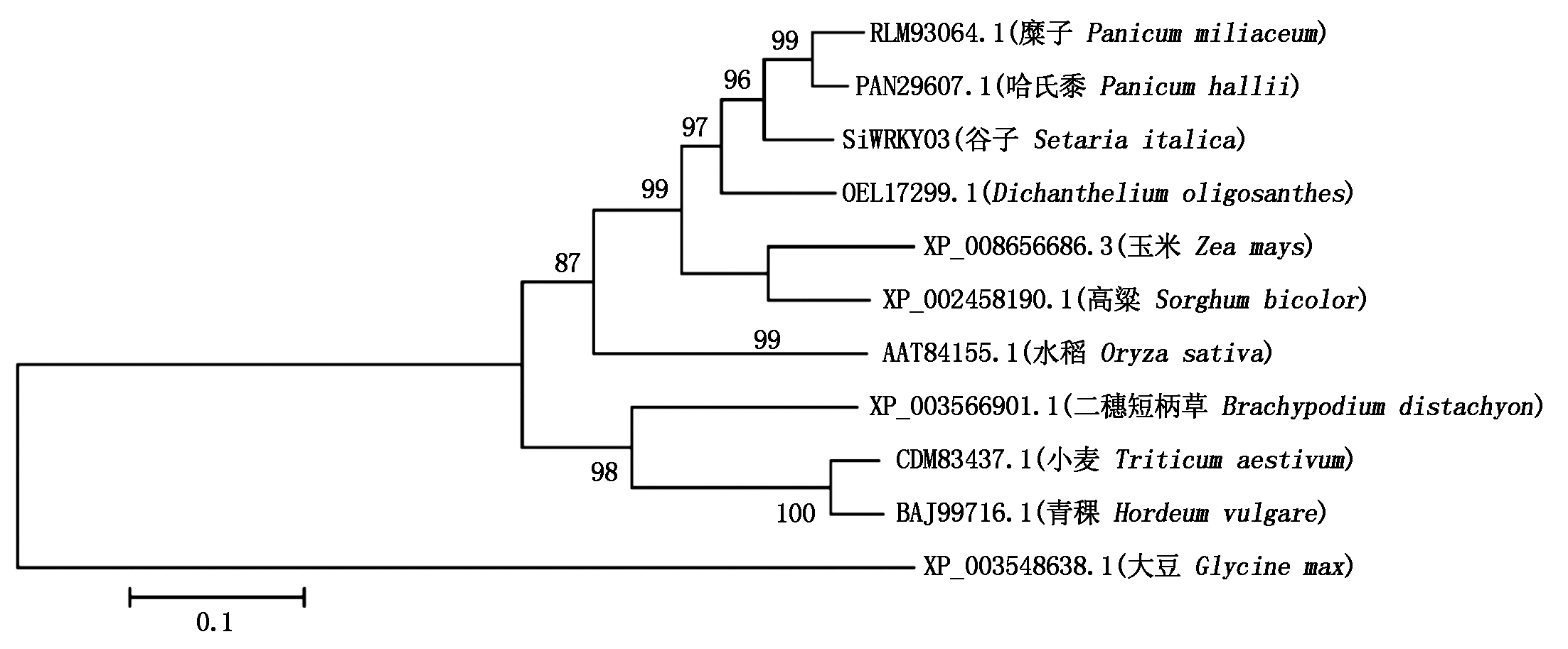
图3 SiWRKY03的系统进化树分析
Fig.3 The phylogenetic tree analysis of SiWRKY03
2.3 SiWRKY03基因的组织表达分析
为了解SiWRKY03基因在谷子不同组织部位中的表达情况,采用Real-time PCR技术检测了该基因在谷子豫谷1号孕穗期的根、茎、叶和穗4个部位的表达量。结果如图4所示,SiWRKY03在谷子孕穗期的根、茎、叶和穗中均有表达,但主要在根中表达,在其他组织部位中表达水平较低,穗部最低。其中,SiWRKY03在根中的表达量是茎的4.34倍,是叶的3.57倍,是穗的12.50倍。豫谷1号孕穗期根、茎、叶和穗部的转录组数据显示,SiWRKY03在根中的表达量最高,是其他3个部位表达量的5.81,3.80,5.99倍,与Real-time PCR结果基本一致。
2.4 生物胁迫下SiWRKY03基因的表达分析
采用Real-time PCR检测分析了SiWRKY03基因在谷子抗病材料十里香和感病材料豫谷1号接种谷锈菌后0,12,24,36,48,72,96,120 h的表达情况。结果如图5所示,SiWRKY03在抗病和感病2种反应中的表达模式不同。抗病反应中,SiWRKY03的表达量在12 h上调并达到最大表达量,是起始表达量的3.47倍。在36 h同样上调表达,表达量为起始表达量的2.16倍,其他时间点SiWRKY03的表达量无显著变化。在感病反应中,SiWRKY03的表达量在所有的时间点均未发生显著的变化。推测SiMYB003与抗病相关,且在抗病反应的早期起正调控作用。
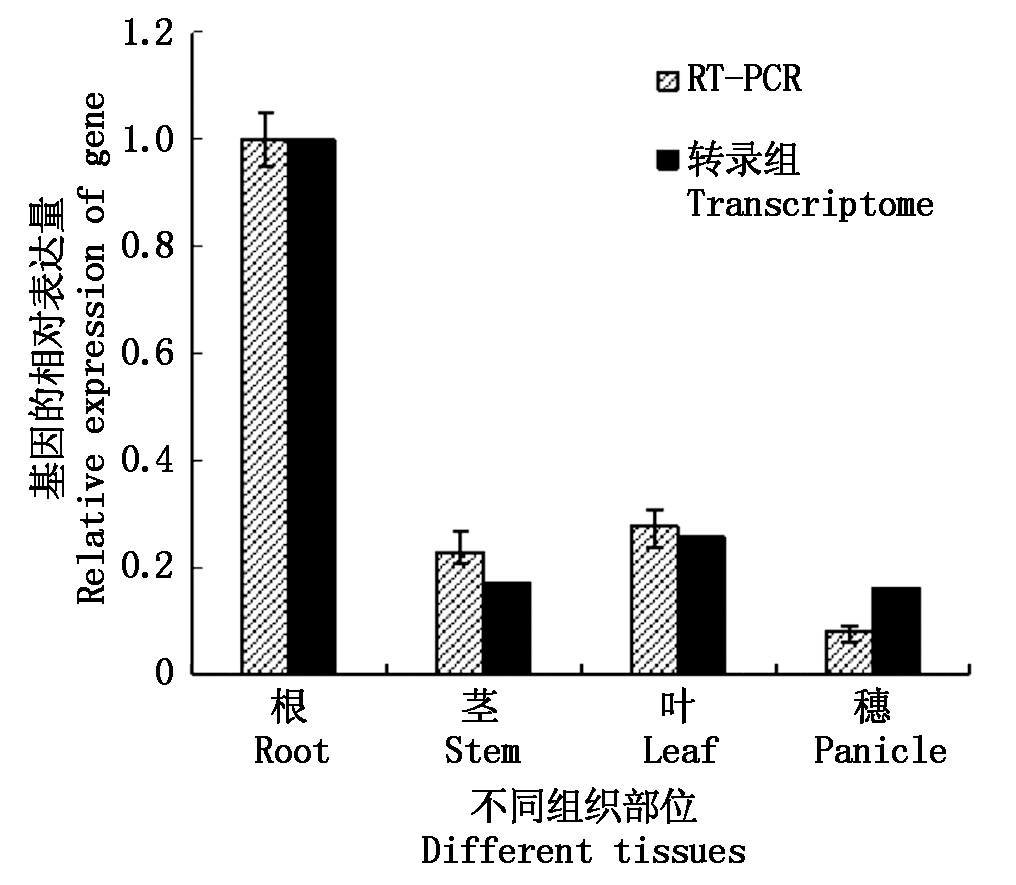
图4 SiWRKY03在谷子的不同组织部位的表达分析
Fig.4 Analysis of expression of SiWRKY03 gene at different tissue of foxtail millet
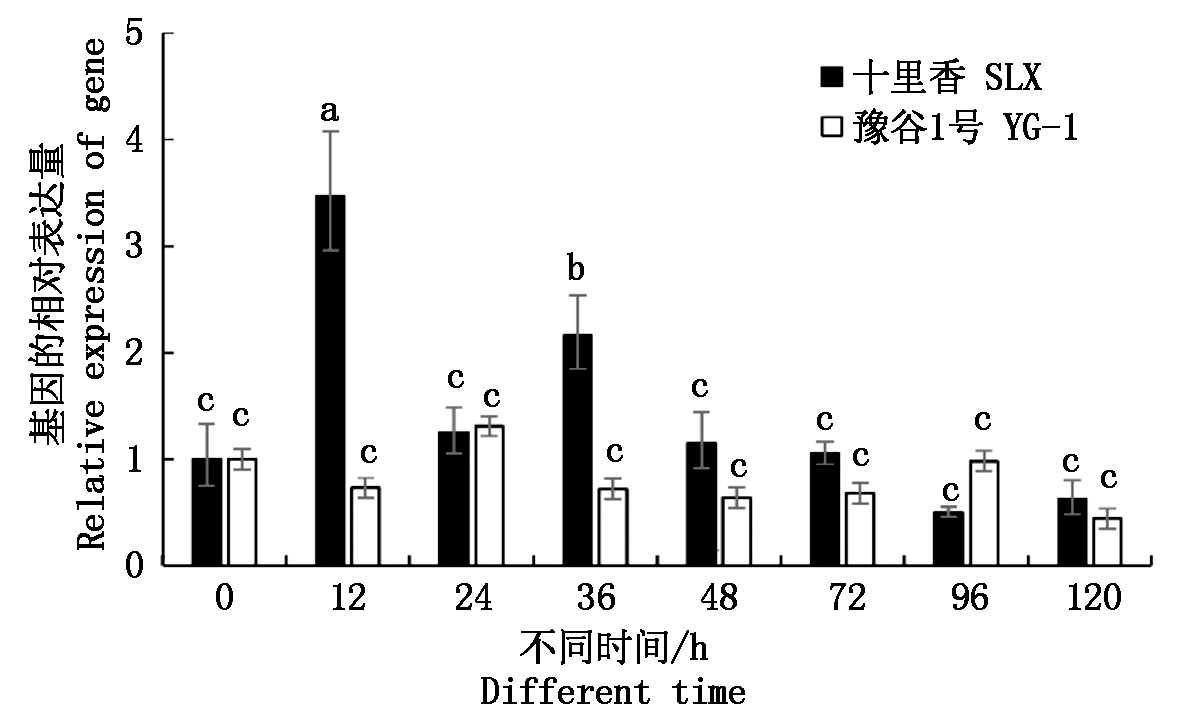
不同小写字母表示差异显著,P<0.05。 Different lowercase indicate significant different at 0.05 level.
图5 SiWRKY03在抗、感反应中不同时间点的表达模式分析
Fig.5 Analysis of expression patterns of SiWRKY03 genes in the reaction of resistance and susceptible at different time points
3 结论与讨论
本研究利用Real-time PCR分析SiWRKY03在豫谷1号中不同组织部位的表达情况,结果显示,在根、茎、叶和穗中均有表达,在根中表达量最高,推测其参与植株根部的发育过程。邢国芳等[26]采用生物信息学方法,对谷子基因组中WRKY家族进行鉴定与分析,得到103个WRKY转录因子,并对其在不同组织中的表达进行检测,结果发现,其中80个SiWRKY基因在根中的表达量很高;SiWRKY51和SiWRKY31在叶片中具有高表达量;SiWRKY86和SiWRKY87在茎中高表达;SiWRKY4、SiWRKY6、SiWRKY34、SiWRKY54、SiWRKY57和SiWRKY67在穗中特异性表达,说明WRKY家族基因具有组织表达特性。其中, SiWRKY03基因在根中特异性表达[26],与本研究结果一致,猜测SiWRKY03可能在根的生长发育中起到一定的作用。本试验结果对了解WRKY 转录因子的功能进一步积累了重要数据。
同样,本研究还分析了SiWRKY03在响应谷子抗谷锈菌胁迫反应中的表达情况。SiWRKY03在谷子十里香抗锈病反应中上调表达,在豫谷1号感锈病反应中表达量无显著变化,2种表达模式的不同提示基因可能与抗病相关,且为正调控因子。在其他物种中已有此基因的同源基因的相关研究,在水稻中的OsWRKY03超表达会导致OsNPR1以及其他几种病程相关基因(如OsPR1b、苯丙氨酸-氨解酶ZB8和过氧化物酶POX22.3)的表达量的提升,表明OsWRKY03对于水稻抗真菌是正调控因子[25];OsWRKY03在拟南芥中的同源基因AtWRKY29/22编码的蛋白,可以被MAP激酶信号级联途径激活,过表达可使植株对细菌和真菌产生抗性[24]。这2个研究结果与本试验结果一致,由此推断SiWRKY03基因在谷子抗锈病反应过程中起正调控作用,但抗病是一个复杂的过程,具体的作用机制有待进一步的研究。
[1] Ülker B, Somssich I E.WRKY transcription factors:from DNA binding towards biological function[J]. Current Opinion in Plant Biology,2004,7(5):491-498. doi:10.1016/j.pbi.2004.07.012.
[2] Ross C A, Liu Y, Shen Q J.The WRKY gene family in rice(Oryza sativa)[J]. Journal of Integrative Plant Biology,2007,49(6):827-842.doi:10.1111/j.1744-7909.2007.00504.x.
[3] Mangelsen E, Kilian J, Berendzen K W, Kolukisaoglu Ü H, Harter K, Jansson C, Wanke D. Phylogenetic and comparative gene expression analysis of barley(Hordeum vulgare) WRKY transcription factor family reveals putatively retained functions between monocots and dicots[J]. BMC Genomics, 2008, 9:194. doi:10.1186/1471-2164-9-194.
[4] Ling J, Jiang W J, Zhang Y, Yu H J, Mao Z C, Gu X F, Huang S W, Xie B Y.Genome-wide analysis of WRKY gene family in Cucumis sativus[J]. BMC Genomics,2011,12:471. doi:10.1186/1471-2164-12-471.
[5] Wei K F, Chen J, Chen Y F, Wu L J, Xie D X. Molecular phylogenetic and expression analysis of the complete WRKY transcription factor family in maize[J]. DNA Research :an International Journal for Rapid Publication of Reports on Genes and Genomes,2012,19(2):153-164. doi:10.1093/dnares/dsr048.
[6] Fan X Q, Guo Q, Xu P, Gong Y Y, Shu H M, Yang Y, Ni W C, Zhang X G, Shen X L. Transcriptome-wide identification of salt-responsive members of the WRKY gene family in Gossypium aridum[J]. PLoS One,2015,10(5):e0126148. doi:10.1371/journal.pone.0126148.
[7] 樊蕾, 高志英. 番茄SlWRKY44基因的克隆及表达[J]. 北方园艺, 2018(22):6-10. doi:10.11937/bfyy.20181435.
Fan L, Gao Z Y. Cloning and expression analysis of SlERKY44 gene in tomato[J]. Northern Horticulture, 2018(22):6-10.
[8] 刘自成, 苗丽丽, 王景一, 杨德龙, 毛新国, 景蕊莲. 普通小麦转录因子基因TaWRKY35的克隆及功能分析[J]. 中国农业科学, 2016, 49(12):2245-2254. doi:10.3864/j.issn.0578-1752.2016.12.001.
Liu Z C, Miao L L, Wang J Y, Yang D L, Mao X G, Jing R L. Cloning and characterization of transcription factor TaWRKY35 in wheat(Triticum aestivum) [J]. Scientia Agricultura Sinica, 2016,49(12):2245-2254.
[9] Eulgem T, Rushton P J, Robatzek S, Somssich I E.The WRKY superfamily of plant transcription factors[J]. Trends in Plant Science,2000,5(5):199-206. doi:10.1016/S1360-1385(00)01600-9.
[10] Rushton P J, Somssich I E, Ringler P, Shen Q J. WRKY transcription factors[J]. Trends in Plant Science,2010,15(5):247-258. doi:10.1016/j.tplants.2010.02.006.
[11] Johnson C S, Kolevski B, Smyth D R. TRANSPARENT TESTA GLABRA2, a trichome and seed coat development gene of Arabidopsis, encodes a WRKY transcription factor[J]. The Plant Cell,2002,14(6):1359-1375. doi:10.1105/tpc.001404.
[12] Robatzek S, Somssich I E. A new member of the Arabidopsis WRKY transcription factor family, AtWRKY6, is associated with both senescence-and defence-related processes[J]. The Plant Journal,2001,28(2):123-133. doi:10.1046/j.1365-313X.2001.01131.x.
[13] Jing S J, Zhou X, Song Y, Yu D Q. Heterologous expression of OsWRKY23 gene enhances pathogen defense and dark-induced leaf senescence in Arabidopsis[J]. Plant Growth Regulation,2009,58(2):181-190. doi:10.1007/s10725-009-9366-z.
[14] 徐文静, 缪刘杨, 李莉云, 刘钊, 刘雨萌, 江光怀, 杨凤环, 何晨阳, 刘国振. 五个WRKY转录因子在水稻叶片生长和抗病反应中的表达研究[J]. 生物化学与生物物理进展, 2013, 40(4):356-364. doi:10.3724/SP.J.1206.2012.00279.
Xu W J, Miao L Y, Li L Y, Liu Z, Liu Y M, Jiang G H, Yang F H, He C Y, Liu G Z. Characteristic expression analysis of five WRKY transcriptional factors in rice leaf growth and disease resistance reaction [J]. Progress in Biochemistry and Biophysics, 2013,40(4):356-364.
[15] Abbruscato P, Nepusz T, Mizzi L, Del Corvo M, Morandini P, Fumasoni I, Michel C, Paccanaro A, Guiderdoni E, Schaffrath U, Morel J B, Piffanelli P, Faivre-Rampant O. OsWRKY22, a monocot WRKY gene, plays a role in the resistance response to blast[J]. Molecular Plant Pathology,2012,13(8):828-841. doi:10.1111/j.1364-3703.2012.00795.x.
[16] Liu X Q, Bai X Q, Wang X J, Chu C C. OsWRKY71, a rice transcription factor, is involved in rice defense response[J]. Journal of Plant Physiology,2007,164(8):969-979. doi:10.1016/j.jplph.2006.07.006.
[17] Jiang Y J, Liang G, Yang S Z, Yu D Q.Arabidopsis WRKY57 functions as a node of convergence for jasmonic acid-and Auxin-mediated signaling in jasmonic acid-Induced leaf senescence[J]. The Plant Cell,2014,26(1):230-245. doi:10.1105/tpc.113.117838.
[18] Wang J J, Tao F, An F, Zou Y P, Tian W, Xu X M, Hu X P. Wheat transcription factor TaWRKY70 is positively involved in high-temperature seedling plant resistance to Puccinia striiformis f. sp. tritici[J]. Molecular Plant Pathology,2017,18(5):649-661. doi:10.1111/mpp.12425.
[19] Ciolkowski I, Wanke D, Birkenbihl R P, Somssich I E. Studies on DNA-binding selectivity of WRKY transcription factors lend structural clues into WRKY-domain function[J]. Plant Molecular Biology,2008,68(1-2):81-92.doi:10.1007/s11103-008-9353-1.
[20] Chujo T, Takai R, Akimoto-Tomiyama C, Ando S, Minami E, Nagamura Y, Kaku H, Shibuya N, Yasuda M, Nakashita H, Umemura K, Okada A, Okada K, Nojiri H, Yamane H. Involvement of the elicitor-induced gene OsWRKY53 in the expression of defense-related genes in rice[J]. Biochimica et Biophysica Acta,2007,1769(7-8):497-505. doi:10.1016/j.bbaexp.2007.04.006.
[21] 李南羿, 柴荣耀, 郭泽建. OsWRKY80基因参与调控水稻抗病反应研究[J]. 上海农业学报, 2009, 25(3):14-18. doi:10.3969/j.issn.1000-3924.2009.03.004.
Li N Y, Chai R Y, Guo Z J. The disease resistance of rice regulated by OsWRKY80 gene [J]. Acta Agriculturae Shanghai, 2009,25(3):14-18.
[22] Fu J Y, Liu Q, Wang C, Liang J, Liu L J, Wang Q. ZmWRKY79 positively regulates maize phytoalexin biosynthetic gene expression and is involved in stress response[J]. Journal of Experimental Botany, 2018, 69(3):497-510. doi:10.1093/jxb/erx436.
[23] 李志勇, 贾丽霞, 董立, 王楠, 白辉, 全建章, 刘磊, 董志平. 谷子十里香抗锈抑制消减杂交文库构建及初步分析[J]. 华北农学报, 2014, 29(6):126-130. doi:10.7668/hbnxb.2014.06.022.
Li Z Y, Jia L X, Dong L, Wang N, Bai H, Quan J Z, Liu L, Dong Z P. Construction and preliminary analysis of the SSH library from the foxtail millet rust resistant variety of Shilixiang [J]. Acta Agriculturae Boreali-sinica, 2014,29(6):126-130.
[24] Asai T, Tena G, Plotnikova J, Willmann M R, Chiu W L, Gomez-Gomez L, Boller T, Ausubel F M, Sheen J. MAP kinases signaling cascade in Arabidopsis innate immunity[J]. Nature,2002,415(6875):977-983. doi:10.1038/415977a.
[25] Liu X Q, Bai X Q, Qian Q, Wang X J, Chen M S, Chu C C. OsWRKY03, a rice transcriptional activator that functions in defense signaling pathway upstream of OsNPR1[J]. Cell Research,2005,15(8):593-603. doi:10.1038/sj.cr.7290329.
[26] 邢国芳, 张莉, 冯万军, 谢圣杰, 贾亚涛, 苑乂川, 陈小雨. 谷子WRKY转录因子基因家族分析[J]. 山西农业大学学报(自然科学版), 2016, 36(12):837-845. doi:10.3969/j.issn.1671-8151.2016.12.001.
Xing G F, Zhang L, Feng W J, Xie S J, Jia Y T, Yuan Y C, Chen X Y. Analysis of WRKY transcription gene family in foxtail millet [J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2016,36(12):837-845.
