棉花(Gossypium hirsutum L.)是世界范围内重要的经济作物之一,我国是世界最大的棉花生产国,新疆是全国最大的产棉区,棉花生产成为新疆经济产业支柱。植物的正常生长发育需要一个适度的盐分环境,盐分过高时植物会受到伤害,严重时甚至导致死亡[1]。土壤盐渍化是棉花生长发育、产量和品质提高的重要非生物胁迫因子之一。中国是盐渍土分布广泛的国家,中国的盐渍土面积约为1亿hm2,其中我国1亿多hm2耕地中就有600多万hm2盐渍化土壤,已严重制约中国经济发展和生态平衡,土壤盐渍化被认为是21世纪世界性农业问题,而提高棉花耐盐性是新疆棉花生产的迫切需要。
地壳中含量第二的硅(Si)元素是植物生长有益元素,可增强植物抗性,克服包括病、虫害等在内的生物或非生物胁迫[2]。大量研究表明,施用外源硅可提高盐胁迫下玉米、黄瓜、甘草叶片、柳树稷幼苗等的耐盐性[3-6],缓解盐胁迫损伤。目前,硅对盐胁迫下植物的影响多集中在对光合参数、抗氧化酶活性等研究上,例如陈罡等[7]研究表明,硅处理可有效缓解盐胁迫诱导的生长抑制,逆转叶绿素荧光参数变化,保护黄瓜幼苗光合器官结构和功能的完整,从而增强黄瓜的耐盐性。崔佳佳[8]研究表明,硅能提高盐胁迫下甘草叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等抗氧化系统酶活性,减轻活性氧及自由基对甘草叶片的毒害,缓解NaCl胁迫造成的膜脂过氧化伤害,提高其抗盐能力,促进正常生长。而外源硅对盐胁迫下棉花幼苗渗透调节系统及活性氧的影响报道较少,其作用机理还尚不清楚。为此,研究了不同硅、盐分处理对棉花幼苗生长、渗透调节系统、活性氧及丙二醛(MDA)的影响,初步探讨施用外源硅后棉苗渗透调节系统及活性氧对抗盐性的生理响应机制,为提高新疆棉花苗期生产耐盐性提供理论依据。
选用棉花品种新陆早45号(Gossypium hirsutum L.cv.Xinluzao 45)为供试材料,用总氮水平为5.0 mmol/L的Hoagland营养液,采用蛭石为介质的营养液培养。播种前选择均匀、饱满的种子晒种2 d,再用10%的过氧化氢消毒10 min,最后用蒸馏水冲洗干净。将种子以“品字形”播种在12 cm×12 cm的培养钵内,把培养钵置于长45 cm、宽33 cm、高20 cm的周转箱中,每个周转箱内放置15钵棉苗。出苗前用去离子水进行浇灌,当幼苗2片子叶完全展开后用营养液培养。出苗12 d后进行盐分(将对应浓度的NaCl用量加入营养液中)处理,18 d后进行抗盐硅(将对应浓度的Si用量加入营养液中)处理。从盐处理开始,每天早上浇去离子水,下午浇处理后的营养液。出苗60 d后每个重复选取4株棉苗,测定其生物量、根冠比、根系活力和渗透调节物质含量等。设置盐分(NaCl 分析纯:0,100,200 mmol/L)、硅(K2SiO3 分析纯:0,262.3 mg/L)2因子的随机组合,共6个处理,每处理重复3次,分别为:①CK:添加NaCl 0 mmol/L,加K2SiO3 0 mg/L;②100-0:添加NaCl 100 mmol/L,加K2SiO3 0 mg/L;③200-0:添加NaCl 200 mmol/L,加K2SiO3 0 mg/L;④0-1:添加NaCl 0 mmol/L,加K2SiO3 262.3 mg/L;⑤100-1:添加NaCl 100 mmol/L,加K2SiO3 262.3 mg/L;⑥200-1:添加NaCl 200 mmol/L,加K2SiO3 262.3 mg/L。
棉花出苗60 d后,每处理取4株,擦干水分后马上分器官测定鲜质量,然后在105 ℃下杀青30 min,80 ℃下烘干24 h至恒质量测定棉花幼苗生物量;根冠比按照根干质量占地上部干质量的百分比计算,即根冠比=(根干质量/地上部干质量)× 100%;根系活力测定采用氯化三苯基四氮唑法(TTC法)[9];可溶性糖(SS)含量采用蒽酮乙酸乙酯法[10]测定;游离脯氨酸(Pro)含量采用茚三酮法[11]测定;有机酸采用滴定法[12] 测定;游离氨基酸采用茚三酮比色法[13]测定;过氧化氢(H2O2) 含量采用二甲酚橙法[14]测定;氧自由基产生速率采用羟胺法[15]测定;电解质渗出率采用电导仪法[16]测定;丙二醛(MDA)含量采用硫代巴比妥酸法[17]测定。
数据分析用Microsoft Excel 2010软件,采用SPSS 19.0软件进行方差分析和差异显著性检验(Duncan法),使用Sigmaplot 12.5 软件绘图。
2.1.1 生物量 由表1可以看出,加硅与不加硅处理,盐胁迫对棉花幼苗叶片鲜质量、叶片干质量、茎鲜质量、茎干质量、根干质量和根冠比都产生了抑制,且不同浓度NaCl(0,100,200 mmol/L)胁迫对棉花幼苗生物量产生了不同程度抑制作用。而同浓度盐分处理下,加硅(即262.3 mg/L, K2SiO3)处理比不加硅处理棉花幼苗生物量均呈增加趋势,说明外源施硅能在一定程度上缓解盐分逆境对棉花幼苗生长的胁迫。
表1 硅对盐胁迫下棉花幼苗生物量的影响
Tab.1 Effect of silicon on biomass of cotton seedlings under salt stress
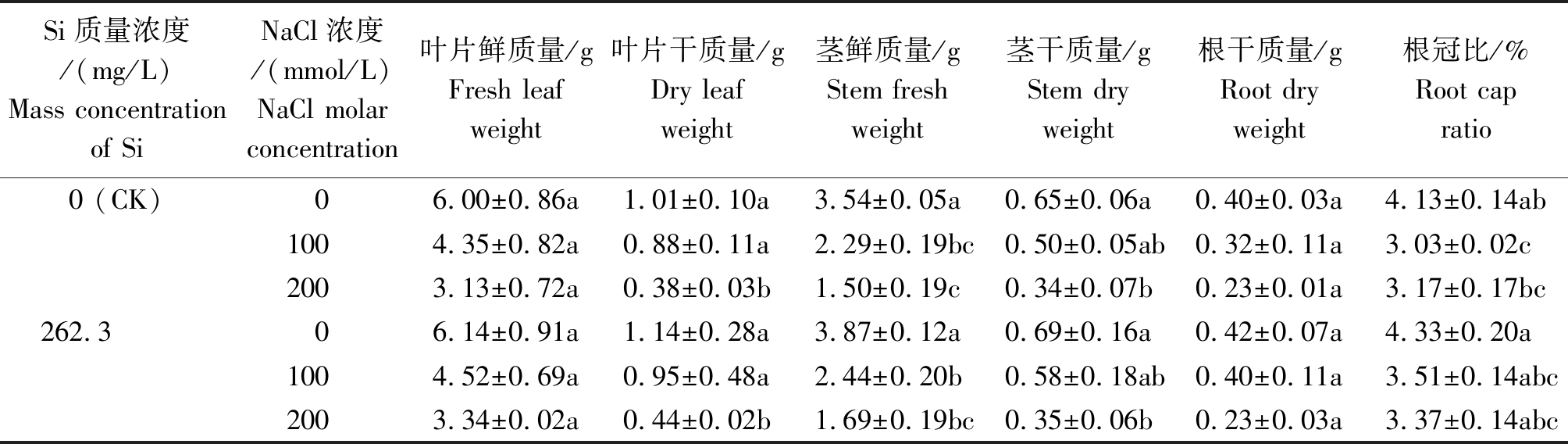
Si质量浓度/(mg/L)Mass concentration of SiNaCl浓度/(mmol/L)NaCl molar concentration叶片鲜质量/g Fresh leaf weight叶片干质量/gDry leaf weight茎鲜质量/gStem fresh weight茎干质量/gStem dry weight根干质量/g Root dry weight根冠比/%Root cap ratio0 (CK)06.00±0.86a1.01±0.10a3.54±0.05a0.65±0.06a0.40±0.03a4.13±0.14ab1004.35±0.82a0.88±0.11a2.29±0.19bc0.50±0.05ab0.32±0.11a3.03±0.02c2003.13±0.72a0.38±0.03b1.50±0.19c0.34±0.07b0.23±0.01a3.17±0.17bc262.306.14±0.91a1.14±0.28a3.87±0.12a0.69±0.16a0.42±0.07a4.33±0.20a1004.52±0.69a0.95±0.48a2.44±0.20b0.58±0.18ab0.40±0.11a3.51±0.14abc2003.34±0.02a0.44±0.02b1.69±0.19bc0.35±0.06b0.23±0.03a3.37±0.14abc
注:表中不同小写字母表示处理间差异达5%显著水平(P<0.05)。
Note:Different letter mean significant difference among treatments at the 5% level.
在加盐无硅的处理下,100,200 mmol/L盐分处理与CK相比,棉花叶片鲜质量分别下降了27.54%,47.95%;叶片干质量分别下降了12.78%,62.32%;茎鲜质量分别下降了35.22%,57.71%;茎干质量分别下降了22.22%,47.56%;根系干质量分别下降了21.20%,43.30%;根冠比分别下降了1.10,0.96百分点。在盐分浓度相同条件下,外源硅处理比对应盐浓度无硅处理棉苗叶片鲜质量分别增加了2.33%,3.91%,6.72%。棉苗叶片干质量、茎鲜质量、茎干质量、根干质量及根冠比亦是如此,外源硅处理比对应盐浓度无硅处理明显增大。
方差分析表明,棉花幼苗叶片鲜质量随盐分浓度升高而显著下降(P<0.05),而棉花幼苗叶片干质量、茎鲜质量、茎干质量和根冠比均极显著下降(P<0.01)。盐分与硅交互作用,棉花幼苗叶片干质量和茎鲜质量各处理间与CK差异极显著(P<0.01),棉苗茎干质量和根冠比各处理间差异显著(P<0.05)。
2.1.2 根系活力 如图1所示,加硅与不加硅处理下,棉花幼苗根系活力均表现为随着盐分浓度升高而显著下降(P<0.05)。加盐无硅处理中,100,200 mmol/L盐分处理根系活力比CK分别下降了28.92%,65.42%。而同浓度盐分处理中,加硅处理比不加硅处理棉苗根系活力升高,即0,100,200 mmol/L盐分处理,外源施硅处理比对应浓度不加硅处理根系活力分别升高了7.18%,37.16%,110.20%,说明外源施硅减缓盐分胁迫下棉花幼苗叶片根系活力的下降趋势,尤其是在200 mmol/L盐分处理下,外源硅处理可有效缓解盐胁迫下棉花叶片根系活力下降。盐分与硅交互作用方差分析表明,各处理间与CK差异达显著水平(P<0.05)。
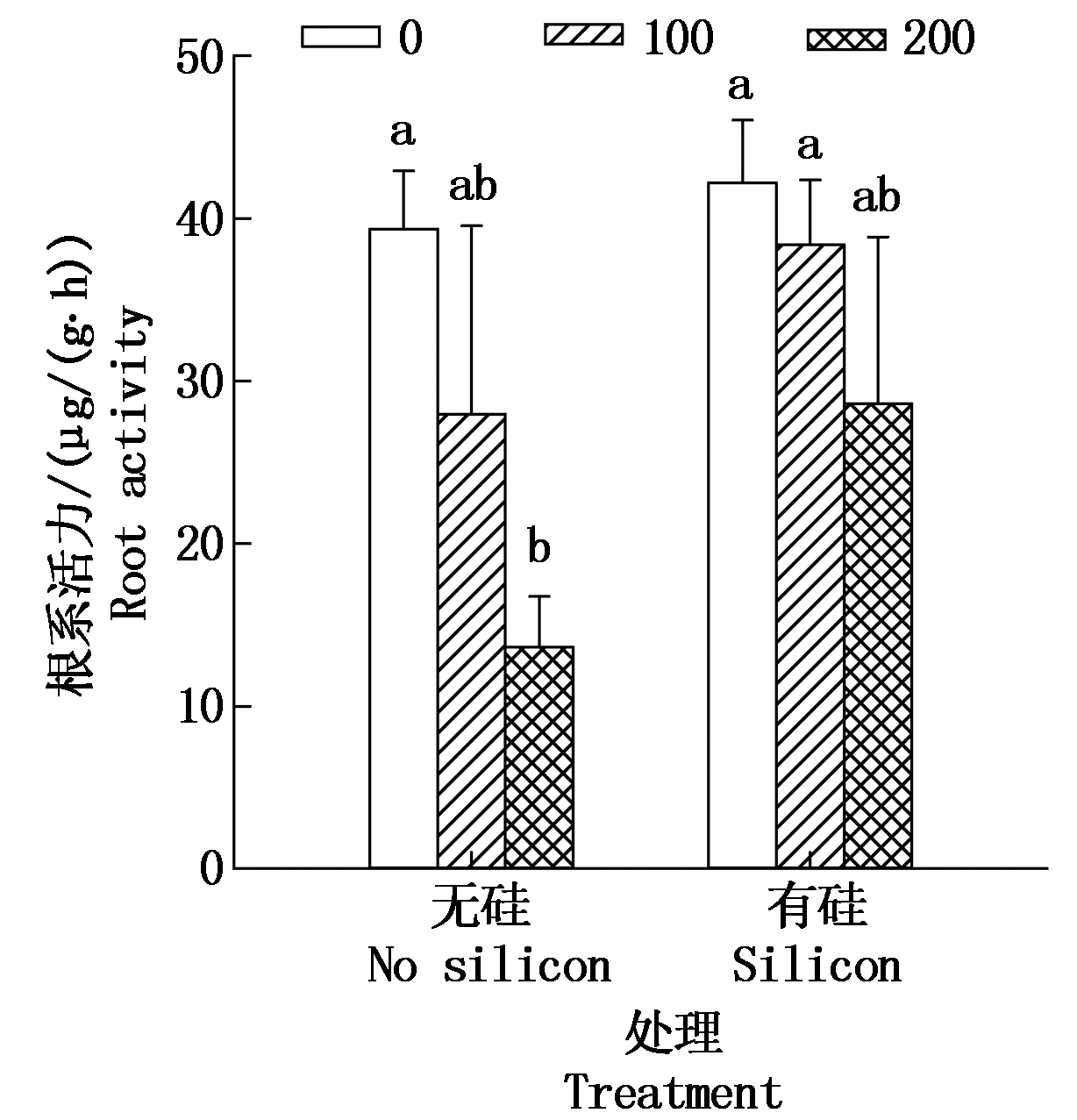
图中不同小写字母表示处理间差异达5% 显著水平(P<0.05)。图2-7同。 Different letter mean significant difference among treatments at the 5% level. The same as Tab.2-7.
图1 硅对盐胁迫下棉花幼苗根系活力的影响
Fig.1 Effect of silicon on root activity of cotton seedlings under salt stress
2.2.1 可溶性糖(SS)含量 由图2可知,加硅与不加硅处理,随着营养液中盐分浓度升高,棉花幼苗SS含量均表现为先增加后减少的趋势。加盐无硅处理与CK相比,100 mmol/L盐分处理棉苗SS含量升高了10.03%,200 mmol/L盐分处理棉苗SS含量下降了13.07%,但各加盐无硅处理与CK相比均差异不显著。而盐分浓度相同处理,加硅处理比对应盐浓度不加硅处理棉苗SS含量明显增多,如0,100,200 mmol/L盐分处理,外源施硅处理比对应盐浓度不施硅处理棉苗SS含量分别增加了8.42%,14.41%,18.73%。
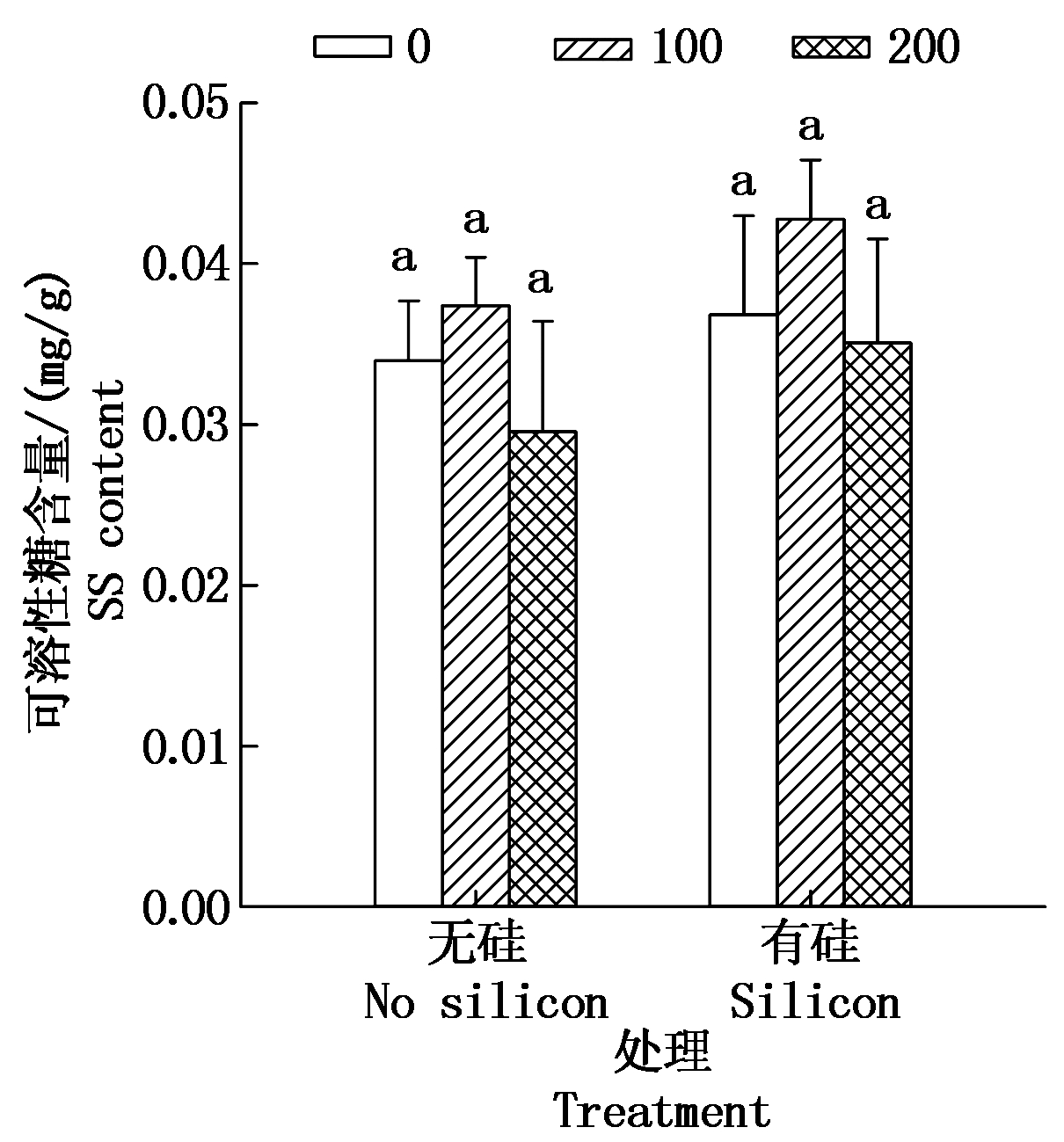
图2 硅对盐胁迫下棉花幼苗可溶性糖含量的影响
Fig.2 Effect of silicon on the content of SS in cotton seedlings under salt stress
2.2.2 游离脯氨酸(Pro)含量 从图3看,无硅各处理中,棉花幼苗Pro含量均随盐浓度升高而逐渐增长,施加外源硅后,各处理也表现出相同趋势。有盐无硅处理中,100,200 mmol/L盐分处理与CK相比,棉苗Pro含量分别增长了133.06%,389.69%,200 mmol/L盐分处理与CK间差异显著上升(P<0.05)。而相同浓度盐分处理下,如100,200 mmol/L盐分处理,外源硅处理比对应盐浓度不加硅处理棉苗Pro含量分别下降了17.60%,7.20%,加硅比对应盐浓度不加硅处理Pro含量明显减少,说明外源硅在一定程度上缓解了盐分胁迫下棉花叶片Pro含量的增长趋势。盐分与硅交互作用在各处理间差异显著(P<0.05)。
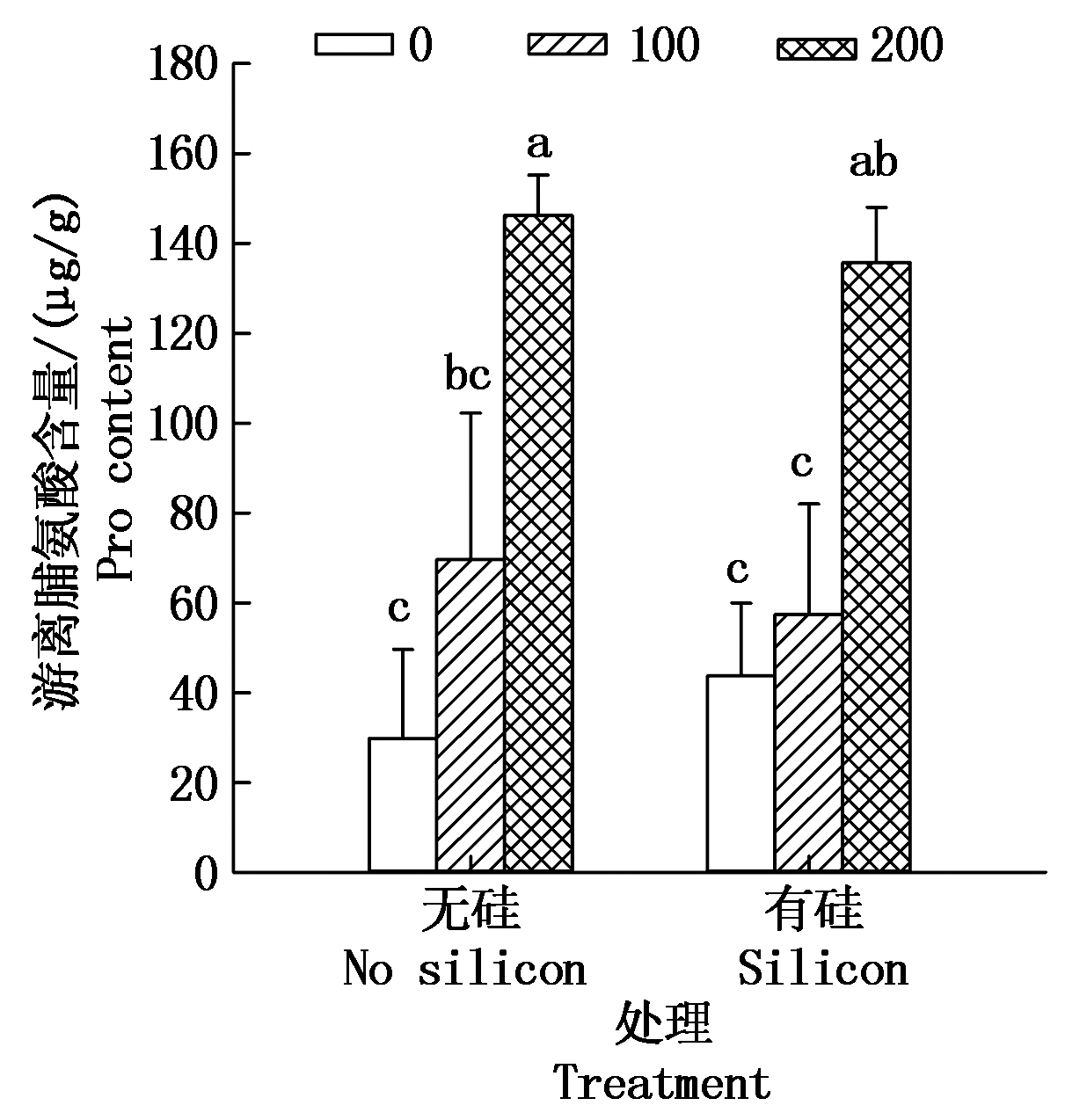
图3 硅对盐胁迫下棉花幼苗游离脯氨酸含量的影响
Fig.3 Effect of silicon on the content of Pro in cotton seedlings under salt stress
2.2.3 有机酸含量 由图4-A可以看出,加硅与不加硅处理,棉花幼苗苹果酸含量均呈现随着盐分浓度升高而下降的趋势。加盐无硅处理,即100,200 mmol/L盐分处理与CK相比,苹果酸含量分别下降了32.04%,41.03%,200 mmol/L盐分无硅处理与CK间差异不显著。而盐分浓度相同处理,加硅处理比对应盐浓度不加硅处理棉苗苹果酸含量均明显增加,即0,100,200 mmol/L盐分处理,外源加硅处理比对应盐浓度不加硅处理棉苗苹果酸含量分别增加了28.98%,3.72%,9.88%。
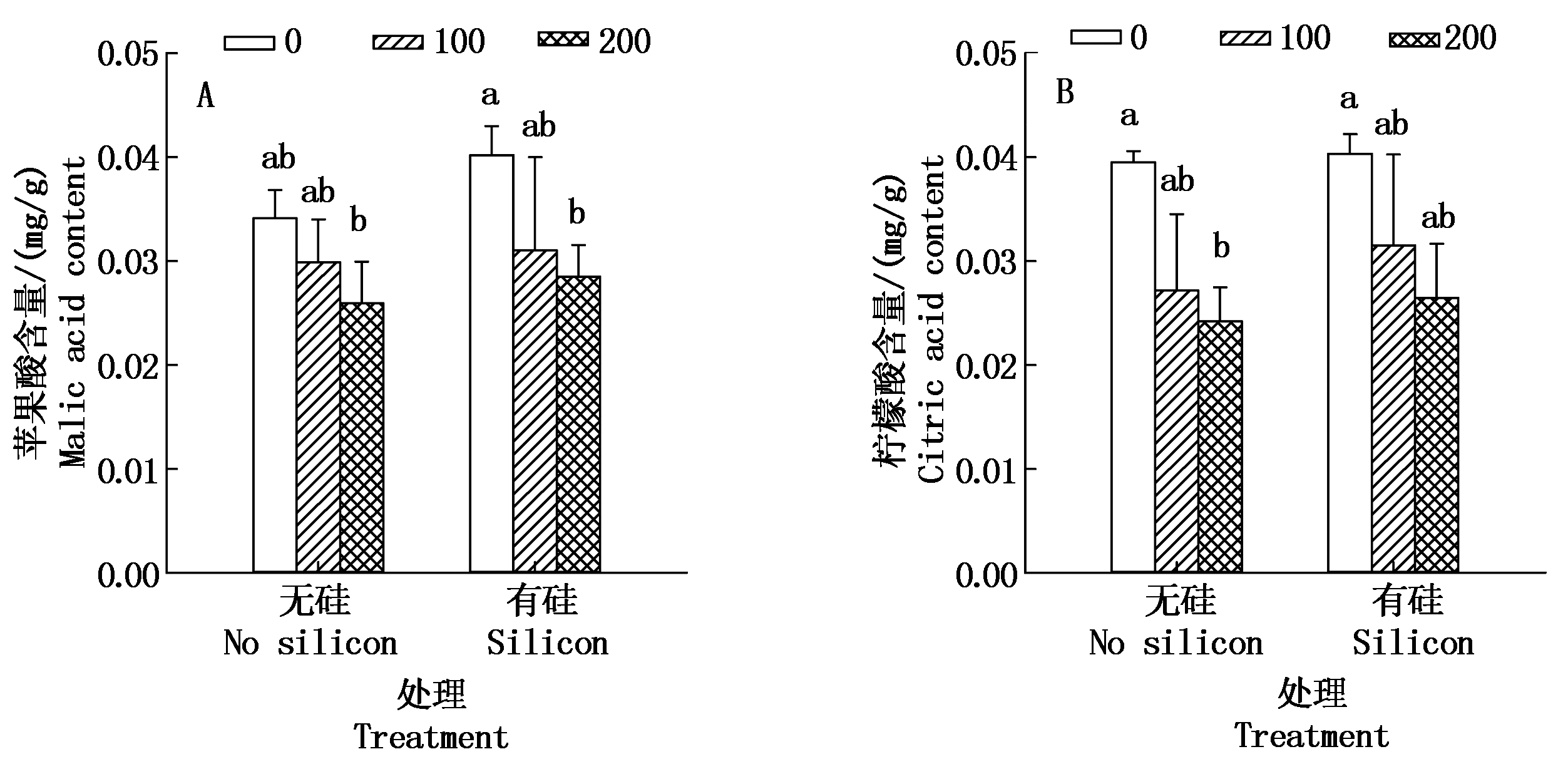
图4 硅对盐胁迫下棉花幼苗有机酸含量的影响
Fig.4 Effect of silicon on the content of organic acid in cotton seedlings under salt stress
由图4-B可知,棉花幼苗柠檬酸含量变化与苹果酸保持一致,也表现为随盐浓度升高而明显下降;同一盐分浓度处理下,加硅比不加硅柠檬酸含量增加。
2.2.4 游离氨基酸含量 如图5所示,无论是否添加外源硅处理,棉花幼苗游离氨基酸含量均表现为随盐分浓度升高,先增大后减小趋势。加盐无硅处理的棉苗游离氨基酸含量与CK相比,100 mmol/L盐分处理增大了19.95%,200 mmol/L盐分处理减小了18.70%,且处理间差异显著(P<0.05)。而相同浓度盐胁迫条件时,加硅比对应盐浓度不加硅处理棉苗游离氨基酸含量明显增加,即0,100,200 mmol/L盐分处理,外源加硅处理比对应盐浓度不加硅处理棉苗游离氨基酸含量分别增加了11.08%,11.53%,8.34%。方差分析表明,盐分与硅交互作用,各处理与CK差异达到极显著水平(P<0.01)。

图5 硅对盐胁迫下棉花幼苗游离氨基酸含量的影响
Fig.5 Effect of silicon on the free amino acid content of cotton seedlings under salt stress
由图6-A可以看出,无论是否施用外源硅,棉花幼苗体内过氧化氢(H2O2)含量均随着盐浓度增加而增加。在加盐无硅处理下,100,200 mmol/L盐分处理与CK相比,棉苗H2O2含量分别增加了52.2%,133.4%,200 mmol/L盐分无硅处理与CK间差异显著(P<0.05)。而同浓度盐分处理中,加硅处理比对应盐浓度不加硅处理棉苗H2O2含量减少,即0,100,200 mmol/L盐分处理,外源加硅处理比对应盐浓度不加硅处理H2O2含量分别下降了23.6%,22.6%,36.6%。方差分析表明,外源硅与盐分交互作用各处理间差异极显著(P<0.01)。
由图6-B可知,棉花幼苗氧自由基![]() 产生速率变化与H2O2保持一致,也表现为随盐浓度增加而增加。加盐无硅处理的棉苗
产生速率变化与H2O2保持一致,也表现为随盐浓度增加而增加。加盐无硅处理的棉苗![]() 产生速率与CK相比,100 mmol/L盐分处理增加了141.0%,200 mmol/L盐分处理增加了205.1%,显著增加(P<0.05)。而相同浓度盐分处理下,如0,100,200 mmol/L盐分处理,外源硅处理比对应盐浓度不加硅处理棉苗
产生速率与CK相比,100 mmol/L盐分处理增加了141.0%,200 mmol/L盐分处理增加了205.1%,显著增加(P<0.05)。而相同浓度盐分处理下,如0,100,200 mmol/L盐分处理,外源硅处理比对应盐浓度不加硅处理棉苗![]() 产生速率分别下降了69.2%,79.3%,23.0%,处理间差异显著(P<0.05),说明外源施硅能在一定程度上抑制盐胁迫下棉苗
产生速率分别下降了69.2%,79.3%,23.0%,处理间差异显著(P<0.05),说明外源施硅能在一定程度上抑制盐胁迫下棉苗![]() 的产生。方差分析表明,盐分与硅交互作用,各处理与CK差异达到极显著水平(P<0.01)。
的产生。方差分析表明,盐分与硅交互作用,各处理与CK差异达到极显著水平(P<0.01)。
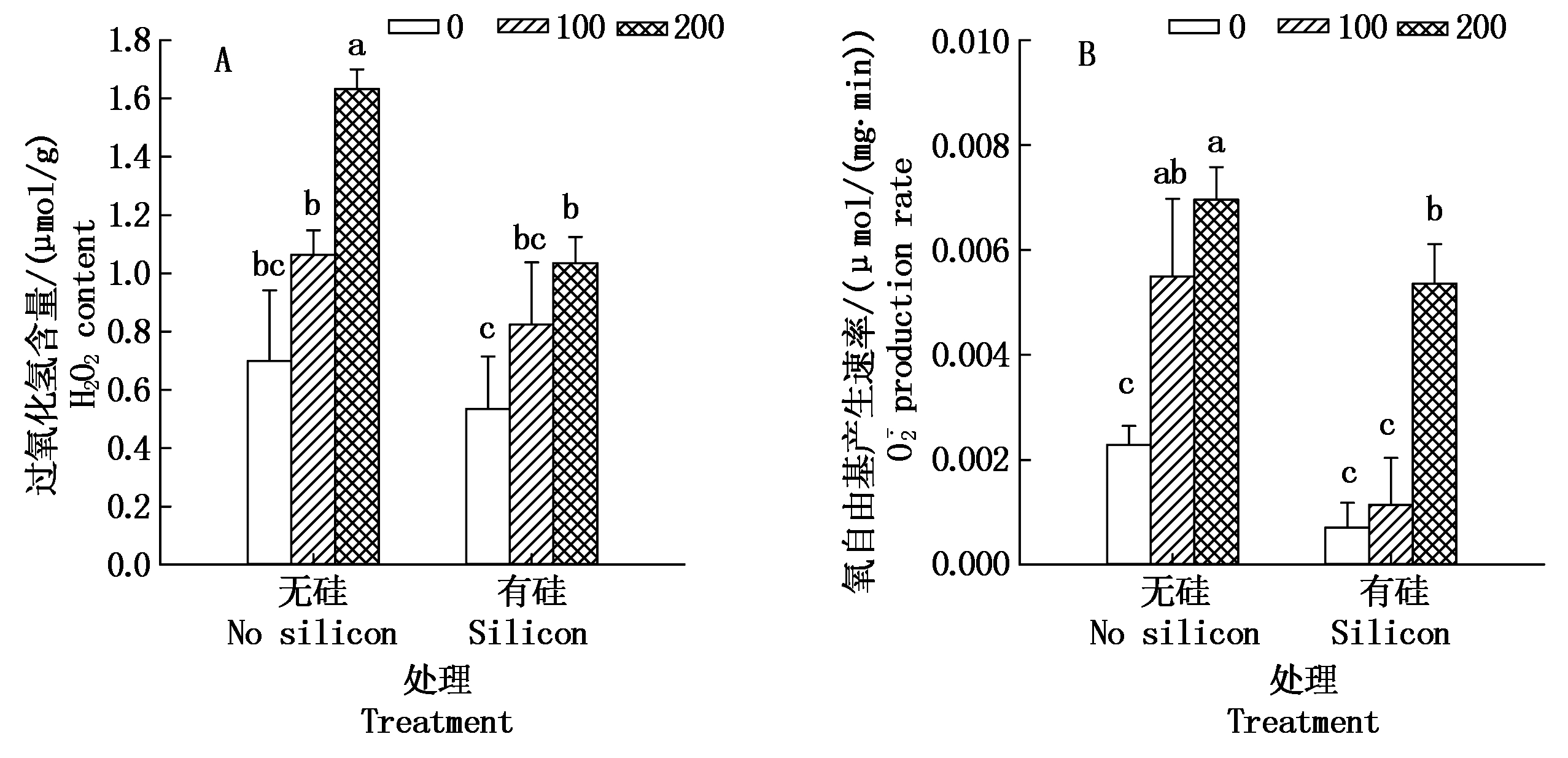
图6 盐胁迫下外源硅对棉花幼苗活性氧的影响
Fig.6 Effects of exogenous silicon on reactive oxygen in cotton seedlings under salt stress
由图7-A可知,加硅与不加硅处理,随着营养液中盐分浓度升高,棉花幼苗电解质渗出率均呈现上升趋势。加盐无硅处理与CK相比,100,200 mmol/L盐分处理棉苗电解质渗出率分别升高了7.66,29.66百分点,加盐无硅处理与CK间差异显著(P<0.05)。而同浓度盐分处理,加硅比对应盐浓度不加硅棉苗电解质渗出率呈下降趋势,如0,100,200 mmol/L盐分处理,外源施硅处理比对应盐浓度不施硅处理棉苗电解质渗出率分别减少了2.61,0.26,6.47百分点,说明外源硅在一定程度上缓解了盐胁迫下棉花叶片电解质渗出率的增长趋势。方差分析表明,外源硅与盐分交互作用各处理间差异极显著(P<0.01)。
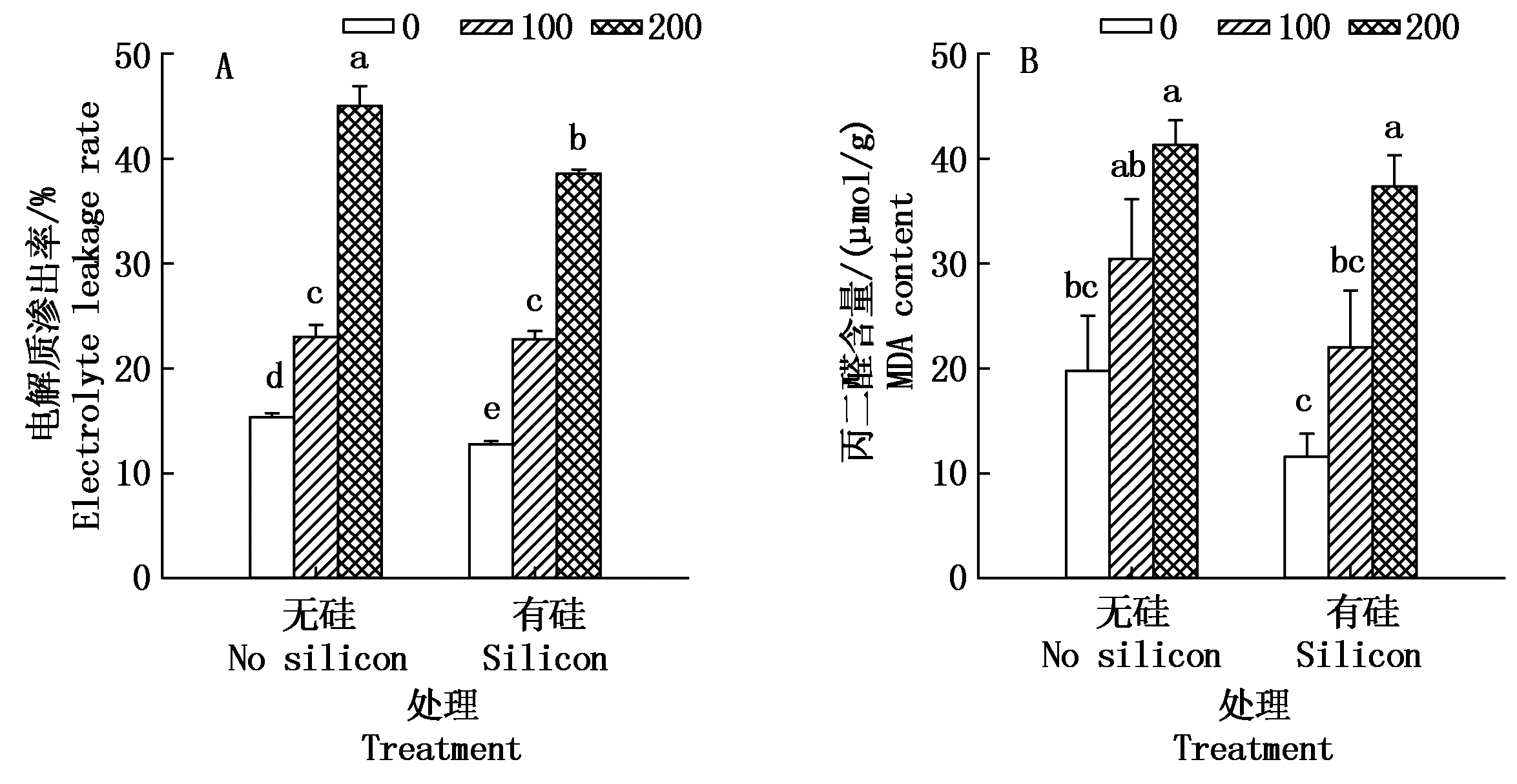
图7 盐胁迫下外源硅对棉花幼苗电解质渗出率和丙二醛含量的影响
Fig.7 Effects of exogenous silicon on the electrolyte leakage rate and the content of MDA of cotton seedlings under salt stress
由图7-B还可看出,棉花幼苗MDA含量变化与电解质渗出率保持一致,也表现为随盐浓度升高而呈现上升趋势。同一盐分浓度处理下,外源硅处理比对应盐浓度无硅处理棉苗MDA含量分别下降了41.2%,27.7%,9.6%。方差分析表明,盐分与硅交互作用,各处理与CK差异达到极显著水平(P<0.01)。
张梅等[18]研究表明,硅能缓解盐胁迫对棉苗根系的伤害,逆转盐胁迫下棉花幼苗生物量、根系活力下降趋势。本试验研究表明施加外源硅能显著提高棉苗茎鲜质量和根系活力,这与张梅等[18]研究结果一致。说明NaCl胁迫下产生的高浓度Na+毒害作用导致棉苗生长缓慢[19],代谢失调,而外源施硅能提高叶片中K+含量,降低Na+含量及Na+/K+比值[20],从而维持棉苗营养平衡,促进棉苗生长,缓解盐胁迫损伤。
本试验结果表明,加硅与不加硅处理,棉花幼苗SS含量均表现为随盐浓度升高先增加后减少的趋势,猜测这与棉苗遇盐后合成大量SS以维持渗透压避免失水或盐离子进入有关,而盐浓度越大这种恢复作用越小[21]。盐分浓度相同处理,加硅处理比对应盐浓度不加硅处理棉苗SS含量明显增多。而盐分浓度相同条件下,加硅比不加硅处理棉苗Pro含量明显减少,其原因可能是外源硅参与了细胞壁孔隙度调节,减少盐分进入机体[22],提高了棉苗对水分的利用,从而表现出Pro含量降低。施用外源硅棉苗苹果酸、柠檬酸含量明显增加,这与外源硅增强棉苗离子的吸收及硅对棉苗pH调节机制有关。棉花幼苗游离氨基酸含量随盐分浓度增大呈现出先升后降的变化规律,而相同盐浓度条件,外源硅处理后棉苗游离氨基酸含量增多。可能是低盐处理加快棉苗体内蛋白质分解,致使氨基酸积累过多,出现氨基酸含量升高趋势,但随着大量氨基酸转化为丁二胺等毒害物质,累积过多影响转氨酶活性,降低棉苗氨代谢,导致氨基酸含量大幅降低[23];而施硅处理后植物细胞液浓度升高,结合水比例升高,代谢相对减弱,蛋白质合成减慢,游离氨基酸逐渐积累。
王丽燕[24]研究结果表明,外源硅可以降低盐胁迫下野生大豆![]() 产生速率和H2O2含量。束良佐等[25]对玉米的研究表明,硅能使盐胁迫下玉米幼苗叶片
产生速率和H2O2含量。束良佐等[25]对玉米的研究表明,硅能使盐胁迫下玉米幼苗叶片![]() 产生速率显著下降,从而减轻盐胁迫对玉米幼苗的伤害。本试验研究结果表明,盐胁迫下棉苗H2O2含量和
产生速率显著下降,从而减轻盐胁迫对玉米幼苗的伤害。本试验研究结果表明,盐胁迫下棉苗H2O2含量和![]() 产生速率均随盐浓度增加而增加,而外源硅处理能显著降低棉苗H2O2含量和
产生速率均随盐浓度增加而增加,而外源硅处理能显著降低棉苗H2O2含量和![]() 产生速率。说明外源硅通过增强抗氧化酶活性和细胞内清除自由基能力,缓解了盐胁迫导致的膜脂过氧化伤害[24-25],促进棉花幼苗正常生长。
产生速率。说明外源硅通过增强抗氧化酶活性和细胞内清除自由基能力,缓解了盐胁迫导致的膜脂过氧化伤害[24-25],促进棉花幼苗正常生长。
张梅等[18]对棉花的研究表明,盐胁迫导致棉花叶片MDA含量增加,加硅处理显著降低盐胁迫下棉花叶片MDA含量。本试验结论与之基本相同,即盐胁迫下棉苗MDA含量随盐浓度增加而增加,外源硅处理减少了棉苗MDA含量。猜测与外源硅通过参与棉苗代谢活动减少体内MDA含量,降低了盐胁迫下脂质过氧化伤害有关。无硅条件下,棉苗电解质渗出率随盐浓度增加而增加,说明盐胁迫导致棉苗细胞膜透性增大,大量电解质外渗;外源硅条件下,棉苗电解质渗出率上升幅度显著下降,说明硅的添加能保护细胞膜,明显降低细胞膜透性,从而缓解盐胁迫对棉苗细胞造成的伤害。
综合本试验结果可知:盐胁迫导致棉苗生物量减少,渗透调节物质、H2O2、MDA含量、电解质渗出率和![]() 产生速率增加;而外源施硅后可减轻盐胁迫对棉苗损伤程度,促进正常生长,提高棉花苗期抗逆性。基于本研究结果推测,硅通过提高棉花幼苗叶片、茎秆、根冠比等生物量及根系活力和SS、有机酸、游离氨基酸等渗透调节物质含量,并降低Pro、H2O2、MDA含量、电解质渗出率和
产生速率增加;而外源施硅后可减轻盐胁迫对棉苗损伤程度,促进正常生长,提高棉花苗期抗逆性。基于本研究结果推测,硅通过提高棉花幼苗叶片、茎秆、根冠比等生物量及根系活力和SS、有机酸、游离氨基酸等渗透调节物质含量,并降低Pro、H2O2、MDA含量、电解质渗出率和![]() 产生速率以实现棉花耐盐性的提高。硅通过降低根系对 Na+、Cl-吸收,提高 K+/Na+ 比值是提高棉花耐盐性的另一机制。总之,硅对促进盐胁迫下棉花幼苗的生长发育具有显著作用,有助于新疆盐渍化地区实现减轻盐胁迫对棉花幼苗生长的威胁,达到棉花增产的目的。
产生速率以实现棉花耐盐性的提高。硅通过降低根系对 Na+、Cl-吸收,提高 K+/Na+ 比值是提高棉花耐盐性的另一机制。总之,硅对促进盐胁迫下棉花幼苗的生长发育具有显著作用,有助于新疆盐渍化地区实现减轻盐胁迫对棉花幼苗生长的威胁,达到棉花增产的目的。
[1] 胡华冉.盐碱胁迫对大麻种子萌芽和生长的影响[D].昆明:云南大学,2015.
Hu H R. Effects of saline-alkali stress on germination and growth of hemp seeds [D]. Kunming: Yunnan University, 2015.
[2] 郭振祥,华海霞.植物中的硅素营养[J].农家参谋,2018(16):87.
Guo Z X, Hua H X. Silicon nutrition in plants [J]. Farm Staff Officer, 2018(16): 87.
[3] 解明.外源硅对盐胁迫下玉米萌发及幼苗生长量影响[J].新疆农垦科技,2015,38(7):50-52.doi:10.3969/j.issn.1001-361X.2015.07.022.
Xie M. Effects of exogenous silicon on germination and seedling growth of maize under salt stress [J]. Xinjiang Agricultural Reclamation Science and Technology, 2015, 38(7): 50-52.
[4] 朱永兴. 硅对黄瓜幼苗盐胁迫损伤的缓解效应及机理研究[D].杨凌:西北农林科技大学,2016.
Zhu Y X. Study on mitigation effect and mechanism of silicon on salt stress damage of cucumber seedlings [D]. Yangling:Northwest University of Agriculture and Forestry Science and Technology, 2016.
[5] 解植彩,罗栋,张文晋,李月彤,高晓娟,张新慧.硅对盐胁迫下甘草叶片显微结构的影响[J].中药材,2016,39(12):2698-2701.doi:10.13863/j.issn1001-4454.2016.12.006.
Jie Z C, Luo D, Zhang W J, Li Y T, Gao X J, Zhang X H. Effect of silicon on microstructure of Glycyrrhiza uralensis fisch leaves under salt stress [J]. Journal of Chinese Medicinal Materias, 2016, 39(12): 2698-2701.
[6] 李菁.外源硅对盐胁迫下柳枝稷幼苗生理特性及生态化学计量学特征的影响[D].杨凌:西北农林科技大学,2016.
Li J. Effects of exogenous silicon on physiological and ecological chemometrics characteristics of switchgrass seedlings under salt stress [D].Yangling:Northwest University of Agriculture and Forestry Science and Technology, 2016.
[7] 陈罡,樊平声,冯伟民,管安琴,卢昱宇,万云龙.外源硅对盐胁迫下黄瓜幼苗生长和光合荧光特性的影响[J].江苏农业学报,2014,30(6):1402-1409.doi:10.3969/j.issn.1000-4440.2014.06.035.
Chen G, Fan P S, Feng W M, Guan A Q, Lu Y Y, Wan Y L. Effects of exogenous silicon on growth and characteristics of photosynthesis and chlorophyll fluorescence in cucumber seedlings under salt stress[J]. Jiangsu Journal of Agricultural Science, 2014, 30(6): 1402-1409.
[8] 崔佳佳.NaCl胁迫下外源Si调控甘草生长的生理生化机制研究[D].兰州:甘肃农业大学,2016.
Cui J J. Physiological and biochemical mechanisms of exogenous Si regulating the growth of Glycyrrhiza uralensis fisch under NaCl stress [D]. Lanzhou:Gansu Agricultural University, 2016.
[9] 高俊凤.植物生理学试验技术[M].西安:世界图书出版社, 2000,7:159-198.
Gao J F. Plant physiology experimental technology [M].Xi′an: World Book Press, 2000, 7: 159-198.
[10] 蔡庆生.植物生理学实验[M].北京:中国农业出版社,2013,2:175-177.
Cai Q S. Plant physiology experiment[M]. Beijing: China Agriculture Press, 2013, 2:175-177.
[11] 赵远伟.棉花幼苗根系对盐胁迫的响应及机制[D].保定:河北农业大学,2014.
Zhao Y W. Response and mechanism of cotton seedling roots to salt stress [D]. Baoding: Hebei Agricultural University, 2014.
[12] 雷成康,郭玲.山楂中有机酸含量测定方法的改进[J].中药材,2010,33(5):745-747.
Lei C K, Guo L. The improvement of the method of determination of organic acid in the mountain range[J]. Journal of Chinese Medicinal Materials, 2010, 33(5):745-747.
[13] 黄松,吴月娜,刘梅,赖小平.茚三酮比色法测定青天葵中总游离氨基酸的含量[J].中国中医药信息杂志,2010,17(12):50-52.doi:10.3969/j.issn.1005-5304.2010.12.021.
Huang S, Wu Y N, Liu M, Lai X P. Quantitative determination of total free-amino acid in Nervilia fordii(Hance) Schltr. by ninhydrin colorimetric method[J]. Chinese Journal of Information Traditional Chinese Medicine, 2010, 17(12): 50-52.
[14] 李忠光,宋玉泉,龚明.二甲酚橙法用于测定植物组织中的过氧化氢[J].云南师范大学学报(自然科学版),2007,27(3):50-54.doi:10.3969/j.issn.1007-9793.2007.03.012.
Li Z G, Song Y Q, Gong M. Xylenol orange method used for the determination of hydrogen peroxide in plant tissue[J]. Journal of Yunnan Normal University(Natural Sciences Edition), 2007, 27(3): 50-54.
[15] 王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990(6):55-57.
Wang A G,Luo G H. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants [J].Plant Physiology Communications,1990(6):55-57.
[16] 陈爱葵,韩瑞宏,李东洋,凌连莲,罗惠霞,唐上剑.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,30(5):88-91.doi:10.3969/j.issn.1007-8754.2010.05.016.
Chen A K, Han R H, Li D Y, Ling L L, Luo H X, Tang S J. A comparative of two methods for electrical conductivity about plant leaves [J]. Journal of Guangdong Institute of Education, 2010, 30(5): 88-91.
[17] Rezai S, Orojloo M, Bidabadi S S,Soleimanzadeh M. Possible role of methyl jasmonate in protection to NaCl-induced salt stress in pepper cv.″Green hashemi″[J].International Journal of Agriculture and Crop Sciences,2013, 6(17) :1235-1238.
[18] 张梅,李泽剑,唐诚,褚贵新.硅、硒、黄腐酸、氯甲基吡啶组合对棉花生长及抗盐生理特性的影响[J].生态环境学报,2016,25(10):1671-1677.doi:10.16258/j.cnki.1674-5906.2016.10.011.
Zhang M, Li Z J, Tang C, Chu G X. Influences of the combination using of silicon, selenium, fulvic acid nitrapyrin on cotton growth and cotton plant salt-resistant physiological characteristics[J]. Ecology and Environment Sciences, 2016, 25(10):1671-1677.
[19] 王宁,杨杰,黄群,苏桂兰,周红,许庆华,董合林,严根土.盐胁迫下棉花K+和Na+离子转运的耐盐性生理机制[J].棉花学报,2015,27(3):208-215.doi:10.11963/issn.1002-7807.201503003.
Wang N, Yang J, Huang Q, Su G L, Zhou H, Xu Q H, Dong H L, Yan G T. Physiological salinity tolerance mechanism for transport of K+ and Na+ lons in cotton(Gossypium hirsutum L.)seedling under salt stress [J]. Cotton Science, 2015, 27(3): 208-215.
[20] 顾跃,赵云,姬承东.硅肥对盐胁迫下狗牙根生理生化特征的影响[J].中国草地学报,2019,41(3):30-37.doi:10.16742/j.zgcdxb.20180185.
Gu Y, Zhao Y, Ji C D. Effects of silicon fertilizer on physiological and biochemical characteristics three bermucla grass under salinity stress [J]. Chinese Journal of Grassland, 2019, 41(3):30-37.
[21] 刘金定,朱召勇,樊宝香.棉花品种在不同浓度盐胁迫下的生理表现[J].中国棉花, 1995,22(9):16-17.
Liu J D, Zhu Z Y, Fan B X. Physiological performance of cotton varieties under different concentrations of salt stress [J]. Chinese Cotton, 1995,22(9): 16-17.
[22] 白桦,王玉国.外源脯氨酸对盐胁迫下大豆愈伤组织蛋白质含量的影响[J].山西农业大学学报(自然科学版),2002,22(3):193-195.doi:10.3969/j.issn.1671-8151.2002.03.002.
Bai H, Wang Y G. Effect of exogenous proline on protein content of soybean callus under salt stress [J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2002,22(3): 193-195.
[23] 王涛.盐胁迫诱导棉花早衰机理研究[D].济南:山东师范大学,2014.
Wang T. Study on the mechanism of premature senescence of cotton induced by salt stress [D]. Jinan: Shandong Normal University, 2014.
[24] 王丽燕.硅对野生大豆幼苗耐盐性的影响及其机制研究[J].大豆科学,2013,32(5):659-663.
Wang L Y. Effects of silicon on salt tolerance of Glycine soja seedlings and its mechanism[J].Soybean Science,2013, 32(5):659-663.
[25] 束良佐,刘英慧.硅对盐胁迫下玉米幼苗叶片膜脂过氧化和保护系统的影响[J].厦门大学学报(自然科学版),2001,40(6):1295-1300.doi:10.3321/j.issn:0438-0479.2001.06.022.
Shu L Z, Liu Y H. Effects of silicon on membrane lipid peroxidation and protective system in the leaves of maize seedlings under salt stress [J]. Journal of Xiamen University(Natural Science Edition), 2001, 40(6): 1295-1300.