苹果品种结构不合理是影响我国苹果产业可持续发展的一个重要因素,提高早熟品种所占比例,是苹果产业发展的必然。限制早熟苹果品种在生产中广泛应用的一个重要因素是早熟品种果实容易软化、货架期短。有关苹果果实软化的研究,历来是苹果研究中重要的热点领域。齐秀东等[1-2]以嘎拉、富士、金冠苹果为试材,分析了果实发育软化过程细胞壁组分、细胞壁酶活性及其基因表达的变化。陈学森等[3]以乔纳金及其脆肉株变为试材,比较分析了果实发育后期果实软化相关基因的表达差异,李宏建等[4]研究了岳帅苹果贮藏软化过程中果实酶活性及理化性状的变化。以上分析显示果实软化的研究以中晚熟品种为试材的较多,刘超超等[5]研究了泰山早霞、辽伏、极早红等3个早熟品种果实软化过程中硬度、乙烯、酶活性间的关系。
藤木1号是一个优良早熟苹果品种,在我国已有一定的栽培面积,XU2-5是河北农业大学选育出早熟苹果新品系,具有成熟期早、果个适中、果形端正、色泽鲜艳等优点。本试验通过测定藤木1号、XU2-5果实成熟过程中果实硬度、乙烯释放速率及相关基因表达等指标的变化,探明藤木1号、XU2-5果实软化的原因,以期为延长果实贮藏期,保持其品质提供依据。
1 材料和方法
1.1 试材及采样
试验于2016-2017年在河北省保定市顺平县南神南村河北农业大学苹果示范园中进行,供试材料为7~8 a生的早熟品种(系)XU2-5、藤木1号,中间砧为SH40,基砧为八棱海棠,树形为细长纺锤形,株行距为2 m×4 m,树势生长健壮,常规管理。
每个品种(系)选择生长结果一致的3棵树,自盛花后80~100 d,每隔5 d取样1次,共计5次。各品种(系)每次每株从树冠外围到内膛随机选取大小均匀、无损伤的10个果实,共30个果实。采后立即运回实验室备用。
1.2 试验方法
1.2.1 乙烯释放速率的测定 将苹果果实置于干燥器中,静置密封6 h后收集乙烯气体,医用注射器抽取1 mL气体保存备用,每个重复测定3次。
采用FULI-9790II 气相色谱仪进行测定,色谱条件为:色谱柱采用不锈钢填充柱;氢火焰离子化检测器;柱箱温度90 ℃,汽化室温度140 ℃,载气流速分别为N2:120 mL/min(0.12 MPa),H2:100 mL/min(0.1 MPa),合成空气:100 mL/min(0.1 MPa),进样量为1 mL。
1.2.2 硬度的测定 采用GY-1型果实硬度计测定,在果实表面选择对称的4个面,去皮,取4个面的平均值,单位kg/cm2。
1.2.3 酶活性的测定 取 2 g 样品,用 6 mL 酶提取液(6% NaCl,内含0.6% EDTA,1% PVP) 匀浆。然后再 10 000 r/min 离心 20 min,上清液即为粗酶提取液,待用。
多聚半乳糖醛酸酶(PG)及果胶甲酯酶(PE)活性测定采用薛应龙[6]的方法。脂氧合酶活性(LOX)的测定参照陈昆松等[7]的方法。
1.2.4 MdACS、MdPG、MdPE、MdLOX基因相对表达量测定 采用天根生物科技有限公司的试剂盒提取果实样品总RNA,引用文献中给出的MdPG1、MdPE、MdACS6、MdLOX引物[8-11](表 1),用全式金逆转录试剂盒合成各基因的cDNA 第一链后,在多重Real-time荧光定量PCR仪下进行各基因的相对表达量的测定。以Actin为内参基因。重复3 次。
采用2-ΔΔCT法对数据进行相对定量分析。
2 结果与分析
2.1 果实硬度的变化
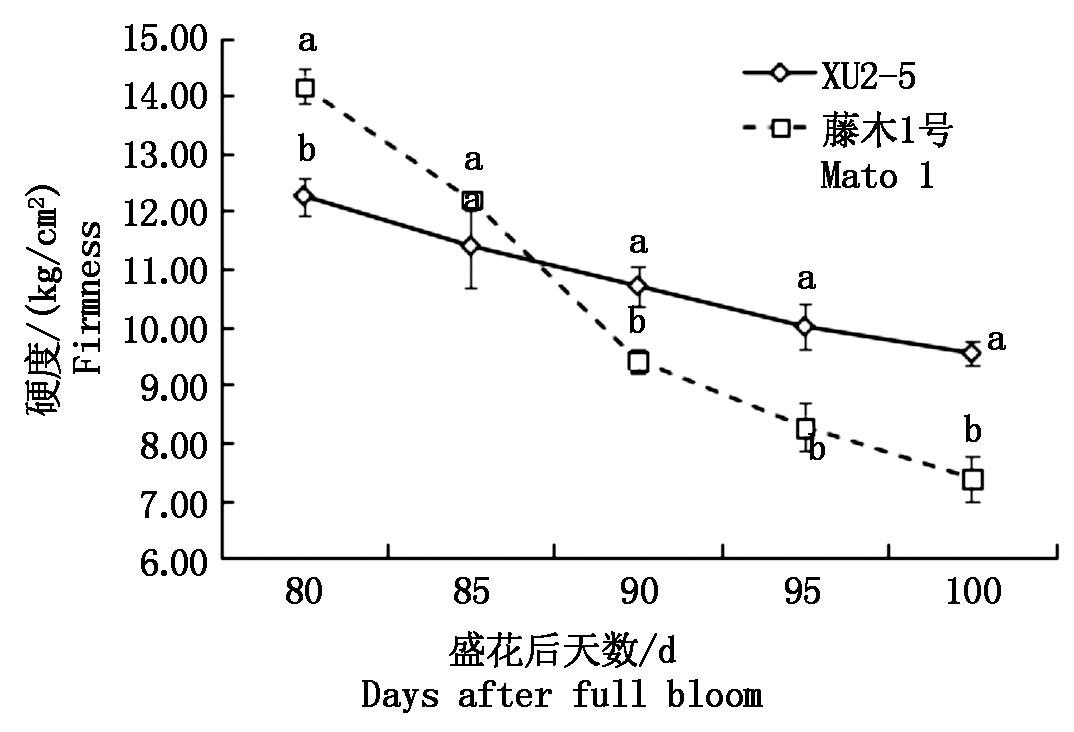
随着果实发育成熟,2个品种(系)果实硬度均呈现降低的趋势,但各品种(系)间下降幅度及速率存在差异(图1)。花后80 d,藤木1号果实硬度最高,为14.15 kg/cm2,到花后100 d硬度最低,仅为7.38 kg/cm2,其硬度下降了47.84%。而XU2-5花后80~100 d,果实硬度变化幅度较小,仅降低了22.19%。花后100 d,XU2-5的果实硬度显著高于藤木1号的果实硬度(P<0.05)。
表1 Real-time PCR 引物序列
Tab.1 Nucleotide sequences of primers in Real-time PCR

基因名称Gene引物序列 Primer sequence正向序列(5′-3′)Forward sequence(5′-3′)反向序列(5′-3′)Reverse sequence(5′-3′)MdPG1CGCACAACAAATCCATGTCATATACCGTGAGACAGGAAGCTTGAMdPEGCTGCCGCCGTGTTCCAAAACCCGAGGGAGAACGCCTGTCGMdLOXAGCGACAAGAAAGAAGAACCTACTGACCGTAGTTGATTGC MdACS6AGTGGATTAATTCGCTCTTATGGTGGAACATCCTCTGGAGTCAAAGTAGActinGGATTTGCTGGTGATGATGCTAGTTGCTCACTATGCCGTGCT
不同小写字母表示在P<0.05水平上差异显著。图2-9同。 Different lowercase letters mean significant difference at 0.05 level.The same as Fig.2-9.
图1 两个品种(系)成熟过程中果实硬度的变化
Fig.1 Changes in firmness of two varieties during the ripening process
2.2 乙烯释放速率及MdACS6基因表达变化
如图2所示,供试2个品种(系)的乙烯释放速率(以鲜质量计)随着果实成熟总体呈现增长的趋势,但2个品种(系)间存在差异。藤木1号的乙烯释放速率在花后95 d出现明显的高峰,此时藤木1号的乙烯释放速率显著高于XU2-5。XU2-5的乙烯释放速率前期缓慢增加,在花后90~100 d迅速升高,乙烯释放速率增加了36.97 nL/(h·g)。花后80~100 d,藤木1号乙烯释放速率显著高于XU2-5。
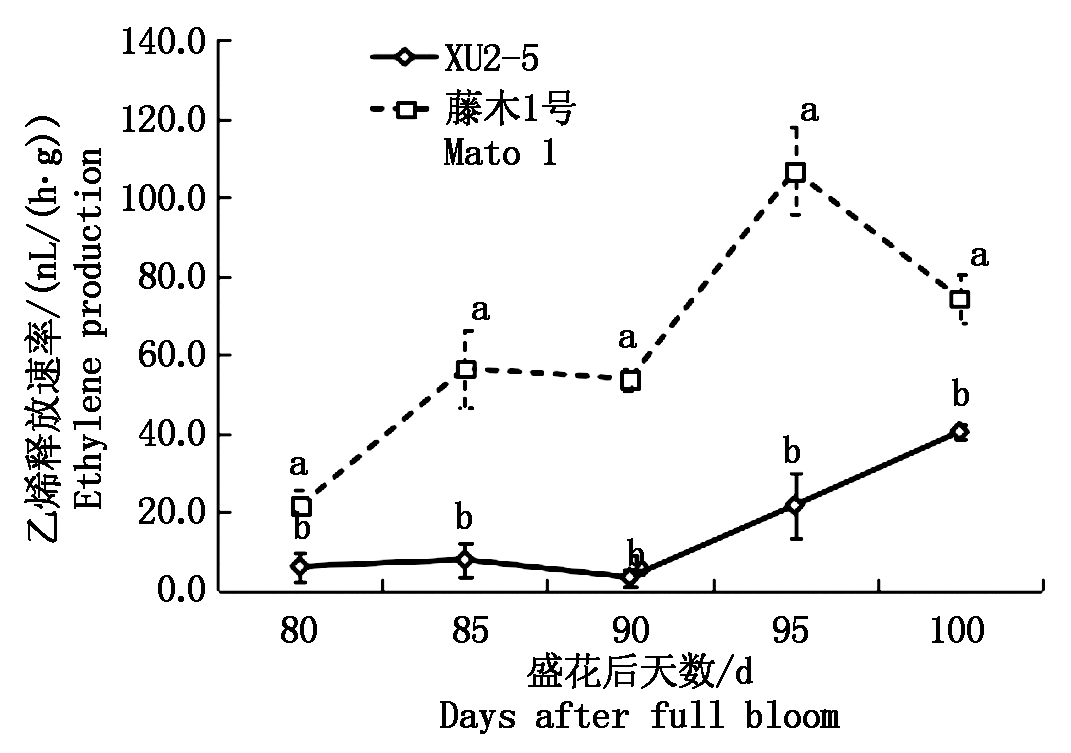
图2 两个品种成熟过程中乙烯释放速率的变化
Fig.2 Changes of ethylene production during the ripening process
XU2-5和藤木1号的MdACS6基因相对表达量变化基本一致(图3),前期基因相对表达量较低,之后相对表达量逐渐升高。花后80,90,95 d藤木1号的MdACS6基因相对表达量均显著高于XU2-5,花后85,100 d虽然藤木1号的MdACS6基因相对表达量高于XU2-5,但未达显著水平。
对比两品种(系)果实的乙烯释放速率与MdACS6基因相对表达量,结果显示二者总体趋势相一致,藤木1号在花后95 d、XU2-5在花后100 d乙烯释放速率较高,而且MdACS6基因相对表达量也相对较高。
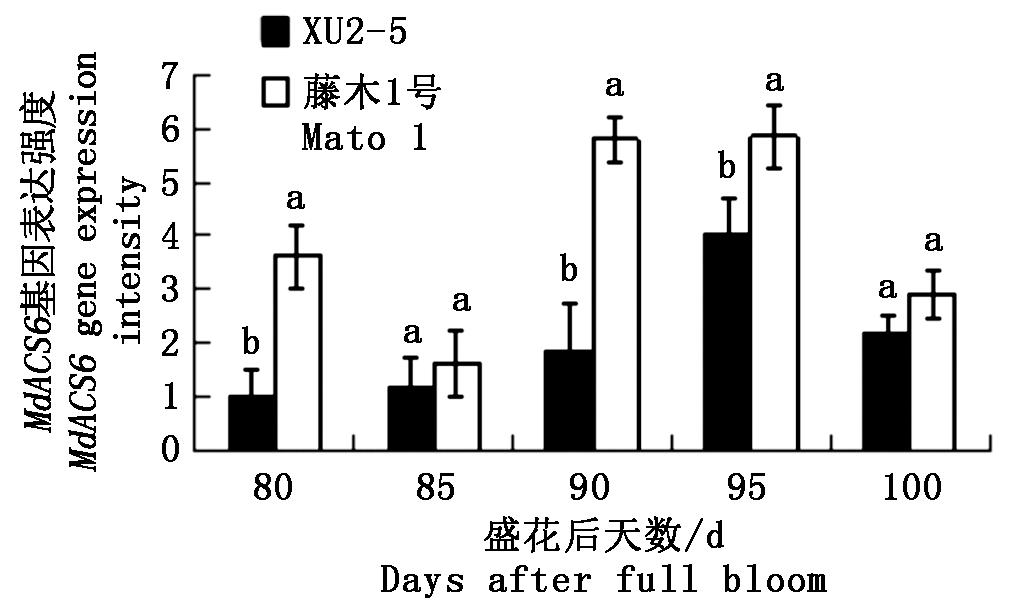
图3 两个品种成熟过程中MdACS6基因相对表达量的变化
Fig.3 Changes in MdACS6 gene expressions during the ripening process
2.3 相关酶活性及其基因表达变化
2.3.1 多聚半乳糖醛酸酶(PG)活性及其基因相对表达量 由图4,5可以看出,藤木1号果实成熟过程中MdPG1基因相对表达量和酶活性表现出了较好的一致性,而XU2-5则表现为盛花后80~90 d二者趋势一致。盛花后80 d,藤木1号的MdPG1基因的相对表达量显著高于XU2-5,此时,藤木1号的酶活性显著高于XU2-5。盛花后85 d,两品种(系)的基因相对表达量及酶活性均下降,差异不显著;盛花后85~90 d两品种(系)的基因相对表达量及酶活性均显著升高,90 d时 MdPG1基因相对表达量是85 d的7.56~29.72倍,XU2-5的相对表达量显著高于藤木1号;盛花后90 d PG活性是85 d的1.39~1.58倍,表现为藤木1号的酶活性显著高于XU2-5。盛花后90~95 d二者的基因相对表达量显著下降,95 d时二者间无显著差异,但二者的PG活性仍较高,二者间无显著差异。盛花后100 d,二者的基因相对表达量和酶活性均升高,藤木1号的基因相对表达量显著大于XU2-5,但酶活性间差异不显著。
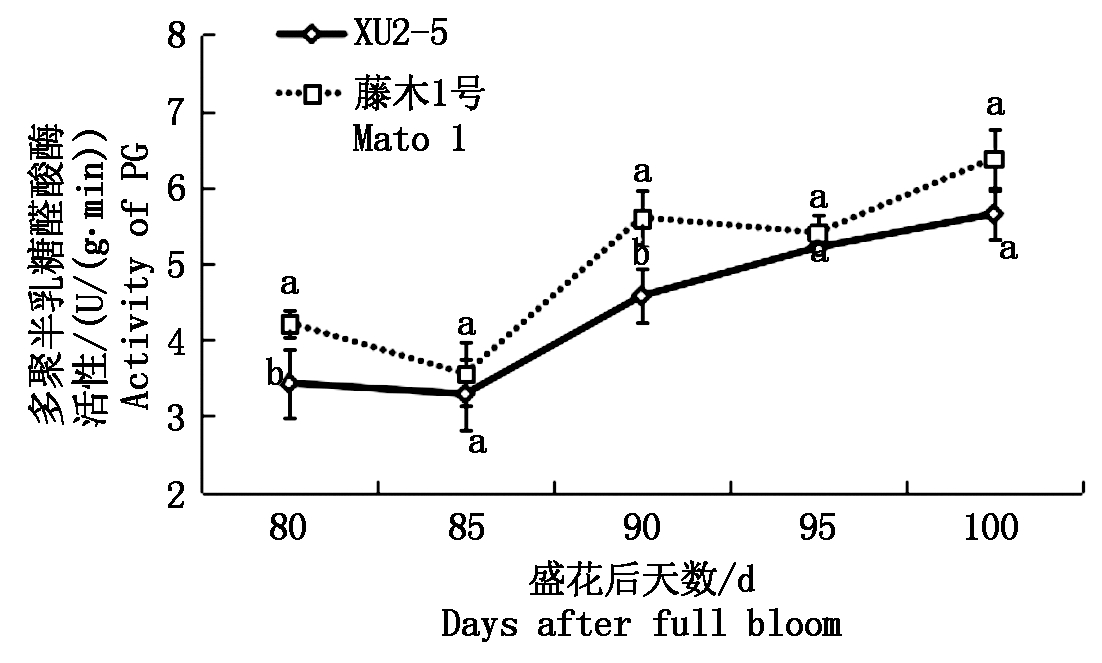
图4 果实成熟过程中多聚半乳糖醛酸酶活性的变化
Fig.4 Changes in PG activity of two varieties during the ripening process
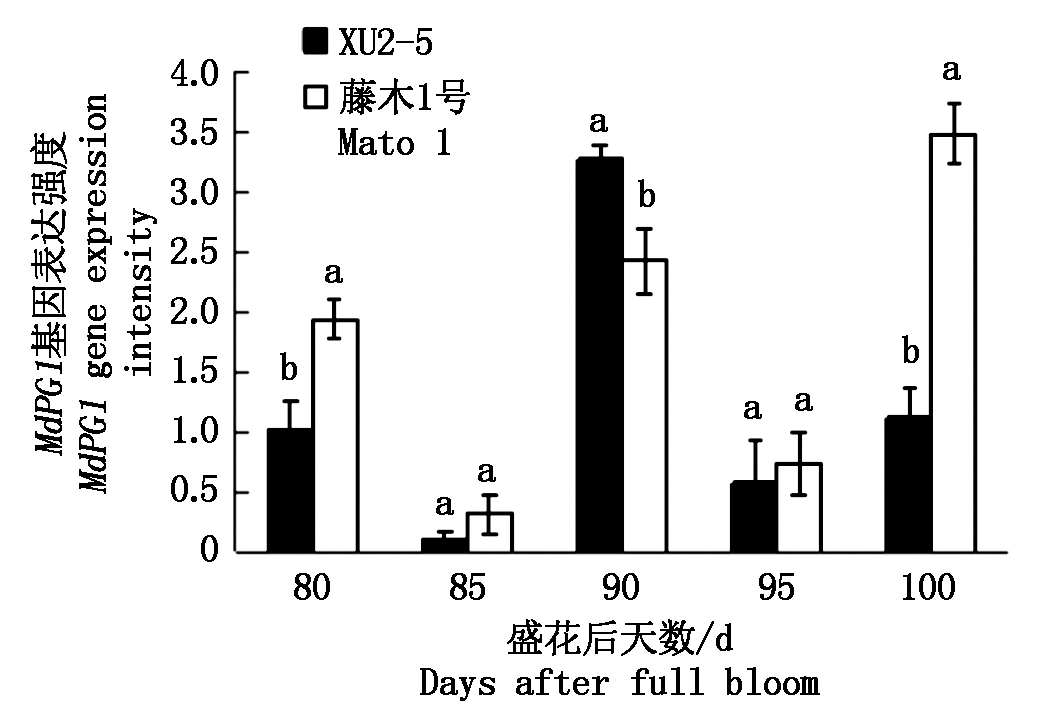
图5 两个品种成熟过程中MdPG1基因相对表达量的变化
Fig.5 Changes in MdPG1 gene expressions during the ripening process
2.3.2 果胶甲酯酶(PE)活性及其基因表达 由图6,7可以看出,两品种的MdPE基因相对表达量与PE酶活性(以鲜质量计)变化趋势在盛花后85 d前一致,以后不一致。盛花后80~85 d,MdPE基因相对表达量升高,藤木1号的高于XU2-5,此时酶活性表现出一致性;盛花后90 d,XU2-5的MdPE基因相对表达量继续升高,而藤木1号的则下降,而此时二者的酶活性则同时下降;盛花后90~100 d,两品种(系)的MdPE基因相对表达量下降,而其酶活性则持续升高,盛花后100 d,藤木1号的酶活性显著高于XU2-5。
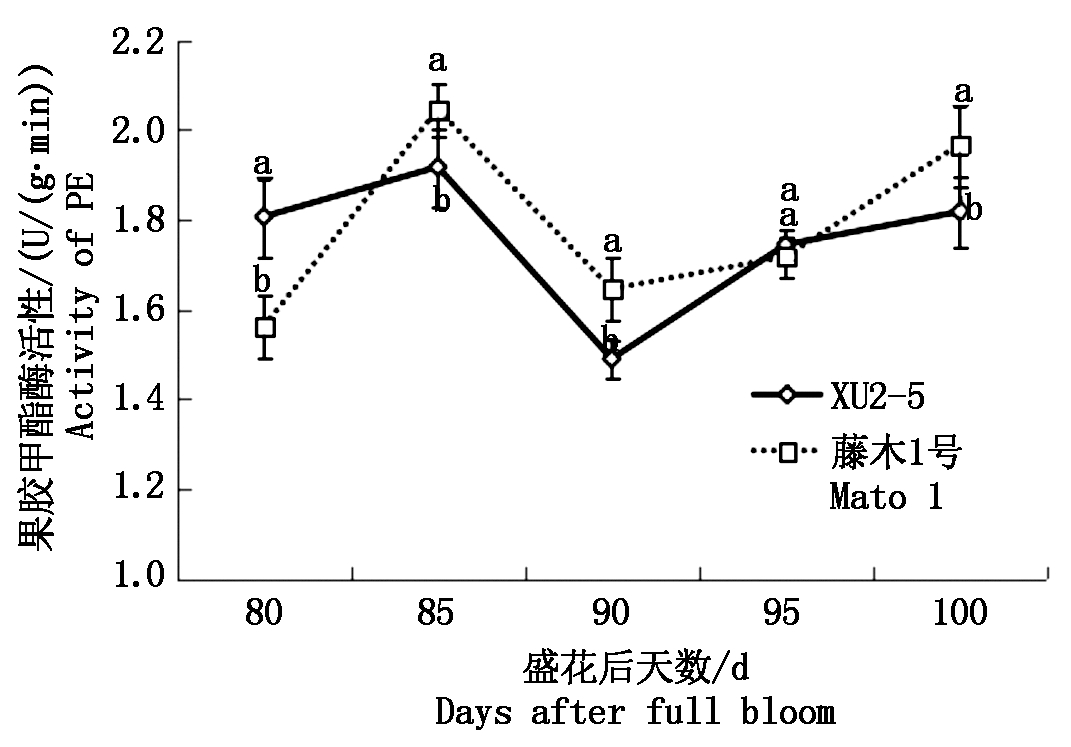
图6 果实成熟过程中果胶甲酯酶活性的变化
Fig.6 Changes in PE activity of two varieties during the ripening process
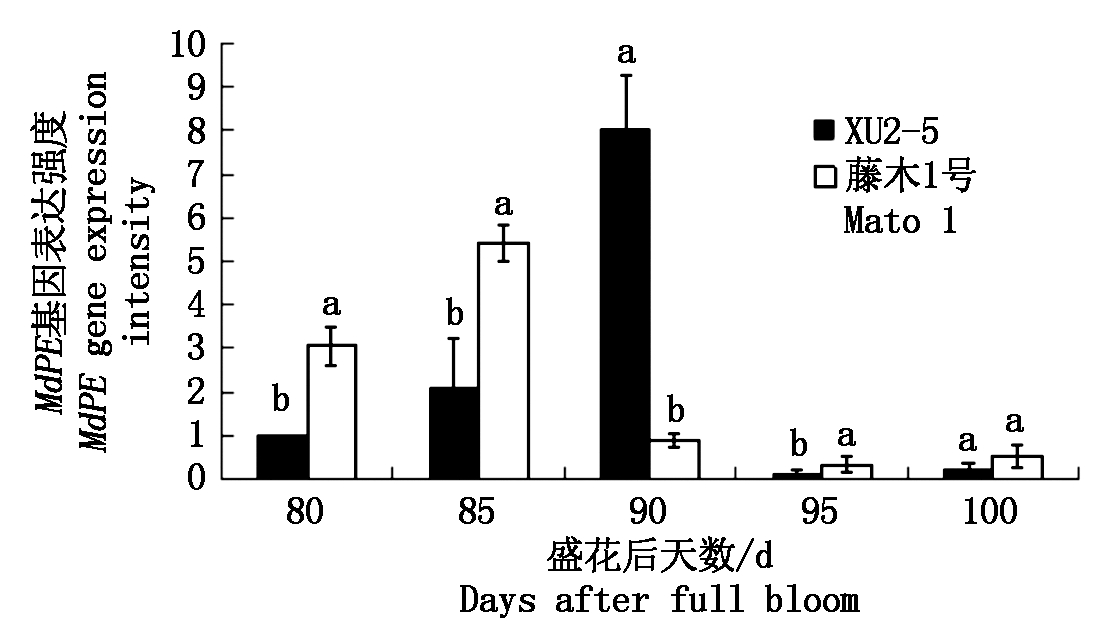
图7 两个品种成熟过程中MdPE基因相对表达量的变化
Fig.7 Changes in MdPE gene expressions during the ripening process
2.3.3 脂氧合酶(LOX)活性及其基因表达 由图8,9可以看出,果实成熟过程中脂氧合酶(以鲜质量计)的变化趋势与MdLOX基因相对表达量变化不一致。随着果实成熟,供试2个品种(系)的脂氧合酶(LOX)活性呈现相似的变化趋势,先降低后升高(图8)。花后80~85 d,2个品种(系)的脂氧合酶活性迅速降低, XU2-5的降低幅度大于藤木1号。花后85~100 d,XU2-5和藤木1号的酶活性呈现逐渐升高的趋势,藤木1号的酶活性始终高于XU2-5的酶活性,花后90 d和花后100 d,藤木1号和XU2-5的酶活性存在显著差异。从图9可以看出,XU2-5的MdLOX基因的相对表达量变化呈现先升高后降低的趋势,高峰出现在花后85 d,而藤木1号的MdLOX基因相对表达量波动较大,最高值出现在花后100 d。
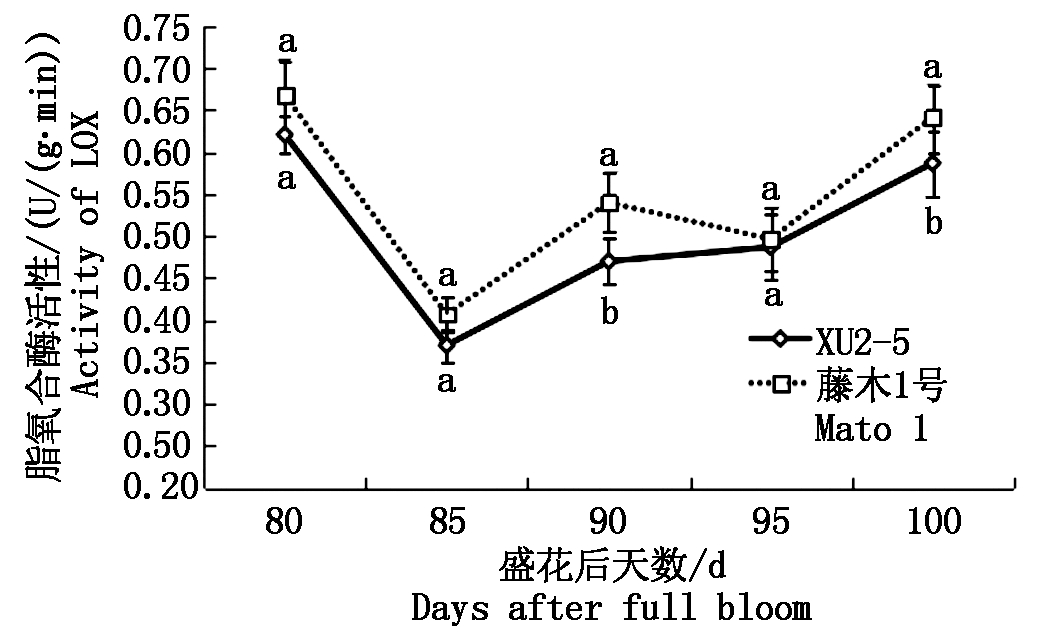
图8 果实成熟过程中脂氧合酶活性的变化
Fig.8 Changes in LOX activity of two varieties during the ripening process
2.3.4 果实硬度与酶活性的相关性 XU2-5和藤木1号的发育过程中果实硬度与酶活性的相关系数见表2。由表2可知,XU2-5和藤木1号的果实硬度与PG活性存在显著负相关,相关系数分别为-0.944,-0.870,而果实硬度与PE活性和LOX活性的相关性不明显。
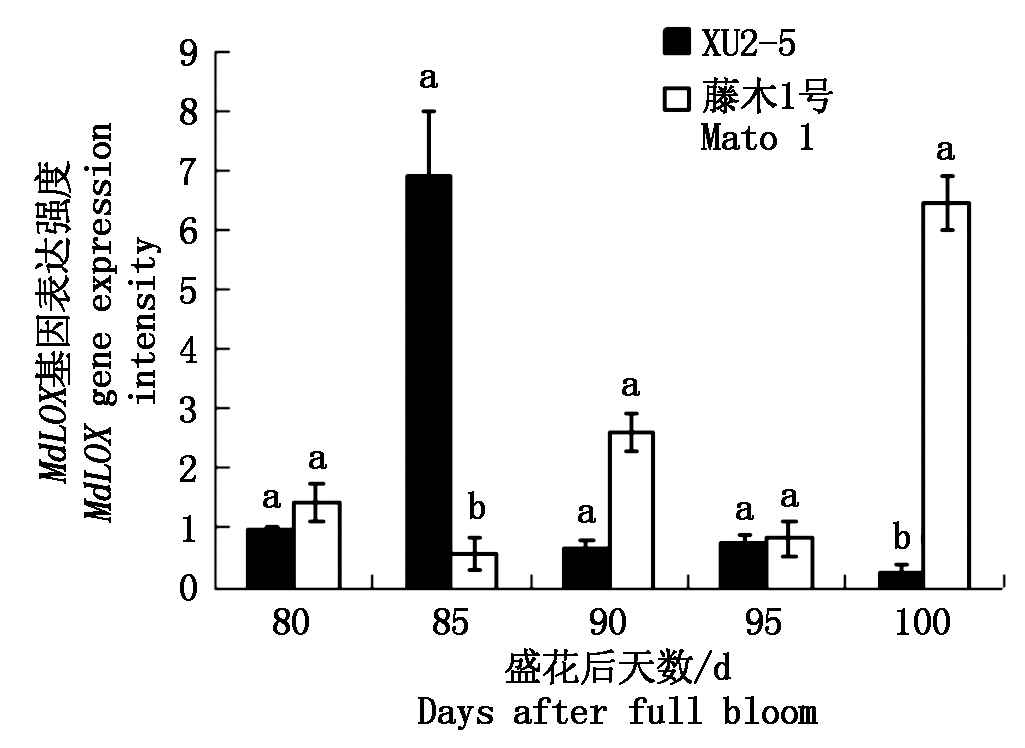
图9 两个品种成熟过程中MdLOX基因相对表达量的变化
Fig.9 Changes in MdLOX gene expressions during the ripening process
表2 果实硬度与酶活性的相关性系数
Tab.2 The correlation coefficient of related enzymes activity and firmness
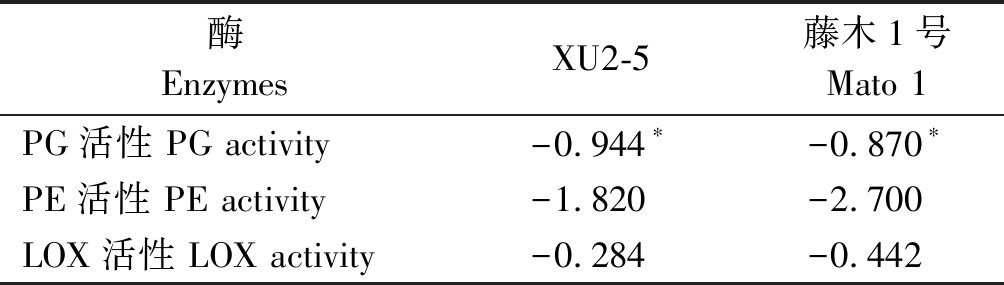
酶EnzymesXU2-5藤木1号Mato 1PG活性 PG activity-0.944∗-0.870∗PE活性 PE activity-1.820 -2.700 LOX活性 LOX activity-0.284 -0.442
注:*.5%的差异显著水平。
Note:*.The significant level of 5%.
3 结论与讨论
乙烯能够改变细胞原生质膜的透性,使水解酶外渗,有助于降解细胞壁的组成成分,所以乙烯对果实的成熟软化起着重要的调节作用。本研究结果显示,随着果实的成熟,XU2-5和藤木1号的乙烯释放速率均呈现增高的趋势,整个采样期间藤木1号的乙烯释放速率均明显大于XU2-5,且藤木1号的果实已产生呼吸跃变。与之对应的二者果实的硬度也呈现明显的下降,且藤木1号的果实硬度下降速率明显高于XU2-5,因而推测乙烯释放速率升高可能是造成果实硬度下降的主要原因,刘超超等[5]对泰山早霞的研究也得出了同样的结果。但对比果实硬度下降和乙烯释放速率可以看出,XU2-5在盛花后80~90 d乙烯释放速率变化很小,但硬度下降较快,表明此时硬度的下降可能是独立于乙烯控制或较小依赖乙烯的事件,Ireland 等[12]也有同样发现。ACC合成酶(ACS)是乙烯合成的限速酶,在果实成熟软化过程中起重要作用,虽然Harb等[13]研究显示,蜜脆苹果乙烯释放量较低与乙烯生物合成基因表达不相关,但本试验结果显示花后90 d藤木1号、花后95 d XU2-5果实的ACS6的基因表达强度达到最高值,以后二者乙烯的释放速率迅速升高。李通[11]的结果也显示ACS基因表达在果实产生乙烯高峰时起着重要的调控作用。因此,采取措施调控ACS基因表达可以有效的调控软化。
研究认为,果实软化主要是多种细胞壁酶的作用引起果胶和细胞壁物质的水解,造成硬度的下降,但在不同果实中起主导作用的水解酶不同,且在不同发育阶段也有所差异[14]。在山农脆梨、黄金梨和鸭梨3个梨品种的研究中认为果胶甲酯酶(PE)、淀粉酶(AM)、纤维素酶(Cx)是引起硬度下降的主要原因[15]。秦冠的硬度和脆度与PG和PE酶活性呈显著负相关[16]。而刘超超等[5]认为硬度的快速下降及货架期短的原因主要是PG活性高峰的出现。在苹果后期软化过程中,PG起主要作用,与果实的成熟软化呈正相关。本试验中XU2-5和藤木1号果实硬度均呈现降低的趋势,但下降幅度不同,2个品种(系)的硬度变化与PG活性变化存在显著的负相关。但对比分析二者MdPG基因表达可以看出,藤木1号的基因相对表达量变化与酶活性变化一致,表明本试验中检测的MdPG基因(为MdPG1)在藤木1号中起主要作用,而在XU2-5中可能MdPG家族中其他基因起主要作用。LOX参与膜质过氧化作用,通过破坏膜结构,从而加速衰老,是果实软化的重要因素之一[17-18]。有研究表明,脂氧合酶(LOX)在红星苹果和肥城桃软化的启动阶段有促进作用,LOX可能是导致前期软化的原因[19-20]。本试验中,XU2-5和藤木1号的果实硬度变化与LOX活性变化相关性不显著,但2个品种(系)的LOX活性在花后80 d处于最高峰,可能与果实软化的启动有关。
[1] 齐秀东, 魏建梅, 赵伶俐. 嘎拉苹果果实质地发育软化与细胞壁降解及其基因表达的关系[J]. 现代食品科技, 2015, 31(6):91-96. doi:10.13982/j.mfst.1673-9078.2015.6.015.
Qi X D, Wei J M, Zhao L L. Correlation of fruit texture development and softening with cell wall degradation and related gene expression in gala apples [J]. Modern Food Science and Technology, 2015, 31(6):91-96.
[2] 齐秀东, 魏建梅, 李永红. 苹果果实质地软化过程中碳水化合物代谢及其关键酶基因表达的变化[J]. 园艺学报, 2015, 42 (3):409-417. doi:10.16420/j.issn.0513-353x.2014-0867.
Qi X D, Wei J M, Li Y H. Carbohydrate metabolism and the key gene expression in apple during fruit texture softening [J]. Acta Horticulturae Sinica, 2015, 42 (3):409-417.
[3] 陈学森, 宋君, 高利平, 冀晓昊, 张宗营, 毛志泉, 张艳敏, 刘大亮, 张芮, 李敏.乔纳金苹果及其脆肉芽变果实质地发育机理[J]. 中国农业科学, 2014, 47(4):727-735. doi:10.3864/j.issn.0578-1752.2014.04.013.
Chen X S, Song J, Gao L P, Ji X H, Zhang Z Y, Mao Z Q, Zhang Y M, Liu D L, Zhang R, Li M. Developing mechanism of fruits texture in Jonagold apple and its crisp flesh sport[J]. Scientia Agricultura Sinica, 2014, 47(4):727-735.
[4] 李宏建, 徐贵轩, 宋哲, 何明莉, 张春波. 岳帅苹果贮藏期间果实软化生理变化研究[J].江苏农业科学, 2011(1):315-317. doi:10.15889/j.issn.1002-1302.2011.01.150.
Li H J, Xu G X, Song Z, He M L, Zhang C B. Study on physiological changes of fruit softening of Yueshuai apple during storage[J]. Jiangsu Agricultural Sciences, 2011(1):315-317.
[5] 刘超超, 魏景利, 徐玉亭, 焦其庆, 孙海兵, 王传增, 陈学森. 苹果3个早熟品种果实发育后期硬度及其相关生理指标的初步研究[J]. 园艺学报, 2011, 38(1):133-138. doi:10.16420/j.issn.0513-353x.2011.01.019.
Liu C C, Wei J L, Xu Y T, Jiao Q Q, Sun H B, Wang C Z, Chen X S. Preliminary study on firmness and related physiological indices of three early-ripening apple cultivar during late development of the fruit [J]. Acta Horticulturae Sinica, 2011, 38(1):133-138.
[6] 薛应龙. 植物生理学实验手册[M]. 上海:上海科学技术出版社, 1995:143-146.
Xue Y L. Plant physiology experiment manual[M]. Shanghai:Shanghai Scientific & Technical Publishers, 1995:143-146.
[7] 陈昆松, 徐昌杰, 许文平, 吴敏, 张上隆. 猕猴桃和桃果实脂氧合酶活性测定方法的建立[J]. 果树学报, 2003, 20(6):436-438. doi:10.13925/j.cnki.gsxb.2003.06.003.
Chen K S, Xu C J, Xu W P, Wu M, Zhang S L. Improved method for detecting lipoxygenase activity from kiwifruit and peach fruit[J]. Journal of Fruit Science, 2003, 20(6):436-438.
[8] 邱化荣. 乙烯抑制苹果轮纹病菌诱导的MAPK-WRKY33免疫信号途径的分子机制[D].泰安:山东农业大学, 2017.
Qiu H R. The molecular mechanism of ethylene suppressed MAPK-WRKY33 immune signaling pathway induced by the apple ring rot pathogenenic fungi Botryosphaeria dothidea[D]. Tai′an:Shandong Agricultural University, 2017.
[9] 刘美艳, 魏景利, 刘金, 房龙, 宋杨, 崔美, 王传增, 陈学森. ‘泰山早霞’苹果采后1-甲基环丙烯处理对其软化及相关基因表达的影响[J]. 园艺学报, 2012, 39(5):845-852.doi:10.16420/j.issn.0513-353x.2012.05.005.
Liu M Y, Wei J L, Liu J, Fang L, Song Y, Cui M, Wang C Z, Chen X S. The regulation of 1-methylcyclopropene on softening and expression of relevant genes in Taishan Zaoxia apple[J]. Acta Horticulturae Sinica, 2012, 39(5):845-852.
[10] 魏建梅. 苹果(Malus domestica Borkh.)果实质地品质发育及采后调控的生理和分子基础[D]. 杨凌:西北农林科技大学, 2009.
Wei J M. Study on physiological and amaolecular mechanism of fruit texture development and Post-harvest regulation of apple (Malus domestica Borkh.)[D]. Yangling:Northwest A & F University, 2009.
[11] 李通. 苹果ACC合成酶基因MdACS6在果实乙烯合成中的调控机制研究[D]. 沈阳:沈阳农业大学, 2014.
Li T. Study of apple ACC synthase gene MdACS6 and its regulatory role in fruit ethylene biosynthesis[D]. Shenyang:Shenyang Agricultural University, 2014.
[12] Ireland H S, Gunaseelan K, Muddumage R, Tacken E J, Putterill J, Johnston J W,Schaffer R J. Ethylene regulates apple (Malus domestica) fruit softening through a dose×time-dependent mechanism and through differential sensitivities and dependencies of cell wall-modifying genes[J]. Plant and Cell Physiology, 2014, 55(5):1005-1016. doi:10.10.1093/pcp/pcu034.
[13] Harb J, Gapper N E, Giovannoni J J,Watkins C B. Molecular analysis of softening and ethylene synthesis and signaling pathways in a non-softening apple cultivar, ′Honeycrisp′ and a rapidly softening cultivar, McIntosh [J]. Postharvest Biology and Technology, 2012, 64(1):94-103. doi:10.1016/j.postharvbio.2011.10.001.
[14] 吴彩娥, 王文生, 寇晓红. 果实成熟软化机理研究进展[J].果树学报, 2001, 18(6):365-369. doi:10.13925/j.cnki.gsxb.2001.06.013.
Wu C E, Wang W S, Kou X H. Advance in research on mechanism of fruit ripening and softening[J]. Journal of Fruit Science,2001,18(6):365-369.
[15] 艾静.山农脆梨果实硬度及其相关酶活性的初步研究[D]. 泰安:山东农业大学, 2014.
Ai J. Preliminary study on the firmness and related enzyme activity of Shannongcui pear[D]. Tai′an:Shandong Agricultural University, 2014.
[16] 张娟, 高滋艺, 杨惠娟, 杨亚州, 赵政阳.秦冠和富士质地差异的解剖学观察及相关酶活性研究[J]. 西北农业学报, 2015, 24(10):88-94. doi:10.7606/j.jssn.1004-1389.2015.10.013.
Zhang J, Gao Z Y, Yang H J, Yang Y Z, Zhao Z Y. Study on anatomy and fruit texture related enzymes in apple (Malus×domestica) cultivars Qinguan and Fuji [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2015, 24(10):88-94.
[17] 张波, 李鲜, 陈昆松. 脂氧合酶基因家族成员与果实成熟衰老研究进展[J]. 园艺学报, 2007, 34(1):245-250. doi:10.16420/j.issn.0513-353x.2007.01.054.
Zhang B, Li X, Chen K S. Physiological and molecular features of lipoxygenase gene family members in ripening fruit[J].Acta Horticulturae Sinica, 2007, 34(1):245-250.
[18] 孟坤. 柿脂氧合酶及其相关基因与果实成熟软化的关系研究[D]. 杨凌:西北农林科技大学, 2016.
Meng K. Studies on lipoxygenase and its associated genes related to persimmon fruit softening and ripening[D]. Yangling:Northwest A & F University, 2016.
[19] 陈安均, 蒲彪, 罗云波, 刘远鹏. 桃果实成熟期的软化机理探讨[J]. 四川农业大学学报, 2003, 21(2):113-115. doi:10.16036/j.issn.1000-2650.2003.02.009.
Chen A J, Pu B, Luo Y B, Liu Y B. The study on mechanism of softening during peach ripening[J]. Journal of Sichuan Agricultural University,2003,21(2):113-115.
[20] 李富军,张新华,翟衡. 红星苹果和肥城桃果实软化的酶学基础[J]. 果树学报, 2005, 22 (5):450-453. doi:10.13925/j.cnki.gsxb.2005.05.003.
Li F J, Zhang X H, Zhai H. Enzyme mechanism of fruit softening of apple cultivar starking and peach cultivar Feicheng[J]. Journal of Fruit Science, 2005, 22 (5):450-453.
