瘤胃微生物包括细菌、原虫和真菌三大类[1],它通过消化和降解植物细胞壁为反刍动物提供能量[2-3]。细菌的种类和数量(每毫升瘤胃内容物含1010 ~ 1011个)最多,对于反刍动物消化植物细胞壁起重要的作用,而真菌的数量最少(每毫升瘤胃内容物<105个)[4-5]。原虫也是牛羊等反刍动物瘤胃微生物的重要组成部分,每毫升瘤胃内容物含有105 ~ 107个原虫[6]。根据饲粮组成和类型的不同,原虫在降解饲料的过程中能够消化5%~21%的粗纤维[7],而真菌降解粗饲料的贡献还不明确[8]。鉴于瘤胃微生态系统的复杂特性,Lee等[9]首次研究了原虫对真菌生长周期的效应关系,发现在真菌生长的后期(即优先培养72 h的稳定期或静止期),添加原虫不会影响真菌降解纤维素,但是在真菌生产早期(即真菌优先培养24 h,也称迟滞期)添加原虫对真菌有显著的抑制作用,原因可能是原虫吞食了未附着到底物上的真菌孢子,而且与单一真菌培养相比,混合培养的真菌孢子数也确实减少了。尽管已经知道原虫和细菌的菌群密度呈负相关关系[10],但是原虫和细菌的相互关系到目前为止还不清楚[9]。
为此,本研究将细菌和原虫进行单独分离后,旨在利用人工瘤胃体外产气技术研究瘤胃原虫对瘤胃细菌活性的影响,以阐明瘤胃原虫是否有助于促进或保持瘤胃细菌的活性,为反刍动物瘤胃微生物的代谢和调控提供基础数据和依据。
1 材料和方法
1.1 瘤胃液供体动物与饲养管理
试验选用2头健康、体质量(400 ± 8)kg、安装有永久性瘤胃瘘管的西门塔尔公牛用于提供瘤胃液。瘘管牛采用单圈拴系饲养,饲粮由2.5 kg的精料混合料和7.0 kg的羊草组成。其中精料混合料的组成为玉米60%、豆粕19%、小麦麸17%、磷酸氢钙2%、食盐1%和微量元素预混料1%,粗饲料为干羊草。试验牛于每天07:00和17:00等量饲喂2次,自由清洁饮水。预饲期14 d,第15天采集瘤胃液。
1.2 培养管和发酵底物
试验选用21个干净的国产玻璃注射器(100 mL),内径为32 mm、长为200 mm,活塞和针筒上的编号保持一致,避免相互混用。试验以羊草风干样为发酵底物,粉碎后过1 mm网筛置于广口瓶中备用。每个注射器称取粉碎后过1 mm网筛的羊草0.200 0 g,用长柄勺将样品送到培养管的最前端,尽量避免样品散落在管壁上,称好后在注射器芯壁上均匀涂抹一薄层凡士林,以防气体泄漏。
1.3 瘤胃液的采集和制备
晨饲后2 h分别采集2头西门塔尔牛的瘤胃液各200 mL,经4层纱布过滤后混匀,置于39 ℃水浴中。
1.4 细菌液和原虫液的准备[11]
将混匀的瘤胃液分别加入6个50 mL的离心管中,每个离心管加40 mL的瘤胃液。于300 r/min离心5 min,将上层清夜弃去。
①在50 mL的离心管中留8 mL沉淀加入32 mL 30%(m/V)的蔗糖溶液,摇匀后在300 r/min离心3 min。②吸取上层液(细菌部分)于三角瓶中,加入混合缓冲液至120 mL。③去除中间的蔗糖溶液,用0.9%的NaCl (m/V)溶液冲洗沉淀,然后在300 r/min离心5 min,重复进行3次,将6个离心管中的沉淀(原虫部分)全部转入另一个三角瓶中,加入混合缓冲液至120 mL,混合均匀。
1.5 试验设计
将21个注射器分为3个处理,每个处理设4个重复,同时分别设置3个空白对照。
细菌处理组:300 mL混合缓冲液+40 mL细菌液+40 mL混合缓冲液;原虫处理组:300 mL混合缓冲液+40 mL原虫液+40 mL混合缓冲液;细菌+原虫组∶300 mL混合缓冲液+40 mL细菌液+40 mL原虫液;向制备好的混合缓冲液中通入CO2气体,同时保存于39 ℃恒温水浴中。
1.6 体外培养
准备3个预热的500 mL广口试剂瓶,分别加入配制好的混合缓冲液和细菌液或原虫液,置于39 ℃水浴中,持续缓慢通入CO2气体。分别向各培养管中吸入30 mL混合培养液,排尽注射管内气体后用密封针头密封前端,置于提前预热的39 ℃水浴摇床(± 0.5 ℃)内,同时记录活塞的初始刻度值,开始培养。混合缓冲液的配制参考Menke和Steingass[12]的方法。体外培养发酵的操作步骤参照Zhao等[13]的方法进行。在培养发酵开始的0,2,4,8,12,24 h分别记录各培养管的活塞刻度值(mL),并计算产气量。发酵24 h后终止发酵,立即用pH计测定发酵液pH值,并采集气体样品,用气相色谱仪(岛津GC-14B)测定气体中甲烷(CH4)、二氧化碳(CO2)和氢气(H2)等气体成分。气相色谱条件为:检测器TCD,色谱柱TDX-01,柱温80 ℃,检测器温度为120 ℃,载气为氮气。收集发酵液将其在5 000 r/min条件下离心20 min用于测定挥发性脂肪酸和氨态氮。取4 mL上清液加1 mL 25%偏磷酸,混合均匀保存于-20 ℃条件下,解冻后4 ℃以20 000 r/min离心20 min,用气相色谱仪(美国安捷伦,型号5890)内标法测定。气相色谱条件为:火焰离子检测器(FID),毛细管柱(30 m × 0.32 mm × 1 μm),进样器温度为225 ℃,检测器温度为250 ℃,载气为氦气(He)。发酵液样品用1∶1(V/V)0.1 mol/L HCl溶液固氮,用分光光度计测定氨态氮[14-15]。
1.7 产气量和挥发性脂肪酸的计算
每个样品各时间点的产气量用以下公式计算:
GP=(V-V0-GP0)/m
式中,GP为某个样品在t时刻的产气量(mL/g);V为t时刻样品培养管读数(mL);V0为0时刻样品培养管读数(mL);GP0为t时刻空白培养管产气量平均值(mL);m为绝干基础样品质量(g)。
总产气量和各气体成分(H2、CO2和CH4)含量以及总挥发酸、乙酸、丙酸和丁酸的产量计算方法如下:
Y样品 = (Y发酵液 -Y空白)/ m。
式中,Y样品为样品的气体(mL/g)或VFA 产量(μmol/g);Y发酵液为发酵液的气体(mL/g)或VFA 产量(μmol/g);Y空白为空白对照样品的气体(mL/g)或VFA 产量(μmol/g);m为饲料样品的干物质量(g)。
1.8 统计分析
试验数据采用Excel 2016进行初步整理后,用SAS 软件(Inst Inc.,Cary,NC,USA)的GLM过程程序进行统计分析,各平均数之间用Duncan法进行多重比较,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析
2.1 不同瘤胃微生物对羊草体外发酵24 h 的总产气量以及CH4、CO2和H2产量的影响
不同瘤胃微生物处理对羊草体外发酵24 h的总产气量以及各气体组分产量的影响见表1。从表1可以看出,细菌+原虫组的产气量最高,原虫组的产气量最低(产气量为0 mL/g,图1),细菌+原虫组的24 h总产气量与细菌组相比,差异显著(P<0.05)。细菌+原虫组的H2和CH4产量均高于细菌组,但是两处理组差异不显著(P>0.05);细菌+原虫组的CO2产量与细菌组相比较,差异也是显著的(P<0.05)。
表1 瘤胃微生物不同处理24 h产气量以及发酵
24 h的气体成分分析
Tab.1 Gas production and component for different rumen microbial groups in 24 h incubation mL/g
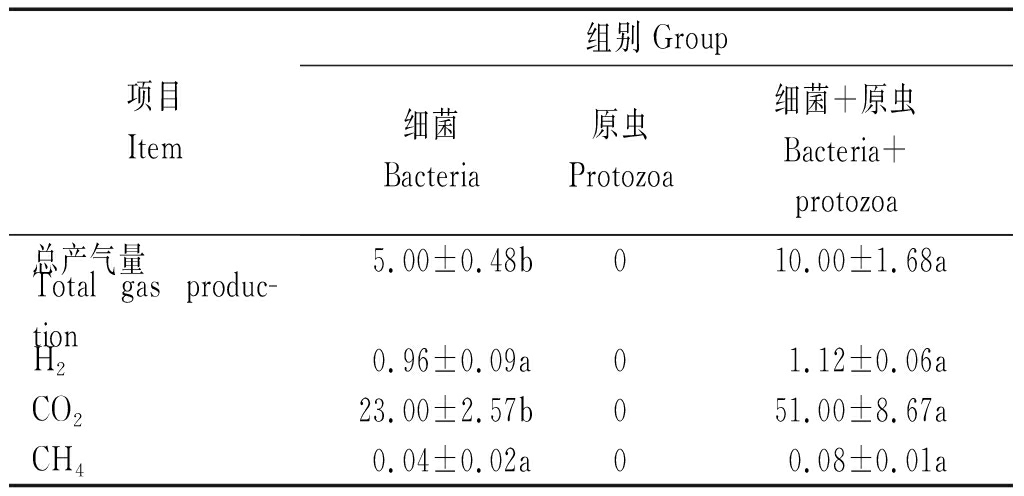
项目Item组别 Group细菌Bacteria原虫Protozoa细菌+原虫Bacteria+protozoa总产气量5.00±0.48b010.00±1.68aTotal gas produc-tionH20.96±0.09a01.12±0.06aCO223.00±2.57b051.00±8.67aCH40.04±0.02a00.08±0.01a
注:同行数据相同小写字母表示差异不显著(P>0.05);不同小写字母表示差异显著(P<0.05)。
Note:In the same row,values with the same small letter mean not significant difference (P>0.05);While with different small letters mean significant difference (P<0.05).
2.2 不同瘤胃微生物对羊草体外发酵24 h 的pH值、氨态氮和VFA的产量影响
不同处理瘤胃微生物(细菌组、原虫组以及细菌+原虫组)对羊草体外发酵24 h的pH值、氨态氮(NH3-N)和VFA产量的影响见表2。原虫组的pH值极显著高于细菌组及细菌+原虫组(P<0.01),而细菌组和细菌+原虫组的pH值差异不显著(P>0.05)。原虫组的氨态氮(NH3-N)量也极显著高于细菌组和细菌+原虫组(P<0.01),细菌+原虫组的氨态氮(NH3-N)量高于细菌组但差异不显著(P>0.05)。细菌+原虫组的总挥发酸产量极显著高于细菌组和原虫组(P<0.01),细菌组和原虫组反而差异不显著(P>0.05)。细菌+原虫组的乙酸产量极显著高于原虫组(P<0.01),原虫组的乙酸产量极显著高于细菌组(P<0.01)。细菌+原虫组的丙酸产量极显著高于细菌组和原虫组(P<0.01),原虫组的丙酸产量稍高于细菌组但是差异不显著(P>0.05)。细菌+原虫组的丁酸产量极显著高于细菌组和原虫组(P<0.01),细菌组和原虫组的丁酸产量差异不显著(P>0.05)。细菌组和原虫组的乙酸/丙酸比例极显著高于细菌+原虫组(P<0.01),细菌组的乙酸/丙酸比例高于原虫组但差异不显著(P>0.05)。
2.3 不同瘤胃微生物对羊草体外发酵不同时间点的产气曲线
瘤胃细菌和原虫各微生物处理组24 h发酵羊草细胞壁的不同时间净产气速率见图1。在24 h 的体外发酵过程中,各个时间点原虫组的产气量均为零。从开始发酵至培养进行到第2 h和4 h时,细菌和细菌+原虫组的产气量均较低,但是细菌+原虫组的产气量稍高于细菌组。在发酵过程进行至第8 h时,细菌组和细菌+原虫组的产气量都急剧上升而且达到最大产气量,但是细菌组的产气速率明显高于细菌+原虫组。从发酵过程中第8 h开始至第12 h时,细菌组和细菌+原虫组的产气速率均呈现下降的趋势,而且刚好在第12 h时,2组的产气量趋于接近。从第12 h开始当发酵进行至24 h时,细菌+原虫组的净产气量变化不大,相对稳定的维持在平台期,而细菌组的产气量则持续下降,且总产气量在24 h时低于细菌+原虫组。
表2 不同处理发酵24 h pH值、氨态氮(mg/dL)和挥发性脂肪酸(mmol/g)产量
Tab.2 The pH value,NH3-N (mg/dL) and VFA production (mmol/g)
for different rumen microbial groups in 24 h incubation
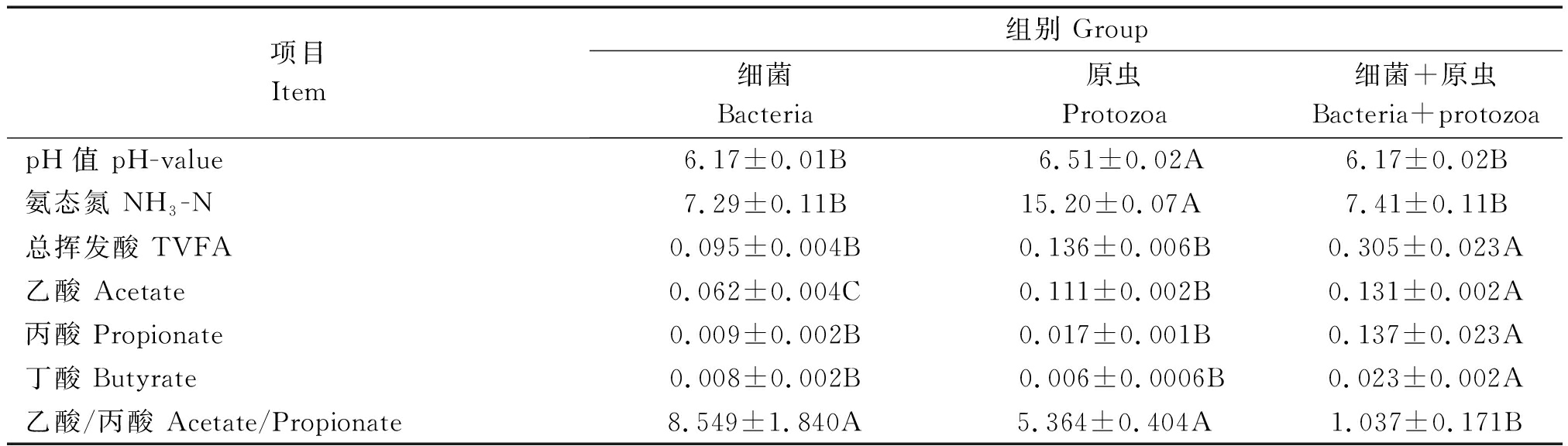
项目Item组别 Group细菌Bacteria原虫Protozoa细菌+原虫Bacteria+protozoapH值 pH-value6.17±0.01B6.51±0.02A6.17±0.02B氨态氮 NH3-N7.29±0.11B15.20±0.07A7.41±0.11B总挥发酸 TVFA0.095±0.004B0.136±0.006B0.305±0.023A乙酸 Acetate0.062±0.004C0.111±0.002B0.131±0.002A丙酸 Propionate0.009±0.002B0.017±0.001B0.137±0.023A丁酸 Butyrate0.008±0.002B0.006±0.0006B0.023±0.002A乙酸/丙酸 Acetate/Propionate8.549±1.840A5.364±0.404A1.037±0.171B
注:同行数据相同大写字母表示差异不显著(P > 0.05);不同大写字母表示差异极显著(P<0.01)。
Note:In the same row,values with the same capital letter mean no difference (P > 0.05);While with different capital letters meaning the difference is extremely significant (P<0.01).
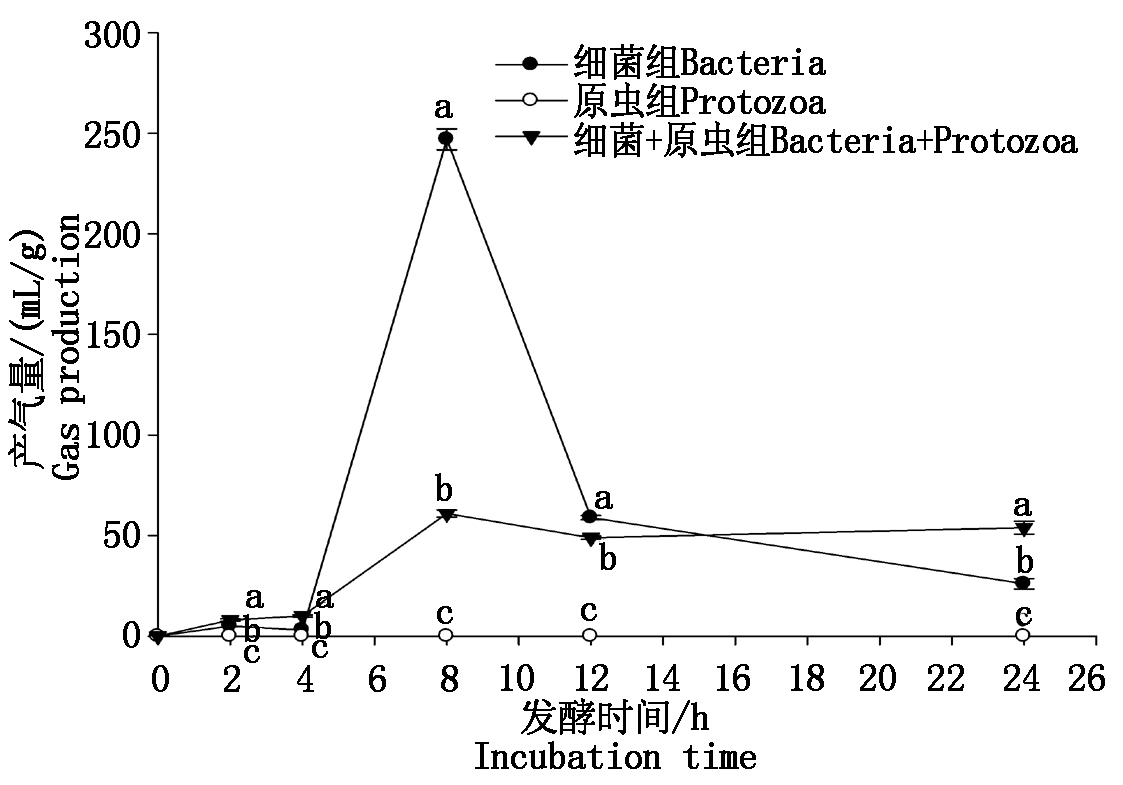
不同小写字母的处理组差异显著(P<0.05)。
Values with different letters are significantly different (P<0.05).
图1 各处理组不同时间净产气曲线
Fig.1 Gas production curve for different groups
3 讨论与结论
3.1 瘤胃微生物对植物细胞壁的降解
关于瘤胃微生物片段细菌、原虫和真菌共同作用,同时降解植物细胞壁中的纤维素成分已有非常多的研究报道[16-17]。但是,相较于瘤胃微生物共培养时的共同作用,瘤胃细菌、原虫和真菌在单独进行单一发酵时,各自的贡献机制仍不清楚,相关的研究也较少。Lee 等[18] 首次评价了瘤胃细菌、原虫和真菌在降解鸭茅细胞壁的整个过程中各自的作用和贡献。瘤胃细菌由于在数量上占绝对优势,加上代谢的功能种类多样,通常认为其负责了瘤胃中绝大部分饲料的消化[19]。然而,Lee 等[18]却有不同的发现,认为厌氧真菌降解细胞壁的贡献远远超过了瘤胃细菌,进而指出在细胞壁的整个降解过程中各微生物片段的相对贡献顺序为厌氧真菌>瘤胃细菌>原虫。Bauchop和Mountfort[20]也认为真菌在瘤胃中纤维素的降解过程中起了非常显著的作用,这是由于厌氧真菌可以穿透深入细菌不能进入的植物组织[21-22]。
关于瘤胃原虫是否能够降解植物细胞壁中纤维素的研究结果也不同,Lee 等[18]通过对鸭茅细胞壁降解的过程发现,尽管原虫能够消化细菌和真菌的细胞、培养基中的营养物质、微生物发酵的产物、其他种类的原生动物以及微小的饲料颗粒,但是原虫单独并不能降解植物细胞壁。Lee 等[9]研究原虫对真菌降解鸭茅细胞壁的影响时,同样发现原虫单独不能降解植物的细胞壁。而Onodera 等[23]的研究结果显示,瘤胃原虫能够通过内源1,4-葡聚糖酶参与瘤胃生态系统中纤维素的消化,Williams和Wither[24]也指出,植物组织大部分的纤维素溶解活性起初可能都源于原虫的活性作用。本研究中原虫组的产气量为零,说明单独原虫也不能降解羊草的细胞壁,该结果与Lee 等[9,18]的研究结果一致,其发现原虫单独存在时也不能降解鸭茅的植物细胞壁。此外,在今后探讨不同微生物降解植物细胞壁的相对贡献时,还应考虑不同瘤胃微生物接近饲料颗粒的机制的不同,因为饲料颗粒的大小不同,会直接影响原虫能否摄食饲料颗粒,还对发酵的程度有显著的影响。
3.2 人工瘤胃体外产气技术
在瘤胃微生物作用下,植物饲料厌氧发酵过程中的气体产生量,已经成为间接衡量饲料底物的降解率的方法[12]。所以,笔者认为羊草细胞壁在降解过程中的产气量能够反映每种微生物处理对细胞壁降解的程度和贡献。采用人工瘤胃产气技术可方便实现对瘤胃中细菌和原虫进行单一或共培养,而且收集气体样品容易,测定样品准确,还可以降低分析测定的成本[25]。Dong等[26-27] 用48 h的人工瘤胃体外培养发酵方法测定了多达55种反刍动物典型饲粮的CH4和挥发性脂肪酸产量数据库,并以此为基础成功建立了预测反刍动物CH4产量和挥发性脂肪酸产量的数学模型。原虫和细菌在真菌不存在时,只能在体外条件下研究。Lee等[9]也用体外培养的方法研究了细菌不存在时真菌和原虫的相互关系。所以,使用人工瘤胃体外产气技术可便于研究瘤胃细菌、原虫或真菌中任意两者之间的相互关系,它也是揭示瘤胃微生物作用机制必要的技术手段。
3.3 培养发酵的时间
本试验中当羊草在体外培养发酵进行至第24 h时,发酵的总产气量已接近培养管注射器的最大刻度值(原虫组除外),由于本试验是从产气量和不同气体成分如CH4、CO2和H2产量的角度,而不是从底物干物质降解率的大小方面研究瘤胃细菌和原虫的相对贡献,故在总产气量接近培养管的最大刻度时未进行排气,所以体外发酵培养的时间仅持续了24 h。一般而言,随着培养时间的增加,植物细胞的降解率差异会更加显著,所以通常在研究植物细胞的底物的降解率时会培养至96 h。本研究在培养进行至24 h时,虽然从培养发酵的这个过程来看处于发酵的早期阶段,但是瘤胃细菌组、原虫组和细菌+原虫组的净总产气量差异已非常明显,Zhang等[28]也发现稻草发酵培养至24 h最理想,此时CH4产量最大。Lee 等[18]的研究也支持了本试验的研究结果,其研究显示瘤胃细菌对鸭茅细胞壁纤维素的降解在发酵的早期(1 d)已经呈现显著的最大化,而到发酵的后期则是厌氧真菌来实现鸭茅的纤维素降解的最大化作用,因为真菌在发酵植物细胞壁时呈现出较长的延迟滞后时间。
3.4 对气体组分的影响
试验中原虫+细菌的产气量均明显高于单独的细菌组或单一原虫组,说明原虫对瘤胃细菌降解羊草细胞壁有显著的互补作用,而且对细菌活性的提高有促进作用,同时也进一步说明原虫+细菌组对于瘤胃纤维素的降解确实做出了巨大的贡献。Zhang等[8]在体外降解玉米秸秆时也发现了类似的现象,研究显示细菌+原虫组(B+P组)的气体总产量显著高于单独的细菌或原虫组,这也证明了瘤胃细菌和原虫存在协同互作效应。瘤胃发酵产生气体的主要成分包括CH4、CO2和H2产量,试验将原虫加入到细菌中,显著影响了CO2气体成分的比例而对CH4和H2的气体产量没有影响。Zhang等[8]在研究瘤胃细菌、原虫和真菌发酵降解不同纤维粒度玉米秸秆时发现,瘤胃细菌+原虫组与单独的原虫组也只对CO2气体成分的比例有显著影响,同样地,两组的CH4和H2的气体产量也不存在显著性差异。
3.5 对发酵参数指标的影响
瘤胃正常的pH值在5.5 ~ 7.1,本试验所测pH值均在此范围之内,说明本试验的发酵过程是正常的,而且经体外培养24 h后显微镜镜检显示瘤胃微生物有活性,但是试验中没有统计微生物的数量。试验中原虫组的pH值最高,细菌组以及细菌+原虫组的pH值均较低(且pH值较一致,均为6.17),表明羊草细胞壁的降解伴随着pH值的降低,进而说明细菌组以及细菌+原虫组的发酵过程是加强的。该结果与Lee 等[18]的研究结果一致,体外降解鸭茅时培养液的pH值也是原虫组最高(6.55),其中细菌组和细菌+原虫组的发酵液pH值也比较接近(分别为6.38和6.41)。这是因为当以植物细胞(粗饲料羊草)为发酵底物时,由于原虫可以从瘤胃液中吞噬可溶性糖类如整个淀粉颗粒,因此减缓了淀粉的发酵速度,从而减缓了pH值的下降。淀粉的快速发酵会加速pH值的急剧下降,所以细菌组和细菌+原虫组的pH值要比原虫组低。原虫组的氨态氮(NH3-N)显著高于细菌组和细菌+原虫组的原因可能是原虫可以吞噬和消化瘤胃中的细菌,使菌体蛋白的合成减少了,这样细菌不能利用NH3-N合成菌体蛋白,所以NH3-N的量相对来说就增加了。另外,将原虫加到细菌中,总挥发酸和各挥发性脂肪酸包括乙酸、丙酸和丁酸的产量均显著高于单独的细菌组或原虫组,说明细菌+原虫组的发酵效率最高,从而表明在羊草细胞壁的降解发酵过程中,原虫促进了瘤胃细菌的活性。Yoder等[29]和Onodera等[23]也观察到,将原虫加到细菌中显著增加了植物纤维素的消化和产酸。这说明在植物细胞壁的降解过程中,原虫对细菌有辅助作用,而不是竞争的关系,正是由于原虫促进了细菌的活性导致了细菌+原虫组的挥发性脂肪酸产量高于单独的细菌或原虫的作用,进一步表明瘤胃细菌和原虫在降解植物细胞壁过程中存在协同效应。另外,在体外培养发酵羊草过程中,细菌+原虫组的发酵液pH值降低、总VFA和总产气量升高,进一步证明羊草细胞壁的发酵程度提高了。
在以粗饲料为主的日粮条件下,从体外产气量、氨态氮、pH值和挥发性脂肪酸的产生量来看,瘤胃细菌在降解羊草的过程中,添加原虫促进了瘤胃细菌的活性,因此是细菌和原虫的共同作用,完成了对植物细胞的消化和降解。结果表明,瘤胃细菌和原虫在降解和利用羊草的过程中存在协同效应而不是竞争的关系。
[1] Wang S,Zhang G,Zhang P,et al. Rumen fluid fermentation for enhancement of hydrolysis and acidification of grass clipping[J]. Journal of Environmental Management,2018,220:142-148.
[2] Forsberg C W, Cheng K J. Molecular strategies to optimize forage and cereal digestion by ruminants[C]//Bills D D, Kung S D, Eds. Biotechnology and Nutrition.Stoneham:Butterworth-Heinemann Publishers, 1992: 107-147.
[3] 冯仰廉. 反刍动物营养学[M]. 北京:科学出版社,2004.
[4] Stewart C S, Flint H J, Bryant M P. The rumen bacteria[C]//Hobson P N, Stewart C S, Eds. In the Rumen Microbial Ecosystem. London:Blackie Academic and Professional Publishers,1997:10-72.
[5] Williams A G,Coleman G S. The rumen protozoa[C]//Hobson P N,Stewart C S,Eds.In the Rumen Microbial Ecosystem. London:Blackie Academic and Professional Publishers,1997:73-139.
[6] Wolin M.The rumen fermentation:a model for microbial interactions in anaerobic ecosystems[J]. Advances in Microbial Ecology,1979,3:49-77.
[7] Dijkstra J,Tamminga S. Simulation of the effects of diet on the contribution of rumen protozoa to degradation of fibre in the rumen[J]. The British Journal of Nutrition,1995,74(5):617-634.
[8] Zhang Y,Gao W,Meng Q. Fermentation of plant cell walls by ruminal bacteria,protozoa and fungi and their interaction with fibre particle size[J]. Archives of Animal Nutrition,2007,61(2):114-125.
[9] Lee S S,Ha J K,Cheng K J. The effects of sequential inoculation of mixed rumen protozoa on the degradation of orchard grass cell walls by anaerobic fungus Anaeromyces mucronatus 543[J]. Canadian Journal of Microbiology,2001,47(8):754-760.
[10] Teather R M,Mahadevan S,Erfle J D,et al. Negative correlation between protozoal and bacterial levels in rumen samples and its relation to the determination of dietary effects on the rumen microbial population[J]. Applied and Environmental Microbiology,1984,47(3):566-570.
[11] 赵广永,冯仰廉,Shand W J. 灌注人工唾液对绵羊瘤胃微生物成分的影响[J]. 动物营养学报,1995,7(3):63.
[12] Menke K H,Steingass H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research Development,1988,28:7-55.
[13] Zhao G Y,Xue Y,Zhang W. Relationship between in vitro gas production and dry matter and organic matter digestibility of rations for sheep[J]. Journal of Animal and Feed Sciences,2007,16(2):229-234.
[14] Broderick G A,Kang J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science,1980,63(1):64-75.
[15] Weatherbum M W. Phenol-Hypochlorite reaction for determination of ammonia[J]. Analytical Chemistry,1967,39(8):971-974.
[16] Chaji M,Mohammadabadi T,Aghaei A. Fermenting cell walls of processed sugarcane pith by ruminal bacteria,protozoa and fungi[J]. International Journal of Agriculture and Biology,2011,13(2):283-286.
[17] Baba Y,Matsuki Y,Mori Y,et al. Pretreatment of lignocellulosic biomass by cattle rumen fluid for methane production:Bacterial flora and enzyme activity analysis[J]. Journal of Bioscience and Bioengineering,2017,123(4):489-496.
[18] Lee S S,Ha J K,Cheng K. Relative contributions of bacteria,protozoa,and fungi to in vitro degradation of orchard grass cell walls and their interactions[J]. Applied and Environmental Microbiology,2000,66(9):3807-3813.
[19] Cheng K J, Forsberg C W, Minato H, et al. Microbial ecology and physiology of feed degradation within the rumen[C]//Tsuda T, Sasaki Y, Kawashima R, Eds. In Physiological aspects of digestion and metabolism in ruminants.Toronto:Academic Press,1991:595-624.
[20] Bauchop T,Mountfort D O. Cellulose fermentation by a rumen anaerobic fungus in both the absence and the presence of rumen methanogens[J]. Applied and Environmental Microbiology,1981,42(6):1103-1110.
[21] Hungate R E. The rumen and its microbes[M]. New York and London:Academic Press,1966.
[22] Thareja A,Puniya A K,Goel G,et al. In vitro degradation of wheat straw by anaerobic fungi from small ruminants[J]. Archives of Animal Nutrition,2006,60(5):412-417.
[23] Onodera R,Yamasaki N,Murakami K. Cellulose-degrading enzyme activities of mixed rumen ciliate protozoa form goats[J]. Agricultural and Biological Chemistry,1998,52(10):2639-2640.
[24] Williams A G,Withers S E. Effect of ciliate protozoa on the activity of polysaccharide-degrading enzymes and fibre breakdown in the rumen ecosystem[J]. The Journal of Applied Bacteriology,1991,70(2):144-155.
[25] Cabeza-Luna I,Carro M D,Fernandez-Yepes J . Effects of modifications to retain protozoa in continuous-culture fermenters on ruminal fermentation,microbial populations,and microbial biomass assessed by two different methods[J]. Animal Feed Science and Technology,2018,240:117-127.
[26] Dong R,Zhao G. Predicting in vitro rumen VFA production using CNCPS carbohydrate fractions with multiple linear models and artificial neural networks[J]. PLoS One,2014,9(12):e116290.
[27] Dong R L,Zhao G Y. The use of artificial neural network for modeling in vitro rumen methane production using the CNCPS carbohydrate fractions as dietary variables[J]. Livestock Science,2014,162(1):159-167.
[28] Zhang H B,Zhang P Y,Ye J,et al. Improvement of methane production from rice straw with rumen fluid pretreatment:A feasibility study[J]. International Biodeterioration & Biodegradation,2016,113:9-16.
[29] Yoder R D,Trenkle A,Burroughs W. Influence of rumen protozoa and bacteria upon cellulose digestion in vitro[J]. Journal of Animal Science,1966,25(3):609-612.