葡萄是一种世界范围内广泛种植的经济水果,在其生长、采收、储藏和运输过程中常常遭受霉菌病害,由此造成巨大的经济损失[1]。葡萄霉菌病主要包括霜霉病、白腐病、黑痘病、炭疽病、灰霉病等,这些病原菌不仅能够在葡萄生长和成熟阶段侵染植株导致减产,还能在采收后继续侵染果实导致脱果、烂果[2-3]。目前,防治葡萄霉菌病害的主要手段有田间管理[4]、物理防治[5]、化学防治[6-7]、培育抗病品种[8]和生物防治[9-10]等。其中,田间管理和物理防治无污染,但效果不明显;化学防治虽然快速高效,但污染环境,威胁人体健康,且容易导致病原菌产生抗药性;培育抗病品种虽然具有很好的效果,但选育周期长、工作量大。有研究者尝试转基因育种[11],将抗病基因导入葡萄苗中,培育抗病新品种,但目前转基因食品存在争议,有可能带来风险。生物防治无毒、有效、经济、安全,是防治病菌病害的新手段,对葡萄品质和保护农业生态环境均具有重要意义。
生防菌是生物防治方法之一,研究发现多种微生物,如芽孢杆菌[12]、枝顶孢霉[13]、异常威克汉姆酵母[14]等,都对葡萄霉菌病具有防治效果。其作用机理是上述微生物具有产几丁质酶或β-1,3-葡聚糖酶能力,这2种酶可水解酶破坏病原菌细胞壁,从而抑制或杀死病原菌[14-15]。传统获取生防菌的方法是从葡萄叶片、果实、葡萄园土壤中分离出单菌株,使用平板对峙法或叶盘法等逐个考察每株菌防治效果,由于没有目的菌株的富集过程,筛选效率较低,工作量较大。这造成现有的葡萄霉菌病生防菌资源较少,限制了葡萄霉菌病害微生物防治的发展。
本研究基于底物压力的筛选方法,以病原真菌细胞壁的关键组分几丁质和β-1,3-葡聚糖作为培养基唯一碳源,筛选可同时产生几丁质酶和β-1,3-葡聚糖酶的菌株。首先经过6轮筛选富集目的菌株,其次对目的菌株进行酶学研究,最后通过16S rDNA鉴定2株葡萄霉菌生防菌。另外,通过本研究方法,可获得大量的潜在的生防菌株,为葡萄霉菌病生防菌的高效筛选提供理论支持。
1 材料和方法
1.1 试验材料
试验菌源:江西高山二号刺葡萄果粉。
培养基:营养琼脂(Nutrient agar,NA)培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,pH值7.2;几丁质(Chitin agar,CA)培养基:几丁质2 g/L,氯化钠5 g/L,七水合硫酸镁 0.2 g/L,磷酸氢二铵1 g/L,磷酸氢二钾1 g/L,pH值7.2;β-1,3-葡聚糖(Glucan agar,GA)培养基:碳源为β-1,3-葡聚糖2 g/L,其他同CA;模拟(SC)培养基:碳源为几丁质2 g/L和β-1,3-葡聚糖2 g/L,其他同CA;固体培养基为液体培养基中加入20 g/L琼脂制得。以上培养基灭菌条件均为121 ℃,20 min。
试验试剂:几丁质和β-1,3-葡聚糖购自Sigma试剂公司;铁氰化钾试剂等均为国产;PCR扩增试剂盒购自生工生物工程(上海)股份有限公司。
试验仪器:紫外可见分光光度计,灭菌锅,超净台,PCR仪等。
1.2 酶活力的测定
几丁质酶与β-1,3-葡聚糖酶酶活力检测方法为改良的Sachales法[16]。具体为:菌液离心,取100 μL上清,加0.4 mL底物(0.5%胶体几丁质或0.5% β-1,3-葡聚糖)和0.5 mL 50 mmol/L醋酸钠缓冲液(pH值5.0),60 ℃下反应15 min后,沸水浴5 min,此为试验组。对照组上清液在反应前沸水浴5 min,其余试验条件同试验组。取1 mL反应液与1.5 mL铁氰化钾试剂混合,沸水浴15 min,冷却后测OD420比色值,以β-D-N-乙酰葡糖胺和葡萄糖做标准曲线。
几丁质酶活定义为在60 ℃,pH值5.0的条件下,每分钟催化几丁质产生1 μmol β-D-N-乙酰葡糖胺的酶量[17]。待测菌液的几丁质酶活(U/mL)=(试验组β-D-N-乙酰葡糖胺含量-对照组β-D-N-乙酰葡糖胺含量)/反应时间,单位菌体几丁质酶活(U/mL)=几丁质酶活/OD600。
β-1,3-葡聚糖酶活定义为在60 ℃,pH值5.0的条件下,每分钟产生1 μmol葡萄糖的酶量[18]。待测菌液的β-1,3-葡聚糖酶活(U/mL)=(试验组葡萄糖含量-对照组葡萄糖含量)/反应时间,单位菌体β-1,3-葡聚糖酶活(U/mL)=β-1,3-葡聚糖酶活/OD600。
1.3 菌株筛选
1.3.1 第1阶段筛选 从江西收集高山二号刺葡萄,随机取25颗置于烧杯中,注入适量生理盐水,加入2~3滴吐温80,混匀,取2 mL上清液接种到50 mL NA液体培养基中,25 ℃下培养48 h。
取上述培养液100 μL接种到CA固体培养基中,37 ℃下培养至有明显菌落长出。取1 mL NA液体培养基将表面菌苔冲洗到50 mL 离心管中,再加入15 mL NA液体培养基,37 ℃培养3 d,此为第1轮筛选。取第1轮筛选的培养液100 μL,重复上述操作,进行第2轮筛选。总共筛选3轮,每轮得到的菌液一部分继续后面的筛选,另一部分用于几丁质酶活和菌浓度的测定。
1.3.2 第2阶段筛选 将第1阶段筛选得到的菌液接种到GA固体培养基中,在37 ℃培养,待有明显菌落长出即进行第2阶段的筛选。第2阶段筛选步骤同第1阶段,但所用培养基为GA固体和液体培养基。筛选进行3轮,每轮得到的菌液一部分继续后面的筛选,另一部分用于几丁质酶活、β-1,3-葡聚糖酶活和菌浓度的测定。
1.3.3 菌株纯化及产酶性能测定 两阶段筛选结束后,从平板上挑取50个较大菌落,反复在NA固体培养基上划线以分离纯化,取其中的10株菌,分别接种到CA液体培养基和GA液体培养基中,37 ℃培养48 h,提取粗酶液测定酶活,计算总酶活和单位菌体酶活。每株菌设置3个平行样。
1.4 酶的表达类型测定
酶的表达类型依据郑天柱等[19]方法进行鉴定,具体为:将菌株分别接种到NA培养基、几丁质(2 g/L)+NA培养基、β-1,3-葡聚糖(2 g/L)+NA培养基、CA培养基和GA培养基中,37 ℃培养48 h,取上清测定酶活。
1.5 模拟自然条件下的菌株性能测定
将待测菌株接种到NA培养基中,37 ℃培养48 h,以2%的接种量接种到SC培养基中,37 ℃下培养,每隔12 h取样,测定酶活。
1.6 菌株鉴定
将待测菌株接种到NA固体培养基上,在37 ℃下培养3 d,观察并记录菌株的菌落特征。挑取部分菌苔,提取基因组DNA并进行PCR扩增,对16S rDNA进行测序。采用通用引物7F 5′-CAGAGTTTG
ATCCTGGCT-3′和1540R 5′-AGGAGGTGATCCAGCC
GCA-3′扩增其16S rDNA片段。PCR反应体系为基因组DNA(20~50 ng/μL)0.5 μL,10×Buffer(Mg2+)2.5 μL,dNTP(各2.5 mmol/L)1.0 μL,Taq DNA聚合酶 0.2 μL,引物F(10 μmol/L)0.5 μL,引物R(10 μmol/L)0.5 μL,加双蒸水至25 μL。PCR反应条件为94 ℃初始变性4 min;94 ℃变性45 s,55 ℃复性45 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min,置于4 ℃保温。PCR产物经生工生物工程(上海)股份有限公司测序。 测序结果在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)上进行Blast 同源性比对分析。
2 结果与分析
2.1 筛选过程与分析
本试验依次进行了6轮筛选,每轮筛选过程中的菌群酶活力如图1所示。从图中可以看出,出发菌群没有表现出明显的几丁质酶活和β-1,3-葡聚糖酶活,说明目的菌株所占比例较小;随着筛选轮数增加,各菌群的2种酶的活力较上一轮都有极显著提高,最终单位菌体几丁质酶活与单位菌体的β-1,3-葡聚糖酶活分别达到0.208 8,0.011 1 U/mL,表明目标菌株得到了有效富集。
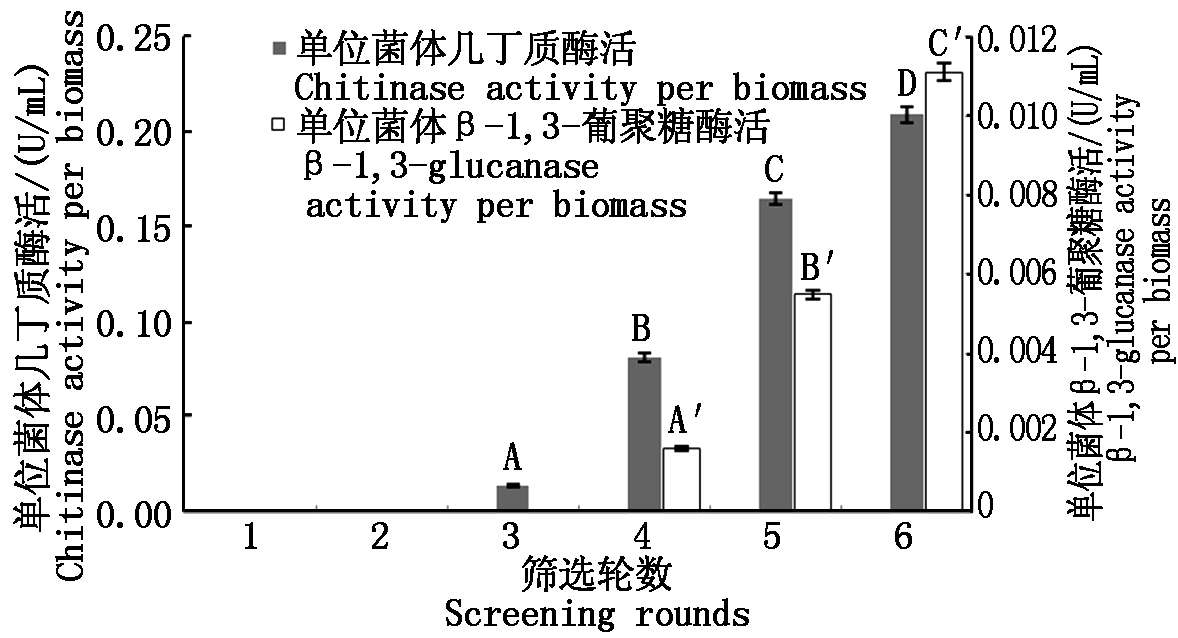
不同大写字母表示0.01水平上差异极显著。图3同。
Capital letters mean significant difference at 0.01 level.The same as Fig.3.
图1 筛选过程中酶活变化
Fig.1 Changes of enzyme activities during screening process
2.2 菌株纯化及产酶性能测定
经6轮筛选后,从平板上挑取50个较大菌落,反复在NA固体培养基上划线以分离纯化,得到10株阳性菌株进行产酶性能研究,结果如图2所示,10株菌株均同时具有几丁质酶活和β-1,3-葡聚糖酶活,筛选阳性率为20%。它们的单位菌体几丁质酶活为0.42~4.09 U/mL,其中,9号菌株单位几丁质酶活最高,其后依次为8号菌和1号菌。单位β-1,3-葡聚糖酶活力为0.28~3.99 U/mL。6号菌株单位β-1,3-葡聚糖酶活性最高,其后是5号菌,1号菌、2号菌、3号菌和10号菌酶活之间没有显著性差异,次于5号菌。综合比较,双酶活性均较高的是1号菌 (单位菌体几丁质酶活力为2.52 U/mL,单位菌体β-1,3-葡聚糖酶活力为0.76 U/mL)和6号菌(单位菌体几丁质酶活为1.45 U/mL,单位菌体β-1,3-葡聚糖酶活为3.99 U/mL)。
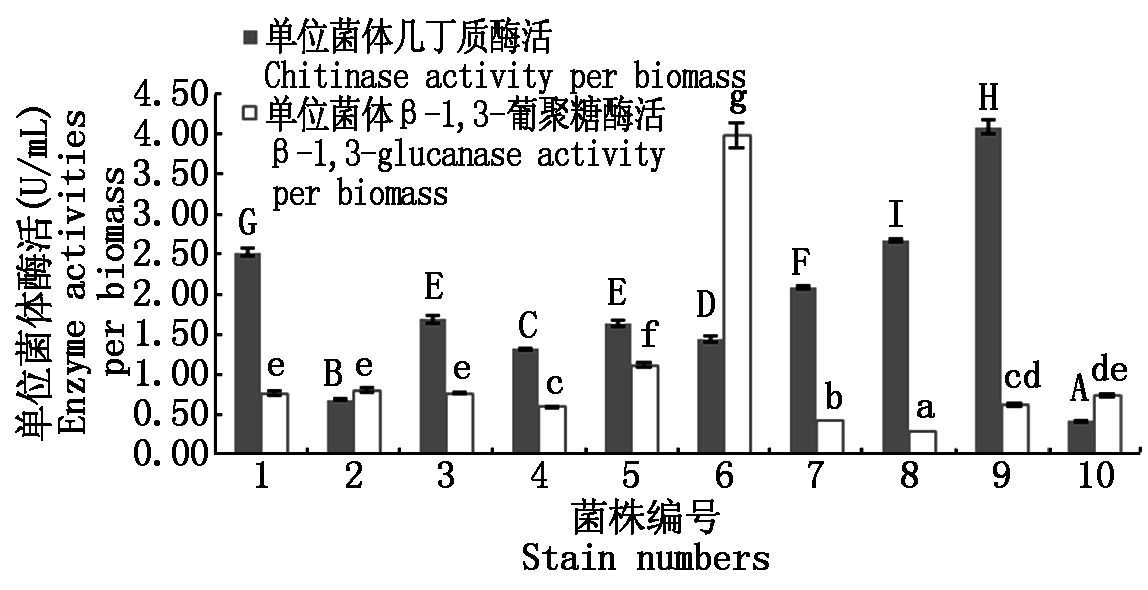
不同大写字母表示0.01水平上有极显著差异;不同小写字母表示0.05水平上有显著差异。
Capital letters mean significance difference at 0.01 level;Lowercase letters mean significance difference at 0.05 level.
图2 菌株酶活测定
Fig.2 Enzyme activities of strains
2.3 酶的表达类型
1号菌和6号菌在不同培养基中的产酶结果如图3所示。在NA培养基中,2株菌的酶活力较低,外加几丁质或β-1,3-葡聚糖,2种酶的酶活力无显著差异性。而在CA培养基中,几丁质酶活力有极显著增加,可正常表达;在GA培养基中,β-1,3-葡聚糖酶活力有显著增加,可正常表达,说明1号菌和6号菌的只有在几丁质或β-1,3-葡聚糖为唯一碳源的条件下才能正常表达,结果证明2株菌的几丁质酶和β-1,3-葡聚糖酶都属于诱导型。
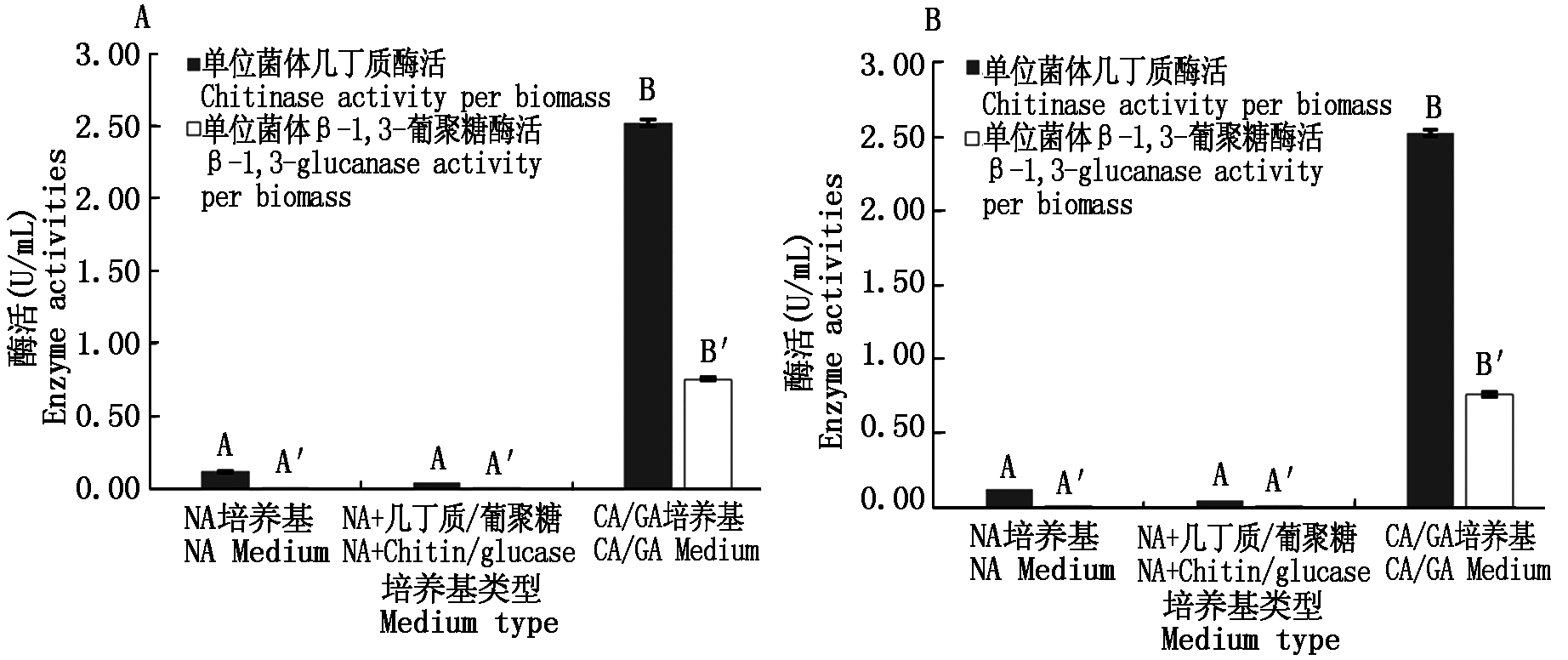
图3 1号(A)和6号(B)菌株在不同培养基中的酶活表现
Fig.3 Enzyme activities of bacteria 1#(A)and 6#(B)in different mediums
2.4 模拟自然条件下的产酶性能
1号菌和6号菌在模拟自然条件下(SC培养基)的产酶结果如图4所示。这2株菌的酶活力均随发酵的进行,先升高后降低。其中,1号菌的几丁质酶活和单位菌体几丁质酶活在36 h达到峰值,分别为0.08,0.10 U/mL;其β-1,3-葡聚糖酶活和单位菌体β-1,3-葡聚糖酶活在60 h时达到峰值,为0.03 U/mL。6号菌株的几丁质酶活和单位菌体几丁质酶活在24 h时达到峰值,分别为0.07,0.10 U/mL;其β-1,3-葡聚糖酶和单位菌体β-1,3-葡聚糖酶酶活在36 h时达到峰值,为0.09 U/mL。
2种酶的酶活力变化与发酵过程中菌体及底物含量变化密切相关。发酵初始,随着菌体数逐渐升高,在几丁质和β-1,3-葡聚糖的诱导下,几丁质酶和β-1,3-葡聚糖酶表达量增加,相应的酶活力升高;随着菌体生长进入稳定期和衰亡期,活细胞数下降,底物浓度也逐渐降低,诱导相应酶的表达量逐渐降低,导致2种酶酶活在达到峰值后开始回落并趋于稳定,与王红梅等[20]的研究结果相似。
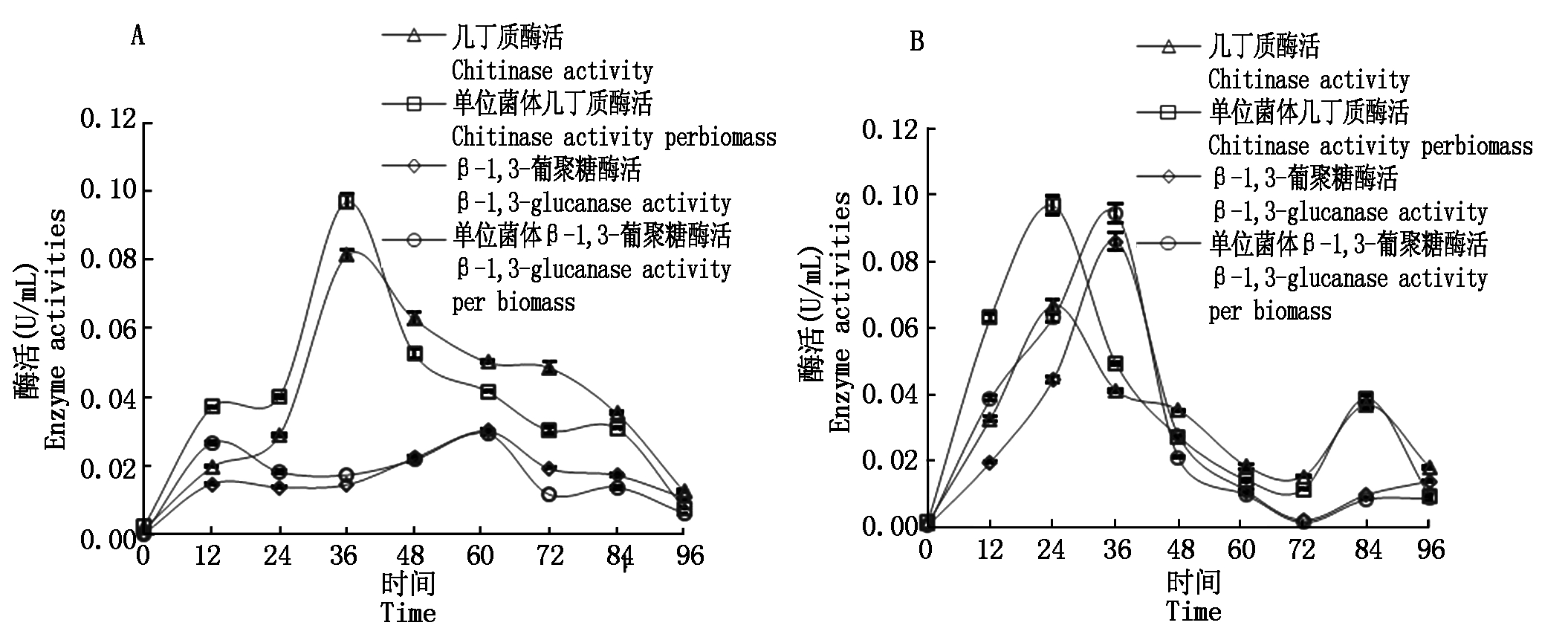
图4 模拟自然条件下1#(A)和6#(B)菌株酶活随时间的变化
Fig.4 Changes of enzyme activities of bacteria 1#(A)and 6#(B)under simulated condition
2.5 菌株鉴定
观察1号菌和6号菌的菌落形态发现,2种菌菌落形态相似,均为表面光滑、微隆起、边缘整齐波状的菌落,可产生水溶性的绿脓素(呈蓝绿色)和荧光素(呈黄绿色),能渗入培养基内,使培养基变为黄绿色。
通过提取2种菌株的基因组DNA,扩增其16S rDNA序列,发现产物序列长度均为1 300 bp左右(图5),送至生工生物工程(上海)股份有限公司测序。经测序1号菌序列长度为1 297 bp,6号菌为1 316 bp,经Blast同源性比对发现,2种菌均分别与假单胞菌(Pseudomonas sp.)(GQ417592.1和JQ396178.1)具有很高的同源性,采用CLUSTAL(X)和MEGA(6.0)软件进行多重序列比较,分别构建系统发育树(图6)。结合菌落形态和16S rDNA测序结果,将1号菌和6号菌分别命名为Pseudomonas sp. Y1和Pseudomonas sp. Y6。
图5 菌株1#和6#的16S rDNA PCR扩增结果
Fig.5 Electrophoresis of PCR amplification products of 16S rDNA from bacteria 1# and 6#

图6 菌株Y1和Y6 16S rDNA系统发育树
Fig.6 The 16S rDNA phylogenetic tree of bacteria Y1 and Y6
3 结论与讨论
在筛选过程中,分别以几丁质(前3轮筛选)、β-1,3-葡聚糖(后3轮筛选)为唯一碳源,为菌群扩增提供了底物压力。只有能产生几丁质酶或/和β-1,3-葡聚糖酶的菌株才可以分解相应的底物获取碳源,满足生长和增殖的需求,而不能产生上述酶的菌株,生长和增殖受限,从而在筛选过程中筛掉,达到了富集目的菌株的目的。富集过程有效地提高了菌株筛选效率,最终筛选阳性率为20%,高于大多传统葡萄霉菌病生防菌筛选方法的效率[21-22],为高效获取葡萄霉菌病害生防菌资源提供了新的思路和方法。
由于几丁质酶与β-1,3-葡聚糖酶共同作用下能够取得更好的防病抗病效果[23-24],因此在筛选出的菌株中选取2种酶活性都相对较高的1号菌(单位菌体几丁质酶活力为2.52 U/mL,单位菌体β-1,3-葡聚糖酶活力为0.76 U/mL)和6号菌(单位菌体几丁质酶活为1.45 U/mL,单位菌体β-1,3-葡聚糖酶活为3.99 U/mL)进行进一步研究。
1号菌与6号菌的几丁质酶和β-1,3-葡聚糖酶都属于诱导型,但在外加几丁质或β-1,3-葡聚糖的NA培养基中,2种酶的酶活力依然很低,其原因可能是NA培养基中碳源抑制了产酶基因的表达[25],林毅等[26]与孙建义等[27]的研究中也出现了类似的结果。
与CA和GA培养基相比,模拟自然条件下(SC培养基)2株菌表达的酶活水平均较低,这可能是由于SC培养基中同时存在几丁质和β-1,3-葡聚糖,2种底物在诱导2种酶表达过程中存在相互抑制现象,具体的作用机理还需进一步的研究。
本研究采用底物压力的方法在菌株筛选中逐渐富集了目的菌株,提高了筛选效率,获得了两株具有应用潜力的假单胞菌(Pseudomonas sp. Y1和Pseudomonas sp. Y6),并研究了它们的性能。这些工作为高效获取葡萄霉菌病害生防菌资源提供了新的思路和方法,对葡萄霉菌病害的生物防治具有重要意义。
此外,虽然在之前的研究中发现假单胞菌对植物病原菌具有良好的拮抗作用[28],但是并未发现相应的葡萄霉菌病生防菌,本研究获得的菌株对开展葡萄霉菌病假单胞菌生防菌的研究提供了基础。
[1] Armijo G,Schlechter R,Agurto M,et al. Grapevine pathogenic microorganisms:understanding infection strategies and host response scenarios[J]. Frontiers in Plant Science,2016,7(382):1-18.
[2] 鄢新民,付雅丽,李学营,等. 葡萄贮藏保鲜研究进展[J]. 中国园艺文摘,2012(10):17-18.
[3] 顾建梅. 葡萄病害综合治理技术刍议[J]. 现代园艺,2012(18):143-144.
[4] 王云华. 葡萄常见病虫害防治技术[J]. 农村科技,2010(3):29.
[5] 李明娟,游向荣,文仁德,等. 葡萄果实采后生理及贮藏保鲜方法研究进展[J]. 北方园艺,2013,37(20):173-178.
[6] 林 羽,潘国栋,胡方南,等. 几种药剂对葡萄病害的防效试验初报[J]. 中国南方果树,2013,42(1):86-88.
[7] 艾 青. 葡萄病虫害的农业与化学防治[J]. 西北园艺:果树,2012(4):35-36.
[8] 林 玲,张 瑛,谢太理,等. 葡萄新品种桂葡4号选育及其栽培技术[J]. 南方农业学报,2016,47(5):617-621.
[9] Ji Muxiang,Yao Kebing,Miu Kang,et al. Toxicity test and field control effect of 4 different fungicides on grape downy mildew[J]. Agricultural Science & Technology,2016,17(7):1654-1657,1752.
[10] Droby S,Wisniewski M,Teixido N,et al. The science,development,and commercialization of postharvest biocontrol products[J]. Postharvest Biology and Technology,2016,122(SI):22-29.
[11] Nookaraju A,Agrawal D C. Enhanced tolerance of transgenic grapevines expressing chitinase and beta-1,3-glucanase genes to downy mildew[J]. Plant Cell Tissue and Organ Culture,2012,111(1):15-28.
[12] 郭继平,马 光,高小宽,等. 葡萄霜霉病拮抗细菌N22的筛选鉴定及其防效初探[J]. 中国植保导刊,2016,36(4):9-14.
[13] Lo Piccolo S,Alfonzo A,Giambra S A,et al. Identification of acremonium isolates from grapevines and evaluation of their antagonism towards Plasmopara viticola[J]. Annals of Microbiology,2015,65(4):2393-2403.
[14] Parafati L,Vitale A,Restuccia C A. Biocontrol ability and action mechanism of food-isolated yeast strains against Botrytis cinerea causing post-harvest bunch rot of table grape[J]. Food Microbiology,2015,47:85-92.
[15] 刘 普,方静凡,程运江,等. 生防酵母菌防治果品采后病害机理的研究进展[J]. 华中农业大学学报,2013,32(2):134-140.
[16] Xia G Q,Jin C S,Zhou J,et al. A novel chitinase having a unique mode of action from Aspergillus fumigatus YJ-407[J]. European Journal of Biochemistry,2001,268(14):4079-4085.
[17] 刘蒲临,程德勇,缪礼鸿. 产几丁质酶侧孢短芽孢杆菌的筛选及其酶学性质研究[J]. 生物技术通报,2016,32(6):174-180.
[18] 郑必胜,王玉霞. 裂褶菌发酵产β-1,3-葡聚糖酶条件的优化[J]. 现代食品科技,2011,27(6):643-646,633.
[19] 郑天柱,张庆庆,胡 俊,等. 胶体几丁质诱导红曲霉产几丁质酶的研究[J]. 安徽工程大学学报,2014,29(4):1-3,14.
[20] 王红梅,蒋立科,陶 芳,等. 哈茨木霉高产几丁质酶菌株的筛选及产酶条件研究[J]. 浙江大学学报:农业与生命科学版,2010,36(2):146-152.
[21] 郭继平,马 光,朱会霞,等. 葡萄霜霉病拮抗真菌的分离筛选及鉴定[J]. 东北农业科学,2014,39(5):72-75.
[22 ] 谢雪迎,王贻莲,扈进冬,等. 拮抗葡萄霜霉病生防细菌的筛选及其抑菌效果研究[C]// 中国植物病理学会青年学术研讨会论文选编. 2015.
[23] 王廷璞. β-1,3-葡聚糖酶和几丁质酶在农作物病虫害防治中的研究进展[J]. 安徽农业科学,2010,38(26):14417-14419.
[24] Mauch-Mani B. Inhibition of fungal growth by combinations of chitinase and β-1,3-glucanase[J]. Plant Physiology,1988,88(3):936-942.
[25] 李 丽,杨雪松,刘红全. 微生物几丁质酶的特性及其应用的研究进展[J]. 广西民族大学学报:自然科学版,2011,17(1):92-96.
[26] 林 毅,洪雪梅,彭 锟. 碳源对苏云金杆菌HD224菌产几丁质酶的影响[J]. 食品工业科技,2006(3):98-99.
[27] 孙建义,李卫芬,顾赛红. 木霉GXC产β-葡聚糖酶条件和酶学性质[J]. 微生物学报,2001,41(4):457-462.
[28] 左 静,廖晓兰. 应用假单胞菌防治植物真菌性病害研究进展[J]. 现代农业科技,2011(22):164-165,167.