光不仅是植物光合作用的能量来源,也是影响植物生长发育的重要环境因子。光质的改变可严重影响植物生理过程、形态建成和生长发育,而光质对植物生理过程、形态建成和生长发育的影响会因植物种类的不同而发生变化。相比于其他光谱区域,红光和蓝光可被光合色素更有效的吸收[1-2]。蓝光通常促进气孔的开放,这会促进植株光合能力的提高并伴随着干物质产量的增加[3]。红光诱导K+、溶质从保卫细胞流出,导致气孔关闭[4]。较多研究表明,蓝光可调控叶绿素的合成,生长在蓝光下的植株具有较高的叶绿素a/b比值、较少的LHCII数量和较高的Rubisco活性[5-7]。而相比于生长在白光或红蓝LEDs组合光下的植株,生长在红光下的植株其叶绿素a/b比值、植株生物量较低[8-9]。蓝光可抑制叶片展开、下胚轴伸长[10-11],而红光促进叶片展开、下胚轴伸长[12-13]。也有研究发现,与单质红光相比,单质蓝光也可促进植株茎伸长[14]。蓝光可在其较低的强度下(100 μmol/(m2·s)),促进植株叶片的形态和光合作用呈现阳生特性[15-16]。无论是在有限光还是饱和光条件下,生长在红蓝LEDs混合光下水稻(Oryza sativa L.)的光合速率均高于在单质红光LEDs下生长的植株[17]。以上研究结果说明,红光、蓝光和红蓝混合光可影响植株的光合作用、形态建成和生理特性。
桑树(Morus alba L.)的果实和叶片具有较高的经济价值和药用价值,黑龙江盐碱土地区传统的桑树种植方式主要是以大田种植为主,而随着农业的迅速发展,设施栽培桑树在黑龙江盐碱土地区有了一定面积的种植。但在设施栽培条件下,晚秋、冬、春等季节都不同程度地存在光照时间短、光照不足等严重缺光的问题,使设施栽培植物不能正常生长,会严重地影响桑树果实的产量和品质。因此,选取有效的人工光源或制定可行的补光措施对设施栽培桑树的发展具有重要意义。目前,发光二极管(LEDs)已发展成为一种可为植物提供光照的较好的光源[18-19]。相比于那些宽光谱的光源,LEDs发射的光只在一个狭窄的波段内,因此,LEDs为研究不同光质对植物的生长发育、光合作用的影响提供了较好的方法。然而,还未见关于红光LEDs和蓝光LEDs对桑树植株形态、光合作用和生理特性影响的报道。为此,本试验评价了白光、单质红光LEDs、红蓝组合LEDs、单质蓝光LEDs对桑树幼苗生长、生理生化特性和叶片光系统Ⅱ功能的影响,旨在为设施栽培桑树下光质条件的调控提供基础数据。
1 材料和方法
1.1 材料与培养环境
试验于2015年5月进行,供试材料为1年生桑树品种龙桑1号幼苗(Morus alba L. cv. Longsang No.1),去掉桑树幼苗的分枝、叶片和须根,仅保留主茎、主根各约2 cm,然后将幼苗移栽到直径8 cm、高12 cm的培养盆中,培养盆内装草炭土和蛭石的混合培养基质(2∶1,V/V),每盆定植1株。每株只保留一支枝条,抹去其他的芽。在移栽后将所有植株放置在人工气候室中,由白色冷荧光灯(广州绿荧光电有限公司)(波长为410~700 nm)提供光照,光照强度为100 μmol/(m2·s),环境条件控制为:光周期(14 h/10 h,光/暗),白天温度(28±2)℃,夜间温度(23±2)℃,相对湿度60%~65%。每3 d浇1次水。
1.2 光质处理方法
幼苗培养21 d后挑选健壮、长势一致的幼苗接受不同红蓝光配比处理。一些幼苗仍在白色冷荧光灯下培养,作为白光对照处理(CK),其他分别在红光LEDs阵列、红蓝组合LEDs阵列、蓝光LEDs阵列光源下培养,以上LEDs阵列光源均由广州绿荧光电有限公司提供。组成LEDs阵列的红光LED和蓝光LED的峰值波长分别为660,465 nm,半峰全宽均为20 nm。由红光LEDs、红蓝组合LEDs、蓝光LEDs阵列光源提供的6种不同红蓝光配比的光照可分别按光照中蓝光(B)的光合光量子通量密度(PPFD)所占比例表示为单质红光(0B)、红蓝组合光(15%B、20%B、30%B和50%B)、单质蓝光(100%B)。不同光源的光谱和光照强度通过光谱仪(OPT-2000,Optpe Co.,中国)和光量子传感器(LI-250A,Licor,美国)测定。放置不同光源的灯架外部用遮光布覆盖,以避免外界光照干扰。通过调整光源到植株顶部的距离,使各处理的光照强度保持在100 μmol/(m2·s),其他环境条件同1.1。每处理各20盆植株,3次重复。幼苗在不同光质处理下培养30 d后,选取从顶端往下数第2片完全展开叶片进行各项指标测定。
1.3 测定指标与方法
1.3.1 生长指标测定 各处理均随机选取5株幼苗,测定从植株茎基部到顶部的茎长度;用叶面积仪测定叶片面积(LI-3000C,Licor,美国);将植株的茎、叶杀青后,在80 ℃下烘干至恒质量,用电子天平称量干质量;根据从顶端往下数第2片完全展开叶片的叶面积、干质量计算比叶质量(LMA)。
1.3.2 生理指标测定 各处理均随机选取3株幼苗进行各项指标测定。用打孔器从新鲜叶片上取6个小圆形叶片,每个1.5 cm2,将其浸没在15 mL 80%丙酮(V/V)中,待叶片变白后,用分光光度计(TU-1810,Persee Co.,中国)测定提取液的吸光度,按照Arnon[20]的方法计算叶绿素含量。叶片中可溶性蛋白含量的测定参照Bradford[21]的方法。
桑树叶片Rubisco含量测定参考Makino等[22]的方法,稍作改进:取0.4 g桑树叶片,在冰浴条件下,加入6 mL内含5 mmol/L巯基乙醇和12.5%丙三醇(V/V)的50 mmol/L Tris-HCl缓冲液(pH值8.0),研磨成匀浆,4 ℃、12 000 r/min离心20 min,取上清液,加入相同体积内含2% SDS(m/V)、4%巯基乙醇(V/V)和10%丙三醇(V/V)的溶解液,置于沸水浴条件下10 min,冷却后用于SDS-PAGE。每个处理取20 μL加样,具体电泳步骤按照Makino等[22]所述方法。电泳完成后,用蒸馏水反复漂洗胶,然后将胶放入含有0.25%考马斯亮蓝R-250(m/V)的染色液中,保证染色液没过胶,在25 ℃下振荡染色2 h。然后将胶置于脱色液中,25 ℃下振荡脱色,中间换脱色液4~6次,直至胶的背景完全脱色。将Rubisco的大小亚基条带切下,放在离心管中,加入3 mL甲酰胺。再将离心管置于50 ℃下水浴约6 h。以背景胶洗脱液为空白对照,测定595 nm下各洗脱液的吸光度,用牛血清蛋白做标准蛋白,最后计算Rubisco含量。桑树叶片Rubisco活性测定参照Nakano等[23]的方法。
1.3.3 光合气体交换参数和叶绿素荧光参数测定 利用LI-6400XT便携式光合仪(Licor,美国)测定从植株顶端往下数第2片完全展开叶片的净光合速率(Pn)、气孔导度(Gs),叶室温度控制为(28±1)℃,相对湿度65%,外界CO2浓度为400 μmol/mol,各处理植株气体交换参数测定时的光源与其培养时的光源相同,光强为100 μmol/(m2·s)。用与测定气体交换参数相同的叶片测定叶绿素荧光参数,叶绿素荧光参数利用FMS-2叶绿素荧光仪(Hansatech,英国)测定,在测定之前先将植株暗适应30 min,PSⅡ的最大光化学效率(Fv/Fm)、PSⅡ的实际光化学效率(ΦPSⅡ)、开放的PSⅡ反应中心激发能的捕获效率(Fv′/Fm′)、非光化学猝灭(NPQ)参照Wingler等[24]所述的方法测量和计算。
1.4 数据统计分析
利用SPSS 17.0软件对数据进行方差分析(One-way ANOVA)分析,并比较不同数据组间的差异(LSD,α=0.05)。采用Microsoft Excel 2007作图,图表中数据均为3次或3次以上重复的平均值±SD。
2 结果与分析
2.1 不同红蓝光配比对桑树幼苗生长的影响
由图1可以看出,不同红蓝光配比处理对桑树幼苗生长有明显影响。红光处理下植株的茎长最大且显著高于对照及其他处理。生长在红蓝组合光下植株的茎长随着红蓝组合光中蓝光比例的增大而逐渐变小,除在红蓝组合光(15%B)处理下植株的茎长与对照相比无显著差异,其他各红蓝组合光处理下茎长均显著低于对照。蓝光处理下植株的茎长最小且显著低于对照及其他各处理。
由图1可以看出,不同红蓝光配比处理下植株叶面积的变化趋势与茎长相同,但红光处理下植株叶面积与对照相比并无显著差异,同时在红蓝组合光(20%B)处理下植株叶面积虽低于对照,并未达到差异显著水平。与不同红蓝光配比处理下茎长、叶面积的变化趋势不同,红光下处理植株的比叶质量(以干质量计)显著低于对照及其他各处理,而且随着红蓝组合光中蓝光比例的增大,比叶质量呈现逐渐增大的趋势,但与对照相比,各红蓝组合光处理下植株的比叶质量并未显著增加,而蓝光处理下植株的比叶质量最大且显著高于对照及其他各处理。不同红蓝光配比处理下植株的叶干质量、茎干质量变化趋势相似,均表现为对照白光处理下的叶干质量、茎干质量最大且显著高于其他各处理,而红光、蓝光处理下植株的叶干质量、茎干质量显著低于对照和红蓝组合光处理,在红蓝组合光处理下,植株的叶干质量、茎干质量随蓝光比例的增大而呈现降低的趋势。

不同小写字母表示处理间差异显著 (P<0.05)。图2-4同。
Different small letters indicate significant difference (P<0.05). The same as Fig.2-4.
图1 不同红蓝光配比对桑树幼苗生长的影响
Fig.1 Effects of different proportions of red and blue light on growth of mulberry seedlings
2.2 不同红蓝光配比对桑树幼苗叶片光合气体交换参数的影响
由图2可以看出,不同红蓝光配比处理对桑树叶片的气体交换参数有明显影响。红光处理下植株叶片的净光合速率Pn最小且显著低于对照和其他各光质处理,红蓝组合光处理下叶片的Pn显著高于对照和红光处理,其中在红蓝组合光(20%B)处理下Pn最大;而蓝光处理下植株叶片的Pn低于各红蓝组合光处理,但显著高于对照。红光处理下叶片的气孔导度Gs显著低于对照及其他各光质处理,而蓝光处理下叶片的Gs最大且显著高于对照及其他各处理。同时如图2所示,除对照外,植株叶片的Gs随照光中蓝光比例的增加总体呈现上升的趋势。以上结果说明,蓝光可促进桑树叶片Gs增大。
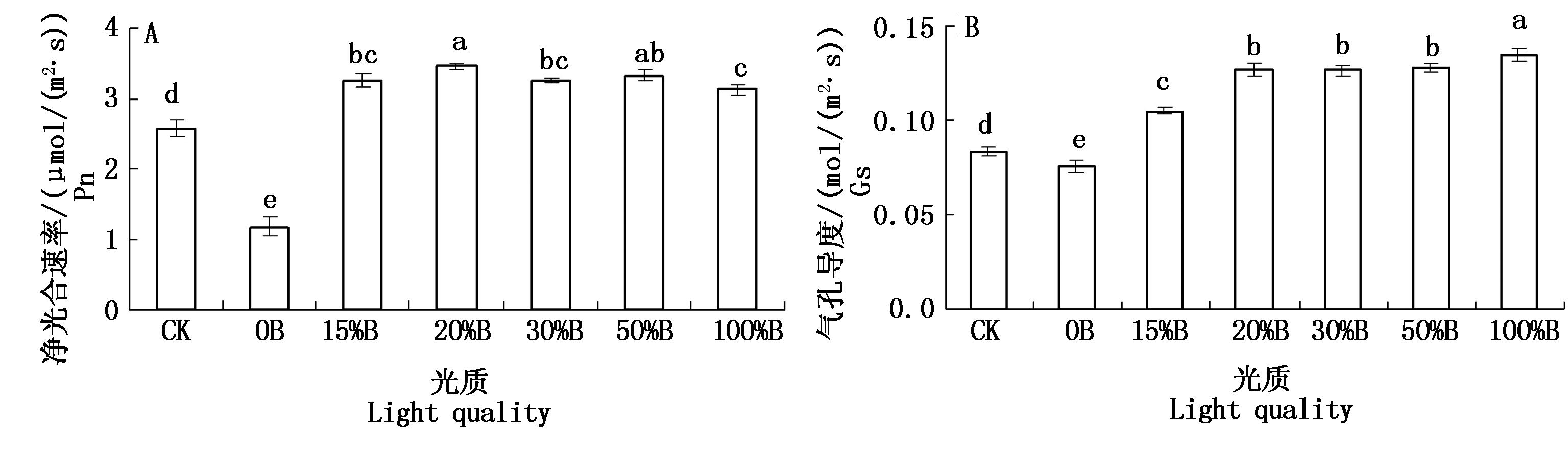
图2 不同红蓝光配比对桑树叶片光合气体交换参数的影响
Fig.2 Effects of different proportions of red and blue light on photosynthetic gas exchange parameters of mulberry leaves
2.3 不同红蓝光配比对桑树幼苗叶片荧光参数的影响
由图3可以看出,红光处理下桑树幼苗叶片的Fv/Fm最小且显著低于对照及其他各处理,虽然红蓝组合光及蓝光处理下叶片的Fv/Fm显著低于对照,但显著高于红光处理。红光、蓝光处理下植株叶片的ΦPSⅡ显著低于对照及红蓝组合光处理;而就红蓝组合光处理而言,除了红蓝组合光(15%B)下的ΦPSⅡ显著低于对照,其他各红蓝组合光处理的ΦPSⅡ与对照相比均无显著差异。红光、蓝光处理下植株叶片的NPQ显著高于对照及红蓝组合光处理,而在红蓝组合光处理下,除了红蓝组合光(15%B)下植株叶片的NPQ显著高于对照,其他各红蓝组合光处理下叶片的NPQ与对照相比均无显著差异。不同红蓝光配比处理下植株叶片Fv′/Fm′的变化趋势与ΦPSⅡ相似,表现为红光、蓝光处理下叶片的Fv′/Fm′显著低于对照及红蓝组合光处理;而在红蓝组合光处理下,除了生长在红蓝组合光(15%B)下叶片的Fv′/Fm′显著低于对照,其他各红蓝组合光处理下叶片的Fv′/Fm′与对照相比均无显著差异。
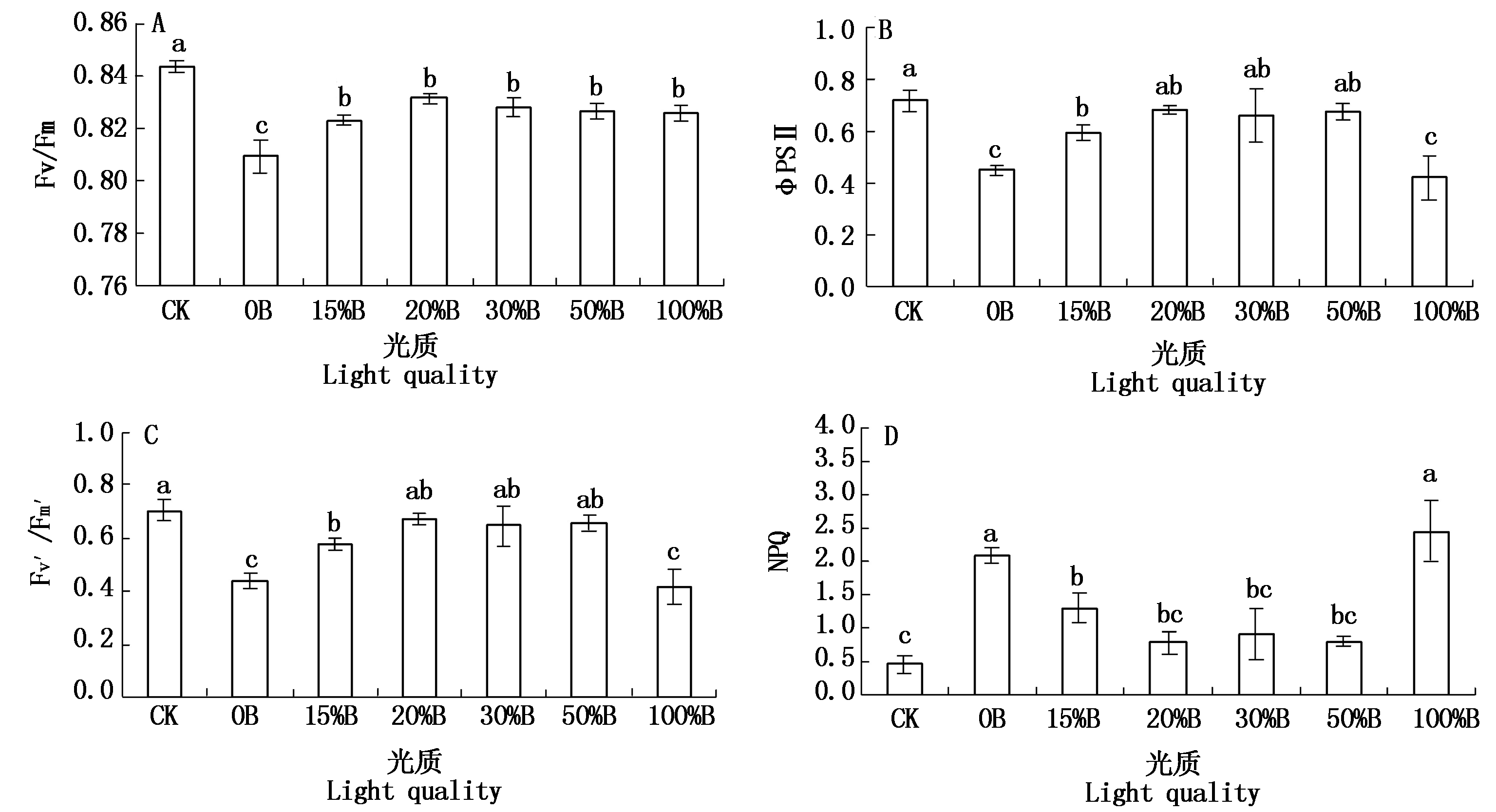
图3 不同红蓝光配比对桑树叶片荧光参数的影响
Fig.3 Effects of different proportions of red and blue light on chlorophyll fluorescence parameters of mulberry leaves
2.4 不同红蓝光配比对桑树幼苗叶片单位面积叶绿素含量、可溶性蛋白含量、Rubisco含量和活性的影响
由图4可以看出,红光处理下桑树幼苗叶片的单位面积叶绿素含量(以鲜质量计)最低且显著低于对照及其他各处理;在红蓝组合光处理下叶片叶绿素含量随着蓝光比例的增加而呈现上升趋势,在红蓝组合光(20%B、30%B)处理下叶绿素含量与对照相比无显著差异,而在红蓝组合光(50%B)处理下叶绿素含量显著高于对照及其他各处理,按照从红光开始叶绿素含量随光照中蓝光比例升高而增加的趋势,蓝光下的叶绿素含量将达到最大值,但图中结果表明,与红蓝组合光(50%B)处理相比,蓝光处理下叶片的叶绿素含量显著降低,但与对照相比差异不显著。不同红蓝光配比处理下叶片可溶性蛋白含量(以鲜质量计)的变化趋势与叶绿素含量不同,虽然红光下的可溶性蛋白含量最小且显著低于红蓝组合光处理和蓝光处理,但其与对照相比并无显著差异,同时随着红蓝组合光中蓝光比例的增大,叶片中的可溶性蛋白含量也逐渐升高,在蓝光处理下达到最大值,而且在红蓝组合光(30%B、50%B)及蓝光处理下可溶性蛋白含量均显著高于对照。

图4 不同红蓝光配比对桑树叶片单位面积叶绿素含量、可溶性蛋白含量、Rubisco含量和Rubisco活性的影响
Fig.4 Effects of different proportions of red and blue light on the chlorophyll content per unit leaf area,soluble protein content,rubisco content and rubisco activity of mulberry leaves
如图4所示,不同红蓝光配比对桑树幼苗叶片的Rubisco含量(以鲜质量计)和活性具有明显影响。红光处理下的Rubisco含量最低,而蓝光处理下的Rubisco含量最高,红蓝组合光处理(20%B、30%B 和50%B)、蓝光处理下的Rubisco含量均显著高于对照和红光处理。红光处理下的初始Rubisco活性、总Rubisco活性最低,随着红蓝组合光中蓝光比例的增大,初始Rubisco活性、总Rubisco活性逐渐增加,在蓝光处理下达到最高水平;红蓝组合光(30%B、50%B)及蓝光处理下的初始Rubisco活性、总Rubisco活性均显著高于对照及红光处理,红蓝组合光(15%B、20%B)处理下的活性与对照相比无显著差异。与对照相比,Rubisco的活化比例除在红光处理下显著低于对照,其他各处理下Rubisco的活化比例与对照相比无显著变化。
3 讨论
光质(光谱)的变化可显著影响植株的生长和发育,蓝光、红光可以通过多种途径影响植物的发育[25]。Ouzounis等[26]的研究发现,红光可促进蝴蝶兰(Phalaenopsis)叶面积的增大,而蓝光则导致植株叶面积变小。有研究表明,与白光处理相比,红光可使黄瓜(Cucumis sativus L.)株高显著增加,蓝光显著抑制茎伸长导致株高降低[27]。Wu等[28]的研究表明,与白光对照相比,蓝光可造成番茄(Solanum lycopersicum L.)株高显著降低,而红光对株高无显著影响,同时蓝光、红光均可导致叶面积大幅降低。O′carrigan等[29]的研究则发现单质红光处理下番茄的株高明显高于单质蓝光处理。本试验的研究结果表明,与白光对照相比,红光处理使桑树幼苗叶面积和茎长明显提高,而随着蓝光比例的增大,叶面积和茎长逐渐降低,在蓝光处理下叶面积和茎长最小,这说明红光、蓝光在对桑树幼苗叶片展开和茎伸长上似乎存在相互拮抗作用。而Hernandez等[30]的研究结果表明,黄瓜的株高、上胚轴长度、下胚轴长度及叶面积在单质红光处理下最大,光照中的蓝光比例增大导致这些指标逐渐降低,但单质蓝光却引起这些指标明显增加。以上研究发现表明,红光、蓝光可明显影响植物茎的伸长,而且植物对光质的响应是物种依赖的。
较多研究表明,光质对植物细胞分裂具有明显影响,蓝光区(400~500 nm)可被蓝光光受体感受,通过蓝光受体介导的反应可抑制原管藻(Protosiphon botryoides (Kuetzing)Klebs)的细胞分裂[31];而红光可促进莱茵衣藻(Chlamydomonas reinhardtii P.A.Dangeard)的细胞分裂[32]。关于光对高等植物细胞分裂影响的研究结果与对单细胞藻类的研究结果具有可比性。例如,有研究表明,不同红蓝光配比处理(红光、蓝光、红蓝组合光)可影响欧美杨(Populus euramericana)组培苗叶片细胞的分裂,但不同品种对相同光质的响应存在差异[33]。Dougher和Bugbee[34]的研究表明,光照中蓝光比例的增大(从小于0.1%到26%)可抑制大豆(Glycine max L.)茎中细胞分裂,造成节间变短;而光照中蓝光比例从6%增大到26%可抑制大豆叶片细胞扩展,导致叶面积变小。结合这些前人结果,本试验中随着蓝光比例的增加,桑树幼苗茎长和叶面积变小,也可能是由于细胞分裂和细胞扩展受抑制所致。但是也有研究结果表明,光照中蓝光比例由0增大到6%,莴苣(Lactuca sativa L.)叶片细胞分裂、细胞扩展分别提高了1.6倍和3.1倍,从而造成了莴苣叶面积的增大[34]。由此可见,蓝光对植物细胞分裂的影响也是物种依赖的。
光照中较高的蓝光比例,通常与植物“阳生型”叶片的发育相关,这些叶片具有较高的LMA[35]。Terfa等[36]研究发现,LEDs(蓝光比例为20%)下生长的月季(Rosa×hybrida)LMA显著高于HPS(蓝光比例为5%)下生长植株,而叶面积显著低于HPS处理。本试验中,蓝光比例增大导致桑树比叶质量显著增加,而叶面积显著降低。前人研究发现叶片对光照中蓝光比例增加的响应与叶片对光强增加的响应相似[37-38]。同时叶面积的降低及比叶质量LMA的增大是植物对高光强的响应特征,因此,本试验中,尽管光照强度较弱(100 μmol/(m2·s)),桑树叶片对具有较高蓝光比例光照的响应与叶片对光强较高光照的响应相似。
本试验研究结果表明,白光处理(对照)最有利于桑树幼苗地上干物质的积累,而随着蓝光比例的增加(15%~100%),桑树的茎干质量、叶干质量逐渐降低。这与红蓝LEDs组合光对黄瓜生物量的影响相一致[30]。茎干质量、叶干质量的降低可能是由于随着蓝光比例增加(15%~100%),叶面积减小进而造成桑树植株对光能的截获能力下降,光能截获量的降低显然会影响植物生长,可能造成生物量的降低。尽管红光处理下桑树叶片的净光合速率Pn显著低于蓝光处理,但本研究中红光处理下的茎干质量、叶干质量明显高于蓝光处理,可能是由于红光处理下叶面积远大于蓝光处理,增大了叶片的光能截获量。本研究中红光处理下的茎干质量、叶干质量明显低于红蓝组合光处理(蓝光比例为15%~20%)则可能归因于红蓝组合光处理下叶片的Pn远高于红光处理。与此结果相一致的是,生长在红蓝组合光下不结球白菜(Brassica campestris L.)的干质量显著高于单质红光处理[39]。
有研究表明,随着红蓝组合光中蓝光比例的增加(0~100%),黄瓜叶片的净光合速率逐渐升高,而单质红光处理下的Pn最低[37]。本试验结果与此相似。有研究认为,红光处理下黄瓜叶片的Pn明显低于红蓝组合光处理可能是由于缺少蓝光导致光合机构功能失调(Fv/Fm、ΦPSⅡ降低)以及红光下极低的Gs造成的[37]。与此相似的是本试验中,红光处理下的Fv/Fm、ΦPS Ⅱ和Gs明显低于红蓝组合光处理,这表明单质红光可导致桑树幼苗叶片中PSⅡ的功能失调和光化学活性降低,同时影响桑树幼苗叶片的气体交换,显然Fv/Fm、ΦPSⅡ和Gs的降低,可能是红光处理下Pn明显低于红蓝组合光处理的原因。除此之外,红光处理下叶片较低的叶绿素含量、可溶性蛋白含量也可能是造成Pn低于红蓝组合光处理的原因,这是因为植物叶片羧化效率受Rubisco的含量和活化程度的限制,而Rubisco是叶片中可溶性蛋白的主要组成部分,占植物叶片中可溶性蛋白的50%左右,可溶性蛋白含量下降表明作为其主要组分的Rubisco含量也有可能降低,本试验对桑树叶片Rubisco含量的测定结果也证明了这一点。此结果与红蓝组合光处理下水稻叶片Pn高于红光处理,是由于红蓝组合光处理下叶片总氮含量、叶绿素和Rubisco等光合作用相关组分含量增加引起的观点相似[40]。
气孔在调节叶片气体交换中发挥重要作用,前人的研究结果表明,蓝光可通过快速并可逆的调节气孔孔径,从而影响气孔导度[41]。相比其他波长的光,蓝光对促进气孔张开更为有效,比如在相同光强下,蓝光促进鸭拓草(Commelina communis L.)气孔张开的有效性大于红光、绿光[3,42]。有研究认为这一过程可能是由吸收蓝光的玉米黄质介导的[42],但向光素和隐花色素也可能在这一过程中起作用[43-44]。Terfa等[36]发现光照中蓝光比例增大,月季的Gs增加;O′carrigan等[45]的研究表明,蓝光处理下番茄的Gs大于白光、红光处理,红光处理下的Gs最小,同时不同光质处理下气孔长度、宽度和孔径与Gs呈现显著正相关;Wang等[27]发现,白光、红光处理下黄瓜植株的Gs无显著差异,而蓝光处理下的Gs显著高于白光、红光处理。本研究结果表明,随着蓝光比例增加(0~100%),Gs总体呈现升高趋势,蓝光有利于桑树叶片Gs增大。与此相一致的是,Hogewoning等[37]发现黄瓜Gs也随蓝光比例增加而升高,同时他们也认为Gs的增加与气孔密度、气孔孔径相应提高有关。
Wang等[27]发现与白光及蓝光处理相比,红光处理下黄瓜植株的Fv/Fm、ΦPSⅡ和Fv′/Fm′显著降低,而NPQ大幅提高;Ouzounis等[26]发现红光处理下蝴蝶兰的Fv/Fm显著低于红蓝组合光处理。本研究结果表明,红光处理下桑树幼苗叶片的Fv/Fm、ΦPSⅡ显著低于对照及红蓝组合光处理。以上结果说明,光质可调控桑树PSⅡ的功能。由于Fv/Fm反映的是PSⅡ最大光化学效率的高低,其常被用作表明环境胁迫的指标,Fv/Fm的降低通常与PSⅡ受伤害或活性下调有关。因此,本试验结果表明红光处理下叶片PSⅡ的光化学活性降低。Hogewoning等[37]把红光下黄瓜叶片较低的Fv/Fm、ΦPSⅡ归因于光合机构发育和功能失调。Schmid等[46]认为红光下伞藻(Acetabularia mediterranea Lamour.)的Fv/Fm降低和光合作用受抑制可能与核心天线叶绿素蛋白复合体数量减少,捕光天线复合体与PSⅡ反应中心解耦联有关。Mochizuki等[47]的研究表明,临界强度为5 μmol/(m2·s)的蓝光可通过隐花色素激活拟南芥(Arabidopsis thaliana L.)中编码PS反应中心D2蛋白的psb D基因表达。因此,红光下桑树幼苗叶片Fv/Fm降低可能与光合机构功能失调或叶片合成D2蛋白能力受损有关。本研究中,相比于红光处理,红蓝组合光下的Fv/Fm显著增加,这说明一定比例的蓝光在某种程度上可缓解红光造成的光合机构功能失调,但光质调控桑树PSⅡ功能的机理还有待进一步研究。本试验中,虽然蓝光处理下的Fv/Fm显著高于红光处理,但ΦPSⅡ却与红光处理并无显著差异。这与前人的研究结果并不一致[37]。同时也说明单质蓝光不利于桑树叶片PSⅡ保持较高的光化学效率,这可能与单质光可造成能量在2个光系统间的不均衡分配,导致光合作用下调有关[48]。同时本试验中,红光、蓝光处理下的NPQ显著高于红蓝组合光处理,而Fv′/Fm′则显著低于红蓝组合光处理,这说明红光、蓝光处理下较低的ΦPSⅡ,也与NPQ升高,而Fv′/Fm′降低有关。
Wang等[27]研究结果表明,与白光处理相比,蓝光下黄瓜植株叶片的Rubisco活性显著提高,而红光处理下显著降低,同时蓝光促进了rbcS和rbcL的表达,而红光导致rbcS和rbcL表达下调;也有研究表明,与白光处理相比,红光、蓝光处理下番茄叶片的Rubisco相对含量降低,而蓝光上调rbcS和rbcL的表达,基因的表达情况(mRNA水平)与Rubisco含量并不相关,光质可能是在转录后水平上调控Rubisco的表达[28]。本试验结果表明,红光处理下的Rubisco含量显著低于对照及其他各光质处理,这说明红光不利于Rubisco的合成,而补充蓝光可促进Rubisco含量增加。同时结合前人研究结果,不同光质有可能调控桑树Rubisco相关基因表达,进而影响Rubisco含量,此方面问题还有待进一步研究。同时本试验中红光处理下叶片的初始Rubisco活性、总Rubisco活性和Rubisco活化比例明显低于红蓝组合光处理,说明红光处理下活化的Rubisco减少,而这主要是Rubisco含量和活化程度降低造成的,而补充蓝光可能有利于减弱红光对Rubisco活化的不利影响。红蓝组合光、蓝光处理下较高的初始Rubisco活性、总Rubisco活性与这些处理下较高的Rubisco含量和活化程度有关。这与Wang等[27]的研究结果相似。红光处理下较低的Rubisco活性也可能是造成Pn低于对照和红蓝光处理的原因。
综上所述,红光可促进桑树幼苗的茎伸长和叶片展开,但引起桑树幼苗叶片光合活性、Rubisco含量和活性降低;补充蓝光可逆转或削弱这些红光的负面效应,提高叶片Pn、光系统Ⅱ光化学活性、单位面积叶绿素含量,促进桑树叶片呈现“阳生型”特征,但同时补充蓝光抑制桑树幼苗茎伸长和叶片展开,红蓝组合光中的蓝光比例与茎伸长、叶片展开受抑制的程度密切相关。相比于白光、红蓝组合光和蓝光处理,红光下Pn的降低主要是由于光系统Ⅱ光化学活性、叶绿素含量、Gs、Rubisco含量和活性降低造成的。本试验结果表明,一定比例的红蓝组合光(15%B和20%B)可减弱单质红光、蓝光对桑树植株生长的不利影响。因此,相对单质红光、单质蓝光,红蓝组合光更适于桑树幼苗的生长发育。
[1] Kwon A R,Cui H Y,Lee H,et al. Light quality affects shoot regeneration,cell division,and wood formation in elite clones of Populus euramericana[J]. Acta Physiologiae Plantarum,2015,37(3):65.
[2] Hoffmann A M,Noga G,Hunsche M. Acclimations to light quality on plant and leaf level affect the vulnerability of pepper (Capsicum annuum L.) to water deficit[J]. Journal of Plant Research,2015,128(2):295-306.
[3] Wang X Y,Xu X M,Cui J. The importance of blue light for leaf area expansion,development of photosynthetic apparatus,and chloroplast ultrastructure of Cucumis sativus grown under weak light[J]. Photosynthetica,2015,53(2):213-222.
[4] Busch F A. Opinion:the red-light response of stomatal movement is sensed by the redox state of the photosynthetic electron transport chain[J]. Photosynthesis Research,2014,119(1/2):131-140.
[5] Leong T Y,Anderson J M. Effect of light quality on the composition and function of thylakoid membranes in Atriplex triangularis[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics,1984,766(3):533-541.
[6] Senger H,Bauer B. The influence of light quality on adaptation and function of the photosynthetic apparatus[J]. Photochemistry and Photobiology,1987,45(S1):939-946.
[7] Eskins K,Jiang C Z,Shibles R. Light-quality and irradiance effects on pigments,light-harvesting proteins and rubisco activity in a chlorophyll-harvesting and light-harvesting-deficient soybean mutant[J]. Physiologia Plantarum,1991,83(1):47-53.
[8] Milivojevic D B,Tyszkiewicz E. Effect of light quality on the organization of chloroplast thylakoids of pinus-nigra arn[J]. Journal of Plant Physiology,1992,139(5):574-578.
[9] Brown C S,Schuerger A C,Sager J C. Growth and photomorphogenesis of pepper plants under red light-emitting diodes with supplemental blue or far-red lighting[J]. Journal of the American Society for Horticultural Science,1995,120(5):808-813.
[10] Dougher T O,Bugbee B. Differences in the response of wheat,soybean and lettuce to reduced blue radiation[J]. Photochemistry and Photobiology,2001,73(2):199-207.
[11] Ahmad M,Grancher N,Heil M,et al. Action spectrum for cryptochrome-dependent hypocotyl growth inhibition in Arabidopsis[J]. Plant Physiology,2002,129(2):774-785.
[12] Johkan M,Shoji K,Goto F,et al. Blue light-emitting diode light irradiation of seedlings improves seedling quality and growth after transplanting in red leaf lettuce[J]. HortScience,2010,45(12):1809-1814.
[13] Park S Y,Kim M J. Development of zygotic embryos and seedlings is affected by radiation spectral compositions from light emitting diode (LED) system in Chestnut (Castanea crenata S. et Z.)[J]. J Korean Soc,2010,99(5):750-754.
[14] Fukuda N,Ishii Y,Ezura H,et al. Effects of light quality under red and blue light emitting diodes on growth and expression of FBP28 in petunia[J].Acta Horticulture,907:361-366.
[15] Hogewoning S W,Douwstra P,Trouwborst G,et al. An artificial solar spectrum substantially alters plant development compared with usual climate room irradiance spectra[J]. Journal of Experimental Botany,2010,61(5):1267-1276.
[16] Matsuda R,Ohashi-Kaneko K,Fujiwara K,et al. Photosynthetic characteristics of rice leaves grown under red light with or without supplemental blue light[J]. Plant & Cell Physiology,2004,45(12):1870-1874.
[17] Sebastian A,Prasad M N. Red and blue lights induced oxidative stress tolerance promote cadmium rhizocomplexation in Oryza sativa[J]. Journal of Photochemistry and Photobiology B-Biology,2014,137(8):135-143.
[18] Bantis F,Ouzounis T,Radoglou K. Artificial LED lighting enhances growth characteristics and total phenolic content of Ocimum basilicum,but variably affects transplant success[J]. Scientia Horticulturae,2016,198:277-283.
[19] 许大全,高 伟,阮 军. 光质对植物生长发育的影响[J]. 植物生理学报,2015,51(8):1217-1234.
[20] Arnon D I. Copper enzymes in isolated chloroplasts. polyphenoloxidase in beta vulgaris[J]. Plant Physiology,1949,24(1):1-15.
[21] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[22] Makino A,Mae T,Ohira K. Colorimetric measurement of protein stained with Coomassie Brilliant Blue R on Sodium dodecyl sulfate-polyacrylamide gel electrophoresis by eluting with formamide[J]. Agricultural and Biological Chemistry,1986,50(7):1911-1912.
[23] Nakano H,Muramatsu S,Makino A,et al. Relationship between the suppression of photosynthesis and starch accumulation in the pod-removed bean[J]. Functional Plant Biology,2000,27(2):167-173.
[24] Wingler A,Marès M,Pourtau N. Spatial patterns and metabolic regulation of photosynthetic parameters during leaf senescence[J]. New Phytologist,2004,161(3):781-789.
[25] Ouzounis T,Rosenqvist E,Ottosen C O. Spectral effects of artificial light on plant physiology and secondary metabolism:a review[J]. HortScience,2015,50(8):1128-1135.
[26] Ouzounis T,Fretté X,Ottosen C O,et al. Spectral effects of LEDs on chlorophyll fluorescence and pigmentation in Phalaenopsis′Vivien′ and ′Purple Star′[J]. Physiologia Plantarum,2015,154(2):314-327.
[27] Wang H,Gu M,Cui J X,et al. Effects of light quality on CO2 assimilation,chlorophyll-fluorescence quenching,expression of Calvin cycle genes and carbohydrate accumulation in Cucumis sativus[J]. Journal of Photochemistry and Photobiology B-Biology,2009,96(1):30-37.
[28] Wu Q,Su N,Shen W,et al. Analyzing photosynthetic activity and growth of Solanum lycopersicum seedlings exposed to different light qualities[J]. Acta Physiologiae Plantarum,2014,36(6):1411-1420.
[29] O'carrigan A,Hinde E,Lu N,et al. Effects of light irradiance on stomatal regulation and growth of tomato[J]. Environmental and Experimental Botany,2014,98:65-73.
[30] Hernandez R,Kubota C. Physiological responses of cucumber seedlings under different blue and red photon flux ratios using LEDs[J]. Environmental and Experimental Botany,2016,121(SI):66-74.
[31] Nishihama R,Kohchi T. Evolutionary insights into photoregulation of the cell cycle in the green lineage[J]. Current Opinion in Plant Biology,2013,16(5):630-637.
[32] Beel B,Prager K,Spexard M,et al. A flavin binding cryptochrome photoreceptor responds to both blue and red light in Chlamydomonas reinhardtii[J]. The Plant Cell,2012,24(7):2992-3008.
[33] Kwon A R,Cui H Y,Lee H,et al. Light quality affects shoot regeneration,cell division,and wood formation in elite clones of Populus euramericana[J]. Acta Physiologiae Plantarum,2015,37(3):1-9.
[34] Dougher T O,Bugbee B. Long-term blue light effects on the histology of lettuce and soybean leaves and stems[J]. Journal of the American Society for Horticultural Science,2004,129(4):467-472.
[35] Buschmann C,Meier D,Kleudgen H K,et al. Regulation of chloroplast development by red and blue light[J]. Photochemistry and Photobiology,1978,27(2):195-198.
[36] Terfa M T,Solhaug K A,Gisler d H R,et al. A high proportion of blue light increases the photosynthesis capacity and leaf formation rate of Rosa × hybrida but does not affect time to flower opening[J]. Physiologia Plantarum,2013,148(1):146-159.
[37] Hogewoning S W,Trouwborst G,Maljaars H,et al. Blue light dose-responses of leaf photosynthesis,morphology,and chemical composition of Cucumis sativus grown under different combinations of red and blue light[J]. Journal of Experimental Botany,2010,61(11):3107-3117.
[38] Poorter H,Niinemets U,Poorter L,et al. Causes and consequences of variation in leaf mass per area (LMA):a meta-analysis[J]. The New Phytologist,2009,182(3):565-588.
[39] Fan X X,Zang J,Xu Z G,et al. Effects of different light quality on growth,chlorophyll concentration and chlorophyll biosynthesis precursors of non-heading Chinese cabbage (Brassica campestris L.)[J]. Acta Physiologiae Plantarum,2013,35(9):2721-2726.
[40] Matsuda R,Ohashi-Kaneko K,Fujiwara K,et al. Analysis of the relationship between blue-light photon flux density and the photosynthetic properties of spinach (Spinacia oleracea L.) leaves with regard to the acclimation of photosynthesis to growth irradiance[J]. Soil Science and Plant Nutrition,2007,53(4):459-465.
[41] Assmann S M,Jegla T. Guard cell sensory systems:recent insights on stomatal responses to light,abscisic acid,and CO2[J]. Current Opinion in Plant Biology,2016,33:157-167.
[42] Zeiger E,Talbott L D,Frechilla S,et al. The guard cell chloroplast:a perspective for the twenty-first century[J]. New Phytologist,2002,153(3):415-424.
[43] Inoue S I,Kinoshita T. Blue light regulation of stomatal opening and the plasma membrane H+-ATPase[J]. Plant Physiology,2017,174(2):531-538.
[44] Horrer D,Flütsch S,Pazmino D,et al. Blue light induces a distinct starch degradation pathway in guard cells for stomatal opening[J]. Current Biology,2016,26(3):362-370.
[45] O'carrigan A,Babla M,Wang F,et al. Analysis of gas exchange,stomatal behaviour and micronutrients uncovers dynamic response and adaptation of tomato plants to monochromatic light treatments[J]. Plant Physiology and Biochemistry,2014,82:105-115.
[46] Schmid R,Wennicke R,Fleischhauer S. Quantitative correlation of peripheral and intrinsic core polypeptides of photosystem II with photosynthetic electron-transport activity of Acetabularia mediterranea in red and blue light[J]. Planta,1990,182(3):391-398.
[47] Mochizuki T,Onda Y,Fujiwara E,et al. Two Independent light signals cooperate in the activation of the plastid psbD blue light-responsive promoter in Arabidopsis[J]. FEBS Letters,2004,571(1/3):26-30.
[48] Tennessen D J,Singsaas E L,Sharkey T D. Light-emitting diodes as a light source for photosynthesis research[J]. Photosynthesis Research,1994,39(1):85-92.