种子萌发是一个多因素参与的复杂的调控途径,也是植物世代循环中最重要、最脆弱的一个阶段[1-2],而低温是影响种子萌发最常见的环境胁迫因子之一。棉花(G.hirsutum L.)等喜温作物,种子萌发期对低温胁迫更为敏感[3]。研究表明,棉花种子萌发的最低温度为10.5 ℃~12 ℃,10 ℃以下不能萌发[4-5]。生产上棉花播种后如遭遇低温胁迫,常造成烂种、烂芽,导致缺苗断垅,严重影响产量和纤维质量。因此,棉花种子萌发期耐低温机理研究逐渐受到科研工作者的关注[6]。王钰静等[5]研究表明,棉花种子萌发时,胁迫温度越低,种子萌发受抑制程度越大,耐冷性萌发强的材料占比越少。闫强等[7]对17个棉花主栽品种(系)低温萌发证实,低温胁迫对棉花种子萌发与幼苗长势具有显著的抑制作用,而且不同品种(系)间具有显著差异。武辉等[8]、尹晓斐[9]、辛慧慧[10]等研究表明,棉花幼苗期低温耐逆性与抗氧化酶活性、可溶性蛋白含量、游离脯氨酸含量密切相关。本研究是在对黄淮棉区不同时期棉花品种萌发期低温耐受性评价的基础上,筛选出低温萌发耐受性差异较大的4个品种,通过相关生理指标及耐冷性基因表达差异分析,进一步研究耐低温萌发棉花品种的生理特性,探讨不同棉花品种耐低温萌发差异的成因,为选育耐低温萌发棉花品种提供理论依据。
1 材料和方法
1.1 试验材料
在对黄淮棉区不同时期38个代表性棉花品种萌发期低温耐受性评价基础上,筛选出低温萌发耐受性差异显著的4个品种作为本试验材料,详见表1。4个品种经山东棉花研究中心试验站(山东临清)与海南基地(海南三亚南滨农场)连续2代自交提纯,恢复活力,于2015年在山东棉花研究中心试验站集中种植,统一选收棉株中部内围棉铃籽棉,轧花脱绒,选择籽粒饱满、无损伤种子作为本试验用种。
表1 品种名称、来源及萌发期低温耐受性
Tab.1 The name of variety,resource,and the resistant of seed germination

品 种Variety系谱或来源 Pedigree or resource 低温耐性评价值The chilling resistant index低温耐性级别The chilling resistant level 鲁棉研37号鲁9136×鲁99系0.879 1强耐低温品种SCRC37鲁棉研36号鲁棉研21号×{[中12×(冀538×鲁742)] 0.782 4强耐低温品种SCRC 36×川2802}×鲁55斯字棉5A美国引进0.350 6低温敏感品种Stoneville 5A斯字棉2B美国引进0.148 6低温敏感品种Stoneville 2B
1.2 试验方法
试验设18,15,12 ℃ 3个低温胁迫处理,对照(CK)为25 ℃。种子萌发采用砂培法,每个发芽盒每次处理50粒种子,3次重复。分别于种子吸胀萌发0,12 ,24,36 ,48 h时取整个种子进行各项生理指标测定。同时在此条件下另设置3个重复,连续处理12 d,参照高荣岐等[11]的方法,计算发芽率。耐冷性基因表达测定是以12 ℃低温胁迫下,种子吸胀萌发0,12,24,36,48 h时选取的整个种子为试验材料。
生理指标测定参照高俊凤[12]的方法。超氧化物歧化酶(Superoxide dismutase,SOD)活性利用氮蓝四唑(Nitroblue tetrazolium,NBT)光化还原法测定酶活性大小;过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚法;过氧化氢酶(Catalase,CAT)活性测定采用紫外光吸收法;丙二醛(Malonaldehyde,MDA)含量测定采用硫代巴比妥酸法;可溶性蛋白含量测定采用考马斯亮蓝G-250染色法;游离脯氨酸含量测定采用酸性茚三酮染色与紫外光吸收法。
RNA提取采用百泰克通用植物总RNA提取试剂盒(RP3301)。cDNA合成采用TaKaRa反转录试剂盒(RR037A)。荧光定量PCR使用TaKaRa SYBR Premix Ex TaqⅡ试剂盒,以Ubi为内参基因进行4个CBF基因家族成员的荧光定量分析。目标基因的相对定量采用2-ΔΔCT法[13],每处理设置3个生物学重复、3个技术重复,用平均数统计相对表达量。
1.3 数据处理
试验数据处理采用统计分析软件SPSS 22.0进行方差显著性分析,应用Microsoft Excel对数据进行作图。
2 结果与分析
2.1 低温胁迫下不同品种萌发出苗差异比较
4个品种不同低温胁迫处理12 d的发芽率见表2。25 ℃条件下,4品种均能正常萌发出苗(图1),发芽率不低于90%,以斯字棉5A发芽率最高,达98.0%,斯字棉2B发芽率最低,为90%,2品种发芽率差异达显著水平(P<0.05)。随着胁迫温度降低,4品种发芽率、萌发出苗均表现下降趋势,且品种间发芽率差异逐渐加剧,达显著水平(P<0.05)。18 ℃低温下,强耐低温萌发品种鲁棉研37号、鲁棉研36号能继续保持90%以上的发芽率,而低温萌发敏感品种斯字棉2B、斯字棉5A发芽率急剧下降,分别为73.3%,68.7%,且棉苗表现发黄、矮小。15 ℃低温下,2个强耐低温萌发品种仍然保持较高的发芽率,而2个低温萌发敏感品种斯字棉2B、斯字棉5A发芽率虽然分别为40.6%和50.0%,但是发芽势较弱,基本已不能正常出苗。12 ℃低温下,2个低温萌发敏感品种发芽率为0.0,完全不能萌发出苗,而强耐低温萌发品种鲁棉研37号、鲁棉研36号发芽率仍分别为69.3%和58.7%,部分仍然能够正常萌发出苗。
表2 不同低温胁迫12 d 4品种的发芽率
Tab.2 Germination rates of four varieties to different low temperatures stress for 12 d %
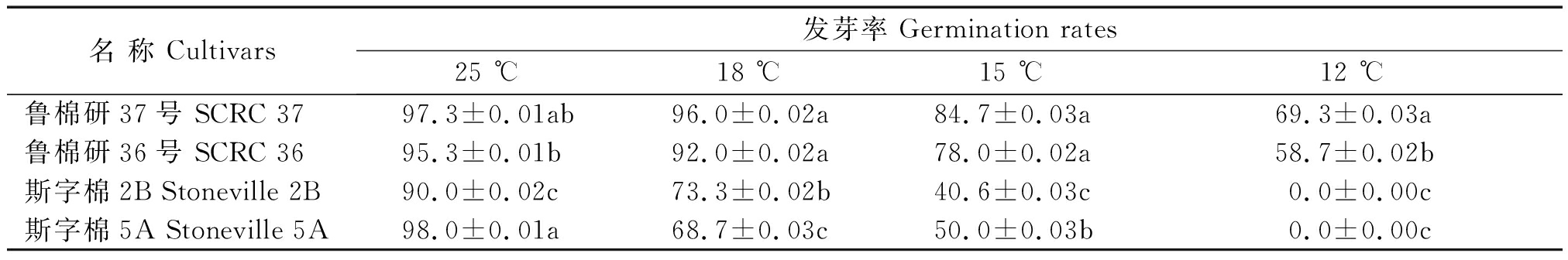
名 称 Cultivars发芽率 Germination rates25 ℃18 ℃15 ℃12 ℃鲁棉研37号 SCRC 3797.3±0.01ab96.0±0.02a84.7±0.03a69.3±0.03a鲁棉研36号 SCRC 3695.3±0.01b92.0±0.02a78.0±0.02a58.7±0.02b斯字棉2B Stoneville 2B90.0±0.02c73.3±0.02b40.6±0.03c0.0±0.00c斯字棉5A Stoneville 5A98.0±0.01a68.7±0.03c50.0±0.03b0.0±0.00c
注:同一列数据后不同小写字母表示差异显著(P<0.05)。
Note: The different lowercase letters after date in the same column indicate significant difference(P<0.05).

图1 不同低温胁迫12 d 4品种萌发出苗情况
Fig.1 Seedling emergence of four varieties to different low temperatures stress on 12 d
2.2 低温胁迫下不同品种种子萌发期生理指标差异
2.2.1 丙二醛(MDA)含量 与对照温度相比,18,15 ℃低温胁迫下,4品种MDA含量变化较小(图2),但在12 ℃低温胁迫下,2个低温萌发敏感品种MDA含量大幅上升,胁迫至48 h,斯字棉2B比鲁棉研37号、鲁棉研36号分别上升48.17%,53.32%;斯字棉5A比鲁棉研37号、鲁棉研36号分别上升50.65%,55.89%,差异均达显著水平(P < 0.05)。表明鲁棉研37号、鲁棉研36号低温胁迫下细胞膜系统相对稳定,受到活性氧伤害程度较小。
2.2.2 抗氧化酶活性 低温逆境胁迫下,植物自身抗氧化系统发生一系列的代谢调节,以调控体内活性氧水平,从而维持活性氧代谢的动态平衡[14]。图3所示,鲁棉研37号超氧化物歧化酶(SOD)活性在各温度下均显著高于其他3品种。鲁棉研36号在低温胁迫下SOD活性逐渐增强,仅次于鲁棉研37号。12 ℃低温胁迫48 h,鲁棉研37号、鲁棉研36号SOD活性比斯字棉2B分别上升30.30%,28.88%;比斯字棉5A分别上升61.15%,59.39%,差异显著(P < 0.05)。如图4所示,4品种过氧化物酶(POD)活性随低温胁迫时间延长呈升高趋势。低温胁迫下鲁棉研37号、鲁棉研36号POD活性始终高于斯字棉2B、斯字棉5A。12 ℃低温胁迫48 h,鲁棉研37号POD活性比斯字棉2B、斯字棉5A分别上升46.88%,51.61%,鲁棉研36号POD 活性比斯字棉2B、斯字棉5A分别上升34.38%,38.71%,均达显著水平(P<0.05)。图5所示,25 ℃下,鲁棉研37号、鲁棉研36号与斯字棉2B、斯字棉5A相比,过氧化氢酶(CAT)活性并不高,但随着温度降低,鲁棉研37号、鲁棉研36 CAT活性逐渐升高,12 ℃低温胁迫48 h,鲁棉研37号、鲁棉研36号CAT活性分别比斯字棉2B 高37.55%,25.29%,比斯字棉5A 高41.90%,29.25%。

不同小写字母表示差异显著(P< 0.05)。图3-8同。
The different lowercase letters indicate significant difference (P< 0.05).The same ad Fig.3-8.
图2 各温度下4品种萌发期MDA含量变化
Fig.2 Changes of MDA content during germination of four varieties at different temperatures
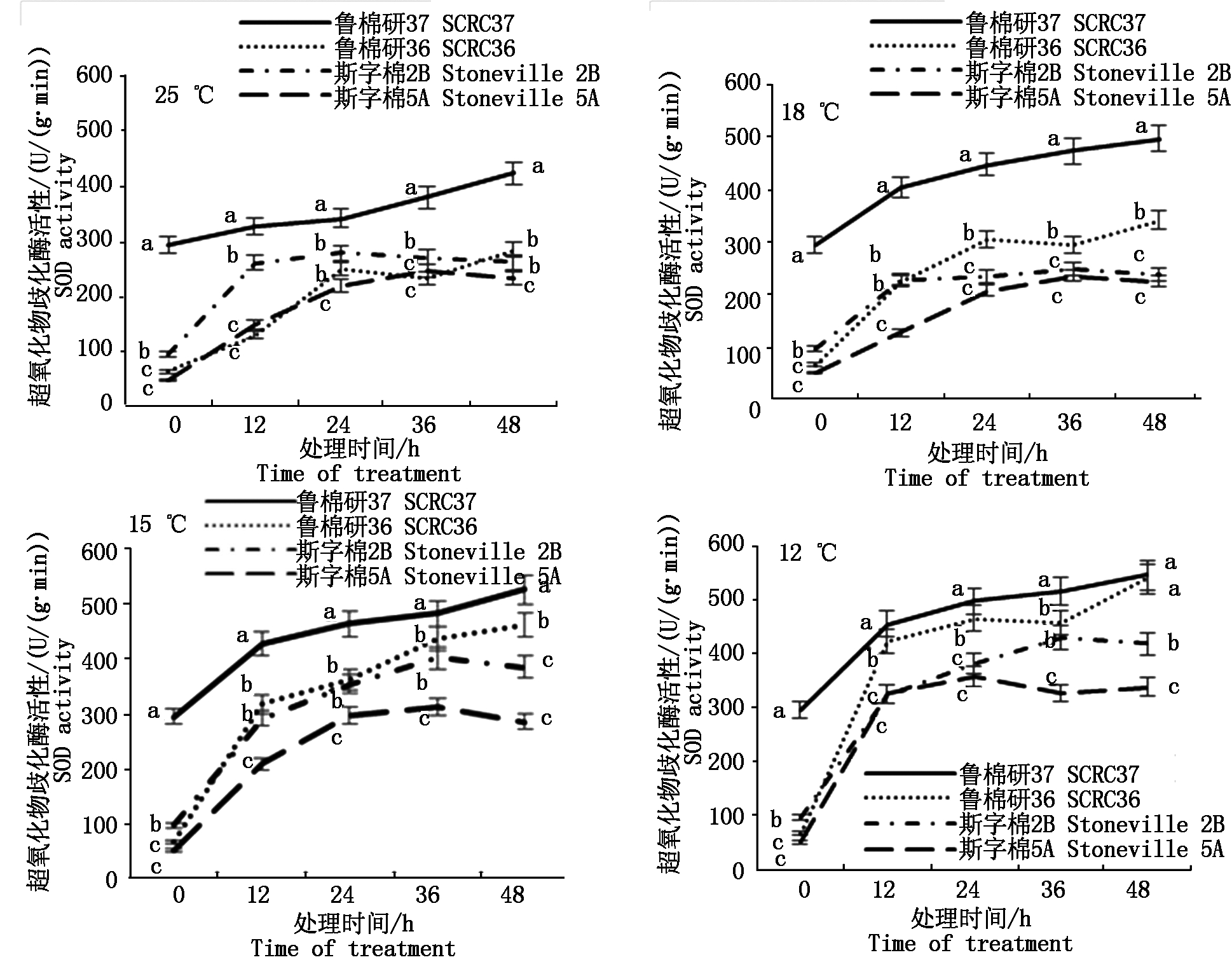
图3 各温度下4品种萌发期SOD活性变化
Fig.3 Changes of SOD activity during germination of four varieties at different temperatures
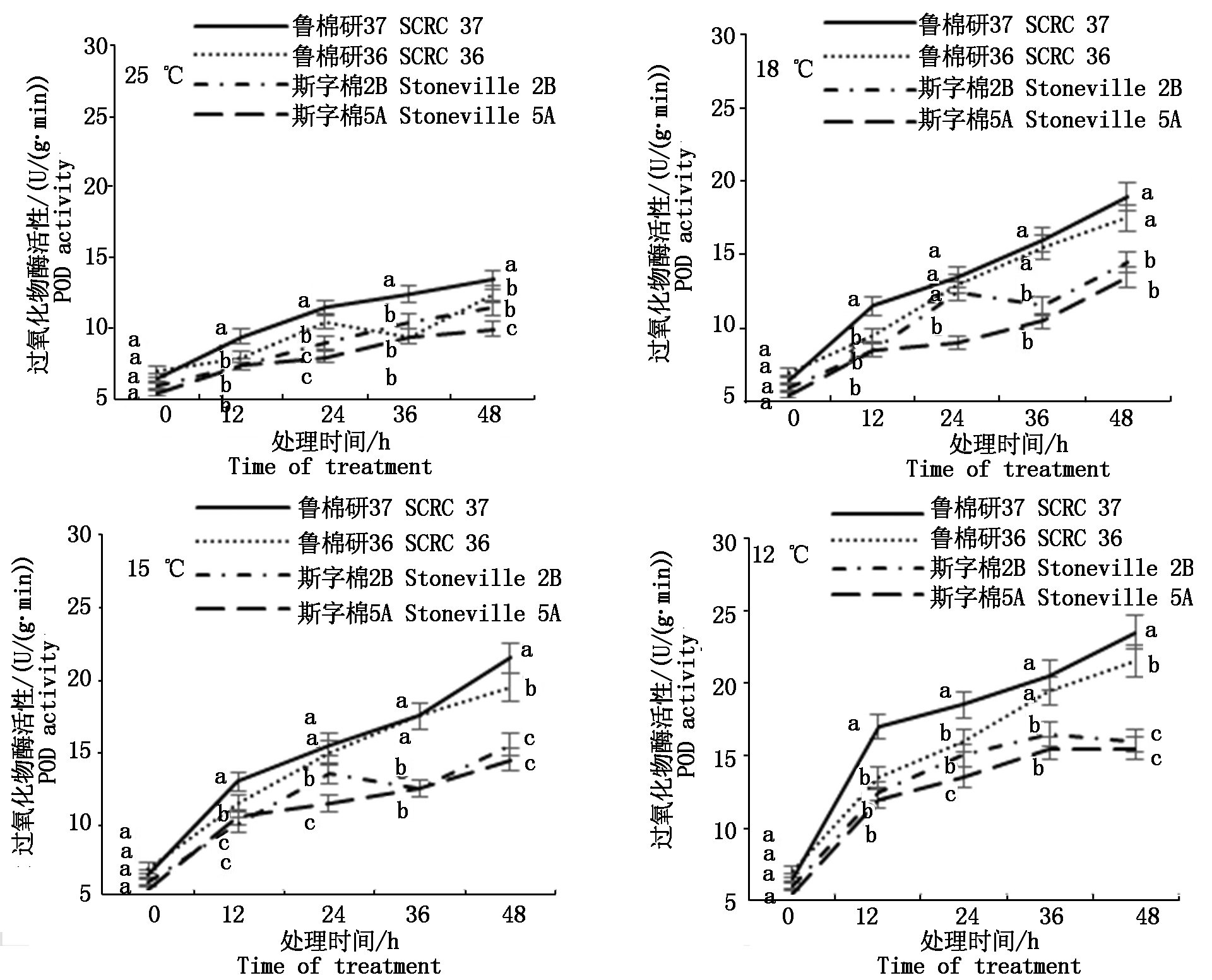
图4 各温度下4品种萌发期POD活性变化
Fig.4 Changes of POD activity during germination of four varieties at different temperatures
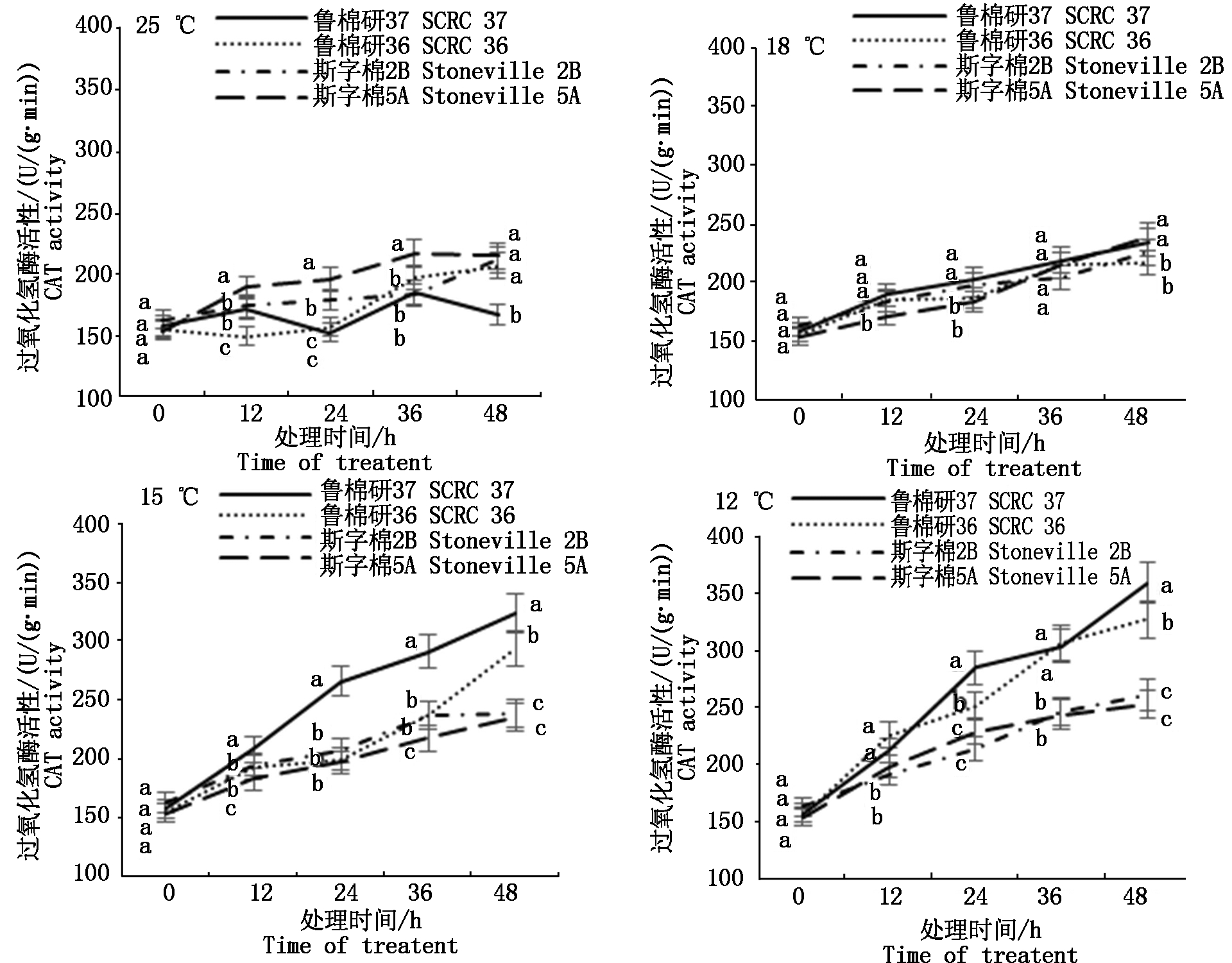
图5 各温度下4品种萌发期CAT活性变化
Fig.5 Changes of CAT activity during germination of four varieties at different temperatures
2.2.3 渗透调节物质含量 种子低温逆境萌发过程中,自发调节一系列生理代谢,从而使细胞内主动累积更多可溶性物质,以降低细胞渗透势,增加细胞吸水能力,维持膨压,从而避免原生质在低温逆境胁迫下受到脱水伤害[15-16]。如图6所示,25 ℃条件下,鲁棉研37号、鲁棉研36号可溶性蛋白含量并不高,随着胁迫加剧,含量逐渐升高。在胁迫温度下,4品种处理12 h时可溶性蛋白含量急剧升高,随后升高缓慢。12 ℃低温胁迫至48 h,鲁棉研37号可溶性蛋白含量比斯字棉2B、斯字棉5A分别上升6.25%,8.45%,鲁棉研36号比斯字棉2B、斯字棉5A分别上升5.40%,7.58%。此外,随着胁迫加剧,4品种游离脯氨酸含量均呈升高趋势(图7)。25,18 ℃条件下,4品种游离脯氨酸含量上升缓慢,随着进一步的低温刺激,15,12 ℃条件下,游离脯氨酸含量急剧升高。12 ℃低温胁迫48 h,鲁棉研37号较斯字棉2B、斯字棉5A脯氨酸含量分别上升33.32%,23.27%,鲁棉研36号分别上升32.28%,22.30%,差异均达显著水平(P < 0.05)。

图6 各温度下4品种萌发期可溶性蛋白含量变化
Fig.6 Changes of soluble protein content during germination of four varieties at different temperatures

图7 各温度下4品种萌发期游离脯氨酸含量变化
Fig.7 Changes of free proline content during germination of four varieties at different temperatures
2.3 不同品种种子萌发期耐冷基因表达差异
CBF (Cold binding transcription factor,CBF)转录激活因子是一类受低温诱导的反式作用因子,是植物CBF抗冷途径的枢纽,特异地与CRT/DRE(C-repeat dehydration-responsive element)顺式作用元件结合,从而激活启动子中具有这一调控元件的冷诱导基因表达,在植物低温耐冷性中起着重要的调控作用[17]。低温胁迫下4品种萌发期耐冷性基因CBF的相对表达量见图8。12 ℃低温胁迫下,各品种4个CBF基因均有不同程度的响应,且均在胁迫12 h达到相对表达量峰值。但强耐低温萌发品种鲁棉研37号、鲁棉研36号在不同处理时间4个基因的相对表达量基本都高于低温萌发敏感品种斯字棉2B、斯字棉5A,在胁迫12 h显著高于斯字棉2B、斯字棉5A。而强耐低温萌发品种相比,鲁棉研37号4个基因的相对表达量在大多数处理时间高于鲁棉研36号,且差异显著(P< 0.05),仅CBF1胁迫12 h时例外。此外,鲁棉研37号相较于鲁棉研36号,CBF2、CBF4、CBF6胁迫12 h 3个基因相对表达量达到极显著水平(P < 0.01),CBF4、CBF6胁迫24 h 2个基因相对表达量同样达到极显著水平(P<0.01)。由此可见,鲁棉研37号4个基因的相对表达量更高,在种子萌发过程中表现为更强的耐低温性。
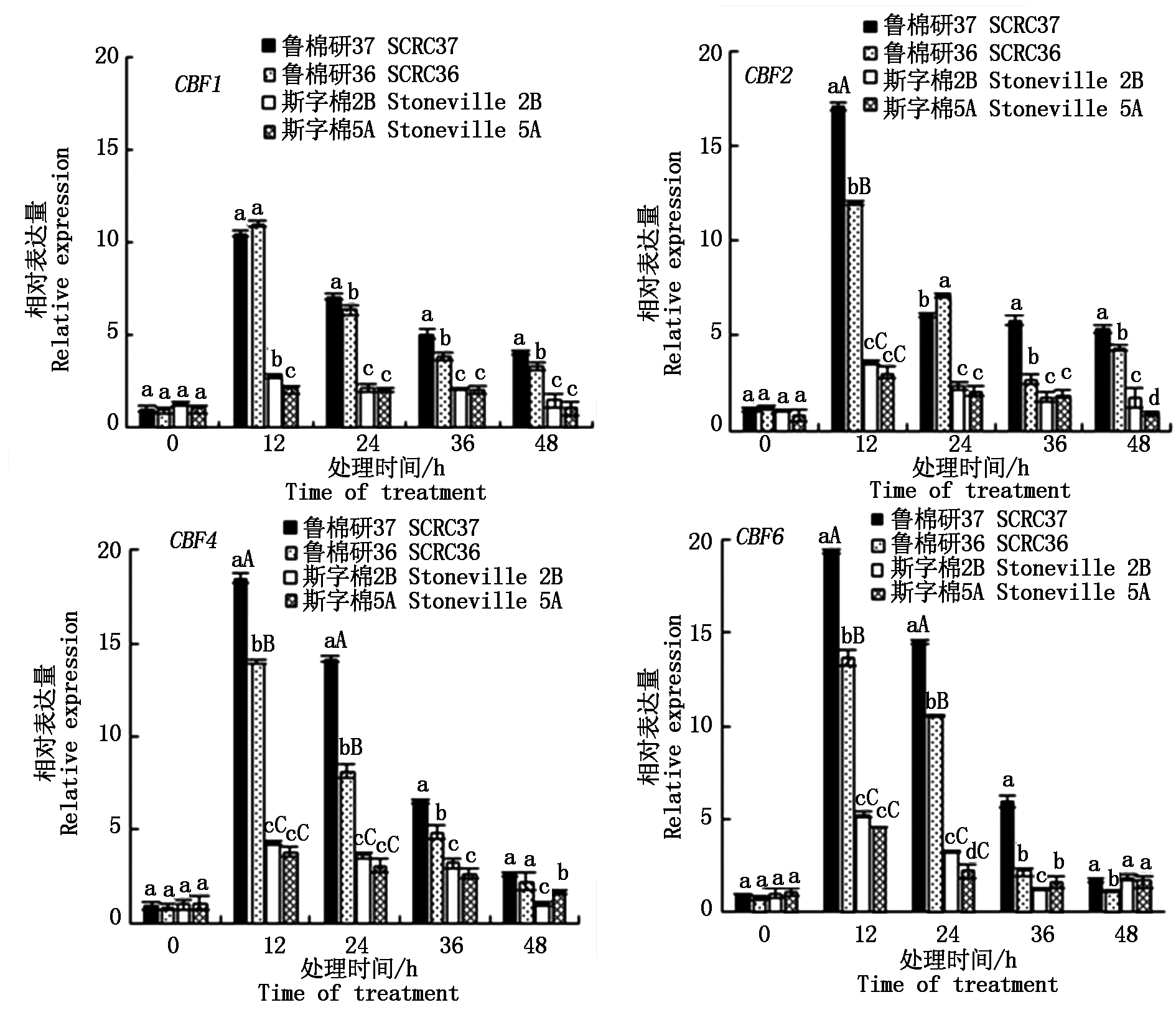
图8 低温胁迫下4品种萌发期耐冷性基因的相对表达量
Fig.8 Relative expression of the cold resistance genes to low temperature stress in seed germination of four cottons
3 讨论
低温胁迫显著影响植物种子萌发与幼苗生长[18-20]。低温胁迫下,4个棉花品种的发芽率均下降,萌发出苗受到抑制,不耐低温萌发品种受抑制程度大于耐低温萌发品种,而耐低温萌发品种在保持其能够萌发的基础上仍然能够维持一定的生长,表现为苗的增高和生物量的增加。
MDA含量是膜脂过氧化的最终产物之一,其含量高低代表细胞膜系统被破坏的严重程度[21]。本研究结果显示,在一般低温胁迫下,4个品种MDA含量变幅不大,但在12 ℃低温胁迫36 h时,不耐低温萌发品种MDA含量急剧升高,而耐低温萌发品种MDA含量几乎保持不变,因此,12 ℃胁迫36 h 的MDA含量可以作为棉花种子萌发期低温耐受性的鉴定指标。逆境胁迫下,SOD、POD、CAT等抗氧化酶相互协调,维持体内活性氧的动态平衡,以有效阻止过量活性氧对细胞膜系统的伤害[8]。本研究发现,即使在对照温度下,4品种中最耐低温萌发的鲁棉研37号SOD活性就远高于其他3个品种,而随着低温胁迫加剧(15,12 ℃),2个强耐低温萌发品种鲁棉研37号、鲁棉研36号POD、CAT活性呈快速上升趋势,最终其活性显著高于低温萌发敏感品种斯字棉2B、斯字棉5A,这与前人的研究结果相吻合,而SOD在棉花种子耐低温萌发过程中似乎发挥着更重要的作用,有待于进一步研究。
逆境环境下,植物体内可溶性蛋白、游离脯氨酸含量与植物抗寒性密切相关[22-24]。本研究与其具有一致性。对照温度下,强耐低温萌发品种鲁棉研37号、鲁棉研36号渗透调节物质含量并不高于甚至是低于低温萌发敏感品种斯字棉2B、斯字棉5A,而随着胁迫温度降低,前2个品种渗透调节物质含量迅速上升,显著高于斯字棉2B、斯字棉5A,表明了强耐低温萌发品种在低温应激反应中能够迅速调节自身代谢,维持细胞内外渗透压的平衡,减少对细胞的损伤,增强对低温胁迫的抗耐受能力。
前人研究表明,CBF转录激活因子在植物应对低温胁迫应答过程中发挥着重要作用。信月芝[25]发现低温诱导棉花CBF1、CBF2、CBF3基因表达,并在胁迫12 h达到高峰。李月等[26]对海岛棉GbCBF6基因低温表达研究证实,该基因参与低温应答,且随着胁迫时间延长表达量上升。但也有人认为GbCBF2、GbCBF3、GbCBF5在应对低温胁迫时应答无反应[27]。本研究结果表明, CBF1、CBF2、CBF4、CBF6均参与了棉花种子低温萌发应答途径,但4品种在不同低温胁迫时间,基因相对表达量存在显著差异,强耐低温萌发品种鲁棉研37号、鲁棉研36号4个耐冷性基因表达量显著高于低温萌发敏感品种斯字棉2B、斯字棉5A,且低温萌发敏感品种在低温胁迫下各基因上调表达不显著。这与前人的研究结果趋向一致,同时也反映了不同棉花品种低温萌发耐受性不同的分子基础。
[1] 王友凤,马祥庆. 林木种子萌发的生理生态学机理研究进展[J]. 世界林业研究,2007,20(4):19-23.
[2] 徐恒恒,黎 妮,刘树君,等. 种子萌发及其调控的研究进展[J]. 作物学报,2014,40(7):1141-1156.
[3] Barrero-Gil J,Salinas J. Post-translational regulation of cold acclimation response[J]. Plant Science,2013,205:48-54.
[4] Lauterbach B,Krieg D R,Jividen G. Fatty acid composition of lipid fractions in germination cotton as affected by temperature[J]. Proceeding Belteid Cotton Conference,1999,1:564-565.
[5] 王钰静,谢 磊,李志博,等. 低温胁迫对北疆棉花种子萌发的影响及其耐冷性差异评价[J]. 种子,2014,5(5):74-77.
[6] Li X G,Meng Q W,Jiang G Q,et al. The susceptibility of cucumber and sweet pepper to chilling under low irradiance is related to energy dissipation and water-water cycle[J]. Photosynthetica,2003,41(2):259-265.
[7] 闫 强,曾雅青,王乐然,等. 不同棉花品种种子活力对低温和人工老化胁迫的反应差异[J]. 棉花学报,2016,28(2):144-151.
[8] 武 辉,张巨松,石俊毅,等. 棉花幼苗对不同程度低温逆境的生理响应[J]. 西北植物学报,2013,33(1):74-82.
[9] 尹晓斐. 低温胁迫对棉花生理特性的影响及关键酶基因表达分析[D]. 晋中:山西农业大学,2016.
[10] 辛慧慧. 棉花对低温胁迫的生理响应及调控研究[D]. 石河子:石河子大学,2015.
[11] 高荣岐,张春庆. 种子生物学[M]. 北京:中国农业出版社,2009.
[12] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[13] Afrin S,Zhu J,Cao H Z. Molecular cloning and expression profile of an abiotic stress and hormone responsive MYB transcription factor gene from Panaxginseng[J]. Acta Biochimica Biophysica,2015,47(4):267-277.
[14] 罗 萍,贺军军,姚艳丽,等. 低温对不同耐寒性橡胶树叶片抗氧化能力的影响[J]. 西北植物学报,2014,34(2):311-317.
[15] 马艳芝,客绍英. 柴胡幼苗越冬抗寒性及其相关生理指标筛选[J]. 西北植物学报,2014,34(4):786-791.
[16] 陈杰忠,徐春香,梁立峰. 低温对香蕉叶片中蛋白质及脯氨酸的影响[J]. 华南农业大学学报,1999,20(3):54-58.
[17] 杨 莎. 低温胁迫下甜椒CBF3基因的表达和功能研究[D]. 泰安:山东农业大学,2011.
[18] 闫世江,张继宁,刘 洁. 茄子幼苗耐低温性生理机制研究[J]. 西北植物学报,2011,31(12):2498-2502.
[19] Chen Q J,Zhang F M,Wang Y J. Studies of physiologic characteristics of reaction of cucumber to low temperature and poor light[J]. Scientia Agricultura Sinica,2003,36(1):77-81.
[20] 王俊娟,王 帅,陆许可,等. 棉花幼苗对低温胁迫的响应及抗冷机制初步研究[J]. 棉花学报,2017,29(2):147-156.
[21] 张大伟,杜翔宇,刘春燕,等. 低温胁迫对大豆萌发期生理指标的影响[J]. 大豆科学,2010,29(2):228-232.
[22] 张晓红,冯梁杰,杨特武,等. 冬季低温胁迫对油菜抗寒生理特性的影响[J]. 植物生理学报,2015,51(5):737-746.
[23] 董万鹏,罗 充,龙秀琴,等. 低温胁迫对西番莲抗寒生理指标的影响[J]. 植物生理学报,2015,51(5):771-777.
[24] 李春燕,陈思思,徐 雯,等. 苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响[J]. 作物学报,2011,37(12):2293-2298.
[25] 信月芝. 棉花CBF调控因子的克隆及其在耐冷调节中的作用[D]. 北京:中国农业科学院,2005.
[26] 李 月,孔丽颖,李才运,等. 海岛棉GbCBF6基因克隆及其在逆境胁迫下的表达分析[J]. 西北植物学报,2015,35(10):1949-1955.
[27] 李 月,代培红,刘 超,等. 海岛棉5个CBF/DREB基因的克隆与表达分析[J]. 棉花学报,2016,28(1):42-51.