果皮色泽作为葡萄果实品质重要的商品价值评价指标,日益受到广大果树栽培者及消费者的重视。我国葡萄栽培品种的果皮颜色主要有红色、白色、黑色,而花青素(Anthocyanin)是使果实表面呈现出红、紫红到蓝等不同颜色的主要原因[1]。葡萄果实在接近转色期时,叶绿素开始迅速分解,花色素随着在果实发育中不断积累的程度,葡萄果皮颜色逐渐由底色绿色转变为各种各样的表色,直至浆果成熟期,葡萄品种呈现红色、蓝色、黑色等固有的颜色[2]。弗雷无核,属早熟欧亚葡萄品种,果皮呈鲜红色。由于石河子地区春冬季低温,造成设施栽培条件下根际与室内温度升温不协调,延缓果枝萌芽,使得夏季果实进入转色期时室内昼夜温差减小,引起葡萄果实着色不良。因此,如何在不使用存在安全隐患调节剂的条件下促进果实着色成为当前果农及果树研究者迫切需要解决的生产问题。
近年来,果实中花青素合成研究发展迅速,人们认识到糖类物质[3]、色素类物质[4]及相关基因[5]调控对果实花青素合成的影响与果实着色有着密切联系,在果树生产实践中,喷布植物生长调节物质促进果实花青苷合成的生产措施已在许多地区推广使用,有关5-氨基乙酰丙酸(5-aminolevulinic acid ,ALA)对果实花青素生物合成及调控方面的研究已有大量报道。ALA作为自然界动植物以及微生物体内天然存在的一种生理活性物质,是所有生物体卟啉化合物(叶绿素、光敏色素、维生素B、亚铁血红素等)生物合成的第一个关键前体,与生命活动有着紧密的联系。ALA不仅是一种中间代谢产物,且在农业实践生产中有着重要的应用价值,天然、无毒、无残留,被视为一种新的植物生长调节物质,参与植物生长发育的调节过程,提高植物叶片光合效率,促进作物生长,增强其抗逆性[6-7]。相关外源试验表明,通过喷施ALA处理对果实相关基因[8]和糖类物质的调控能够影响果皮中花青苷的积累,而有关ALA对色素类物质调控影响花青素合成的研究尚较少。为此,本研究以大棚栽培欧亚葡萄品种弗雷无核为试验材料,研究了外源ALA处理对葡萄果实外观色泽、内在品质及花青素合成相关酶活性的影响,探讨ALA处理对果实花青素含量变化与糖、酸、色素及相关酶活性变化的关系,对提高葡萄果实花青素含量的技术措施进行总结,为今后ALA在促进葡萄果实着色调控及其在优质果品的生产提供理论依据。
1 材料和方法
1.1 试验材料
试验于2017年6月进行。试材选取石河子总场北泉镇果品公司大鹏基地内的5年生欧亚葡萄品种弗雷无核。处理及对照均采用单厂字型,东西行向,株行距1.5 m×2.5 m。
1.2 试验设计
试验于2017年6月进行。选择架势、长势和负载量均相似的葡萄植株,于果实膨大期、转色期每株随机选取大小一致的果穗挂牌进行ALA处理。共设置4个处理(分别为清水喷施;50 mg/L ALA溶液喷施;100 mg/L ALA溶液ALA喷施;150 mg/L ALA溶液喷施),以清水喷施作为对照。葡萄果实膨大期(6月25日)进行第一次喷施,转色期(7月5日)进行第2次喷施。第2次处理结束之日起,各处理每隔5 d取样1次,共采样5次,最后一次采样为7月30日,果实均达成熟。取样时随机从各处理植株上采摘3穗带标签果穗,重复3次。葡萄果实采集后,从各处理果穗上中下各选取10粒长势一致的果实,共30粒,重复3次。剥取果皮立即放入液氮中,于-80 ℃超低温冰箱中贮存,用于花青素及相关酶活性的测定。剩余各处理果穗带回实验室,用于测定葡萄果实的各项生理指标。
1.3 试验方法
果实色泽指标(色泽明亮度L*、颜色组分a*、颜色组分b*)采用NC-9801 手持色差计测定,然后计算葡萄果实颜色指数(CIRG)[9];果实总糖含量测定参照李合生[10]的方法进行,采用蒽酮比色法;可滴定酸含量的测定采用酸碱滴定法[11];叶绿素及类胡萝卜素含量参照文献[12]进行测定;果皮花青素含量参照王惠聪等[13]方法进行测定;苯丙氨酸裂解酶(PAL)、查尔酮异构酶(CHI)活性测定参照刘晓静[14]方法;二氢黄酮醇还原酶(DFR)活性参考Lister等[15]方法进行测定。
1.4 数据分析
采用Microsoft Excel 2007软件进行数据分析,SPSS 19.0软件进行方差分析,利用Origin 9软件绘图。
2 结果与分析
2.1 ALA处理对成熟期葡萄果实色泽参数的影响
由图1可知,各处理(50,100,150 mg/L)下果实颜色指数(CIRG)在葡萄果实成熟期均显著高于对照(0 mg/L),增幅分别达16.9%,30.9%,19.6%;而葡萄果面色泽明亮度(L*)、颜色组分(b*)、色泽饱和度(C*)、色度角(h°)均显著低于对照;其中,颜色组分(a*)仅在100 mg/L ALA处理条件下与对照有显著差异。100 mg/L ALA处理与对照果实色泽各个参数差异均达显著水平(P<0.05),处理效果最好,且这种浓度对各色泽参数的促进或抑制效应呈规律变化,各浓度之间的效应并无规律。因此,认为ALA处理使得果面色泽明亮度下降,颜色深暗,但能够显著促进葡萄果实着色,改善果实外观色泽,且这种促进效应不随处理浓度的增加而增强。
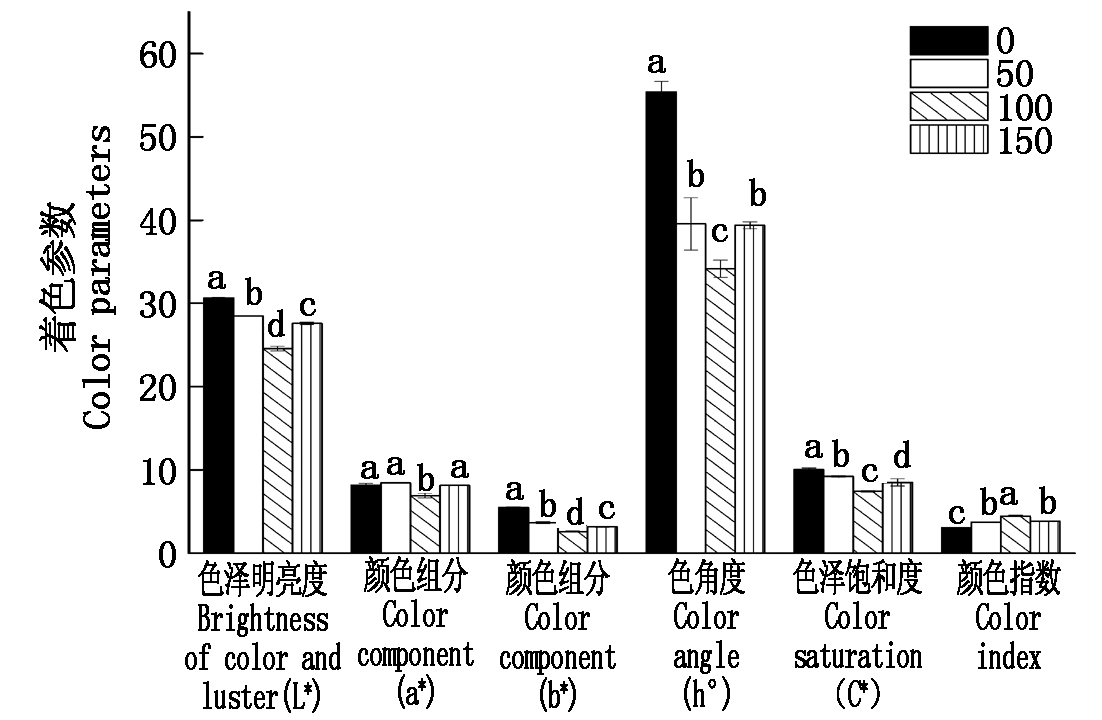
柱状图上的不同小写字母表示处理间差异显著(P<0.05) 。
The histograms capped with different letters indicate significant difference(P<0.05) .
图1 ALA处理对成熟期葡萄果实色泽参数的影响
Fig.1 Effect of ALA treatment on ripening grape fruit color parameters
2.2 ALA处理对葡萄果实品质变化规律的影响
图2-A可知,ALA处理后25 d内弗雷无核葡萄果实总糖含量变化规律表现为,果实发育过程中,各处理(50,100,150 mg/L)与对照(0 mg/L)葡萄果实中总糖含量呈线性增长趋势,处理后5~15 d,总糖含量增长较快,且50,100 mg/L ALA处理显著高于对照(P<0.05);处理后15~25 d,果实总糖含量虽随着果实逐渐成熟增长减缓,但各处理果实总糖含量相比对照增长幅度较大,以处理后25 d最为显著,较对照分别提高了23.8%,24.8%,8.7%,其中100 mg/L ALA处理效果最好。ALA处理能够显著提高葡萄果实总糖含量,这种促进效应在处理后5 d便开始显现,与ALA使用剂量无相关性。
由图2-B可看出,处理(50,100,150 mg/L)及对照(0 mg/L)果实可滴定酸含量在果实成熟过程中逐渐降低,与总糖含量呈现相对应的变化趋势,处理后5~10 d,可滴定酸含量迅速降低;处理后10~25 d果实可滴定酸含量下降速率逐渐减缓,且经ALA处理后25 d内弗雷无核葡萄果实可滴定酸含量总体显著低于对照(P<0.05),100 mg/L ALA处理效果最为明显,处理后5 d即显现效应,且此时与对照差异幅度最大,较对照降低了37.1%。
图2-C显示的是ALA处理后25 d内弗雷无核葡萄果皮叶绿素含量(以鲜质量计)的变化规律。处理与对照葡萄果实叶绿素积累与果实发育阶段密切相关,处理后5~10 d,果皮内叶绿素含量伴随葡萄果实着色逐渐上升;处理后10~25 d,果皮内叶绿素含量伴随葡萄果实成熟持续下降。同时发现,ALA处理能够有效促进果皮叶绿素含量的积累,缓解果实成熟过程中叶绿素的降解速率,处理后5 d效果最为明显,同对照相比,各处理叶绿素含量分别提高了53.3%,52.9%,50.9%。
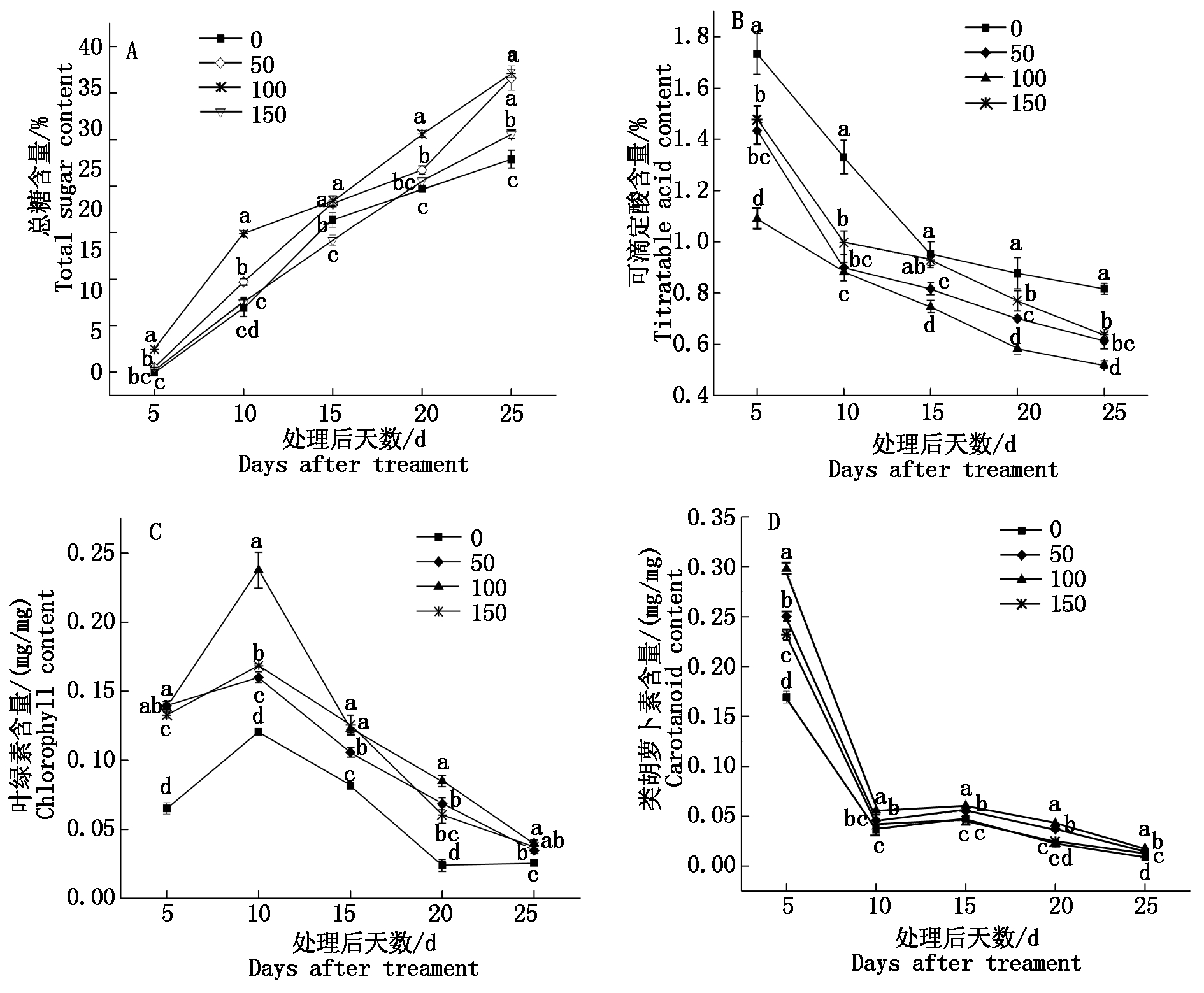
折线图上的不同小写字母表示处理间差异显著(P<0.05) 。图 3 同。
The line chart capped with different letters indicate significant difference(P<0.05) . The same as Fig.3.
图2 ALA处理对葡萄果实糖、酸、叶绿素及类胡萝卜素含量变化的影响
Fig.2 Effect of ALA treatment on sugar,titratable acid,chlorophyll and carotenoid contents in grape fruit
图2-D转色期-成熟期25 d内葡萄果皮类胡萝卜素含量(以鲜质量计)变化规律显示,处理后5~10 d,葡萄果皮类胡萝卜素含量急剧下降;处理后10~15 d,类胡萝卜素含量稍有增加;处理后15~25 d,果皮类胡萝卜素含量伴随果实成熟逐渐降低。同时可看出,50,100 mg/L ALA处理可显著促进果皮类胡萝卜素含量的积累,缓解果实成熟过程中类胡萝卜素含量的降解速率,而150 mg/L ALA处理与对照总体差异性不显著(P>0.05)。各处理(50,100,150 mg/L)均在5 d时开始显现效应且最为明显,相比对照,积累量分别增加了32.33%,43.20%,27.00%。
2.3 ALA处理对葡萄果皮花青素及合成相关酶活性变化规律的影响
图3-A所示的是转色期-成熟期25 d内葡萄果皮花青素含量(以鲜质量计)变化规律。葡萄果实着色前期(处理后5~10 d)果皮花青素含量增长缓慢;处理10~15 d着色速度加快,果皮花青素含量大幅度增加;伴随果实逐渐成熟果皮花青素含量缓慢升高或降低。同时发现,ALA处理(50,100,150 mg/L)可显著促进果皮花青素的积累(P<0.05),处理15 d时效果最明显,较对照增幅分别达49.4%,62.2%,49.3%,100 mg/LALA处理总体效果表现最好。直至处理后25 d,花青素虽呈缓慢增长或下降,相比对照而言,100,150 mg/L ALA处理仍表现出较高的促进效应。
由图3-B可见,葡萄果实着色期(处理后5~15 d),对照与各处理(50,100,150 mg/L)果皮内PAL活性(以鲜质量计)迅速增加,处理15 d时均达最峰值,分别为79.49,87.75,94.92,96.7 mg/g;随着果实逐渐成熟果皮PAL活性虽逐渐下降,但经ALA处理后的葡萄果皮PAL活性在整个葡萄果实发育过程中明显高于对照,说明ALA处理能够显著提高与花青素合成相关PAL的活性。
与花青素合成相关酶CHI在不同质量浓度ALA处理及处理后不同时间活性的变化规律如图3-C所示。从处理后不同时间阶段CHI活性(以鲜质量计)变化来看,处理后5~15 d CHI活性显著上升,15 d时达到最高;处理后15~25 d,CHI活性伴随果实成熟迅速降低。同时发现,各处理在处理后10,25 d能够显著提高果皮CHI活性(P<0.05),而在其他发育阶段均呈现不同的促进或抑制作用,说明ALA处理提高果皮花青素合成相关CHI活性的效应与处理浓度无直接关系,与处理后浓度作用时间密切相关。
图3-D所示各处理和对照与花青素合成相关酶DFR在处理后不同发育阶段的活性总体呈波动性变化,处理后5~10 d 果皮内DFR活性(以鲜质量计)伴随果实着色大幅度提高,之后10~15 d 有所下降,成熟过程中又迅速增加,伴随果实着色完全后缓慢下降。100 mg/L ALA处理在处理后第10,20天能够显著提高葡萄果皮DFR活性(P<0.05);各处理在处理后第10天果皮DFR活性均达峰值,较对照7.94 mg/g分别增加了8.5%,10.9%,6.6%,其他发育阶段均表现不同差异的促进或抑制作用。
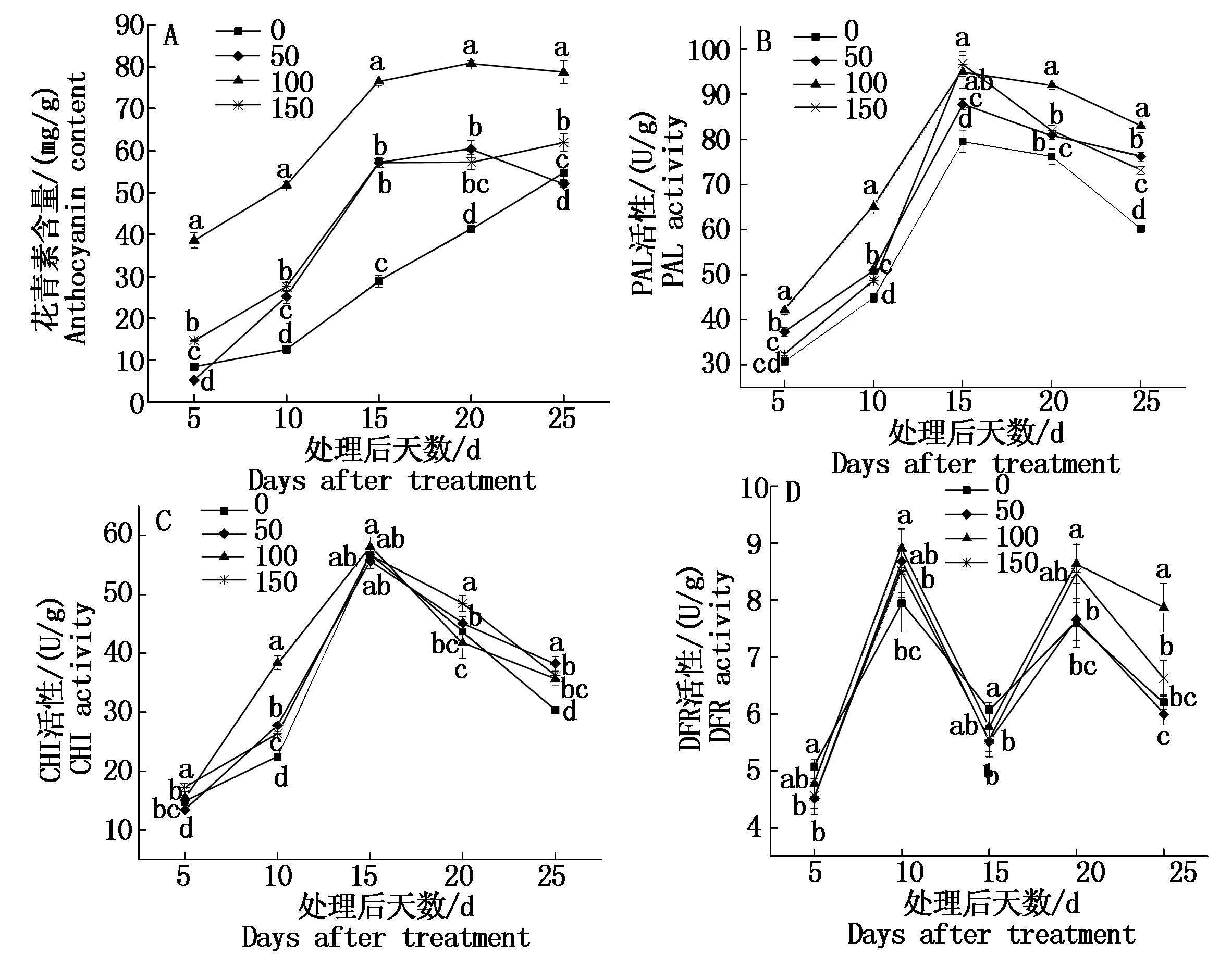
图3 ALA处理对葡萄果皮花青素及合成相关酶活性的影响
Fig.3 Effect of ALA treatment on anthocyanin synthesis and related enzymes activities in grape pericarp
2.4 ALA处理后葡萄果皮花青素与其合成相关酶活性的相关性
由表1 ALA处理后葡萄果皮花青素含量变化与其合成相关酶活性变化的相关性分析可看出,在果实成熟过程中,未经ALA处理的弗雷无核葡萄果皮花青素含量变化与PAL活性变化呈显著正相关,但与CHI、DFR活性变化相关性不显著;ALA处理后的葡萄果皮花青素含量变化均与PAL、CHI呈极显著正相关,与DFR仍无显著相关性。说明成熟过程中葡萄果皮花青素合成与果皮PAL、CHI活性密切相关,且ALA处理能够激活诱导花青素合成相关PAL、CHI的表达,显著提高葡萄果皮花青素含量与其合成相关酶活性变化规律的相关性。
表1 ALA处理后葡萄果皮花青素与其合成相关酶的相关性系数
Tab.1 The correlation coefficient of anthocyanin synthesis and the enzyme activity of anthocyanin biosynthesis in grape pericarp after ALA treatment
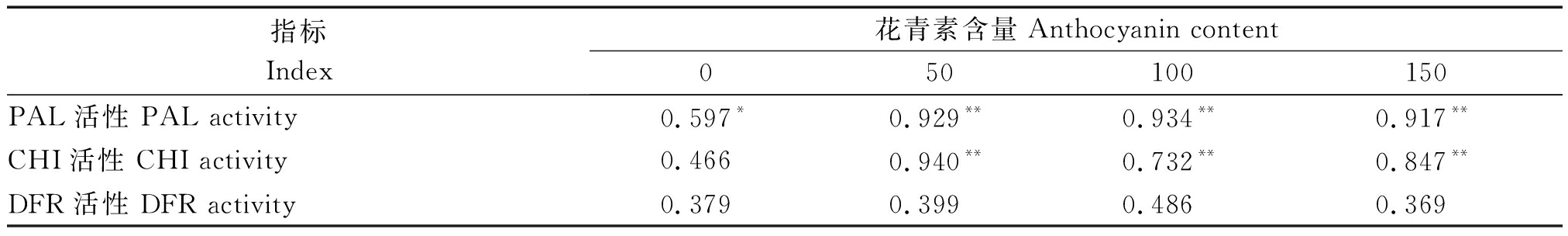
指标Index花青素含量Anthocyanin content050100150PAL活性 PAL activity0.597*0.929**0.934**0.917**CHI活性 CHI activity0.466 0.940** 0.732** 0.847**DFR活性 DFR activity0.3790.3990.4860.369
注:*.5% 的差异显著水平;**.1%水平差异极显著水平。
Note:*.Significant difference at 5% level;**.Extremely significant difference at 1% level.
3 讨论与结论
果皮着色程度受到多种色素类物质综合作用的影响,而花青素种类含量的不同对葡萄果实着色和品质起决定性的作用。糖作为花青素合成的重要原料,其种类的不同通过糖代谢途径能够使花青苷呈现不同的颜色。外源试验表明,通过喷施外源ALA处理能够提高果实内可溶性固形物和可溶性糖含量,并使酸度降低,果实品质明显得到改善[16-17]。前期试验也表明,通过盛花期后喷施ALA处理葡萄果实可显著提高成熟期果实内可总糖含量,降低可滴定酸含量,且花青素含量与糖含量呈显著正相关[18]。本试验进一步研究结果表明,在弗雷无核葡萄果实膨大期和着色期通过喷施ALA处理,果实内可滴定酸含量明显下降,总糖含量显著增加,与花青素含量变化保持很好的一致性,并使成熟期葡萄果实颜色指数(CIRG)显著提高,同时发现,这种浓度效应在处理后25 d内具有一定的持久性,以100 mg/L ALA处理表现最好。而在桃果实着色前利用不同质量浓度ALA涂布果实的结果发现,ALA处理后的成熟果实可溶性固形物含量与对照相比没有明显差异,可滴定酸含量在300,100 mg/L ALA处理下显著低于对照,花色素含量仅在300 mg/L ALA处理下较对照差异显著[19]。由此看出,ALA处理能够通过对果实糖酸含量的调控影响花青素合成积累,其处理浓度及时间在不同物种的研究效应中会有所差异,与浓度本身无直接关系,因此,选择适宜浓度ALA处理能够有效改善果实内在品质和外观色泽。
果皮中花青素的表达常常受到叶绿素和类胡萝卜素含量的干扰。高叶绿素含量是影响妃子笑果实着色不良的主要原因,一方面加重了果面的底色,干扰花青苷色泽的显现,另一方面屏蔽了花青苷的合成,使糖积累量下降,从而影响果实的着色效果[20]。大量外源试验表明,ALA处理能够提高兔眼蓝莓[17]、番茄[21]、萝卜[22]等果实内叶绿素和类胡萝卜素含量。本研究结果表明,ALA处理后葡萄果皮花青素、叶绿素和类胡萝卜素含量明显增加,与前人不同的是,本研究发现处理后10~15 d是葡萄果皮花青素含量大幅度增长期,而此时葡萄果皮叶绿素含量迅速降解,经ALA处理的葡萄果皮叶绿素含量较对照降解速率明显变缓,由此可知,外源ALA在有效促进花青素积累的同时,还能够在一定程度上减少叶绿素迅速降解对花青素合成的干扰作用,同时,再次证明了叶绿素开始降解的时间与花青素开始合成的时间大致吻合。因此,在对果皮叶绿素、类胡萝卜素含量的调控影响果实花青素合成积累的研究中,应更多考虑叶绿素和类胡萝卜素的降解对花色素积累的影响,明确一个提高果实着色的最佳处理时期,从而更好地促进果实着色。
在花青素生物合成途径中,其生物合成的各类关键酶的高效表达能够促使果实中花青素的积累。苯丙氨酸裂解酶(Phenvlalanine ammonia lyase,PAL)属于花青苷生物合成初始反应的关键酶。目前,大多学者认为只有在缺少某种前体物质的条件下,花青素的合成才与PAL活性具有相关性[23]。PAL基因的表达受到多种外界因素(光照、温度、外源植物激素等)的影响,在苹果疏果期间,利用不同浓度ALA处理苹果幼果的研究发现,300 mg/L以内的ALA处理能够明显提高苹果PAL酶活性及其基因表达量,且随ALA质量浓度的提高而升高[24]。王中华等[25]在苹果果实着色期喷施ALA的处理研究发现,照光36 h内,经ALA处理后的果皮中PAL活性呈现先升高后下降的趋势,且苹果果皮花青苷的积累量在离体条件下明显提高,认为ALA处理诱导苹果果皮花青素积累与PAL活性瞬时上调密切相关。本试验研究结果表明,伴随果实成熟,果皮花青素含量与PAL 活性变化呈极显著正相关,且ALA处理极显著提高了果皮PAL活性,以100 mg/L ALA处理表现最佳,这种效应并不随浓度的增加而增强,说明ALA仅作为一种适宜的浓度效应激活与花青素合成相关PAL的表达,从而促进花青素的积累。
查尔酮异构酶(Chaleone isomerase,CHI)是催化查尔酮生成二羟基黄烷酮的关键酶,并不是植物体形成二氢黄酮醇的必要调控基因,当植物体内CHI完全缺乏时,才会影响花青苷的积累[26]。而二羟基黄酮醇还原酶(Dihydorflavonol-4-reductase,DFR)作为花青素生物合成主要限制因子,参与催化二氢黄酮醇转化为花白素,最终合成未修饰的花青素。相关外源试验表明,不同质量浓度ALA处理苹果幼果,果实内CHS、CHI基因的相对表达量均较对照显著提高[5]。在桃果实着色前利用不同质量浓度的ALA溶液处理果实能够显著提高UFGT、DFR、LDOX和CHS 4个结构基因的表达量,且与桃果皮中花色素苷积累量的变化趋势表现很好的一致性,进而从一定程度上揭示了ALA对果实着色的促进作用[19]。还有学者通过釆前ALA处理对苹果花青苷及相关基因表达的影响研究发现,ALA主要是通过上调CHS、F3H、UFGT和MYB10类相关基因的表达量来促进果皮花青苷积累,而非DFR ,与花青素合成相关基因的表达不仅受到ALA的调控,同样也受到光、温度、气体等环境因子的影响[27]。白鸽等[8]通过一定质量浓度的ALA及GNT处理苹果果实的研究发现,处理过的苹果果皮内CHS、CHI、ANR、FLS及MYB10基因的表达量均为最高,且与苹果果皮中花青苷含量的变化趋势相一致。但也有学者通过在葡萄上喷布ALA处理对离体果皮进行半定量RT-PCR检测结果发现,一定质量浓度的ALA处理能够显著促进与花青苷合成相关基因CHI的表达,而对CHS的表达没有额外影响[7]。本试验研究结果表明,ALA处理均可显著提高与葡萄花青素合成相关CHI活性,对DFR的促进效应仅在特定时期表达。同时通过ALA处理对弗雷无核葡萄果皮花青素与其合成相关酶活性的相关性分析表明,ALA处理极显著提高了PAL、CHI与花青素含量变化的相关性,且处理及对照葡萄果皮花青素大量积累期与果皮PAL、CHI迅速提高期相一致。但发现处理及对照果皮内DFR活性与花青素含量变化均无显著相关性。由此看出,ALA处理能够在不同程度上提高葡萄果皮花青素合成相关PAL、CHI、DFR的活性,通过喷施ALA处理促进果皮花青苷积累与相关基因PAL、CHS瞬时上调密切相关,与DFR无直接相关性,其关系有待进一步研究。
[1] 孟祥云,王枝翠,王雨歌,等.地面遮阴对新疆‘红地球’葡萄果实着色的影响[J].果树学报,2014,31(1):60-65.
[2] 王枝翠. 干旱区红地球葡萄果实色素积累的光响应机制研究[D]. 石河子:石河子大学,2013.
[3] 陈 叶,李 番,马秀萍,等. 5-氨基乙酰丙酸对甜叶菊产量和糖含量的影响[J]. 中国糖料,2017,39(2):36-38.
[4] 高晶晶,冯新新,段春慧,等. ALA提高苹果叶片光合性能与果实品质的效应[J]. 果树学报,2013,30(6):944-951.
[5] 陈 磊,郭玉蓉,张晓瑞,等. ALA对苹果幼果黄酮含量及CHS和CHI基因表达的影响[J]. 西北农林科技大学学报:自然科学版,2014,42(12):161-165.
[6] 李汉钊,孙军利,赵宝龙,等. 外源5-氨基乙酰丙酸对NaCl胁迫下酸枣光合特性的影响[J]. 西北植物学报,2017,3(5):0952-0958.
[7] 赵宝龙,刘 鹏,张 祥,等.5-氨基乙酰丙酸对盐胁迫下葡萄叶片光合特性及生长特性的影响[J].北方园艺,2016 (14):1-6.
[8] 白 鸽,郭玉蓉,陈 磊. ALA和GNT对苹果果皮中多酚,酶活及相关基因的影响[J]. 食品工业科技,2015,36(13):194-198.
[9] Fernandez-Lopez J A,Almela L,Munoz J A,et al. Dependence between colorand individual anthocyanin content in ripening grapes[J]. Food Research International,1998,31(9):667-672.
[10] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:192-195.
[11] 沈德绪. 果树育种技术[D].北京:农业出版社,1992.
[12] 李 伟. 套袋及生理活性物质对苹果梨果实着色的影响[D]. 延吉:延边大学,2011.
[13] 王惠聪,黄旭明,胡桂兵,等. 荔枝果皮花青苷合成与相关酶的关系研究[J]. 中国农业科学,2004,37(12):2028-2032.
[14] 刘晓静.国光苹果红色芽变果实品质评价及着色机理的初步研究[D].济南:山东农业大学,2009.
[15] Lister C E,Lancaster J E,Walker J L. Phenylalanine ammonia-lyase(PAL)activity and its relationship to anthocyanin and flavonoid levels in New Zealandgrown Apple cultivars[J]. Journal of the American Society for Horticultural Science,1996,121(2):281-285.
[16] 王 婷,饶景萍,宋永令,等. 叶面喷施5-氨基乙酰丙酸对番茄果实采后生理指标的影响[J]. 西北农业学报,2009,18(1):243-247.
[17] 韦继光,於 虹,张晓娜,等. 5-氨基乙酰丙酸对兔眼蓝莓光合性能及果实产量和品质的影响[J]. 北方园艺,2014(16):9-12.
[18] 张梦燕,孙军利,赵宝龙,等. 外源ALA对葡萄果实品质及PAL活性的影响[J]. 中外葡萄与葡萄酒,2017(3):16-19.
[19] 郭 磊,蔡志翔,张斌斌,等. 5-氨基乙酰丙酸促进桃果皮提前着色机制研究[J]. 园艺学报,2013,40(6):1043-1050.
[20] 王惠聪,黄旭明,黄辉白. 妃子笑荔枝果实着色不良原因的研究[J]. 园艺学报,2002,29(5):408-412.
[21] 徐 铭,徐福利. 5-氨基乙酰丙酸对日光温室番茄生长发育和产量品质的影响[J]. 西北农林科技大学学报:自然科学版,2008,36(9):129-132.
[22] 汪良驹,刘卫琴,孙国荣,等. ALA对萝卜不同叶位叶片光合作用与叶绿素荧光特性的影响[J]. 西北植物学报,2005,25(3):488-496.
[23] Ju Z G,Yuan Y B,Liu C L,Xin S H. Relationships among phenylalanine ammonia-lyase activity,simple phenol concentrations and nthocyanin accumulation in apple[J]. Scientia Hortriculture,1995,61:215-226.
[24] 陈 磊,郭玉蓉,刘永峰,等. 5-氨基乙酰丙酸对苹果幼果多酚含量,苯丙氨酸解氨酶活性及其基因表达的影响[J]. 食品科学,2014,35(11):135-138.
[25] 王中华,汤国辉,李志强,等. 5-氨基乙酰丙酸和金雀异黄素促进苹果果皮花青苷形成的效应[J]. 园艺学报,2006,33(5):1055-1058.
[26] 孟繁静. 植物花发育的分子生物学[M]. 北京:中国农业出版社:2000,225-269.
[27] 陈 磊. 采前ALA/GNT处理和气调贮藏方式对苹果花青苷及相关基因表达的影响[D]. 西安:陕西师范大学,2015.