黑果枸杞(Lycium ruthenicum)是中国西北干旱及半干旱生态脆弱区广泛分布的典型药食两用的经济型盐生植物,并兼有特种用途林的属性。因其富含氨基酸、原花青素(Oligomeric proantho cyanidin,OPC) 和超氧化物歧化酶(Super oxide dismutase,SOD)等重要物质,所以在抗疲劳、抗衰老以及防治疾病和保健方面具有重要作用[1]。目前,现有研究对花青素合成路径、影响因素已开展了不少研究:李兴国和于泽源[2]认为上述花青素合成受到酶、碳水化合物、环境等因素影响,且均有酶的参与。刘鸿飞[3]认为拟南芥花青素含量增加可能参与了植物对外界生物与非生物胁迫的响应。张泽煌等[4]以杨梅为材料,研究了花青苷和糖代谢的差异,表明青素合酶(ANS)、苯基丙氨酸解氨酶(PAL)、查尔酮合酶11(CHS11 )、二磷酸尿核苷葡萄糖︰类黄酮3-O-葡糖基转移酶(UFGT)是花青苷合成的关键酶。刘长英等[5]在桑葚花青素含量与基因关系研究中证实外源ABA和乙烯利促进花青素合成以及相应基因上调。严莉等[6]进一步指出MYB基因可能参与了不同时期花青素变化的调控。Mn直接参与Ca-Po代谢和粘多糖的合成,王庆菊等[7]也曾研究表明,配施Mn,叶片中花青苷显著高于对照。任永丽和董海峰[8]通过对应聚类分析研究得出Cu和Mn与青海黑果枸杞品质密切相关。虽然,现有研究报道了多种因素影响花青素合成与代谢,但关于黑果枸杞内源微量元素与黑果枸杞体内原花青素、多糖和还原糖关系的研究仍较少。本研究以新疆阿拉尔垦区栽培黑果枸杞为例,通过分析植株中微量元素与其营养物质的关系,以期为本区黑果枸杞营养物质累积提升提供施肥指导,并阐明上述物质与盐渍化逆境作用机制。
1 材料和方法
1.1 试验材料
2016年10月初,收获中盐渍土(0.5%<总盐含量/干土质量<1.0%)黑果枸杞植株及果实。植株分器官收集,60 ℃烘干,研磨成粉末,过0.3 mm筛,分装待测。
1.2 试验方法
准确称量1.000 0 g样品于20 mL烧杯,加入10 mL HNO3浸泡24 h,于煤气灯上小火加热消化近干。再加入HNO3∶HClO4 =4∶1溶液15 mL,小火加热消化,直至浓白烟产生,样品溶液结晶,冷却后去离子水定容50 mL,为待测液。用原子吸收分光光度计在波长324.7,279.5 nm测定Cu、Mn[9]。Ca、Mg使用EDTA浸提后测定,Cl使用AgNO3滴定。
原花青素测定参照文献[10],取果实1.000 g样品,按照物液比1 g∶20 mL加入60%乙醇恒温水浴浸泡浸提6 h过滤。以香兰素显色,混合静止5 min,儿茶素510 nm制备标准曲线,计算求得原花青素含量(mg/g)。
多糖和还原糖测定:前者将果实样品捣碎用80%乙醇提纯,并进行适当稀释,移取1 mL加入试管,并加入去离子水1 mL、1 mL苯酚溶液,摇匀,迅速加入H2SO4 5.00 mL,冷却到室温,以去离子水加相应试剂为空白[11]。还原糖测定参照斐林试剂比色法[12]。
1.3 统计分析
样品各指标测定均重复3次,Kolmogorov-Smirnov(K-S)检验数据是否正态分布,样本n<50,P>0.3接受假设检验结果,即数据符合正态分布;若P<0.3则可能出现错误判断,若符合且指标间存在明显相关性,则使用非线性回归分别分析根及地上部微量元素Mn、Cu、Ca、Mg和Cl与原花青素、多糖和还原糖的关系;若不符合且相关性不强,则通过log(x+1)对数转化,再进行回归分析。
2 结果与分析
2.1 黑果枸杞矿质元素和营养物质非参数检验
K-S检验表明:整株植物Cu、Ca、OPC、还原性糖和多糖符合正态分布,其假设性检验参数分别为0.664,0.699,0.898,0.878,0.925(P>0.05)。Mn和Mg也符合正态分布,其检验参数分别为0.110,0.175(P<0.05)。原花青素、还原性糖和多糖的平均含量分别为24.97,157.25,90.57 mg/kg(表1)。
表1 对数标准化黑果枸杞整株样本不同参数的K-S检验
Tab.1 One-sample Kolmogorov-Smirnov test
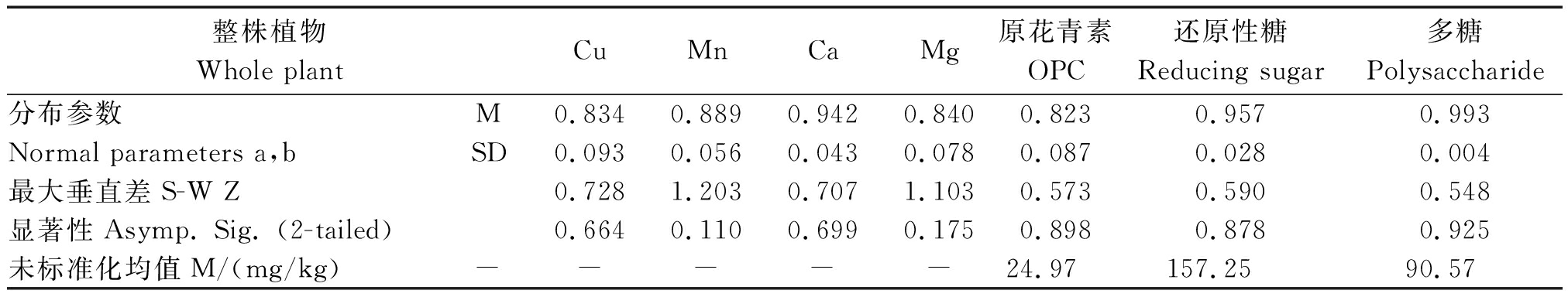
整株植物Whole plantCuMnCaMg原花青素OPC还原性糖Reducing sugar多糖Polysaccharide分布参数M0.8340.8890.9420.8400.8230.9570.993Normal parameters a,bSD0.0930.0560.0430.0780.0870.0280.004最大垂直差S-W Z0.7281.2030.7071.1030.5730.5900.548显著性Asymp. Sig. (2-tailed) 0.6640.1100.6990.1750.8980.8780.925未标准化均值M/(mg/kg)-----24.97157.2590.57
2.2 黑果枸杞不同器官矿质元素与营养物质的相关性
盐碱地条件下,植株体矿质元素Ca和Mg之间呈显著正相关,植株体Mg与多糖表现为正相关。微量元素Cu和多糖、还原性糖及原花青素(OPC)分别呈负相关作用。Mn、Cu与Ca、Mg之间存在激发作用,Mn、Cu可能增加了Ca、Mg活性并增强了Ca、Mg的吸收,但此过程中植物将其应用于逆境胁迫的拮抗,所以仅剩余少量,因而阻碍了上述元素对原花青素合成的影响。Cu与Ca存在一定正相关性。Ca与多糖和还原糖之间存在正相关作用,能够促进多糖、还原糖的累积(表2)。
表3显示,根系中Ca与多糖呈极显著负相关。根系中Mn元素含量与Ca和Mg呈极显著正相关。后两者也存在极显著正相关性。多糖和根系中Mn存在一定负相关;还原性糖累积量受根系中Cu的一定影响,但均未达到显著水平。OPC与根系中Mg表现出一定正相关性,但也未达到显著水平(P>0.05)。
表2 整株中非繁殖组织微量元素与黑果枸杞果实营养物质之间相关性分析
Tab.2 Correlation analysis between trace elements in non-reproductive organs and nutrients in the whole plant
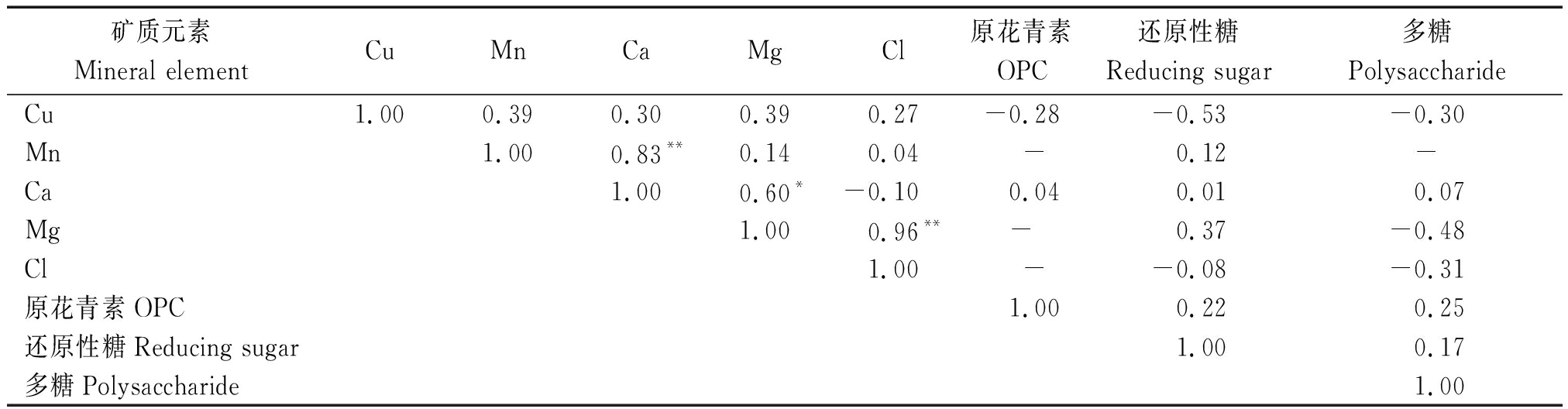
矿质元素Mineral elementCuMnCaMgCl原花青素OPC还原性糖Reducing sugar多糖PolysaccharideCu1.000.390.300.390.27-0.28-0.53-0.30Mn1.000.83**0.140.04 -0.12-Ca1.000.60*-0.100.040.010.07Mg1.000.96**-0.37-0.48Cl1.00 --0.08-0.31原花青素OPC1.000.220.25还原性糖Reducing sugar1.000.17多糖Polysaccharide1.00
注:Cu、Mn、Ca、Mg、Cl分别表示整株中非繁殖器官元素含量。
Note:Cu,Mn,Ca,Mg and Cl respectively represent the non-propagating organ element content in the whole plant.
表3 根系中微量元素与黑果枸杞营养物质累积量相关性
Tab.3 Correlation between micronutrients in root system and accumulation of nutrients
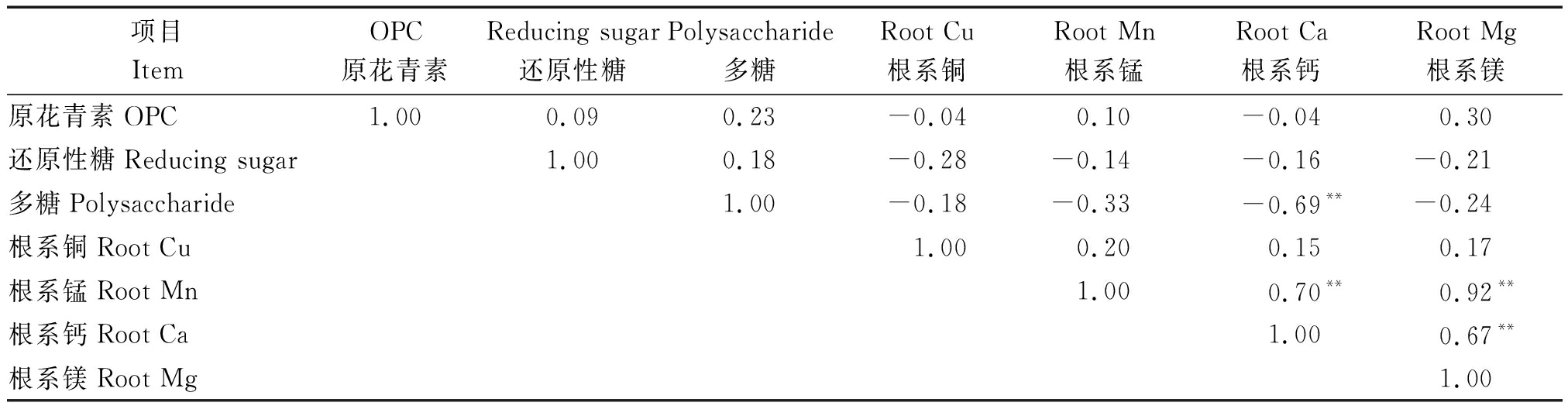
项目ItemOPC原花青素Reducing sugar还原性糖Polysaccharide多糖Root Cu根系铜Root Mn根系锰Root Ca根系钙Root Mg根系镁原花青素OPC1.000.090.23-0.040.10-0.040.30还原性糖Reducing sugar1.000.18-0.28-0.14-0.16-0.21多糖Polysaccharide1.00-0.18-0.33 -0.69**-0.24根系铜Root Cu1.000.200.150.17根系锰Root Mn1.00 0.70**0.92**根系钙Root Ca1.000.67**根系镁Root Mg1.00
2.3 矿质元素对黑果枸杞营养物质的影响
图1表明,黑果枸杞植株Mn含量为14.81~147.30 mg/kg(图1-A)。矿质元素超出一定范围原花青素(OPC)随着植株体Cl和Mn增量,其累积量显著减少,上述元素均抑制了OPC的积累。回归分析表明:OPC与植株体Mg、Cl拟合方程分别为OPC=1.54 Mg+1.19,R2=0.67;OPC=-0.22Cl2+0.93 Cl+0.87,R2=0.36,当植株体Cl大于2.11即未经对数标准化时Cl大于2.24%,原花青素含量显著升高。图1-C显示植株内源Mn当大于67 mg/kg,随着内源Mn元素增加,OPC含量显著降低,二者符合OPC=-227Mn2 + 22.24 Mn +0.91,R2=0.29。同时,由图1通过指数转化后得出,OPC含量多分布于20~30 mg/kg。图1-D表明,果实中多糖与植株Mn元素符合:多糖=-9.58 Mn2+1.13 Mn+2.21,R2=0.45。当Mn元素小于等于84 mg/kg,果实多糖显著增加。
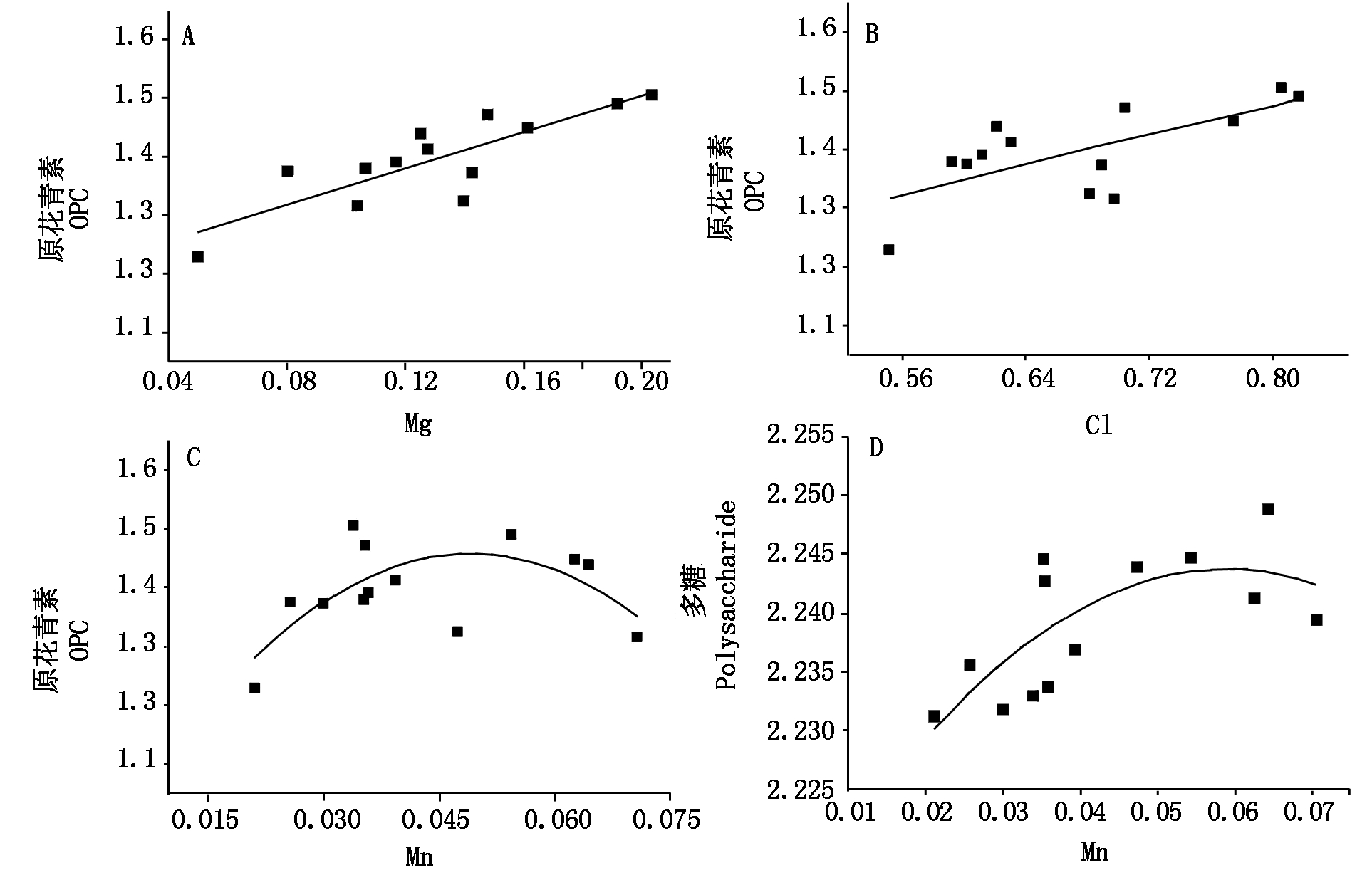
图1 中度土壤盐渍化条件植株内源元素Mg、Cl和Mn含量与原花青素(OPC)及多糖的回归分析
Fig.1 Regression analysis of endogenous elements Mg,Cl and Mn,procyanidins (OPC)
and polysaccharides in plants with moderate soil salinization conditions
3 讨论
本研究表明:中度盐渍化土壤条件下,超出一定范围内植株内源Mn明显阻碍了原花青素的累积,其中:Mn的抑制作用较为明显,Cl的抑制作用较弱。Skupień 和Oszmiaski[13]发现黑果腺肋花楸在Mn和碱性肥(N、K、Si)及其协同作用下,果实中多酚类物质显著减少,样品的没食子酸当量(以鲜质量计)由23.77 mg/g减少到21.05~21.82 mg/g。同时,清除自由基的能力从38.1%,下降到29.8%~31.6%。这说明,Mn元素在碱性条件下,可能对多酚类物质积累造成阻碍。Treutter[14]认为Mn2+和Mg2+能够维持PAL、CoA-ligases和甲基转移酶的生物活性。Sanghera等[15]进一步分析指出Mn SOD主要分布于线粒体和过氧化物酶体内,并且主要用于清除活性氧,遭受胁迫时Mn可能会抑制花青素前体物质的形成。Bindon等[16]试验显示果实表皮结构的差异影响了原花青素的合成。Gao等[17]认为灌溉量为20 m3/hm枣(Ziziphus jujuba)原花青素含量显著降低,这是因为干旱胁迫使植株本应产生非活性原花青素前体,产生抵抗干旱胁迫活性物质。金鱼草转录因子AmYBMYB308和拟南芥转录因子AtMYB4是R2R3MYB转录抑制因子,可以抑制花青素途径的上游结构基因。Booker和Maier[18]曾将火炬松(Pinus taeda)暴露于不同浓度CO2环境中,较高浓度原花青素含量增加了11%,并且潘芝梅等[19]在李果实花青素和矿质元素关系研究中指出果实中花青素与Ca呈幂函数关系。郭晓光[20]研究表明,氯大于75 mmol/L,2种蓝莓(Vaccinium corymbosum L.)光合速率显著下降,是因为蓝莓适应胁迫的表现。就本研究而言,黑果枸杞能够耐受较高浓度的氯,所以初始表现为原花青素显著增加,当浓度进一步增加,则表现出强烈抑制作用。
植物根系对矿质元素的富集,一方面表现为防卫性措施,用于抵抗根围逆境胁迫;另一方面是植物生长和发育所必须。研究区黑果枸杞生长于盐碱地,因而更倾向于先改善并维持最易存活的近似环境,再进行生长和繁殖。当根系中富集较多钙离子时,可以防御来自根系环境所产生的胁迫,因为Ca2+是多种抗氧化酶的信使,可以激活抗氧化酶系统,清除相应活性氧自由基。通常认为钙镁离子间存在协同作用,这可以被解释为镁离子是光合过程中重要辅酶因子[21],镁的充分吸收,更有利于碳水化合物形成,在一定程度缓解了盐碱胁迫。
综上所述,中度盐碱地生境中,黑果枸杞花青素受到内源镁的显著影响,镁促进了果实花青素的累积;盐碱地中氯离子在一定程度促进了花青素积累,但超过2.24%,则强烈抑制花青素累积。植株内源锰介于14.81~147.30 mg/kg,均与花青素和多糖之间符合开口朝下二次函数,当锰含量分别超过67,84 mg/kg则会强烈阻碍二者累积。根系中钙的富集促进锰和镁元素的吸收,但抑制了果实中多糖的形成,这可能是因为黑果枸杞在盐碱地胁迫中,矿质元素主要用于增加抗氧化酶活性,而阻碍了果实多糖的合成。
[1] 郝媛媛,颉耀文,张文培,等. 荒漠黑果枸杞研究进展[J]. 草业科学,2016,33(9):1835-1845.
[2] 李兴国,于泽源. 花青苷的研究进展[J]. 北方园艺,2003(4):6-8.
[3] 刘鸿飞. SAL(Short primary root and abundant lateral roots)参与调控拟南芥根系发育和花青素合成[D].北京: 中国科学院大学,2013.
[4] 张泽煌,陈义勇,钟秋珍,等. 红果肉与白果肉杨梅花青苷和糖代谢途径的差异蛋白研究[J]. 园艺学报,2013,40(12):2391-2400.
[5] 刘长英,李 军,赵爱春,等. 桑椹发育中花青素、叶绿素含量变化及相关基因的表达分析[J]. 林业科学,2014(9):59-66.
[6] 严 莉,王翠平,陈建伟,等. 基于转录组信息的黑果枸杞MYB转录因子家族分析[J]. 中国农业科学,2017,50(20):3991-4002.
[7] 王庆菊,胡艳丽,李晓磊,等. 紫叶稠李叶片不同叶序花青苷与化学成分的相关性[J]. 山东农业大学学报:自然科学版,2007,38(4):557-560.
[8] 任永丽,董海峰. 青海和宁夏枸杞子中微量元素的对应聚类分析[J]. 安徽农业科学,2012(31):15119-15120,15143.
[9] 李宏岩,彭 茵,郝爱国,等. 黄芪属植物微量元素Fe,Zn,Cu,Mn含量的测定与比较[J]. 大连医科大学学报,2007,29(3):303-304.
[10] 李凤英,崔蕊静,郑立红,等. 植物中原花青素含量的分析测定[J]. 食品与发酵工业,2004,30(5):147-149.
[11] 代 晶. 笃斯越橘(Vaccinium uliginosum L.)果实多糖的提取纯化,结构鉴定及生物活性研究[D]. 哈尔滨: 东北农业大学,2016.
[12] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000.
[13] ![]() K,Oszmianski J. The effect of mineral fertilization on nutritive value and biological activity of chokeberry fruit[J]. Agricultural and Food Science,2007,16(1):46-55.
K,Oszmianski J. The effect of mineral fertilization on nutritive value and biological activity of chokeberry fruit[J]. Agricultural and Food Science,2007,16(1):46-55.
[14] Treutter D. Managing phenol contents in crop plants by phytochemical farming and Breeding-visions and constraints[J]. International Journal of Molecular Sciences,2010,11(3):807-857.
[15] Sanghera G S,Malhotra P K,Sidhu G S,et al. Genetic engineering of crop plants for enhanced antioxidants activity[J]. International Journal of Advancements in Research & Technology,2013,2(5):2278-7763.
[16] Bindon K A,Bacic A,Kennedy J A. Tissue-specific and developmental modifications of grape cell walls influence the adsorption of proanthocyanidins[J]. Journal of Agricultural& Food Chemistry,2012,60(36):9249-9260.
[17] Gao Q H,Yu J G,Wu C S,et al. Comparison of drip,pipe and surge spring root irrigation for jujube (Ziziphus jujuba mill.) fruit quality in the loess plateau of China[J]. PLoS One,2014,9(2):e88912.
[18] Booker F L,Maier C A. Atmospheric Carbon dioxide,irrigation,and fertilization effects on phenolic and nitrogen concentrations in loblolly pine (Pinus taeda) needles[J]. Tree Physiology,2001,21(9):609-616.
[19] 潘芝梅,徐金刚,卢 刚,等. 李果实发育期矿质元素和果皮花青素含量的变化规律及相关性分析[J]. 浙江林业科技,2009,29(4):21-24.
[20] 郭晓光. 氯胁迫下蓝莓叶片的转录组测序及对光合生理、氮代谢相关基因的表达分析[D]. 金华: 浙江师范大学,2015.
[21] Vatansever R O I,Beneficial trace elements in plants and their transport in roots:a review[J]. Applied Biochemistry and Biotechnology,2017,181(1):464-482.