小反刍兽疫(Peste des petits ruminants,PPR)由小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起。是一种严重的接触性传染病,PPRV为副黏病毒科麻疹病毒属病毒。与牛瘟病毒(Rinderpest virus,RPV)具有相似的物理化学及免疫学特征[1]。主要感染山羊、绵羊等小反刍兽,野生动物可感染 [2],尚无人感染的报道。PPR发病率可高达100%、死亡率达90%,多高发于雨季以及干燥寒冷的季节[3-4],直接接触为主要的传播方式。PPRV基因全长15 948 bp,为不分节段的单股负链RNA病毒,6种基因编码8种蛋白[5-6]。6种基因分别为N-P(C/V)-M-F-H-L,H蛋白为病毒囊膜蛋白,与病毒进入宿主细胞相关[7-8]。传统病毒检测分离方法繁琐,琼脂扩散实验、ELISA实验,灵敏度低,且无法区分RPV和PPPV[9]。本研究运用SYBR Green Ⅰ实时荧光定量PCR 技术旨在建立一种快速、特异、准确、灵敏的检测PPRV方法[10-11],为PPRV的诊断和检测提供技术支持。
1 材料和方法
1.1 试验材料
1.1.1 细胞及病毒 甘肃省动物细胞工程技术研究中心提供试验用细胞非洲绿猴肾细胞(Vero细胞)。PPRV病毒为从PPR Nigeria75/1弱毒苗分离,弱毒疫苗购自新疆天康畜牧生物技术股份有限公司产品。
1.1.2 试剂、仪器 新生牛血清(兰州民海生物工程有限公司);pUM19-T质粒、Ex Taq DNA聚合酶、反转录试剂盒购自TaKaRa-宝生物工程(大连)有限公司;琼脂糖胶回收试剂盒购自兰州美伯生物技术有限公司;2×SYBR Green qPCR Mix和总 RNA 提取试剂盒购自北京博凌科为生物科技有限公司;Bio-Rad实时荧光定量PCR仪购自美国伯乐有限公司。
1.2 试验方法
1.2.1 PCR及qPCR引物设计与合成 参照GenBank登录的PPRV Nigeria75/1 H基因序列,应用Primer Premier 5.0软件设计引物,设计一对引物F1和F2扩增H基因1 830 bp全长片段构建制作标准曲线质粒,设计一对特异引物F3和F4扩增H基因约100 bp片段用于qPCR检测方法建立,引物由生工(上海)生物工程有限合成(表1)。
1.2.2 标准质粒pMD18-T-H构建 接种PPRV Nigeria75/1株于Vero细胞培养扩增PPRV病毒,参照博凌科为说明书提取病毒总RNA,反转录为cDNA,并以此为模板扩增H基因片段,PCR反应体系为50 μL:10 ×Ex Taq Buffer 5 μL,Ex Taq DNA 聚合酶0.25 μL,dNTP Mixture 2 μL,F1、F2各 1 μL,反转录产物 cDNA 500 ng,补加 ddH 2O 至 50 μL。反应条件为95 ℃、 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,循环35次;72 ℃延伸10 min。PCR 扩增产物经鉴定、回收后与 pMD18-T连接,转化E.coli JM109感受态细胞,培养细菌,提取质粒,经酶切鉴定和测序鉴定(苏州金唯智生物技术有限公司)。测定阳性质粒pMD18-T-H在紫外光谱波长为260,280 nm处的吸光度值,并根据公式((6.02×1023×(ng/μL×10-9))/(DNA 长度×660)=copies/μL)计算每微升液体中质粒的拷贝数。该标准质粒命名为H-stand,置-80 ℃保存备用。
表1 PCR和qPCR引物的核苷酸序列
Tab.1 Nucleotide sequences of the primers for PCR and qPCR
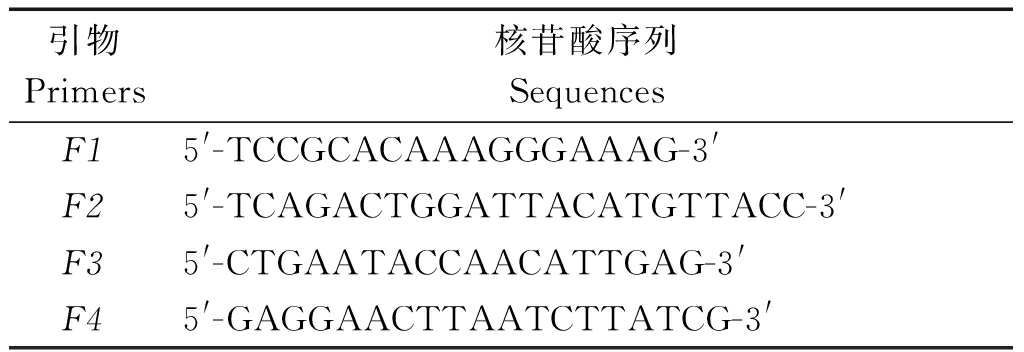
引物Primers核苷酸序列Sequences F15'-TCCGCACAAAGGGAAAG-3'F25'-TCAGACTGGATTACATGTTACC-3'F35'-CTGAATACCAACATTGAG-3'F45'-GAGGAACTTAATCTTATCG-3'
1.2.3 qPCR反应条件优化 参照博凌科为公司2×SYBR Green qPCR Mix说明书,qPCR反应体系为 25 μL,质粒DNA模板1 μL,F3和F4引物浓度分别为0.2,0.3,0.4,0.5,0.6 μmol/L。反应条件:94 ℃变性2 min;94 ℃变性5 s,退火温度分别为57.0,56.2,55.0,58.1,59.1,60.0 ℃,30 s,40个循环。以获得最小Ct值和最大荧光信号时的引物浓度和退火温度为最佳引物浓度和最佳退火温度。
1.2.4 标准曲线的建立 根据紫外分光光度计测算出的H-stand质粒浓度,用DEPC水10倍倍比稀释成7个浓度梯度(3.28×104~3.28×10-2 copies/μL)。以这7个浓度梯度的质粒作为模板,建立25 μL qPCR反应体系,再按照优化的反应条件所得到的最佳引物浓度和最佳退火温度,在Bio-Rad实时荧光定量PCR仪中进行扩增。系统自动建立标准曲线。
1.2.5 灵敏性试验 将标准品倍比稀释成8个浓度梯度(3.28×104~3.28×10-3 copies/μL),以此作模板分别进行普通PCR反应SYBR Green Ⅰ荧光定量PCR反应,以此确定2种反应检测下限并比较二者灵敏性。
1.2.6 重复性试验 以稀释后的H-stand(3.28×104~3.28×10-2 copies/μL)作为样本,进行SYBR Green Ⅰ荧光定量PCR反应,3次重复,确定本试验建立的PCR方法的稳定性。
1.2.7 特异性试验 分别提取PPR疫苗毒、羊口疮疫苗毒、羊痘病毒RNA,反转录为cDNA。以此为模板检测所建立方法的特异性,每组设2个重复。
2 结果与分析
2.1 质粒标准品的制备
由接种PPR Nigeria75/1弱毒疫苗接种Vero细胞分离得到PPRV病毒,以提取的PPRV总RNA反转录的cDNA为模板,用F1和F2经PCR扩增出约1 830 bp全长PPRV Nigeria75/1 H基因(图1)。扩增产物连接到载体pMD18-T获得重组质粒pMD18-T-H,经 BamH Ⅰ、Hind Ⅲ 双酶切,1%琼脂糖凝胶电泳得到约1 830 bp 左右的目的条带(图2),序列验证与GenBank的PPRV序列同源性为100%,表明标准阳性质粒H-stand构建成功,质粒浓度为3.28×104 copies/μL。
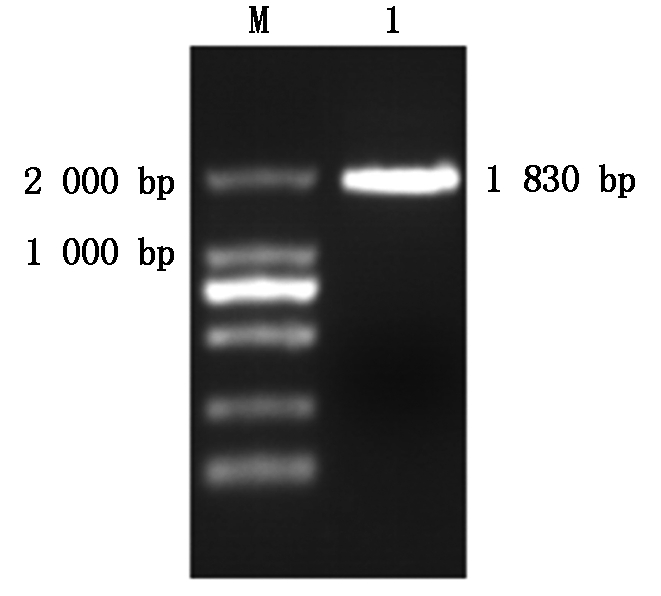
M.DNA标准DL2000;1.H基因PCR扩增产物。
M.DNA Marker DL2000;1.H gene PCR product.
图1 PPRV H基因PCR电泳
Fig.1 The electrophoresis of H gene from PPRV
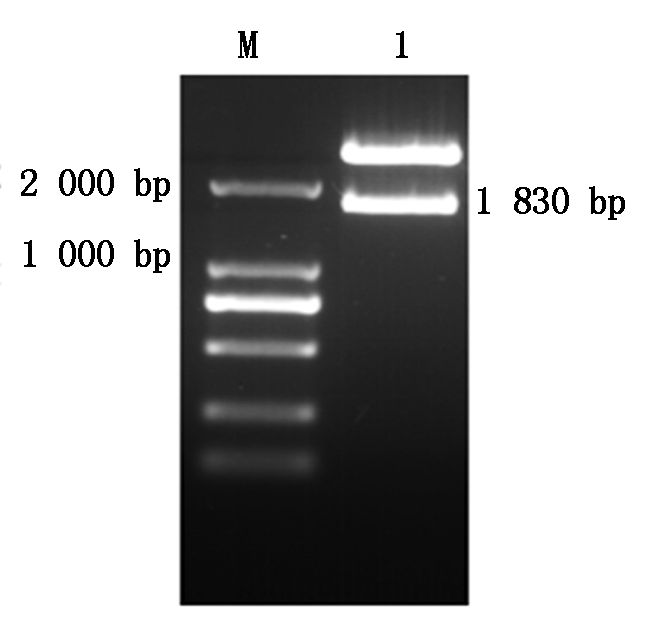
M.DNA标准DL2000;1.质粒的BamHⅠ+Hind Ⅲ 双酶切产物。
M.DNA Marker DL2000;1.Products of H-Stand digested with BamHⅠ+Hind Ⅲ.
图2 重组质粒pMD18-T-H 双酶切(BamHⅠ/Hind Ⅲ)鉴定电泳
Fig.2 Restriction map of recombinant plasmid pMD18-T-H(BamH Ⅰ/Hind Ⅲ)
2.2 反应条件优化
经反应条件优化,当F3和F4引物浓度均为0.2 μmol/L 时Ct值最小(图3),最优反应体系为2×SYBR qPCR Mix 12.5 μL,DNA模板1 μL,F3、F4(10 μmol/L)各0.2 μL,DEPC H2O 10.5 μL。当退火温度为57 ℃时,qPCR反应的荧光信号最强(图4),最佳反应条件为94 ℃ 2 min;94 ℃ 5 s,57 ℃ 30 s,40个循环。
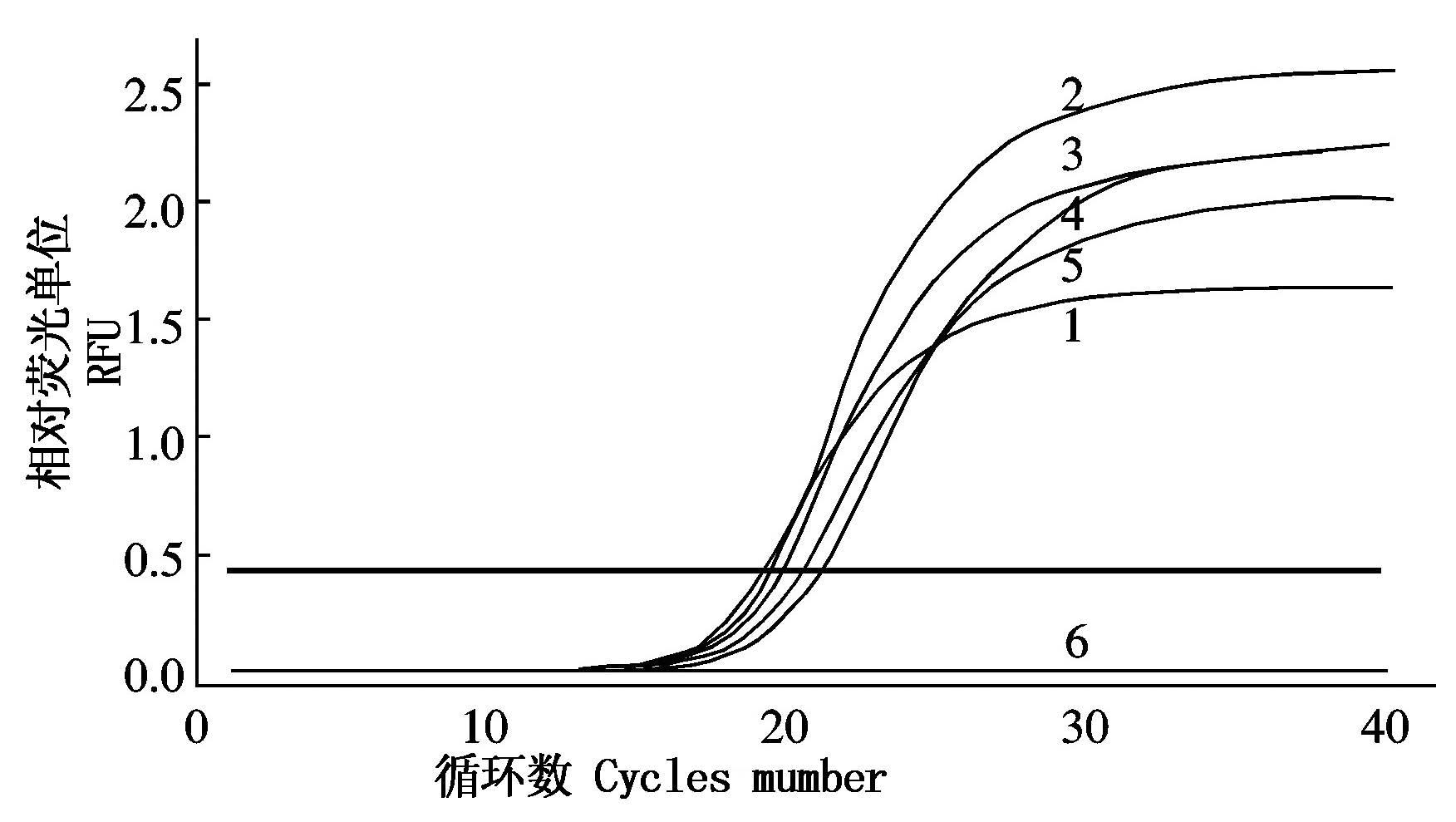
1.0.2 μmol/L;2.0.3 μmol/L;3.0.4 μmol/L;4.0.5 μmol/L;5.0.6 μmol/L。
图3 优化引物浓度
Fig.3 Optimization of the primer concentration
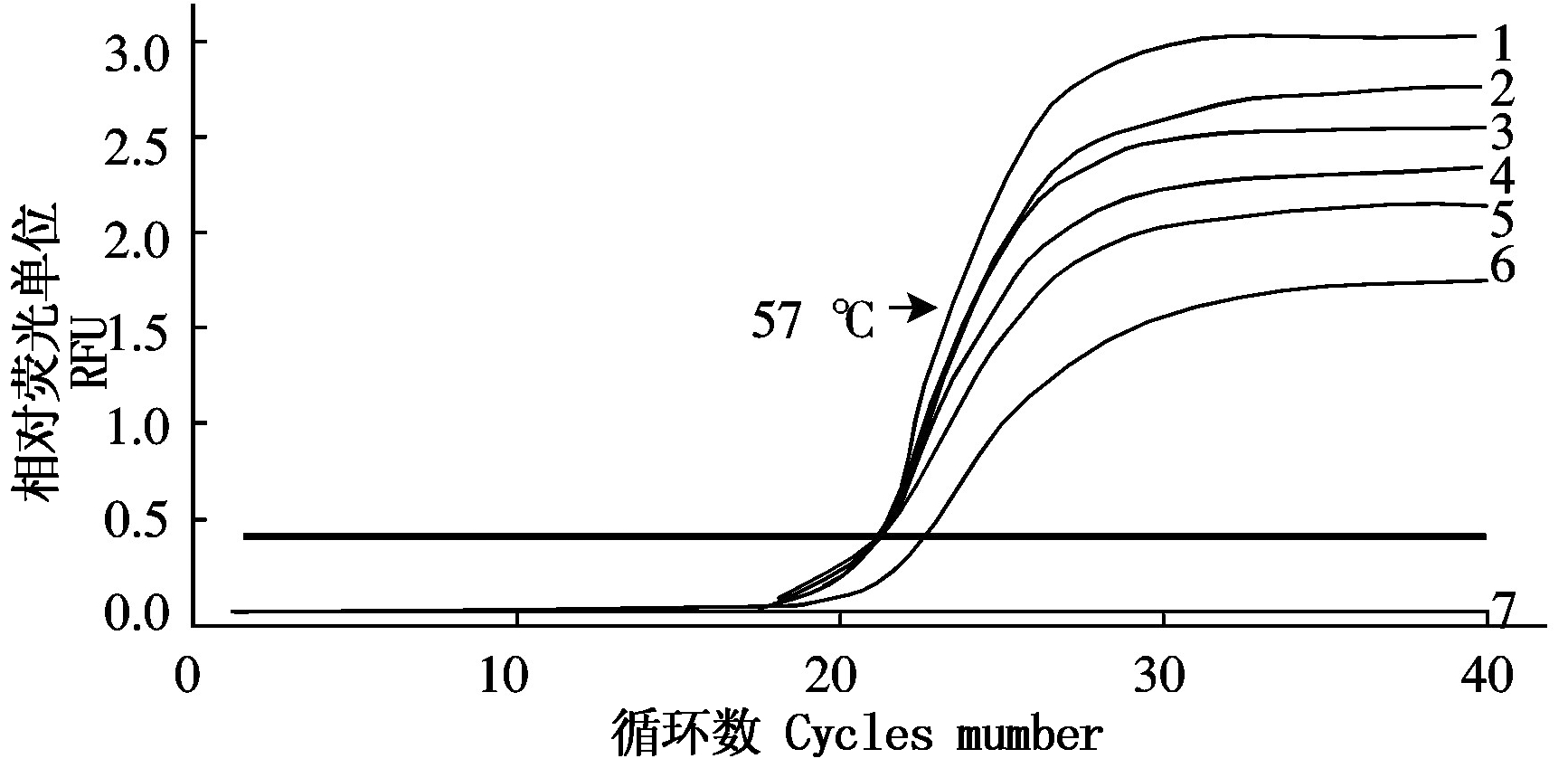
1.57.0 ℃;2.56.2 ℃;3.55 ℃;4.58.1 ℃;5.59.1 ℃;6.60.0 ℃;7.阴性对照。
1.57.0 ℃;2.56.2 ℃;3.55 ℃;4.58.1 ℃;5.59.1 ℃;6.60.0 ℃;7. Negative control.
图4 优化退火温度
Fig.4 Optimization of the reaction temperature
2.3 标准曲线的建立
H-stand质粒标准品10倍倍比稀释后作模板,按2.2体系和参数进行试验,得到图5-7所示动力曲线、标准曲线和熔解曲线。如下图所示,标准质粒模板浓度与Ct值呈现良好线性关系,y=-2.913x+36.904,扩增效率为120.5%,相关系数R2达0.994。
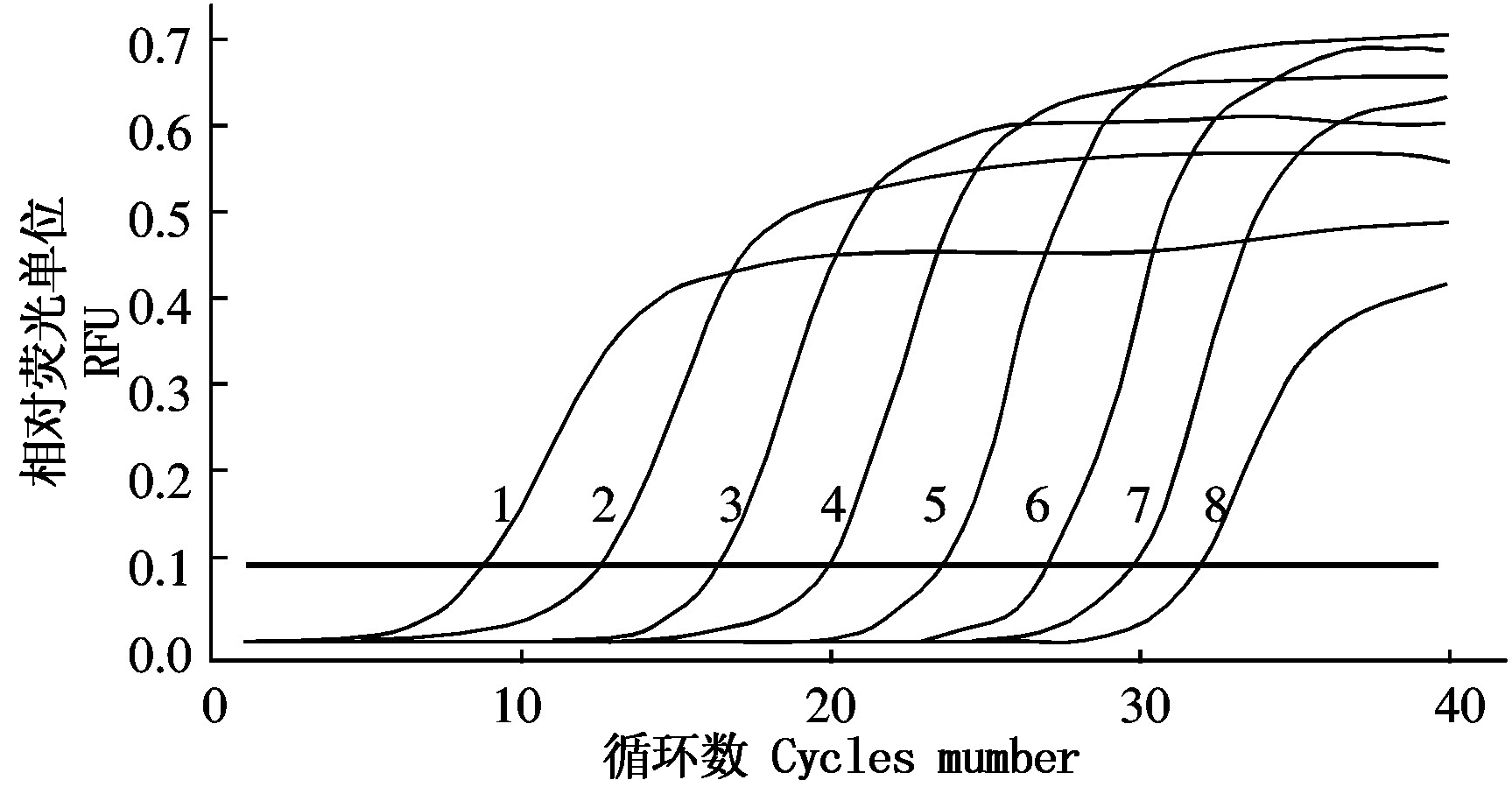
1~8.3.28×104,3.28×103,3.28×102,3.28×101,3.28×100,3.28×10-1,3.28×10-2 copies/μL,阴性对照。
1-8.3.28×104,3.28×103,3.28×102,3.28×101,3.28×100,3.28×10-1,3.28×10-2copies/μL,Negative control.
图5 H-stand SYBR Green Ⅰ实时荧光定量PCR动力学曲线
Fig.5 The H-stand SYBR Green ⅠqPCR dynamic curve
2.4 灵敏性试验
以 3.28×104~3.28×10-3 copies/μL共 8个浓度梯度H-stand质粒为模板进行 Real-time PCR,及普通 PCR。Real-time PCR 检测下限3.28×103 copies/μL (图8-A),而普通 PCR 的检测下限为 3.28×107 copies/μL(图8-B),建立的Real-time PCR 比普通 PCR 灵敏 10 000倍。
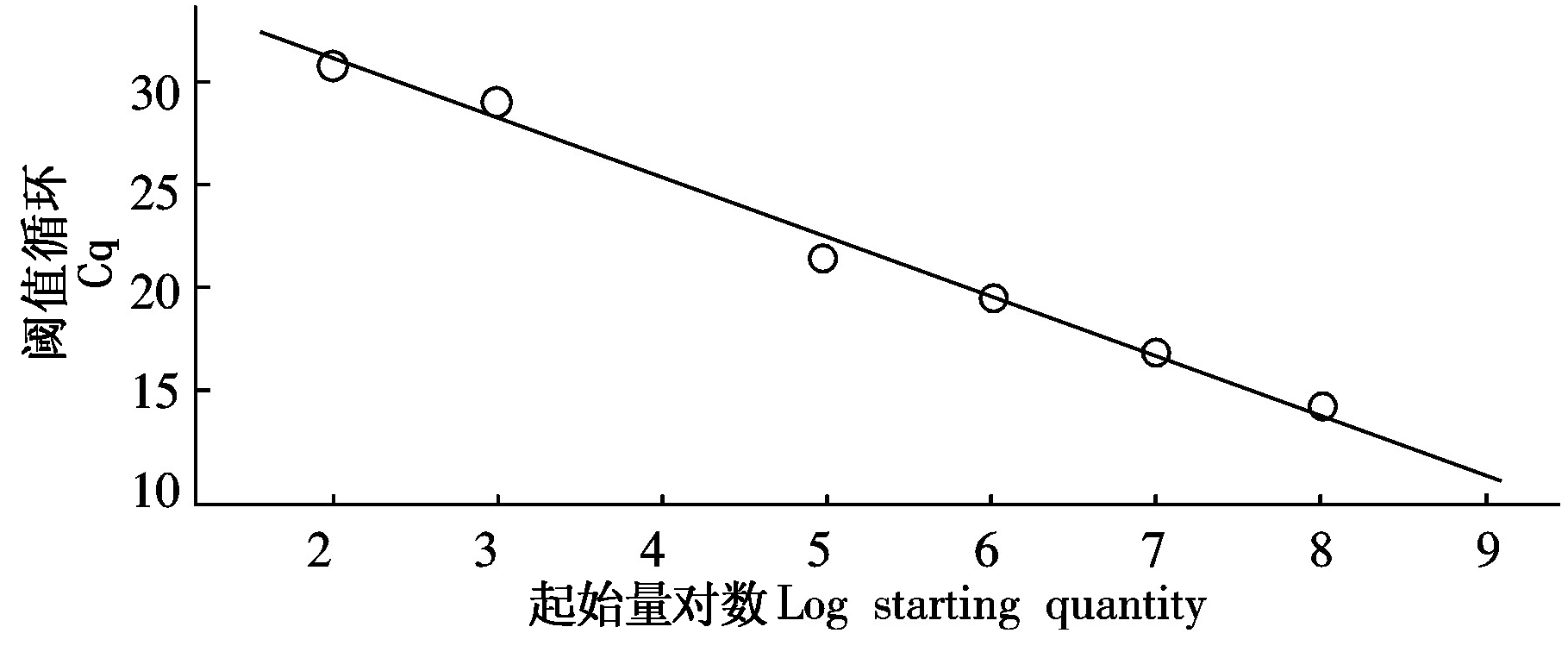
图6 H-Stand SYBR Green Ⅰ实时荧光定量PCR标准曲线
Fig.6 The H-stand SYBR Green Ⅰ qPCR standard curve
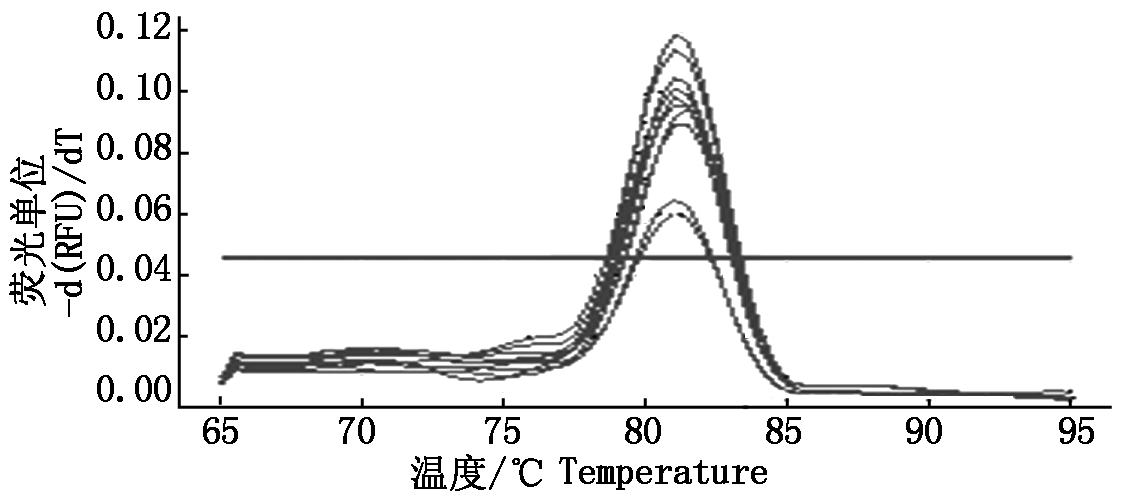
图7 H-stand SYBR Green Ⅰ实时荧光定量PCR熔解曲线
Fig.7 The H-stand SYBR Green Ⅰ qPCR melting curve
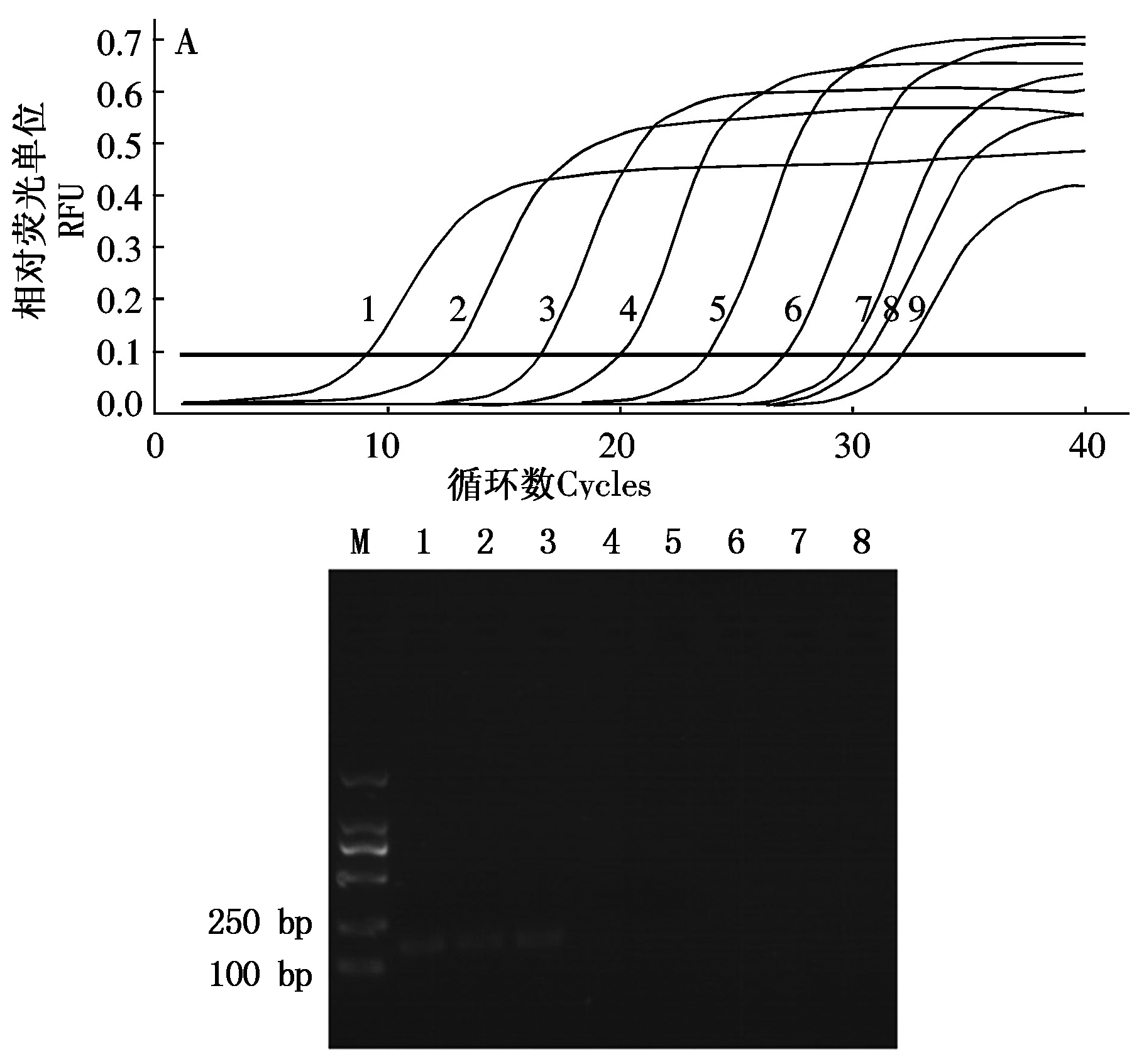
A. 1-9 .3.28×104,3.28×103,3.28×102,3.28×101,3.28×100,3.28×10-1,3.28×10-2,3.28×10-3 copies/μL,阴性对照。B.M.DNA 标准 DL2000;1-7.3.28×109~3.28×102copies/μL; 8.阴性对照。
A.1-9 . 3.28×104,3.28×103,3.28×102,3.28×101,3.28×100,3.28×10-1,3.28×10-2,3.28×10-3 copies/μL,Negative control.B. M.DNA Marker DL2000;1-7.3.28×109-3.28×102copies/μL; 8.Negative control.
图 8 H-stand Real-time PCR 灵敏性试验
Fig.8 Evaluation of the sensitivity of the established Real-time PCR assay
2.5 重复性试验
取3.28×104~3.28×10-2 copies/μL标准品为样品,进行SYBR Green Ⅰ荧光定量PCR反应,每组设3次重复,结果显示(图9),样本组间误差均小于0.5个循环,表明本试验建立方法重复性较高,保证试验结果稳定、可靠。
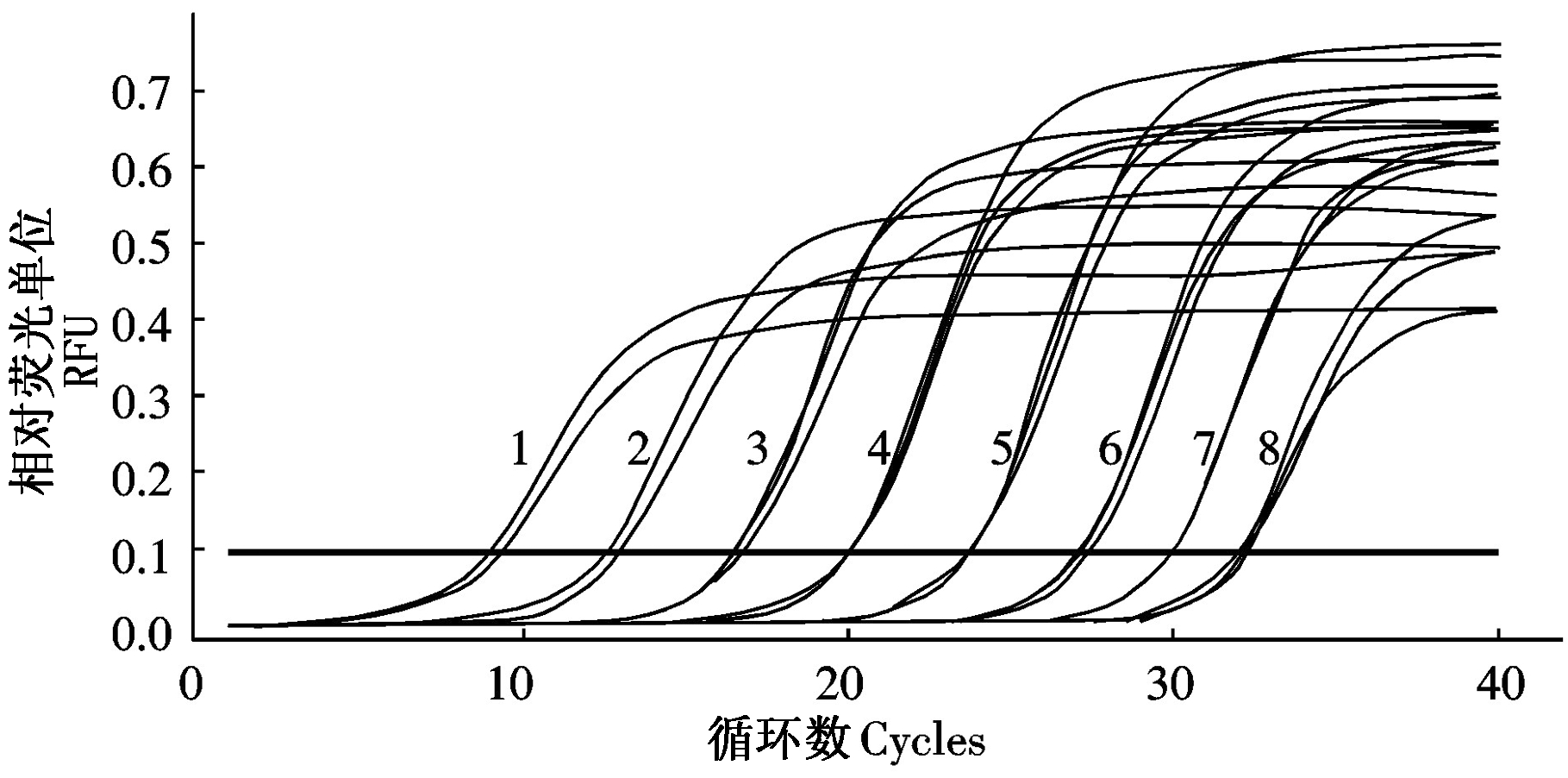
1~8.3.28×104,3.28×103,3.28×102,3.28×101,3.28×100,3.28×10-1,3.28×10-2 copies/μL, 阴性对照。
1-8.3.28×104,3.28×103,3.28×102,3.28×101,3.28×100,3.28×10-1,3.28×10-2copies/μL,Negative control.
图9 H-stand SYBR Green I实时荧光定量PCR检测方法的重复性
Fig.9 Repeatability of the established Real-time PCR assay
2.6 特异性试验
用本试验建立检测方法检测PPR疫苗病毒、羊口疮病毒、羊痘病毒。该方法只能检测出PPR疫苗株病毒,羊口疮病毒、羊痘病毒及阴性对照的检测结果均为阴性,表明本试验建立的方法特异性好,可以用于通用型PPRV的检测(图10)。
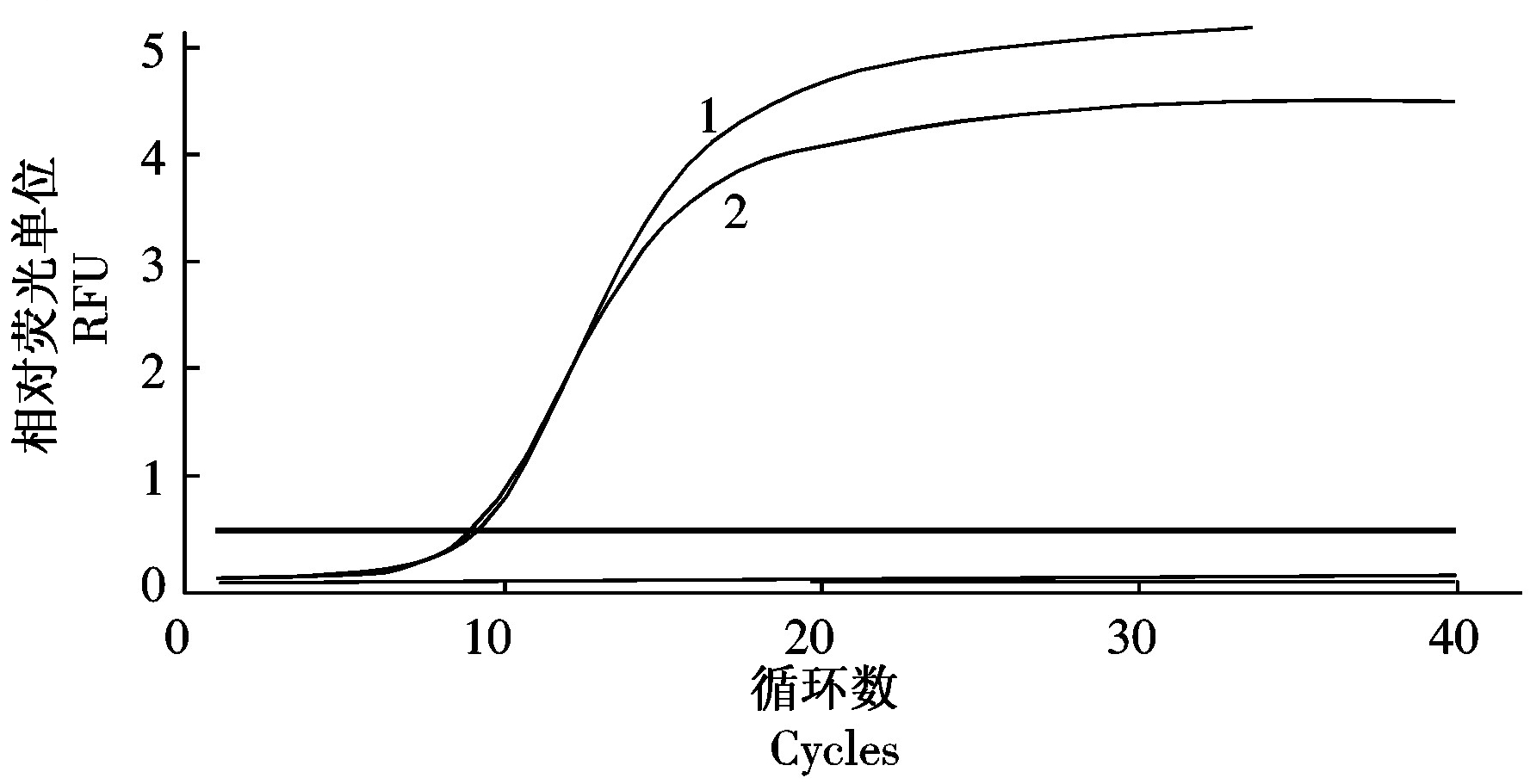
1,2.PPR疫苗毒。
1,2.Vaccine of PPR.
图10 H-stand SYBR Green Ⅰ实时荧光定量PCR检测方法特异性试验
Fig.10 Specificity of the established Real-time PCR assay
3 讨论
PPR对我国畜牧业造成了巨大的经济损失。探索一种快速有效的检测方法对PPRV的诊断和检测十分重要。实时荧光定量PCR(Real-time quantitative PCR)在传统PCR的基础上加入荧光基团,在反应过程中荧光信号增强,从而达到检测的目的。时实荧光定量PCR检测方法较其他方法灵敏性高,特异性强。通过已构建标准曲线定量分析未知样品,可得到更加直观、准确、有效的结果,且能减少检测结果的假阳性[12]。目前,国内外检测PPR的方法多种多样。已建立的方法有血清学检测、病毒分离、RT-PCR及荧光RT-PCR、酶联免疫吸附试验、琼脂免疫扩散试验等[11]。相对于时实荧光定量PCR检测方法,血清学检测耗时较长,不能满足在疫病发生时快速高效检测的要求。相较于传统RT-PCR及PCR,SYBR Green Ⅰ是与双链 DNA双螺旋小沟区域结合,激发绿色荧光的染料[13]。可与双链 DNA 特异性结合,较溴化乙锭(EB)灵敏度高[14]。由于试验过程需要定量,经数据处理后更为直观其可判断未知样品核酸含量。与TaqMan 荧光定量PCR方法相比SYBR Green Ⅰ实时荧光定量PCR检测方法减少了对探针的设计、优化[15]。与酶联免疫吸附试验、琼脂免疫扩散试验相比,其通用性好,灵敏度高[16-17],操作简便,且价格相对低廉。国内外学者对PPRV PCR检测方法进行了大量试验,Forsyth等首次建立了PPRV和RPV的RT-PCR 鉴别诊断方法;Couacy等[18]建立了检测PPRV的RT-PCR方法;Balamurugan等[19]建立了检测PPRV的一步RT-PCR方法;姚李四等[20]也建立了一步RT-PCR方法检测PPRV。
本研究成功建立了PPRV H基因的SYBR Green Ⅰ实时荧光定量PCR检测方法。经条件优化,最适退火温度为57 ℃,最佳引物浓度为0.2 μmol/L,所建立方法特异性高,试验中只有PPR疫苗毒可扩增出特异性曲线,其他病毒均为阴性。与普通PCR相比,建立的实时荧光定量PCR检测方法可以检测下限为拷贝数为3.28×10-3copies/μL的样品,而普通PCR只能检测出拷贝数为3.28×101copies/μL的样品,表明试验所建立的检测方法 比普通 PCR 灵敏 10 000倍。重复性试验中组内重复误差小于0.5个Ct值,说明试验所建立的 Real-time PCR 检测方法重复性、稳定性高。试验所建立的标准曲线呈现出较好线性关系,y=-2.913x+36.904,扩增效率为120.5%,相关系数R2达到0.994,溶解曲线呈现单一峰,无非特异性扩增。综上所述,本研究建立实时荧光定量PCR检测方法可以有效检测PPRV,可用于PPRV的实验室检测。
[1] 何世成,邹玖零,王卫国,等.小反刍兽疫病毒野毒与疫苗毒双重荧光RT-PCR鉴别检测方法的建立[J].中国动物传染病学报,2016,24(4):31-35.
[2] 赵文华, 杨仕标,朱建波, 等. 小反刍兽疫灭活抗原 RT-PCR检测方法的建立及其相关序列分析[J].动物医学进展, 2008, 29(11):16-19.
[3] 曲林茂.表达小反刍兽疫病毒H、F蛋白的重组山羊痘病毒的构建及免疫原性研究[D].南京:南京农业大学,2009.
[4] Dhar P,Sreenivasa B P,Barrett T,et al.Recent epidemiology of Peste des petits ruminants virus (PPRV) [J].Veterinary Microbiology,2002,88(2):153-159.
[5] 井 波,赵玉军,袁 远.小反刍兽疫病毒研究进展[J].畜牧与兽医,2004,36(6):40-43.
[6] 刘玉洪,徐自忠,花群义,等.小反刍兽疫病毒分子生物学研究进展[J].动物医学进展,2006,27(12):1-6.
[7] 闫飞虎,王化磊,邱泊宁,等.小反刍兽疫病毒H蛋白的原核表达及其多克隆抗体的制备[J].中国生物制品学杂志,2016,29(6):576-581.
[8] 王昌建,邹玖零,何世成,等.小反刍兽疫病毒荧光RT-PCR检测方法的建立与应用[J].中国动物检疫,2016,33(6):72-76.
[9] 沈付娆,杨建乐,赵贵民.牛冠状病毒 SYBR GreenⅠ实时荧光定量[J].中国兽医杂志,2016,6(52):22-27.
[10] Mody K T,Popat A,Mahony D,et al.Mesoporous silica nanoparticles as antigen carriers and adjuvants for vaccine delivery[J].Nanoscale,2013,5(12):5167-5179.
[11] 蒲敬伟,袁立岗,缪文革,等.野牦牛布病感染情况调查[J].中国兽医杂志,2007,43(8):53-54.
[12] 许黎黎,鲍琳琳,谷松至,等.埃博拉病毒莱斯顿亚型实时荧光定量PCR检测方法的建立[J].病毒学报,2015,31(3):276-281.
[13] 吴忆春.猪繁殖与呼吸综合征病毒SYBR GreenⅠ实时荧光定量PCR检测方法的建立[J].动物医学进展,2013,34(2):20-24.
[14] 彭秋莹,陈爱欢.白三烯C_4合成酶mRNA荧光定量PCR方法建立及结果的分析[J].黑龙江医学,2014,8(8):892-894.
[15] Cikos S,Bukovská A,Koppel J.Relative quantification of mRNA:comparison of methods currently used for real-time PCR data analysis[J].BMC Molecular Biology,2007,8:113.
[16] 包晓婧,张海霞,李琼毅,等.CD63基因TaqMan实时荧光定量PCR检测方法的建立及评价[J].中国兽医科学,2016,46(9):1141-1146.
[17] 张海霞,马玉梅,包晓婧,等.膜连蛋白A2基因实时荧光定量PCR检测方法的建立及应用[J].动物医学进展,2015,36(10):15-19.
[18] Couacy H E,Roger F,Hurard C,et al. Rapid and sensitive detection of Peste des petits ruminants virus by a polymerase chain reaction assay[J].Virol Methods,2002,100(1/2)17-25.
[19] Balamurugan V,Sen A,Saravanan P,et al. One-step multiplex RT-9PCR assay for the detection of Peste des petits ruminants virusin clinical samples [J].Vet Res Commun,2006,30(6):655-666.
[20] 姚李四,陈 颖,徐宝梁,等. RT-PCR检测小反刍兽疫病毒核酸方法的建立[J].中国动物检疫,2006,23(5):19-20.