蓝狐是一种珍贵的毛皮动物,狐皮是制作高档裘皮服装和饰品的重要原料,是世界三大裘皮产业之一。我国养殖的蓝狐主要有地产狐、芬兰狐及杂交狐,体质量分别为3~7 kg,8~16 kg,8~12 kg,芬兰狐的体型、体质量及毛皮质量明显高于地产狐,由于体质量大小与皮张尺码呈正相关,因此,培育体质量大和毛绒质量好的蓝狐品种一直是蓝狐育种追求的目标。而动物的生长由生长轴调控,生长激素(Growth hormone,GH)基因是生长轴的关键基因,所以对其GH基因进行研究,在遗传上探索影响蓝狐生长的因素,对培育大型蓝狐品种起着非常重要的作用。
GH是由脑垂体前叶嗜酸性细胞分泌的一种单一肽链的蛋白质激素,其成熟肽由190~191个氨基酸残基组成[1-4]。GH基因有5或6个外显子,4或5个内含子[5-8]。GH对动物具有显著加快肌肉、骨骼生长,降低脂肪含量,促进生长发育,降低饲料报酬的作用[9-13]。近年来,研究者对不同家畜及家禽GH基因多态性与相关性状的关联性分析也进行了大量报道。胡怡菲等[14]研究了秦川牛生长激素基因第2外显子的多态性,在第5外显子中发现了2处SNPs,且不同基因型间牛体尺性状差异显著。闵令江等[15]对鲁北白山羊、波尔山羊以及杂交一代的GH基因进行了多态性研究,推断生长激素基因可能是影响山羊体质量性状的主基因或与主基因相连锁,可以用该位点对山羊体质量性状进行标记辅助选择。陶志云等[16]在高邮鸭GH基因的第2外显子上发现1个A→G单核苷酸突变位点,在高邮鸭早期生长发育过程中,GG基因型个体的体质量显著高于AA基因型个体和AG基因型个体。而在狐狸研究中,目前对于GH基因方面的报道很少,胡晓航[17]构建了银狐GH成熟mRNA真核表达载体,刘玉堂等[18]对银狐的GH基因的cDNA进行了克隆以及原核表达。杜智恒等[19]以北极狐为试验群体,在GH基因上发现了4个SNPs位点,且表明这些位点对北极狐皮张长度性状具有一定的影响。但并未见芬兰蓝狐和地产狐不同资源群体间GH基因的SNP研究报道。
本研究拟对体质量差异显著的芬兰狐和地产狐为研究对象,利用构建DNA池以及PCR产物测序的方法搜索GH基因在2个资源群体的SNPs,并分析SNPs与蓝狐生长性状的相关性,从而为培育大型蓝狐品种提供理论基础。
1 材料和方法
1.1 试验材料
48只芬兰狐(公母各半)血样采自石家庄市藁城区华泽畜牧业发展有限公司;50只地产狐(公母各半)采自中国农业科学院特产研究所左家试验基地;打皮期采血,于-20 ℃冰箱保存,备用。
DNA提取试剂盒购自宝泰克(北京)有限公司;PrimeSTAR HS DNA Polymerase购自宝生物。
1.2 试验方法
1.2.1 基因组DNA提取 采用DNA提取试剂盒提取基因组DNA,从同一资源群体狐DNA样品中各取5 μL混合,构建群体DNA池,使用分光光度计NanoDrop2000测定DNA浓度后调整至50 ng/μL。
1.2.2 引物设计和PCR反应 蓝狐GH基因全序列(起始密码子到终止密码子之间序列)由河北科技师范学院李祥龙老师提供,作为参考序列。用Primer Premier 5.0设计引物,扩增GH基因全长,引物由库美生物技术有限公司合成,引物序列见表 1。
表1 引物序列、退火温度及目的片段长度
Tab.1 The primers sequence,annealing temperature and length of target fragment

引物Primer目的片段长度/bpLength of target fragment退火温度/℃Annealing temperature引物序列Primers sequenceP1FP1714R1 714665'-ATGGCTGCAAGTAAGTCCCCCT-3'5'-CTAGAAGGCACAGCTGCTTTCCACG-3'
利用构建的DNA池进行PCR反应。反应体系(25 μL):基因组DNA 1 μL,10 μmol/μL 上、下游引物各0.5 μL,PrimeSTAR® HS DNA Polymerase 0.25 μL,三蒸水15.75 μL。PCR 扩增体系:94 ℃预变性5 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃延伸5 min。PCR 产物用1%琼脂糖凝胶电泳。
1.3 序列分析
将特异性好、产量高的PCR产物委托吉林库美生物技术有限公司进行纯化测序,利用DNAStar软件中的Seqman程序对测序结果进行校正和Blast分析确定SNPs。用DNAMAN软件对试验测出的序列及参考序列进行同源性分析,经比对,扩增片段与参考序列的相似性为100%,确定目的片段为GH基因片段。
2 结果与分析
2.1 基因组提取
蓝狐全血样本采用试剂盒提取,得到浓度和纯度均较高的基因组DNA。从凝胶电泳检测结果(图 1)可以看出,本研究提取的蓝狐基因组DNA为一条较致密、整齐的条带,无拖尾,亮度较好,说明DNA的完整性较好、纯度也较高,不需要纯化,可直接用于下一步的PCR扩增。
1-3.基因组;4.阴性对照。
1-3.Genome;4.Negative control.
图1 DNA原液1%琼脂糖凝胶电泳结果
Fig.1 Detection of the DNA stock solution by 1% agarose gel electrophoresis
2.2 PCR 扩增结果
根据蓝狐GH基因设计上游引物P1F和下游引物P1714R,扩增DNA池基因组中GH基因,PCR产物经1%琼脂糖凝胶电泳检测,在1 000 bp和2 000 bp之间出现1条清晰的DNA条带,与预期片段大小一致,目的片段大小为1 714 bp(图2)。
1-6.PCR 产物;M.DL2000 分子质量标准。
1-6.PCR product; M.DL2000 Marker.
图2 引物P1F和P1714R PCR扩增结果
Fig.2 PCR amplified results of primer P1F and P1714 R
2.3 测序结果
设计1对引物扩增出GH基因全长序列,并对扩增产物进行双向测序测通,Blast分析共发现2个SNPs。以GH基因编码区起始密码子ATG第一位为+1位,SNPs位点A306G处于基因全长中的第306 bp位置,将与参考序列一致的纯合子命名为AA型,另外一种纯合子定义为BB型(图3)。SNPs位点T1144C处于第1 144 bp位置,将与参考序列中一致的纯合子命名为CC型,另外一种纯合子定义为DD型(图4)。A306G位于第2外显子编码区内,通过序列分析表明,该点突变并没有导致氨基酸上的变化,为同义突变,T1144C突变位点位于内含子区。
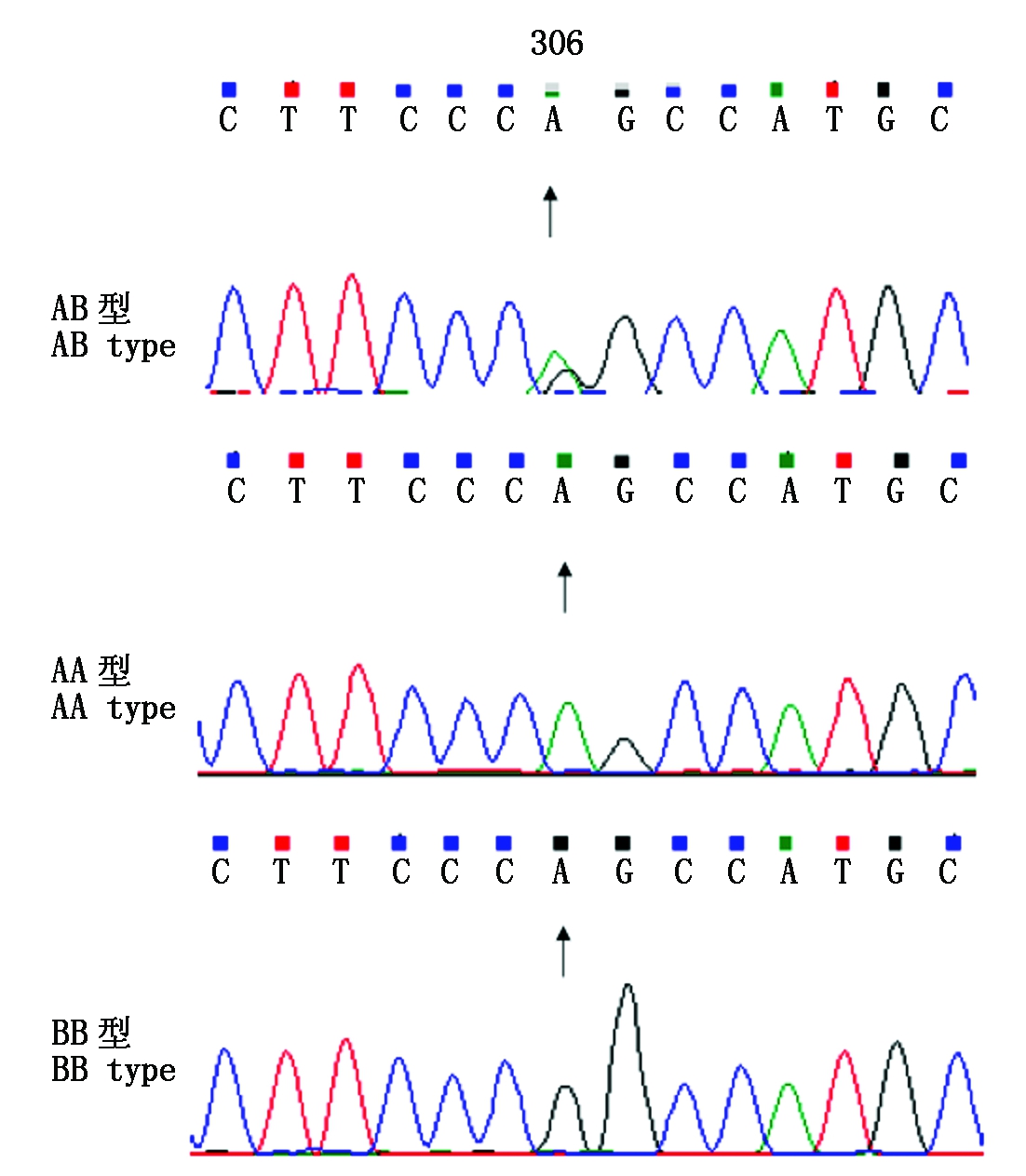
图3 AB、AA和BB基因型的测序结果
Fig.3 Sequence results of AB,AA and BB genotypes
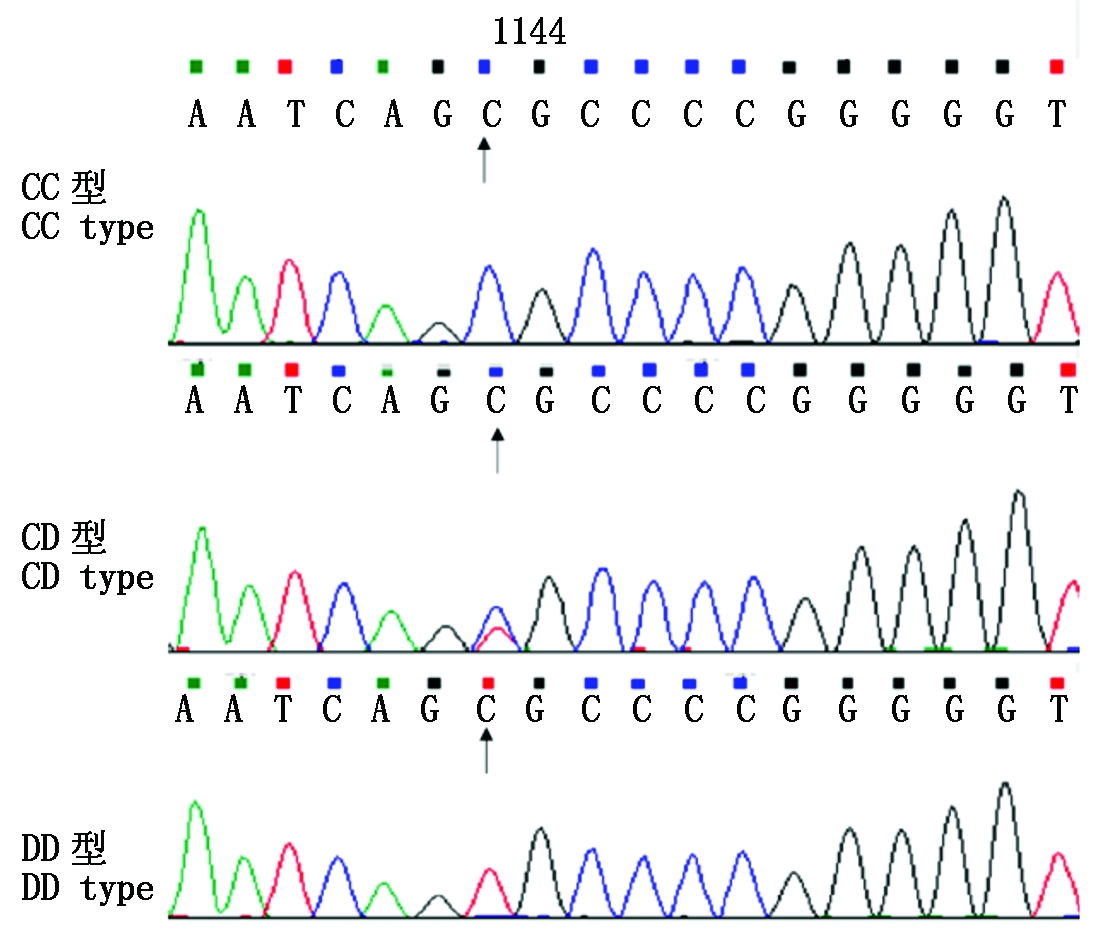
图4 CC、DD和CD基因型的测序结果
Fig.4 Sequence results of CC,DD and CD genotypes
2.4 遗传参数统计
2.4.1 基因频率和基因型频率及卡方检验 对芬兰狐和地产狐共98只蓝狐进行PCR检测,2个资源群体蓝狐均为AA(CC)型频率明显高于AB(CD)和BB(DD)型频率,等位基因A(C)较等位基因B(D)占优势(表2,3)。卡方检验结果表明,地产狐和芬兰狐的基因型频率差异极显著![]() 个SNPs位点的遗传多样性参数、基因型频率和基因频率在同一群体中高度一致,说明这2个SNPs位点之间完全连锁,并将其组成的3种单倍型分别命名为AACC、ABCD和BBDD。
个SNPs位点的遗传多样性参数、基因型频率和基因频率在同一群体中高度一致,说明这2个SNPs位点之间完全连锁,并将其组成的3种单倍型分别命名为AACC、ABCD和BBDD。
表2 GH基因A306G的基因型频率和等位基因频率
Tab.2 Genotype distribution and allelic frequencies of the A306G at the GH gene
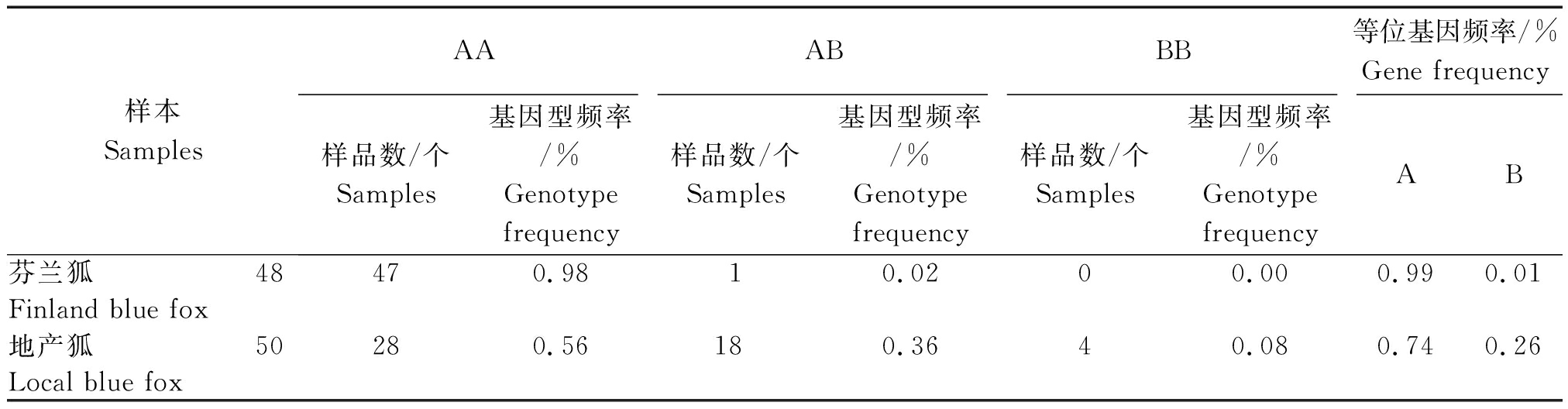
样本SamplesAAABBB等位基因频率/%Gene frequency样品数/个Samples基因型频率/%Genotypefrequency样品数/个Samples基因型频率/%Genotypefrequency样品数/个Samples基因型频率/%GenotypefrequencyAB芬兰狐48470.9810.0200.000.990.01Finland blue fox地产狐50280.56180.3640.080.740.26Local blue fox
表3 GH基因T1144C位点的基因型频率和等位基因频率
Tab.3 Genotype distribution and allelic frequencies of the T1144C at the GH gene
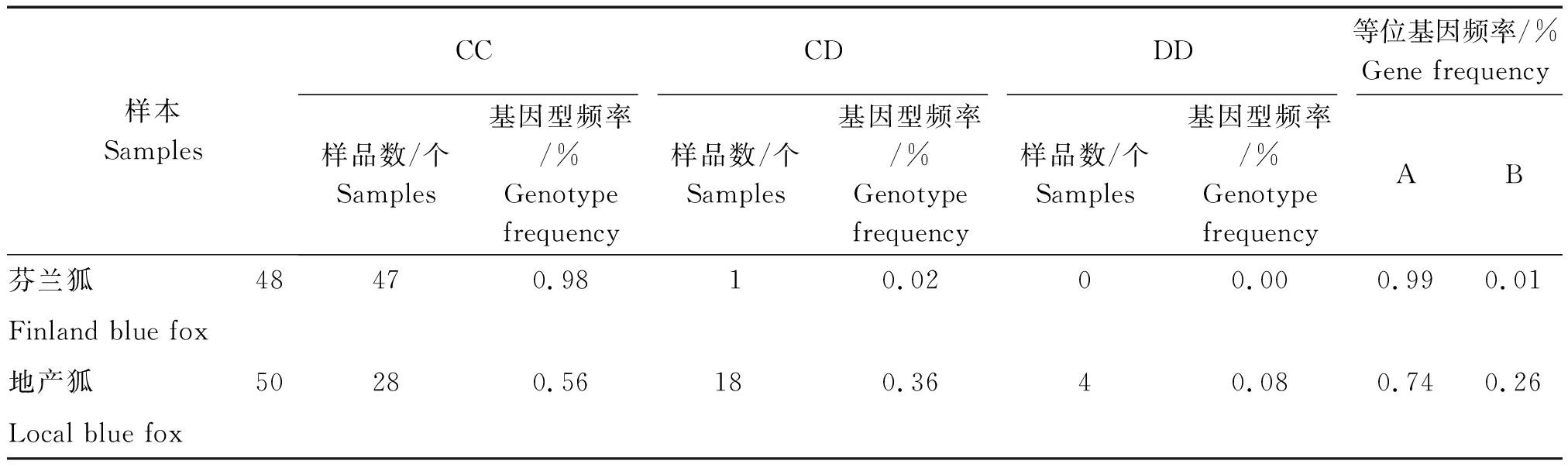
样本SamplesCCCDDD等位基因频率/%Gene frequency样品数/个Samples基因型频率/%Genotypefrequency样品数/个Samples基因型频率/%Genotypefrequency样品数/个Samples基因型频率/%GenotypefrequencyAB芬兰狐48470.9810.0200.000.990.01Finland blue fox地产狐50280.56180.3640.080.740.26Local blue fox
2.4.2 GH基因的遗传参数值 用POPGENE软件计算GH基因不同位点的纯合度、杂合度、多态性信息含量(表4)。试验中芬兰狐基因纯合度为0.979 2,杂合度为0.020 8,地产狐基因纯合度为0.653 8,杂合度为0.346 2,芬兰狐GH基因等位基因的纯合度都比地产狐高。芬兰狐多态信息含量为0.057 9 (0.25 表4 GH基因纯合度、杂合度、多态信息含量和有效等位基因数 群体Group纯合度Ho杂合度Ho有效等位基因数PIC多态信息含量Ne芬兰狐Finland blue fox0.979 20.020 81.021 10.057 9地产狐Local blue fox0.653 80.346 21.625 50.573 1 芬兰狐和地产狐不同基因型之间体质量比较结果见表5。由表5可知,地产狐公狐体质量和体长均为基因型AACC>ABCD>BBDD,母狐则无此趋势。表6对芬兰狐和地产狐全部个体进行分型统计后,运用SPSS 18.0软件分析蓝狐不同基因型与生长性状的相关性。由表6可知,公狐AACC基因型个体体质量显著高于ABCD基因型(P<0.05),而体长则差异不显著(P>0.05);母狐AACC基因型个体体质量极显著高于ABCD基因型个体(P<0.01)且体长显著高于ABCD基因型个体(P<0.05)。 本试验对蓝狐GH基因进行了扩增和测序分析,并且是采用DNA池扩增测序的方法,与常用的单个个体比较测序寻找序列多态的方法相比,单个个体比较测序方法个体数太少不易发现SNPs,且花费成本较高;应用DNA池测序筛查SNPs,切实有效,大大减少了工作量、降低了研究成本 [20-23]。 本试验选用的2个蓝狐资源群体芬兰狐和地产狐体质量、体长具有明显差异,且产区相距较远,具有很好的代表性。本试验利用DNA池对全基因组 表5 GH基因的多态性与体质量体尺性状的相关分析 群体Group基因型Genotypes体质量Body weight体长Body length公狐Male fox母狐Female fox公狐Male fox母狐Female fox芬兰狐AACC11.25±1.6910.74±1.5674.50±3.7773.70±2.76Finland blue foxAACC6.31±0.355.67±0.3272.50±1.4760.36±3.50地产狐ABCD6.26±0.355.78±0.3371.56±2.2161.77±3.53Local blue foxBBDD6.20±0.645.08±0.1869.00±1.4161.50±4.95 表6 不同基因型对体质量、体长性状相关性影响 基因型Genotypes体质量Body weight体长Body length公狐Male fox母狐Female fox公狐Male fox母狐Female foxAACC9.31±2.70a8.87±2.78A73.62±3.17a68.79±7.19aABCD7.01±2.40b5.78±0.33B72.30±3.15a61.78±3.53bBBDD6.20±0.64ab5.08±0.18AB69.00±1.41a61.50±4.95ab 注:同列不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。 Note: In the same column, values with different small letter mean significant difference(P<0.05);And with different capital letter superscripts mean extremely significant difference(P<0.01). 中GH基因进行检测,从中筛选出2个与体长、体质量可能相关的SNPs位点A306G和T1144C,且首次发现这2个位点完全连锁,共形成AACC 型、ABCD型和BBDD型3个单倍型,基因型频率统计结果显示,芬兰狐中只存在2种基因型,48只样本中47个基因型为AACC,1个样本基因型为ABCD;地产狐3种基因型都存在,50个样本中基因型AACC数量为28,基因型ABCD为18,基因型BBDD为4。2个等位基因频率比较显示A等位基因的频率略高,卡方检验表明,芬兰狐和地产狐因型频率差异极显著(P<0.01)。用POPGENE软件计算GH基因不同位点的纯合度、杂合度、多态性信息含量。结果芬兰狐多态信息含量为0.057 9,属于低度多态位点,地产狐多态信息含量为0.573 1,属于高度多态位点。说明目前芬兰蓝狐的纯度较高,对芬兰蓝狐的系统保种和选育的效果较好,这也与实际情况是一致的,但在检测中发现了一只蓝狐在该位点发生了突变,可能是这几年芬兰蓝狐品种退化的原因之一,需要增加样本测定量来确定。相关性分析结果表明,公狐AACC基因型个体体质量显著高于ABCD基因型(P<0.05),与体长无显著差异(P>0.05);母狐AACC基因型个体体质量极显著高于ABCD基因型个体(P<0.01)且体长显著高于ABCD基因型个体(P<0.05)。结果表明,公狐和母狐体质量和体长在3种基因型间差异情况不同,这可能是由于GH基因对不同性别的蓝狐所起作用并不完全相同造成的。 本试验首次采用直接测序法,研究了地产狐及芬兰狐GH基因的SNPs,以期寻找品种内和品种间的特征SNP和组合基因型及与性状的相关性,从而为蓝狐资源生长发育规律、矮小性状遗传机理、资源保护等方面的研究提供遗传学依据。结果首次发现GH基因中存在2个完全连锁SNPs位点,组成3种单倍型,相关性分析表明可能与蓝狐的体长、体质量存在相关性,但仍有待于进一步研究。 [1] Ashpole N M,Sanders J E,Hodges E L,et al. Growth hormone,insulin-like growth factor-1 and the aging brain[J]. Experimental Gerontology,2014,68:76-81. [2] Chen H C,Wilelmi A E,Howard S C.Purification and characteristics of porcine growth hormone[J]. Journal of Biological Chemistry,1970,245(13):3402-3406. [3] Lantinga-van Leeuwen I S,Oudshoorn M,Mol J A. Canine mammary growth hormone gene transcription initiates at the pituitary-specific start site in the absence of Pit-1[J]. Molecular & Cellular Endocrinology,1999,150(1-2):121-128. [4] Etherton T D,Bauman D E. Biology of somatotropin in growth and lactation of domestic animals[J]. Physiological Reviews,1998,78(3):745-761. [5] Oberbauer A M. The influence of growth hormone on bone and adipose programming[J]. Advances in Experimental Medicine and Biology,2014(814):169-176. [6] Ohkubo T,Araki M,Tanaka M,et al. Molecular cloning and characterization of the yellowtail GH gene and its promoter:a consensus sequence for teleost and avian Pit-1/GHF-1 binding sites[J]. Journal of Molecular Endocrinology,1996,16(1):63-72. [7] Sekar M,Singh S D,Gupta S. Cloning and characterization of Pangasianodon hypophthalmus growth hormone gene and its heterologous expression[J].Appl Biochem Biotechnol,2014,173(6):1446-1468. [8] Tanaka M,Toma Y,Ohkubo T,et al. Sequence of the flounder (Paralichthys olivaceus) growth hormone-encoding gene and its promoter region[J]. Gene,1995,165(2):321-322. [9] Yoshino M,Mizutani T,Yamada K,et al. Early growth response gene-1 regulates the expression of the rat luteinizing hormone receptor gene[J]. Biology of Reproduction,2002,66(6):1813-1819. [10] Su Y,Liebhaber S A,Cooke N E. The human growth hormone gene cluster locus control region supports position-independent pituitary-and placenta-specific expression in the transgenic mouse[J]. Journal of Biological Chemistr,2000,275(11):7902-7909. [11] Flint D J,Gardner M J. Influence of growth hormone deficiency on growth and body composition in rats:site-specific effects upon adipose tissue development[J]. Journal of Endocrinolgy,1993,137(2):203-211. [12] Toumba M,Neocleous V,Shammas C,et al. Effects of growth hormone on heart structure and function in adolescence[J]. Georgian Medical News,2012 (210):34-39. [13] Kasuya E. Secretory pattern and regulatory mechanism of growth hormone in cattle[J]. Animal Science Journal,2016,87(2):178-182. [14] 胡怡菲,昝林森,王洪宝,等. 秦川牛GH基因第5外显子的多态性及其与体尺性状的关联性[J]. 西北农林科技大学学报,2010,38(6):47-55. [15] 闵令江,李美玉,孙国强,等.生长激素基因多态性与山羊体重性状的关系[J]. 遗传学报,2005,32(6):650-654. [16] 陶志云,徐文娟,朱春红,等. 高邮鸭GH基因SNP位点及其与早期体质量的相关性[J]. 江苏农业学报,2017,33(1):146-150. [17] 胡晓航. 银狐生长激素基因克隆与基因表达研究[D]. 哈尔滨:东北林业大学,2005. [18] 刘玉堂,胡晓航,闫丽辉,等. 银狐生长激素cDNA克隆和原核表达[J]. 中国畜牧兽医2008,35(4):26-30. [19] 杜智恒,刘宗岳,白秀娟. 北极狐GHR基因单核苷酸多态性及其与生长性状的相关性分析[J]. 遗传,2010,32 (6):599-605. [20] 初 芹,李 东,侯诗宇,等. 基于DNA池测序法筛选奶牛高信息量SNP标记的可行性[J]. 遗传,2014,36(7):691-696. [21] 荣 敏,徐佳萍,涂剑锋,等. 水貂GHR基因的DNA池测序分析[J]. 黑龙江畜牧兽医,2017(19):240-241. [22] 张劲松,龙威海,许厚强,等. 贵州地方山羊GnRHR基因多态性研究[J]. 黑龙江畜牧兽医,2015(15):97-99. [23] 赵冰茹,黄锡霞,田可川,等. 基于DNA池重测序技术研究细毛羊LAMB1基因的SNPs分析[J]. 农业生物技术学报,2016,24(12):1872-1881.
Tab.4 Ho,He,PIC and Ne of GH gene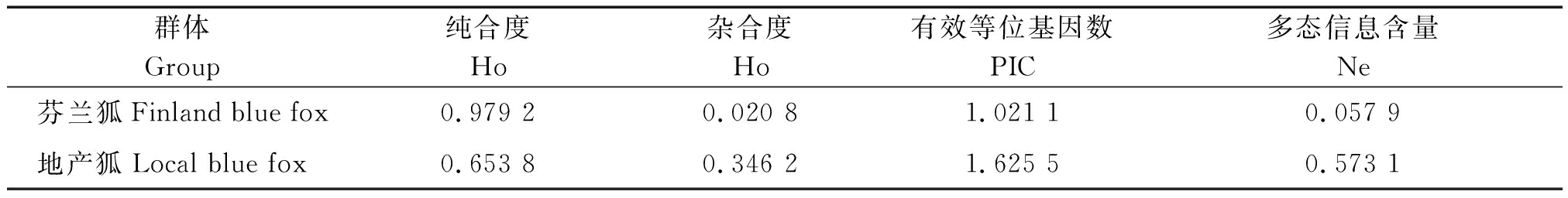
2.5 GH基因多态位点对体质量体长的影响
3 讨论
Tab.5 Association of polymorphisms for GH gene with body weight and body length traits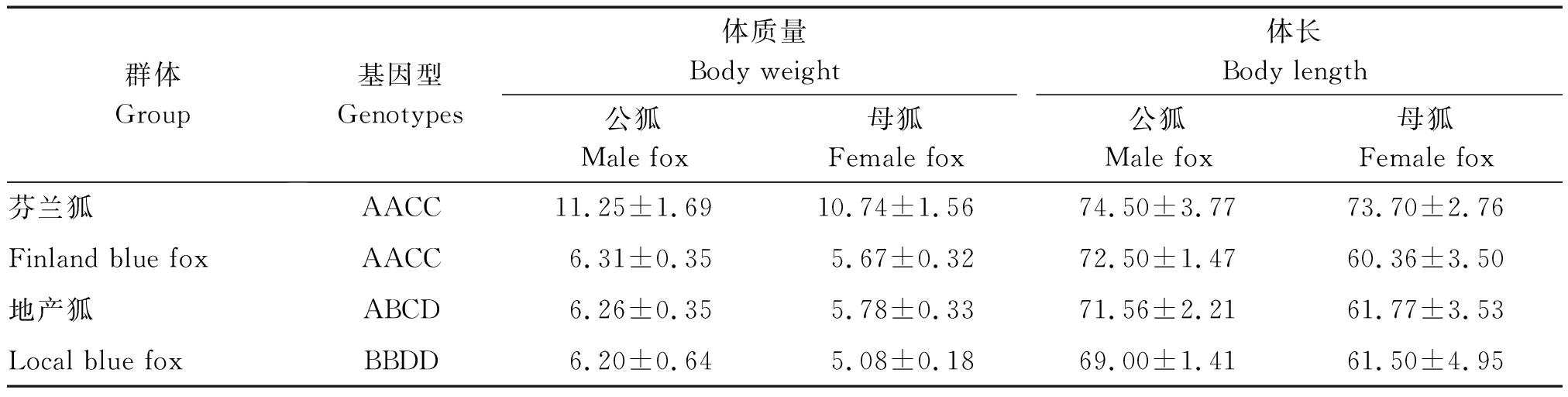
Tab.6 Effects of different genotypes on body weight and body length traits