奥斯陆莫拉菌(Moraxella osloensis)于1967年由Henriksen在挪威奥斯陆城市首次发现,因此命名[1]。该菌广泛存在于人和动物黏膜上,已从人的耳朵、咽喉、气管、骨髓、血液等分离得到[2-3],在门诊病例中以儿童较为容易感染[4]。2013年在一只5岁患有双侧后肢跛行的猕猴中首次分离出奥斯陆莫拉菌感染性关节炎[5];2014年于重庆某羊场送检的山羊肺炎病例中分离得到一株奥斯陆莫拉菌[6]。近年来,国内外有关该菌导致人类患病的报道日益增多,但从未发现有猪源关于该菌的报道。本研究从送检的病死母猪肺子内分离得到1株细菌,命名为ZF2,通过分子生物学方法鉴定,确定该菌株为奥斯陆莫拉菌,对分离得到的奥斯陆莫拉菌进行耐药性分析,以期在临床诊断和用药治疗上起到一定的指导作用。
1 材料和方法
1.1 病料来源
2017年12月初,吉林省四平市某猪场送检1头病死母猪。经剖检发现病猪喉头气管有白色黏性液体,肺间质明显增宽,胸腔及肺脏表面有纤维素性渗出物,取出肺脏,进行实验室检测。
1.2 培养基及试剂
TSA固体培养基、LB固体培养基、TSB液体培养基、胎牛血清均购自北京元亨圣马生物技术研究所。细菌生化微量鉴定管购自杭州微生物试剂有限公司。dNTP Mixtur、Ex Taq DNA聚合酶、pMD18-T、96孔细胞培养板、切胶回收试剂盒购自宝生物工程技术服务公司。抗菌药物(11种)购自北京海洋医药化工生物科技有限公司。
1.3 试验动物
4头一月龄健康断奶仔猪,体质量(10±0.5)kg,免疫程序正常,购自长春某猪场。
1.4 细菌的分离培养
实验室解剖送检病猪,在超净工作台内对肺脏化脓部位表面灭菌分别涂于LB平板和TSA固体培养基(含5%胎牛血清)上,置于37 ℃恒温培养箱中,需氧培养24 h,待细菌纯化培养后,挑取纯化后单个菌落于LB和TSB液体培养基(含5%胎牛血清)中培养24 h备用。
1.5 形态学观察
从固体培养基中环挑单个菌落于载玻片上,经无菌生理盐水稀释纯培养物,置于火焰上加热固定后,进行革兰氏染色,显微镜下1 000倍观察菌体形态特征。
1.6 生化试验
备用菌液以氧化酶、触酶、靛基质、硝酸盐还原、醋酸盐、DL-乳酸盐、尿素酶、明胶液化、乳糖、麦芽糖、鼠李糖等16种生化试剂对菌株进行检测。试验结果与《伯杰氏细菌鉴定手册》进行对比。
1.7 动物回归试验
4头一月龄健康仔猪分成2组,每组2只,第1组滴鼻接种TSB液体培养基中菌液(3×108 cfu/mL),2 mL/只。第2组为对照组,以同样的接种方式接种2 mL生理盐水。接种后第1,4,7,10,14天检测并记录临床症状。
1.8 分子生物学鉴定
取2.0 mL备用菌液,以12 000 r/min离心10 min,收集菌体,按照细菌基因组DNA提取试剂盒说明提取DNA,PCR扩增16S rDNA基因。
上游引物:5′-ATCCGCTATTTACCCAGTGG-3′;
下游引物:5′-GCTGTAAACGAACTCGCCAC-3′。
反应体系:细菌基因组DNA 0.5 μL,10×Buffer 2.5 μL,dNTP 2.0 μL,Ex Taq 0.2 μL,上下游引物各1 μL,ddH2O 17.5 μL。
反应条件:94 ℃ 5 min;H2O 94 ℃ 1 min,50 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
取2.5 μL PCR的扩增产物与0.4 μL 6×Loading Buffer混合后通过1%琼脂糖凝胶电泳检测并根据试剂盒说明书进行切胶回收。连接、转化、提取质粒、测序。测序由生工生物有限公司完成。
1.9 构建系统进化树
将测序结果与GenBank数据库中已报道的序列进行Blast分析比对,构建系统进化树。
1.10 药敏试验与大环内酯耐药基因检测
选用兽医临床上较为常用的11种抗菌药物,分别是庆大霉素、链霉素、氟苯尼考、阿莫西林、头孢噻肟、卡那霉素、恩诺沙星、阿奇霉素、阿米卡星、强力霉素、红霉素。采用微量稀释法测定分离菌MIC(Minimum inhibitory concentration)。结果参照EUCAST欧盟药敏试验标准[7],判定其耐药情况。
参照GenBank数据库中大环内酯耐药基因(ermB)序列,采用Primer 5.0设计大环内酯耐药基因(ermB):
上游引物:5′-GTTCAAGAACAATCAATACAGAG-3′;
下游引物:3′-GGATCAGGAAAAGGACATTTTAC-5′。
取备用菌液进行PCR检测,反应条件为:94 ℃ 5 min;94 ℃ 1 min,52 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PCR产物送往生工生物有限公司测序,测序结果采用Blast比对分析。
2 结果与分析
2.1 细菌的分离培养结果
分离菌株在LB平板上生长十分缓慢,24 h后仍观察不到菌落。TSA固体培养基(含5%胎牛血清)上生长24 h后呈现大量白色圆形边缘整齐的菌落(图1)。
2.2 形态学观察结果
在1 000倍镜下观察分离菌株为革兰阴杆菌,单个或成双排列球杆状,菌体两端钝圆(图2)。
2.3 生化试验结果
记录生化试验结果并参照《伯杰氏细菌鉴定手册》进行比对,其生化特性与奥斯陆莫拉菌的生化特性基本一致(表1),初步确定为奥斯陆莫拉菌。
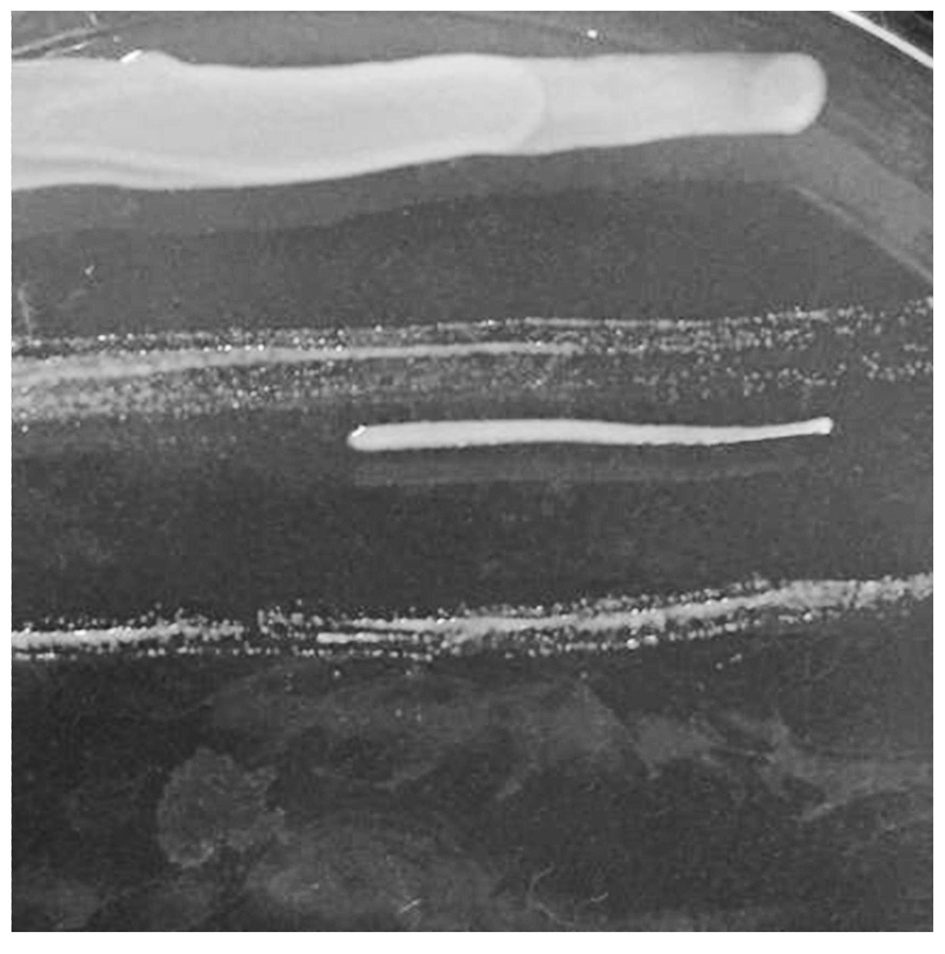
图1 菌落形态
Fig.1 Colony morphology
2.4 动物回归试验结果
对仔猪的临床表现连续观察14 d,其中试验组的2只仔猪均在7 d后出现症状,主要表现为体温升高,采食量下降,精神不振,鼻腔黏膜发红,有大量黏性分泌物流出,有时咳嗽,眼观病变主要见于呼吸道,无死亡现象。对照组的2只仔猪无异常变化。对试验组的仔猪进行剖检,发现试验组仔猪与病死母猪有相同的病理变化,取肺脏病原菌进行实验室分离培养,鉴定出发病仔猪的肺脏中再次分离到奥斯陆莫拉菌。
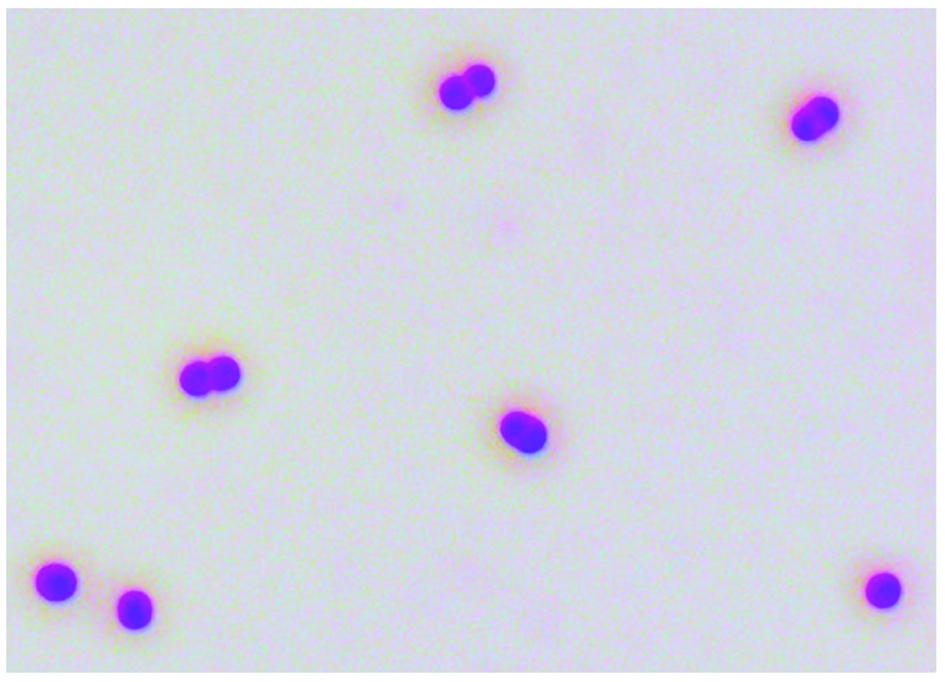
图2 革兰染色镜检结果(1000×)
Fig.2 Gram staining results(1000×)
表1 菌株ZF2 生理生化特性
Tab.1 Physiological and biochemical characteristics of strain ZF2
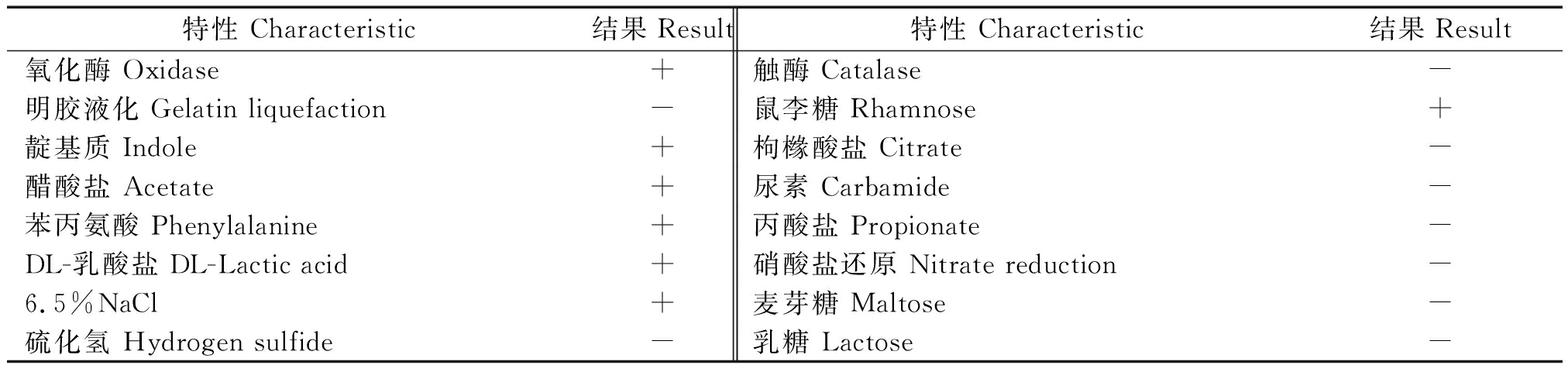
特性 Characteristic结果Result特性 Characteristic结果Result氧化酶 Oxidase+触酶 Catalase-明胶液化 Gelatin liquefaction-鼠李糖 Rhamnose+靛基质 Indole+枸橼酸盐 Citrate-醋酸盐 Acetate+尿素 Carbamide-苯丙氨酸 Phenylalanine+丙酸盐 Propionate-DL-乳酸盐 DL-Lactic acid+硝酸盐还原 Nitrate reduction-6.5%NaCl+麦芽糖 Maltose-硫化氢 Hydrogen sulfide-乳糖 Lactose-
注:+.阳性;-.阴性。
Note:+.Positive; -.Negative.
2.5 分子生物学鉴定结果
用提取得到分离菌株的DNA为模板,利用16S rDNA通用引物进行PCR扩增,结果如图3所示,得到的条带约为1 420 bp,与预期结果大小相符,证明扩增成功。将测得序列上传至GenBank比较可得与奥斯陆莫拉菌相似度为99%,证明该分离菌株为奥斯陆莫拉菌。
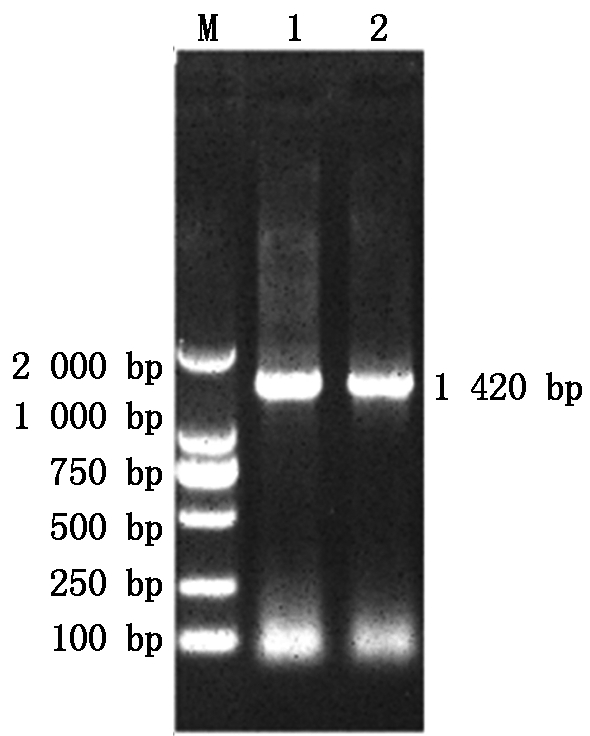
M.DNA分子质量标准;1-2.ZF2 16S rRNA的PCR产物。
M.DL2000 DNA Marker; 1-2.PCR-amplified 16S rRNA gene from strain ZF2.
图3 16S rDNA扩增结果
Fig.3 16S rDNA amplification results
2.6 系统进化树的构建及分析
测序结果在GenBank数据库中进行Blast分析比对,并与奥斯陆莫拉菌的其他种建立进化树,结果(图4)显示,该分离菌与奥斯陆莫拉菌(CP024180.1)同在一个分支,同源性为99%,确定该分离菌为奥斯陆莫拉菌。
2.7 药敏试验及大环内酯耐药基因检测结果
采用微量稀释法对分离菌株进行11种抗菌药物MIC值的测定,根据EUCAST欧盟药敏试验标准,结果显示(表2),分离菌株对大环内酯类的药物中的阿奇霉素和红霉素明显耐药,对于其他药物如阿米卡星、强力霉素、阿莫西林、恩诺沙星等9种均敏感,其中氨基糖苷类药物中的链霉素敏感性偏低。
对分离菌株的大环内酯耐药基因(ermB)进行PCR检测,10 g/L琼脂糖凝胶电泳检测于421 bp出现一条较亮目的条带(图5),经切胶回收测序验证该基因即为大环内酯耐药基因(ermB),证明该菌大环内酯耐药基因呈显性表达。
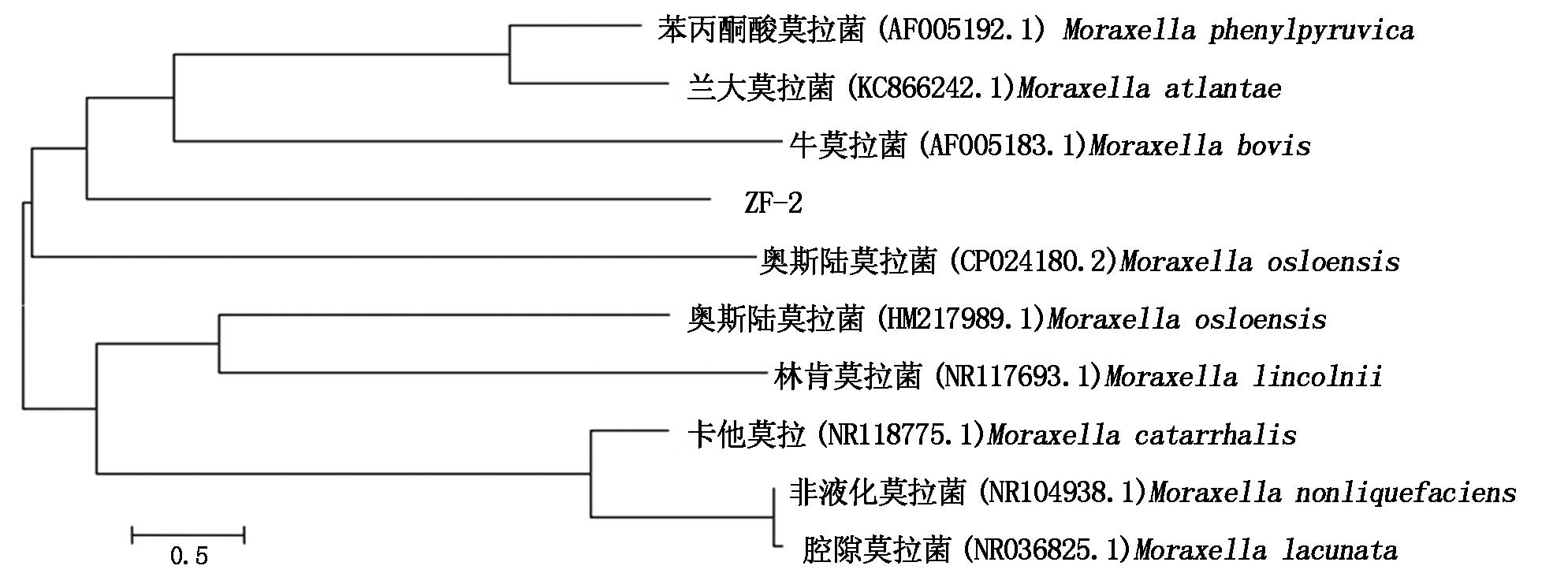
图4 ZF2株与相关菌株的系统发育树
Fig.4 Phylogenetic tree constructed by ZF2 strain and other Wohlfahrtiimonas chitiniclastica strains
表2 菌株ZF2药敏试验结果
Tab.2 Drug susceptibility test results of strain ZF2g/mL

抗菌药物Antibacterial agents最小抑菌浓度MIC判定标准Criterion敏感Sensitive中介Intermediate耐药Resistant阿奇霉素 Azithromycin1.000≤0.25->0.5红霉素 Erythromycin0.500≤0.25->0.5氟苯尼考 Florfenicol1.000≤2.004≥8.0链霉素 Streptomycin0.500≤0.504≥8.0阿米卡星 Amikacin0.500≤8.00->16.0庆大霉素 Gentamicin1.000≤2.00-≥4.0恩诺沙星 Enrofloxacin0.125≤0.50->1.0头孢噻肟Cefotaxime sodium0.125≤1.00->2.0强力霉素 Doxycycline0.500≤1.00->2.0阿莫西林 Amoxicillin0.125≤0.25->0.5卡那霉素 Kanamycin0.065≤2.004≥8.0
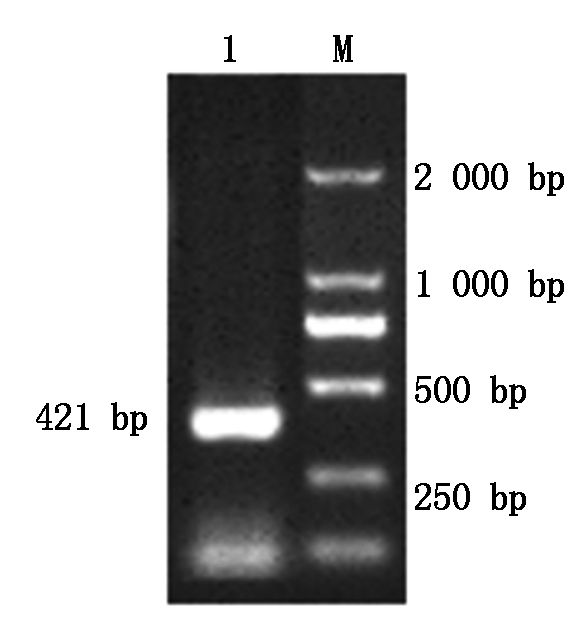
M.DL2000 Marker;1.ermB PCR产物。
M.DL2000 Marker; 1.PCR product of ermB.
图5 ermB基因
Fig.5 ermB gene
3 结论与讨论
莫拉氏菌属为需氧的革兰氏阴性菌,无鞭毛,可形成荚膜,该菌属包括腔隙莫拉菌(M.lacunata)、卡他莫拉菌(M.catarrhalis)、非液化莫拉菌(M.nonliquefaciens)、奥斯陆莫拉菌(M.osloensis)、亚特兰大莫拉菌(M.atlantae)、狗莫拉菌(M.canis)、林肯莫拉菌(M.lincolnii)[8]。奥斯陆莫拉菌是存在于人类的皮肤、黏液膜和呼吸道的正常菌群。在机体抵抗力降低时,该菌可以导致败血症、脑膜炎、肺炎、肺脓肿及泌尿道感染[9]。由该菌引起的侵入性感染比较少见,国外曾有报道该菌引起人的心内膜炎,化脓性关节炎,菌血症和脑膜炎[10-13]。1981年,Sugarman等[14]报道了由奥斯陆莫拉氏菌感染引起的骨髓炎。在国内,杜庆玮等[15]报道从患有败血症的病人中分离出奥斯陆莫拉菌。张京文等[16]报道从一例肛周脓肿患者的肛周脓液和血液培养中,连续2次分离出奥斯陆莫拉菌。在家畜中,王江博[17]从四川绵阳地区鸭场分离到一株新种莫拉菌。胡文举等[18]报道奥斯陆莫拉菌为奶牛子宫内膜炎的主要致病菌,同时牛晖等[19]报道在奶牛子宫内膜炎中奥斯陆莫拉菌的单独感染率和混合感染率较高。Emerson等[20]报道于四群13周龄的公火鸡中发现了类似禽霍乱的病理变化,从病变组织中分离得出为奥斯陆莫拉菌。至今未有报道从猪源中分离出该菌。
本试验在死亡母猪的肺脏内分离得到1株优势菌,通过对分离菌株16S rDNA基因的序列测定并结合菌株的形态特征和生化特性综合分析后,确定为奥斯陆莫拉菌。奥斯陆莫拉菌的临床分离率低,需要复杂的营养条件,作为条件致病菌,该菌常在动物机体免疫力低下时,与其他病毒或细菌混合发病导致动物发病。在动物回归试验中,分离菌株对健康仔猪具有一定的致病性,表现为体温升高、食欲减少、精神沉郁等临床症状,病理变化主要见于仔猪呼吸道。因此,在兽医临床上不可忽视该菌对家畜细菌病的潜在威胁。药敏试验结果表明,该菌对阿奇霉素和红霉素表现为耐药,本试验中检测到奥斯陆莫拉菌存在ermB基因。对阿米卡星、庆大霉素、卡那霉素敏感,阿米卡星、庆大霉素、卡那霉素都属于氨基糖苷类药物,可为临床用药提供参考依据。
对于本病的治疗,最重要的就是改善饲养管理,提高圈舍的卫生环境,提高动物的抵抗力能够有效地预防感染本病,严格实行兽医卫生监督体系能够控制本病传播。本试验所分离的奥斯陆莫拉菌属于人畜共患型条件致病菌,这也增加了饲养人员和畜牧养殖业的风险。因此,应该针对该菌流行病学特点及传播机制进行深入的研究,以期从根源上减少由该菌引发的疾病。
[1] Graham D R,Band J D,Thornsberry C,et al.Infections caused by Moraxella,Moraxella urethralis,Moraxella-like groups M-5 and M-6,and Kingella kingae in the United States,1953-1980[J].Reviews of Infectious Diseases,1990,12(3):423-431.
[2] Berger U,Falsen E.Distribution of species of Moraxella and Moraxella-like organisms in the nasopharynx of healthy human adults (author′s transl)[J].Medical Microbiology & Immunology,1976,162(3-4):239.
[3] Alkhatib N J,Younis M H,Alobaidi A S,et al.An unusual osteomyelitis caused by Moraxella osloensis:A case report[J].International Journal of Surgery Case Reports,2017,41:146-149.
[4] 傅响玲,张玉侠,胡晓静,等. 新生儿重症监护病房护理信息系统手持终端细菌污染情况的调查研究[J].中国实用护理杂志, 2017, 33(10):772-774.
[5] Wren M A,Caskey J R,Liu D X,et al.Septic arthritis due to Moraxella osloensis in a rhesus macaque (Macaca mulatta)[J].Comparative Medicine,2013,63(6):521-527.
[6] 张素辉,黄勇富,付利芝,等.山羊源奥斯陆莫拉菌的分子鉴定与分析[J].中国人兽共患病学报,2014,30(1):12-16.
[7] 刘玉庆,李璐璐,骆延波,等.EUCAST欧盟药敏试验标准[M].北京:中国标准出版社,2016.
[8] Baron E J, Antonson S. Identification of unusual pathogenic Gram-negative aerobic and facultatively anaerobic bacteria[J].Clinical Infectious Diseases, 1986, 24(3):537-537.
[9] Lee W S,Hsueh P R,Yu F L,et al.Moraxella osloensis bacteremia complicating with severe pneumonia in a patient with lung cancer[J].Journal of Microbiology,Immunology,and Infection,2017,50(3):395-396.
[10] Buchman A L,Pickett M J,Mann L,et al.Central venous catheter infection caused by Moraxella osloensis in a patient receiving home parenteral nutrition[J].Diagnostic Microbiology and Infectious Disease,1993,17(2):163-166.
[11] Shah S S,Ruth A,Coffin S E.Infection due to Moraxella osloensis: case report and review of the literature[J].Clinical Infectious Diseases,2000,30(1):179-181.
[12] Fox-Lewis A,Coltart G,Rice S,et al.Extensive subclinical sinusitis leading to Moraxella osloensis meningitis[J].IDCases,2016,6:39-42.
[13] Gagnard J C,Hidri N,Grillon A,et al.Moraxella osloensis,an emerging pathogen of endocarditis in immunocompromised patients? [J].Swiss Medical Weekly,2015,145:w14185.
[14] Sugarman B,Clarridge J.Osteomyelitis caused by Moraxella osloensis[J].Journal of Clinical Microbiology,1982,15(6):1148-1149.
[15] 杜庆玮,孙庆丰,吴金国,等.奥斯陆莫拉菌败血症1例分析[J].现代医药卫生,2009,25(2):258-259.
[16] 张京文,邓书杰,姜 惠.从脓液、血培养中分离奥斯陆莫拉菌[J].中华医史杂志,1996,19(2):54.
[17] 王江博.一株莫拉氏菌新种的分离鉴定与特性研究[D].雅安:四川农业大学,2016.
[18] 胡文举,宋艳画,秦佳辰,等.奶牛子宫内膜炎主要致病菌的分离鉴定及药敏试验[J].动物医学进展,2014(5):117-123.
[19] 牛 晖,徐照学,王二耀,等.奶牛子宫内膜炎血常规分析及病原分离鉴定[J].河南农业科学,2015,44(8):141-144.
[20] Emerson F G,景 鲁.奥斯陆莫拉氏菌引起似禽霍乱的病理变化[J].青海畜牧兽医杂志,1984(5):121.