亚麻野生种具有抗旱、抗冻、抗病、抗虫和耐瘠薄等多种优良性状,是栽培种性状改良的极其宝贵的基因资源。但由于种间杂交存在生殖隔离,造成野生资源优异基因很难在常规种的性状改良上得到应用。花粉管通道法是利用植物在开花、受精过程中形成的花粉管通道,将外源DNA导入受精卵细胞,并进一步地被整合到受体细胞的基因组中,使外源基因得到转化的育种技术。利用该法可以较容易实现种间杂交,甚至可以进行不同属之间的基因交流。自70年代由我国学者周光宇[1]先生提出后,已在棉花[2-3]、小麦[4]、水稻[5]、大豆[6-9]等多种作物的遗传转化上,取得了显著成功。自2000年来,利用花粉管通道技术,在纤维用亚麻新品种选育上获得了可喜的进展[10-11],但该法在油用亚麻新品种选育上的利用鲜见文献报道。
本研究报道了利用花粉管通道法实现野生胡麻DNA的转移和利用RAPD技术对转化后代的分子验证结果。
1 材料和方法
1.1 供体、受体材料选择
受体选用当地主推优良品种坝选三号,供体选用具有抗病、抗寒等特性的野生亚麻资源垂果亚麻(L.nutans Maxim.)。
1.2 T1导入后代材料总DNA的提取
采用张家口赛诺生物科技有限公司生产的新型植物DNA提取试剂盒,货号SN-0205,对采集到的处于快速生长期的亚麻植株体上部10~15 cm的幼嫩部分进行DNA提取,提取的DNA经过北京凯奥5600 DNA检测仪和琼脂糖凝胶电泳鉴定,A260/230≥2.0;A260/280≥1.8,片段大小50 kb左右,符合分子育种导入要求。
1.3 外源DNA导入
在胡麻开花当天,9:00-11:00为适宜导入时期,采用花柱基部切割滴注法,即将柱头的一半或全部剪去,然后将DNA溶液滴于花柱切口处,处理后的子房套袋,以减少水分蒸发。
1.4 T1的种植与观察
当代收获的T0种子全部播种于田间,并按照常规育种程序进行田间调查,单株收获考种。
1.5 T1材料的RAPD分析
根据贾影影等[12]2016年发表在麦类作物学报上的大豆DNA导入春小麦后的标记验证的文章中的RAPD引物序列(上海生物工程技术有限公司合成)。
PCR扩增体系(30 μL):2×pure TaqMix(张家口赛诺生物科技有限公司)15 μL;DNA(20 ng/μL)1 μL;引物(50 pmol/μL)2 μL;ddH2O 12 μL。
PCR仪中扩增。扩增程序:94 ℃预变性5 min;94 ℃变性50 s,40~50 ℃退火50 s,72 ℃延伸80 s,40个循环;72 ℃延伸10 min,4 ℃保温。
电泳检测:反应结束后,每个体系中加5 μL 6×Loading Buffer混匀,用1%的琼脂糖凝胶电泳检测扩增片段的多态性,试验重复3次。
2 结果与分析
2.1 亲本及其导入后代的农艺性状调查
随机选取导入后代单株24株进行考种,其中有3株发生明显变异,考种数据见表1。
表1 转化后代与其亲本主要农艺性状的比较
Tab.1 Comparison of the main agronomic characters of the transformed offspring and their parent
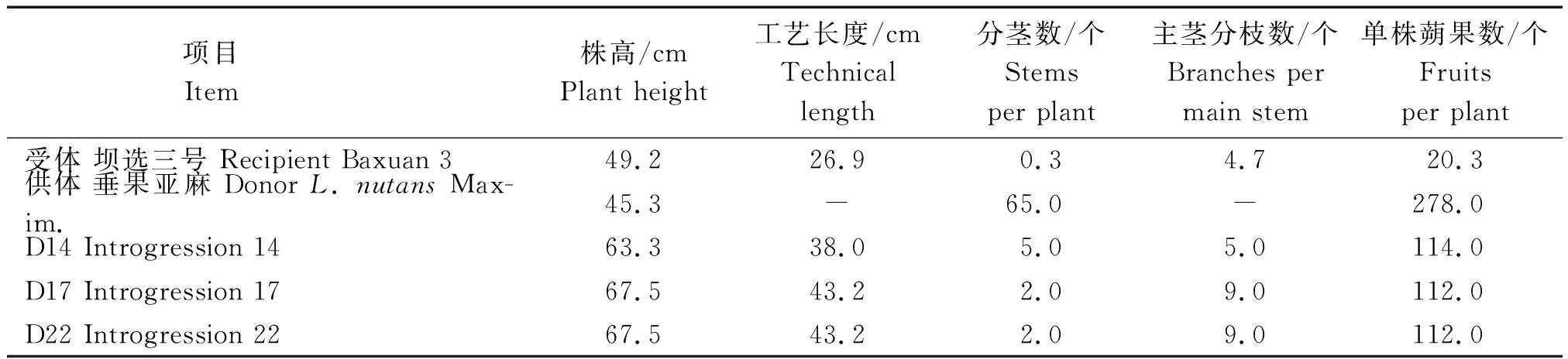
项目 Item 株高/cmPlant height工艺长度/cmTechnicallength分茎数/个Stemsper plant主茎分枝数/个Branches permain stem单株蒴果数/个Fruitsper plant受体 坝选三号 Recipient Baxuan 349.226.90.34.7 20.3供体 垂果亚麻 Donor L. nutans Max-im.45.3-65.0-278.0D14 Introgression 1463.338.05.05.0114.0D17 Introgression 1767.543.22.09.0112.0D22 Introgression 2267.543.22.09.0112.0
从表1可以看出,转化后代的株高、工艺长度、分茎数、主茎分枝数及单株蒴果数与受体相比较,均发生明显变化。导入后代D14、D17、D22的株高较受体分别增加28.6%,37.1%,19.5%,工艺长度增加41.4%,60.8%,24.7%,分茎数增加1400%,500%,1100%,主茎分枝数增加6.4%,91.5%,27.7%,单株蒴果数增加461.6%,451.7%,254.7%。其他性状如叶色、花色、籽粒性状等均与受体相同。
2.2 亲本及其导入后代的RAPD分析
利用18条引物对供体、受体及24株T1导入材料的全基因组DNA进行了RAPD扩增分析,结果显示,其中有6条引物(OPH20、OPK14、S103、S118、OPJ4、OPT6)对8个样品的DNA扩增产物带型出现明显差异,占全部所用引物的33.3%,结果见图1。
引物OPH20在导入后代D15的300 bp处、引物OPK14在导入后代D14、D15、D17、D21、D22的650 bp处、引物OPT6在导入后代D1、D7、D8的600 bp处、在D14、D15、D17、D21、D22的350 bp处的扩增产物均出现了和供体、受体不同的特异带。
引物S103在导入后代D7、D14、D15、D17、D21、D22的750 bp处、引物S118在导入后代D7、D14、D15、D17、D21、D22的250 bp处的扩增产物均出现了和受体不同,但和供体相同的特异带。
引物OPJ4在导入后代D1、D7、D8、D14、D15、D17、D21的扩增产物和受体相比,少了一条带,大小约为1 500 bp。
以上结果说明,供体DNA片段已通过花粉管通道进入受体,并对受体基因的表达产生影响。

第一个泳道为 DL2000 DNA Marker;A.坝选三号(受体);B.垂果亚麻(供体);C-J.为导入后代D1、D7、D8、D14、D15、D17、D21、D22。
The first lane is DL2000 DNA Marker; A.Baxuan 3(Recipient);B.L.nutans Maxim.(Donor);C-J. Refer to the transformed off springs D1,D7,D8,D14,D15,D17,D21,D22.
图1 六条引物RAPD分析结果
Fig.1 The Result of RAPD analysis with six primers
3 结论与讨论
远缘杂交作为农作物品种改良的重要途径之一,已在许多作物中得到了应用[13-16]。但对于油用亚麻,因亚麻属的不同种存在生殖隔离,导致野生种质资源优良基因难于在油用亚麻品种选育中得到应用。国内仅有张家口市坝上农科所的米君研究员于20世纪80年代,成功将亚麻野生种宿根亚麻(L.perenne L.)和栽培品种坝亚七号进行种间杂交后通过系统选育,选育出种间杂交新品种,并从染色体和分子水平上对杂交种进行了真实性鉴定,于2017年对该品种进行了鉴定,定名冀张亚1号,这是国内外首个鉴定的亚麻种间杂交种[17-20]。近年来,将收集到的包括垂果亚麻等在内的多个胡麻野生种,通过常规方法与栽培种进行种间杂交,结果均未获成功。
花粉管通道法作为一种基因转化手段,已经得到了普遍应用。该法不依赖组织培养人工再生植株,技术简单,不需要装备精良的实验室,常规育种工作者易于掌握。李闻娟等[21]、苏文杰[22]利用花粉管通道法成功将Bar基因转入胡麻中,并获得了具有抗除草剂特性的导入后代。但到目前为止,还未见利用该法进行油用亚麻远缘杂交的报道。
本研究通过花粉管通道法将垂果亚麻总DNA导入栽培种坝选三号中,转化后T1部分植株的株高、工艺长度、分茎数、分枝数及单株蒴果数与受体相比较,发生明显变化。特别是单株蒴果数性状,和受体相比,导入后代得到了很大提高。为了验证供体基因组DNA是否成功导入到受体基因组中,随即对T1植株进行了RAPD分析。
经过分析,变异情况共有3种,比较复杂。一是导入后代出现不同于供体和受体的新带(OPH20、OPK14、OPT6),这种情况比较多见。二是供体特异带出现于后代(S103、S118)。三是导入后代和受体相比,有特异带消失。
D14、D17、D22 3个植株的RAPD谱带中均有来自于供体的特异条带,结合考种数据,认为是外源的DNA片段整合进了受体。外源的DNA片段进入受体,可能引起基因组DNA序列的变化,进而影响基因的转录,调控某些基因的表达,最后导致导入后代性状的变化,在RAPD扩增产物中出现多态性。但对于一些导入后代植株,RAPD检测虽有特异条带出现,但表型上没有发现明显变化。这可能和导入片段的大小及在受体基因组整合的位置有关。
利用该法进行种质创制,由于供体基因组以随机的方式整合进入受体染色体基因组中,故导入植株后代的遗传情况较为复杂。同时,该法导入效率较低,要获得足量的带有目标性状的导入后代,需要大量的转化群体。另外,T1导入植株的外源基因的整合与表达不稳定,要获得纯合体,需要进行多代种植。本研究获得了分枝数和单株蒴果数得到极大提高的转化T1植株,并通过RAPD的方法对其进行了验证。充分证明了该法在油用亚麻种质创新上的可行性。今后,需进一步提高导入效率,以充分发挥其简便快速的优势,利用该法将更多具有优良性状的亚麻野生种基因导入到栽培种中,培育更多更好的优良品种。
[1] 周光宇. 从生物化学的角度探讨远缘杂交的理论[J]. 中国农业科学,1977(2):16-20.
[2] 刘传亮,田瑞平,孔德培,等. 棉花规模化转基因技术体系构建及其应用[J]. 中国农业科学,2014,47(21):4183-4197.
[3] 黄骏麒,钱思颍,刘桂铨,等. 外源抗枯萎病棉DNA导入感病棉的抗性转移[J]. 中国农业科学,1986(3):32-36.
[4] 郭 彤,刘 政,胡银岗. 导入谷子基因组DNA对小麦光合生理特性的影响[J]. 麦类作物学报,2015,35(4):514-520.
[5] 段晓岚,陈善葆. 外源DNA导入水稻引起性状变异[J]. 中国农业科学,1985(3):6-11.
[6] 雷勃钧,尹光初,王树林,等. 外源野生大豆DNA导入栽培大豆引起的变异[J]. 中国油料作物学报,1989(3):11-14.
[7] 雷勃钧,尹光初. 外源DNA直接导入大豆的研究[J]. 大豆科学,1991,10(1):58-63.
[8] 李艳超,赵青松,王凤敏,等.大豆遗传转化技术研究进展[J]. 大豆科学,2015,34(1):155-162.
[9] 何 欢,高 嵩,韩 丹,等. 抗虫基因Cry1Iem转化大豆的研究[J]. 吉林农业大学学报,2017,39(6):665-669.
[10] 王玉富,刘 燕,康庆华,等. 纤维亚麻新品种黑亚14号选育报告[J]. 中国麻业科学,2003,25(3):112-113.
[11] 关凤芝,吴广文,宋宪友,等. 纤维亚麻新品种黑亚17号的选育[J]. 黑龙江农业科学,2009(1):152-153.
[12] 贾影影,刘凤楼,王掌军,等. 大豆DNA导入春小麦后的农艺性状和品质性状分析及RAPD标记验证[J]. 麦类作物学报,2016,36(7):833-840.
[13] 崔淑芳,钱玉源,王广恩,等. 远缘杂交种冀棉25的选育及其育种利用[J].中国棉花,2018,45(3):21-25.
[14] 王爱凡,康 雷,李鹏飞,等. 我国甘蓝型油菜远缘杂交和种质创新研究进展[J]. 中国油料作物学报,2016,38(5):691-698.
[15] 彭娜娜,王亚娟,王长有,等. 普通小麦/山羊草属间杂交F1的形态学及细胞遗传学研究[J]. 麦类作物学报,2016,36(12):1563-1569.
[16] 兰 海,苏 鹏,周树峰,等. 玉米与四倍体大刍草杂交结实性的遗传分析[J]. 核农学报,2014,28(3):393-397.
[17] 米 君. 油纤兼用型亚麻种间杂交技术研究[J]. 河北农业科学,2004,8(3):6-7.
[18] 米 君,李爱荣,钱合顺,等. 亚麻种间杂交技术研究初报[J]. 中国麻业科学,2008,30(3):136-140.
[19] 王 丽,马晓娣,米 君,等. 栽培亚麻×野生亚麻种间杂交胚胎发育的研究[J]. 河北农业大学学报,2007,30(5):19-22.
[20] 张丽丽,白 苇,米 君,等. 栽培亚麻×野生亚麻种间杂交种的真实性鉴定[J]. 华北农学报,2012,27(S):57-60.
[21] 李闻娟,张建平,陈 芳,等. bar基因的亚麻花粉管通道法转化[J]. 中国农学通报,2013,29(12):96-100.
[22] 苏文杰. 花粉管通道法转Bar基因胡麻后代的分子检测[J]. 种子科技,2017,35(3):117-120.