近年来,全球土地盐渍化程度日益严重,已成为影响作物生产的重要因素。在高盐环境中,植物会通过多种策略维持细胞内的离子稳态,以减轻Na+引起的离子胁迫对植物造成的伤害[1-2]。高亲和性钾离子转运蛋白(High-affinity K+ transporters,HKT)参与控制K+的吸收和K+/Na+的选择性运输,提高植物抵抗逆境胁迫的能力[3-4]。HKT属于Trk/Ktr/HKT转运体家族,在离子运输过程中表现为双重性,即低Na+时充当Na+和K+协同转运体,高Na+时仅运输Na+,对调节细胞内Na+/K+动态平衡起着决定性作用[5-6]。植物HKT类蛋白由多个跨膜区和P-Loop组成,根据第一个P-Loop环关键部位氨基酸残基的种类,将该蛋白家族分为2个亚家族:P-Loop处含有丝氨酸的为Ⅰ型HKT类蛋白亚家族,是Na+特异性载体;P-Loop处含有甘氨酸的为Ⅱ型HKT类蛋白亚家族,是K+选择性载体[7-10]。最早从小麦中克隆得到HKT基因(TaHKT1),其编码蛋白可介导高亲和的K+/Na+同向转运,而当Na+浓度升高时又可催化低亲和的Na+单向转运[11-12]。目前,已陆续在拟南芥、水稻、大麦、赤桉、杨树、芦苇、盐地碱蓬、盐角草等植物中鉴定出HKT家族的多个同源基因[13-16]。研究表明,不同植物的HKT基因及同种植物不同的HKT家族成员,在功能上往往存在差异[17]。拟南芥AtHKT1为HKT基因亚家族Ⅰ成员,主要介导Na+的吸收[18]。AtHKT1主要在维管系统中表达,通过移除木质部中的Na+提高植物的耐盐性[19]。AtHKT1还可将叶肉细胞中Na+转运到韧皮部筛管中,并运输到植物的根部,从而减少地上组织中的Na+积累[20]。在遭受盐胁迫时,AtHKT1过表达植株可以合成较多的海藻糖、龙胆二糖和棉子糖等渗透保护剂;AtHKT1缺失突变体对Na+的敏感程度明显增加,三羧酸(TCA)循环中间体的水平显著提高,显示糖类代谢的调节与植物盐胁迫的反应密切相关[1,18]。大豆中发现有4个HKT 家族成员(GmHKT1;1、GmHKT1;2、GmHKT1;3和 GmHKT1;4),其中 GmHKT1;2 在大豆幼苗根中对低钾胁迫的响应明显高于其他3个基因,同时对低温、干旱、高盐和 ABA也有较强的响应[21]。水稻OsHKT1和OsHKT2主要在根中表达,参与调控根对Na+的吸收、转运来调节K+/Na+比[15]。小盐芥TsHKT1在高盐环境中通过选择性吸收K+,来维持K+/Na+平衡[22]。胡杨PeuHKT1基因能够在短时间内响应Na+而上调表达,吸收一定的Na+进入细胞内,以维持渗透压的平衡[13]。盐地碱蓬SsHKTl,转运K+而不转运Na+;SsHKT1表达受低K+和Na+处理诱导,而且在高盐条件下保持较高表达水平[23]。盐角草SeHKT1不仅能响应NaCl胁迫,还能在缺K+条件下提高表达,发挥高亲和K+载体功能[14]。
植物通过K+和Na+的转运响应盐胁迫是一个非常复杂的动态过程,受多种因素调控。HKT家族成员在其中发挥十分重要的作用。目前,有关HKT类蛋白K+和Na+转运方式的机制并不明确,本研究通过分析AtHKT1基因启动子在本生烟草中的表达水平,为进一步了解AtHKT1基因的作用机制提供参考。
1 材料和方法
1.1 试验材料
1.1.1 材料及试剂 本生烟草(Nicotiana benthamiana )种植和培养条件为:16 h光照、8 h黑暗,湿度保持在60%~70%,温度控制在22 ℃左右,光照强度为2 200 lux。限制性核酸内切酶、Primer STARTM HS DNA ploymerase、pMD18-T载体购自TaKaRa公司,Taq酶、T4 DNA连接酶、凝胶回收试剂盒购自Fermentas公司,引物合成和核酸测序由上海生工完成,大肠杆菌DH5α、土壤农杆菌GV3101和pCAMIA1300-gus载体由滨州学院生物与环境工程学院基因工程实验室保存。
1.1.2 培养基成分 基本培养基:MS;不定芽诱导培养基Y1:MS+1.5 mg/L 6-BA+ 0.1 mg/L NAA;生根培养基Y2:1/2MS+0.1 mg/L IBA。
1.2 试验方法
1.2.1 AtHKT1基因启动子的克隆 根据GenBank数据库中拟南芥AtHKT1基因启动子(pHKT1)序列的相关信息,应用Primer Premier 5.0软件设计如下引物(下划线显示引入酶切位点的位置),pHKT1 LP:5′-GCGAAGCTTGGTCATCTATATTTCTCAAATAG
TT-3′(HindⅢ),pHKT1 RP:5′-ATAGGATCCG AGCTCTTTAGTTCTCGAGTCGGTTT-3′(BamHⅠ-SacⅠ)。以野生型拟南芥基因组DNA为模板,高保真PCR扩增pHKT1,连入pMD18-T载体。
1.2.2 重组质粒的构建 用Hind Ⅲ-BamH Ⅰ分别酶切pMD18-T-pHKT1和pCAMIA1300-gus,将回收的目的片段进行连接,从而构建pCAMIA1300-pHKT1载体。将含目的片段的表达载体转入农杆菌GV3101中。
1.2.3 本生烟草的遗传转化 将含pCAMBIA1300-pHKT1的农杆菌28 ℃振荡培养,当OD600为0.4~0.5时,离心后加入MS培养基重悬菌体。切取本生烟草叶片,置于菌液中侵染5 min,转入Y1培养基共培养2 d。用羧苄青霉素钠(Carbenicillin,Carb)除去农杆菌,用潮霉素(Hygromycin,Hyg)进行抗性植株的筛选。叶片在不定芽诱导培养基Y1+Hyg(25 mg/L)+Carb(500 mg/L)中进行分化培养。抗性芽在生根培养基Y2+Hyg(25 mg/L)+Carb(250 mg/L)中诱导生根。通过相应的分子生物学技术检测,最终获得外源基因高表达的转基因本生烟草。
1.2.4 GUS染色分析 将转基因本生烟草的幼苗、叶片、花、果实、种子等置于离心管中,加入适量的GUS染液(50 mmol/L pH值7.0磷酸钠缓冲液、10 mmol/L pH值8.0 Na2EDTA、0.5 mmol/L K3(Fe(CN)6)、0.5 mmol/L K4(Fe(CN)6)、0.1% TritonX-100和0.8 g/L X-Gluc),在37 ℃条件下过夜染色。染色后的材料用70%乙醇进行脱色,获得待测组织,观察染色结果。
1.2.5 生物信息学分析 多序列比对及同源性分析采用ClustalW 和MEGA 软件;使用PlantCARE工具分析启动子序列;利用Arabidopsis eFP Browser对基因表达情况进行预测。
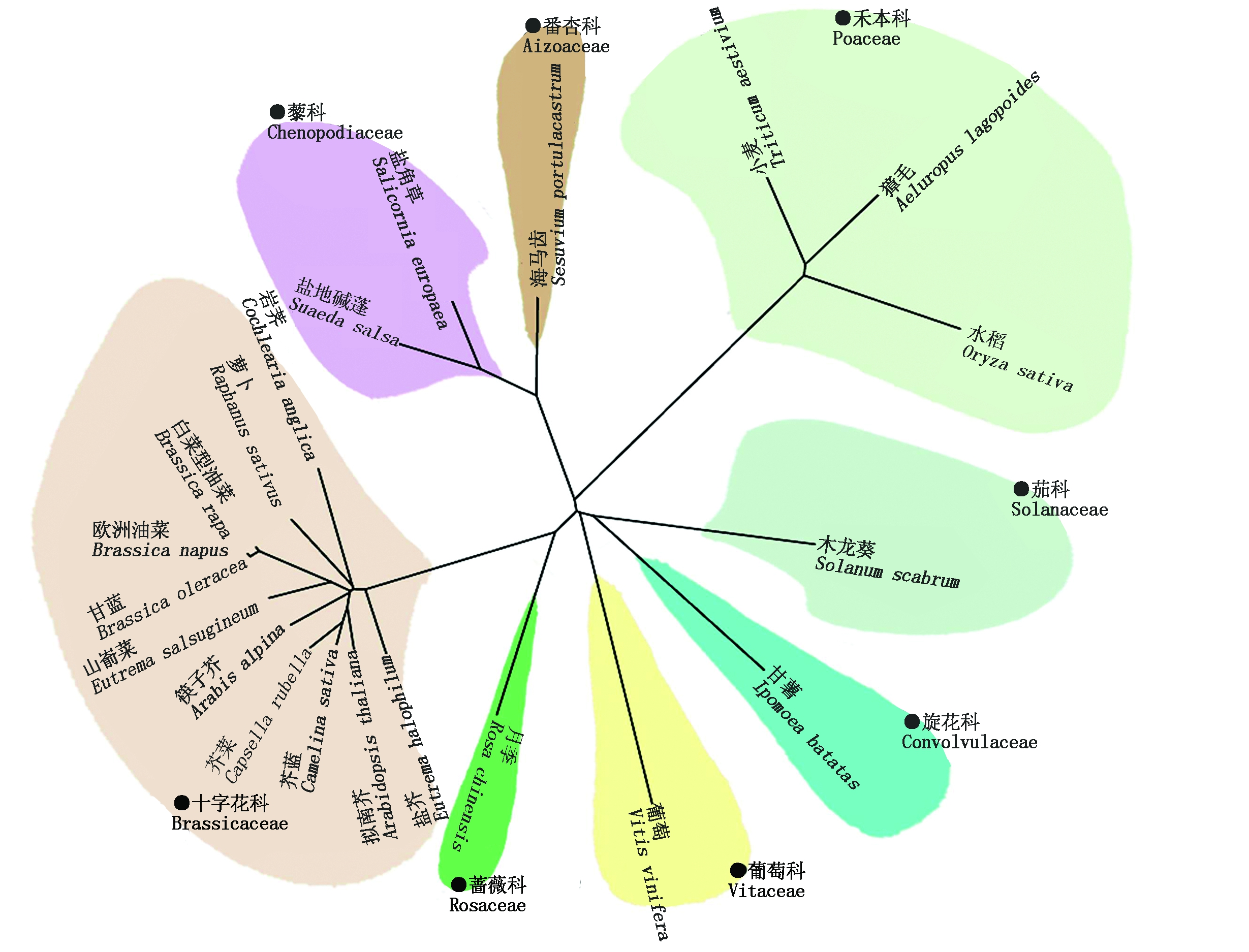
图1 基于不同植物HKT1蛋白氨基酸序列构建的系统进化树
Fig.1 The phylogenetic tree was built based on the different biological amino acid sequence of the HKT1 proteins
2 结果与分析
2.1 同源性分析
根据不同植物HKT1氨基酸序列信息,使用ClustalW软件进行序列比对,然后再利用MEGA软件进行系统进化分析。结果如图1所示,在所构建的系统进化树中,十字花科植物处于相同的进化分支,其中拟南芥和盐芥聚类在一起,表明它们之间有更近的亲缘关系和更相似的蛋白质序列特征;但拟南芥和水稻以及小麦等禾本科植物处于不同的进化分支,它们之间的亲缘关系相对较远,所以可以推测,AtHKT1的功能很可能与水稻以及小麦中的相应蛋白存在较大的差异。
2.2 AtHKT1组织表达水平预测
基因表达部位和表达量与基因功能之间具有密切的联系,根据基因的表达情况可以初步预测该基因的功能。为了了解AtHKT1基因在拟南芥不同器官和不同发育阶段的表达水平,利用在线工具Arabidopsis eFP Browser对AtHKT1基因的表达情况进行预测,结果显示(图2),在拟南芥的不同组织和器官中,都可以检测到该基因的表达,尤其在花中表达十分强烈。此外,在叶片、根和果实中AtHKT1基因的表达量也较高。在拟南芥发育的不同阶段,AtHKT1的表达情况也不相同。在花发育的早期,AtHKT1表达水平相对较低,但在花发育的第15期,该基因的表达达到最高水平,尤其在花瓣、萼片和雄蕊中表达十分显著。
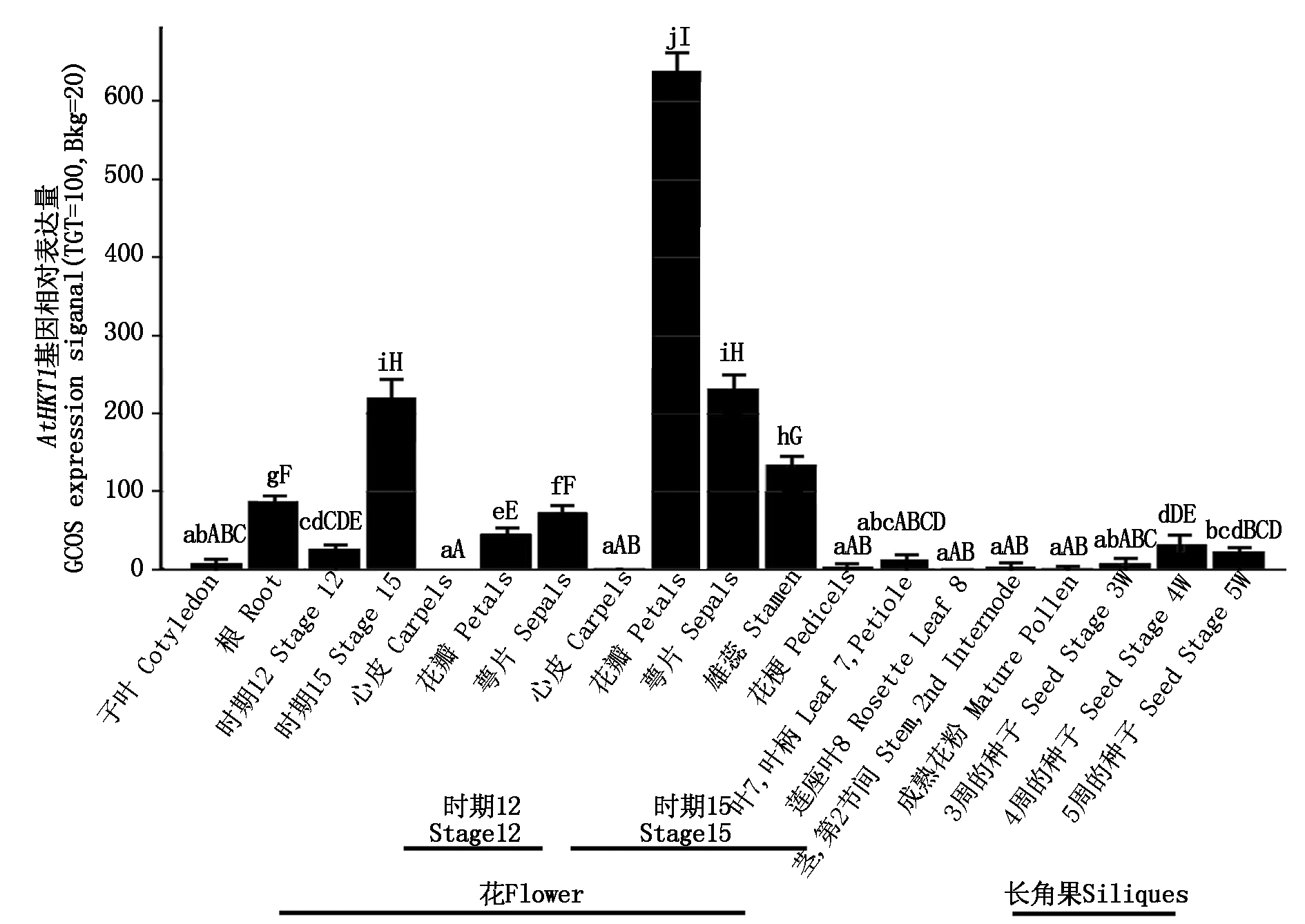
显著性测验,字母相同者差异不显著,字母不同者表示在0.05(小写字母)或0.01(大写字母)水平上差异显著。
The same letters represent insignificant difference; The different lower case letters represent significant differences at P<0.05 level;Capital letters represent extremely significant differences at P<0.01 level,by Duncan′s new multiple range test.
图2 AtHKT1基因在不同组织和器官表达水平预测
Fig.2 The expression level prediction of AtHKT1 gene in different tissues and organs
2.3 AtHKT1启动子顺式作用元件的分析
植物基因的启动子序列中包含许多重要的顺式作用元件,能够在转录水平上参与调控下游相应基因的表达,从而提高植物适应复杂多变环境的能力。利用PlantCARE工具对AtHKT1基因的启动子序列进行分析,结果表明(图3),在AtHKT1的启动子内部存在多个重要的调控位点。这些顺式作用元件分别为:TATA-box(TATA/ccTATAAAaa),它是启动子的核心元件,能与RNA聚合酶结合并调节转录的起始;CAAT-box(CCAAT)是启动子和增强子区域常见的作用元件,能
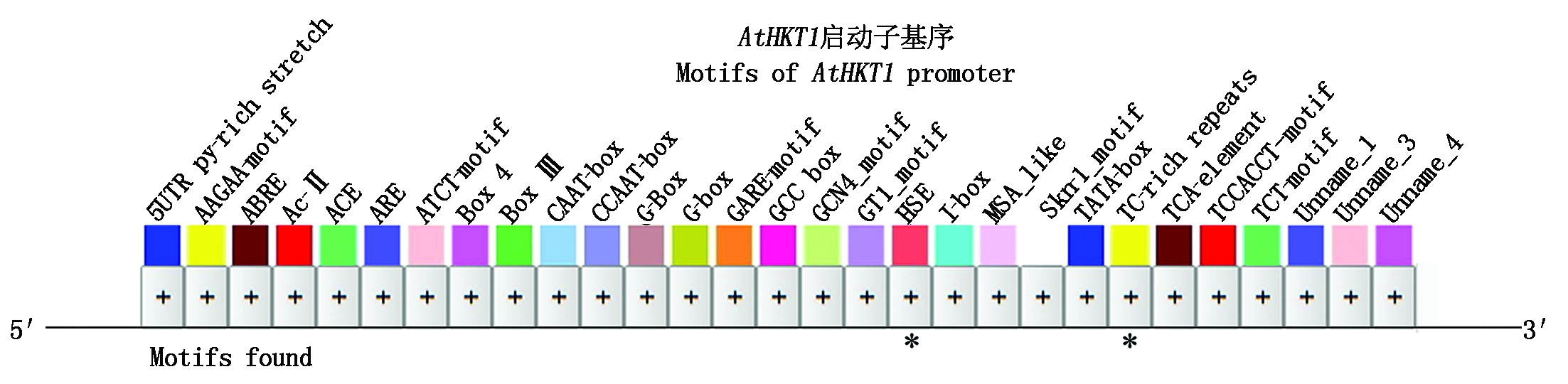
图3 AtHKT1启动子顺式作用元件
Fig.3 Cis-acting element of the AtHKT1 promoter
与转录因子相结合。G-box(CACGTG)是参与光应答的调节元件;GARE(CACGTG)是ABA响应元件;GARE-motif(AAACAGA)对GA诱导起响应的调控元件;TCA-element(CCATCTTTTT)是类似于烟草中参与水杨酸应答的调控元件;HSE(AAAAAATTTC)是响应热胁迫的调控元件;TC-rich repeats(GTTTTCTTAC)是参与防御和胁迫应答的调控元件。由此可以推测,AtHKT1基因表达很可能受到光照、激素和环境胁迫的调控。
2.4 转pCAMBIA1300-pHKT1本生烟草的获得
提取拟南芥的DNA,并通过PCR克隆启动子,将其插入pCAMBIA1300-gus质粒中,进而成功构建表达载体pCAMBIA1300-pHKT1,然后将其转入根癌农杆菌备用(图4-A)。通过农杆菌介导的叶盘法对本生烟草进行遗传转化。将农杆菌侵染后的叶片放入抗性芽筛选培养基中进行不定芽诱导,培养2周后,叶片上开始分化长出幼小的不定芽(图4-B);进一步培养至第3周时,抗性芽已明显增大(图4-C);随着培养时间的增长,抗性芽已产生2,3片叶片(图4-D);当培养至第6周时,抗性芽的叶片已经长到4~5个,以备下一步的生根诱导(图4-E);切取生长良好的抗性芽,将其转移至生根筛选培养基中进行生根诱导(图4-F);培养8周后,不定芽的基部产生大量的不定根(图4-G);将抗性苗从培养基中取出,洗净根部的培养基,种入营养土中,转入温室中进行培养(图4-H)。通过对筛选得到的本生烟草进行分子检测,最终获得转pCAMBIA1300-pHKT1本生烟草。

A.植物表达载体pCAMBIA1300-pHKT1;B.培养2周的叶片;C.培养3周的叶片;D.培养4周的叶片;E.分化诱导6周的不定芽;F.生根诱导;G.生根培养8周的试管苗;H.生长2个月的转基因植株。
A.The plant expression vector of pCAMBIA1300-pHKT1; B.Leaf blade cultured for 2 weeks; C.Leaf blade cultured for 3 weeks; D.Leaf blade cultured for 4 weeks; E.Adventitious buds induced by differentiation for 6 weeks; F. Root induction; G.Rooting induction for 8 weeks; H.Transgenic plants grown for 2 months.
图4 转pCAMBIA1300-pHKT1本生烟草的获得
Fig.4 The genetic transformation of Nicotiana benthamiana with pCAMBIA1300-pHKT1
2.5 AtHKT1基因组织表达水平分析
取转pCAMBIA1300-pHKT1本生烟草的幼苗、幼叶、成熟叶、花、花药、雌蕊、果实、种子、胚等进行GUS染色,分析AtHKT1在本生烟草中的组织表达水平,结果如图5所示。生长7 d的野生型烟草植株上未出现蓝色(图5-A),转空载体幼苗几乎整株都为蓝色(图5-B),转pHKT1-gus幼苗的叶片、维管系统及根部染色较深(图5-C、D)。成熟叶片AtHKT1基因表达水平明显降低,染色较深的部位主要是叶尖、叶柄、叶脉和叶毛(5-E、F)。本生烟草成熟时期花的GUS染色深浅不一,其中,萼片、花梗、花药、柱头、子房染色较深(图5-G-J),表明这些部位AtHKT1基因表达量较高。即将发育成熟的种子一端染色较深,该部分为胚所处的位置(图5-K、L)。显示AtHKT1基因可能与胚的正常发育密切相关。
3 讨论
对作物而言,土壤盐渍化是最重要的非生物胁迫之一,NaCl的调节涉及非常复杂的代谢和运输现象[20]。植物具有多个Na+运输系统以规避Na+毒性,在拟南芥中发现存在多种Na+转运蛋白,包括SOS1、AtNHX和AtHKT1等[7]。其中HKT蛋白家族主要参与控制K+的吸收和K+/Na+的选择性运输,对提高植物抗胁迫能力具有重要的作用[3]。系统进化分析表明,拟南芥和禾本科植物小麦处于不同的进化分支,亲缘关系较远,提示AtHKT1的功能可能与小麦中相应蛋白存在一定的差异。与上述结果一致,拟南芥AtHKT1主要介导Na+的吸收;而小麦TaHKT1既可介导高亲和的K+/Na+同向转运,又可介导低亲和的Na+单向转运[12,18]。生物信息学分析显示,AtHKT1基因在拟南芥许多器官和组织中都有丰富的表达,进一步证实AtHKT1基因应该具有重要的生理功能。AtHKT1基因在叶和根中的表达量较高,这与AtHKT1介导叶中Na+外排,从根木质部细胞回收Na+的功能相一致[17]。此外,AtHKT1在花中表达十分强烈,表明该基因很可能与花的发育相关,体现出AtHKT1基因功能的复杂性。通过预测AtHKT1基因启动子顺式作用元件可以看出,除了核心元件外,还包括能够响应光、激素诱导,热、干旱和盐等环境胁迫的重要元件,这说明AtHKT1启动子可能是一个逆境响应启动子,AtHKT1基因表达很可能受到光、激素和环境胁迫的调控。近来的研究结果也初步证实了上述预测,细胞分裂素可以通过转录因子ARR1和ARR12控制AtHKT1在根中的表达,进而调节拟南芥芽中Na+的积累;ABI4(Abscisic acid insensitive,ABI)通过下调拟南芥根中AtHKT1的表达影响其耐盐性[24-25]。

A.野生型幼苗; B.转空载体幼苗;C.转pHKT1-gus幼苗;D.生长7 d的幼苗的叶;E.成熟叶;F.叶毛;G.完整的花;H.剥开的花;I.花药;J.雌蕊;K.种子;L.胚。其中图A-B bars=200 μm;图C-D、K-L bars=100 μm;图E bars=300 μm;图F和I bars=500 μm;图G bars=3 mm;图H bars=2 mm;图J bars=1 mm。
A.The wild-type seedlings; B.The seedlings with empty vector; C.The transgenic seedlings of pHKT1-gus; D.Leaves of seedlings growing for 7 days; E.The mature leaves; F.The leaf hairs; G.The intact flower;H.Peeled flower; I.Anther; J.Pistil; K.Seeds; L.Embryo.Scale bars=200 μm (A and B);100 μm (C, D, K and L);300 μm (E);500 μm (F and I); 3 mm (G);2 mm (H); and 1 mm (J).
图5 AtHKT1基因组织表达水平分析
Fig.5 Analysis of AtHKT1 gene tissue expression level
对转pHKT1-gus本生烟草幼苗进行GUS染色显示,叶片、维管系统及根部染色较深。该现象说明AtHKT1可能在这些区域表达量较高,有利于Na+的转运,进而调节植物耐盐性。植物的根及根毛具有吸收离子的功能,木质部和韧皮部是植物运输水分、营养物质和无机离子的主要通道,贯穿于植物的根茎叶。AtHKT1具有Na+的选择性运输功能,对拟南芥叶片中Na+外排、维持K+稳态和较高的K+/Na+比值具有重要作用。AtHKT1通过从根木质部细胞回收Na+和Na+从地上部分到根部的再循环,有利于减少地上部分Na+的积累[19,23]。本生烟草花的染色较深,尤其是萼片、花梗、花药、花柱、子房等部位,此外种子的胚染色也较深,表明这些部位AtHKT1表达较为强烈,这与Arabidopsis eFP Browser预测的结果相符合。上述结果提示,AtHKT1除了与Na+转运有关外,可能还有其他未知的功能,如:细胞分裂、花药和胚胎发育等。这进一步增加了AtHKT1功能的复杂性,因此,为了深入了解HKT类蛋白的作用机制,还需大量的工作要做。
[1] Hill C B,Jha D,Bacic A,et al. Characterization of ion contents and metabolic responses to salt stress of different Arabidopsis AtHKT1;1 genotypes and their parental strains[J]. Molecular Plant,2013,6(2):350-368.
[2] Ren Z J,Liu Y,Kang D,et al. Two alternative splicing variants of maize HKT1;1 confer salt tolerance in transgenic tobacco plants[J]. Plant Cell Tissue and Organ Culture,2015,123(3):569-578.
[3] 郭 杰,庄丽芳,亓增军. 百萨偃麦草ThbGSK和ThbHKT1基因的同源克隆与表达分析[J]. 麦类作物学报,2013,33(2):209-216.
[4] Rodrígueznavarro A,Rubio F. High-affinity potassium and sodium transport systems in plants[J]. Journal of Experimental Botany,2006,57(5):1149-1160.
[5] Corratge-Faillie C,Jabnoune M,Zimmermann S,et al. Potassium and sodium transport in non-animal cells:the Trk/Ktr/HKT transporter family[J].Cellular and Molecular Life Sciences,2010,67(15):2511-2532.
[6] Gassman W,Rubio F,Schroeder J I. Alkali cation selectivity of the wheat root high-affinity potassium transporter HKT1[J]. The Plant Journal,1996,10(5):852-869.
[7] Horie T,Hauser F,Schroeder J I. HKT transporter-mediated salinity resistance mechanisms in Arabidopsis and monocot crop plants[J]. Trends in Plant Science,2009,14(12):660-668.
[8] Hauser F,Horie T. A conserved primary salt tolerance mechanism mediated by HKT transporters:a mechanism for Sodium exclusion and maintenance of high K(+)/Na(+) ratio in leaves during salinity stress[J]. Plant,Cell & Environment,2010,33(4):552-565.
[9] Mäser P,Hosoo Y,Goshima S,et al. Glycine residues in potassium channel-like selectivity filters determine potassium selectivity in four-loop-per-subunit HKT transporters from plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(9):6428-6433.
[10] 张 琳. 长穗偃麦草高亲和K+转运蛋白基因EeHKT1;4的克隆及对烟草遗传转化研究[D]. 晋中: 山西农业大学,2015.
[11] Schachtman D P,Schroeder J I. Structure and transport mechanism of a high-affinity potassium uptake transporter from higher plants[J]. Nature,1994,370(6491):655-658.
[12] 单 雷,赵双宜,夏光敏. 植物耐盐相关基因及其耐盐机制研究进展[J].分子植物育种,2006,4(1):15-22.
[13] 胥 猛,孙子谋,刘思安,等. 胡杨耐盐基因PeuHKT1的克隆与表达分析[J]. 分子植物育种,2016,14(9):2312-2318.
[14] 马金彪,张大勇,张梅茹,等. 盐角草高亲和钾离子转运蛋白SeHKT1基因的克隆及表达分析[J]. 生物技术通报,2015,31(11):159-165.
[15] Horie T,Yoshida K,Nakayama H,et al. Two types of HKT transporters with different properties of Na+ and K+ transport in Oryza sativa[J]. The Plant Journal :for Cell and Molecular Biology,2001,27(2):129-138.
[16] Shao Q,Zhao C,Han N,et al. Cloning and expression pattern of SsHKT1 encoding a putative cation transporter from halophyte Suaeda salsa[J]. DNA Sequence,2008,19(2):106-114.
[17] 张 莹. 互花米草SOS1基因和HKT1基因的克隆及耐盐转基因水稻研究[D]. 烟台: 烟台大学,2012.
[18] Rus A,Lee B H,Munnoz-Mayor A,et al. AtHKT1 facilitates Na+ homeostasis and K+ nutrition in planta[J]. Plant Physiology,2004,136(1):2500-2511.
[19] Davenport R J,Mu ozmayor A,Jha D,et al. The Na+ transporter AtHKT1;1 controls retrieval of Na+ from the xylem in Arabidopsis[J]. Plant,Cell & Environment,2007,30(4):497-507.
[20] Berthomieu P,Conéjéro G,Nublat A,et al. Functional analysis of AtHKT1 in Arabidopsis shows that Na+ recirculation by the phloem is crucial for salt tolerance[J]. EMBO Journal,2003,22(9):2004-2014.
[21] 殷桂香,张 磊,佘茂云. 大豆TRK-HKT家族基因结构及逆境胁迫响应机制[J]. 作物学报,2015,41(2):259-275.
[22] Ali Z,Park H C,Ali A,et al. TsHKT1;2,a HKT1 homolog from the extremophile Arabidopsis relative thellungiella salsuginea,shows K+ specificity in the presence of NaCl[J]. Plant Physiology,2012,158(3):1463-1474.
[23] 吴蕊蕊. 盐地碱蓬SsHKT1基因启动子的克隆及功能分析[D]. 济南: 山东师范大学,2011.
[24] Mason M G,Jha D,Salt D E,et al. Type-B response regulators ARR1 and ARR12 regulate expression of AtHKT1;1 and accumulation of sodium in Arabidopsis shoots[J]. Plant Journal,2010,64(5):753-763.
[25] Shkolnik-Inbar D,Adler G,Bar-Zvi D. ABI4 downregulates expression of the sodium transporter HKT1;1 in Arabidopsis roots and affects salt tolerance[J]. Plant Journal,2013,73(6):993-1005.