杧果(Mangifera indica L.),是世界上著名的水果之一,原产自于印度,目前全球总共有85个国家与地区种植杧果[1],种植品种达1 000多个。在我国的广西、海南、台湾、广东、贵州、云南、福建、四川等地均有广泛种植。随着我国扶贫力度的不断加强、农业供给侧改革的深入以及市场引导、企业主导、科技支撑、政府扶持、农户参与的联动运作模式和产业发展体系的逐步构建[2],目前,杧果产业已成为以上地区农业、农村经济发展和农民脱贫致富的支柱产业[3]。在果实成熟的过程中,果实往往会发生色泽的转变并决定最终色泽的形成。成熟果实的外表直接关乎着其商品性和价值,成熟果实鲜艳诱人的色泽能很大程度上激发消费者的购买需求从而大大提升其市场性[4]。果实色泽的形成与调控一直是近年来研究的热点和难点之一,其中在柑橘[5]、苹果[6]、梨[7]、葡萄[8]和猕猴桃[9]等水果的果实色泽研究较为深入。
影响植物叶绿素降解的因素可分为2种,一种为内因,即酶促降解。早在1975年已经报道叶绿体的破裂和叶绿素合成与分解代谢均由核基因控制[10]。叶绿素降解的内因实质上是在叶绿素降解相关酶参与下酶促降解,据报道有近20种之多的酶参与了叶绿素降解[10]。高等植物中叶绿素降解的各个步骤已经基本清楚[11]。首先由叶绿素b还原酶(NYC)催化叶绿素b生成叶绿素a[12];然后经过A途径(PAO/RCCR途径)叶绿素a经过叶绿素降解酶和脱镁螯合酶2种酶的催化作用下在不同物种中分先后不同的顺序脱掉植醇焦礙酸和镁离子,从而生成脱镁叶绿酸a[13-14]或者在 B 途径[15]中叶绿素 a直接被脱镁叶绿素酶催化形成脱镁叶绿素酸a,再在脱镁叶绿酸a氧化酶(PAO)的催化作用下在吡咯环A和B间第5个碳原子裂解后生成红色叶绿素代谢物(Red chl catabolit,RCC)[16];红色叶绿素代谢产物还原酶(RCCR)催化红色叶绿素代谢物分子C1-4220处发生加氢反应生成原初荧光叶绿素降解产物(Primary fluorescent chlorophyll catabolite,pFCC),最后再经过几次非酶异构化修饰之后转移到液泡,形成无荧光叶绿素代谢物(Non-fluorescent chlorophyll catabolite,NCC)[17]。具体途径如图1。目前,MiPAO基因的cDNA序列已经在拟南芥、小麦、水稻、番茄、大豆和油菜等植物中克隆得到[18-22]。而杧果中未见类似的研究报道。
植物体外的环境中光质[23-24]、光照时间[25]、光强[26-27]、温度[28]、金属离子[29]、盐胁迫[30-45]和部分外源植物激如乙烯(Ethylene)[46-48]等都可以影响叶绿素的降解。

图1 叶绿素降解途径
Fig.1 Pathway of chlorophyll degradation
随着表观遗传学的研究深入,植物中病毒诱导的基因沉默(VIGS)成了目前反向遗传学较常见的研究方法[49-51]。就目前的报道来看VIGS已被广泛用于烟草[52-53] 、拟南芥[54] 、番茄[55] 、大麦[56] 、胡椒[57] 、土豆[58-59] 、豆科植物[60] 、木薯[61] 、矮牵牛(花)[62]等植物某些基因功能的研究。烟草花叶病毒(TRV)[53] 、马铃薯X病毒[59] 、大麦条纹花叶病毒[56]等载体已经被证明能够成功应用于某些基因功能的鉴定。其中,TRV与其他病毒相比,具有传播速度快和症状轻微的优点而被广大研究者所青睐[53]。目前在植物的叶片内[55],(植物的)块茎[59]、根[63-64]、花[52,62]等器官中VIGS技术已被广泛的运用。然而,到目前为止国内外关于VIGS技术应用于杧果基因功能鉴定的研究还鲜有报道。
1 材料和方法
1.1 材料及处理
本试验分别从3个不同着色杧果品种(红色贵妃品种、黄色金煌品种、绿色桂七)采集果皮样品为原材料。每个品种采集30个果,分别取完全成熟(软熟期)且没有斑点、病变的果皮,然后将这30个果采集的果皮样品混匀组成混合样。
1.2 试验准备及方法
试验选取CTAB法提取3个不同着色杧果品种果皮的RNA。在试验开始前所用各种枪头、2.0,1.5 mL的离心管和研钵均需用0.1%的DEPC水浸泡12 h以上,高压蒸汽灭菌30 min后置于烘箱烘干。
RNA的电泳检测:配制1%的琼脂糖凝胶电泳进行RNA检测,质量较好的RNA应可以在电泳图上观察到3条条带,其中最亮2条带从上至下为28S和18S,其中最上面的28S条带的亮度是其下面18S条带亮度的2倍,而位于最下面的5.8S的条带较暗。
RNA的纯度检测:利用NanoDrop1000微量紫外可见分光光度计对RNA的纯度进行检测,一般认为OD260/280在1.9~2.1证明RNA的纯度较好。
1.3 杧果MiPAO基因全长的克隆
本试验MiPAO的第一链的cDNA序列的合成是借助于SMARTerTM RACE cDNA Amplification Kit (Clontech)试剂盒,目的片段的回收方法参照Omega公司Gel Extraction Kit使用说明书,回收片段与pMD-19T载体连接,转化到DH5α感受态大肠杆菌中,取40 μL的100 mmol/L IPTG和40 μL的20 mg/mL X-gal均匀涂在含有100 μg/mL氨苄青霉素抗性的固体LB培养基上,放置在37 ℃培养0.5 h后,取200 μL菌液涂布均匀,封口膜密封,置于37 ℃培养箱过夜培养。挑取白色阳性单菌落于加有100 μg/mL氨苄霉素的液体LB培养基内37 ℃,200 r/min摇床培养,直到足够浑浊,经过PCR检测后委托上海英俊生物工程技术服务有限公司测序,根据MiPAO 3′ 端和5′末端cDNA序列测序结果拼接该基因的全长cDNA,再设计特异引物在3个不同着色品种的杧果中扩增得到MiPAO基因的全长cDNA序列。
1.4 杧果MiPAO基因相关生物信息学分析
应用DNAMAN 6.0软件对MiPAO基因全长进行翻译获得其所编码的蛋白序列,再根据查找的30种其他植物物种的MiPAO蛋白序列,进行多序列比较探究同源性。应用在线分析软件分析这2个蛋白序列的结构、亲水性和疏水性、氨基酸的组成成分、物理和化学性质以及同源性。
1.5 pTRV2-MiPAO基因沉默载体的构建
将回收的目的基因MiPAO的全长cDNA序列和基因沉默载体pTRV2同时进行双酶切,所用的2种酶为BamHⅠ和XbaⅠ,回收大小约600 bp目的片段和双酶切后的载体片段。用T4 DNA连接酶16 ℃过夜连接,其中使用的连接体系为10 μL连接体系,各部分配比为:5 μL的目的基因的回收片段、3 μL的载体片段、1 μL的T4 DNA 连接酶 和1 μL的10×T4 DNA Ligase Buffer。连接完成后进行转化感受态大肠杆菌,进行双酶切和菌液PCR检测检测,以确定pTRV2-MiPAO基因沉默载体是否构建完成。
2 结果与分析
2.1 获取3个杧果品种的MiPAO基因的全长序列
克隆得到3个不同着色杧果品种(红色贵妃品种、黄色金煌品种、绿色桂七)MiPAO基因全长cDNA序列,通过琼脂糖凝胶电泳得到了1 979 bp的电泳条带(图2),经分析发现,其开放阅读框为1 641 bp,3个不同着色杧果品种的MiPAO基因cDNA序列只有几个碱基的差异。
2.2 杧果MiPAO基因的相关生物信息学分析
以红色贵妃品种为例,用DNAMAN 6.0对杧果MiPAO基因的CDS序列进行分析可得,其编码546个氨基酸,对橙子(Citrus sinensi XP_006487996.1)、番茄(Solanum lycopersicum AAL32300.1)、拟南芥(Arabidopsis thaliana OAP06119.1)的PAO基因编码的氨基酸序列进行了比对发现它们具有部分保守结构域(图3)。用NCBI 的Protein Blast 软件获取MiPAO蛋白的保守区,可以得到其保守结构域。结果表明,其含有PLN02518(Pheophorbide a oxygenase)、Rieske_RO_Alpha_PaO(Rieske non-heme iron oxygenase (RO) family)、HcaE(Phenylpropionate dioxygenase or related ring-hydroxylating dioxygenase)、PaO(Pheophorbide a oxygenase)、nirD_assim_sml(nitrite reductase[NAD(P)H])等结合域(图4)。
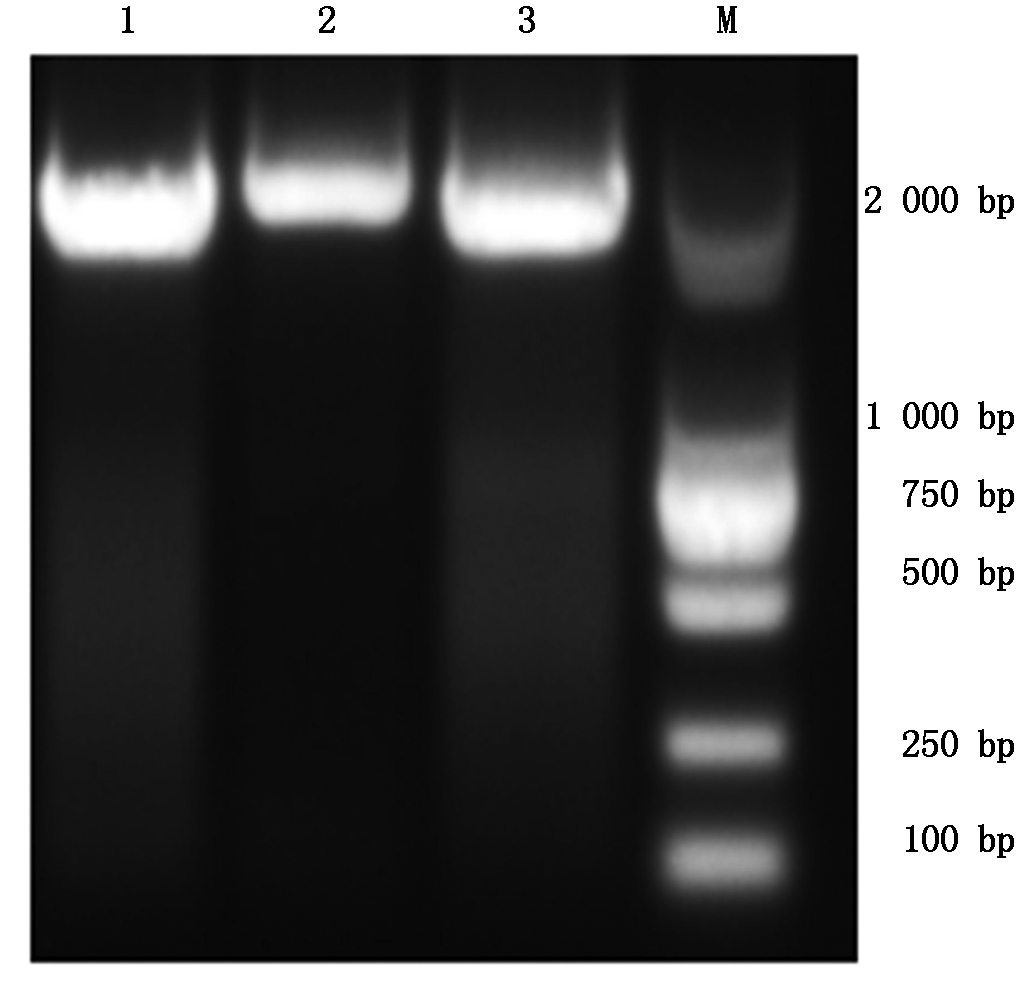
M.DL 2 000 bp DNA Marker;1.红色贵妃;2.黄色金煌;3.绿色桂七。
M. DL 2 000 bp DNA Marker; 1. Red Guifei; 2.Yellow Jinhuang; 3.Green Guiqi.
图2 三种不同着色品种杧果MiPAO基因cDNA电泳结果
Fig.2 cDNA electrophoresis of MiPAO gene in three different colored varieties of mango

图3 四种植物的MiPAO蛋白的序列比对
Fig.3 Sequence alignment of four plant MiPAO protein
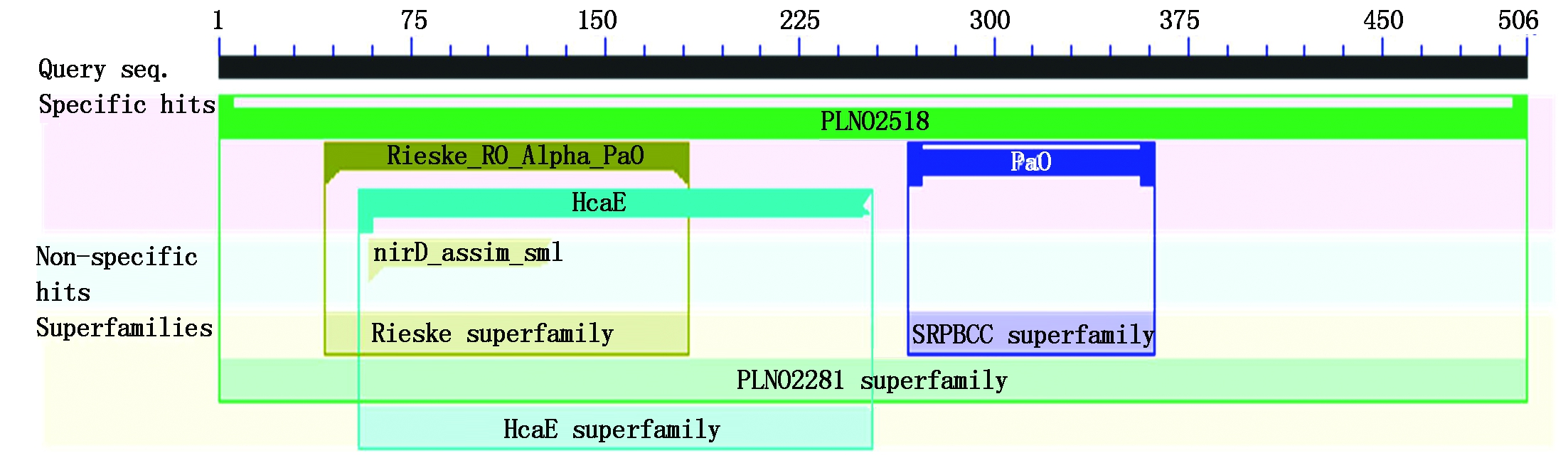
图4 存在于MiPAO蛋白的保守结构域
Fig.4 Conserved domain presenting in MiPAO protein
借助于ProtParam tool(http://web.expasy.org/protparam/)软件得到MiPAO蛋白中每种氨基酸的含量、分子质量、等电点,结果发现,MiPAO蛋白中丝氨酸(Ser)、亮氨酸(Leu)的含量最高分别为8.1%和7.7%,其分子质量为61.82 ku,等电点为6.54。预测了杧果MiPAO蛋白质的二级结构,发现无规则卷曲(Random coil)占40.48%,α-螺旋(Alpha helix)占14.91%,延伸链(Extended strand )占23.08%,β-转角占11.54%为其二级结构的结构原件(图5)。借助于ProtScale(http://web.expasy.org/protscale/)软件分析了杧果编码MiPAO蛋白的氨基酸的疏水性发现:构成杧果MiPAO蛋白的所有氨基酸的亲水性(负值)和疏水性(正值)均分布在-2.833~2.889,为亲水性氨基酸(图6)。借助于SWISS-MODE(https://swissmodel.expasy.org/Interactive)软件预测了MiPAO蛋白的三级结构,得到了3种三级结构模型(图7);对NCBI上刊载的部分植物的PAO蛋白进行了聚类分析,结果发现杧果MiPAO蛋白与橙子等果树的蛋白序列的相似度高,证明了它们的亲缘关系较近(图8)。
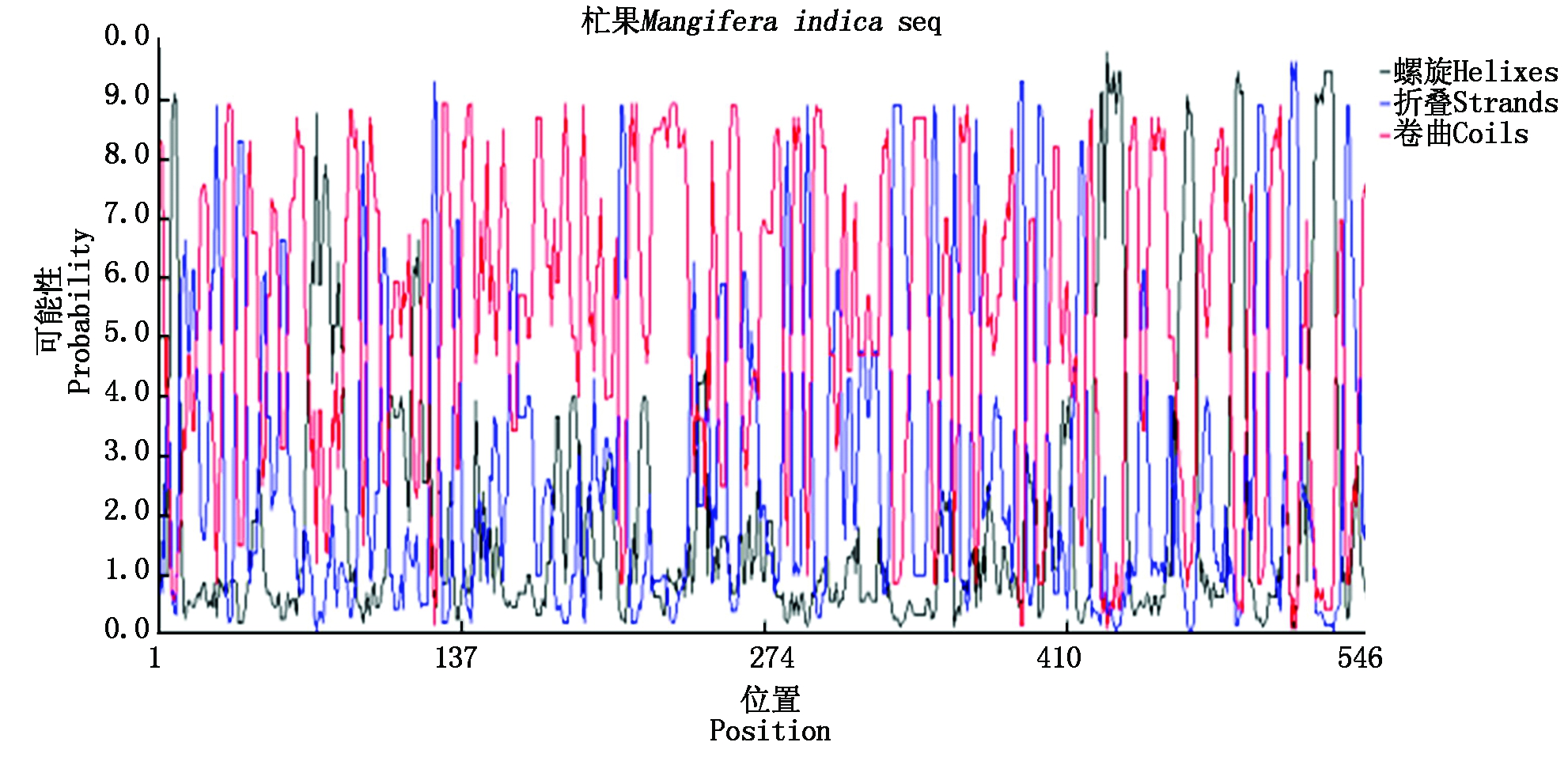
图5 杧果MiPAO蛋白的二级结构预测结果
Fig.5 The prediction result of two structure of mango MiPAO protein
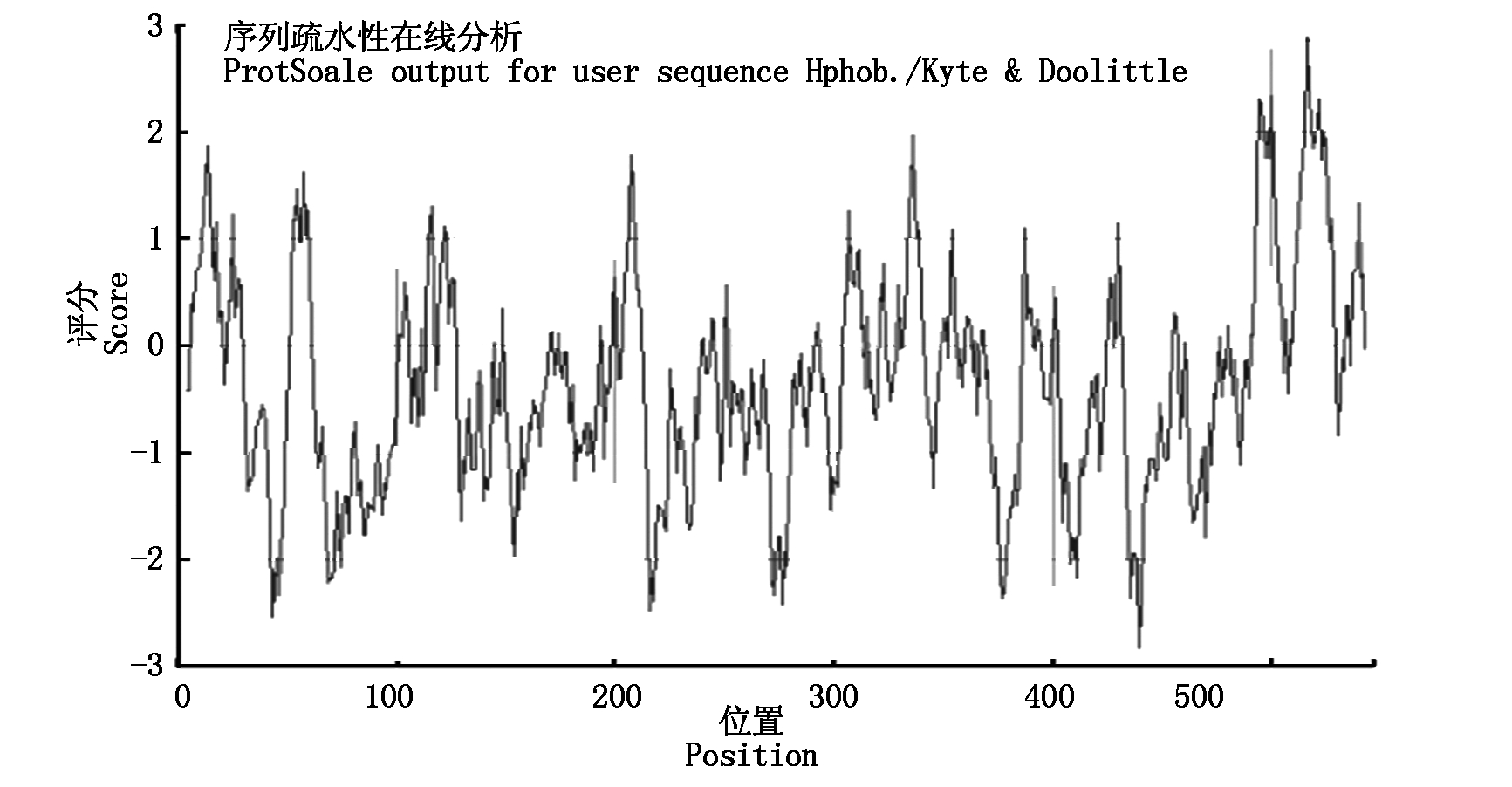
图6 杧果MiPAO蛋白疏水区的分布
Fig.6 The hydrophobic region of mango MiPAO protein

图7 MiPAO蛋白的三级结构
Fig.7 The model of tertiary structure of MiPAO protein
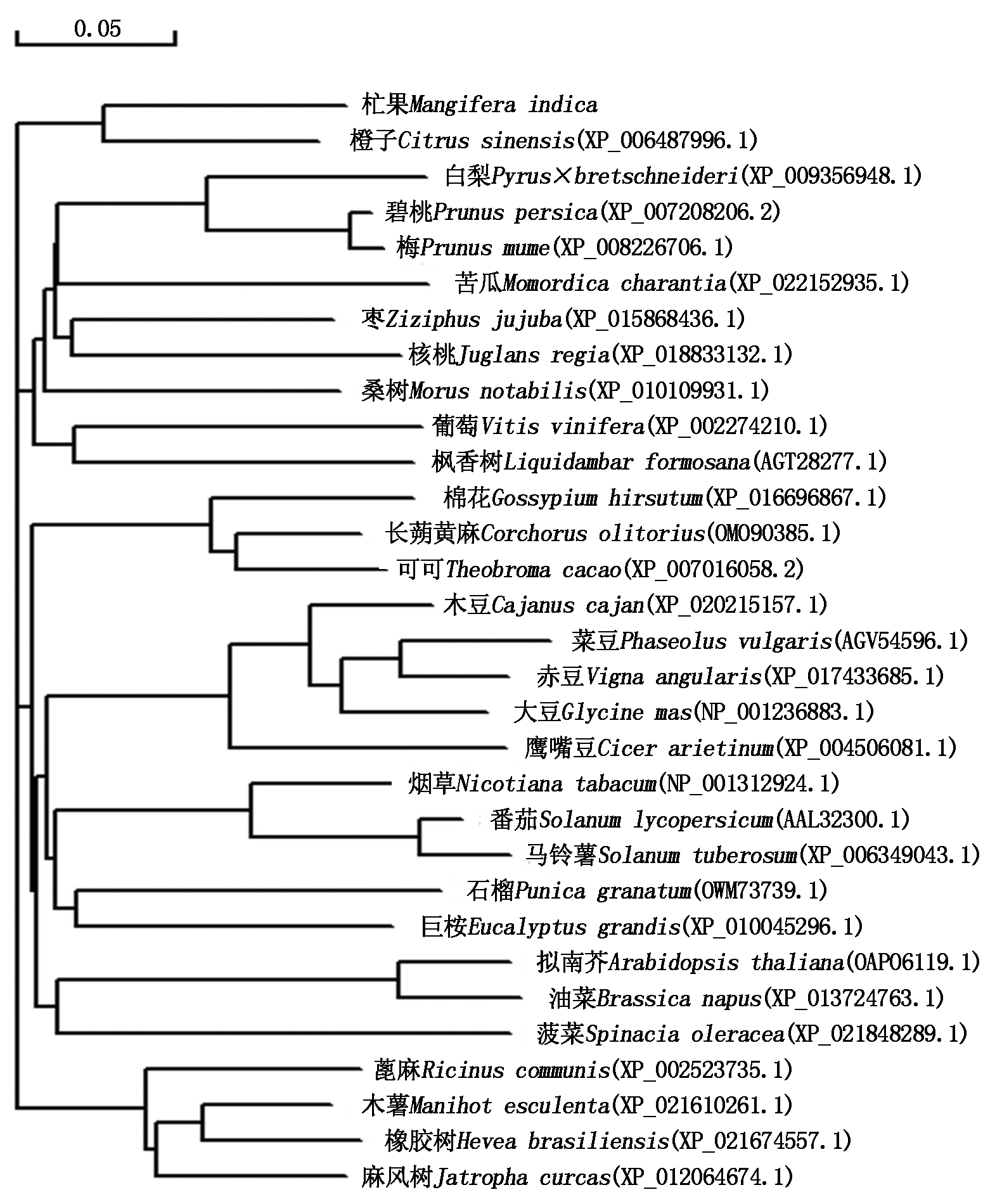
图8 30种植物基因的PAO蛋白序列的系统发育关系
Fig.8 Phylogenetic relationship of 30 plants PAO protein sequences
2.3 pTRV2-MiPAO基因沉默载体的构建
对阳性克隆质粒MiPAO和载体pTRV2同时进行双酶切,回收大小约600 bp目的片段和双酶切后的载体片段(图9)。
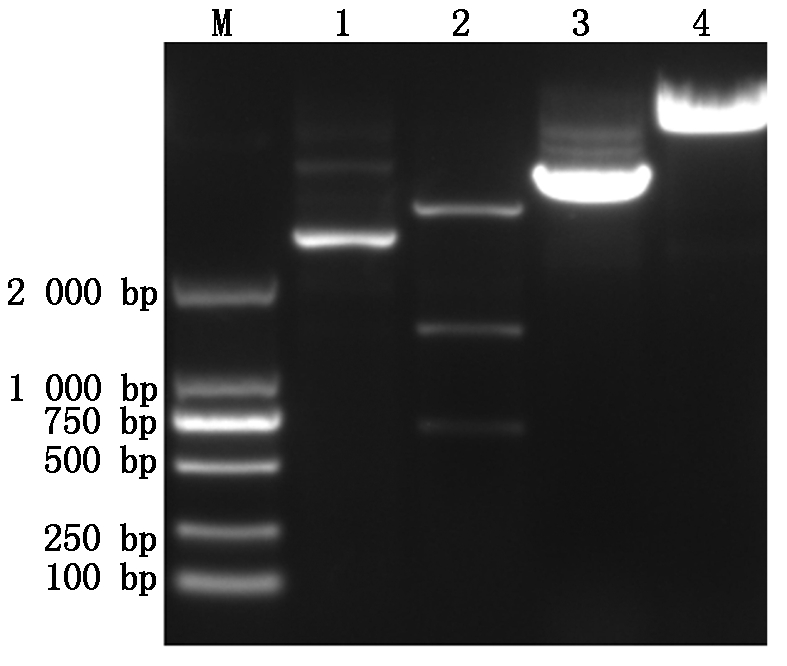
M.DL 2 000 bp DNA Marker;1.对照;2.MiPAO的双酶切;3.载体对照;4.pTRV2载体的双酶切。
M. DL 2 000 bp DNA Marker; 1.Control group; 2.The MiPAO was digested by double enzymes; 3.Control group of vector; 4.The pTRV2 vector was digested by double enzymes.
图9 MiPAO和pTRV2的双酶切
Fig.9 MiPAO and pTRV2 by two enzymes restriction
对pTRV2-MiPAO菌液进行PCR检测,发现菌液PCR检测电泳条带比空载PCR对照电泳条带大600 bp左右,这与双酶切回收的片段大小一致(图10-A)。提取pTRV2-MiPAO表达质粒用BamHⅠ和XbaⅠ双酶切,结果能得到对应大小的载体片段和目的片段(图10-B)。菌液PCR和双酶切检测证明pTRV2-MiPAO基因沉默载体已构建完成。
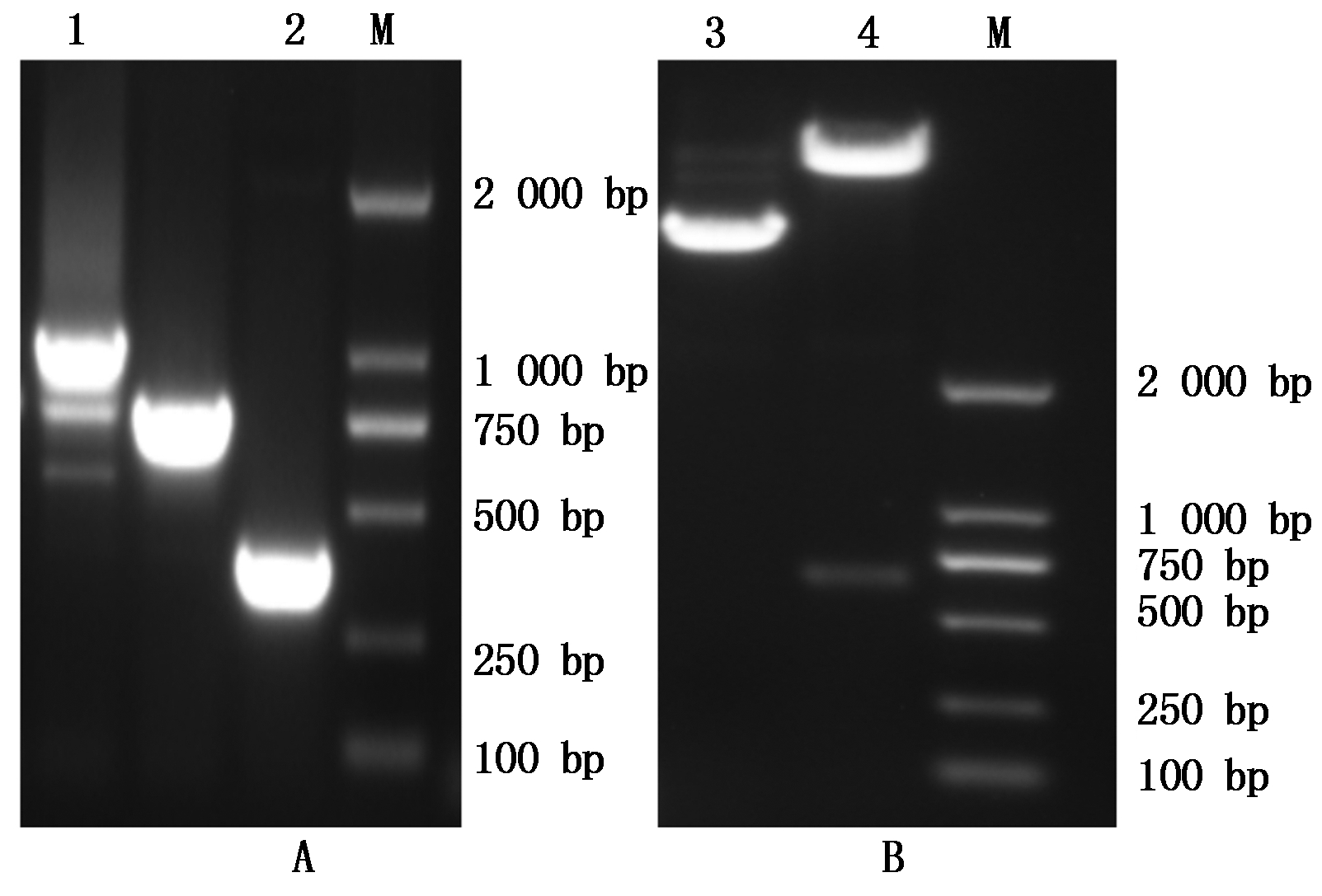
A.pTRV2-MiPAO菌液PCR检测;B.pTRV2-MiPAO双酶切检测;M.DL 2 000 bp DNA Marker;1.菌液PCR检测;2.空载PCR对照;3.酶切对照;4.双酶切检测。
A. pTRV2-MiPAO bacterial liquid PCR test; B. pTRV2-MiPAO double enzyme restriction test; M. DL 2 000 bp DNA Marker; 1.Bacterial liquid PCR test;2.Comparison of without load by bacterial liquid PCR;3.Comparison of double enzyme digestion;4.Double restriction enzyme digestion.
图10 pTRV2-MiPAO菌液PCR和双酶切检测
Fig.10 pTRV2-MiPAO bacterial liquid PCR and double enzyme restriction test
3 讨论
在杧果成熟的过程中,其果皮往往会发生色泽的转变和最终色泽的形成。成熟果皮的色泽直接关乎着其商品性和价值,成熟果皮鲜艳诱人的色泽能很大程度上激发消费者的购买需求从而大大提升其市场性。果实色泽的形成与调控一直是近年来研究的热点和难点之一。在其他物种中已经证明脱镁叶绿酸a氧化酶(Pheophorbide a oxygenase,PAO)是叶绿素降解过程中的关键酶,其参与的叶绿素的降解已经证明在绿色植物代谢过程中广泛存在,但其在杧果果皮叶绿素降解过程中的作用尚不清楚。此次试验分别在红色贵妃、黄色金煌、绿色桂七这3个不同着色杧果品种中克隆得到了MiPAO基因全长cDNA序列,试图探究是否是因为3个品种的MiPAO基因全长cDNA序列的差异导致其果色差异,结果发现,3个着色品种cDNA序列只有几个碱基的差异,经过反复测序排除了这个猜想。
脱镁叶绿酸a氧化酶早在1996年就被定位于叶绿体膜上[10]。在对拟南芥和辣椒中的研究发现,PAO结构的破坏,会使乙稀诱导衰老过程中叶绿素含量的减少[65-67]。Vicentini等[68]研究发现叶绿体基粒内囊体膜上PAO蛋白活性缺失可以导致部分植物滞绿。此外,一些植物激素如赤霉素、细胞分裂素、茉莉酸甲醋、ABA都可以通过抑制PAO/RCCR基因的表达,从而延迟了叶绿素含量的降低[67,69-70]。Pourtau等[71]发现糖也能通过调控PAO/RCCR表达变化来影响植物叶绿素含量。这些结果都显示PAO基因参与调控多种不同植物中叶绿素降解代谢。故本试验构建了pTRV2-MiPAO基因沉默载体,为进一步研究MiPAO在杧果果皮叶绿素降解中的作用,以及为探究绿色桂七杧果品种滞绿的真正原因打下基础。
[1] 莫 宇. 广西百色市右江区芒果产业发展研究[D]. 南宁:广西大学,2015.
[2] 龚德勇,彭 扬,王晓敏,等. 贵州山地芒果生产优势及产业化前景[J]. 江西农业学报,2016,28(1):30-34.
[3] 白大娟,严 海,周开兵,等. 三亚芒果产业现状,存在问题及其发展对策[J]. 热带农业科学,2017,37(9):94-97.
[4] 张 波. 杧果DFR和UFGT基因的克隆及其对果实着色的影响[D]. 海口:海南大学,2015.
[5] 杨国顺,石雪晖,刘昆玉,等. 柑橘果实着色机理研究进展(英文) [J]. 湖南农业大学学报:自然科学版,2005,31(1):106-110.
[6] 武少杰,高九思. 苹果果实着色机制及促进苹果果实着色技术[J]. 园艺与种苗,2016(10):41-44.
[7] 韦 云. 南果梨及其红色芽变‘南红梨’果皮着色差异机理研究[D]. 沈阳:沈阳农业大学,2016.
[8] 任国慧. 南方葡萄果实着色相关机理的初步研究[D]. 南京:南京农业大学,2014.
[9] 齐秀娟,徐善坤,林苗苗,等. 红肉猕猴桃果实着色机制研究进展[J]. 果树学报,2015,32(6):1232-1240.
[10] Thomas H,Stoddart J L. Separation of chlorophyll degradation from other senescence processes in leaves of a mutant genotype of meadow fescue (Festuca pratensis L.)[J]. Plant Physiology,1975,56(3):438-441.
[11] Hortensteiner S. The loss of green color during chlorophyll degradationa prerequisite to prevent cell death [J]. Planta,2004,219(2):191-194.
[12] Sato Y,Morita R,Nishimura M,et al. Mendel,s gene cotyledon gene encodes a positive regulator of the chlorophyll-degrading pathway[J]. PANS,2007,104:14169-14174
[13] Heaton J W,Yada R Y,Marangoni A G. Discoloration of coleslaw is caused by chlorophyll degradation[J]. Journal of Agricultural and Food Chemistry,1996,44(2):395-398.
[14] Kunieda T,Amano T,Shioi Y. Search for chlorophyll degradation enzyme,Mg-dechelatase,from extracts of Chenopodium album with native and artificial substrates[J]. Plant Science,2005,169(1):177-183.
[15] Schelbert S,Aubry S,Burla B,et al. Pheophytin pheophorbide hydrolase (pheophytinase) is involved in chlorophyll breakdown during leaf senescence in Arabidopsis[J]. Plant Cell,2009,21(3):767-785.
[16] Vicentini F,Hortensteiner S,Schellenberg M,et al. Chlorophyll breakdown in senescent leaves:identification of the biochemical lesion in a stay-green genotype of Festuca pratensis Huds[J]. New Phytologist,1995,129(2):247-252.
[17] Hortensteiner S. Chlorophyll degradation during senescence[J]. Annual Review Plant Biology,2006,57:55-57.
[18] Pružinská A,Tanner G,Anders I,et al. Chlorophyll breakdown:Pheophorbide a oxygenase is a Rieske-type iron-sulfur protein,encoded by the accelerated cell death 1 gene[J]. Proceedings of the National Academy of Sciences of the United States,2003,100(25):15259-15264.
[19] Spassieva S,Hille J. A lesion mimic phenotype in tomato obtained by isolating and silencing an Lls1 homologue[J]. Plant Science,2002,162(4):543-549.
[20] Chung D W,Pruzinska A,Hortensteiner S A. The role of pheophorbide a oxygenase expression and activity in the canola green seed problem[J]. Plant Physiology,2006,142(1):88-97.
[21] Tang Y,Li M,Chen Y,et al. Knockdown of OsPAO and OsRCCR1 cause different plant death phenotypes in rice[J]. Journal of Plant Physiology,2011,168(16):1952-1959.
[22] Ma N,Ma X,Li A F,et al. Cloning and expression analysis of wheat pheophorbide a oxy-genase gene taPaO[J]. Plant Molecular Biology Reporter,2012,30(5):1237-1245.
[23] 汪 洋,阚建全. 光照对鲜青花椒干燥过程中叶绿素降解的影响[J]. 食品科学,2014,35(3):10-15.
[24] 李军营,徐超华,崔明昆,等. 不同光质对烟草叶片生长及叶绿素荧光参数的影响[J]. 江苏农业科学,2015,43(11):140-145.
[25] 李婷婷,舒红英,徐 军. 苦瓜叶绿素的提取和稳定性的研究[J]. 江西化工,2008(3):65-68.
[26] 王晓敏. 遮光对光合作用的影响分析[J]. 现代农业科技,2013(3):74.
[27] Cheng D D,Zhang Z S,Sun X B,et al. Photoinhibition and photoinhibition-like damage to the photosynthetic apparatus in tobacco leaves induced by Pseudomonas syringae pv. Tabaci under light and dark conditions[J]. BMC Plant Biology,2016,16(1):1-11.
[28] 许 凤. 采后处理对延缓青花菜衰老的作用及其机理研究[D]. 南京:南京农业大学,2012.
[29] 胡亚杰,刘 高,王 维,等. 喷施金属离子对初烤烟叶颜色变化的影响[J]. 作物研究,2017,31(5):524-527.
[30] 刘 行,张彦广. 盐胁迫对金露梅的生长及其叶绿素含量的影响[J]. 宁夏大学学报:自然科学版,2017,38(1):90-95.
[31] 何奇江,李 楠,周文伟,等. 盐胁迫对雷竹叶绿素含量的影响[J]. 竹子研究汇刊,2014,33(2):58-62.
[32] 金雅琴,李冬林,丁雨龙,等. 盐胁迫对乌桕幼苗光合特性及叶绿素含量的影响[J]. 南京林业大学学报:自然科学版,2011,35(1):29-33.
[33] 周丹丹,刘德玺,李存华,等. 盐胁迫对朴树和速生白榆幼苗光合特性及叶绿素荧光参数的影响[J]. 西北植物学报,2016,36(5):1004-1011.
[34] 翁锦周,林江波,林加耕,等. 盐胁迫对桉树幼苗的生长及叶绿素含量的影响[J]. 热带作物学报,2007,28(4):15-20.
[35] 阿曼古丽·买买提阿力,拉扎提·努尔布拉提,高丽丽,等. 盐胁迫对海岛棉和陆地棉幼苗生长及生理特性的影响[J]. 植物学报,2017,52(4):465-473.
[36] 王 珺,李贺鹏,黄云峰,等. 盐胁迫对夹竹桃幼苗生长及光合特性的影响[J]. 浙江林业科技,2016,36(5):45-50.
[37] 王国霞,张 宁,杨玉珍,等. 盐胁迫对红心萝卜种子萌发及幼苗生长的影响[J]. 西北农业学报,2016,25(5):744-749.
[38] 张荣梅. 不同浓度NaCl胁迫对5个种源黑果枸杞叶片生理特性的影响[D]. 兰州:甘肃农业大学,2016.
[39] 牛灵慧,朱光明,王康才,等. 盐胁迫对丹参种子萌发及幼苗生长的影响[J]. 安徽农业大学学报,2016,43(4):651-657.
[40] 穆永光. 盐碱胁迫对紫穗槐生长和生理的影响[D]. 长春:东北师范大学,2016.
[41] 张 兵. 盐胁迫下柽柳的生长变化和代谢分析[D]. 哈尔滨:东北林业大学,2016.
[42] 吴 昊,高 永,杜美娥,等. 盐胁迫对连翘叶绿素荧光参数的影响[J]. 北方园艺,2016(7):55-60.
[43] 张 玲,王 华,周 静,等. NaCl胁迫对两个辣椒品种幼苗叶绿素荧光参数等生理特性的影响[J]. 浙江农业学报,2017,29(4):597-604.
[44] 齐延巧,廖 康,孙静芳,等. NaCl和Na2CO3胁迫对枸杞幼苗生长和光合特性的影响[J].经济林研究,2017,35(3):70-78,84.
[45] 杨秀艳,李焕勇,朱建峰,等. NaCl胁迫下2种白刺光合特性适应性研究[J]. 核农学报,2017,31(10):2047-2054.
[46] Charoenchongsuk N,Ikeda K,Itai A,et al. Comparison of the expression of chlorophyll-de-gradation-related genes during ripening between stay-green and yellow-pear cultivars[J]. Scientia Horticulturae,2015,181:89-94.
[47] Cheng Y,Guan J. Involvement of pheophytinase in Ethylene-mediated chlorophyll degradation in the peel of harvested Yali pear[J]. Journal of Plant Growth Regulation,2014,33(2):364-372.
[48] Yin X,Xie X,Xia X,et al. Involvement of an ethylene response factor in chlorophyll degradation during citrus fruit degreening[J]. Plant Journal for Cell & Molecular Biology,2016,86(5):403-412.
[49] Dinesh-Kumar S P,Anandalakshmi R,et al. Virus induced gene silencing[J].Methods Mol Biol,2003,236:287-294.
[50] Fu D Q,Zhu B Z,Zhao X D,et al. Advance of thevirus-induced gene silencing in plant[J]. Chinese Biotech,2005,1:89-95.
[51] Robertson D. VIGS vectors for gene silencing:Many targets,many tools[J]. Annual Review of Plant Biology,2004,55:495-519.
[52] Liu Y,Nakayama N,Schiff M,et al. Virus induced gene silencing of a DEFICIENS Ortholog in Nicotiana benthamiana[J]. Plant Mol Biol,2004,54:701-711.
[53] Ratcliff F,Martin-Hernandez A M,Baulcombe D C. Tobacco rattle virus as a vector for analysis of gene function by silencing[J]. Plant J,2001,25:237-245.
[54] Turnage M A,Muangsan N,Peele C G,et al. Geminivirus-based vectors for gene silencing in Arabidopsis[J]. Plant J,2002,30(1):107-114.
[55] Liu Y,Schiff M,Dinesh-Kumar S P. Virus-induced gene silencing in tomato[J]. Plant J,2002,31(6):777-786.
[56] Holzberg S,Brosio P,Gross C,et al. Barley stripe mosaic virus-induced gene silencing in a monocot plant[J]. Plant J,2002,30(3):315-327.
[57] Chung E,Seong E,Kim Y C,et al. A method of high frequency virus-induced gene silencing in chili pepper (Capsicum annuum L. cv. Bukang)[J].Mol Cell,2004,17(2):377-380.
[58] Brigneti G,Martin-Hernandez A M,Jin H L,et al. Virus-induced gene silencing in Solanum species[J]. Plant Journal,2004,39(2):264-272.
[59] Faivre-Rampant O,Gilroy E M,Hrubikova K,et al. Potato virus X-induced gene silencing in leaves and tubers of potato[J]. Plant Physiology,2004,134(4):1308-1316.
[60] Constantin G D,Krath B N,Macfarlane S A,et al. Virus-induced gene silencing as a tool for functional genomics in a legume species[J]. Plant J,2004,40:622-631.
[61] Fofana I B,Sangare A,Collier R,et al. A geminivirus-induced gene silencing system for gene function validation in cassava[J]. Plant Mol Biol,2004,56:613-624.
[62] Chen J C,Jiang C Z,Gookin T E,et al. Chalcone synthase as a reporter in virus-in-duced gene silencing studies of flower senescence[J]. Plant Mol Biol,2004,55:521-530.
[63] Ryu C M,Anand A,Kang L,et al. Agrodrench: a novel and effective agroinoculation method for virus-induced gene silencing in roots and diverse Solanaceous species[J]. Plant,2004,40(2):322-331.
[64] Valentine T,Shaw J,Blok V C,et al. Efficient virus-induced gene silencing in roots using a modified tobacco rattle virus vector[J]. Plant Physiol,2004,136:3999-4009.
[65] Schenk N,Schelbert S,Kanwischer M,et al. The chlorophyllases AtCLH1 and AtCLH2 are not essential for senescence-related chlorophyll breakdown in Arabidopsis thaliana[J]. FEBS Letters,2007,581(28):5517-5525.
[66] Borovsky Y,Paran I. Chlorophyll breakdown during pepper fruit ripening in the chlorophyll retainer mutation is impaired at the homolog of the senescence-inducible stay-green gene[J]. Theoretical& Applied Genetics,2008,117(2):235-240.
[67] Gomez-Lobato M E,Civello P M,Martínez G A. Effects of ethylene,cytokinin and physical treatments on BoPaO gene expression of harvested broccoli[J]. Journal of the Science of Food& Agriculture,2012,92(1):151.
[68] Vicentini F,Hörtensteiner S,Schellenberg M,et al. Chlorophyll breakdown in senescent leaves identification of the biochemical lesion in a stay-green genotype of Festuca pratensis Huds[J]. New Phytologist,2010,129(2):247-252.
[69] Li J R,Yu K,Wei J R,et al. Gibberellin retards chlorophyll degradation during senescence of Paris polyphylla[J]. Biologia Plantarum,2010,54(2):395-399.
[70] Alós E,Cercós M,Rodrigo M J,et al. Regulation of color break in citrus fruits. Changes in pigment profiling and gene expression induced by gibberellins and nitrate,two ripening retardants[J]. Journal of Agricultural &Food Chemistry,2006,54(13):4888-4895.
[71] Pourtau N,Mares M,Purdy S,et al. Interactions of abscisic aid and sugar signaling in the regulation of leaf senescence[J]. Planta,2004,219(5):765-772.