棉花WRKY22基因分离及其对黄萎病的抗性分析
雷 煜1,2,张振楠2,胡 广2,刘建芬1,2,唐 叶2,张 宁1,司怀军1,吴家和1,2
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.中国科学院 微生物研究所,北京 100101; 3.棉花生物学国家重点实验室,郑州大学基地,河南 郑州 450001)
摘要:为了克隆棉花抗黄萎病相关基因,利用生物信息学、病毒诱导基因沉默技术(VIGS)、实时定量PCR(qPCR)和接菌分析来研究棉花WRKY基因对大丽轮枝菌的诱导响应和抗性。结果从棉花中筛选出8个与拟南芥直系同源的棉花抗病相关WRKY基因,这些直系同源WRKY基因表达受到大丽轮枝菌浸染诱导响应。其中有6个GhWRKY基因的表达均受到大丽轮枝菌诱导上调,而GhWRKY70和GhWRKY48的表达量随着不同的时间点呈现上调或下调。GhWRKY22等5个基因表达量在24,72 h分别表现为上调,呈现出双峰曲线。对GhWRKY22表达特征进一步分析,结果显示,GhWRKY22基因在茎里优势表达,同时表达受到大丽轮枝菌、水杨酸和茉莉酸激素的诱导。GhWRKY22基因沉默植株对大丽轮枝菌的敏感性增加,抗病标志基因(PR1、PR3、PR4、PR5、PAL和PDF1.2)表达量也显著降低,揭示GhWRKY22是通过SA和JA信号途径参与棉花对大丽轮枝菌的响应过程。总之,棉花中8个WRKY基因参与棉花对黄萎病抗性调控,其中GhWRKY22基因正调控棉花的抗性,可作为棉花抗病育种的候选基因。
关键词:棉花;GhWRKY22;抗病;大丽轮枝菌;基因沉默
植物不能够像动物那样趋利避害的自由移动,因此,当病原菌浸染时,其只能通过调节自身的生理生化反应来抵抗或适应这些变化,这些变化被称为植物先天免疫反应。一般认为植物的先天免疫反应包括2个层次或进程,一个是由病原菌相关分子模式(PAMP)启动的先天免疫反应,称为PTI,另一个是由病原菌效应因子(Effector)启动的先天免疫反应,称之为ETI[1-2]。当植物先天免疫反应时细胞内的抗病相关基因表达发生了改变(Reprogram),而这些抗病相关基因主要是受编码调控蛋白和转录因子调控的,其中转录因子主要包括WKRY、MYB、NAC、bZIP等[3]。
WRKY转录因子是植物中最大转录因子家族之一,在拟南芥中有72个WRKY转录因子[4],棉花中报道的为116个[5]。WRKY蛋白一般被分为3个组群,分别为GroupⅠ、Ⅱ、Ⅲ,其中Group Ⅱ又被分为5个亚组,被标为Ⅱa、b、c、d和e。WRKY蛋白含有WRKYGQK保守结构域,其C端含有C2H2或C2C2的锌指结构[5-6]。WRKY转录因子通常作为植物信号网络中的重要组成因子,在植物体内承担着多种功能,包括植株的生长发育和逆境响应。其中对病原菌抗性反应研究涉及多个WRKY转录因子,如在拟南芥中,WRKY7、33、3、22、48、70、72和40等直接参与抗病反应[7-14],这些蛋白有的参与腐生性病原菌抗性,有的参与寄生性病原菌的抗性,有的对二者都能产生抗性反应[15]。这些WRKY转录因子的抗病机制比较复杂,不断增加的研究报道说明,WRKY转录因子可以通过多种途径接受抗病信号,从而调控下游抗病靶基因的表达。
棉花是一种重要的经济作物,属于人们种植的主要作物之一[16]。棉花纤维是纺织工业的重要原料,是支撑纺织工业发展和人们生活的基础;同时棉籽油是食品和化工用油的主要来源之一,棉籽粕是一种牛羊等反刍动物的蛋白饲料添加成分[17]。棉花稳产性是保障种植效益的首要因素,然而,由大丽轮枝菌(Verticillium dahliae)引起的棉花黄萎病是影响当前棉花稳产性的最重要因素之一,因此,如何提高棉花品种的抗病性是当今棉花育种的一个主要目标。有关棉花抗病WRKY转录因子的研究已经有一些报道,如GhWRKY3[18]、GhWRKY40[19]和 GhWRKY1[20]。然而,棉花有116个WRKY蛋白,参与棉花抗病反应的WRKY蛋白鉴定和其抗病反应的分子机制等有待于进一步研究。
本研究中,通过比对拟南芥中抗病相关的WRKY蛋白序列,分别在陆地棉中获得这些蛋白的直系同源基因,分析这些GhWRKY基因对大丽轮枝菌侵染时的表达响应。筛选出了对病原菌反应剧烈的GhWRKY22基因,并对其进行基因沉默(Knockdown)的研究。结果显示,GhWRKY22基因沉默的植株对大丽轮枝菌的抗性下降,同时抗病标记基因(Marker genes)PDF1.2、PR1、PR3、PR4、PR5和PAL等的表达分析结果表明,GhWRKY22通过水杨酸(SA)和茉莉酸(JA)信号途径参与大丽轮枝菌抗性反应。总之,GhWRKY22基因正调控棉花对黄萎病的抗性,可以作为棉花抗病候选基因用于棉花的抗病育种。
1 材料和方法
1.1 试验材料
陆地棉遗传标准系TM-1(Gossypium hirsutum acc. TM-1)以及棉花抗黄萎病品系BD18由山西省农业科学院棉花研究所罗晓丽研究员提供。
根癌农杆菌菌株 GV3101、大肠杆菌菌株 DH5α,均由中国科学院微生物研究所植物基因组国家重点实验室保存。
强致病力落叶型黄萎病菌菌株 V991 (Verticillium dahliae strain,V991),由中国农业科学院植物保护研究所简桂良研究员惠赠。
植物病毒诱导基因沉默(Virus induced gene silencing,VIGS)技术系统,包括干扰表达载体 pYL156以及辅助载体 pYL192由清华大学刘玉乐教授馈赠。
1.2 基因序列比对分析与进化树构建
根据文献报道从模式植物拟南芥中选取抗病相关的WRKY编码蛋白作为对象,在棉花数据库(https://www.cottongen.org)中进行Blast同源比对,获得了8个棉花直系同源WRKY编码蛋白,利用Clustalx 2.1软件进行氨基酸多重比对,并使用 MEGA 5.0邻接法生成系统进化树进行同源性分析。
1.3 棉花材料的培养
将干燥的硫酸脱绒种子在水中37 ℃浸泡过夜,移至培养盒中并在其上覆盖2~3 cm厚的灭菌湿润的蛭石,置于暗处,每天补充适量水分以保证种子正常萌发。大约3 d后,将长势一致的棉花幼苗移植到注满水的12孔水培盒中,放置于16 h光照/8 h黑暗、25 ℃、光强120 μmol/(m2·s)的培养箱中进行培养。每天定时观察适当加水确保棉苗正常生长,以备接菌和取样。
1.4 棉花根部RNA的提取及cDNA合成
剪取不同处理棉花样品,立即置于含液氮的研钵中迅速研磨成粉状,随后使用植物总RNA分离试剂盒(Sangon,上海)提取和纯化组织样品的总RNA,并用Nanodrop检测RNA样品的纯度与浓度,其后通过1.0% 的琼脂糖凝胶电泳检测总RNA 的完整性,选择纯度和完整性优良的RNA进行cDNA合成。按照试剂盒提供的方法,用EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix(Transgen Biotech,北京,中国)将1 μg RNA进行逆转录合成cDNA。反转录获得的cDNA稀释10倍置于-20 ℃冰箱保存。
1.5 基因片段克隆及载体构建
选取GhWRKY22基因特异的核苷酸序列设计引物,并分别在正向引物和反向引物前添加限制性内切酶BamHⅠ和KpnⅠ识别位点以及保护碱基(表1)。用TM-1遗传标准系陆地棉的cDNA为模板进行PCR扩增GhWRKY22基因,利用双酶切法将目的片段插入到植物病毒表达载体 pYL-156中;酶切和测序鉴定正确后命名为pYL-156-GW22。
1.6 农杆菌介导的VIGS植株培育
通过电击法分别将pYL-156-GW22、pYL-156-PDS(阳性对照载体)、pYL-156(空载体)和pYL-192辅助载体转化到农杆菌菌株GV3101中,PCR验证无误备用。
将上述农杆菌菌株在含有50 mg/mL卡那霉素、25 mg/mL利福平的液体LB培养基中于28 ℃,200 r/min培养过夜。菌液在室温下4 000 r/min离心7 min(Eppendorf 5810R,德国)收集农杆菌细胞。随后将沉淀的菌体重新悬浮于MMA(10 mmol/L MES,10 mmol/L MgCl2,200 mmol/L AS)溶液中,调节至终浓度OD600为1.0~1.2,将含有pYL-156-PDS、pYL-156-GW22和pYL-156(空载体)的农杆菌悬浮液分别与pYL-192等比例混合均匀,随后室温暗处孵育3 h备用。当BD18棉花2片子叶完全展开时,选取长势健壮一致的棉花幼苗进行农杆菌注射浸染。先用针头在子叶背面划出伤口,再用1 mL无针注射器将菌液从子叶背部伤口处注入,叶面浸染面积达90%以上为佳。侵染后的棉株室温避光12 h左右,随后移回光照培养箱中进行培养。
1.7 大丽轮枝菌活化和棉花接菌处理及其抗病性调查
将保存于-80 ℃的大丽轮枝菌菌株取适量均匀涂布于PDA培养基上,28 ℃暗培养3 d后,挑取菌块于100 mL查式培养液中,放置在28 ℃ 200 r/min摇床上培养,4~5 d后取出用8层医用纱布过滤菌丝,利用血球计数板计算孢子浓度,并用5%的蔗糖溶液调整其浓度为106 个/mL备用。
TM-1棉花接种大丽轮枝菌的方法参考文献[21]报道,简而言之,取长势一致并具有3片真叶的棉株,对其主根进行统一伤根处理,将棉花根部浸泡到上述准备好的菌液中,50 min后放回水培盒中并置于光照培养箱中培养。收取0,12,24,36,48,72,96 h等不同处理时间的根样品进行棉花WRKY基因表达分析。
为了观察棉花植株发病情况,根据范强等[22]报道,采用土培法对基因沉默BD18植株进行接菌,并在接菌21 d后,统计植株的发病棵数和发病程度,计算发病率和病指。参照Wang等[21]报道,进行大丽轮枝菌回复培养试验,简而言之:分别剪取对照组与试验组第一节间的茎段进行表面灭菌(浸泡在25%~50%的84消毒液中5 min)后横向切成小段,放置在PDA培养基上,25 ℃培养5 d后观察这些切断的大丽轮枝菌生长状况。
1.8 SA和JA处理
棉花幼苗具有2片真叶时,分别用茉莉酸甲酯(Methyl jasmonate,MeJA)和水杨酸(Salicylic acid,SA)进行激素诱导处理,具体方法参照先前报道的方法[23]。在激素处理0,0.5,1.0,3.0,6.0,12.0 h后分别取其根系,进行GhWRKY22基因诱导表达分析。
1.9 实时荧光定量PCR(qRT-PCR)分析
以不同棉花样本cDNA为模板和目的基因特异引物(表1)进行qRT-PCR分析,具体反应体系按照TransStart Top Green qPCR SuperMix试剂盒使用说明(Transgen Biotech Beijing,China)进行配置,以棉花持家基因UBQ7为内参基因。反应使用的是IQ5多色检测系统(Bio-Rad,Hercules,CA,USA),反应条件为 95 ℃ 5 min;95 ℃ 30 s,60 ℃ 20 s,72 ℃ 30 s,40个循环。数据处理采用2-ΔΔCt方法计算基因的相对表达量[24],试验重复3次。
表1 引物序列
Tab.1 Primer sequence

引物名称Name正向引物(5'-3')Forward primer sequence(5'-3')反向引物(5'-3')Reverse primer sequence(5'-3')GhWRKY7GGAAAGAAACGAATCGCCTCAACGGCGAGAGAATGAACGhWRKY33CATACGAGGGAAAGCACAATCCAGTTGCTGATGCTCGTTTGGhWRKY3GTGGAAAGAGCATCAGACGATGGTGAGTTGGAATCGGGATGhWRKY22CCAGAAGCCTTTCACTCCACTTTCAGCGAGTCCTTCTAAACCGhWRKY48GAAGGCAAACACACGCATCCATTAGCCTCGTTCCTCGTCTGhWRKY70CAAACAAGCACAGTGGTGTCTGCCAACACCACCCATCATTACATGhWRKY72GCTGCCATTTCATCATTGGGACGGCTGATTTGAACTTCCGhWRKY40CAGCAACAACAACAATGGGTAACAGGGCAACTTGGTGCpYL-156-GW22-1CGCGGATCCCTTCCCCAAATCTCAACCTCCGGGGTACCGTTTGACTGAGTCACCpYL-156-GW22-2GTCTCTCTTCAGATGTGTGGGCCGTTTGTGGAGTGAAAGGGhPR1GGGGCAGTGCTGACCTATCGTTAGCACAACCAAGATGGACAGAGTGhPR3GATGACTCCACAATCACCGAAGCGCGGTCTTCTACCTGGGCATTGhPR4GCCTATTGCTCAACTTGGGACAATCTGCTGGAACAAGGCTGhPR5CGACAACTCTGGCTCAGGAACCATCATCTGTAACTCGGCGGhPDF1.2CTGTGGTAGCGGATGGTGATAAGGTGCAGACGCATTTGCGAAGGAAGhPALCTGCTAAGGGTGGTGTCGTCGCCAATGACCTCCTGTACTCGGCUBQ7GAAGGCATTCCACCTGACCAACCTTGACCTTCTTCTTCTTGTGCTTG
2 结果与分析
2.1 生物信息学分析筛查棉花抗病相关WRKY基因
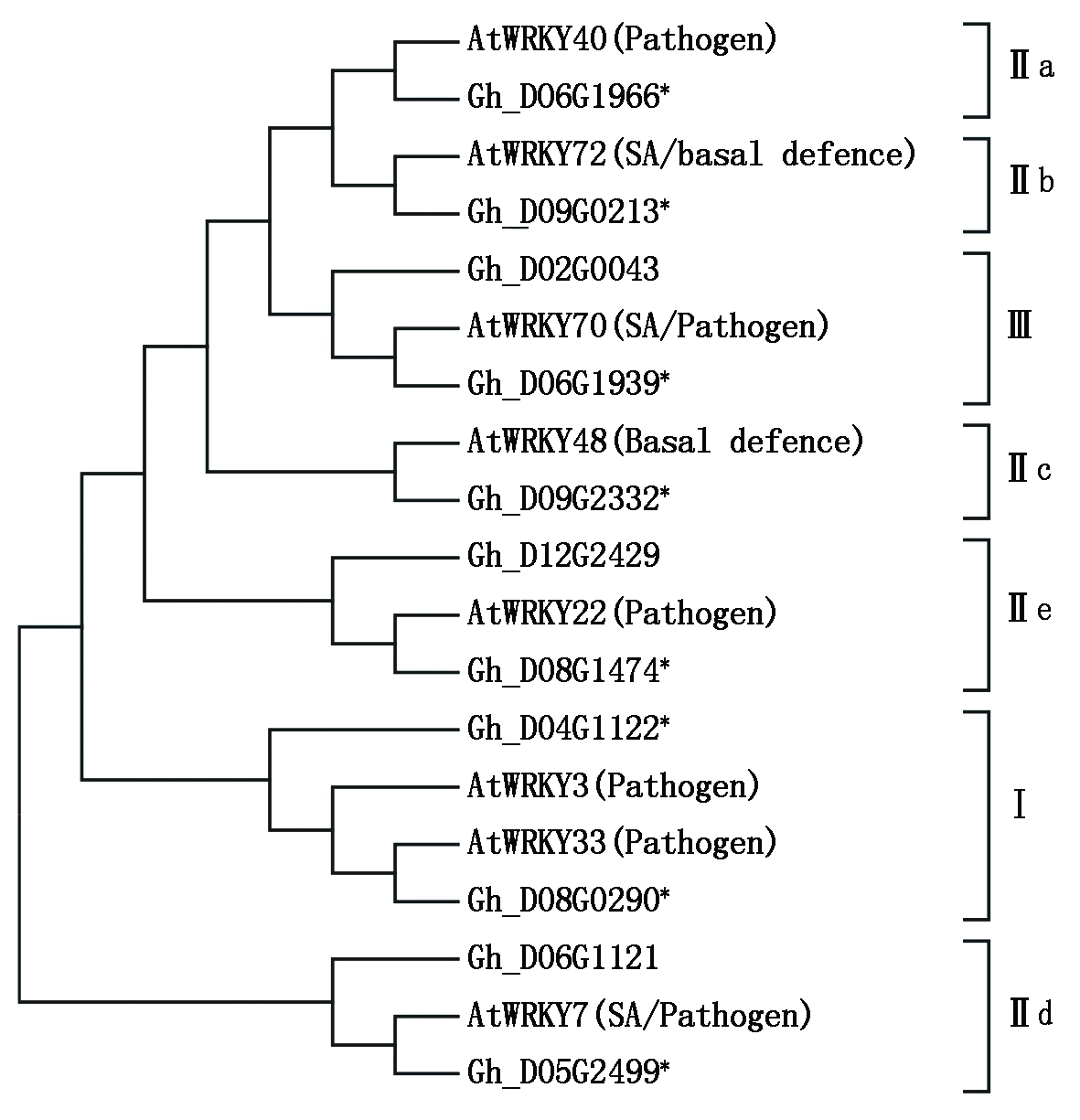
WRKY转录因子参与植物生长发育和抗性反应等一系列过程,能够调控多个生理途径基因表达。在拟南芥中,已经报道多个WRKY转录因子参与植株的抗病反应,主要包括WRKY7、33、3、22、48、70、72和40等(表2)。根据8个拟南芥WRKY抗病蛋白序列进行(直系)同源比对,在棉花基因组数据库中筛查到11个棉花WRKY转录因子,如图1所示,其中8个棉花WRKY转录因子分别与拟南芥的8个WRKY响应的聚合在一起,暗示它们可能是直系同源基因。这些抗病相关的WRKY转录因子分布在3个WRKY类型中,在Ⅱ型的5个亚类a、b、c、d和e中也分别存在,说明参与调控抗病反应的WRKY蛋白类型比较广泛。
表2 拟南芥抗病相关WRKY转录因子和其对应棉花直系同源基因
Tab.2 Defense related WRKY transcription factors in Arabidopsis and their orthologous genes in cotton
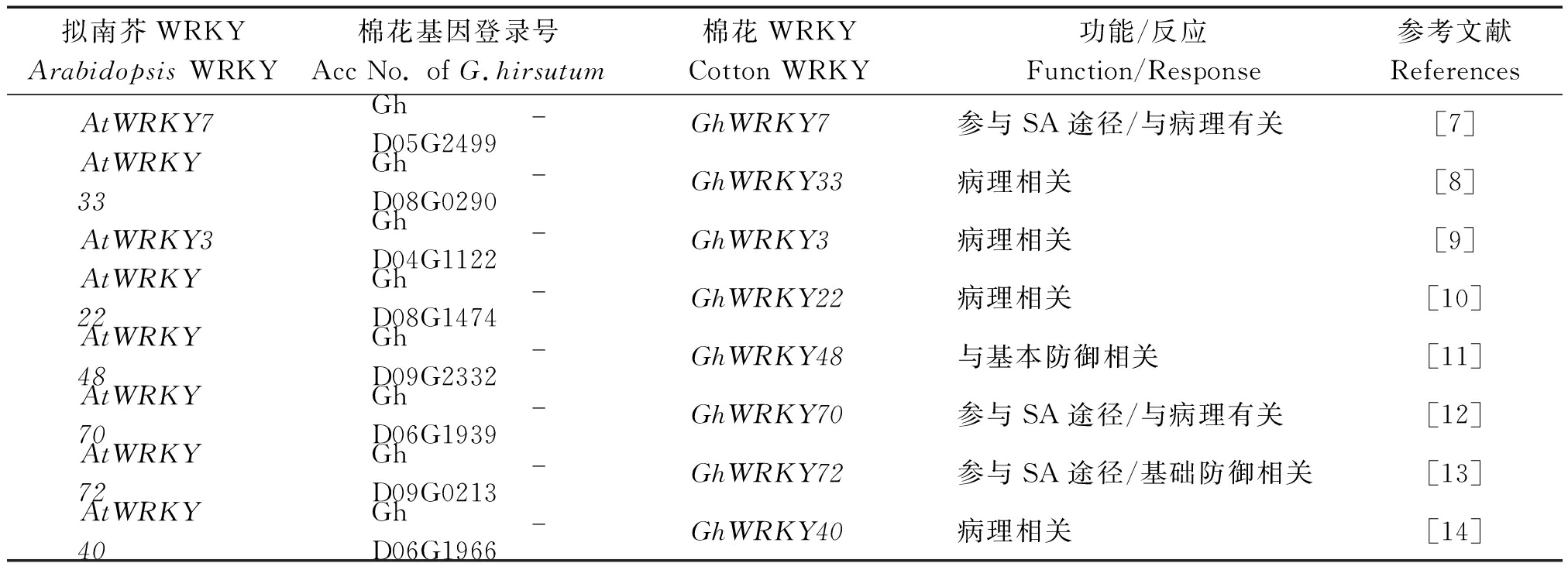
拟南芥WRKY Arabidopsis WRKY棉花基因登录号Acc No. of G.hirsutum棉花WRKYCotton WRKY功能/反应Function/Response参考文献ReferencesAtWRKY7Gh_D05G2499GhWRKY7参与SA途径/与病理有关[7]AtWRKY33Gh_D08G0290GhWRKY33病理相关[8]AtWRKY3Gh_D04G1122GhWRKY3病理相关[9]AtWRKY22Gh_D08G1474GhWRKY22病理相关[10]AtWRKY48Gh_D09G2332GhWRKY48与基本防御相关[11]AtWRKY70Gh_D06G1939GhWRKY70参与SA途径/与病理有关[12]AtWRKY72Gh_D09G0213GhWRKY72参与SA途径/基础防御相关[13]AtWRKY40Gh_D06G1966GhWRKY40病理相关[14]
2.2 棉花抗病相关WRKY基因在大丽轮枝菌侵染下的表达响应
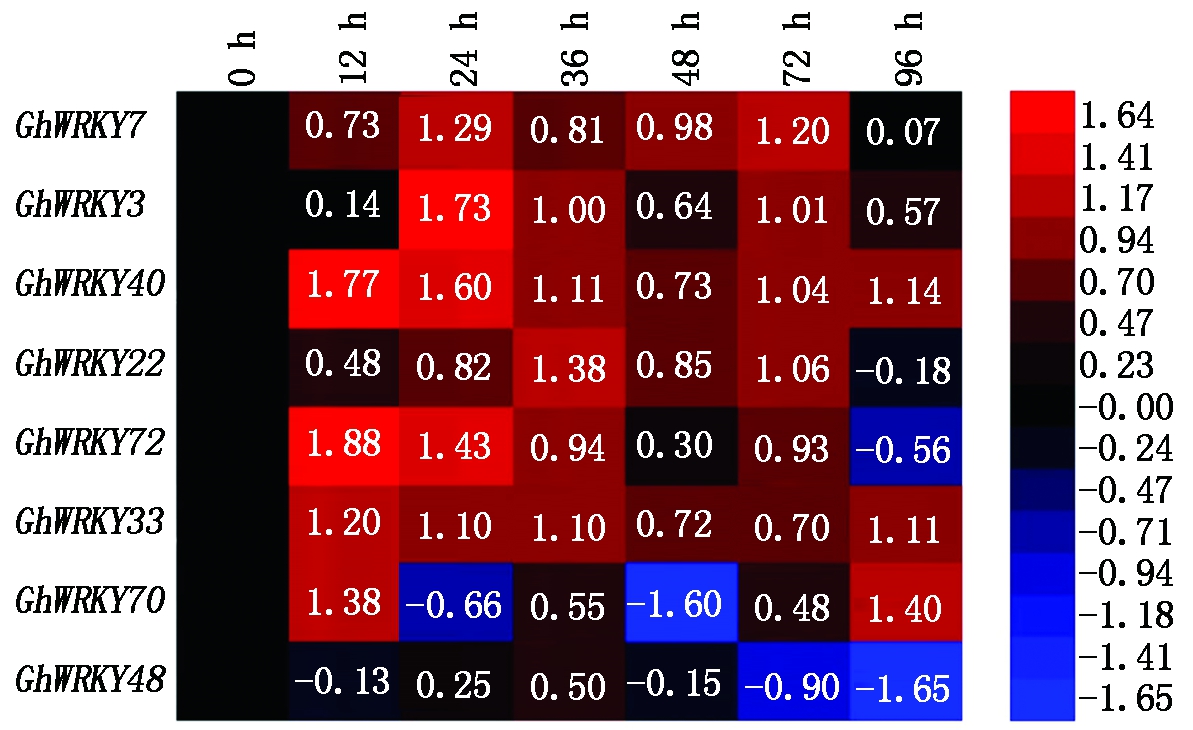
棉花黄萎病是棉花的主要病害,其病原菌为大丽轮枝菌,因此,这8个与拟南芥直系同源的棉花WRKY基因表达是否对大丽轮枝菌产生应答响应,是研究这些GhWRKY基因抗病功能的前提。在水培盒中培养21 d大小的棉花苗被用于接菌试验。接种大丽轮枝菌后0,12,24,36,48,72,96 h进行根部取样,通过qRT-PCR方法分析这8个GhWRKY基因的表达情况。相对于0 h对照,其中有6个GhWRKY基因的表达在72 h之前均受到大丽轮枝菌诱导上调,另外2个WRKY基因(GhWRKY48和GhWRKY70)表达变化比较复杂,GhWRKY48的表达量总体呈现下降趋势,而GhWRKY70表现为升-降-升的趋势。在图2中GhWRKY7、GhWRKY40、GhWRKY22、GhWRKY3和GhWRKY72等5个WRKY基因表达量在24 h左右和72 h分别表现为上调,呈现出双峰曲线,暗示这5个WRKY基因的表达量可能受到水杨酸(SA)和茉莉酸(JA)2种激素信号的调控[25]。而GhWRKY48在病原菌浸染下总的表现为下降趋势,说明这个GhWRKY基因是一个负调控抗病的转录因子。
2.3 GhWRKY22组织表达和植物激素诱导表达分析
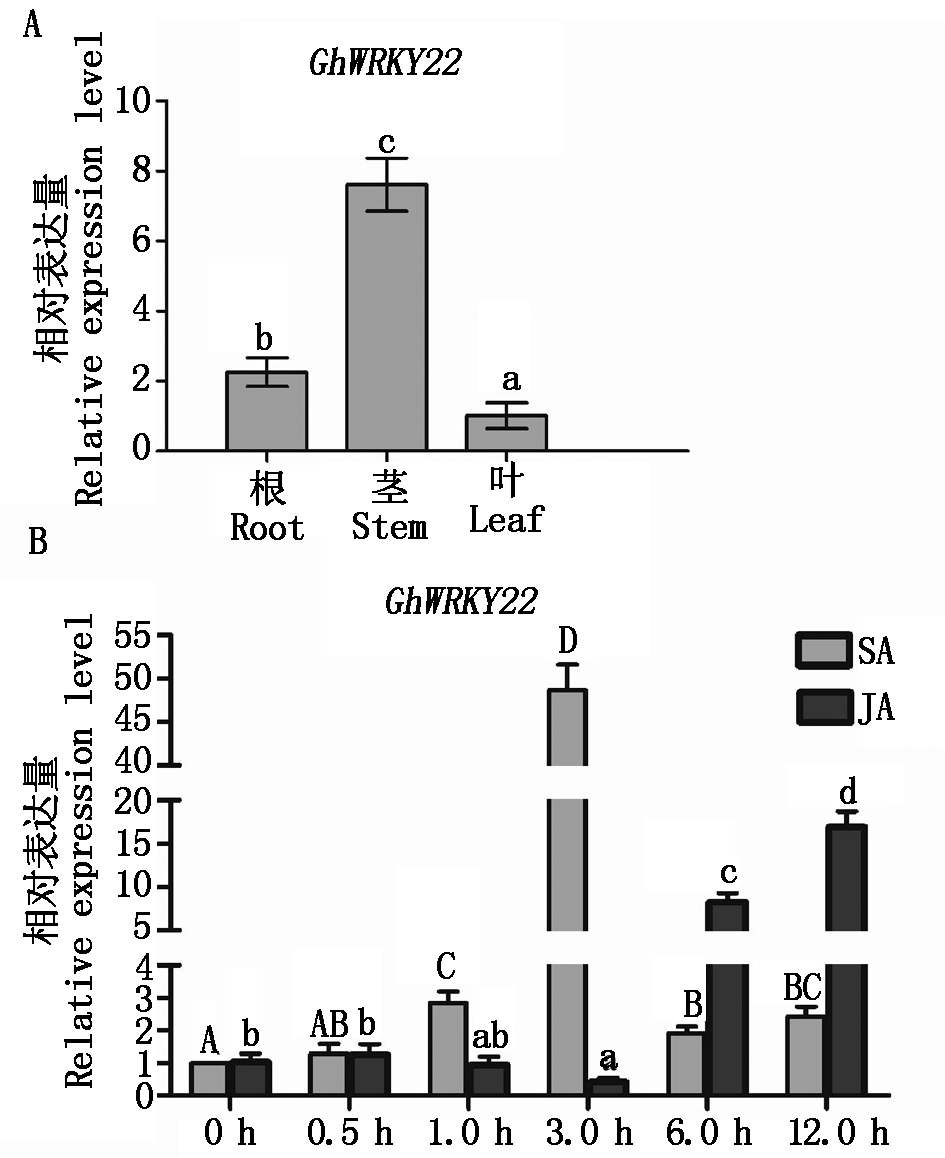
从上述正调控抗病的5个GhWRKY基因中,挑选GhWRKY22进行深入的抗病功能分析。利用qRT-PCR分析棉花根、茎和叶器官中GhWRKY22基因表达量,结果显示,该基因在棉花根、茎和叶中均有表达,但存在显著差异(图3-A),其在茎中表达量最高,在叶中表达量最低。在图2中已暗示GhWRKY22基因表达可能受到SA和JA抗病信号途径的影响,因此,分别外源使用这2种抗病相关激素处理棉花植株,然后检测GhWRKY22基因的表达情况。图3-B显示,在SA诱导3 h,GhWRKY22基因表达有了显著的升高;而在JA处理后6,12 h,该基因表达呈现显著上升。这些数据表明,GhWRKY22基因表达受到SA和JA信号途径的调控,从而参与棉花的抗病反应。
2.4 GhWRKY22基因沉默植株的培育
为了进一步分析GhWRKY22抗病功能,利用病毒诱导基因沉默(VIGS)技术来培育GhWRKY22基因沉默植株,分析GhWRKY22基因表达抑制时棉花植株的抗病性。首先,利用NCBI数据库分析比对设计GhWRKY22基因特异靶序列(图4-A、B)。利用BamHⅠ和KpnⅠ双酶切把这个序列插入到烟草脆裂病毒(TRV)载体pYL156中,GhWRKY22构建病毒诱导基因沉默载体pYL-156-GW22(图4-B)。
当棉花苗的2片子叶完全展开时,进行农杆菌注射浸染。空载体pYL156农杆菌作为浸染负对照,pYL156-PDS农杆菌浸染作为正对照,PDS基因被沉默的植株表现为叶片失绿,一般作为病毒诱导基因沉默的标记基因[22]。接种后的植株继续在培养箱中培养14 d左右,正对照植株呈现叶片失绿白化表型(图4-C),说明TRV系统在棉花中具有系统的感染,并能成功地进行基因表达沉默。此时,GhWRKY22基因沉默植株的幼嫩叶片被取样进行表达量分析。结果表明,GhWRKY22基因在沉默植株中平均表达量显著下降了60%左右(图4-D)。选择GhWRKY22基因表达沉默60%以上的10个植株接种大丽轮枝菌,分析这些沉默植株的抗病反应。
2.5 沉默WRKY22基因植株对大丽轮枝菌的抗性分析
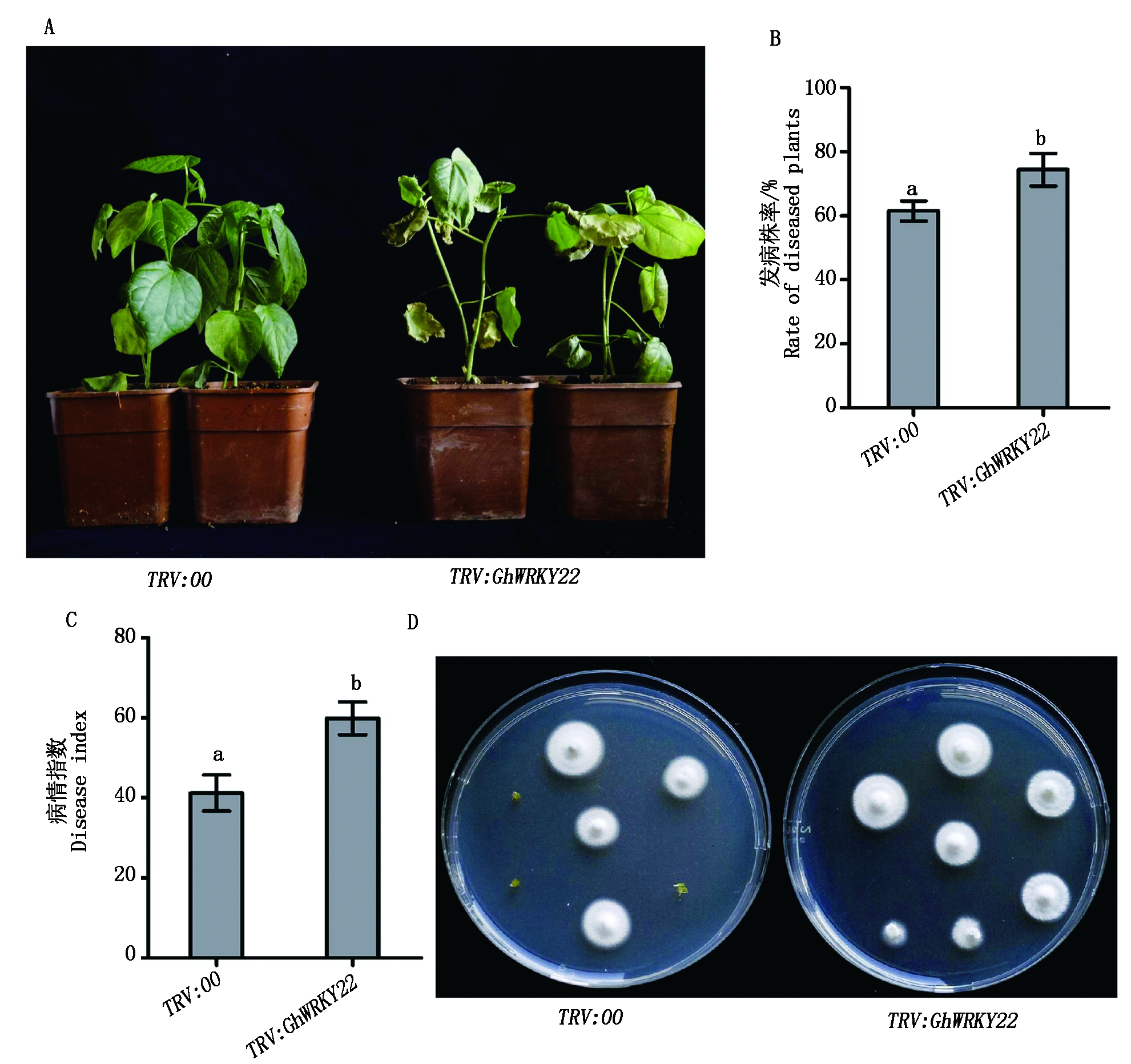
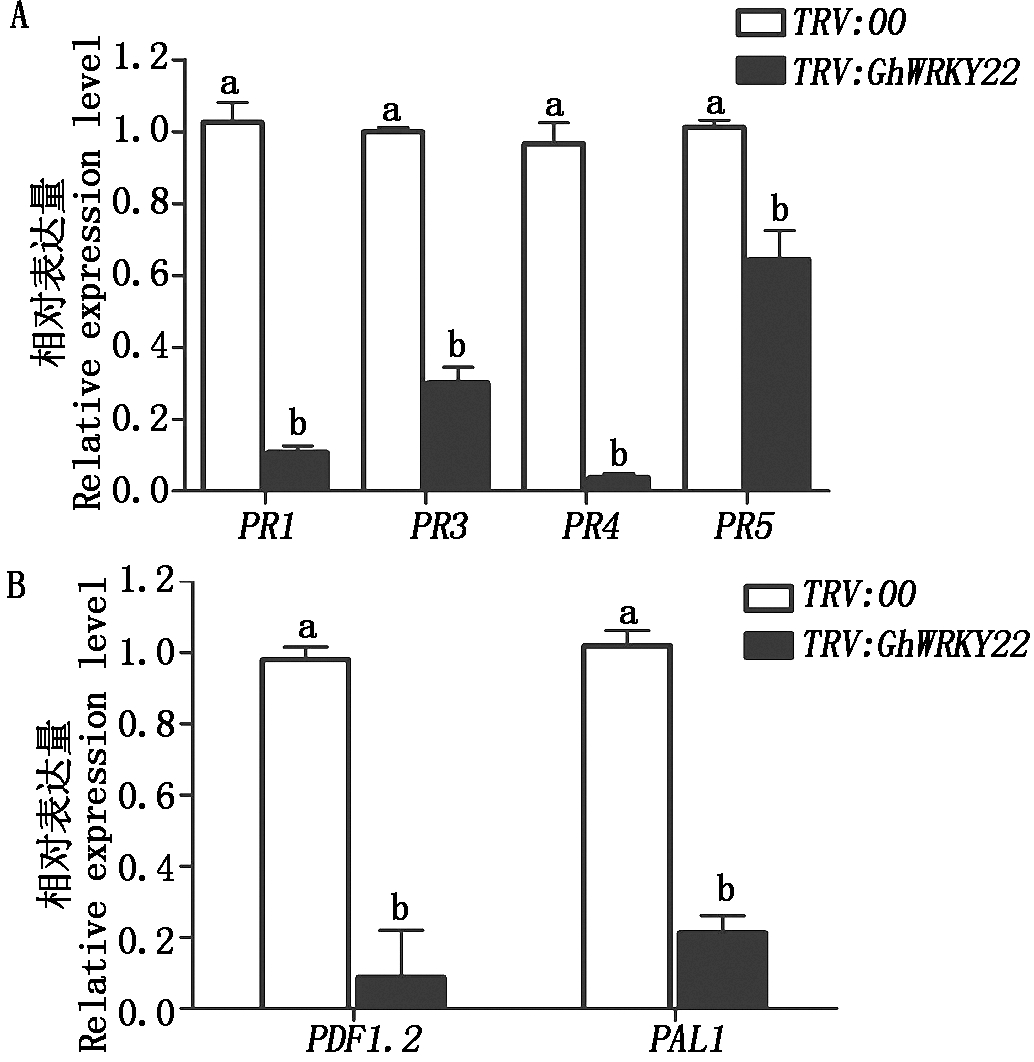
GhWRKY22沉默植株接种黄萎病菌21 d后,发现基因沉默植株表现为对病原菌侵染更敏感。相对于空载体沉默对照植株的发病症状,GhWRKY22沉默植株叶片黄色程度加重,落叶更多;GhWRKY22沉默植株的发病率和发病指数显著高于对照(图5-A-C),发病株率和病情指数分别比对照升高了18百分点,20%,这些数据表明了GhWRKY22基因正调控棉花的抗病反应。为了进一步分析GhWRKY22基因的抗病功能,接菌沉默植株中大丽轮枝菌菌丝生长情况也被检测。首先分析接菌植株主茎断面在培养基上病原菌回复情况,结果显示,GhWRKY22基因沉默植株的病原菌回复率明显高于对照(图5-D)。归纳这些试验结果,可以证明GhWRKY22基因参与棉花对黄萎病的抗性,并且正调控棉花的抗病性。
GhWRKY22基因表达受到SA和JA激素的诱导(图3),因此,GhWRKY22沉默植株对黄萎病的抗性下降,也可能涉及SA和JA信号途径中的基因调控。为了验证这个假设,利用qPCR技术分析SA和JA信号途径中抗病标志基因的表达情况。在GhWRKY22基因沉默植株和对照接种大丽轮枝菌21 d后,分析SA和JA抗病标志基因PR1、PR3、PR4、PR5、PAL1和PDF1.2表达水平。结果表明,基因沉默植株中6个抗病标志基因的表达量显著低于对照植株,其中PR4和PDF1.2的表达量下降最大,仅为对照的3.7%,8.7%。这些结果进一步表明GhWRKY22基因通过SA和JA信号途径参与棉花对大丽轮枝菌的抗性(图6)。
3 结论与讨论
植物WRKY基因参与一系列的生理生化过程,包括植物的生长发育和对外界环境的抗性。其中有许多WRKY蛋白参与植物对病原菌抗性,在模式植物拟南芥中已经报道了许多WRKY转录因子参与抗病反应。然而在棉花中只有少数几个WRKY蛋白被报道参与抗病反应,如GhWRKY3[18]、GhWRKY40[19]和 GhWRKY1[20]。相比较于拟南芥,棉花中肯定存在着其他没有鉴定的WRKY蛋白也参与抗病反应。因此,利用比较基因组方法,通过生物信息学技术鉴定了8个与拟南芥直系同源的GhWRKY基因,通过接菌诱导反应显示棉花中这8个WRKY基因均参与大丽轮枝菌的应答反应。并利用基因沉默技术证明了GhWRKY22参与棉花的抗病反应。
本研究结果显示,8个棉花WRKY基因的表达受到大丽轮枝菌的诱导,但是诱导表达的趋势不同,GhWRKY7、GhWRKY72、GhWRKY40等6个WRKY基因表达一直为上调,而GhWRKY48的表达表现为下调,GhWRKY70的表达比较复杂。在棉花中前人已经报道了3个抗病相关WRKY,包括GhWRKY3[18]、GhWRKY40[19]和 GbWRKY1[20]。Guo 等[18]报道了GhWRKY3表达受到多种激素诱导,同时也受到立枯丝核菌(Rhizoctonia solani)、棉花炭疽菌(Colletotrichum gossypii)和尖孢镰刀菌(Fusarium oxysporum)的诱导。在SA、MeJA和ET处理下,GhWRKY40基因表达上调,正调控茄科植物对雷尔氏菌(Ralstonia solanacearum)抗性[19]。Li等[20]研究结果显示海岛棉GbWRKY1通过JA信号途径介导棉花抗病和发育的转变,负调控棉花对灰葡萄孢菌(Botrytis cinerea)和大丽轮枝菌抗性。在本研究中的8个直系同源的抗病WRKY基因包含着GhWRKY3和GhWRKY40,都是正调控棉花黄萎病的抗性反应。另外,本研究中有6个WRKY基因正调控棉花大丽轮枝菌应答反应,但同时也存在负调控应答反应GhWRKY48。拟南芥中,利用突变体和过表达植株也证明了WRKY48负调控细菌基础抗性以及PR基因的表达[11];上面论述的海岛棉GhWRKY1也是一个抗病负调控因子;在番茄中,SlWRKY70的转录水平也表现为负调控植株对真菌的抗性[26]。因此,WRKY转录因子参与植物的抗病反应既可以是正向调控也可以是负向调控。
本研究表明,GhWRKY22基因受到大丽轮枝菌浸染的诱导,其表达量随着时间的变化呈现双峰形式的上调,利用VIGS技术确证了GhWRKY22正调控棉花对大丽轮枝菌的抗性。通过激素诱导GhWRKY22防御反应,发现其可能是受到JA和SA交叉信号转导途径的调控,是植物抗病反应中重要调控蛋白,有望成为一个新的棉花抗病育种的候选基因。Zhang等[27]也报道了一个棉花WRKY22基因的抗病功能,这个基因和本研究中的GhWRKY22基因是同源基因,不是拟南芥WRKY22的直系同源基因;然而有趣的是这2个基因都参与棉花对大丽轮枝菌的抗性,它们之间是否存在功能叠加或冗余现象有待深入的研究。在拟南芥中[10],通过野生型与突变体wrky22-1和wrky22-2在淹水处理下比较,发现WRKY22也具有较低的抗病性和先天性免疫特性。此外,Abbruscato等[28]在水稻也报道了OsWRKY22基因位于信号转导回路的交汇点,参与对稻瘟病的抗性。总之,GhWRK22是一个抗病正调控转录因子,可以作为抗病候选基因用于棉花的抗病品种培育。
参考文献:
[1] Peyraud R,Dubiella U,Barbacci A,et al. Advances on plant-pathogen interactions from molecular toward systems biology perspectives[J]. Plant Journal,2017,90(4):720-737.
[2] Dodds P N,Rathjen J P. Plant immunity:towards an integrated view of plant-pathogen interactions[J]. Nature Reviews Genetics,2010,11(8):539-548.
[3] Buscaill P,Rivas S. Transcriptional control of plant defence responses[J]. Current Opinion in Plant Biology,2014,20:35-46.
[4] Sarris P F,Duxbury Z,Huh S U,et al. A plant immune receptor detects pathogen effectors that target WRKY transcription factors[J]. Cell,2015,161(5):1089-1100.
[5] Yan Y,Jia H H,Wang F,et al. Overexpression of GhWRKY27a reduces tolerance to drought stress and resistance toRhizoctonia solani infection in transgenicNicotiana benthamiana[J]. Frontiers in Physiology,2015,6(265):265.
[6] Bakshi M,Oelmüller R. WRKY transcription factors[J]. Plant Signaling & Behavior,2014,9(2):e27700.
[7] Kim K C,Fan B F,Chen Z X. Pathogen-inducedArabidopsis WRKY7 is a transcriptional repressor and enhances plant susceptibility toPseudomonas syringae[J]. Plant Physiology,2006,142(3):1180-1192.
[8] Birkenbihl R P,Diezel C,Somssich I E.Arabidopsis WRKY33 is a key transcriptional regulator of hormonal and metabolic responses towardBotrytis cinerea infection[J]. Plant Physiology,2012,159(1):266-285.
[9] Lai Z,Vinod K,Zheng Z,et al. Roles ofArabidopsis WRKY3 and WRKY4 transcription factors in plant responses to pathogens[J]. BMC Plant Biology,2008,8:68.
[10] Hsu F C,Chou M Y,Chou S J,et al. Submergence confers immunity mediated by the WRKY22 transcription factor inArabidopsis[J]. Plant Cell,2013,25(7):2699-2713.
[11] Xing D H,Lai Z B,Zheng Z Y,et al. Stress-and pathogen-inducedArabidopsis WRKY48 is a transcriptional activator that represses plant basal defense[J]. Molecular Plant,2008,1(3):459-470.
[12] Li J,Zhong R S,Palva E T. WRKY70 and its homolog WRKY54 negatively modulate the cell wall-associated defenses to necrotrophic pathogens inArabidopsis[J]. PLoS One,2017,12(8):e0183731.
[13] Bhattarai K K,Atamian H S,Kaloshian I A. WRKY72-type transcription factors contribute to basal immunity in tomato andArabidopsis as well as gene-for-gene resistance mediated by the tomato R gene Mi-1[J]. Plant Journal,2010,63(2):229-240.
[14] Geilen K,Bohmer M. Dynamic subnuclear relocalisation of WRKY40 in response to Abscisic acid inArabidopsis thaliana [J]. Scientific Reports,2015,5:13369.
[15] Bakshi M,Oelmüller R. WRKY transcription factors:Jack of many trades in plants[J]. Plant Signaling & Behavior,2014,9(2):e27700.
[16] Hagenbucher S,Olson D M,Ruberson J R,et al. Resistance mechanisms against arthropod herbivores in cotton and their interactions with natural enemies[J]. Critical Reviews in Plant Sciences,2013,32(6):458-482.
[17] Sunilkumar G,Campbell L M,Puckhaber L A,et al. Engineering cottonseed for use in human nutrition by tissue-specific reduction of toxic gossypol[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(48):18054-18059.
[18] Guo R,Yu F,Gao Z,et al.GhWRKY3,a novel cotton (Gossypium hirsutum L.) WRKY gene,is involved in diverse stress responses[J]. Molecular Biology Reports,2011,38(1):49-58.
[19] Wang X,Yan Y,Li Y,et al. GhWRKY40,a multiple stress-responsive cotton WRKY gene,plays an important role in the wounding response and enhances susceptibility toRalstonia solanacearum infection in transgenicNicotiana benthamiana[J]. PLoS One,2014,9(4):e93577.
[20] Li C,He X,Luo X,et al. Cotton WRKY1 mediates the plant defense-to-development transition during infection of cotton byVerticillium dahliae by activating JASMONATE ZIM-DOMAIN1 expression[J]. Plant Physiology,2014,166(4):2179-2194.
[21] Wang L,Wu S M,Zhu Y E,et al. Functional characterization of a novel jasmonate ZIM-domain interactor (NINJA) from upland cotton (Gossypium hirsutum) [J]. Plant Physiology and Biochemistry,2017,112:152-160.
[22] 范 强,王 乐,谢彩玲,等. 棉花冠菌素不敏感因子GhCOI1基因分离和对大丽轮枝菌的抗性分析[J]. 华北农学报,2017,32(1):29-35.
[23] Sun L Q,Zhu L F,Xu L,et al. Cotton cytochrome P450 CYP82D regulates systemic cell death by modulating the octadecanoid pathway[J]. Nature Communications,2014,5:5372.
[24] Fu W J,Hu J B,Spencer T,et al. Statistical models in assessing fold change of gene expression in real-time RT-PCR experiments[J]. Computational Biology and Chemistry,2006,30(1):21-26.
[25] Peng X,Hu Y,Tang X,et al. Constitutive expression of riceWRKY30 gene increases the endogenous jasmonic acid accumulation,PR gene expression and resistance to fungal pathogens in rice[J]. Planta,2012,236(5):1485-1498.
[26] Atamian H S,Eulgem T,Kaloshian I. SlWRKY70 is required for Mi-1-mediated resistance to aphids and nematodes in tomato[J]. Planta,2012,235(2):299-309.
[27] Zhang W W,Zhang H C,Qi F J,et al. Generation of transcriptome profiling and gene functional analysis inGossypium hirsutum uponVerticillium dahliae infection[J]. Biochemical and Biophysical Research Communications,2016,473(4):879-885.
[28] Abbruscato P,Nepusz T,Mizzi L,et al.OsWRKY22,a monocot WRKY gene,plays a role in the resistance response to blast[J]. Molecular Plant Pathology,2012,13(8):828-841.
GhWRKY22 Isolation and Function Analysis in Cotton Resistance to Verticillium wilt
LEI Yu1,2,ZHANG Zhennan2,HU Guang2,LIU Jianfen1,2,TANG Ye2,ZHANG Ning1,SI Huaijun1,WU Jiahe1,2
(1.College of Life Science and Technology,Gansu Agricultural University,Lanzhou 730070,China;2.Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China;3.State Key Laboratory of Cotton Biology, Research Base of Zhengzhou University, Zhengzhou 450001, China)
Abstract:The development of plant disease-resistant cultivars by disease-resistant gene mining becomes a most available measure. The bioinformation,virus induced gene silencing,qPCR and fungus inoculation were employed to analyze cotton WRKY resistance toVerticillium dahliae. Eight cotton orthologous WRKY genes corresponding to 8Arabidopsis defense-related WRKYs was selected by phylogenetic tree analysis. And their expression was induced byV.dahliae infection,indicating that they participate in cotton defense to this fungus. Among these genes,six GhWRKYs showed up-regulation expression, and expression levels ofGhWRKY70 andGhWRKY48 exhibited up-or down-regulation over time. Five cotton WRKY genes including showed two expression peaks at 24,72 h after pathogen inoculation.GhWRKY22 gene was chosen for further charactering its function in cotton resistance toV.dahliae infestation.GhWRKY22 expressed predominantly in stem,and its expression level was obviously increased upon pathogen infestation and responded positively to the defense signaling molecules such as salicylic acid and jasmonic acid hormones. Knockdown ofGhWRKY22 gene increased susceptibility of plants toV.dahliae infection. Additionally,the expression level of defense marker genes,includingPR1,PR3,PR4,PR5,PAL andPDF1.2,significantly decreased inGhWRKY22-silenced plants compared to the control plants,which suggesed thatGhWRKY22 participates in cotton defense againstVerticillium wilt through SA and JA signaling pathways. Taken together,these results showed that 8 GhWRKYs were identified and characterized in regulation of resistance toV.dahliae. Among them,GhWRKY22 was a positive regulation component in cotton defense,which could be regarded as a candidate gene to breed plant defense cultivars.
Key words:Gossypium hirsutum L.; GhWRKY22; Disease-resistance;Verticillium dahliae; Gene silencing
中图分类号:Q78;S435.62
文献标识码:A
文章编号:1000-7091(2018)06-0160-09
doi:10.7668/hbnxb.2018.06.022
收稿日期:2018-07-20
基金项目:国家自然基金项目(31771848);棉花生物学国家重点实验室开放课题基金项目(CB2017B04)
作者简介:雷 煜(1991-),女,甘肃兰州人,在读硕士,主要从事生物化学与分子生物学研究。
通讯作者:吴家和(1968-),男,安徽合肥人,研究员,博士,博士生导师,主要从事分子生物学研究。