不同字母表示处理间差异显著(P<0.05)。图3-5同。
Different letters indicate significant difference among different treatments atP<0.05 .The same as Fig.3-5.
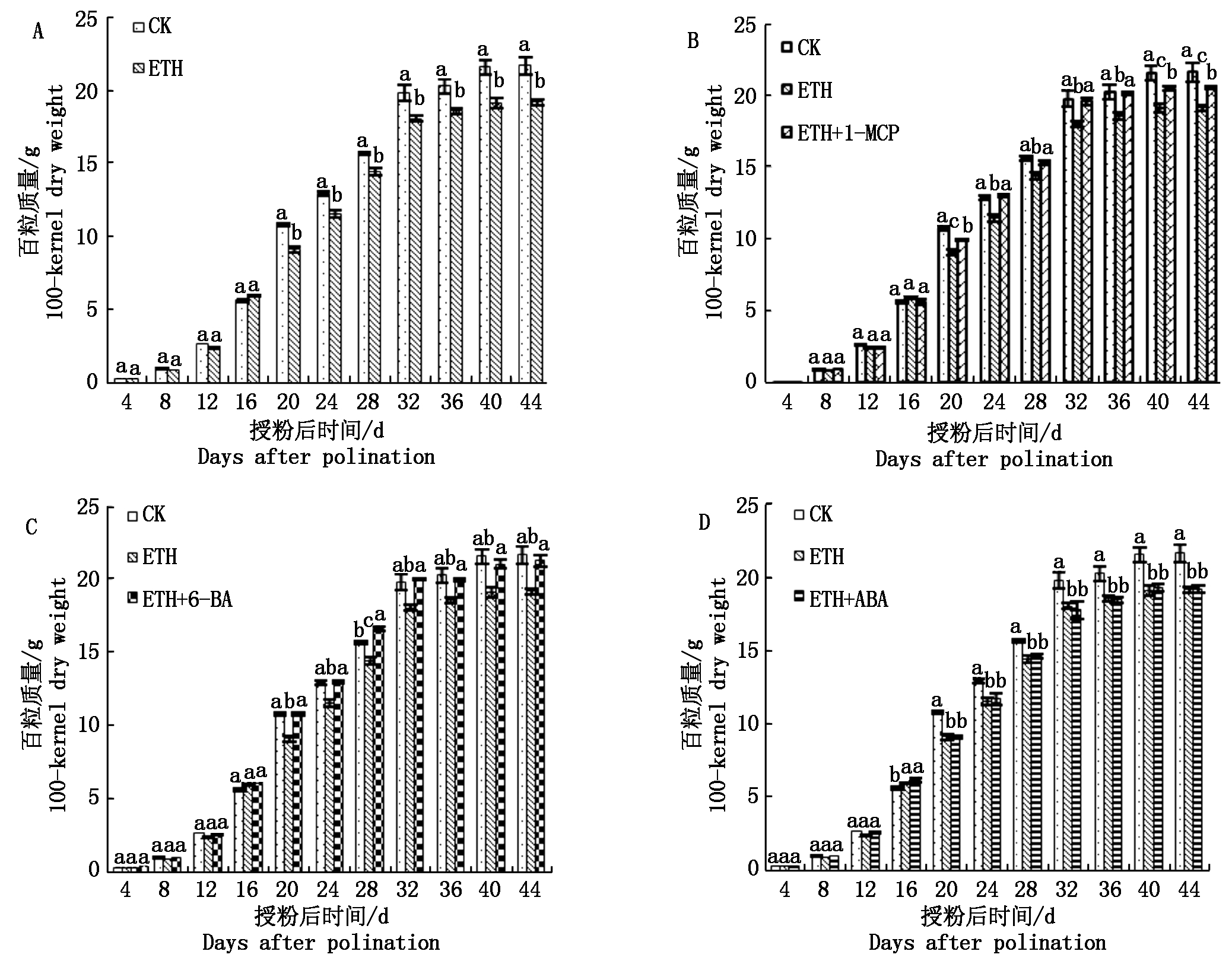
图1 调节剂处理对玉米百粒质量的影响
Fig.1 Effect of plant growth regulators on maize 100-kernel dry weight
乙烯利是大田作物常用调节剂,在玉米营养生长时期喷施乙烯利能够降低株高、穗位高和倒伏率[1-2]。许多研究结果显示,喷施乙烯利在降低玉米株高的同时会导致产量的下降[3-5]。Kasele等[4]研究了在干旱条件下玉米喷施乙烯利之后对玉米产量的影响,发现在低种植密度(24 700株/hm2)下的玉米籽粒产量随着乙烯利浓度的升高(从280 g/hm2提高到560 g/hm2)下降非常显著(从2.92 mg/hm2下降到2.34 mg/hm2)。Langan等[5]研究发现,使用乙烯利之后玉米在连续2年中倒伏率分别降低85%,93%,产量分别下降6%,2%。在小麦和大麦以及其他作物的研究中也发现类似的情况[6-7]。Tripathi等[6]研究发现,喷施乙烯利之后,小麦的株高降低,倒伏率下降,产量下降8.3%。由此可见,乙烯利对降低株高和产量的影响是非常普遍的。
针对乙烯利能够降低株高的显著效果以及其在玉米产量上存在的问题,生产上推出了以乙烯利为主的复配植物生长调节剂如玉米壮丰灵[8]、玉米健壮素[9]、玉黄金(27%乙烯利+3%胺鲜酯)[10],但是由于这类复配剂存在应用窗口期短、后期操作困难、效果不稳定等问题,影响产品的推广。对壮丰灵的研究结果显示,在吉林省种植玉米喷施壮丰灵的最佳时间是7月5-10日,过早或者过晚都会影响其效果[8]。玉黄金在玉米的4展叶+10展叶以及6展叶+10展叶时期同时喷施则会提高玉米的产量而单独在4展叶、6展叶或者10展叶时期喷施都会导致减产[10]。因此,研究乙烯利影响籽粒发育及产量的生理机制,可为形成方便、有效、广谱的以乙烯利为主的玉米调节技术提供理论依据。
玉米籽粒发育过程是库建成和物质积累的过程,形成足够的籽粒库容是提高粒质量的基础,也是产量的主要影响因素之一[11-13]。籽粒库容可表示为单位面积穗数×穗粒数×单粒体积,单粒体积由籽粒中胚乳细胞、淀粉粒的数目和大小决定[11]。胚乳细胞大小、数目以及淀粉粒的数目是评价籽粒充实程度的一个重要指标[14-15]。玉米的库容量在理想环境下是由遗传决定的,但是在田间环境下库容的大小受环境如水分亏缺[16]、热胁迫[17]影响显著,进而对产量造成影响。Reddy等[18]通过研究籽粒大小与胚乳细胞数量和淀粉颗粒之间的关系发现淀粉粒的数目比胚乳细胞的数目对籽粒的发育和干质量的影响更大。因而,胚乳细胞的数目以及淀粉粒的数目和大小可以影响库容的大小进而影响籽粒的灌浆过程,最终影响籽粒干物质的积累。
本研究以玉米自交系B73为试验材料,在拔节期用乙烯利处理,研究乙烯利对库容和物质积累的影响,并比较吐丝期喷施1-MCP、6-BA和ABA结合拔节期乙烯利处理对玉米籽粒灌浆速率、胚乳细胞及淀粉粒发育的影响,以期为乙烯利影响玉米籽粒发育机制和乙烯利复合调节剂的应用提供参考。
供试材料为玉米自交系B73,生育期130~135 d,植株高度210 cm,穗位80 cm,叶片平直,叶片数21片左右。籽粒半马齿型,籽粒黄色,长楔形。
试验在中国农业大学上庄实验站进行,共设5个处理,每个处理3次重复,小区面积50 m2。于2017年5月5日播种,按450 kg/hm2用量施用复合肥作基肥,小口期追施尿素375 kg/hm2,其他正常田间管理,进行人工授粉。处理A:对照组(CK),拔节期(以下同时间)喷施清水+吐丝期喷施清水;处理B:拔节期整株喷施600 mg/L乙烯利(ETH)+吐丝期喷施清水;处理C:拔节期喷施600 mg/L乙烯利(ETH)+吐丝期喷施8 mg/L 1-MCP;处理D:拔节期喷施600 mg/L乙烯利(ETH)+吐丝期喷施60 mg/L 6-BA;处理E:拔节期喷施600 mg/L乙烯利(ETH)+吐丝期喷施25 μmol/L ABA。
1.3.1 取样方法 分别于授粉后4(DAP 4),8,12,16,20,24,28,32,36,40,44 d选取植株长势一致、穗长发育情况一致的玉米雌穗,取样位于雌穗下部约1/3处,剥取籽粒,备用。
1.3.2 籽粒干质量以及灌浆速率 从穗部取下的籽粒直接称取鲜质量后,将籽粒置于80 ℃烘箱,待籽粒质量恒定之后称取籽粒的干质量。籽粒灌浆速率=(后一次取样百粒干质量-前一次取样百粒干质量)/取样间隔。进行3次生物学重复。
1.3.3 胚乳细胞数目的计数及面积的统计 胚乳细胞的分离和计数:参考Singh等[19-20]的方法,并有所改进。在授粉后8,12,16 d,从各处理组的果穗下部1/3处取籽粒,每个处理组各取来自6个不同果穗的10粒籽粒备用,FAA(福尔马林∶冰醋酸∶乙醇=5∶5∶90,V/V/V)固定液抽气固定,测定时用蒸馏水浸泡24 h,剥去胚和种皮,用5 mL蒸馏水清洗3次,加入5 mL的翰生(Hansen)氏苏木精染色液,染色24 h。蒸馏水中分色至澄清。加入5 mL 0.1%的纤维素酶液(用磷酸-柠檬酸缓冲液 pH值5.0配置),在40 ℃下振荡4~6 h,使胚乳细胞离解充分。通过细胞计数板计数胚乳细胞数。
胚乳细胞面积的统计:随机取授粉后36 d籽粒10粒,制作石蜡切片,I2染色后取籽粒中部1/2处从糊粉层细胞向内第8至第10层的淀粉质胚乳细胞用于分析。用OLYMPUS-UB100i显微镜进行拍照,细胞面积用MOTIC软件进行测量统计。
1.3.4 淀粉粒的计数 在玉米授粉后灌浆前期12 d(此时淀粉粒数目不断增加、体积不断增大)和灌浆后期36 d(淀粉粒数目不再增加,淀粉粒体积增大不明显),取各处理组中玉米穗下部1/3处籽粒10粒,制作石蜡切片并用PAS(Periodic Acid-Schiff stain)染色,切片位置为籽粒的居中纵切,用OLYMPUS-UB100i显微镜进行拍照。计数不同籽粒的相同位置共计120个细胞(每个籽粒统计12个胚乳细胞),记录胚乳细胞内淀粉粒数目,并测量胚乳细胞面积。进行3次生物学重复。
1.3.5 淀粉粒的提取及分析 淀粉粒的提取方法参照Yang等[21]。取各处理组中授粉后12,36 d的胚乳,在40 mL 0.1 mol/L NaCl溶液中分散过夜。用磨样机将样品研磨充分后,将混合物用直径为74 μm的滤网过滤,滤液室温下10 000 r/min离心10 min。沉淀依次用2 mol/L NaCl 10 mL、2% (m/V) SDS 10 mL和0.2 mol /L NaOH 10 mL洗脱,10 000 r/min离心10 min,重复3次。加入10 mL丙酮,弃去有机层并风干。进行3次生物学重复。淀粉粒的粒度分析采用马尔文Master-sizer Hydro 2000进行。淀粉粒的检测用水作为分散剂,采用仪器本身携带的软件输出试验结果。
1.3.6 数据分析 采用SPSS 19.0进行数据分析,并用Excel 2010软件进行作图,采用Duncan法进行显著性检验(P<0.05)。
在籽粒形成期,玉米百粒质量在各个处理组中差异不显著(图1-A)。随着灌浆时间的延长,逐渐表现出差异显著性。在DAP 20,与CK相比处理B的百粒质量下降显著,约下降15.4%。在灌浆末期DAP 44,处理B与CK相比百粒质量下降约11.3%(图1-A)。处理C的百粒质量在DAP 44与对照相比下降约4.8%,表现出差异显著性,并且显著高于乙烯利处理(图1-B)。这说明乙烯受体抑制剂1-MCP可以促进籽粒干物质的积累,可以在一定程度上补偿乙烯利造成的产量下降。在DAP 44,处理D籽粒百粒质量与CK相比差异不大(图1-C),并且显著高于乙烯利处理,说明6-BA可以弥补乙烯利导致的籽粒干质量的下降。由图1-D可知,处理E的百粒质量与处理B在整个灌浆过程中均没有表现出显著差异,这说明ABA不能提高或者恢复乙烯利造成的产量的下降,与乙烯利处理玉米百粒质量差异不大。总体看来,6-BA的使用对改善前期乙烯利处理对百粒质量造成的下降有显著作用,1-MCP处理对改善前期乙烯利处理造成的百粒质量的下降有一定的效果,ABA处理则影响不显著。

不同字母表示处理间差异显著(P<0.05)。图3-5同。
Different letters indicate significant difference among different treatments atP<0.05 .The same as Fig.3-5.
图1 调节剂处理对玉米百粒质量的影响
Fig.1 Effect of plant growth regulators on maize 100-kernel dry weight
从整个发育期来看,玉米灌浆速率在各个处理组中变化趋势基本一致,均为双峰曲线。在DAP 20籽粒灌浆速率达到第1个峰值,处理B与CK灌浆速率呈显著差异性,处理B的灌浆速率与CK相比下降约17.7%;在DAP 32,籽粒灌浆速率达到第2个峰值,处理B的灌浆速率与CK相比下降约24.3%,同样显著低于CK(图2-A)。在DAP 20,处理C中灌浆速率与CK无显著差异,在DAP 24显著高于CK,而在DAP 32显著低于CK(图2-B)。处理D的灌浆速率在DAP 16和DAP 20与处理B差异不显著,与CK差异显著;在DAP 24和DAP 28灌浆速率显著高于CK和处理B;在DAP 32则显著低于CK(图2-C)。处理E的灌浆速率与CK相比波动较大,处理E灌浆速率的第2个峰值出现在DAP 28,而CK出现在DAP 32,这说明ABA处理之后灌浆时间有可能缩短(图2-D)。
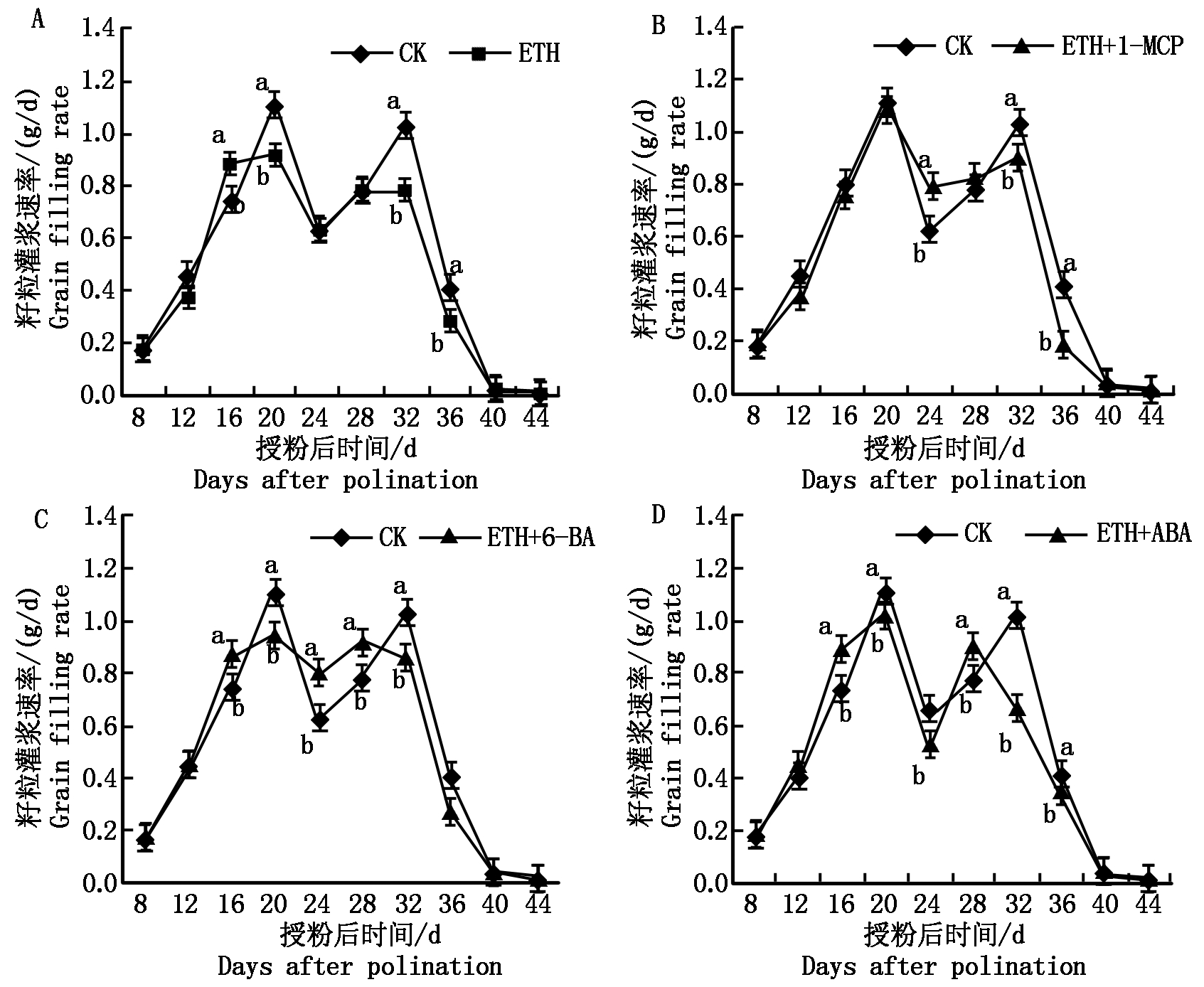
图2 调节剂处理对玉米籽粒灌浆速率的影响
Fig.2 Effect of plant growth regulators on maize grain filling rate
由图3-A可知,在DAP 8,处理D与CK差异不显著,处理B与处理C无显著差异同时均显著低于CK和处理D。在DAP 12,处理B与CK相比胚乳细胞数目显著下降约22.9%;处理C的胚乳细胞数目显著高于处理B同时显著低于CK,与处理B相比高约20.9%,与CK相比低约12.8%。在DAP 12,处理D的胚乳细胞数目与CK差异不显著。在DAP 12,处理E中胚乳细胞数目与处理B差异不显著,同时显著低于CK、处理C以及处理D。在DAP 16,各处理组中的胚乳细胞数目与DAP 12时的胚乳细胞数目相比差异不大。
在授粉后36 d,从整体来看,各个处理组中胚乳细胞面积多集中在0.25×104~3.25×104 μm2。由图3-B可知,处理B中在Ⅳ范围内的胚乳细胞数目所占百分数显著高于CK,而在Ⅵ范围内的胚乳细胞数目所占百分比显著低于CK。处理C中在Ⅳ范围内的胚乳细胞数目所占百分比显著高于CK同时与处理B无显著差异,处理C中在Ⅴ范围内的胚乳细胞数目所占百分比显著高于CK与处理B,在Ⅵ范围内的胚乳细胞数目所占百分比显著低于CK而高于处理B。处理D的胚乳细胞数目所占百分比在Ⅳ、Ⅴ范围内的均显著高于CK,与CK相比分别高约27.8%和19.3%,而在Ⅵ范围内低于CK约61.9%。处理E在Ⅳ、Ⅴ、Ⅵ范围内的胚乳细胞数目所占百分比与处理B无显著差异(图3-B)。
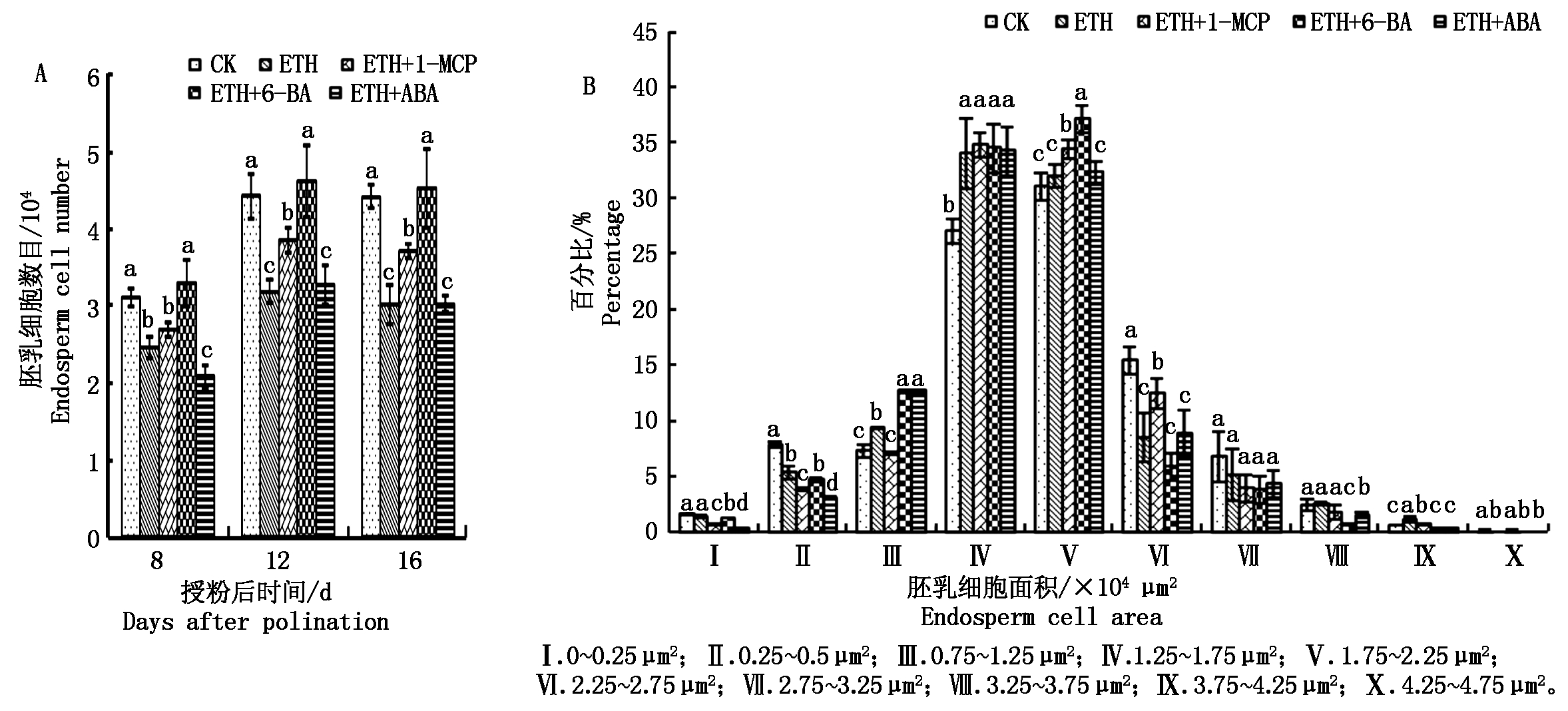
图3 胚乳细胞数目以及面积所占百分比
Fig.3 Endosperm cell number and the percentage of endosperm cell area
由图4-A可知,在DAP 12,胚乳细胞内淀粉粒数目较少。在Ⅱ、Ⅳ、Ⅴ和Ⅵ范围内,CK、处理C以及处理D的淀粉粒数目无显著差异并且均显著高于处理B和处理E,同时,处理B和处理E之间没有显著差异。在DAP 36,胚乳细胞面积多集中在1.25×104~2.75×104μm2(图3-B),这个范围里细胞内的淀粉粒的数目基本决定整个胚乳的淀粉粒数目。在Ⅳ、Ⅴ和Ⅵ范围内的淀粉粒数目在CK、处理C和处理D之间无显著差异,均显著高于处理B和处理E(图4-B)。在处理B、处理D和处理E中,没有检测到在X范围内的胚乳细胞,加之该范围内细胞比例很小,对总淀粉粒数目影响不显著。
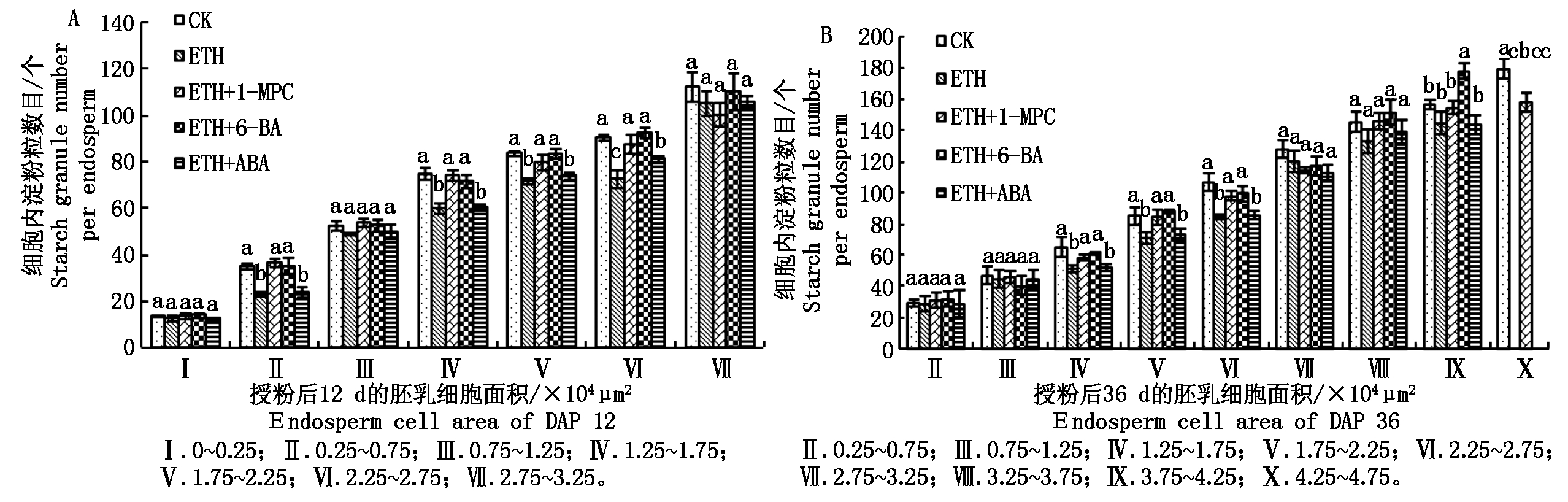
图4 胚乳细胞面积与淀粉粒的关系
Fig.4 The relationship of endosperm cell number area and starch granule number
淀粉粒的直径分布范围如图5所示,在DAP 12,淀粉粒直径范围分布较小,多集中在2.89~7.59 μm,CK中在K范围的淀粉粒数目所占百分比最高,处理B在I范围的淀粉粒数目所占百分比最高。在E、F、G、H范围内处理B的淀粉粒数目所占百分比显著高于CK,但是在J、K、L范围内的淀粉粒数目所占百分比显著低于CK,这说明CK的平均淀粉直径显著大于处理B(图5-A)。在处理C和处理D中,淀粉粒在不同粒径范围下的数目所占百分比与CK差异不大。处理E淀粉粒直径在F~L范围内的数目所占百分比与处理B差异不显著,且在K、L范围内的淀粉粒数目所占百分比显著低于CK,特别是在L范围内处理E的淀粉粒数目所占百分比与对照相比下降约75.8%,这说明后期ABA处理不能恢复乙烯利对淀粉粒直径造成的改变(图5-A)。
在DAP 36,CK在R范围的淀粉粒数目所占百分比最高,处理B在M范围的淀粉粒数目所占百分比最高(图5-B)。处理B中淀粉粒数目所占百分比在C~M范围内均显著高于CK,在P~V范围内的百分比显著低于CK,特别是在M范围的所占百分比高于CK约46.3%,在R范围的所占百分比低于CK约61.2%(图5-B)。处理C在L、M范围内淀粉粒数目所占百分比显著高于CK,在R、S的淀粉粒数目所占百分比显著低于CK。处理D在C~S直径范围内淀粉粒数目所占百分比与CK差异不显著。处理E在C~M直径范围内淀粉粒数目所占百分比与处理B无显著差异(图5-B)。

图5 不同授粉时期淀粉粒直径分布
Fig.5 Starch granule diameter distribution in different stages after pollination
库容的大小会直接影响籽粒的灌浆过程进而影响产量,库的减小会导致蔗糖运输速率减弱或者库拉力降低,因此,形成足够的籽粒库容是提高粒质量的基础,而库容的大小是由籽粒中胚乳细胞数目、淀粉粒的数目和大小决定[22-24]。本研究通过探讨乙烯利对库容的影响以及搭配使用调节剂对库容的改善情况进行了研究。结果发现,与CK相比乙烯利处理之后在DAP 20时百粒质量下降约15.4%,灌浆速率下降17.7%。通过对库容大小进行分析发现,乙烯利处理之后胚乳细胞数目显著下降约22.9%,淀粉粒数目在胚乳细胞面积为1.25~2.75 μm2也显著低于CK。另外,通过对淀粉粒的大小进行分析,发现淀粉粒在DAP 36,乙烯利处理组在直径为11.49~30.21 μm的淀粉粒数目显著低于CK,这些试验结果表明乙烯利处理之后,显著降低了库容的大小。通过搭配使用不同调节剂之后发现,6-BA对乙烯利造成的影响恢复效果最好,乙烯利和6-BA搭配使用与CK相比胚乳细胞数目、淀粉粒数目、大小差异不显著,这说明乙烯利与6-BA搭配使用基本可以恢复乙烯利对库容造成的不利影响。乙烯利与1-MCP搭配使用之后,对籽粒百粒质量、灌浆速率与乙烯利单独使用相比有一定程度的提高,但是低于CK,并且两者搭配使用之后胚乳细胞内淀粉粒数目、淀粉粒大小也有一定程度的恢复,这说明1-MCP可以部分弥补乙烯利对库容造成的不利影响。另外,乙烯利与ABA搭配使用之后,对库容的影响与乙烯利单独使用的差别不大,表明ABA不能恢复乙烯利对玉米库容造成的下降。
1-MCP处理之后胚乳细胞的数目与乙烯利处理之后相比有一定程度的改善,同时胚乳细胞的面积、淀粉粒数目以及淀粉粒的直径分布有显著提高。这一结果与Panda等[25]研究结果有一定的相似之处。本研究结果显示乙烯利与1-MCP的搭配使用并不能带来胚乳细胞数目的恢复,究其原因,可能是前期乙烯利的喷施在一定程度上抑制了与细胞分裂相关的信号通路,而1-MCP的添加并未完全启动该信号通路。然而,其内源乙烯含量却会下降,可能促进与淀粉相关酶类活性进而导致了淀粉合成过程的加强,在一定程度上促进了淀粉粒的积累。
6-BA对于胚乳细胞分裂的促进作用在许多研究中都有报道[26],并且许多研究认为细胞分裂素在玉米灌浆前中期对籽粒的灌浆速率和粒质量都有显著的影响,并且推测6-BA可以通过增加库容来影响产量[26-27]。在本研究中,胚乳细胞数目在乙烯利处理之后显著下降,但是吐丝期喷施6-BA之后胚乳细胞数目有了显著的提高,且与对照组差异不显著。6-BA处理之后胚乳细胞的面积也有较大的增加,并且籽粒的灌浆速率与乙烯利处理组相比也有显著的提高。根据以上试验结果,推测6-BA通过增加胚乳细胞的数目以及细胞的面积扩大了库的容积,增加了库的拉力,进而导致籽粒灌浆速率的提高和最终产量的增加。
此外,乙烯与ABA对胚乳细胞程序性死亡的影响也有较多的报道[28]。玉米中胚乳细胞的程序性死亡起始于约授粉后16 d,并且乙烯参与该过程[29]。外源施加1-MCP与AVG都降低了细胞程序性死亡以及DNA的断裂[30],而细胞的程序性死亡过程与淀粉合成相关酶的活性直接相关。另外,本研究采用自交系B73为试验材料,由于B73已经完成测序工作,使用B73作为试验材料有利于从分子生物学角度深入研究乙烯利与其他调节剂搭配使用对籽粒发育的影响,其对不同调节剂的响应与杂交种是否完全一致,还不是特别清楚。后续试验将在探索乙烯利以及其他调节剂搭配使用对B73籽粒发育分子机制的探索以及对杂交种的影响方面展开工作。
乙烯利处理之后,B73玉米籽粒灌浆过程、胚乳细胞数目以及面积、淀粉粒径分布、淀粉粒的大小等都受到显著影响。乙烯利在拔节期喷施之后并在吐丝期喷施一定浓度的6-BA可以促进胚乳细胞的分裂以及淀粉粒的积累,进而增加库容,增加灌浆速率与粒质量。在乙烯利处理之后再施用1-MCP处理玉米,对细胞数目的变化与单独用乙烯利处理差异不显著,但是可以在一定程度上增加细胞的面积以及淀粉粒的数目,因而也表现出粒质量与乙烯利处理组相比显著提高的情况。在乙烯利处理之后吐丝期用ABA处理的玉米籽粒在灌浆前期表现出与乙烯利处理组的显著差异,但是并没有显著影响籽粒的干质量以及库容大小。
[1] Shekoofa A E Y, Alters M.Plant growth regulator (Ethephon) alters maize (Zea mays L.)growth, water use and grain yield under water stress[J]. Journal of Agronomy, 2008, 7(1): 160-174.
[2] Xu C, Gao Y, Tian B, et al. A novel plant growth regulator, on mechanical strength, stalk vascular bundles and grain yield of summer maize at high densities[J]. Field Crops Research, 2017(200): 71-79.
[3] Ye D L, Zhang Y S, Al-Kaisi M M, et al. Ethephon improved stalk strength associated with summer maize adaptations to environments differing in nitrogen availability in the North China Plain[J]. Journal of Agricultural Science, 2016, 154(6): 960-977.
[4] Kasele I N, Nyirenda F, Shanahan J F, et al. D′andria R:ethephon alters corn growth, water use, and grain yield under drought stress[J]. Agronomy Journal, 1994, 86(2): 283-288.
[5] Langan T D, Oplinger E S. Growth and yield of ethephon treated maize[J]. Agron J, 1987, 79(1):130-134.
[6] Tripathi S C, Sayre K D, Kaul J N, et al. Lodging behavior and yield potential of spring wheat (Triticum aestivum L.): effects of ethephon and genotypes[J]. Field Crops Research, 2004, 87(2/3): 207-220.
[7] Ramburan S, Greenfield P L. Use of ethephon and chlormequat chloride to manage plant height and lodging of irrigated barley(cv. Puma)when high rates of N-fertiliser are applied[J]. South African Journal of Plant & Soil, 2007, 24(4): 181-187.
[8] 周凤兰, 张吉川, 陈泽光. 玉米壮丰灵不同喷施期对玉米株型结构与产量的影响[J]. 吉林农业科学, 1997(1): 35-37.
[9] 申占保. 玉米健壮素对浚单20玉米生长发育的影响[J]. 现代农业科技, 2013(23): 43-44.
[10] 赵玉路, 秦连保, 赵玉兰. 玉黄金和金得乐对玉米产量及其性状的影响[J]. 山西农业科学, 2010, 38(7): 53-55.
[11] Jones R J, Schreiber B, Roessler J A. Kernel sink capacity in maize: genotypic and maternal regulation[J]. Cropence, 1996, 36(2): 301-306.
[12] Kitonyo O M, Sadras V O, Zhou Y, et al. Nitrogen supply and sink demand modulate the patterns of leaf senescence in maize[J]. Field Crops Research, 2018(225): 92-103.
[13] Shekoofa A, Emam Y, Pessarakli M. Source-sink manipulation effects on maize kernel quality[J]. Journal of Plant Nutrition, 2013, 36(9): 1401-1411.
[14] Jones R J, Roessler J, Ouattar S. Thermal environment during endosperm Cell-Division in Maize-Effects on number of endosperm cells and starch granules[J]. Crop Science, 1985, 25(5): 830-834.
[15] Aprile A, Mastrangelo A M, Leonardis A M D, et al. Study of the transcriptional profiles of common and durum wheat in response to water stress during the filling stage of kernels[J]. Georgofili, 2015.
[16] Ouattar S, Jones R J, Crookston R K. Effect of water deficit during grain filling on the pattern of maize kernel growth and development[J]. Crop Science, 1987, 27(4): 726-730.
[17] Jones R J, Roessler J, Ouattar S. Thermal environment during endosperm cell division in maize:effects on number of endosperm cells and starch granules 1[J]. Crop Science, 1984, 25(5): 830-834.
[18] Reddy V M, Daynard T B. Endosperm characteristics associated with rate of grain filling and kernel size in corn[J]. Maydica, 1983, 28(4): 339-355.
[19] Singh B K, Jenner C F. A modified method for the determination of cell number in wheat endosperm[J]. Plant Science Letters, 1982, 26(2/3): 273-278.
[20] Yang J C, Zhang J H, Huang Z L, et al. Correlation of cytokinin levels in the endosperms and roots with cell number and cell division activity during endosperm development in rice[J]. Annals of Botany, 2002, 90(3): 369-377.
[21] Yang W B, Li Y, Yin Y P, et al .Ethylene and Spermidine in wheat grains in relation to starch content and granule size distribution under water deficit[J]. J Integr Agr,2014, 13(10):2141-2153.
[22] Zheng Y, Fei X, Yu X. Observation and investigation of starch granules within wheat pericarp and Endosperm[J]. Agricultural Research,2017, 6(2):1-6.
[23] Xie G N, Li Z X, Ran Q J, et al. Over-expression of mutatedZmDA1 orZmDAR1 gene improves maize kernel yield by enhancing starch synthesis[J]. Plant Biotechnology Journal, 2018, 16(1): 234-244.
[24] Tetlow I J, Emes M J. Starch biosynthesis in the developing endosperms of grasses and cereals[J]. Agronomy-basel, 2017, 7(4): 81.
[25] Panda B B, Badoghar A K, Sekhar S, et al. 1-MCP treatment enhanced expression of genes controlling endosperm cell division and starch biosynthesis for improvement of grain filling in a dense-panicle rice cultivar[J]. Plant Science, 2016, 246: 11-25.
[26] Gao Z, Liang X G, Zhang L, et al. Spraying exogenous 6-benzyladenine and brassinolide at tasseling increases maize yield by enhancing source and sink capacity[J]. Field Crops Research, 2017(211): 1-9.
[27] Koprna R, De Diego N, Dundalkova L, et al. Use of cytokinins as agrochemicals[J]. Bioorganic & Medicinal Chemistry, 2016, 24(3): 484-492.
[28] Zhang L, Li X H, Gao Z, et al. Regulation of maize kernel weight and carbohydrate metabolism by abscisic acid applied at the early and middle post-pollination stages in vitro[J]. J Plant Physiol,2017, 216:1.
[29] Young T E, Gallie D R. Programmed cell death during endosperm development[J]. Plant Molecular Biology, 2000, 44(3): 283-301.
[30] Young T E, Gallie D R, Demason D A. Ethylene-mediated programmed cell death during maize endosperm development of wild-type and shrunken2 genotypes[J]. Plant Physiology, 1997, 115(2): 737-751.