表1 供试牦牛样品清单
Tab.1 List of samples used for analyses
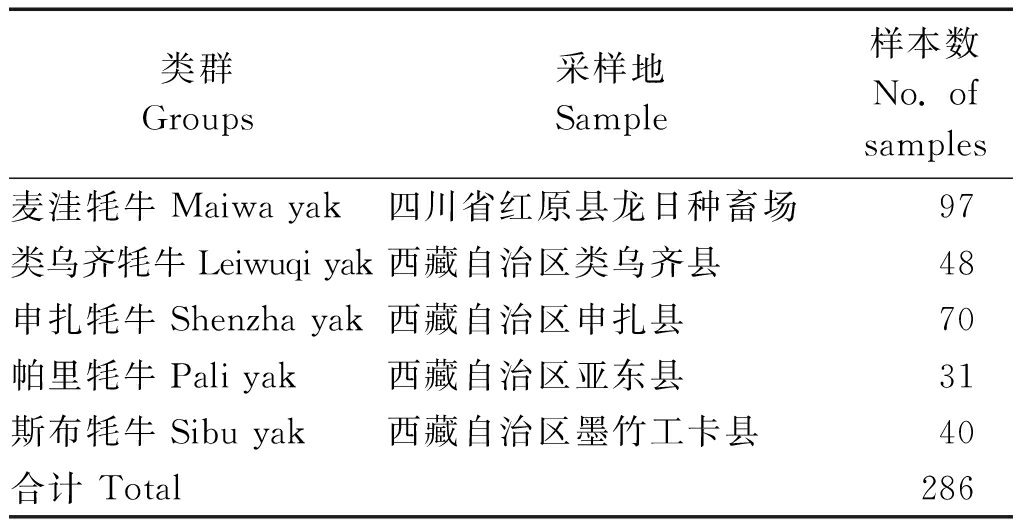
类群Groups采样地Sample样本数No. of samples麦洼牦牛Maiwa yak四川省红原县龙日种畜场97类乌齐牦牛Leiwuqi yak西藏自治区类乌齐县48申扎牦牛Shenzha yak西藏自治区申扎县70帕里牦牛Pali yak西藏自治区亚东县31斯布牦牛Sibu yak西藏自治区墨竹工卡县40合计 Total 286
生肌调节因子(Myogenic regulatory factors,MRFs)家族主要包括生肌决定因子(Myogenic determining factor,MyoD)、生肌调节因子4(Myogenic regulatory factor 4,MRF4)、肌细胞生成素(Myogenin,MyoG)和生肌决定因子5(Myogenic fatcor 5,MYF5)[1],主要控制骨骼肌正常生长发育,体肌细胞定型、增殖,成肌细胞转化以及肌纤维形成,同时对肌肉功能完善发挥重要作用[2]。研究表明,MyoG在所有骨骼肌细胞中均可表达,其可调控中胚层细胞分化为成肌细胞、再由成肌细胞融合成肌纤维[3-4],是该家族中唯一能在骨骼肌细胞发育与生长过程中均可表达的调控因子。Neville、Weintraub等[5-6]敲除生肌调节基因家族4个转录因子,其中单独敲除MyoG基因的小鼠骨骼肌发育受损进而死亡,且个体发育较正常小鼠小;而单独敲除其他3个基因的小鼠,骨骼肌发育正常。肌细胞生成素具有调节基因表达功能,对其他因子起调控作用,MyoG可调控MRF4基因表达,也可通过调节肌肉肌酸激酶、肌钙蛋白和肌球蛋白轻链基因表达从而调节肌肉特异性。其作为转录调节因子,表达并启动骨骼肌特异胚胎性受体和收缩蛋白的合成[7]。Wright等[1]研究表明,MyoG基因作为一种正调控因子,影响小鼠骨骼肌发育。Fujisawa-Sehara等[8]研究发现,在小鼠胚胎发生期,MyoG基因上游序列可促进骨骼肌细胞系转录激活。Buonanno等[9]研究表明,MyoG基因上游区域可促进转基因小鼠组织发育的特异性表达。
牦牛生长性状是选育工作的重要参考指标,MyoG基因是骨再塑的重要调控因子,对骨骼肌发育成熟发挥重要作用,而骨骼生长在大型畜种中主要表现在体高、体长等生长指标上。基于MyoG 基因在 MRFs 基因家族中的决定性作用,其调控机制已得到广泛研究,但目前对牦牛该基因的研究较少。
本研究以西藏主要牦牛类群及四川麦洼牦牛为对象,分析MyoG基因遗传多样性及与生长性状的相关性,寻找新的性状关联SNPs位点,以期应用于牦牛育种实践,提高生产性能,为牦牛分子标记辅助选育提供参考。
选取四川麦洼牦牛、西藏类乌齐牦牛、申扎牦牛、帕里牦牛、斯布牦牛5个类群共286头健康成年个体(表1)。采集耳组织,-80 ℃保存备用。同时测定其体高、体斜长、胸围、管围、体质量等生长性能指标。按照动物组织基因组DNA提取试剂盒说明进行提取,1% 凝胶电泳和分光光度计检测其纯度及浓度,-20 ℃保存备用。
表1 供试牦牛样品清单
Tab.1 List of samples used for analyses

类群Groups采样地Sample样本数No. of samples麦洼牦牛Maiwa yak四川省红原县龙日种畜场97类乌齐牦牛Leiwuqi yak西藏自治区类乌齐县48申扎牦牛Shenzha yak西藏自治区申扎县70帕里牦牛Pali yak西藏自治区亚东县31斯布牦牛Sibu yak西藏自治区墨竹工卡县40合计 Total 286
测量需牦牛端正站立于宽阔、平坦地面上。四肢直立,从后面向前看只能看见后腿而不见前腿,侧望左腿不见右腿或右腿不见左腿,头自然前伸,不左不右,不高不低,4蹄落在地面2条平行的直线上。体质量测定采用电子磅秤,测杖测量牦牛个体高度、体斜长。体高测量标准为耆甲最高点到地面的垂直距离,体斜长通常称体长,肩端至坐骨端的距离,卷尺测量胸围、管围。胸围为肩胛后角处体躯的垂直周径。管围为前肢胫部上1/3的周径,一般在胫部最细处测量[10],每项测量2次,取平均值。
1.3.1 DNA池构建 重复测定DNA浓度,取其3次平均值,稀释至50 ng/μL。100个DNA样品各取5 μL混合,4 ℃静置24~48 h。
1.3.2 PCR扩增 根据GenBank牛MyoG基因序列(AC_000173),利用Primer Premier 6.0软件设计PCR引物(表 2)。
PCR扩增体系(50 μL):DNA模板2 μL,上下游引物各2 μL,ddH2O 19 μL、Premix ExTaq 聚合酶25 μL。
PCR扩增条件:94 ℃预变性4 min;94 ℃ 变性30 s,退火30 s,72 ℃延伸(具体如表2所示),共30个循环;72 ℃延伸5 min,4 ℃保存。10 g/L凝胶电泳检测,纯化、回收后送往英潍捷基(上海)生物科技有限公司测序。
1.3.3 SNPs筛查及数据分析 利用BioEdit 7.0.5软件将扩增序列与参考序列比对,查找双峰(突变位点)。利用直接测序法验证突变位点,并判定基因型。
统计不同基因型个体数量,利用PIC_CALC、Popgen 32、SPSS 17.0等软件分析多态指数,Hardy-Weinberg平衡检测及进行关联性分析。
表2 候选基因引物信息
Tab.2 Information of primer in candidate gene
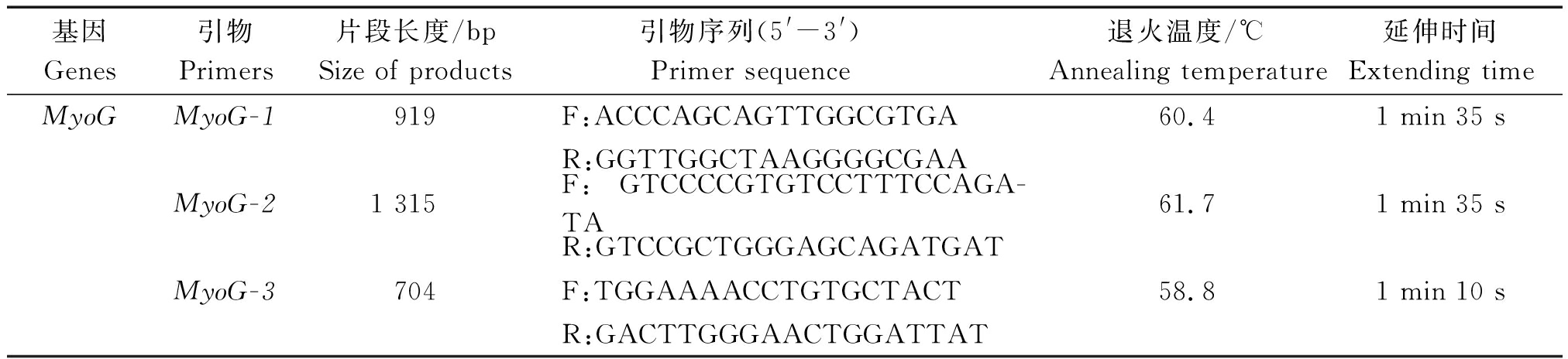
基因Genes引物Primers片段长度/bpSize of products引物序列(5'-3') Primer sequence 退火温度/℃Annealing temperature延伸时间Extending timeMyoGMyoG-1919F:ACCCAGCAGTTGGCGTGA60.41 min 35 sR:GGTTGGCTAAGGGGCGAAMyoG-21 315F:GTCCCCGTGTCCTTTCCAGA-TA61.71 min 35 sR:GTCCGCTGGGAGCAGATGATMyoG-3704F:TGGAAAACCTGTGCTACT58.81 min 10 sR:GACTTGGGAACTGGATTAT
从286头牦牛样品中,筛选年龄结构相同的牦牛个体进行体尺性状比较。由表3可知,申扎牦牛体高、体斜长、胸围、管围和体质量等指标均明显小于麦洼牦牛、类乌齐牦牛和帕里牦牛。申扎和斯布2个牦牛类群体质量及体尺指标接近,申扎牦牛在西藏当地称为矮小牦牛,群体个体均较小,而斯布牦牛称为矮脚牦牛,其肢长指数较小,因其在地理条件、生态环境较为相近且年降水量稀少导致植被及牧草长势较差从而影响其发育。帕里牦牛体高、胸围和体质量指标均优于其他类群。5个类群中,公牦牛各项体尺指标普遍大于母牦牛,但在斯布牦牛体质量指标中,母牦牛的体质量明显大于公牦牛。牦牛的生长与气候及牧草生长情况密切相关。
表3 牦牛类群的体尺性状方差分析(平均数±标准差)
Tab.3 Analysis of variance on growth traits in yak ![]()

类群Groups性别Gender样本量Total体高/cmBody height体斜长/cmBody length胸围/cmHeart girth管围/cmCircumference体质量/kgBody weight麦洼牦牛♂1129.00b155.00b183.00b21.50b346.00bMaiwa yak♀95111.47±5.70b130.21±7.87b159.77±7.81b16.21±1.33b236.33±28.76b类乌齐牦牛♂12118.09±6.18b139.73±7.65b176.09±14.24b18.18±1.55b339.91±72.09bLeiwuqi yak♀36105.19±5.18b123.13±5.54b151.94±8.50b14.00±0.82b224.47±32.70b申扎牦牛♂1691.50±7.86a97.28±7.91a127.01±12.89a15.81±1.24b122.56±39.23aShenzha yak♀1499.57±7.70a110.00±5.35a141.14±11.72a15.36±0.98b168.94±15.09a帕里牦牛♂6119.00±5.69bc138.00±5.59b169.67±9.01bc17.25±0.58b311.67±44.47bcPali yak♀21110.95±4.94b127.98±6.56b158.90±5.59b14.86±0.52a246.33±31.18b斯布牦牛♂14101.79±7.03a113.00±5.04a137.79±7.58a14.14±0.63a153.36±24.21aSibu yak♀17105.59±17.60a119.65±10.21a140.88±16.66a14.12±0.84a180.35±55.10a
注:不同字母表示差异显著(P<0.05);表中数据为平均数±数准差。表4,7同。
Note:The different scripts mean significantly different(P<0.05);The data in the table are![]() The same as Tab.4,7.
The same as Tab.4,7.
体尺指数是衡量牦牛发育完全的重要参考标准,其中,体长指数表明高和长相对发育程度,胸围指数说明胸部宽和深相对发育程度,管围指数反映骨骼的发育程度。各相关指数计算方法均为与体高的百分比[11]。由表4可知,麦洼牦牛和类乌齐牦牛各项指数较接近,类乌齐牦牛胸围指数高于其他4个类群,说明其胸部肌肉发育较好。麦洼牦牛和类乌齐牦牛雌性个体的体长、胸围指数较接近,2个品种均具有较典型的乳肉兼用体型。申扎牦牛体长指数较小但管围较大,与实际情况相符。帕里牦牛胸围和管围指数较其他牦牛类群偏低,与体型特征相符。
表4 五个牦牛品种(类群)平均体尺指数比较(平均数±标准差)
Tab.4 Comparison body size average index of five yak ![]() %
%
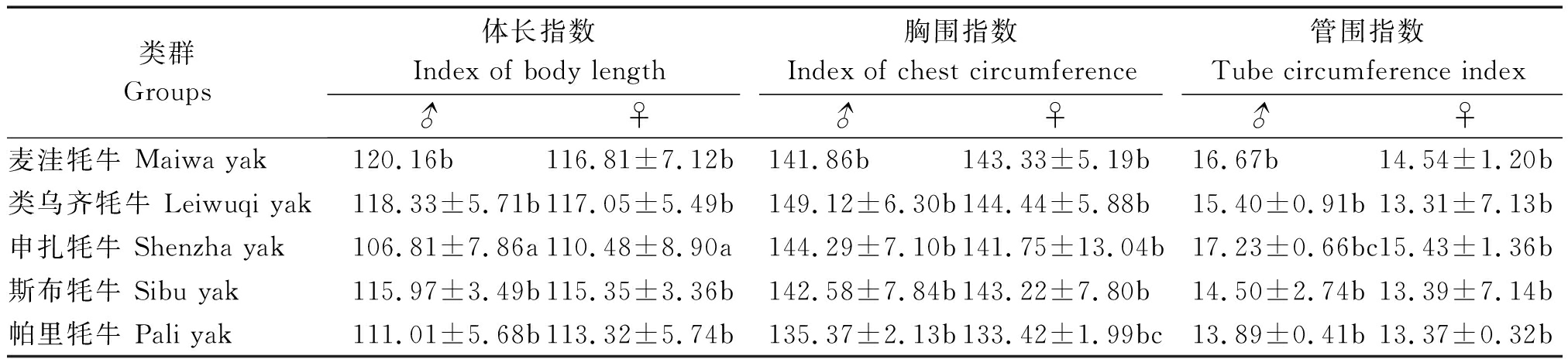
类群Groups体长指数Index of body length胸围指数Index of chest circumference管围指数Tube circumference index♂♀♂♀♂♀麦洼牦牛 Maiwa yak120.16b 116.81±7.12b141.86b 143.33±5.19b16.67b 14.54±1.20b类乌齐牦牛 Leiwuqi yak118.33±5.71b117.05±5.49b149.12±6.30b144.44±5.88b15.40±0.91b13.31±7.13b申扎牦牛 Shenzha yak106.81±7.86a110.48±8.90a144.29±7.10b141.75±13.04b17.23±0.66bc15.43±1.36b斯布牦牛 Sibu yak115.97±3.49b115.35±3.36b142.58±7.84b143.22±7.80b14.50±2.74b13.39±7.14b帕里牦牛 Pali yak111.01±5.68b113.32±5.74b135.37±2.13b133.42±1.99bc13.89±0.41b13.37±0.32b
2.2.1 PCR 产物检测 扩增目的片段,1.2%琼脂糖凝胶电泳检测(图1)。扩增产物大小与预期扩增片段长度一致。
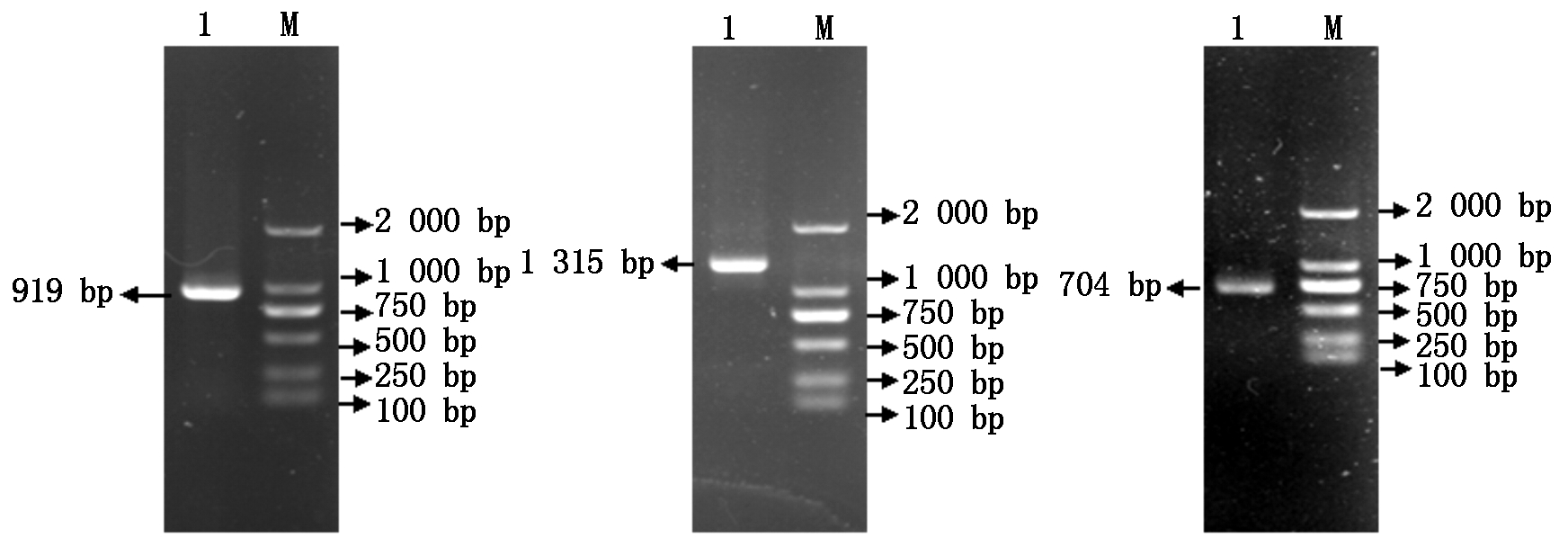
图1 MyoG基因PCR扩增
Fig.1 The amplification result of MyoG from PCR
2.2.2 序列分析 将测序结果与参考序列比对、校正,根据峰值图筛查SNPs位点,发现MyoG基因存在4个SNPs(图2),均位于内含子区域,分别为g.757 T>C、g.662 G>A、g. 539 A>G和g. 2216 A>G。利用DNAMAN 5.0对测序结果比对分析,判定个体基因型(图2)。其中,g.757 T>C包括CC、CT、TT共3种基因型,g.662 G>A、g. 539 A>G均检出AA、AG和GG 共3种基因型,g. 2216 A>G在麦洼、类乌齐和申扎牦牛类群存在AA、AG基因型,帕里牦牛和斯布牦牛包含基因型 AA、AG和GG。

图2 牦牛MyoG 基因 757,662,539,2 216 bp 处碱基变异
Fig.2 The bases variation of the MyoG gene at positions 757,662,539,2 216 bp in yak
2.2.3MyoG基因遗传学分析 牦牛MyoG基因SNP位点基因型频率和基因频率如表5所示。g.757 T>C位点,基因型CT在类乌齐牦牛、申扎牦牛和帕里牦牛类群为优势基因型;TT基因型在麦洼牦牛和斯布牦牛为优势基因型;CC基因型在5个牦牛类群中的分布频率最低。位点g.662 G>A,杂合基因型AG在类乌齐牦牛、申扎牦牛和帕里牦牛类群分布频率分别为0.50,0.51和0.65,为优势基因型;GG基因型在麦洼牦牛和斯布牦牛中频率分别为0.55和0.48,为优势基因型;AA基因型在5个牦牛类群中的分布频率最低。g. 539 A>G位点AG型在类乌齐牦牛、申扎牦牛和帕里牦牛类群中分布频率分别为0.50,0.51和0.65;AA在麦洼牦牛和斯布牦牛中为优势基因型。位点g. 2216 A>G,AA型在5个牦牛类群中均为优势基因型。
牦牛MyoG基因SNPs位点的群体遗传多态性如表6所示。根据经典多态信息含量评估模型(PIC<0.25为低度多态;0.25<PIC<0.50为中度多态;PIC>0.50为高度多态),位点g.757 T>C、g.662 G>A和g. 539 A>G在5个牦牛类群中分布均为中度多态,遗传变异较大;位点g. 2216 A>G除了帕里牦牛为中度多态,其余均为低度多态。在位点g.757 T>C、g.662 G>A和g. 539 A>G中,申扎和帕里牦牛纯合度较低,其余纯合度均大于0.5;位点g. 2216 A>G纯合度较高,说明以上牦牛类群受人工选育程度较低,原始生态习性保持良好。χ2适合性检验表明,牦牛MyoG基因4个SNPs位点均符合Hardy-Weinberg平衡(P>0.05),这可能是由于在育种过程中主要采用原始育种方式,人工干预较少,使其在长期进化过程中达到了群体基因遗传平衡。
表5 牦牛MyoG基因SNPs位点基因型及基因频率
Tab.5 Gene frequency and genotype frequency of SNPs in MyoG gene
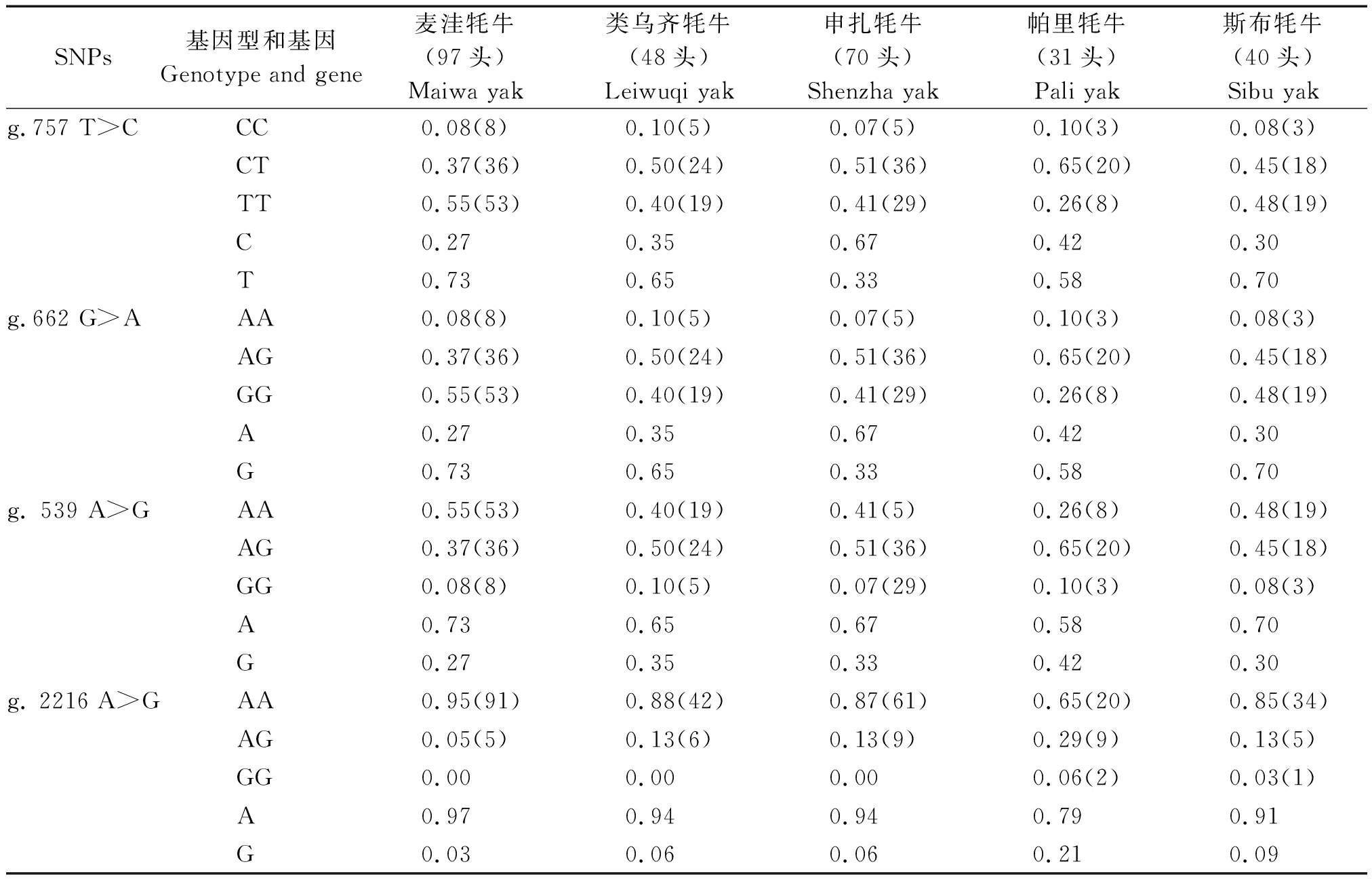
SNPs基因型和基因Genotype and gene麦洼牦牛(97头)Maiwa yak类乌齐牦牛(48头)Leiwuqi yak申扎牦牛(70头)Shenzha yak帕里牦牛(31头)Pali yak斯布牦牛(40头)Sibu yakg.757 T>CCC0.08(8)0.10(5)0.07(5)0.10(3)0.08(3)CT0.37(36)0.50(24)0.51(36)0.65(20)0.45(18)TT0.55(53)0.40(19)0.41(29)0.26(8)0.48(19)C0.270.350.670.420.30T0.730.650.330.580.70g.662 G>AAA0.08(8)0.10(5)0.07(5)0.10(3)0.08(3)AG0.37(36)0.50(24)0.51(36)0.65(20)0.45(18)GG0.55(53)0.40(19)0.41(29)0.26(8)0.48(19)A0.270.350.670.420.30G0.730.650.330.580.70g. 539 A>GAA0.55(53)0.40(19)0.41(5)0.26(8)0.48(19)AG0.37(36)0.50(24)0.51(36)0.65(20)0.45(18)GG0.08(8)0.10(5)0.07(29)0.10(3)0.08(3)A0.730.650.670.580.70G0.270.350.330.420.30g. 2216 A>GAA0.95(91)0.88(42)0.87(61)0.65(20)0.85(34)AG0.05(5)0.13(6)0.13(9)0.29(9)0.13(5)GG0.000.000.000.06(2)0.03(1)A0.970.940.940.790.91G0.030.060.060.210.09
表6 牦牛MyoG基因SNPs位点的遗传多态性
Tab.6 Genetic polymorphism of SNP sites of MyoG gene in yak
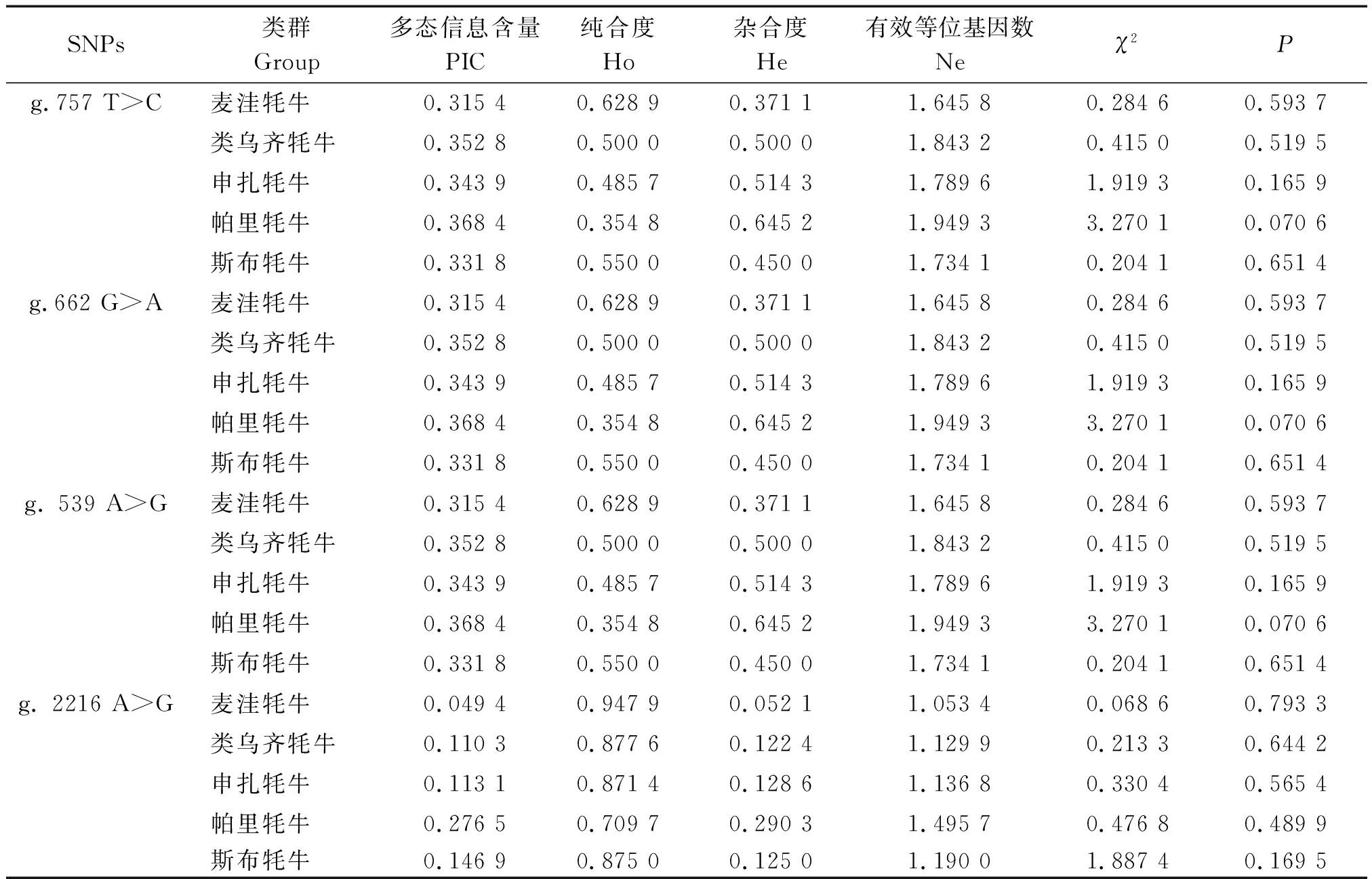
SNPs类群Group多态信息含量PIC纯合度Ho杂合度He有效等位基因数Neχ2Pg.757 T>C麦洼牦牛0.315 40.628 90.371 11.645 80.284 60.593 7类乌齐牦牛0.352 80.500 00.500 01.843 20.415 00.519 5申扎牦牛0.343 90.485 70.514 31.789 61.919 30.165 9帕里牦牛0.368 40.354 80.645 21.949 33.270 10.070 6斯布牦牛0.331 80.550 00.450 01.734 10.204 10.651 4g.662 G>A麦洼牦牛0.315 40.628 90.371 11.645 80.284 60.593 7类乌齐牦牛0.352 80.500 00.500 01.843 20.415 00.519 5申扎牦牛0.343 90.485 70.514 31.789 61.919 30.165 9帕里牦牛0.368 40.354 80.645 21.949 33.270 10.070 6斯布牦牛0.331 80.550 00.450 01.734 10.204 10.651 4g. 539 A>G麦洼牦牛0.315 40.628 90.371 11.645 80.284 60.593 7类乌齐牦牛0.352 80.500 00.500 01.843 20.415 00.519 5申扎牦牛0.343 90.485 70.514 31.789 61.919 30.165 9帕里牦牛0.368 40.354 80.645 21.949 33.270 10.070 6斯布牦牛0.331 80.550 00.450 01.734 10.204 10.651 4g. 2216 A>G麦洼牦牛0.049 40.947 90.052 11.053 40.068 60.793 3类乌齐牦牛0.110 30.877 60.122 41.129 90.213 30.644 2申扎牦牛0.113 10.871 40.128 61.136 80.330 40.565 4帕里牦牛0.276 50.709 70.290 31.495 70.476 80.489 9斯布牦牛0.146 90.875 00.125 01.190 01.887 40.169 5
2.2.4MyoG基因多态性与牦牛生长性能的关联性分析 运用SPSS 17.0建立最小二乘线性模型分析MyoG基因多态位点不同基因型与牦牛体高、体斜长、胸围、管围及体质量等生长性状的相关性。由表7可知,位点g.757 T>C、g.662 G>A和g. 539 A>G均与体高相关(P<0.05)。位点g.757 T>C中CC基因型个体体高显著高于CT基因型和TT基因型,g.662 G>A位点中AA基因型个体体高显著高于AG和GG型个体,在位点g. 539 A>G中,GG基因型个体体高显著高于AG基因型和AA基因型。g.2216 A>G与生长性状不相关,无统计学差异(P>0.05),但该位点中GG基因型在体斜长和体质量指标较其他位点有明显差异,可以作为影响因子进行相关研究。
表7 MyoG基因多态位点与牦牛生长性状的关联分析
Tab.7 The association analysis the polymorphic locus of MyoG gene and growth traits
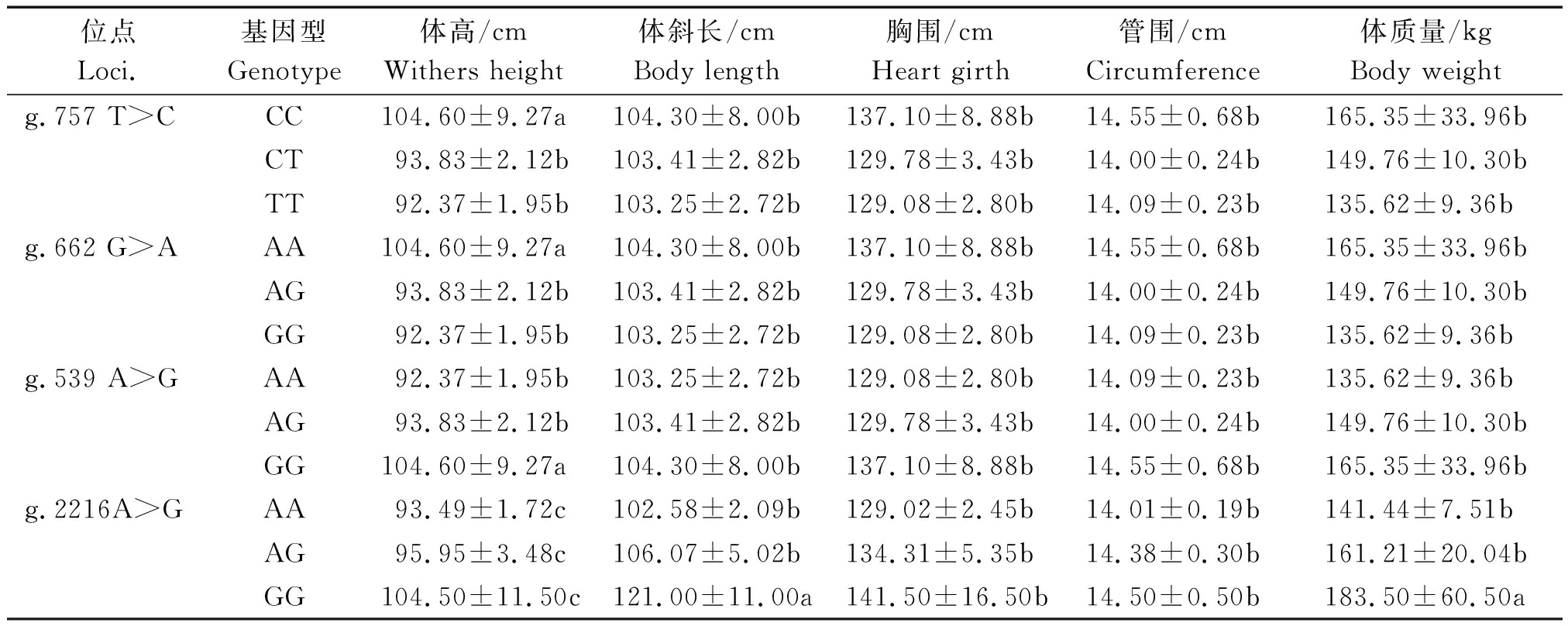
位点Loci.基因型Genotype体高/cmWithers height体斜长/cmBody length胸围/cmHeart girth管围/cmCircumference体质量/kgBody weightg.757 T>CCC104.60±9.27a104.30±8.00b137.10±8.88b14.55±0.68b165.35±33.96bCT93.83±2.12b103.41±2.82b129.78±3.43b14.00±0.24b149.76±10.30bTT92.37±1.95b103.25±2.72b129.08±2.80b14.09±0.23b135.62±9.36bg.662 G>AAA104.60±9.27a104.30±8.00b137.10±8.88b14.55±0.68b165.35±33.96bAG93.83±2.12b103.41±2.82b129.78±3.43b14.00±0.24b149.76±10.30bGG92.37±1.95b103.25±2.72b129.08±2.80b14.09±0.23b135.62±9.36bg.539 A>GAA92.37±1.95b103.25±2.72b129.08±2.80b14.09±0.23b135.62±9.36bAG93.83±2.12b103.41±2.82b129.78±3.43b14.00±0.24b149.76±10.30bGG104.60±9.27a104.30±8.00b137.10±8.88b14.55±0.68b165.35±33.96bg.2216A>GAA93.49±1.72c102.58±2.09b129.02±2.45b14.01±0.19b141.44±7.51bAG95.95±3.48c106.07±5.02b134.31±5.35b14.38±0.30b161.21±20.04bGG104.50±11.50c121.00±11.00a141.50±16.50b14.50±0.50b183.50±60.50a
生长性状是畜牧业生产重要的性状指标,是衡量育种价值及经济效益的重要指标,寻找相关基因分子标记可缩短对生长性状的选育周期[12]。申扎牦牛体高、体斜长、胸围、管围及体质量等指标均明显小于麦洼牦牛、类乌齐牦牛和帕里牦牛,这与牦牛所处生态环境及气候条件有关,不同生态环境与草场、植被类型及长势显著相关,也直接影响牦牛的采食量和生长发育。
类乌齐牦牛分布在西藏自治区昌都市类乌齐县,海拔高度4 500 m,光照充足,但昼夜温差大,属高原温带半湿润性气候,俗称“西藏小瑞士”,属藏东牦牛产业带,以牧业为主,农、林相结合,经济较为发达。类乌齐牦牛肉质鲜嫩,膘肥体壮,类乌齐牦牛肉被列为地理标志保护产品,且因其遗传多样性丰富,作为遗传资源通过农业资源委员会鉴定。麦洼牦牛分布于四川省阿坝藏族自治州红原县、若尔盖县等地,平均海拔3 600 m,太阳辐射强度大且日照时间充足,气候类型为高原寒温带季风气候,是中国草地型优良地方品种,是典型乳肉兼用型品种。斯布牦牛以上体尺指标与申扎牦牛接近,申扎牦牛主产于那曲地区申扎县平均海拔4 450 m,属高原亚寒带半干旱季风气候,寒冷干旱[12],而斯布牦牛主产于拉萨市墨竹工卡县斯布村,平均海拔4 000 m,属高原温带半干旱季风气候区,高寒干燥,年温差小而昼夜温差大[13],申扎和斯布牦牛类群在地理条件、生态环境较为接近且年降水量稀少导致植被及牧草长势较差,牧草作为牦牛主要食物来源,直接影响牦牛个体生长发育。而帕里牦牛产于亚东县帕里地区,处于吐蕃南部、喜马拉雅山脉中段南麓,平均海拔4 640 m,属高原温带季风半湿润气候,气温日差较大,年日照时数2 663.8 h,降水充沛,物产丰富[14],使帕里牦牛体高、胸围和体质量指标存在一定的优势。5个牦牛类群,公牦牛各项体尺指标普遍大于母牦牛,但在斯布牦牛体质量指标中,母牦牛的体质量明显大于公牦牛,牦牛的生长与气候及牧草生长情况密切相关,同时也因选取试验用牦牛公母数量差异有关,存在误差。
MyoG是重要的成肌调节因子,其表达水平对肌细胞生成、融合及肌肉组织生长均产生重要影响,对骨骼肌发生起重要调节作用[15-17]。近年来,许多研究对家畜、家禽MyoG基因多态位点进行挖掘分析,并进一步探究SNPs位点与相关性状的关联性。赵忠海等[18]利用MyoG 和MEF2a 基因多态性聚合效应对鸭屠宰性状的影响进行分析,发现MyoG 基因 g.1131C>T 和 g.2204G>A 突变分别对胸肌率、体质量和全净膛质量有显著影响。杨又兵[19]对猪2个资源家系进行RFLP-MspⅠ多态性扫描,显示MyoG基因多态性与猪瘦肉率显著相关;朱超杰等[20]研究发现,草原红牛MyoG 基因外显子1上SNP位点与体高、体斜长和十字部高均显著相关。薛梅等[21]研究认为,MyoG基因可作为黄牛体尺性状标记候选基因。韩银仓等[22]研究表明,MyoG基因对藏羊生长发育有一定影响。白俊艳等[23]研究表明,MyoG基因外显子1对羊肉的水分和色泽有影响。栾兆进等[16]研究报道,MyoG基因表达影响绵羊肌内脂肪的沉积。研究显示,MyoG基因不同SNPs位点与家畜和家禽骨骼、肌肉及体尺、产肉质量、生长速度及肉品质等经济性状显著相关。目前,对牦牛MyoG基因研究相对较少,仅林亚秋等[24]对九龙牦牛MyoG基因cDNA区进行克隆并在不同组织中进行表达分析。
本研究,共发现4个SNP位点,均位于内含子区域,这与王敏强等[25]对牦牛、黄牛和水牛MyoG基因外显子1和5′侧翼区部分序列研究中,在牦牛该区域内并未检测到多态位点的研究结果一致,说明该基因外显子区域较稳定;卡方适合性检验显示,4个位点在不同牦牛类群χ2值均符合Hardy-Weinberg平衡,说明牦牛在生长发育过程中具有相对稳定性,但对生产性能的提高有一定阻碍,需适度进行人工干预。在位点g.757 T>C、g.662 G>A和g. 539 A>G中分布均为中度多态(0.25<PIC<0.5),g.2216A>G除了帕里牦牛为中度多态外其余均为低度多态。而在生长性能分析中显示,类乌齐托牦牛各项体尺指标均优于其他牦牛类群,也可能与此中度多态性分布、选择空间较广、优于品种选育等相关因素具有一定相关性。对5个牦牛品种(类群)MyoG基因SNPs不同基因型与体高、体斜长、胸围、管围和体质量等生长性状进行相关性分析,位点g.757 T>C、g.662 G>A和g. 539 A>G均与体高相关(P<0.05),CC基因型个体的体高显著高于AC基因型和CC基因型。g.2216A>G与生长性状不相关(P>0.05),其余性状在各个 SNPs 不同基因型间和性别间差异不显著。Bhuiyan 等[26]利用PCR-RFLP技术对7个牛品种 MYRs 家族4个基因外显子序列进行分析,发现MyoG基因g.1111C>G 位点对活体质量的影响接近显著(P=0.08)。薛梅等[21]研究发现,6个黄牛群体MyoG基因多态性与其体尺性状相关。以上试验结果与本研究对5个牦牛品种(类群)MyoG基因的研究结果相近,因对牦牛MyoG基因SNP位点筛查区域选择存在差异,造成试验结果不同。MyoG基因与体高具有相关性,可作为体尺性状标记辅助选择的候选基因。
[1] Wright W E, Sassoon D A, Lin V K. Myogenin, a factor regulating myogenesis, has a domain homologous to MyoD[J]. Cell, 1989, 56(4): 607-617.
[2] Bergstrom D A, Tapscott S J. Molecular distinction between specification and differentiation in the myogenic basic helix-loop-helix transcription factor family[J]. Molecular and Cellular Biology, 2001, 21(7): 2404-2412.
[3] 赵 青, 钟土木, 徐宁迎. 金华猪MyoG基因多态性与部分生长性能的关系[J]. 华南农业大学学报, 2010, 31(2): 121-124.
[4] Te Pas M F W, Soumillion A, Harders F L, et al. Influences of myogenin genotypes on birth weight, growth rate, carcass weight, backfat thickness, and lean weight of pigs[J]. Journal of Animal Science, 1999, 77(9): 2352-2356.
[5] Neville C M, Schmidt M, Schmidt J. Response of myogenic determination factors to cessation and resumption of electrical activity in skeletal muscle: a possible role for myogenin in denervation supersensitivity[J]. Cellular and Molecular Neurobiology, 1992, 12(6): 511-527.
[6] Weintraub H, Davis R, Tapscott S, et al. ThemyoD gene family: nodal point during specification of the muscle cell lineage[J]. Science, 1991, 251(4995): 761-766.
[7] Hasty P, Bradley A, Morris J H, et al. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene[J]. Nature, 1993, 364(6437): 501-506.
[8] Fujisawa-Sehara A. Development and regeneration of skeletal muscle[J]. Tanpakushitsu Kakusan koso. Protein, Nucleic Acid, Enzyme, 2000, 45(13 S1): 2228-2234.
[9] Buonanno A, Edmondson D G, Hayes W P. Upstream sequences of the myogenin gene convey responsiveness to skeletal muscle denervation in transgenic mice[J]. Nucleic Acids Research, 1993, 21(24): 5684-5693.
[10] 王永智.牛的外貌鉴定、体尺测量及体重估测[J]. 养殖技术顾问, 2013(12):19-20.
[11] 李 强, 傅昌秀, 文勇立, 等. 金川多肋牦牛体尺和屠宰性状测定及其相关性分析[J]. 中国草食动物科学, 2012, 32(2): 19-20.
[12] 徐怀超, 昝林森, 王洪宝, 等.CRTC3基因多态性及基因型组合与秦川牛生长性状的关联分析[J]. 畜牧兽医学报, 2016, 47(11): 2184-2190.
[13] 王晓军, 程绍敏. 西藏主要气候特征分析[J]. 高原山地气象研究, 2009, 29(4): 81-84.
[14] 邹联付, 潘 刚, 方江平. 西藏三江流域生态功能区划研究[J]. 西藏科技, 2009(5): 18-21.
[15] 姬秋梅, 达娃央拉, 洛 桑, 等. 西藏帕里牦牛本品种选育研究[J]. 西藏科技, 2011(2):60-62.
[16] 栾兆进,贺建宁,程 明,等.绵羊肌肉组织MyoG和PID1基因的表达及其与肌内脂肪含量的关系[J].畜牧兽医学报, 2016, 47(10):1986-1994.
[17] Liu Y Y, Li F N, Kong X F, et al. Signaling pathways related to protein synthesis and amino acid concentration in pig skeletal muscles depend on the dietary protein level, genotype and developmental stages[J]. PLoS One, 2015, 10(9): 1-21.
[18] 赵忠海, 李 辉, 易恒洁, 等.MyoG 和MEF2a 基因多态性聚合效应对鸭屠宰性状的影响[J]. 中国农业科学, 2016, 49(18): 3649-3661.
[19] 杨又兵. 猪MYOG基因和CAST基因多态性研究及部分DNA片段的测序[D]. 武汉: 华中农业大学, 2003.
[20] 朱超杰, 张立春, 秦立红, 等. 不同品种牛MyoG基因Exon 1多态性比较分析[J]. 中国兽医学报, 2016, 36(6): 1024-1031.
[21] 薛 梅, 昝林森, 王洪宝, 等. 6个黄牛群体MyoG 基因单核苷酸多态性及其与体尺性状的相关性[J]. 西北农林科技大学学报, 2011, 39(7): 35-42.
[22] 韩银仓, 孙永刚, 陈 志.MyoG基因SNP检测及与藏羊体尺性状的关联分析[J]. 家畜生态学报, 2016, 37(6): 19-23.
[23] 白俊艳, 杨又兵, 王玉琴, 等. 绵羊MyoG基因外显子1的多态性及其与肉质性状的关联性分析[J]. 中国畜牧兽医, 2017, 44(6): 1778-1783.
[24] 林亚秋, 张倡珲, 郑玉才, 等. 九龙牦牛肌细胞生成素基因的克隆及其表达谱[J]. 畜牧兽医学报, 2014, 45(2): 207-211.
[25] 王敏强, 苏 培, 刘晓玲, 等. 黄牛,牦牛和水牛MyoG 基因单核苷酸多态性分析[J]. 西北农业学报, 2011, 20(6): 7-11.
[26] Bhuiyan M S A, Kim N K, Choyoon Y M, et al. Identification of SNPs inMyoG gene family and their associations with carcass traits in cattle[J]. Livestock Science, 2009,126:292-297.