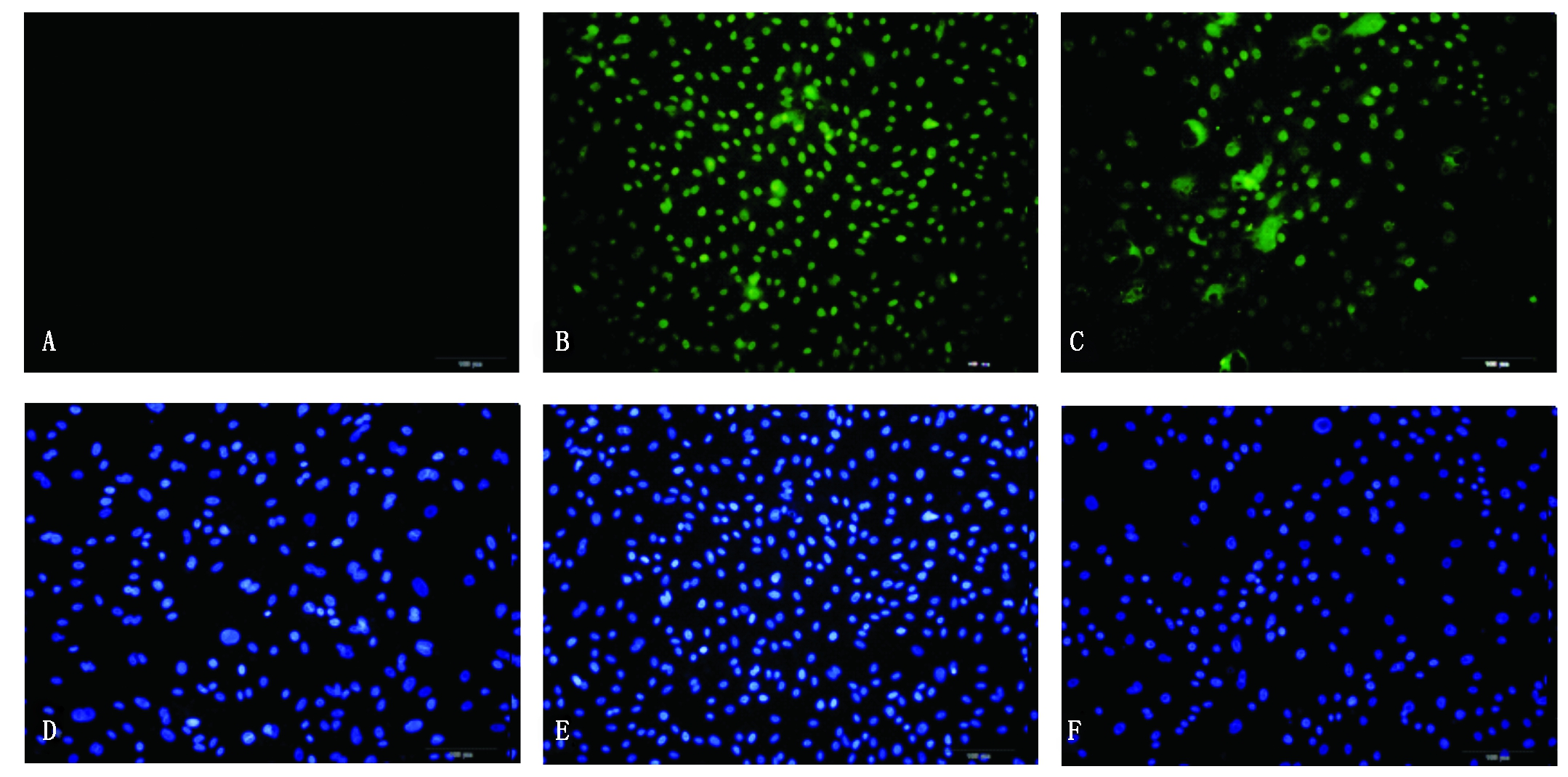
A,D.正常细胞;B,E.慢病毒空载体转染细胞;C,F.HSP72慢病毒转染细胞。
A,D. Normal cells; B,E. Lentiviral empty carrier transfected cells; C,F.HSP72 lentivirus transfected cells.
图1 HSP72慢病毒载体感染奶牛乳腺上皮细胞
Fig.1 HSP72 lentivirus vector infect bovine mammary epithelial cells
奶牛乳腺炎主要由病原微生物侵入、化学物理性损伤及机械性刺激乳房实质和/或间质而发病。奶牛乳腺炎发病率高、治愈率低,严重影响牛奶品质和产奶量,甚至危害人类健康[1-2]。
热休克蛋白(HSP),也称为热应激蛋白,通常是机体遭受应激而表达,具有高度保守性[3],其中,诱导表达型热休克蛋白(HSP72)在调节细胞保护、抗凋亡和免疫调控中具有重要作用[4]。大量人类医学报道,HSP72有明显的抗炎症作用[5]。各种因素引起的炎症反应都伴有HSP72的高表达,并且HSP72能阻断TREM-1的活化[6],进而解除TREM-1对负调节因子IRAK-M和Tollip表达的抑制[7],有效抑制IL-6、IL-8和TNFα表达[8-10]。LPS可诱导内源性负调控分子HSP72表达,维持细胞内免疫应答平衡[11]。还有研究证实,诱导内源性HSP72高表达,可以减少I-κB的降解和NF-κB的核转录,从而抑制LPS诱导的NF-κB信号转导和炎性因子表达[8]。HSP72能抑制NF-κB的活力,通过细胞内NF-κB调节机制来参与其应激保护作用[9-10],减轻细胞损伤。重组HSP72能诱导抗炎细胞因子IL-10生成,从而发挥抗炎效应[12]。但是,HSP72在奶牛乳腺炎症免疫应答信号通路中的分子调控机制和转导机制尚不完全清楚。因此,建立稳定表达HSP72牛乳腺上皮细胞系,可为研究奶牛乳腺炎分子调控机制以及抗性分子药物筛选提供新的理论依据和工作基础。
牛乳腺上皮细胞经青岛农业大学动物生殖生理与疾病实验室鉴定并传至第56代,以含1%双抗的DMEM/F12加入10% FBS,置入5% CO2、37 ℃恒温CO2培养箱内培养;293T细胞购自中国科学院上海细胞库;慢病毒包装系统由包装质粒pGag/Pol、pRev和Pvsv-G和重组穿梭质粒构成,穿梭质粒LV5既能持续表达目的基因,又能表达嘌呤霉素和绿色荧光蛋白基因,用于细胞筛选,该系统由上海吉玛制药技术有限公司提供。
DMEM/F12、胎牛血清FBS、胰酶Trypsin-EDTA Solution及双抗(青链霉素)购自GIBCO公司;Hepes购自AMRESCO公司;RNAi-Mate转染试剂购自上海吉玛公司;聚凝胺和Hochest33342购自Sigma公司;嘌呤霉素和ABC(小鼠IgG)-POD kit试剂盒购自索莱宝公司;HSP72抗体购自Santa cruz公司;二抗购自Jackson ImmunoResearch公司。
1.3.1 牛HSP72基因扩增及产物回收 将<107悬浮细胞分装于1.5 mL离心管中,根据组织细胞RNA快速提取试剂盒的说明,提取细胞总RNA,反转录合成cDNA,PCR扩增HSP72基因。按照牛HSP72引物(GenBank Acc: BC103083),利用Premier 5.0软件设计。上游引物:5′-GAGCTCAAGCTTC ATGGCGAAAAACATGG-3′;下游引物:5′-GGTATCG TCGACATAACCACCTCAATG-3′,上海生工生物工程股份有限公司合成引物。参考李琪等[13]方法将HSP72基因重组到穿梭质粒中,构建LV5-HSP72表达载体。
1.3.2 慢病毒载体包装及病毒滴度检测 将含目的序列HSP72的穿梭质粒和包装质粒(pGag/Pol、pRev和Pvsv-G)与300 μL RNAi-Mate按比例共转染293T细胞,经过72 h培养,收集上清,4 000 r/min离心4 min,移取上清,分装。采用感染滴度测定法检测病毒滴度,96孔板按4×103个/孔接种293T细胞,于37 ℃、5% CO2培养箱中培养24 h;然后吸取10 μL病毒原液,用10% FBS的DMEM细胞培养液稀释10倍,设置3~5个稀释度,100 μL/孔加至96孔板中,并设置空白对照孔,于37 ℃、5% CO2条件下培养24 h;加入含10% FBS的DMEM培养液,100 μL/孔,于37 ℃、5% CO2条件下培养72 h。倒置荧光显微镜或FACS计数荧光细胞,结合稀释倍数计算病毒滴度。
1.3.3 慢病毒侵染靶细胞MOI筛选 以1×104个/孔奶牛乳腺上皮细胞接种于24孔板,培养至拟合度约60%,将慢病毒分别以10,20,50,70,100 MOI转染细胞,培养48 h,于倒置荧光显微镜下观察转染效率,本试验确定MOI为70。
1.3.4 慢病毒载体转染方法 病毒转染前1 d,以0.5×105个/孔细胞接种至24孔板中,37 ℃、5% CO2条件下培养细胞拟合度至40%~50%;弃掉原来的培养液,每孔加入还有病毒液的0.4 mL新鲜培养液,最后加入0.5 μL聚凝胺。于24 h后更换新鲜培养基继续培养;72 h后于倒置荧光显微镜下观察荧光表达量。
1.3.5 嘌呤霉素浓度的筛选 将25 mg嘌呤霉素溶于25 mL PBS溶液中(浓度为1 mg/mL);筛选前1 d,以 0.5×105个/孔细胞接种至24孔板中,每孔加入0.5 mL含10% FBS的DMEM培养液,37 ℃、5%的条件下培养细胞至40%~50%融合;按梯度浓度(0,0.5,1.0,2.0,4.0,8.0 μg/mL)加入嘌呤霉素稀释液,隔1 d更换含嘌呤霉素的新鲜培养液(浓度不变)一次,培养3 d,最终确定能使牛乳腺上皮细胞全部死亡的嘌呤霉素浓度为筛选浓度。
1.3.6 稳转株的筛选 将慢病毒感染后的牛乳腺上皮细胞用2 μg/mL嘌呤霉素溶液进行筛选,每1~2 d更换含嘌呤霉素的新鲜细胞培养液一次,倒置荧光显微镜下观察绿色荧光表达情况,筛选14 d,得到稳定表达HSP72的牛乳腺上皮细胞。
1.3.7 稳定转染细胞系中HSP72表达的检测 免疫组化法:收集HSP72慢病毒感染细胞、慢病毒空载体感染细胞和正常未感染细胞,用4%多聚甲醛固定,PBS漂洗,0.5% 曲拉通X-100室温孵育,3% H2O2处理,5% BSA封闭,滴加稀释一抗(1∶50),37 ℃孵育1 h左右,PBS清洗3次,滴加Bio-羊抗小鼠IgG稀释液(1∶100),37 ℃孵育30 min,PBS洗涤3次,滴加SABC-POD稀释液(1∶100),37 ℃孵育30 min,PBS清洗4次,DAB显色,苏木素轻度复染,光学显微镜下观察HSP72表达情况。
Western Blot法:分别提取牛HSP72慢病毒转染、慢病毒空载体转染和正常未转染3种细胞株总蛋白,用含1%PMSF的细胞裂解液裂解细胞。经SDS-PAGE分离后,用半干转膜法电转移到PVDF膜上,用5%脱脂奶粉室温封闭1 h;加入羊抗牛HSP72(1∶1 000)和兔抗羊IgG-HRP(1∶3 000)孵育,显色后拍照记录结果。
经倒置荧光显微镜或FACS计数荧光细胞,结合稀释倍数,根据计算公式:病毒滴度(TU/mL)=GFP阳性细胞数/稀释倍数,携带HSP72基因的慢病毒滴度约为1.0×109 TU/mL。空载体对照慢病毒浓缩后的病毒滴度约为1.0×109 TU/mL。
正常牛乳腺上皮细胞经嘌呤霉素筛选3 d后,嘌呤霉素浓度≥2 μg/mL的孔中牛乳腺上皮细胞全部死亡。因此,嘌呤霉素的最佳筛选浓度为2 μg/mL。
感染细胞经嘌呤霉素筛选后,在倒置荧光显微镜下均可观察到绿色荧光,正常细胞组未转染任何载体,没有绿色荧光,慢病毒空载体转染细胞组和HSP72慢病毒转染细胞组均可观察到绿色荧光,转染效率达90%以上,慢病毒成功转染牛乳腺上皮细胞(图1)。

A,D.正常细胞;B,E.慢病毒空载体转染细胞;C,F.HSP72慢病毒转染细胞。
A,D. Normal cells; B,E. Lentiviral empty carrier transfected cells; C,F.HSP72 lentivirus transfected cells.
图1 HSP72慢病毒载体感染奶牛乳腺上皮细胞
Fig.1 HSP72 lentivirus vector infect bovine mammary epithelial cells
免疫组化检测HSP72表达,发现正常细胞和空载体感染细胞,HSP72呈现低表达(图2-A、B),细胞呈现浅棕色,与前2组相比,转染携带HSP72目的基因载体细胞,HSP72高表达,呈现颜色较深的棕色,对比差异明显(图2-C)。
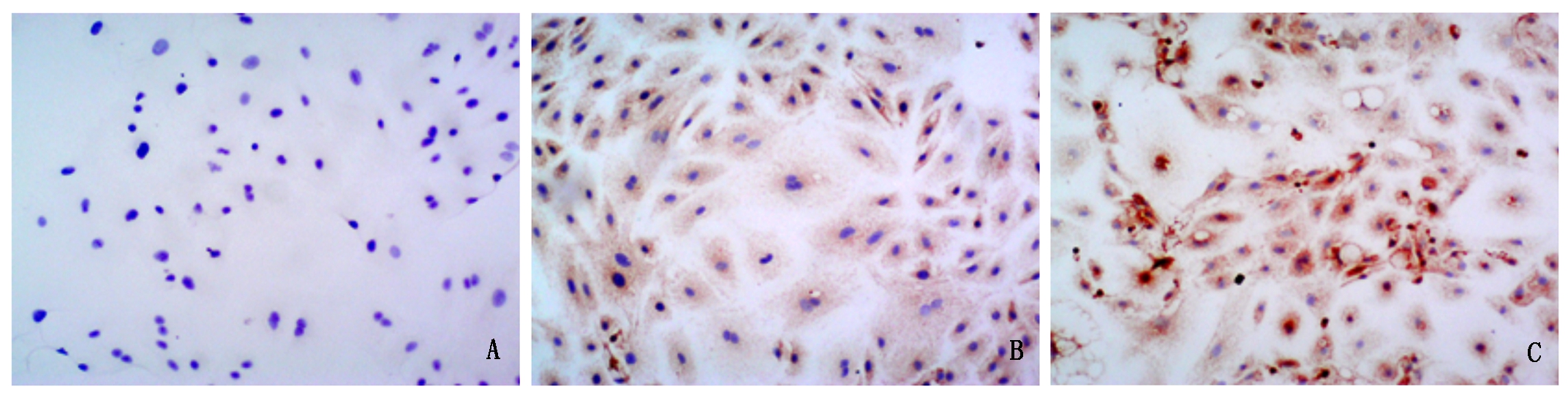
A.正常细胞;B.慢病毒空载体转染细胞;C.HSP72慢病毒转染细胞。
A. Normal cells; B. Lentiviral empty carrier transfected cells; C.HSP72 lentivirus transfected cells.
图2 HSP72慢病毒感染牛乳腺上皮细胞后HSP72表达的检测
Fig.2 Detection of HSP72 expression after HSP72 lentivirus infecting bovine mammary epithelial cells
用Western Blot法检测HSP72表达发现(图3),3组细胞均表达HSP72,与正常转染细胞相比,慢病毒空载体转染的细胞HSP72表达稍有降低,但无统计学差异,而携带HSP72基因的慢病毒载体转染的细胞HSP72呈现高表达,且差异极显著(P<0.01),与慢病毒空载体转染的细胞相比,携带HSP72基因的慢病毒载体转染的细胞HSP72呈现高表达,且差异极显著(P<0.01)。
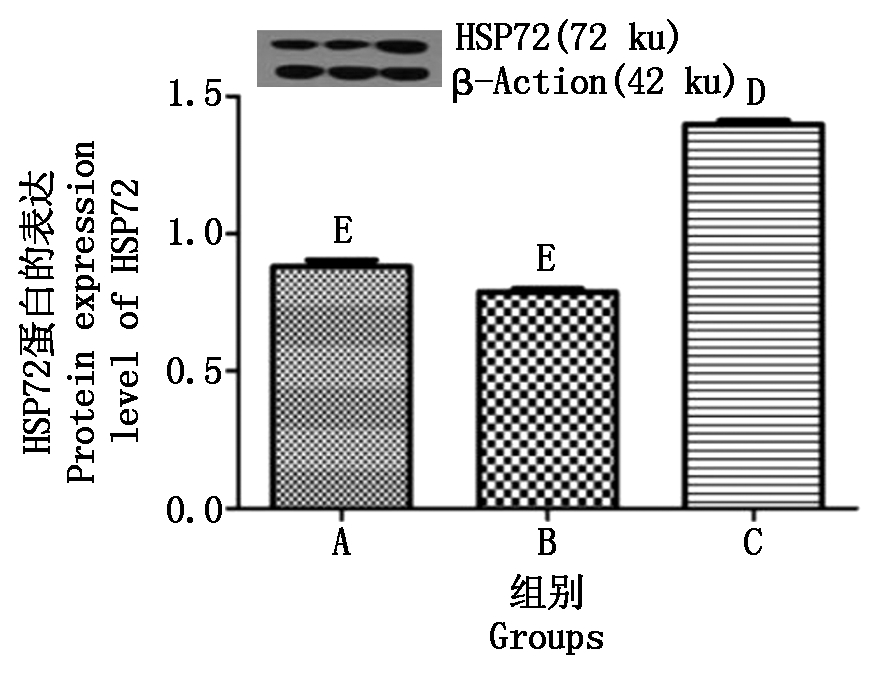
A.正常细胞;B.慢病毒空载体转染细胞;C.HSP72慢病毒转染细胞;不同大写字母表示差异极显著(P<0.01)。
A. Normal cells; B. Lentiviral empty carrier transfected cells; C.HSP72 lentivirus transfected cells; Different capitals indicate extremely significant (P<0.01).
图3 携带HSP72基因的慢病毒载体转染奶牛乳腺上皮细胞后HSP72表达的检测
Fig.3 Detection of HSP72 expression after transfection of lentiviral vector carrying HSP72 gene into dairy cow mammary epithelial cells
研究发现,热应激蛋白对炎症反应的调控作用越来越受到关注[14]。因为HSP72在正常细胞中很少甚至不表达,当细胞受到应激时表达增加,所以在目前的国内外研究中,HSP72是热休克蛋白里研究最深入的一种[15]。研究发现,应激可引起奶牛血浆中HSP72含量升高[16],而人HSP72与TRAF6结合可抑制LPS激活的NF-κB信号通路[17-18],从而抑制细胞炎性因子的表达。研究发现,未转染的正常细胞在G418筛选时被大量杀死,所以HSP72蛋白显著升高[19]。本试验使用嘌呤霉素作为筛选试剂,因为慢病毒载体中含有抗嘌呤霉素的基因,当抗嘌呤霉素的基因序列整合进入奶牛乳腺上皮细胞,细胞便会稳定表达嘌呤霉素抗性基因,所以感染成功的奶牛乳腺上皮细胞可以通过一定浓度的嘌呤霉素筛选出来,获得稳定表达HSP72的细胞株。
相关研究证明,绿色荧光蛋白(GFP)性质比较稳定、荧光强度高,并且对多数的宿主细胞没有明显毒害作用,已经被广泛地用作载体报告基因[20]。含HSP72基因的慢病毒载体质粒中包含Negative control序列、HSP72序列、GFP以及嘌呤霉素抗性基因。当GFP基因整合进入宿主DNA基因组并表达时,在倒置荧光显微镜下会观察到GFP荧光,而没有侵染或整合成功的牛乳腺上皮细胞在倒置荧光显微镜下不会观察到GFP荧光。所以,将携带HSP72基因的慢病毒载体转染牛乳腺上皮细胞,使用倒置荧光显微镜观察GFP荧光表达情况,以此来确定慢病毒是否侵染成功以及是否获得稳定的细胞系。
确定稳定表达HSP72的奶牛乳腺上皮细胞细胞系是否构建成功,主要是HSP72是否在细胞中表达以及是否具有活性。通过免疫组织化学染色技术和Western Blot方法对稳定表达HSP72的奶牛乳腺上皮细胞系进行验证。结果发现,稳定转染的牛乳腺上皮细胞中HSP72表达明显。本试验使用的方法解决了目的蛋白表达不稳定、蛋白活性鉴定繁复以及瞬时转染时转染效率低等问题。
综上所述,本试验成功构建稳定表达HSP72的奶牛乳腺上皮细胞系,为进一步研究HSP72在牛乳腺上皮细胞炎症反应通路中的作用奠定了坚实基础。
[1] Silanikove N, Merin U, Shapiro F, et al. Milk metabolites as indicators of mammary gland functions and milk quality[J]. Journal of Dairy Research, 2014, 81(3): 358-363.
[2] Yang Z T, Yin R L, Cong Y F, et al. Oxymatrine lightened the inflammatory response of LPS-Induced mastitis in mice through affecting NF-kappa B and MAPKs signaling pathways[J]. Inflammation, 2014, 37(6): 2047-2055.
[3] Lindquist S,Craig E A. The heat-shock proteins [J]. Annu Rev Genet, 1988, 22(1): 631-677.
[4] Hsiang-Wen C, Hsu C, Tzong-Shi L, et al. Heat shock pretreatment prevents cardiac mitochondrial dysfunction during sepsis[J]. SHOCK, 2003, 20(3): 274-279.
[5] 郭 辉, 王少刚, 余建华. 慢性前列腺炎患者精浆中热休克蛋白的表达及临床意义[J]. 中华泌尿外科杂志, 2004, 25(6): 411-413.
[6] Lagler H, Sharif O, Haslinger I, et al. TREM-1 activation alters the dynamics of pulmonary IRAK-M expressionin vivo and improves host defense during pneumococcal pneumonia[J]. Journal of Immunology, 2009, 183(3): 2027-2036.
[7] Guha M, Mackman N. LPS induction of gene expression in human monocytes[J]. Cellular Signalling, 2001, 13(2): 85-94.
[8] Shi Y, Tu Z, Tang D, et al. The inhibition of LPS-induced production of inflammatory cytokines by HSP70 involves inactivation of the NF-kappaB pathway but not the MAPK pathways[J]. SHOCK, 2006, 26(3): 277-284.
[9] Doeppner T R, Kaltwasser B, Fengyan J, et al. TAT-Hsp70 induces neuroprotection against stroke via anti-inflammatory actions providing appropriate cellular microenvironment for transplantation of neural precursor cells[J]. Journal of Cerebral Blood Flow and Metabolism, 2013, 33(11): 1778-1788.
[10] Collet G, Lamerant-Fayel N, Tertil M, et al. Hypoxia-regulated overexpression of soluble VEGFR2 controls angiogenesis and inhibits tumor growth[J]. Molecular Cancer Therapeutics, 2014, 13(1): 165-178.
[11] Mohanan V, Grimes C L. The molecular chaperone HSP70 binds to and stabilizes NOD2,an important proteininvolved in crohn disease[J]. Journal of Biological Chemistry, 2014, 289(27): 18987-18998.
[12] 朱冬芳, 晏春根, 黄丹文. 重组热休克蛋白72对体外培养大鼠肝细胞脂肪变性的影响[J]. 中华全科医学, 2014, 12(6): 850-852.
[13] 李 琪, 李华涛, 丛 霞, 等. 稳定转染高表达HSP72的奶牛乳腺上皮细胞系的建立[J]. 中国兽医杂志, 2016, 52(7): 3-5.
[14] Patel H, Shaw S G, Shi-Wen X, et al. Toll-like receptors in ischaemia and its potential role in the pathophysiology of muscle damage in critical limb ischaemia [J]. Cardiol Res Pract,2012, 2012: 121237.
[15] Morteza A, Nakhjavani M, Larry M, et al. Heat shock protein 70 and albuminuria in patients with type diabetes a matched case control study[J]. Cell Stress & Chaperones, 2013, 18(6): 815-819.
[16] Yang C X, Chen H Q, Chen C, et al. Microfilament-binding properties of N-terminal extension of the isoform of smooth muscle long myosin light chain kinase[J]. Cell Research, 2006, 16(4): 367-376.
[17] Chen H, Wu Y, Zhang Y, et al. Hsp70 inhibits lipopolysaccharide-induced NF-kappaB activation by interacting with TRAF6 and inhibiting its ubiquitination[J]. FEBS Letters, 2006, 580(13): 3145-3152.
[18] Li H, Cuartas E, Cui W, et al. IL-1 receptor-associated kinase M is a central regulator of osteoclast differentiation and activation[J]. The Journal of Experimental Medicine, 2005, 201(7): 1169-1177.
[19] Chen H X, Wang S, Wang Z, et al. Overexpression of RUNX3 inhibits malignant behaviour of Ecal109 cellsin vitro andvivo[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(4): 1531-1537.
[20] 赵轶君, 董 浩, 潘红艳, 等. 绿色荧光蛋白原核表达载体的构建[J]. 华北农学报, 2013, 28(3): 73-76.
姜忠玲(1976-),女,黑龙江哈尔滨人,副教授,博士,主要从事动物生殖生理与生殖疾病研究。
李华涛(1986-),男,河南周口人,讲师,博士,主要从事动物生殖生理与生殖疾病研究。