miR-181a-5p靶基因预测及其在鹅卵泡颗粒层中的表达分析
莫远亮,邓 艳,王继文
(四川农业大学 动物科技学院,畜禽遗传资源发掘与创新利用四川省重点实验室,四川 成都 611130 )
摘要:为深入探究miR-181a-5p在鹅颗粒细胞中可能的功能及其作用机制奠定基础。以多个网络数据库资源为基础,通过生物信息学的方法预测可能的靶基因及其信号通路,然后利用qPCR检测miR-181a-5p及其靶基因在不同阶段颗粒层中的表达水平。结果显示,miR-181a-5p在脊椎动物中高度保守;靶基因的GO和KEGG分析发现,miR-181a-5p主要参与调控细胞的增殖、分化、凋亡等过程,多数靶基因主要富集到FOXO、MAPK、PI3K-Akt等信号通路;根据靶基因互作网络图,筛选出10个核心靶基因VEGFA、MAPK1、FOS、KRAS、HRAS、SIRT1、BCL2、ESR1、PTEN和CDKN1A,其中多数靶基因均与细胞增殖凋亡相关。结果表明,miR-181a-5p在2~4 mm表达量最高,但在4~6 mm急剧下降,之后在4~6 mm、 8~10 mm、F5这3个阶段均呈现显著上升趋势。miR-181a-5p可能通过靶向调控SIRT1、BCL2、CDKN1B、PTEN等基因,参与FOXO、MAPK、PI3K-Akt等信号通路来调控颗粒细胞的增殖凋亡过程。
关键词:miR-181a-5p;GO和KEGG分析;表达分析;颗粒细胞;增殖;凋亡
microRNA是一组由基因组编码的长约22 nt的非编码RNA,可与靶基因mRNA的3′UTR碱基互补配对结合,并在Argonaute蛋白参与下形成RNA诱导沉默复合物(RNA-induced silencing complex,RISC),然后通过阻止其翻译或降解靶基因mRNA,以调控靶基因的表达[1]。研究表明,miR-181a-5p在脊椎动物中广泛存在,可参与多种细胞的增殖、分化、凋亡等生理过程。在动物成肌细胞中,miR-181a-5p能够靶向抑制HOXA11的表达,进而增加成肌分化关键基因MyoD、MyoG、MHC、MCK的表达,促进成肌细胞分化[2]。在人的HK-2细胞中,miR-181a能够下调抗凋亡基因BCL2的表达,上调促凋亡基因BAX表达,从而促进细胞凋亡[3]。研究表明,miR-181a既可通过沉默HOXA1来抑制原始生殖细胞的分化,同时又可通过调控NR6A1来抑制原始生殖细胞的增殖[4]。在体外培养的卵巢中,FSH处理可诱导miR-181a的表达,而LH却抑制miR-181a的表达,FSH和LH可能通过类固醇激素和miR-181a所介导的信号通路来调控原始生殖细胞的有丝分裂和减数分裂[5]。
目前,有关miR-181a-5p在颗粒细胞中的功能研究相对较少,而在禽类颗粒细胞中尚未见报道。研究表明,miR-181a可减少人类颗粒细胞中增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)的表达[6]。而小鼠颗粒细胞中,miR-181a-5p过表达时则会靶向抑制ACVR2A的表达,进而导致CCND2和PCNA表达的下调,最终抑制颗粒细胞的增殖[7]。基于鹅卵泡颗粒层的miRNA测序数据,发现miR-181a-5p颗粒层中高表达,在4~6 mm、8~10 mm、F5 这3个阶段均是差异表达的,且呈现出表达上升的趋势,而miR-181a-5p对细胞的增殖凋亡具有重要作用。由此推测,miR-181a-5p可能在鹅颗粒细胞中具有重要的调控功能。
本研究以多个网络数据库资源为基础,结合生物信息学的方法,利用qPCR技术探究miR-181a-5p及其靶基因在鹅颗粒细胞中的表达规律,旨在为进一步研究其在颗粒细胞中的作用机制奠定基础。
1 材料和方法
1.1 试验材料
本试验选用3只健康的、开产时间和体质量基本一致,处于产蛋高峰期的天府肉鹅母系母鹅。放血处死后,迅速取出整个卵巢,分离出不同直径大小的卵泡,用游标卡尺测量不同卵泡横轴直径后,分离不同阶段(2~4 mm、4~6 mm、6~8 mm、8~10 mm、F5、F4、F3、F2、F1)卵泡颗粒细胞,PBS漂洗3~4次,剪碎后置于-80 ℃冻存备用。
1.2 总RNA的提取及cDNA的合成
采用RNAiso Plus(TaKaRa)提取鹅卵泡颗粒层组织总RNA,利用NanoDrop 2000紫外分光光度计检测总RNA的浓度和纯度。cDNA的合成根据PrimeScriptTM RT Reagent Kit(TaKaRa)试剂盒说明书进行,合成的cDNA于-20 ℃冰箱内保存备用。
1.3 miR-181a-5p的保守性分析
在miRBase[8](http://www.mirbase.org/)数据库中在线检索各物种的miR-181a-5p成熟体序列,鹅的miR-181a-5p成熟体序列由四川农业大学水禽育种课题组前期miRNA测序所得,采用MEGA 7进行保守性分析。
1.4 miR-181a-5p靶基因集的建立
利用miRecords_version4[9](http://c1.accurascience.com/)、miRTarBase7.0[10](http://mirtarbase.mbc.nctu.edu.tw/php/index.php)、Tarbase8.0[11](http://carolina.imis.athenainnovation.gr/diana_tools/web/index.php?r=tarbasev8/index)数据库中收录的miR-181a-5p经试验验证的靶基因,结合最新的相关文献,得到试验验证靶基因。为降低靶基因预测的假阳性,综合TragetScan 7.1(http://www.targetscan.org/vert_71/)、miRanda(http://www.microrna.org/)、DIANA-microT[12](http://diana.imis.athena-innovation.gr/DianaTools/index.php?r=microT_CDS/index)、miRWALK 2.0[13](http://zmf.umm.uni-heidelberg.de/apps/zmf/mirwalk2/) 4个在线软件预测结果的交集,得到预测靶基因。将收集整理的已验证靶基因和预测的靶基因合并,得到miR-181a-5p靶基因集。
1.5 miR-181a-5p靶基因的GO和KEGG富集分析
采用webgestalt 2017[14](http://www.webgestalt.org/option.php)对miR-181a-5p靶基因集进行GO和KEGG分析,对所得到的富集结果用R作图。GO分析采用超几何检验计算P值,P<0.05为具有统计学意义。KEGG分析以Fisher Exact Test计算P值,P<0.05为基因集合相对于背景具有统计学意义的信号通路。
1.6 靶基因互作网络分析
根据前面整理得到的miR-181a-5p靶基因集,利用String(https://string-db.org/)数据库,得到靶基因的网络互作关系,使用Cytoscape中的MCODE[15]插件筛选其中的核心调控网络,根据该网络拓扑中度的重要性对靶基因进行筛选。
1.7 miR-181a-5p及其靶基因在不同阶段颗粒层中的表达分析
利用qPCR分别检测miR-181a-5p和部分核心
靶基因在不同阶段颗粒层中的表达,然后运用MEV软件进行基因和样本双向聚类,绘制基因表达热图。miR-181a-5p检测采用茎环法,所用茎环引物和qPCR检测试剂均由广州锐博生物科技有限公司提供。miRNA检测采用20 μL反应体系:2×SYBR Green Mix 10 μL、RT Product 2 μL、Bulge-LoopTM miRNA Forward Primer 0.8 μL、Bulge-LoopTM Reverse Primer 0.8 μL、dH2O 6.4 μL。mRNA检测使用25 μL反应体系:SYBR®Premix ExTaqⅡ 12.5 μL,dH2O 8.5 μL,Forward Primer 1.0 μL(10 μmol/L)、Reverse Primer(10 μmol/L)1.0 μL,cDNA 2.0 μL。qPCR反应条件为:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s扩增,40个循环;熔解曲线为55~95 ℃,每5 s增加0.5 ℃,以检测引物特异性。所用引物信息如表1所示。
表1 所用引物信息
Tab.1 List of used primers
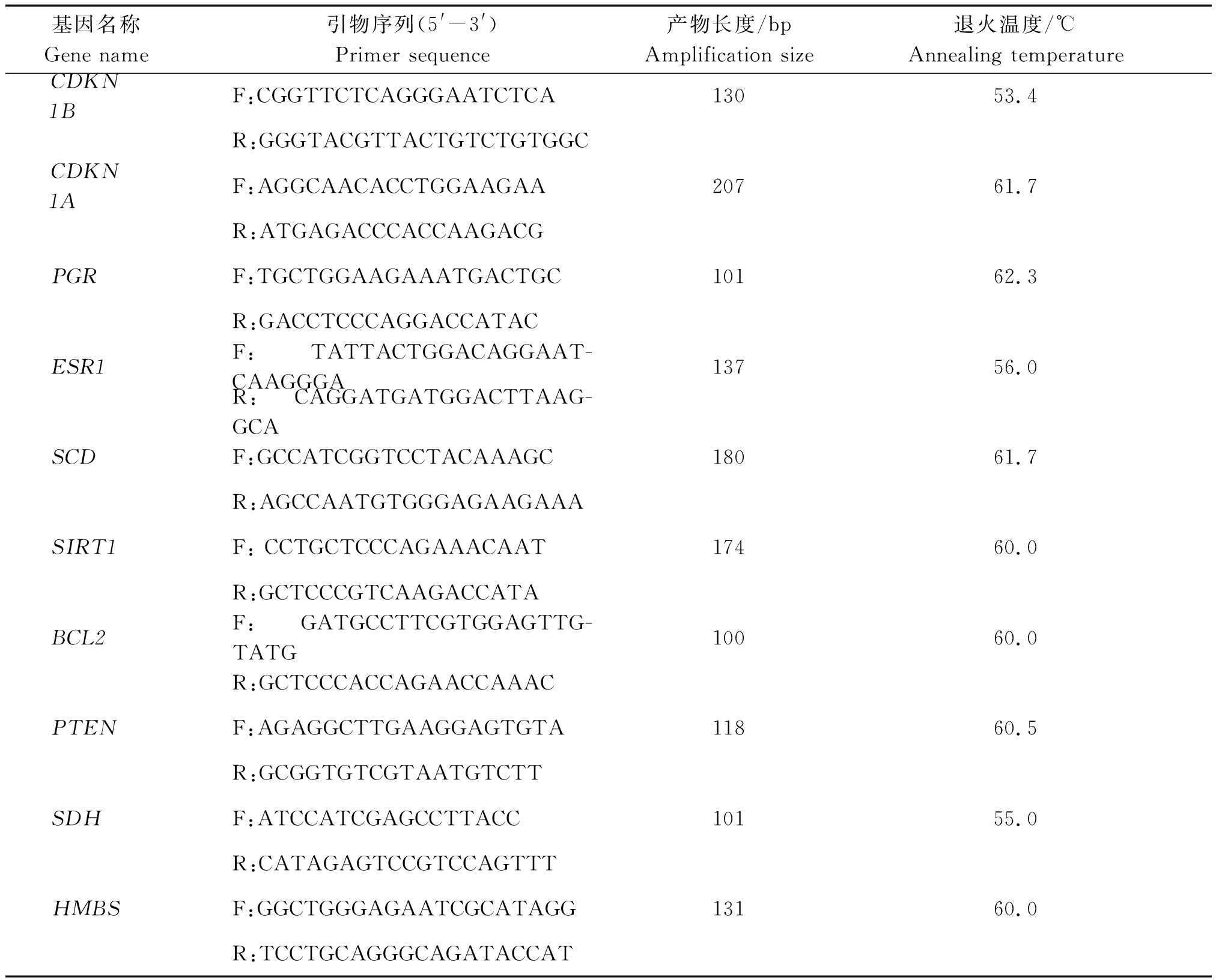
基因名称Gene name引物序列(5'-3')Primer sequence产物长度/bpAmplification size退火温度/℃Annealing temperatureCDKN1BF:CGGTTCTCAGGGAATCTCA13053.4R:GGGTACGTTACTGTCTGTGGCCDKN1AF:AGGCAACACCTGGAAGAA 20761.7R:ATGAGACCCACCAAGACGPGRF:TGCTGGAAGAAATGACTGC10162.3R:GACCTCCCAGGACCATACESR1F:TATTACTGGACAGGAAT-CAAGGGA13756.0R:CAGGATGATGGACTTAAG-GCASCDF:GCCATCGGTCCTACAAAGC 18061.7R:AGCCAATGTGGGAGAAGAAASIRT1F: CCTGCTCCCAGAAACAAT17460.0R:GCTCCCGTCAAGACCATA BCL2F:GATGCCTTCGTGGAGTTG-TATG10060.0R:GCTCCCACCAGAACCAAACPTENF:AGAGGCTTGAAGGAGTGTA11860.5R:GCGGTGTCGTAATGTCTTSDHF:ATCCATCGAGCCTTACC10155.0R:CATAGAGTCCGTCCAGTTTHMBSF:GGCTGGGAGAATCGCATAGG13160.0R:TCCTGCAGGGCAGATACCAT
2 结果与分析
2.1 miR-181a-5p的保守性分析
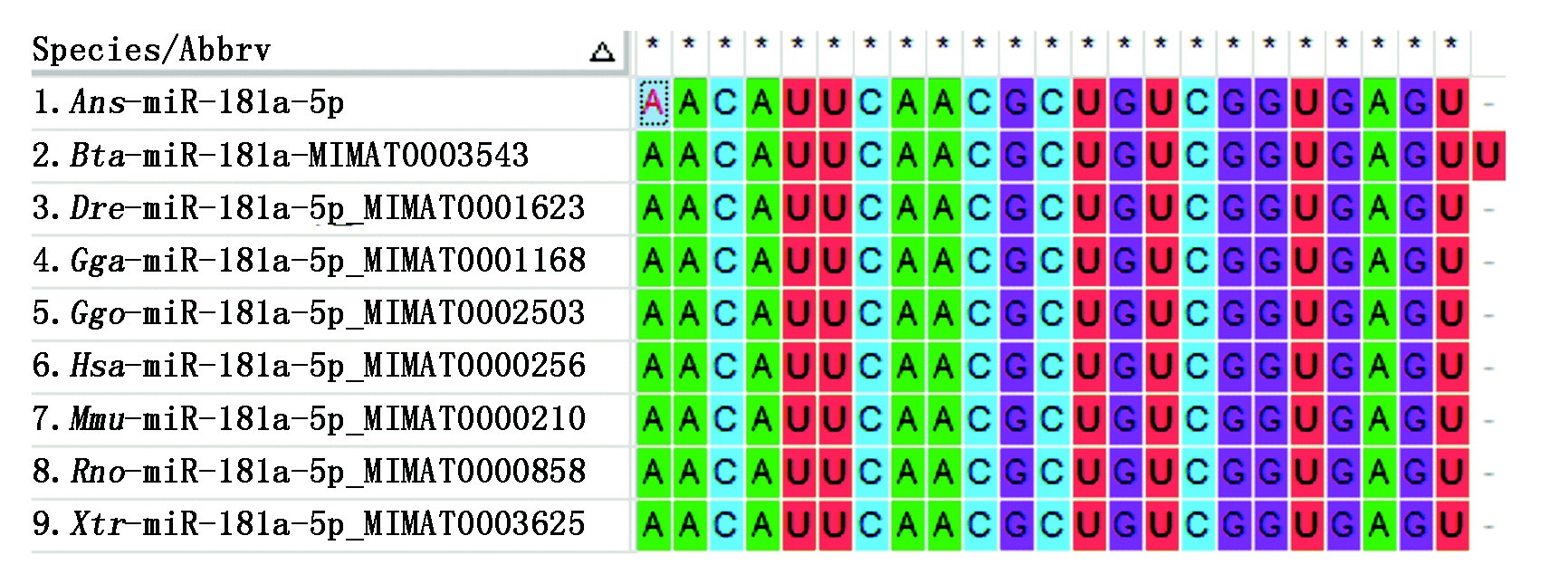
通过miRBase对鹅(Ans)、鸡(Gga)、人(Hsa)、小鼠(Mmu)、大鼠(Rno)、大猩猩(Ggo)、牛(Bta)、斑马鱼(Dre)、热带爪蟾(Xtr)等多个物种的miR-181a-5p的成熟体序列进行比对,发现miR-181a-5p的成熟体序列在各个物种中高度保守,其2~8位核心的种子序列基本一致,仅在部分物种中3′端的个别碱基不同(图1)。
2.2 miR-181a-5p靶基因集的建立
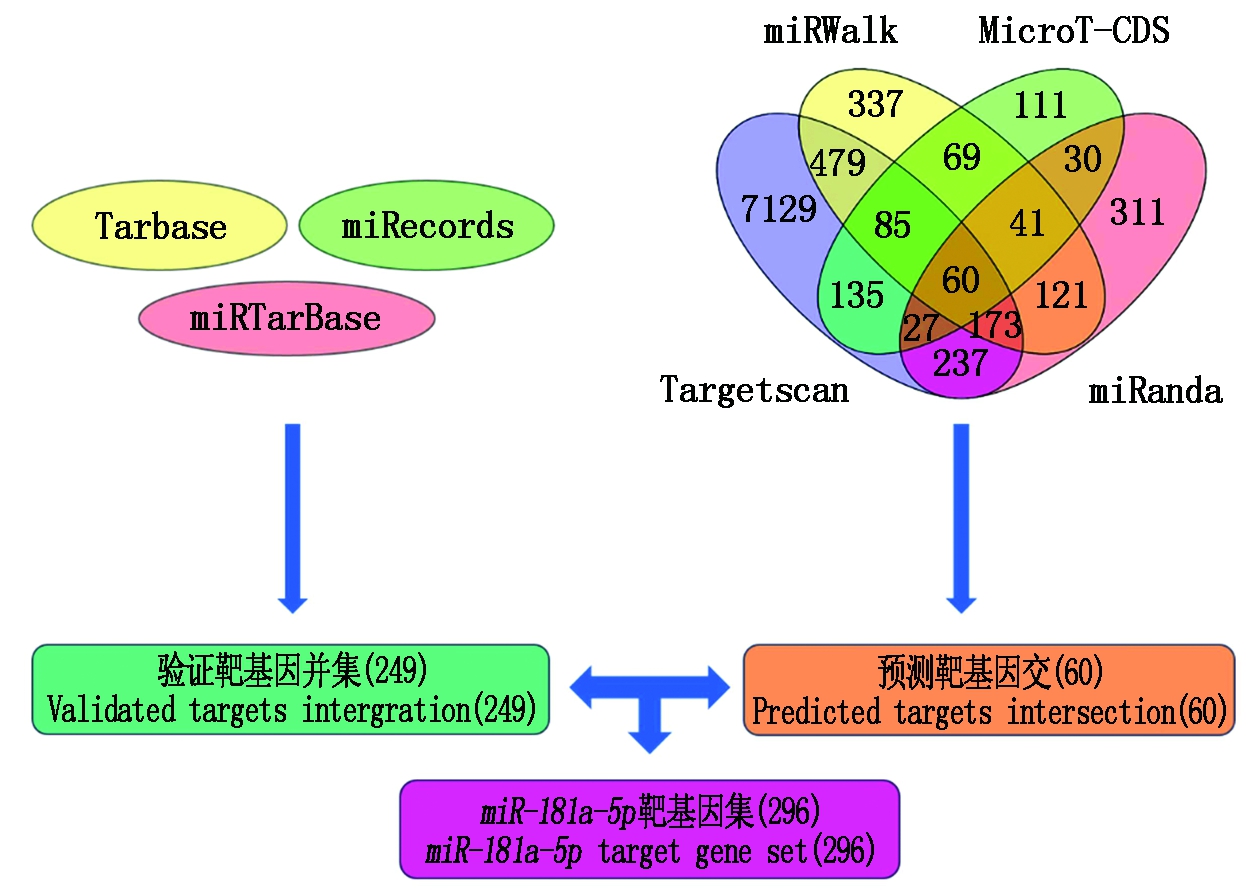
对miRecords_version4、miRTarBase、Tarbase 7.0等数据库中收录的经试验验证的miR-181a-5p靶基因信息,收集整理得到已验证靶基因249个。综合TragetScan 7.1、miRanda、miRWalk 2.0、DIANA-microT等在线软件预测的结果,选择4个软件均预测到的基因,得到60个预测的靶基因。综合验证和预测靶基因的结果,得到总数为296个的miR-181a-5p靶基因集(图2)。
2.3 miR-181a-5p靶基因的GO和KEGG富集分析
对miR-181a-5p靶基因的GO富集分析生物学过程结果如表2所示,发现miR-181a-5p靶基因主要参与调控细胞的增殖分化过程,在显著富集(P<0.05)的前10条Go term中,其中有3条均与细胞的增殖分化有关,表明miR-181a-5p的功能主要与细胞的增殖分化相关。同时miR-181a-5p在繁殖结构和系统的发育、组织结构形成、多细胞器官的发育、生物大分子代谢等过程也具有重要的调控作用。大部分靶基因均定位于细胞膜,主要以结合蛋白的形式发挥转录调控功能。
表2 miR-181a-5p靶基因的GO分析
Tab.2 GO annotation of miR-181a-5p target gene
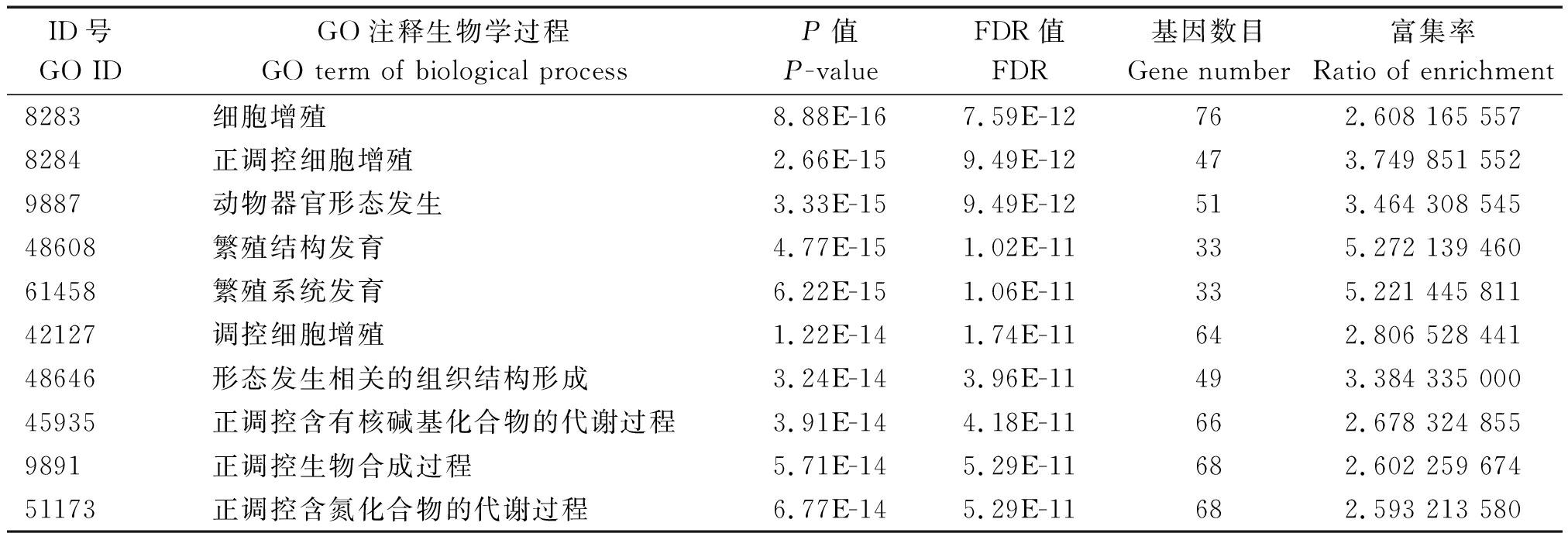
ID号GO IDGO注释生物学过程GO term of biological processP值P-valueFDR值FDR基因数目Gene number富集率Ratio of enrichment8283细胞增殖8.88E-167.59E-12762.608 165 5578284正调控细胞增殖2.66E-159.49E-12473.749 851 5529887动物器官形态发生3.33E-159.49E-12513.464 308 54548608繁殖结构发育4.77E-151.02E-11335.272 139 46061458繁殖系统发育6.22E-151.06E-11335.221 445 81142127调控细胞增殖1.22E-141.74E-11642.806 528 44148646形态发生相关的组织结构形成3.24E-143.96E-11493.384 335 00045935正调控含有核碱基化合物的代谢过程3.91E-144.18E-11662.678 324 8559891正调控生物合成过程5.71E-145.29E-11682.602 259 67451173正调控含氮化合物的代谢过程6.77E-145.29E-11682.593 213 580
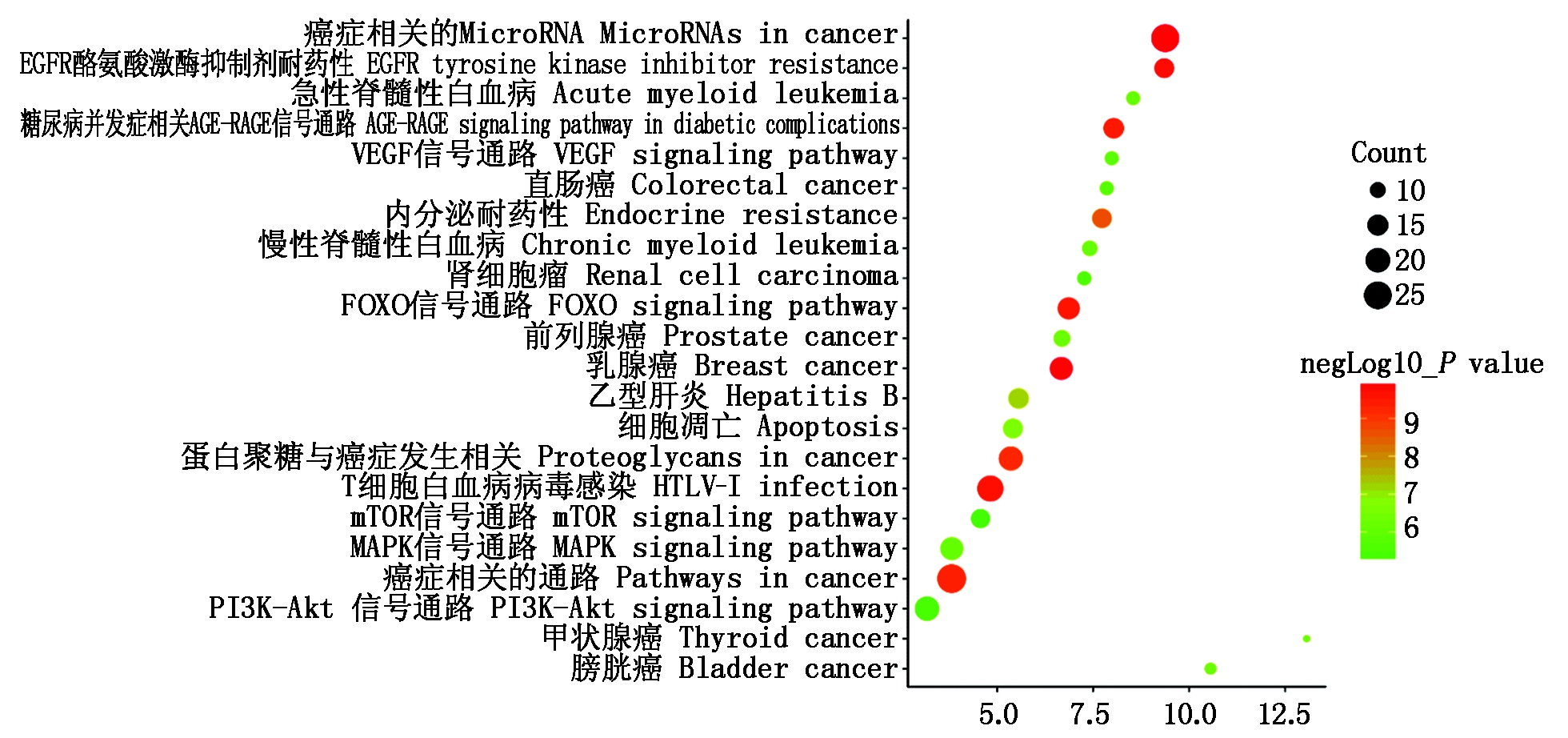
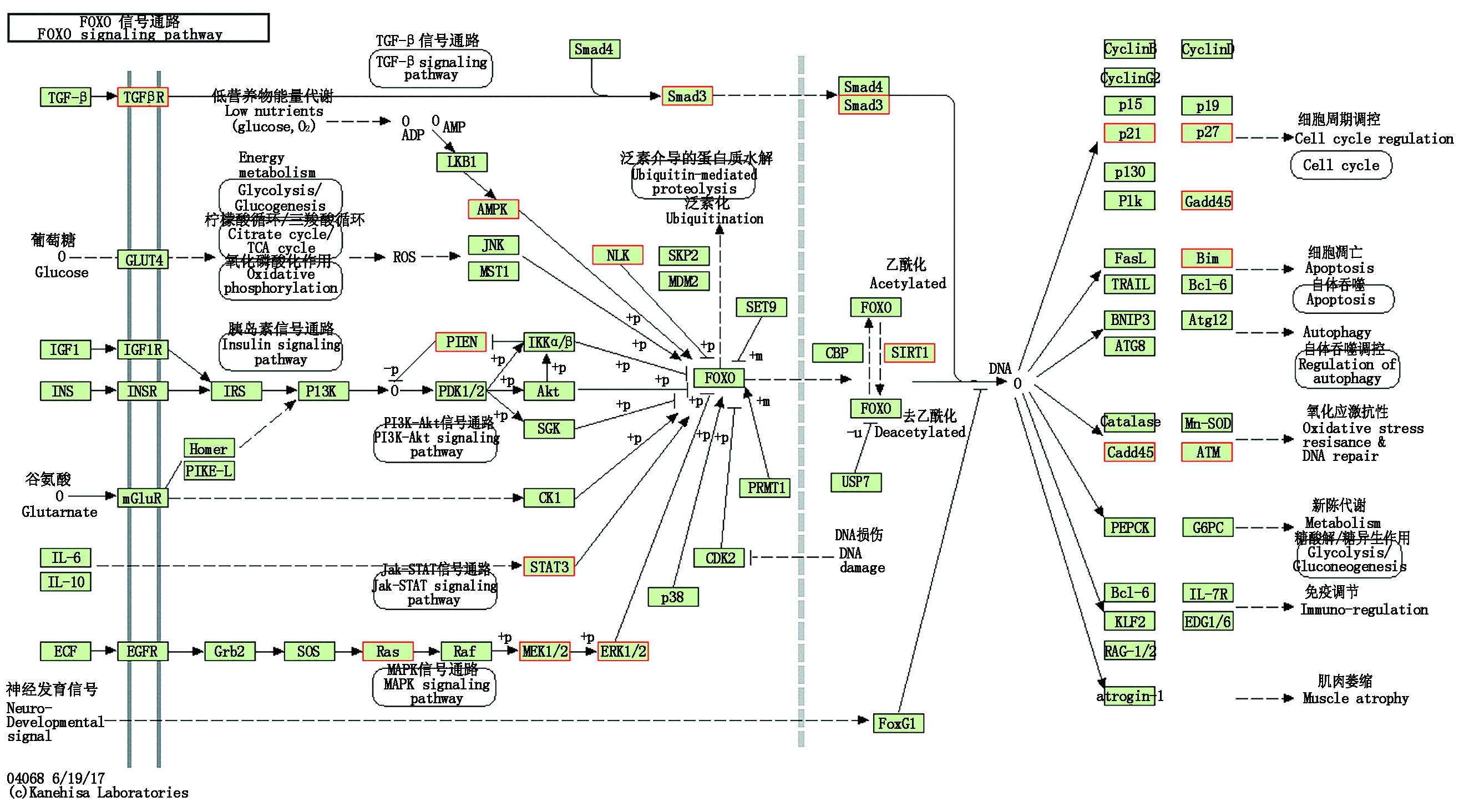
对靶基因进行KEGG富集分析,结果如图3所示,发现主要富集到多种癌症信号通路,如乳腺癌、蛋白聚糖癌、肝炎、前列腺癌、膀胱癌等多种疾病,而在显著富集的20条通路中,除疾病相关的信号通路外,还有FOXO、MAPK、mTOR、PI3K-Akt等信号通路,其中,FOXO为富集最为显著的信号通路之一。FOXO家族为一类转录因子,可通过诱导促凋亡因子来调控细胞的增殖和凋亡[16]。而MAPK、mTOR、PI3K-Akt等信号通路均与细胞的增殖、分化、凋亡有关。多数靶基因均能富集到FOXO信号通路之中(图4),而MAPK、mTOR、PI3K-Akt等信号通路均与细胞的增殖、分化、凋亡相关,而所富集得到的这些信号通路之间相互关联、互相影响。由此说明,miR-181a-5p功能的实现与FOXO、MAPK、mTOR、PI3K-Akt这些信号通路密切相关。
2.4 靶基因功能互作网络分析
根据筛选出的miR-181a-5p靶基因集,利用String数据库得到靶基因的互作关系,使用Cytoscape中的MCODE插件筛选其中的核心调控网络,根据该网络拓扑中度的重要性对靶基因进行排序。如图5所示,其中排在前10位的靶基因分别是:VEGFA、MAPK1、FOS、KRAS、HRAS、SIRT1、BCL2、ESR1、PTEN、CDKN1A,而排在前10位的靶基因均为文献报道的靶基因,可能是由于软件预测存在较高的假阳性,但同时也说明筛选出的靶基因对miR-181a-5p的功能具有重要影响。筛选出来的10个核心靶基因中,PTEN、SIRT1为FOXO信号通路的核心成员。SIRT1主要通过去乙酰化调控相应转录因子的活性,在转录调控、细胞分化、凋亡等过程具有重要的调节作用[17-18]。CDKN1A是细胞周期G1期重要的调控因子,而BCL2是细胞凋亡的关键因子。MAPK1是MAPK信号通路的核心基因,对细胞的增殖分化具有重要的调控作用。
2.5 miR-181a-5p在不同阶段颗粒层中的表达分析
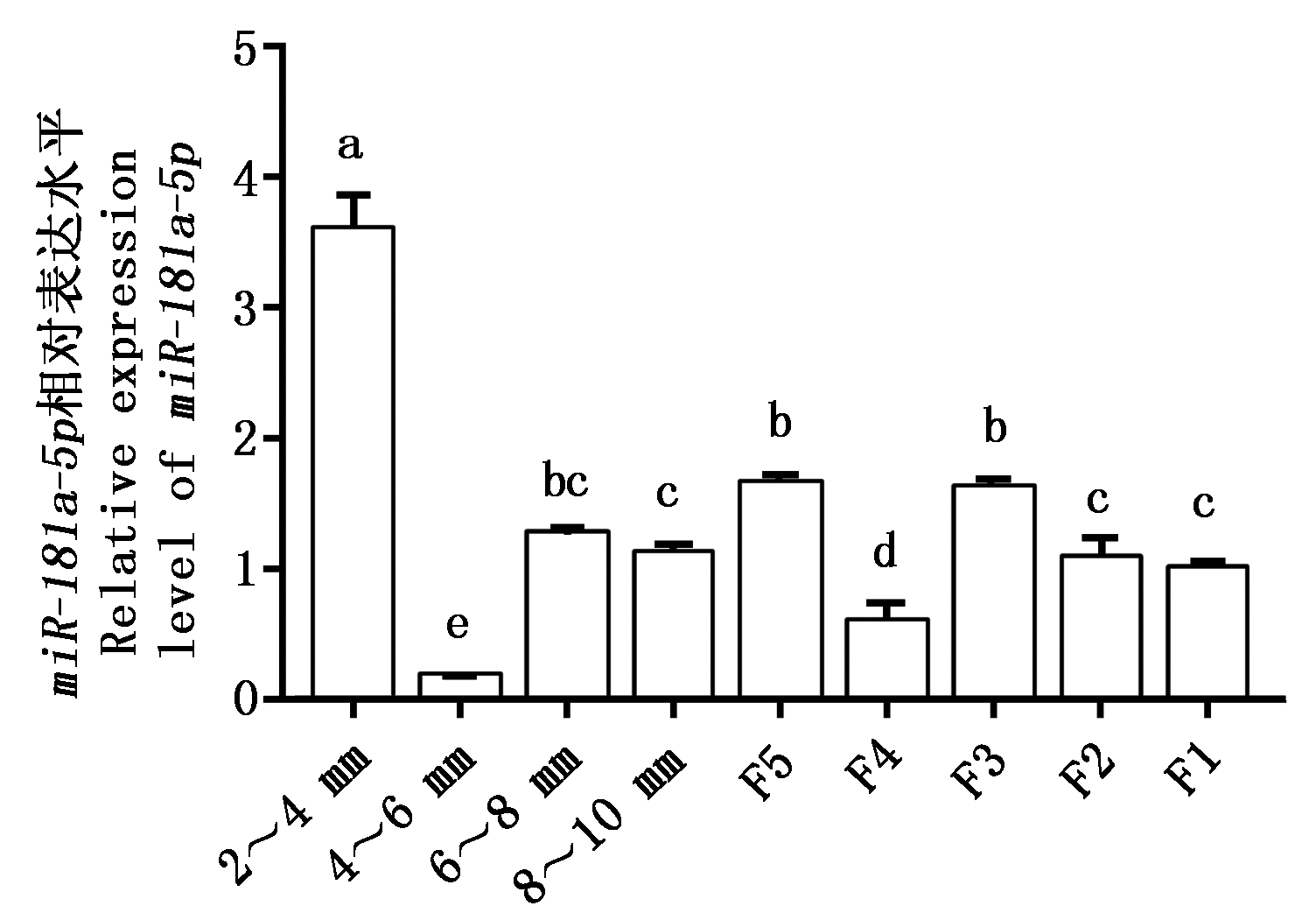
miR-181a-5p在不同阶段颗粒层中的表达情况如图6所示,miR-181a-5p在所有阶段颗粒层中均有分布,miR-181a-5p在2~4 mm阶段表达最高,而在4~6 mm阶段急剧下降,之后在等级前随着卵泡直径的增加,miR-181a-5p表达呈现出逐渐增加的规律,且在4~6 mm,8~10 mm、F5这3个阶段呈现显著上升趋势(P<0.05)。而在进入等级发育阶段后,miR-181a-5p的表达并未呈现明显的变化规律。其中,8~10 mm和F5为等级前卵泡发育到等级卵泡的过渡时期,极易因颗粒细胞凋亡而引发卵泡闭锁,推测miR-181a-5p可能参与鹅卵泡颗粒细胞增殖凋亡过程。
2.6 miR-181a-5p及其靶基因在不同阶段颗粒层中的表达聚类分析
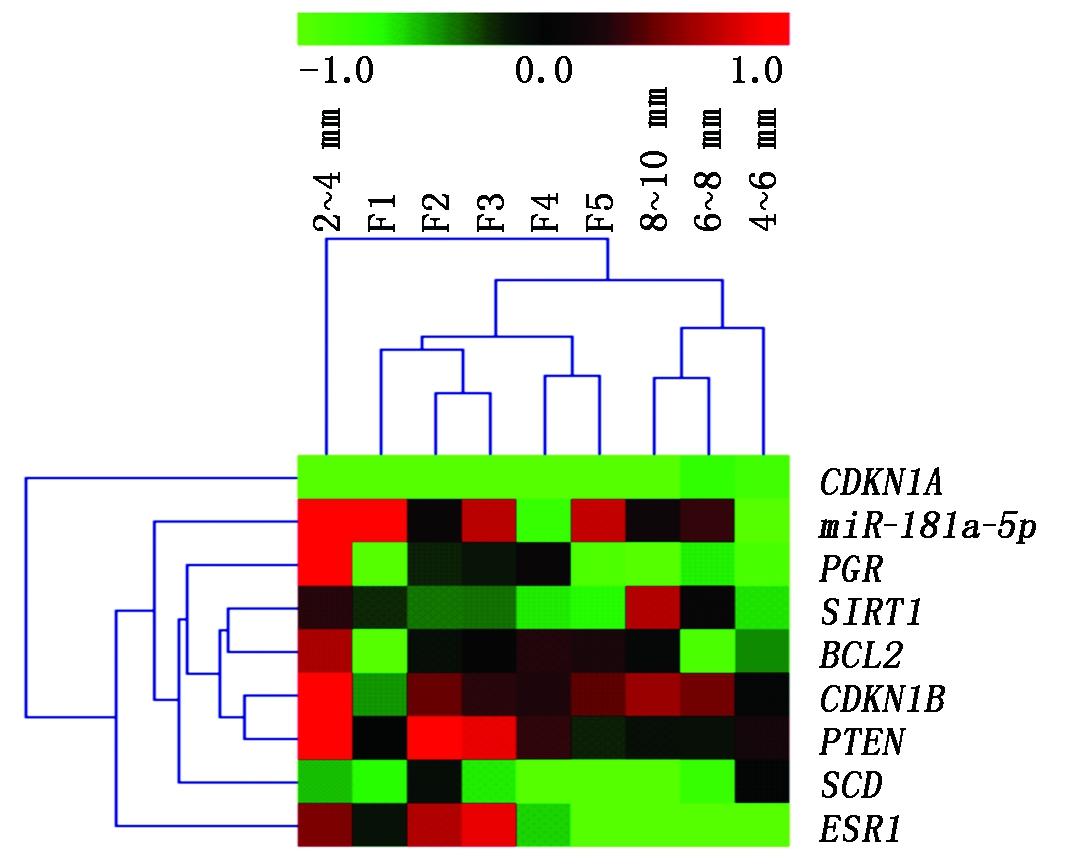
为探究miR-181a-5p及其可能靶基因在不同阶段颗粒层中的表达规律,对miR-181a-5p及其靶基因进行表达聚类分析,结果如图7所示。结果表明,PGR、SIRT1、BCL2、CDKN1B、PTEN、SCD聚在一起,而这些基因主要与细胞的增殖凋亡相关。miR-181a-5p与ESR1在颗粒层中表达模式较为相似,而CDKN1A则与其他基因的表达模式差距较大。miR-181a-5p与其靶基因通常存在负调控关系,理论上而言,在表达模式上越相近,则为miR-181a-5p的靶基因可能性越低。样本聚类上,除2~4 mm比较特殊以外,等级前卵泡3个阶段4~6 mm、6~8 mm、8~10 mm聚为一类,而等级卵泡5个阶段F5、F4、F3、F2、F1则全部聚在了一起。miR-181a-5p与其靶基因的表达模式在8~10 mm、F5阶段发生了较大的变化,而8~10 mm和F5为等级前卵泡发育到等级卵泡的过渡时期,表明miR-181a-5p与其靶基因在卵泡的动态发育中具有重要调控作用,可能通过调控颗粒细胞的增殖凋亡调控卵泡的动态发育。
3 结论与讨论
本研究通过4个靶基因预测软件取交集得到60个可能的靶基因,其中有13个有相关的文献报道,而收集整理的已有文献报道的靶基因249个。通过对预测结合报道的靶基因进行GO分析,发现miR-181a-5p对细胞的增殖、分化、凋亡有重要的调控功能,同时在繁殖结构和系统的发育中也具有重要作用。靶基因的KEGG分析发现,多数靶基因主要富集到FOXO、MAPK、PI3K-Akt等信号通路之中。研究表明,在多数哺乳动物中,miRNA更倾向于结合到保守的mRNA的3′UTR区域,因此,miRNA的靶基因可能具有一定的保守性[19]。由于miR-181a-5p在多数脊椎动物中高度保守,因而在不同的物种中可能具有相类似的功能,而miR-181a-5p发挥其功能主要是负调控其靶基因来实现。目前,已有报道,miR-181a-5p与FOXO、TGF-β、PI3K-Akt、MAPK等信号通路有关,主要通过靶向结合信号通路相关基因来实现相应的生物学功能调控。miR-181a-5p参与FOXO信号通路的调节,在小鼠颗粒细胞中,miR-181a-5p可增加FOXO1乙酰化,同时可靶向抑制SIRT1启动颗粒细胞的凋亡[20]。PTEN作为FOXO信号通路的一员,对卵巢也具有重要调控功能。在靶向敲除PTEN的小鼠中,可延长黄体细胞的生存周期,同时促进排卵[21]。miR-181a-5p可作为一种调控因子来启动TGF-β信号通路,在卵巢上皮癌细胞中,miR-181a-5p可通过靶向抑制SMAD7的功能来调控TGF-β介导的上皮间充质细胞的转变[22]。在小鼠成纤维细胞中,miR-181a-5p能够靶向SMAD7和TCF7L2调节TGF-β/SMAD信号通路,最终影响脂肪细胞的分化形成[23]。研究表明,miR-181a-5p可通过靶向抑制RASSF6,进而激活MAPK信号通路,最终抑制胃癌细胞的增殖[24]。miR-181a-5p可通过MAPK/JNK信号通路调控成神经细胞瘤的凋亡和细胞自噬过程[25]。而在笔者的富集结果中也同样富集到了相关的通路,这些信号通路广泛存在多数细胞之中,与细胞的增殖、分化、凋亡等生理过程联系密切。
研究发现,miRNA靶基因在功能方面也有一定的相似性,通过构建miRNA调控的功能模块,发现miRNA靶基因倾向于分布在同一功能模块[26]。通过对miR-181a-5p靶基因的GO和KEGG发现,miR-181a-5p主要参与调控细胞的增殖、分化、凋亡过程,而多数靶基因集中于FOXO、MAPK、PI3K-Akt等信号通路之中。研究表明,miR-181a-5p可直接靶向ACVR2A抑制颗粒细胞的增殖[9],也可靶向抑制SIRT1启动颗粒细胞的凋亡[20]。研究发现,miR-181a可抑制孕酮的释放,而miR-181a-5p能够与PGR的3′UTR区域结合,并抑制其在mRNA和蛋白水平的表达[27-28],推测可能是由于miR-181a-5p抑制颗粒细胞的增殖分化,进而影响孕酮的合成。miR-181a-5p在所有阶段颗粒细胞中均有分布,且在4~6 mm、8~10 mm、F5这3个阶段呈现显著上升趋势,而在等级前卵泡中,容易因颗粒细胞凋亡而引起卵泡闭锁,8~10 mm和F5为等级前卵泡发育到等级卵泡的过渡时期,表明miR-181a-5p可能通过调控颗粒细胞的增殖凋亡参与卵泡的动态发育过程。而在对miR-181a-5p及其靶基因的表达聚类分析中,也发现样品聚类呈现出明显的阶段划分,基因的表达模式在8~10 mm和F5阶段发生了较大的改变。而细胞增殖凋亡相关的基因SIRT1、BCL2、CDKN1B、PTEN聚在了一起,表明颗粒细胞的增殖凋亡在卵泡的动态发育过程中是主要的生理变化过程。
综上所述,miR-181a-5p可能通过靶向结合SIRT1、BCL2、CDKN1B、PTEN等基因参与FOXO、MAPK、PI3K-Akt相关信号通路来调控颗粒细胞的增殖凋亡过程。本试验为后续深入探究miR-181a-5p在鹅颗粒细胞中的功能机制奠定了基础,而所预测得到的miR-181a-5p可能的靶基因及其信号通路还有待进一步试验验证。
参考文献:
[1] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[2] Naguibneva I, Ameyar-Zazoua M, Polesskaya A, et al. The microRNA miR-181 targets the homeobox protein Hox-A11 during mammalian myoblast differentiation[J]. Nature Cell Biology, 2006, 8(3): 278-284.
[3] Zhu H Y, Liu M Y, Hong Q, et al. Role of microRNA-181a in the apoptosis of tubular epithelial cell induced by cisplatin[J]. Chinese Medical Journal, 2012, 125(3): 523-526.
[4] Lee S I, Lee B R, Hwang Y S, et al. MicroRNA-mediated posttranscriptional regulation is required for maintaining undifferentiated properties of blastoderm and primordial germ cells in chickens[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(26): 10426-10431.
[5] He B, Mi Y, Zhang C. Gonadotropins regulate ovarian germ cell mitosis/meiosis decision in the embryonic chicken[J]. Molecular and Cellular Endocrinology, 2013, 370(1/2): 32-41.
[6] Sirotkin A V, Laukova M, Ovcharenko D A, et al. Identification of MicroRNAs controlling human ovarian cell proliferation and apoptosis[J]. Journal of Cellular Physiology, 2010, 223(1): 49-56.
[7] Zhang Q, Sun H, Jiang Y, et al. MicroRNA-181a suppresses mouse granulosa cell proliferation by targeting activin receptor IIA[J]. PLoS One, 2013, 8(3): e59667.
[8] Kozomara A, Griffiths-jones S. miRBase: annotating high confidence miRNAs using deep sequencing data[J]. Nucleic Acids Res, 2014, 42: D68-D73.
[9] Xiao F, Zuo Z, Cai G, et al. miRecords: an integrated resource for microRNA-target interactions[J]. Nucleic Acids Research, 2009, 37(1): D105-D110.
[10] Chou C H, Chang N W, Shrestha S, et al. miRTarBase 2016: updates to the experimentally validated miRNA-target interactions database[J]. Nucleic Acids Research, 2016, 44(D1): D239-D247.
[11] Vlachos I S, Paraskevopoulou M D, Karagkouni D, et al. DIANA-TarBase v7.0: indexing more than half a million experimentally supported miRNA:mRNA interactions[J]. Nucleic Acids Research, 2015, 43(D1): D153-D159.
[12] Paraskevopoulou M D, Georgakilas G, Kostoulas N, et al. DIANA-microT web server v5.0: service integration into miRNA functional analysis workflows[J]. Nucleic Acids Research, 2013, 41(Web Server issue): W169-W173.
[13] Dweep H, Gretz N. miRWalk2.0: a comprehensive Atlas of microRNA-target interactions[J]. Nature Methods, 2015, 12(8): 697.
[14] Wang J, Vasaikar S, Shi Z, et al. WebGestalt 2017: a more comprehensive, powerful, flexible and interactive gene set enrichment analysis toolkit[J]. Nucleic Acids Research, 2017, 45(W1): W130-W137.
[15] Bader G D, Hogue C W. An automated method for finding molecular complexes in large protein interaction networks[J]. BMC Bioinformatics, 2003, 4(1): 2.
[16] Zhang X B, Tang N M, Hadden T J, et al. Akt, FoxO and regulation of apoptosis[J]. Biochimica et Biophysica Acta-Molecular Cell Research, 2011, 1813(11): 1978-1986.
[17] Saunders L R, Sharma A D, Tawney J, et al. miRNAs regulate SIRT1 expression during mouse embryonic stem cell differentiation and in adult mouse tissues[J]. Aging, 2010, 2(7): 415-431.
[18] Flick F, Luescher B. Regulation of sirtuin function by posttranslational modifications[J]. Frontiers in Pharmacology, 2012, 3(29): 1-13.
[19] Friedman R C, Farh K K, Burge C B, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Research, 2009, 19(1): 92-105.
[20] Zhang M, Zhang Q, Hu Y L, et al. miR-181a increases FoxO1 acetylation and promotes granulosa cell apoptosis via SIRT1 downregulation[J]. Cell Death & Disease, 2017, 8(10): e3088.
[21] Fan H Y, Liu Z L, Cahill N, et al. Targeted disruption of Pten in ovarian granulosa cells enhances ovulation and extends the life span of luteal cells[J]. Molecular Endocrinology, 2008, 22(9): 2128-2140.
[22] Parikh A, Lee C, Joseph P, et al. microRNA-181a has a critical role in ovarian cancer progression through the regulation of the epithelial-mesenchymal transition[J]. Nature Communications, 2014, 5: 2977.
[23] Ouyang D, Xu L F, Zhang L H, et al. MiR-181a-5p regulates 3T3-L1 cell adipogenesis by targeting Smad7 and Tcf7l2[J]. Acta Biochimica et Biophysica Sinica, 2016, 48(11): 1034-1041.
[24] Mi Y, Zhang D, Jiang W, et al. miR-181a-5p promotes the progression of gastric cancer via RASSF6-mediated MAPK signalling activation[J]. Cancer Letters, 2017, 389: 11-22.
[25] Liu Y, Song Y, Zhu X. MicroRNA-181a regulates apoptosis and autophagy process in parkinson′s disease by inhibiting p38 Mitogen-Activated protein kinase (MAPK)/c-Jun N-Terminal kinases (JNK) signaling pathways[J]. Medical Science Monitor : International Medical Journal of Experimental and Clinical Research, 2017, 23: 1597-1606.
[26] Tran D H, Satou K, Ho T B. Finding microRNA regulatory modules in human genome using rule induction[J]. BMC Bioinformatics, 2008, 9(12): S5-S12.
[27] Sirotkin A V, Ovcharenko D, Grossmann R A, et al. Identification of MicroRNAs controlling human ovarian cell steroidogenesis via a Genome-Scale screen[J]. Journal of Cellular Physiology, 2009, 219(2): 415-420.
[28] Panda H, Chuang T D, Luo X P, et al. Endometrial miR-181a and miR-98 expression is altered during transition from normal into cancerous state and target PGR, PGRMC1, CYP19A1, DDX3X, and TIMP3[J]. Journal of Clinical Endocrinology & Metabolism, 2012, 97(7): E1316-E1326.
Prediction of miR-181a-5p Target Gene and Its Expression Analysis in Goose Follicle Granular Layer
MO Yuanliang,DENG Yan,WANG Jiwen
(College of Animal Science and Technology, Sichuan Agricultural University, Farm Animal Genetic Resources Exploration and Innovation Key Laboratory of Sichuan Province,Chengdu 611130, China)
Abstract: To lay a foundation for further explore of the possible function and mechanism ofmiR-181a-5p in geese granulosa cell. Based on various network database, we predicted the potential targets and associated signaling pathways ofmiR-181a-5p through bioinformatics methods. Then the expression ofmiR-181a-5p and its targets in different stages granular layer were detected by qPCR.The results showed thatmiR-181a-5p was highly conserved in vertebrates. The GO and KEGG analysis revealed thatmiR-181a-5p mainly involved in the regulation of cell proliferation, differentiation and apoptosis. Most of target genes were mainly enriched in FOXO, MAPK, and PI3K-Akt signaling pathways. According to the interaction network of target genes, 10 core target genes (VEGFA,MAPK1,FOS,KRAS,HRAS,SIRT1,BCL2,ESR1,PTEN,CDKN1A) were screened out and most of these targets were associated with cell proliferation and apoptosis. The levels ofmiR-181a-5p was the highest in 2-4 mm follicles,but declined sharply in the 4-6 mm and showed an upward trend in the 4-6 mm, 8-10 mm, and F5 follicles.miR-181a-5p might regulate theSIRT1,BCL2,CDKN1B,PTEN, etc, then participate in FOXO, MAPK, PI3K-Akt signaling pathway to regulate the proliferation and apoptosis of granulosa cells.
Key words: miR-181a-5p; GO and KEGG analysis;Expression analysis;Granulosa cells; Proliferation; Apoptosis
中图分类号:S835
文献标识码:A
文章编号:1000-7091(2018)06-0095-08
doi:10.7668/hbnxb.2018.06.013