水杨酸(Salicylic acid,SA)是植物内源性信号分子,参与调节植物许多生理过程[1-2]。外施SA可以提高植物对盐[3]、高热[4]、低温[5]、干旱[6]、紫外线[7]、重金属[8]等非生物胁迫的耐受性。
SA在提高植物抗病性方面的作用尤其受到人们的关注[9-10]。SA是植物受到病原菌侵害时发生超敏反应(Hypersensitive response,HR)以及形成系统获得性抗性(Systemic acquired resistance,SAR)所需要的内源信号分子[11-12],阻断SA的生成或促进SA的分解,都会出现HR的延缓和病斑扩散的现象[13]。有人对辣椒等植物外源施用SA,也有效提高了植株对疾病的抗性和病程相关基因(PR)的表达[14]。
有很多研究证实,SA介导的HR是一个程序性细胞死亡(Programmed cell death,PCD)过程[15-16]。植物发生HR时,常伴随着特异性信号分子ROS和SA的积累以及PR的表达,激发邻近组织的特异性防御反应和植株的SAR[12]。线粒体在PCD中扮演重要角色[17-18]:有研究表明,线粒体通透性转运孔(Mitochondria permeability transition pore,MPTP)的开放是PCD中发生的重要信号之一[19]。MPTP的开放引起线粒体膜电位下降,进一步导致氧化磷酸化作用的解偶联,膜内外离子浓度趋于平衡,进而导致线粒体外膜被破坏和细胞色素C(Cytochrome C,Cyt C)的释放,释放到胞质内的Cyt C可以激活Caspase等下游关键酶类,使信号级联放大而触发PCD[20-21]。但近年来人们开始注意叶绿体在PCD中的作用[22]。早在2002年就有报道,氰化物(CN)在光刺激下引发含叶绿体的豌豆果皮细胞的PCD过程,而不含叶绿体的表皮细胞却不受影响[22-24]。活性氧(Reactive oxygen species,ROS)具有信号和触发植物PCD的作用,而叶绿体也是ROS的重要来源,因此,叶绿体对植物PCD具有重要作用[25]。
被首先关注的就是ROS的作用。有人发现,叶绿体通过光合电子传递和叶绿素生物合成途径产生ROS,导致核心天线复合体降解,并激活 Chloroplastic Executer 1、2 蛋白,继而将信号传递到细胞核,激活细胞死亡相关基因的转录[26-27]。
被关注的还有细胞色素f(Cytochrome f)的作用。在棕榈油酸诱导的茄子细胞死亡中发现,类囊体膜上的电子传递链可释放Cyt f[28],在热胁迫下的小球藻的PCD过程中也发现了Cyt f的释放,并且证明这些Cyt f类似于线粒体中的Cyt C,它们在细胞质中的释放对细胞死亡起到重要作用[29]。通过对水稻叶片衰老过程的研究,证明释放到细胞质中的Cyt f可以与E3泛素连接酶相互作用,激活caspase-3-like 活性,导致包含蛋白泛素化的细胞PCD的发生[30]。
尽管植物基因组上没有找到编码caspase的基因,但还是找到了一些具有caspase活性的蛋白酶[31-32],一些定位在叶绿体的蛋白酶和基因开始被关注,其中有的有caspase活性,与PCD关系密切[33-36]。定位在叶绿体膜上的Cid和Lrg蛋白被发现可以执行类caspase活性,在细胞PCD中起作用[37]。
为了获取更多的与PCD相关的基因信息,植物生物学黑龙江省高校重点实验室采用数字转录表达谱技术获得了1 759个SA诱导表达的基因[38],通过基因注释筛选出15个与叶绿体相关的基因。为了揭示在SA诱导PCD中叶绿体所起的介导作用,本研究在对SA处理前后的黄瓜进行基于活性氧(ROS)原位检测、台盼蓝(Trypan blue)染色、碘化丙啶(PI)和荧光素二乙酸酯(FDA)染色、转移酶介导的dUTP缺口末端标记测定法(TUNEL)等PCD鉴定,对15个筛选得到的基因进行RT-PCR、实时荧光定量PCR的表达分析,为研究这些基因的功能和介导PCD中的作用奠定基础。
以东农649为试验材料,在光照培养箱内培养,设置为10 h黑暗、14 h 66%光照的培养条件,温度分别为24,28 ℃。
当黄瓜幼苗处于四叶期时,每隔3 cm在叶片上滴加50 μL的10 mmol/L的水杨酸,在滴加位置进行试验取材![]() 和H2O2)的检测方法采用Rame的试验方法,即NBT染色法,将材料浸入1 mg/mL DAB染液,抽气使溶液充分渗透材料,静置2~3 h,放进乙酸∶甘油∶乙醇(体积比为1∶1∶3)混合液中煮沸10 min,取出材料后放在95%乙醇中贮存并在显微镜下观察。进行ROS活性原位检测,若H2O2检测结果为阳性,则材料处理部分变成棕色;若
和H2O2)的检测方法采用Rame的试验方法,即NBT染色法,将材料浸入1 mg/mL DAB染液,抽气使溶液充分渗透材料,静置2~3 h,放进乙酸∶甘油∶乙醇(体积比为1∶1∶3)混合液中煮沸10 min,取出材料后放在95%乙醇中贮存并在显微镜下观察。进行ROS活性原位检测,若H2O2检测结果为阳性,则材料处理部分变成棕色;若![]() 检测结果为阳性,则材料处理部分变成蓝色[39]。
检测结果为阳性,则材料处理部分变成蓝色[39]。
取材方法同上,染色方法采用Stone和Bowling的试验方法[40-41]。把材料浸到Trypan blue染色液中,100 ℃水浴2~3 min后,室温(25 ℃)静置1 h,用2.5 g/mL的水合氯醛溶液将材料煮沸20 min,在此过程中需数次更换水合氯醛,至材料完全褪色为止,取材料至50%甘油(V/V)中贮存和装片,在体视显微镜下观察。若染色结果为阳性,则材料经处理的部分呈蓝色。
取经处理材料叶片下表皮细胞,清洗材料至SA完全去除,用FDA染液染色材料30 min,用双蒸水清洗材料,再用PI染色10 min,冲洗后用50%甘油(V/V)装片进行观察,荧光素激发波长为488 nm,发射波长为530 nm。PI与FDA的协同使用,分别对死细胞和活细胞染色。
采用Roche公司的In Situ Cell Death Detection Kit(11684817910)试剂盒,对SA处理后的黄瓜表皮细胞和黄瓜叶片进行TUNEL显色法检测,具体步骤见说明书。
黄瓜幼苗处于四叶期时,在叶片每隔3 cm滴加50 μL 10 mmol/L SA,分别在0,3,12,24 h这4个时间段取材并用液氮冷冻,在-80 ℃冰箱保存。分别进行半定量RT-PCR和实时荧光定量PCR测定,检测SA处理下,15个超敏反应相关基因在黄瓜叶片中的表达水平。
2.1.1 SA处理黄瓜叶片的形态变化 如图1-A所示,用10 mmol/L SA处理黄瓜幼苗叶片后,与对照组叶片(0 h)相比,处理组叶片会出现变薄的趋势,并随着处理时间的加长,叶片的变薄程度也随之增加。3 h时处理组叶片出现变薄趋势,且在6,9,12 h变薄程度明显,并在24 h达到极值。试验结果表明,处理3 h时叶片细胞开始发生PCD,并在24 h达到最大值。
2.1.2 ROS的定位 如图1-B、C所示:用SA处理黄瓜幼苗叶片后,3 h叶片出现了棕色和蓝色,说明在此时已经有ROS的积累。随着处理时间的增加,处理部位的颜色逐渐变深,ROS增多。24 h与6,9 h相比,颜色进一步加深,在处理部位周围也出现了棕色和蓝色的积累。结果表明,在SA诱导黄瓜幼苗叶片细胞死亡的过程中,伴随有ROS的暴发。
2.1.3 Trypan blue染色 如图1-D所示,与对照组叶片相比,SA处理黄瓜幼苗叶片3 h后,染色区域出现浅蓝色;6 h与3 h相比,染色区域的大小和颜色的深浅变化不大,但处理9 h后,染色区域的颜色逐渐变深;处理12,24 h后,染色区域的颜色加深呈现深蓝色,且染色区域开始向未经SA处理的区域扩散。试验结果表明,随着SA处理黄瓜叶片的时间增加,死亡的细胞也逐渐增多。

0 h.对照;3,6,9,12,24 h.10 mmol/L SA处理时长。A.叶片形态;B.DAB染色; C.NBT染色;D.Trypan blue染色。
0 h.Control;3,6,9,12,24 h .The time length of 10 mmol/L SA treated in cucumber leaves,respectively. A.Appearance of cucumber leaves;B.Stained with DAB; C.Stained with NBT;D.Stained with Trypan blue.
图1 SA处理黄瓜叶片的外观变化及DAB、NBT和台盼蓝染色图像
Fig.1 Appearance changes of cucumber leaves and the image of stained with DAB,NBT,Trypan blue in cucumber leaves under SA treatment
2.1.4 PI和FDA染色结果 如图2所示,对照组表皮细胞在荧光显微镜下,无红色荧光出现,说明对照组表皮细胞并未被PI染色,即对照组表皮细胞并没有死亡细胞的出现;FDA染色可见巨量的亮绿色荧光(图2-A),此时的细胞都是活细胞。而经过 SA处理1,3,5 h后,荧光显微镜下的红色荧光逐渐增多,绿色荧光逐渐减少(图2-B-D)。结果表明,随着SA处理时间的延长,黄瓜叶片表皮细胞的死亡比例呈现一个逐渐上升的趋势。
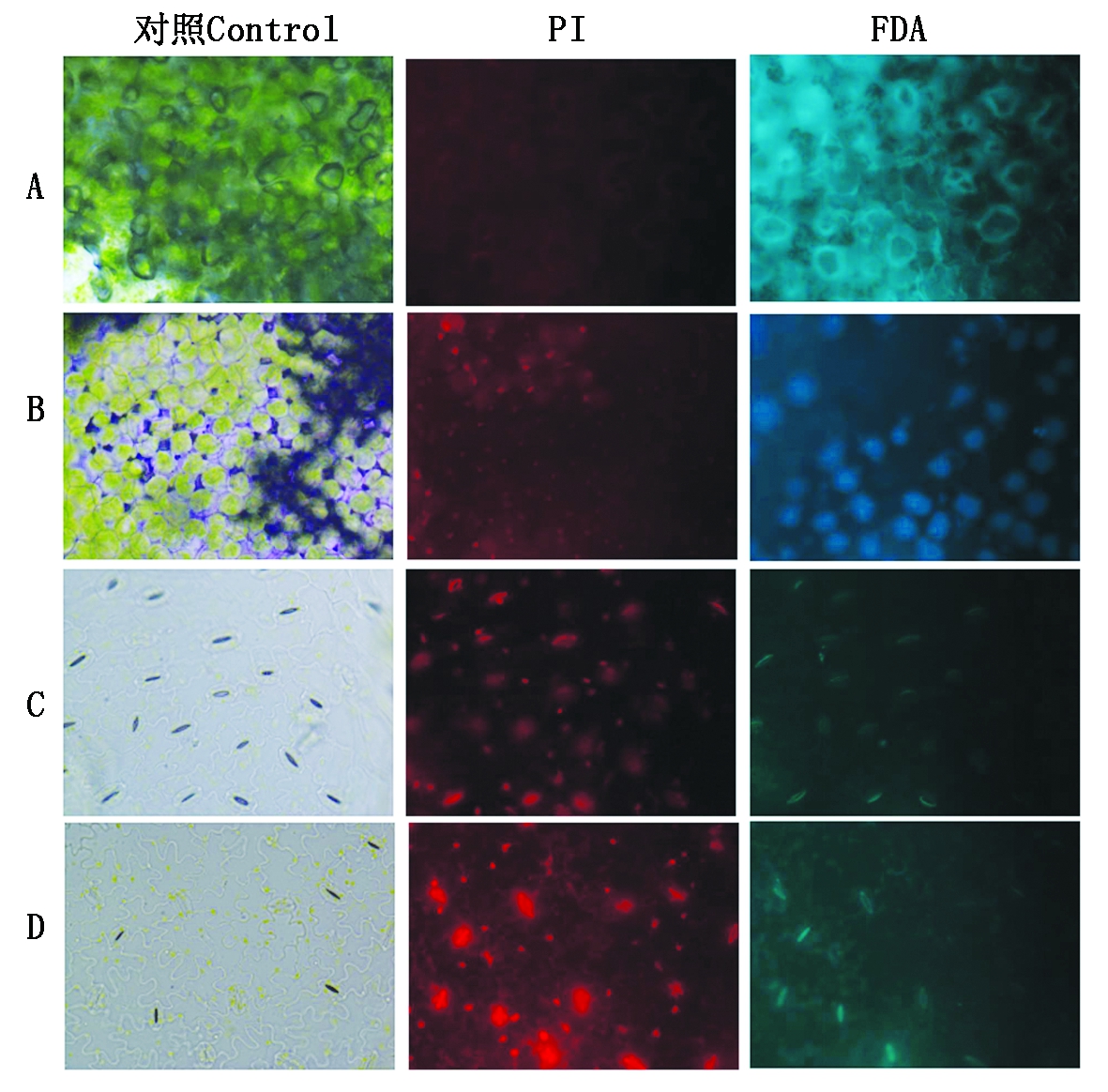
A. 未处理的黄瓜表皮细胞;B. SA处理1 h的黄瓜表皮细胞;C. SA处理3 h的黄瓜表皮细胞;D. SA处理5 h的黄瓜表皮细胞。
A.Untreated cucumber epidermal cell; B. The cucumber epidermal cells were treated with SA for 1 h; C. The cucumber epidermal cells were treated with SA for 3 h; D. The cucumber epidermal cells were treated with SA for 5 h.
图2 对照组和处理组PI染色及FDA染色的荧光图像
Fig.2 Fluorescence images stained by PI and FDA in the control groups and treatment groups
2.1.5 TUNEL法鉴定PCD 如图3所示,对照组细胞A0没有颜色出现,用苏木精复染(B0)后,细胞核多呈现卵形或球形,说明此时没有细胞死亡;使用SA处理3 h(A3)后,有少量的细胞核的颜色发生变化,细胞核变形,这是细胞程序性死亡前期细胞核的典型表现;随着SA处理时间的增加(A6、A9、A12),细胞核颜色变化明显,出现密集的阳性斑点,经过苏木精复染(B6、B9、B12)的细胞核形状发生明显的改变和边缘化,这是细胞程序性死亡加剧的表现。

A. DAB染色;B. 苏木精复染;0 h.对照;3,6,9,12 h分别是SA处理黄瓜叶片的时间。
A.Stained with 3,3′-diaminobenzidine (DAB); B.Cyanobacterium redyeing;0 h.Control;3,6,9,12 h. The time of SA treated in cucumber leaves,respectively.
图3 TUNEL显色法检测SA处理黄瓜叶片PCD
Fig.3 TUNEL chromogenic detection of cucumber leaf PCD under SA treatment
表1 SA诱导黄瓜叶片差异基因中叶绿体相关基因
Tab.1 SA induces chloroplast related genes in cucumber leaf differential genes

序号No.基因IDGene_IDBlast比对结果(基因注释)Blast result (Gene annotation)备注Remark columnA2Csa1G006270Betaine aldehyde dehydrogenase 1 gene(BADH1)甜菜碱脱氢酶1基因A4Csa1G041560Calcium sensing receptor gene(CAS)钙敏感受体基因A5Csa1G132160Pheophorbide a oxygenase gene(PaO)脱镁叶绿酸a单加氧酶基因A6Csa1G250130Probable chlorophyll(ide) b reductase 1 gene(NYC1)叶绿素b还原酶1基因B3Csa2G360710Probable thylakoidal processing peptidase 1 gene(TPP1)类囊体加工肽酶1基因C3Csa3G820480Sigma factor binding protein 1 gene(SIB1)σ因子结合蛋白1基因D1Csa4G0508306-phosphogluconate dehydrogenase, decarboxylating gene(6-PGDH)6-磷酸葡萄糖酸脱氢酶基因D6Csa4G638340NADPH-Protochlorophyllide oxidoreductase gene(NPR)NADPH-原叶绿酸氧化还原酶基因E3Csa5G576660Probable fructose-bisphosphate aldolase 3 gene(FBA3)果糖1,6-二磷酸醛缩酶3基因E4Csa5G576830Nicotinamide adenine dinucleotide transporter 1 gene(NDT1)烟酰胺腺嘌呤二核苷酸转运子1基因E6Csa5G599830Alpha-glucan water dikinase 1 gene(GWD1)α-葡聚糖水合二激酶1基因E7Csa5G643270ATP-dependent zinc metalloprotease FtsH 1 gene(FtsH1)ATP依赖的锌金属蛋白酶1基因E8Csa5G644020Allene oxide cyclase 4 gene(AOC4)丙二烯氧化物环化酶4基因F7Csa6G5254902-succinylbenzoate-CoA ligase gene(MenE)2-琥珀苯甲酸-辅酶A连接酶基因G3Csa7G073520CBS domain-containing protein 1 gene(CBSX1)胱硫醚β合成酶(CBS)蛋白1基因
分析Illumina高通量测序技术获得的差异表达基因片段[38],从1 759个差异表达基因DEGs中,用PCR验证的方法筛选出15个注释中带有chloroplast的基因进行表达分析(表1)。
图4是用qRT-PCR的方法检测15个基因在SA处理下不同时间段的表达量变化。有12个基因都表现先上调后下调(A4、A5、A6、B3、C3、D1、E3、E4、E6、E7、E8和G3),其中A4、A5、B3、C3、E4和E7在SA处理3 h时表达量最高,之后下降;A6、D1、E3、E6、E8和G3在SA处理12 h时表达量最高之后下降。D6和A2属于表达逐步下调的基因。F7的表达在处理第12 h降至最低,至24 h表达又恢复至对照水平。

图4 SA处理15个基因的qRT-PCR表达分析
Fig.4 Real time quantitative RT-PCR expression analysis of fifteen genes under SA treatment
按相对表达量进行分析,与处理前相比,表达量上调不足2倍的只有A5、C3和E4等基因,其他基因都对SA有强烈的表达响应,其中A6、D1、E6的最高表达量比处理前分别高出9,6,10倍。所有基因的上调表达在最高表达量上都不持续,之后的测定都显示表达量已下调直至接近处理前水平,甚至低于处理前(A6、G3)。
基因F7的表达是先下降后上升,其最低表达量与处理前相比差2.5倍,即受SA的诱导作用不很明显。2个下调表达的基因A2和D6受SA影响比较明显,与处理前相比下调程度都达到5倍。
植物细胞程序性死亡(PCD)在植物系统生长、器官形成和对抗逆境中都有重要意义[42]。而ROS和SA作为植物PCD的重要内源信号分子,植物在响应胁迫时常伴随着ROS的积累和爆发[43]。
在SA点滴的部位,叶片出现枯斑,表现类似HR的症状,枯斑部位有ROS(H2O2和![]() 的爆发,经Trypan blue、PI、FDA和TUNEL依次鉴定,证明枯斑部位的细胞发生了细胞死亡,并且是属于典型PCD的细胞死亡,再一次证实,SA可以促进黄瓜叶片发生PCD,同时伴随ROS(H2O2和
的爆发,经Trypan blue、PI、FDA和TUNEL依次鉴定,证明枯斑部位的细胞发生了细胞死亡,并且是属于典型PCD的细胞死亡,再一次证实,SA可以促进黄瓜叶片发生PCD,同时伴随ROS(H2O2和![]() 产生[44-45]。
产生[44-45]。
对选定的15个黄瓜基因进行荧光定量PCR表达分析,响应SA诱导作用表现出上调表达的基因有:类囊体加工肽酶1基因(B3)、6-磷酸葡萄糖酸脱氢酶基因(D1)、果糖1,6-二磷酸醛缩酶3基因(E3)、α-葡聚糖-水二激酶1基因(E6)和丙二烯氧化物环化酶4基因(E8);下调表达的基因有:甜菜碱脱氢酶1基因(A2)、钙敏感受体基因(A4)、脱镁叶绿酸a单加氧酶基因(A5)、叶绿素还原酶1基因(A6)、σ因子结合蛋白1基因(C3)、NADPH-原叶绿酸酯还原酶基因(D6)、2-琥珀苯甲酸-辅酶A连接酶基因(F7)、ATP依赖的锌金属蛋白酶基因(E7)、烟酰胺腺嘌呤二核苷酸转运子基因(E4)、胱硫醚β合成酶(CBS)蛋白基因(G3)。
查阅文献并根据相对表达量的变化,推测了15个基因的功能并分为以下6类:叶绿素合成降解相关基因(PaO、NYC1、NPR);植物抗逆性相关基因(6-PGDH、FtsH1、NDT1);调控SA和JA诱导的植物防卫反应相关基因(AOC4、SIB1);提高植物胁迫耐受性相关基因(BADH1);植物光合作用相关基因(MenE、FBA3);调节植物发育相关基因(CBSX1、GWD1、TPP1、CAS)[46]。
SIB1属核编码的植物特有的抗病原体相关基因,Narusaka等[47]发现拟南芥基因SA的诱导,且在SIBI超表达株系中发现与ROS积累相关的基因转录水平提高,本试验中SIB1表达呈先上升后下降的趋势,印证了该基因参与SA诱导提高植物免疫力的信号途径[47],推测其可能连接叶绿体功能并参与植物防御系统[48]。
FtsH1在SA处理3 h先表达上调,12 h后表达量恢复正常并有所下降,这个结果与烟草受病毒侵染后FtsH1表达下调加速超敏反应是一致的[49]。FtsH1在拟南芥中参与类囊体蛋白的降解,控制蛋白质的质量平衡[50],降解光系统Ⅱ(PS Ⅱ)修复中光损伤反应中心D1蛋白[51]和一些组装PS Ⅱ剩余的蛋白亚基[52]。
PaO在本试验中表达量呈应激性升高,并在之后的时间呈下降的趋势,认为PaO在处理早期时发生应激反应,加速了光合作用,随后下调使光合作用后续产物脱镁叶绿酸a积累,终止光合作用,执行使细胞加速死亡的功能;NYC1的表达量在本试验中呈先上升后下降的趋势,认为NYC1通过诱导LHCⅡ的降解来增加叶绿素a的合成,参与植物光合作用进程,进而参与调控SA诱导PCD的进程。PaO基因受SA诱导下调表达,促进HR,其原因是缺失该酶导致光毒性的脱镁叶绿酸a积累引起光依赖的PCD[53-54]。Horie等[55]研究表明,拟南芥缺失该基因后,会在植物发育期间表现出滞绿表型。光系统Ⅱ的捕光叶绿素a/b蛋白复合物(LHCⅡ)是色素蛋白复合物,结合叶绿素a和叶绿素b并参与调节PS Ⅰ 和PSⅡ能量的分配。叶绿素b是LHCⅡ的主要色素,在NYC1突变体株系衰老期间,叶绿素b的降解被抑制导致LHCⅡ选择性的保留,这表明叶绿素b还原酶参与LHCⅡ降解起始进程。
AOC4是茉莉酸(JA)合成的关键酶,SA处理后,苹果AOC1基因的表达量上升,JA含量也随之增加[56]。喜树AOC基因在细菌中表达后,提高了细菌对盐的耐受性[51]。本试验中AOC4上调表达的结果与提高抗性相一致。NDT1在烟酰胺腺嘌呤二核苷酸(NDA)的运输过程中起重要作用,植物受到病原体侵染时,NAD调控某些次生代谢产物来产生抗性诱导植物发生超敏反应[43]。本试验中NDT1上调,认为NDT1参与了SA提高植物抗性的信号途径。
[1] 孙军利,赵宝龙,郁松林. 外源水杨酸(SA)对高温胁迫下葡萄幼苗耐热性诱导研究[J]. 水土保持学报,2014,28(3):290-294,299.
[2] 孟雪娇,邸 昆,丁国华. 水杨酸在植物体内的生理作用研究进展[J]. 中国农学通报,2010,26(15):207-214.
[3] 王 楠,高 静,黄文静,等. 旱、盐胁迫下黄芪种子萌发及其对水杨酸的响应[J]. 草业科学,2018,35(1):106-114.
[4] 符冠富,张彩霞,杨雪芹,等. 水杨酸减轻高温抑制水稻颖花分化的作用机理研究[J]. 中国水稻科学,2015,29(6):637-647.
[5] 徐晓昀,郁继华,颉建明,等. 水杨酸和油菜素内酯对低温胁迫下黄瓜幼苗光合作用的影响[J]. 应用生态学报,2016,27(9):3009-3015.
[6] 单长卷,赵新亮,汤菊香. 水杨酸对干旱胁迫下小麦幼苗抗氧化特性的影响[J]. 麦类作物学报,2014,34(1):91-95.
[7] 吴 华,苏 倩,陈金慧,等. 水杨酸对紫外线胁迫下杉木组培苗的影响[J]. 江苏农业科学,2016,44(9):207-210.
[8] Khan M,Fatma M,Per T S,et al. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants[J]. Frontiers in Plant Science,2015,6:462.
[9] Anil K,Das S N,Podile A R. Induced defense in plants:a short overview[J]. Proceedings of the National Academy of Sciences India,2014,84(3):669-679.
[10] Wani A B,Chadar H,Wani A H,et al. Salicylic acid to decrease plant stress[J]. Environmental Chemistry Letters,2017,15(1):101-123.
[11] Malamy J,Carr J P,Klessig D F,et al. Salicylic acid:a likely endogenous signal in the resistance response of tobacco to viral infection[J]. Science,1990,250(4983):1002-1004.
[12] Slaymaker D H,Navarre D A,Clark D,et al. The tobacco salicylic acid-binding protein 3 (SABP3) is the chloroplast carbonic anhydrase,which exhibits antioxidant activity and plays a role in the hypersensitive defense response[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(18):11640-11645.
[13] Van Wees S C,Glazebrook J. Loss of non-host resistance ofArabidopsis NahG toPseudomonas syringae pv.phaseolicola is due to degradation products of salicylic acid[J]. The Plant Journal:for Cell and Molecular Biology,2003,33(4):733-742.
[14] Lee B,Park Y S,Yi H S,et al. Systemic induction of the small antibacterial compound in the leaf exudate during benzothiadiazole-elicited systemic acquired resistance in pepper[J]. The Plant Pathology Journal,2013,29(3):350-355.
[15] Heath M C. Hypersensitive response-related death[J]. Plant Molecular Biology,2000,44(3):321-334.
[16] Greenberg J T,Guo A,Klessig D F,et al. Programmed cell death in plants:a pathogen-triggered response activated coordinately with multiple defense functions[J]. Cell,1994,77(4):551-563.
[17] Greenberg J T,Yao N. The role and regulation of programmed cell death in plant-pathogen interactions[J]. Cellular Microbiology,2004,6(3):201-211.
[18] Zhao Y,Luo L,Xu J,et al. Malate transported from chloroplast to mitochondrion triggers production of ROS and PCD inArabidopsis thaliana[J]. Cell Research,2018,28(4):448-461.
[19] Green D R,Reed J C. Mitochondria and apoptosis[J]. Science,1998,281(5381):1309-1312.
[20] Reape T J,Kacprzyk J,Brogan N,et al. Mitochondrial markers of programmed cell death inArabidopsis thaliana[J]. Methods in Molecular Biology,2015,1305(10):211-221.
[21] 王艳杰,邓 雯,张鹏飞. 细胞色素C与细胞凋亡研究进展[J]. 动物医学进展,2012,33(7):89-92.
[22] Balk J,Leaver C J,Mccabe P F. Translocation of cytochrome c from the mitochondria to the cytosol occurs during heat-induced programmed cell death in cucumber plants[J]. FEBS Letters,1999,463(1/2):151-154.
[23] Ambastha V,Tripathy B C,Tiwari B S. Programmed cell death in plants:A chloroplastic connection[J]. Plant Signaling & Behavior,2015,10(2):e989752.
[24] Van Aken O,Van Breusegem F. Licensed to kill:mitochondria,chloroplasts,and cell death[J]. Trends in Plant Science,2015,20(11):754-766.
[25] Samuilov V D,Lagunova E M,Kiselevsky D B,et al. Participation of chloroplasts in plant apoptosis[J]. Bioscience Reports,2003,23(2/3):103-117.
[26] Doyle S M,Diamond M,Mccabe P F. Chloroplast and reactive oxygen species involvement in apoptotic-like programmed cell death inArabidopsis suspension cultures[J]. Journal of Experimental Botany,2010,61(2):473-482.
[27] Lee K P,Kim C,Landgraf F,et al. EXECUTER1-and EXECUTER2-dependent transfer of stress-related signals from the plastid to the nucleus ofArabidopsis thaliana[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(24):10270-10275.
[28] Kim C,Meskauskiene R,Zhang S,et al. Chloroplasts ofArabidopsis are the source and a primary target of a plant-specific programmed cell death signaling pathway[J]. The Plant Cell,2012,24(7):3026-3039.
[29] Peters J S,Chin C. Evidence for cytochrome f involvement in eggplant cell death induced by palmitoleic acid[J]. Cell Death and Differentiation,2005,12(4):405-407.
[30] Zuppini A,Gerotto C,Moscatiello R,et al. Chlorella saccharophila cytochrome f and its involvement in the heat shock response[J]. Journal of Experimental Botany,2009,60(14):4189-4200.
[31] Wang H,Zhu X,Li H,et al. Induction of caspase-3-like activity in rice following release of cytochrome-f from the chloroplast and subsequent interaction with the ubiquitin-proteasome system[J]. Scientific Reports,2014,4:5989.
[32] Yao N,Greenberg J T. Arabidopsis ACCELERATED CELL DEATH2 modulates programmed cell death[J]. The Plant Cell,2006,18(2):397-411.
[33] Zhao Y,Luo L,Xu J,et al. Malate transported from chloroplast to mitochondrion triggers production of ROS and PCD inArabidopsis thaliana[J]. Cell Research,2018,28(4):448-461.
[34] Adam Z,Rudella A,Van Wijk K J. Recent advances in the study of Clp,FtsH and other proteases located in chloroplasts[J]. Current Opinion in Plant Biology,2006,9(3):234-240.
[35] Carrión C A,Costa M L,Martínez D E,et al.In vivo inhibition of cysteine proteases provides evidence for the involvement of ′senescence-associated vacuoles′ in chloroplast protein degradation during dark-induced senescence of tobacco leaves[J]. Journal of Experimental Botany,2013,64(16):4967-4980.
[36] Luis C O,Armando B G,Julio M,et al. AtMCP1b,a chloroplast-localised metacaspase,is induced in vascular tissue after wounding or pathogen infection[J]. Functional Plant Biology,2007,34(12):1061-1071.
[37] Yang Y,Jin H,Chen Y,et al. A chloroplast envelope membrane protein containing a putative LrgB domain related to the control of bacterial death and lysis is required for chloroplast development inArabidopsis thaliana[J]. The New Phytologist,2012,193(1):81-95.
[38] 刘 双,乔 禹,王 芳,等. 基于数字基因表达谱筛选黄瓜中水杨酸诱导基因[J]. 核农学报,2015,29(5):874-884.
[39] Ramel F,Sulmon C,Gouesbet G,et al. Natural variation reveals relationships between pre-stress carbohydrate nutritional status and subsequent responses to xenobiotic and oxidative stress inArabidopsis thaliana[J]. Annals of Botany,2009,104(7):1323-1337.
[40] Stone J M,Heard J E,Asai T,et al. Simulation of fungal-mediated cell death by fumonisin B1 and selection of fumonisin B1-resistant (fbr)Arabidopsis mutants[J]. The Plant Cell,2000,12(10):1811-1822.
[41] Bowling S A, Clarke J D, Liu Y, et al. Thecpr5 mutant ofArabidopsis expresses both NPR1-dependent and NPR1-independent resistance[J]. Plant Cell, 1997, 9: 1573-1584.
[42] 仝 贝. 植物叶绿体电子传递蛋白在细胞程序性死亡中的功能[D]. 西安:西北大学,2017.
[43] Petrov V,Hille J,Mueller-Roeber B,et al. ROS-mediated abiotic stress-induced programmed cell death in plants[J]. Frontiers in Plant Science,2015,6:69.
[44] Pétriacq P,De Bont L,Tcherkez G,et al. NAD:not just a pawn on the board of plant-pathogen interactions[J]. Plant Signaling & Behavior,2013,8(1):e22477.
[45] Yun L J,Chen W L. SA and ROS are involved in methyl salicylate-induced programmed cell death inArabidopsis thaliana[J]. Plant Cell Reports,2011,30(7):1231-1239.
[46] 刘 双. 诱导的黄瓜超敏反应相关基因的筛选和表达分析[D]. 哈尔滨:哈尔滨师范大学,2016.
[47] Narusaka M,Kawai K,Izawa N,et al. Gene coding for SigA-binding protein fromArabidopsis appears to be transcriptionally up-regulated by salicylic acid and NPR1-dependent mechanisms[J]. Journal of General Plant Pathology,2008,74(5):345-354.
[48] Xie Y D,Li W,Guo D,et al. The arabidopsis gene SIGMA FACTOR-BINDING PROTEIN 1 plays a role in the salicylate-and jasmonate-mediated defence responses[J]. Plant,Cell & Environment,2010,33(5):828-839.
[49] Kaurilind E,Brosché M. Stress marker signatures in lesion mimic single and double mutants identify a crucial leaf Age-Dependent salicylic acid related defense signal[J]. PLoS One,2017,12(1):e0170532.
[50] Rodrigues R A,Silva-Filho M C,Cline K. FtsH2 and FtsH5:two homologous subunits use different integration mechanisms leading to the same thylakoid multimeric complex[J]. The Plant Journal :for Cell and Molecular Biology,2011,65(4):600-609.
[51] Malno⊇ A,Wang F,Girard-Bascou J,et al. Thylakoid FtsH protease contributes to photosystem Ⅱ and cytochrome b6f remodeling in Chlamydomonas reinhardtii under stress conditions[J]. The Plant Cell,2014,26(1):373-390.
[52] Soleimani M J. Possible effects of pathogen inoculation and salicylic acid pre-treatment on the biochemical changes and proline accumulation in Green bean[J]. Archives of Phytopathology and Plant Protection,2015,48(3):212-222.
[53] Mur L A,Aubry S,Mondhe M,et al. Accumulation of chlorophyll catabolites photosensitizes the hypersensitive response elicited byPseudomonas syringae inArabidopsis[J]. The New Phytologist,2010,188(1):161-174.
[54] Christ B,Egert A,Süssenbacher I,et al. Water deficit induces chlorophyll degradation via the ′PAO/phyllobilin′ pathway in leaves of homoio-(Craterostigma pumilum) and poikilochlorophyllous (Xerophyta viscosa) resurrection plants[J]. Plant,Cell & Environment,2014,37(11):2521-2531.
[55] Horie Y, Ito H, Kusaba M, et al. Participation of Chlorophyll b reductase in the initial step of the degradation of light-harvesting Chlorophylla/b-protein complexes inArabidopsis[J]. The Journal of Bioloical Chemistry, 2009, 284(26):17449-17456.
[56] 曹晏彬,柏素花,戴洪义. 苹果丙二烯氧化物环化酶基因MdAOC1的克隆与表达分析[J]. 林业科学,2013,49(12):73-80.