39份外引小麦种质抗病基因的分子标记检测及其抗病性评价
董 娜,陈向东,胡铁柱,李 淦,张亚娟,茹振钢
(河南科技学院 小麦中心,河南省高等学校作物分子育种重点开放实验室,现代生物育种河南省协同创新中心,河南 新乡 453003)
摘要:为了初步明确39份外引小麦种质中条锈病和白粉病抗性基因组成,利用共分离或紧密连锁的分子标记对抗条锈病基因Yr5、Yr10、Yr18和抗白粉病基因Pm4、Pm13、Pm21进行检测,同时结合田间鉴定,对外引种质的抗病性进行评价。结果表明,携带Yr18基因的种质有6份,对条锈病菌表现近免疫至中抗,抗性表现稳定;Yr5连锁标记S1320阳性的种质有21份,Yr10连锁标记SC200阳性的种质有2份,但标记阳性的种质中抗病性表现不一致,可能跟载体品种的遗传背景有关,利用这些分子标记进行辅助育种时,要结合接种鉴定结果综合判断。Pm4基因基本丧失白粉病抗性,携带该基因的7份种质中仅有1份抗病。在39份种质中,均未检测到抗白粉病基因Pm13和Pm21。此外,有2份种质澳阿优1号和bermude兼具条锈病和白粉病抗性,综合抗病性好,在育种中可以合理利用。为小麦抗病育种亲本选择和种质资源的合理利用提供了参考依据。
关键词:小麦;抗病基因;分子标记;条锈病;白粉病
小麦(Triticum aestivum L.)是重要的粮食作物,其产量约占粮食作物总产量的1/5,是我国人民粮食供给的主体[1]。由于生长周期长,小麦在生长过程中极易受到各种病害的威胁,其中由专性寄生真菌条形柄锈菌小麦专化型(Puccinia striiformis f. sp.tritici)和禾本科布氏白粉菌(Erysiphe graminis f. sp.tritici)引起的小麦条锈病和小麦白粉病是影响小麦生产的2种重要常发病害,在各麦区广泛分布,严重影响小麦高产、稳产[2]。近年来,随着冬季干旱少雨、气温偏高,春季多雨、气温回升快等极端天气不断出现,小麦生产上传统常发病害的发生程度有加重趋势。
病害防治是小麦生产中一项长期而艰巨的任务。实践证明,培育和推广抗病品种是控制小麦病害最经济、有效和安全的途径。迄今,国际上正式命名的主效抗条锈病基因有79个,即Yr1~Yr79[3-4];正式命名的抗白粉病基因包括44个位点上的60多个基因或等位基因(http://wheat.pw.usda.gov/)[5],其中一部分已经被转育到栽培品种中[6]。由于小麦抗条锈病基因和抗白粉病基因具有很强的小种专化性,生产上应用的抗病基因很容易因为病原菌毒力频率变化或新的毒力型的出现而丧失抗性[7-9]。因此,合理利用已发现的抗病基因,寻找有效新抗源,拓宽小麦品种抗性遗传多样性,是我国小麦抗病育种研究的当务之急和长远任务。
外引种质为我国小麦抗病育种提供了重要的基因资源。例如,以尤皮1号、尤皮2号、维尔和洛夫林10号作为我国不同地区重要的条锈病抗源,曾育成了一系列生产上大面积应用的抗锈品种[10]。周新力等[11]对80份国外春小麦种质资源的抗条锈性评价表明,这些资源中大部分对我国小麦条锈菌流行小种表现优良的抗病性;李艳丽等[12]对从美国引进的67份小麦材料进行农艺性状调查及条锈病、白粉病、赤霉病的抗性鉴定发现,67份材料含有丰富的条锈病和白粉病的抗性基因,其中有5份材料综合抗病性好,17份材料兼抗2种病害;伍玲等[13]利用分子标记对273份CIMMYT小麦材料进行抗病基因Lr34/Yr18/Pm38检测,其中43份含有上述基因,在不同地点对条锈病、叶锈病和白粉病具有不同程度的抗病性;丁晓义等[14]从165份CIMMYT小麦材料中筛选出白粉病免疫材料9份,高抗材料3份,这些材料抗病性表现稳定,可用作抗白粉病育种杂交亲本。总之,外引种质中优异抗病基因的挖掘与利用,对拓宽我国小麦遗传资源、提高小麦生产品种抗病基因多样性、促进高产稳产新品种培育具有重要意义。为此,对河南科技学院小麦中心保存的39份外引小麦种质中抗条锈病、白粉病基因进行分子标记检测,并对其进行抗病性评价,以期为小麦抗病育种亲本选择和种质资源的合理利用提供参考依据。
1 材料和方法
1.1 小麦材料的种植
39份小麦种质分别引自澳大利亚、智利、墨西哥、美国等10个国家,由河南科技学院小麦中心收集和保存。所有小麦种质均种植于新乡市辉县的种质圃中,每份种质播种2行,畦埂上种诱发行(石家庄8号),常规田间管理,第2年春季小麦返青后取样检测。
1.2 小麦抗病性的调查
白粉病为田间自然发病,于小麦灌浆中期调查不同品种白粉病的发病情况,病级划分采用0~4级法。0级:免疫,植株全株无病斑,无菌丝体附着;0;级:发生过敏性坏死反应,叶片有枯死斑;1级:高抗,病斑很小,菌丝层稀薄、可见绿色叶面,偶有较大病斑,但仍透绿,产孢量极少;2级:中抗,叶片病斑小,菌丝层较厚但立体感较弱,不透绿,能产生一定量孢子;3级:中感,叶片病斑多,菌丝层厚、立体感强,叶片失绿,产孢量大,但病斑不连片;4级:高感,叶片病斑很多,菌丝层厚,产孢量多,病斑连片。
条锈病采用接种诱发,条锈病菌为生产上流行小种的混合菌株,购自中国农业科学院植物保护研究所,于小麦拔节期(3月中下旬),采用孢子悬液注射法进行接种,每行接种1个分蘖,灌浆初期调查条锈病发病情况,病级划分采用0~4级法。0(免疫型):叶上无可见症状;0;(近免疫型):叶上产生小枯斑,无孢子堆;1(高抗型):夏孢子堆小,周围有枯斑;2(中抗型):夏孢子堆小到中等大小,生在绿色组织上,周围有枯斑;3(中感型):夏孢子堆较大,周围组织有褪绿现象;4(高感型):夏孢子堆大,周围不褪绿。
1.3 基因组DNA的提取及分子标记检测
取小麦幼苗叶片约0.2 g放入1.5 mL离心管中,液氮研磨后,采用CTAB法提取基因组DNA[15],用1.0%琼脂糖凝胶电泳检测DNA提取效果。
本研究选用目前生产上抗性较好且已开发分子标记的抗条锈病基因Yr5、Yr10、Yr18和抗白粉病基因Pm4、Pm13、Pm21进行分子标记检测。分子标记引物由北京鼎国昌盛生物技术有限责任公司合成,序列见表1。PCR扩增于ABI Gene Amp PCR System 9700型PCR仪上进行。PCR扩增反应体系为20 μL,包括2×Taq Master Mix(购自北京康为世纪生物科技有限公司)10 μL,10 μmol/L上、下游特异引物各0.5 μL,模板DNA 50~100 ng,其余用ddH2O补足。SCAR1400的扩增程序为:94 ℃预变性5 min;94 ℃变性50 s,55 ℃退火50 s,72 ℃延伸2 min,36个循环;72 ℃终延伸10 min,4 ℃保存。SCAR564、STS470、SC200和csLV34的扩增程序均为:94 ℃预变性5 min;94 ℃变性50 s,55 ℃退火50 s,72 ℃延伸50 s,36个循环;72 ℃终延伸10 min,4 ℃保存。S1320的扩增程序为:94 ℃预变性5 min;94 ℃变性50 s,60 ℃退火50 s,72 ℃延伸50 s,36个循环;72 ℃终延伸10 min,4 ℃保存。S1320的扩增产物于170 V下用12%非变性聚丙烯酰胺凝胶电泳约2 h,经银染和显影后,利用凝胶成像仪观察电泳结果并拍照保存;其他标记的扩增产物均于110 V下用1%琼脂糖凝胶(含goldview染料)电泳约40 min,然后用凝胶成像仪观察电泳结果并拍照保存。
表1 抗病基因、分子标记及其引物序列
Tab.1 Disease-resistant genes,markers and their sequences used in this research
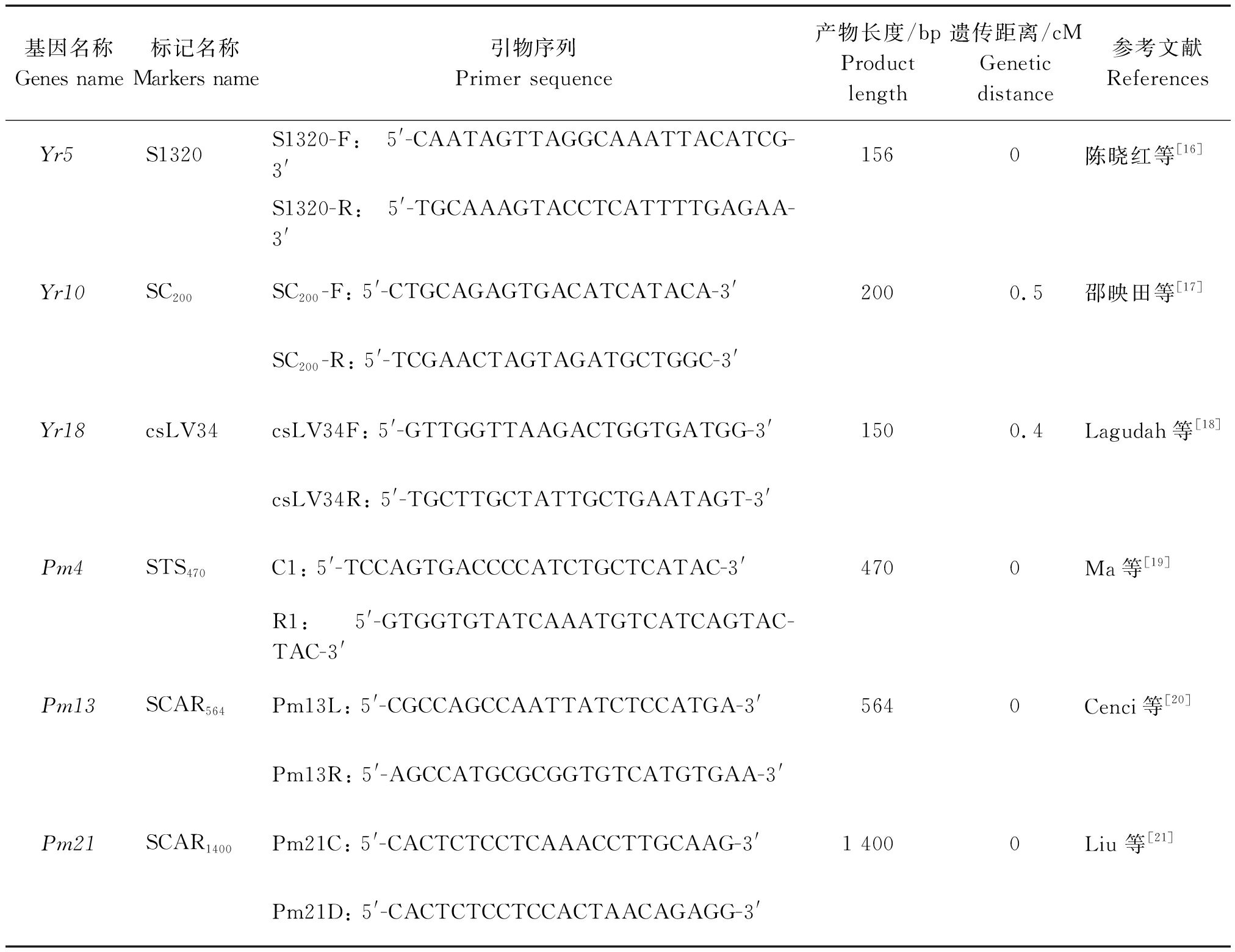
基因名称Genes name标记名称Markers name引物序列Primer sequence产物长度/bpProduct length遗传距离/cMGenetic distance 参考文献ReferencesYr5S1320S1320-F: 5'-CAATAGTTAGGCAAATTACATCG-3'1560陈晓红等[16]S1320-R: 5'-TGCAAAGTACCTCATTTTGAGAA-3'Yr10SC200SC200-F: 5'-CTGCAGAGTGACATCATACA-3'2000.5邵映田等[17]SC200-R: 5'-TCGAACTAGTAGATGCTGGC-3'Yr18csLV34csLV34F: 5'-GTTGGTTAAGACTGGTGATGG-3'1500.4Lagudah等[18]csLV34R: 5'-TGCTTGCTATTGCTGAATAGT-3'Pm4STS470C1: 5'-TCCAGTGACCCCATCTGCTCATAC-3'4700Ma等[19]R1: 5'-GTGGTGTATCAAATGTCATCAGTAC-TAC-3'Pm13SCAR564Pm13L: 5'-CGCCAGCCAATTATCTCCATGA-3'5640Cenci等[20]Pm13R: 5'-AGCCATGCGCGGTGTCATGTGAA-3'Pm21SCAR1400Pm21C: 5'-CACTCTCCTCAAACCTTGCAAG-3'1 4000Liu 等[21]Pm21D: 5'-CACTCTCCTCCACTAACAGAGG-3'
2 结果与分析
2.1 39份外引小麦种质中Yr5基因的分子标记检测
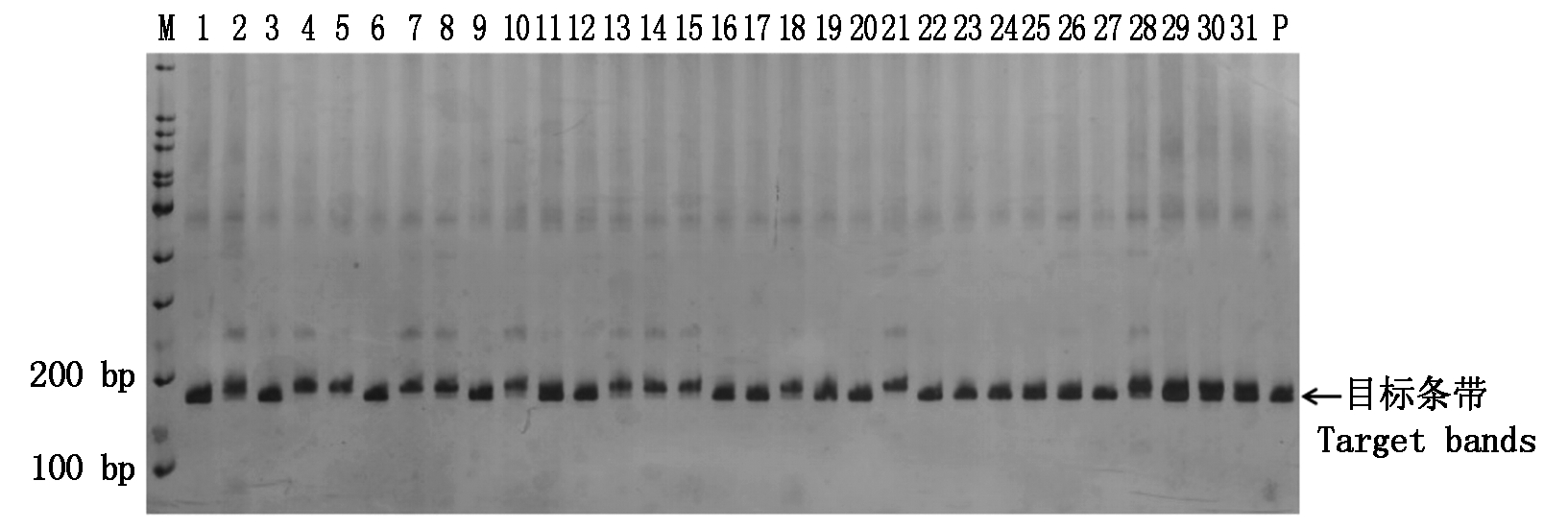
利用与Yr5基因共分离的SCAR标记S1320检测该基因在39份外引小麦种质中的分布情况,含有Yr5基因的种质可扩增出156 bp的目标条带。在检测的39份种质中有21份能够扩增出预期大小的DNA条带,说明这21份种质含有Yr5基因;其他18份种质均未扩增出目标条带,说明这些种质不含Yr5基因,检出率为53.85%(图1)。
2.2 39份外引小麦种质中 Yr10基因的分子标记检测
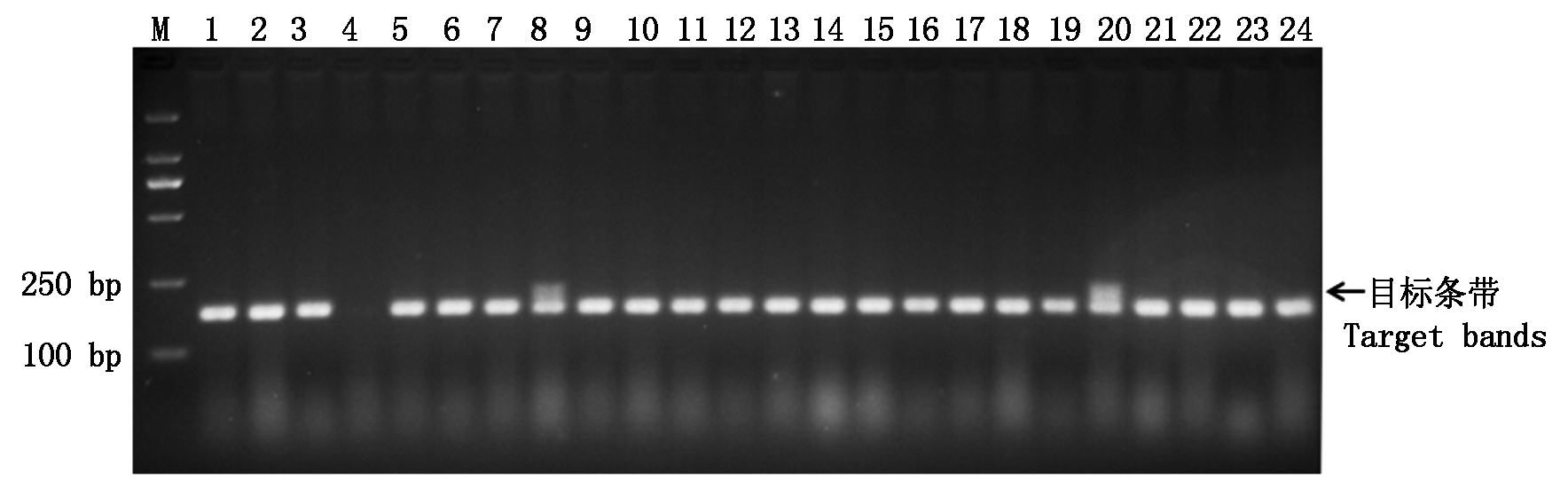
利用SCAR标记SC200对39份外引小麦种质Yr10基因进行检测,该标记与Yr10的遗传距离为0.5 cM,含有Yr10基因的种质可扩增出200 bp的目标条带。在检测的39份种质中有2份能够扩增出预期大小的目标条带,说明这2份种质含有Yr10基因;其他37份种质均没有扩增出目标条带,说明这些种质不含Yr10基因,检出率为5.13%(图2)。
2.3 39份外引小麦种质中 Yr18基因的分子标记检测
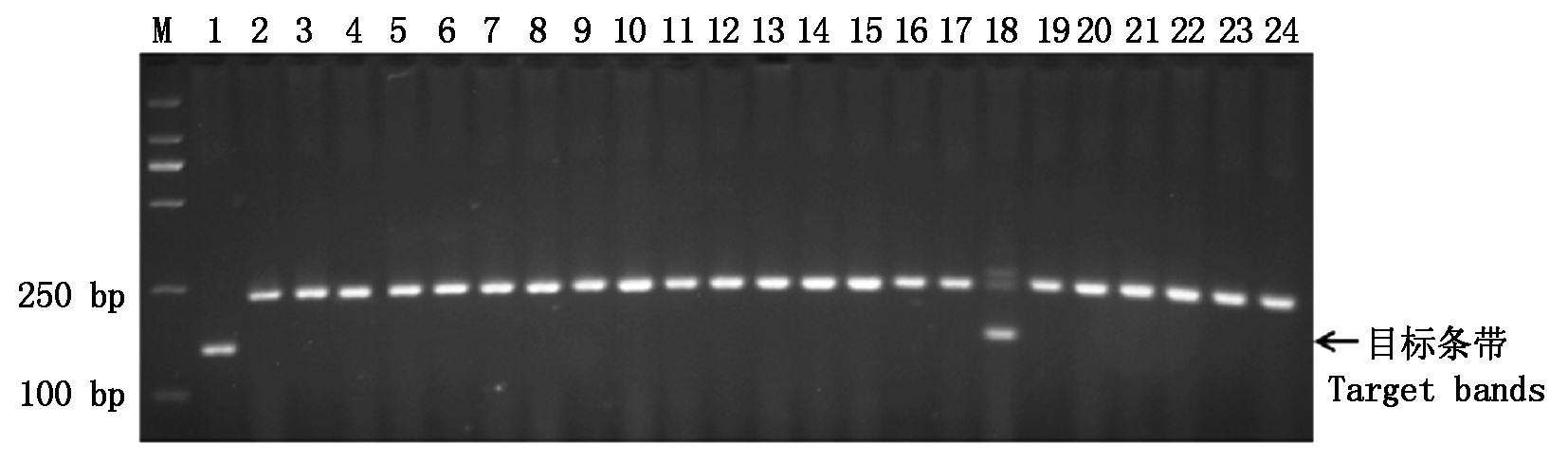
利用STS标记csLV34对39份外引小麦种质Yr18基因进行检测,该标记与Yr18的遗传距离为0.4 cM,含有Yr18基因的种质可扩增出150 bp的目标条带。在检测的39份种质中有6份能够扩增出预期大小的目标条带,说明这6份种质含有Yr18基因;其他33份种质均没有扩增出目标条带,说明这些种质不含Yr18基因,检出率为15.38%(图3)。
2.4 39份外引小麦种质中 Pm4基因的分子标记检测
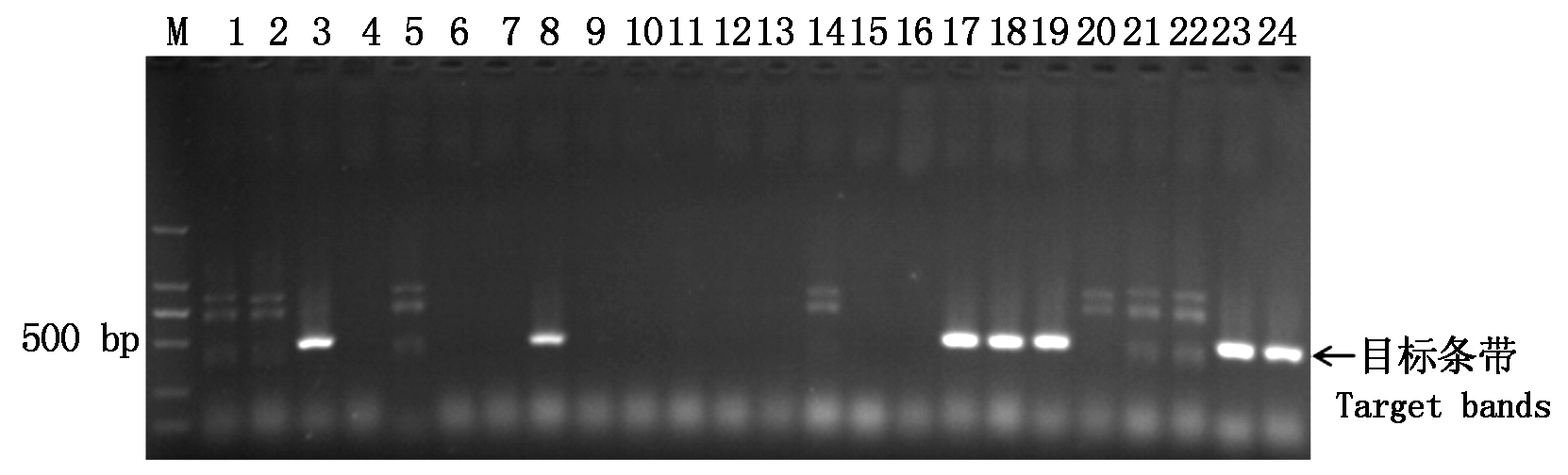
利用与Pm4基因共分离的标记STS470检测该基因在39份外引小麦种质中的分布情况,含Pm4基因的种质可扩增出470 bp的目标条带。在检测的39份种质中有7份能够扩增出预期大小的目标条带,说明这7份种质中含有Pm4基因;其他32份种质均没有扩增出目标条带,说明这些种质不含Pm4基因,检出率为17.95%(图4)。
2.5 39份外引小麦种质中Pm13和Pm21基因的分子标记检测
利用共分离标记SCAR564和SCAR1400分别对39份外引小麦种质Pm13基因和Pm21基因进行分子检测,含Pm13基因的种质可以扩增出大小为564 bp的目标条带,含Pm21基因的种质可以扩增出大小为1 400 bp的目标条带。本试验检测的39份种质中均未扩增出上述2个基因的目标条带,说明这些种质均不携带抗白粉病基因Pm13和Pm21。
2.6 39份外引小麦种质中抗病基因的分布情况及其抗病性评价
由表2可知,在39份外引小麦种质中,携带Yr5基因的有21份,携带Yr10基因的有2份,携带Yr18基因的有6份。其中,澳阿优1号、HUAYUN、TAMOI和CMT-3(T88)同时携带Yr5和Yr18基因,意大利白麦同时携带Yr5和Yr10基因。从抗条锈性鉴定结果看,Yr18基因抗性稳定,单独存在及与Yr5聚合均表现良好抗性。Yr5基因在不同遗传背景中抗性表现不一致,与Yr18聚合时,表现近免疫至中抗,其余17份种质中,有6份表现近免疫至中抗,11份表现中至高感。携带Yr10基因的2份种质中,1份表现中抗,另1份表现高感。另有7份种质KPL-1、攀道拉、CL0401、09智引3号、墨特大、墨176和MRYC,虽未检测到上述3个抗条锈病基因,但是具有良好的条锈病抗性,表现中至高抗,后续将进一步分析其条锈病抗性基因。
在39份外引小麦种质中,均未检测到抗白粉病基因Pm13和Pm21,有7份种质携带Pm4基因。白粉病抗性鉴定结果显示,Pm4基因基本丧失白粉病抗性,携带该基因的7份种质中仅有1份抗病,其余6份表现感病。另有4份种质澳阿优1号、法国材料、莫斯科39和非黑土地24,虽未检测到上述3个抗白粉病基因,但是具有良好的白粉病抗性,后续将进一步分析其抗白粉病基因。
此外,澳阿优1号和bermude综合抗病性好,同时具有条锈病和白粉病抗性,在育种过程中可以合理利用。
表2 39份外引小麦种质携带抗病基因情况及其抗病性
Tab.2 Disease resistant genes carried in these wheat germplasms and the degree of their disease resistance

种质名称Name of wheat germplasm来源SourcePm4Pm13Pm21Yr5Yr10Yr18条锈病发病级别Degree of stripe rust白粉病发病级别Degree of powdery mildew澳阿优1号 Aoayou No.1澳大利亚---+-+1~21KPL-1------13KPL-3+--+--23~4阿大学AGT-② AdaxueAGT-②------3~44鸟麦 Niaomai------3~44攀道拉 Pandaola智利------23~4智矮早 Zhiaizao---+--43硬质博莱特 Yingzhibolaite+---+-24CL0401------24CL0407(早) CL0407(Early)---+--13CL0419------2~34CL0438---+--23~4CL0442---+--3~43~4HUAYUN---+-+0;3PANDORA------33TAMOI---+-+1~23CIKO------2~3309智引1号 09Zhiyin No.1-----+0;309智引2号 09Zhiyin No.2-----+23~409智引3号 09Zhiyin No.3------1~24墨特大 Moteda墨西哥------1~23MRYC------1~24墨176 Mo 176------23墨S139 Mo S139+--+--1~24CMT-3(T88)+--+-+23意大利白麦 Italian baimai意大利---++-43Ciava---+--43~4法国材料 French material法国------40bermude+--+--0;0鲁昂-10 Luang-10俄罗斯+--+--1~23莫斯科39 Moscow 39---+--32非黑土地24 Feiheitudi 24---+--3~42OK.95571美国---+--43~4Jaggar-1---+--43~4美国-2 America-2------43~4NSR-5南斯拉夫---+--3~43~4洛优9909 Luoyou 9909---+--43野猫 Yemao加拿大---+--43~4萨尔斯堡 Salzburg奥地利+-----43
3 结论与讨论
随着分子标记技术的发展,已开发出可用于目标基因检测的多种分子标记如STS、SCAR、CAPS、RGAP、SSR等,与抗病基因共分离或紧密连锁的分子标记可准确、快速地鉴定抗病基因的组成和数目。为了初步明确河南科技学院小麦中心收集的39份外引小麦种质中条锈病和白粉病抗性基因组成,本研究对目前生产上抗性较好且已开发分子标记的抗条锈病基因Yr5、Yr10、Yr18和抗白粉病基因Pm4、Pm13、和Pm21进行了分子标记检测,同时结合田间鉴定,对外引种质的抗病性进行评价。
本研究检测Yr18基因用的是与其紧密连锁的STS标记csLV34,该标记在辅助育种中已有较多应用。杨文雄等[22]利用csLV34对慢锈基因Lr34/Yr18进行分子检测,从231份小麦育成品种(系)和422份农家品种中分别鉴定出14份和359份种质具有上述基因。白小军等[23]利用该标记从111份宁夏小麦材料中鉴定出20份材料携带慢锈基因Lr34/Yr18,成株期条锈病抗性鉴定结果表明,含有Lr34/Yr18基因的材料对条锈病具有较好的抗性。本研究从39份外引小麦种质中鉴定出携带Yr18基因的种质6份,对条锈病菌表现近免疫至中抗,抗性表现稳定,进一步验证了该标记重复性好、准确率高。
Yr5和Yr10为全生育期抗条锈病基因,对目前生产上的流行小种CYR32、CYR33具有良好抗性[9]。本研究分别利用与Yr5、Yr10连锁的SCAR标记S1320、SC200对其进行检测,发现标记阳性的种质抗病性表现并不一致,标记S1320阳性的21份种质中10份表现近免疫至中抗,其余11份表现中至高感;标记SC200阳性的2份种质中,1份表现中抗,1份表现高感,可能与载体品种的遗传背景有关,前人研究中有过类似报道[24-25]。韩德俊等[24]利用紧密连锁的分子标记STS7/8对小麦种质中的Yr5基因进行检测,有15份种质对该标记呈阳性反应,但其抗病性表现与Yr5单基因系都不相符。因此,认为所筛选的抗源可能都不具有Yr5基因。王树和等[25]用SCAR标记Yr10F/R对Yr10基因进行检测,9份该标记阳性的种质中只有3份表现抗病,另外6份不具有Yr10基因的抗性表现。另外,本研究利用的分子标记SC200与Yr10基因位点之间仍有0.5 cM的遗传距离,会发生一定频率的重组。因此,利用这些分子标记进行辅助育种时,要结合接种鉴定结果进行综合判断。
检测抗白粉病基因Pm13、Pm21用的是与其共分离的标记SCAR564、SCAR1400,其在辅助育种中已有较多应用。河南科技学院小麦中心也曾用这2个标记开展过分子标记辅助育种[26-27],标记稳定可靠。因此,可以确定本研究中39份种质均未扩增出上述标记的目标条带是由于这些种质中均未携带这2个基因。Pm4基因基本丧失白粉病抗性,携带该基因的7份种质中有1份抗病,可能与该种质遗传背景有关,也可能是因为该种质含有其他白粉病抗性基因。
参考文献:
[1] 郭天财.试论中国的小麦生产与国家粮食安全[C]//中国作物学会.农业科技创新与生产现代化学术研讨会论文集.北京:中国农业科学技术出版社,2001.
[2] 陈万权. 图说小麦病虫草鼠害防治关键技术[M]. 北京: 中国农业出版社, 2012.
[3] Chhetri M, Bariana H, Kandiah P, et al.Yr58: A new stripe rust resistance gene and its interaction withYr46 for enhanced resistance[J]. Phytopathology, 2016, 106(12): 1530-1534.
[4] Feng J, Wang M, See D R, et al. Characterization of novel geneYr79 and four additional QTL for all-stage and high-temperature adult-plant resistance to stripe rust in spring wheat[J]. Phytopathology, 2018, 108(6): 737-747.
[5] Xiao M, Song F, Jiao J, et al. Identification of the genePm47 on chromosome 7BS conferring resistance to powdery mildew in the Chinese wheat landrace Hongyanglazi[J]. Theoretical and Applied Genetics, 2013, 126(5): 1397-1403.
[6] 张海泉. 小麦抗白粉病分子育种研究进展[J]. 中国生态农业学报, 2008, 16(4): 1060-1066.
[7] 詹海仙, 畅志坚, 杨足君, 等. 小麦抗白粉病基因来源及抗性评价的研究进展[J]. 中国农学通报, 2010, 26(10): 42-46.
[8] 李 欣, 畅志坚, 詹海仙, 等. 小麦抗条锈病基因来源及染色体定位的研究进展[J]. 中国农学通报, 2015, 31(5): 92-95.
[9] 曾庆东, 沈 川, 袁凤平, 等. 小麦抗条锈病已知基因对中国当前流行小种的有效性分析[J]. 植物病理学报, 2015, 45(6): 641-650.
[10] 李小军, 徐 鑫, 刘伟华, 等. 应用SSR分子标记分析国外种质对我国小麦品种的遗传贡献[J]. 作物学报, 2009, 35(5): 778-785.
[11] 周新力, 詹刚明, 黄丽丽, 等. 80份国外春小麦种质资源抗条锈性评价[J]. 中国农业科学, 2015, 48(8): 1518-1526.
[12] 李艳丽, 张 军, 鲁 敏, 等. 67份引进美国小麦种质材料的农艺性状调查和抗病性鉴定[J]. 麦类作物学报, 2013, 33(4): 777-783.
[13] 伍 玲, 夏先春, 朱华忠, 等. CIMMYT 273个小麦品种抗病基因Lr34/Yr18/Pm38的分子标记检测[J]. 中国农业科学, 2010, 43(22): 4553-4561.
[14] 丁晓义, 姜鸿明, 赵 倩, 等. CIMMYT小麦材料的白粉病抗性鉴定与抗源筛选[J]. 麦类作物学报, 2001, 21(3): 93-94.
[15] Wang M, Na D C, Ji H T, et al. A simple and quick method of extracting genomic DNA from wheat leaves[J]. Agricultural Science&Technology, 2009, 10(5): 34-35.
[16] 陈晓红, 牛永春, 胡宝忠. 用变性PAGE-银染法鉴定小麦抗条锈基因Yr5的RAPD标记[J]. 遗传学报, 2004, 31(3): 270-274.
[17] 邵映田, 牛永春, 朱立煌, 等. 小麦抗条锈病基因Yr10的AFLP标记[J]. 科学通报, 2001, 46(8): 669-672.
[18] Lagudah E S, Mcfadden H, Singh R P, et al. Molecular genetic characterization of theLr34/Yr18 slow rusting resistance gene region in wheat[J]. Theoretical and Applied Genetics, 2006, 114(1): 21-30.
[19] Ma Z Q, Wei J B, Cheng S H. PCR-based markers for the powdery mildew resistance genePm4a in wheat[J]. Theoretical and Applied Genetics, 2004, 109(1): 140-145.
[20] Cenci A, D′ovidio R, Tanzarella O A, et al. Identification of molecular markers linked toPm13, an Aegilops longissima gene conferring resistance to powdery mildew in wheat[J]. Theoretical and Applied Genetics, 1999, 98(3/4): 448-454.
[21] Liu Z,Sun Q,Ni Z,et al.Development of SCAR markers linked to thePm21 gene conferring resistance to the powdery mildew in common wheat [J].Plant Breeding,1999,118:215-219.
[22] 杨文雄, 杨芳萍, 梁 丹, 等. 中国小麦育成品种和农家种中慢锈基因Lr34/Yr18的分子检测[J]. 作物学报, 2008, 34(7): 1109-1113.
[23] 白小军, 王宪国, 陈东升. 宁夏小麦品种慢锈基因Lr34/Yr18的分子检测[J]. 麦类作物学报, 2014, 34(11): 1480-1484.
[24] 韩德俊, 张培禹, 王琪琳, 等. 1980份小麦地方品种和国外种质抗条锈性鉴定与评价[J]. 中国农业科学, 2012, 45(24): 5013-5023.
[25] 王树和, 龚凯悦, 初炳瑶, 等. 四川省100个小麦品种(系)抗条锈病基因的分子检测[J]. 植物病理学报, 2018, 48(2): 195-206.
[26] 董 娜, 李 淦, 张亚娟, 等. 354份小麦种质中抗白粉病基因Pm21和Pm13的分布研究[J]. 植物保护, 2015, 41(5): 164-168.
[27] 董 娜, 张亚娟, 张军刚, 等. 分子标记辅助小麦抗白粉病基因Pm21和Pm13聚合育种[J]. 麦类作物学报, 2014, 34(12): 1639-1644.
Molecular Detection and Evaluation of Disease Resistance Genes of 39 Introduced Wheat Germplasms
DONG Na, CHEN Xiangdong, HU Tiezhu, LI Gan, ZHANG Yajuan, RU Zhengang
(Center of Wheat Breeding,Henan Institute of Science and Technology,Henan Key Laboratory for Crop Molecular Breeding in Universities, Collaborative Innovation Center of Modern Biological Breeding, Xinxiang 453003,China)
Abstract: To preliminarily clarify the composition of the resistance genes to stripe rust and powdery mildew in 39 introduced wheat germplasms, co-segregated or tightly-linked markers were used to detect stripe rust resistance genesYr5,Yr10 andYr18, and powdery mildew resistance genePm4,Pm13 andPm21. Simultaneously, the disease resistant level of these germplasms were evaluated in the field. The results indicated that there were 6 germplasms carryingYr18, which showed stable stripe rust resistance and the reaction type was varied from near immune to middle resistance. 21 germplasms wereYr5 linked marker S1320 positive, and 2 ones wereYr10 linked marker SC200 positive. These same marker positive germplasms showed differential disease resistant character, which might be associated with the genetic backgrounds of the carrier varieties. In assistant breeding, the detection results of these markers should be further confirmed by inoculation identification. The resistance ofPm4 to powdery mildew was almost lost, for only 1 of the 7 germplasms carryingPm4 was of disease resistance. In all 39 germplasms, the powdery mildew resistance genesPm13 andPm21 could not be detected. Additionally, 2 germplasms Aoayou No.1 and bermude were of both resistance to stripe rust and powdery mildew, which could be used appropriately in disease resistance breeding.The results would be helpful for parental selection and rational utilization of germplasm resources in wheat disease resistance breeding.
Key words: Wheat; Disease resistance genes; Molecular markers; Stripe rust; Powdery mildew
中图分类号:S512.1
文献标识码:A
文章编号:1000-7091(2018)06-0049-07
doi:10.7668/hbnxb.2018.06.007
收稿日期:2018-07-22
基金项目:国家自然科学基金项目(31301002);河南省重大科技专项(161100110500-0204);河南省高校重点科研项目(18A210001)
作者简介:董 娜(1979-),女,河南沁阳人,讲师,博士,主要从事小麦分子遗传与育种研究。
通讯作者:茹振钢(1958-),男,河南沁阳人,教授,硕士生导师,主要从事作物遗传育种研究。