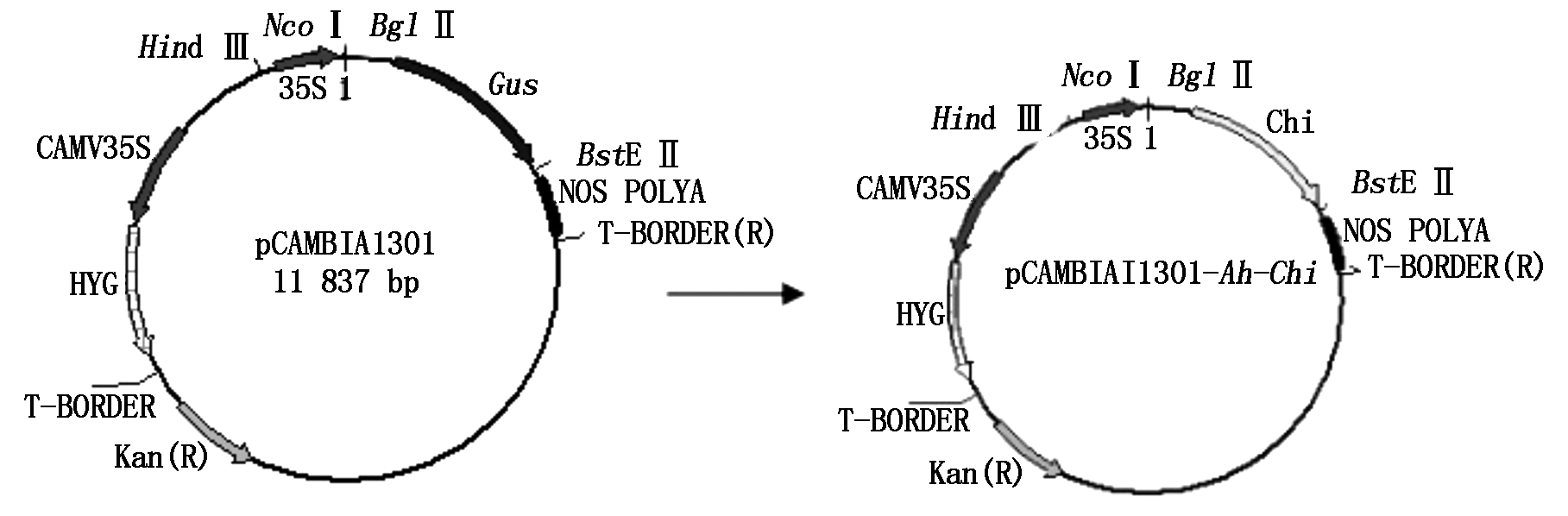
图1 植物表达载体pCAMBIA1301-Ah-Chi的构建过程(Gus基因被Ah-Chi 基因替换)
Fig.1 Construction of recombinant plasmid pCAMBIA1301-Ah-Chi (Gus was substituted for Ah-Chi)
几丁质和葡聚糖是真菌细胞壁的主要成分,几丁质酶通过降解菌丝生长末端新合成的几丁质,破坏菌丝端部生长而使其顶端细胞壁变薄,继而发生球状突起,最后导致病原体死亡[1],而且原生质膜破裂产生的细胞碎片具有诱导作用,进而刺激寄主植物的抗病反应[2]。因此,植物几丁质酶在参与植物抗病反应过程中发挥着重要的作用,在正常情况下,大多数高等植物体中所含几丁质酶基因表达水平很低,但在病原菌侵染、诱导物处理及各种伤害诱导条件下表达量显著提高,如病原菌侵染、至少有31种病原真菌(含变种和专化型)可诱导植物几丁质酶,病毒、类病毒[3]、细菌[4]、真菌、外源几丁质、乙烯、重金属、盐溶液、机械损伤、紫外线辐射、臭氧等因素同样具有诱导作用[5]。水杨酸(SA)也可以诱导几丁质酶的表达,而且植物几丁质酶的诱导是有组织特异性的,与植物的发育有关。诱导可以发生在不同的组织器官中,包括胚、种子、子叶、根、茎、叶、花和原生质体[6]。
已有研究表明,不同来源的几丁质酶对不同病原菌及害虫的作用效果不同。一般认为,对昆虫的生防作用以昆虫病原真菌源和昆虫源的几丁质酶为好,而有试验表明,一些纯化的细菌和植物几丁质酶对昆虫影响甚少。对细菌和真菌的颉抗作用以微生物源的尤其是生防菌本身的几丁质酶基因为好[7]。从转基因作物来源,包括了水稻、小麦、番茄、黄瓜、胡萝卜、油菜、马铃薯、烟草、花生、苹果、核桃、玫瑰等多种作物,其中以烟草最多[8](原因是它的再生和转化非常容易,它是许多研究者首选的受体植物)。自1991年Broglie等[9]首次报道转几丁质酶基因的植物抗真菌病以来,已有更多的研究者转向几丁质酶基因的克隆与转移。到1995年底,已有水稻、大麦、烟草等植物的几丁质酶基因被转入水稻、烟草、番茄等植物。Osman等[10]克隆了棉叶虫的几丁质酶基因,并将其转入到玉米中,转基因玉米对玉米螟的抗性增强。Richa 等[11]从抗水稻纹枯病菌的水稻品种中克隆了1个新的几丁质酶基因,将其转入到对纹枯病敏感的粳稻品系台北309中,转基因植株对水稻纹枯病菌的抗性增强。Marchant等[12]将水稻Ⅰ类碱性几丁质酶基因导入栽培玫瑰中,转基因植株对黑斑病菌的抗性增强。郭林霞等[13]将杜仲的几丁质酶基因EuCHIT1转入到番茄中,接菌灰霉病前转基因番茄的POD活性高于野生型,MDA活性低于野生型;接菌后转基因植株SOD、POD及CAT的活性分别比野生型高19.48%,116.08%,53.80%,MDA含量比野生型低37.65%;说明EuCHIT1基因过量表达增强了转基因番茄的抗氧化能力, 对灰霉病的抗性增强。金学博等[14]从羊草中克隆获得1种新型几丁质酶基因LcChi2,利用农杆菌介导法成功获得过表达的转基因水稻,通过稻瘟病活体接种试验证明了该基因提高了水稻的抗病性。程笑笑[15]通过同源克隆获得大丽轮枝菌内源几丁质酶基因VDECH,并通过原核表达获得纯化蛋白。VDECH蛋白能够诱导植物产生初级免疫反应,引起拟南芥和棉花叶片过敏性反应,上调拟南芥和棉花防御相关基因的表达,显著提高对主要病原菌棉花黄萎病菌的抗性。
花生在生产过程中同样容易感染网斑病、黑斑病、锈病、黄曲霉菌等真菌性病害,严重影响着花生的产量和品质。因此,通过遗传工程手段提高花生的抗病性,便成为花生抗病遗传改良的有效途径。
本研究拟在花生中克隆几丁质酶基因,并通过遗传转化验证其功能,创制抗病花生新材料,旨在为花生抗病育种提供新的基因源及新型抗病种质。
花生(Arachis hypogaea L.)品种花育23和鲁花14,质粒pCANBIA1301,大肠杆菌DH5α菌株和农杆菌EHA105菌株,均由青岛农业大学花生研究中心保存;克隆载体pMD18-TSimpleVector、限制性内切酶及RNA提取、反转录试剂盒,均购自大连宝生物(TaKaRa)工程有限公司;其他化学试剂均为国产分析纯。
1.2.1 培养基 体胚诱导培养基:MS-B5 (MS 无机盐+B5有机成分)+10 mg/L 2,4-D;体胚萌发培养基:MS-B5(MS无机盐+B5有机成分)+4 mg/L 6-BAP[16]。
1.2.2 花生生长及处理 将花生品种花育23的种子用次氯酸钠表面消毒15 min,然后接种到MS培养基上进行催芽,培养室温度为23~25 ℃,光照强度40.5 μmol/(m2·s),每日光照时间13 h。当幼苗长到16 d时,使用1.5 mmol/L的水杨酸喷施叶片表面处理48 h后取样速冻,用于RNA的提取。
1.2.3 DNA提取、RNA提取及反转录 当幼苗长到16 d时,摘取花生尚未完全展开的嫩叶50~100 mg,迅速转移至用液氮预冷的研钵中,用研杵研磨组织成粉末状,利用CTAB法提取基因组DNA;利用RNA iso TM Plus法(TaKaRa Mini BEST Plant RNA Extraction Kit),根据试剂盒说明书进行RNA提取。利用宝生物工程有限公司的反转录试剂盒(Prime scrip TMR Treagent bKit),进行反转录获得cDNA第1条链,进一步合成双链cDNA备用。
1.2.4 引物设计 依据GenBank公布的花生Chi2.2(classII)基因序列(GenBank登录号X82330),设计1对特异性引物P1和P2,在P1的5′ 端引入BglⅡ酶切位点(下划线表示),P2的5′端引入BstEⅡ酶切位点(下划线表示)。引物序列分别为P1:5′-AGATCTGGTACATCCCAAACTCAA-3′;P2:5′-GGTNACCCGCTATACTGGCTACTGCT-3′。引物由大连宝生物公司(TaKaRa)合成。
1.2.5 PCR扩增及RT-PCR扩增 分别以花生品种花育23的DNA和cDNA作为模板进行PCR扩增,PCR总反应体系(25 μL):DNA模板(30 ng/μL)2 μL,上下游引物(10 μmol/L)各1 μL,10× PCR Buffer 4 μL,dNTPs(2.5 mmol/L)2 μL,TaqE(5 U/μL)0.5 μL,ddH2O 14.5 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性50 s,62 ℃退火45 s,72 ℃延伸90 s,33个循环;72 ℃延伸10 min,反应产物用1%琼脂糖凝胶电泳检测。将扩增产物胶回收,连接pMD18-T克隆并测序。
1.2.6 植物表达载体的构建 重组质粒pMD18T-Ah-Chi经限制性内切酶BglⅡ和BstEⅡ酶切,回收Ah-Chi小片段。pCAMBIA1301经同样限制酶酶切切掉Gus基因,回收大片段,与Ah-Chi小片段连接获得重组质粒pCAMBIA1301-Ah-Chi(图1)。对重组质粒进行PCR扩增及BglⅡ和BstEⅡ双酶切验证。重组质粒pCAMBIA1301-Ah-Chi通过冻融法转化农杆菌菌株EHA105获得重组菌株。

图1 植物表达载体pCAMBIA1301-Ah-Chi的构建过程(Gus基因被Ah-Chi 基因替换)
Fig.1 Construction of recombinant plasmid pCAMBIA1301-Ah-Chi (Gus was substituted for Ah-Chi)
1.2.7 花生遗传转化 剥取花生品种鲁花14成熟种子的胚小叶作为外植体,在 70% 乙醇中浸泡 10~20 s,0.1% 升汞中浸泡 8 min,无菌水冲洗3次。将胚小叶外植体接种到预培养培养基上预培养4 d,然后浸于EHA105农杆菌菌液(OD600=0.6~0.8)中,28 ℃,90 r/min振荡侵染15 min。用无菌滤纸将胚小叶表面残留菌液吸干后,再接种到共培养培养基上培养4 d。然后转移外植体到体胚诱导培养基中培养28 d,再将诱导得到的体胚转移到体胚伸长培养基培养2~3个月,期间需要继代培养2~3次,用15 mg/L的潮霉素进行抗性筛选[16]。
1.2.8 转基因植株的分子检测 抗性再生植株利用PCR扩增法进行分子检测及筛选,所用引物为35S启动子序列引物:P3: 5′-GCTCCTACAAATGC CATCA-3′;P4: 5′-GATAGTGGGATTGTGCGTCA-3′, 扩增产物片段大小为195 bp。提取转基因植株及非转基因对照植株RNA,反转录成为cDNA,利用RT-PCR分析Ah-Chi 的表达量,以花生肌动蛋白基因Ah-Actin作为内参基因,其扩增引物序列为:P5: 5′-GTGGCCGTACAACTGGTATTGT-3′, P6: 5′-ATGGAT GGCTGGAAGAGAACT-3′,扩增产物大小为380 bp,引物由大连宝生物公司(TaKaRa)合成。
1.2.9 转基因植株抗病性验证 抗病性鉴定参照Huynh等[17]的方法,将黑斑病菌(Cercosporidium
personatum)接种于试管斜面PDA培养基上,28 ℃培养至菌丝在培养基上长满,然后将其转接于PDA平板培养基上,每个平板上放置3块带有霉菌的PDA培养基继续培养。取转基因植株及非转基因对照植株顶端长势良好且大小一致的叶片,用70% 酒精表面杀菌后放置在底部铺有滤纸的灭菌培养皿中,其中叶片基部用沾无菌水的灭菌棉花包裹以保持花生叶片的活力。从培养黑斑病菌的PDA培养基上用打孔器取直径为6 mm 的菌块放置于叶片的中央(有菌丝的一面紧贴叶片表面),每个叶片接种1个菌饼,28 ℃密封培养7 d后观察叶片感染区域。
以花生品种花育23基因组DNA为模板扩增获得1 779 bp的扩增产物(图2-A);以cDNA为模板通过RT-PCR获得1条795 bp的片段(图2-B)。序列比对结果表明,该基因包含3个外显子和2个内含子,符合 “GT……AG”剪切规则,cDNA序列全长795 bp,编码265个氨基酸。与GenBank中已注册序列X82330同源性为100%,该序列已在GenBank上注册登记(登录号HQ439775)。
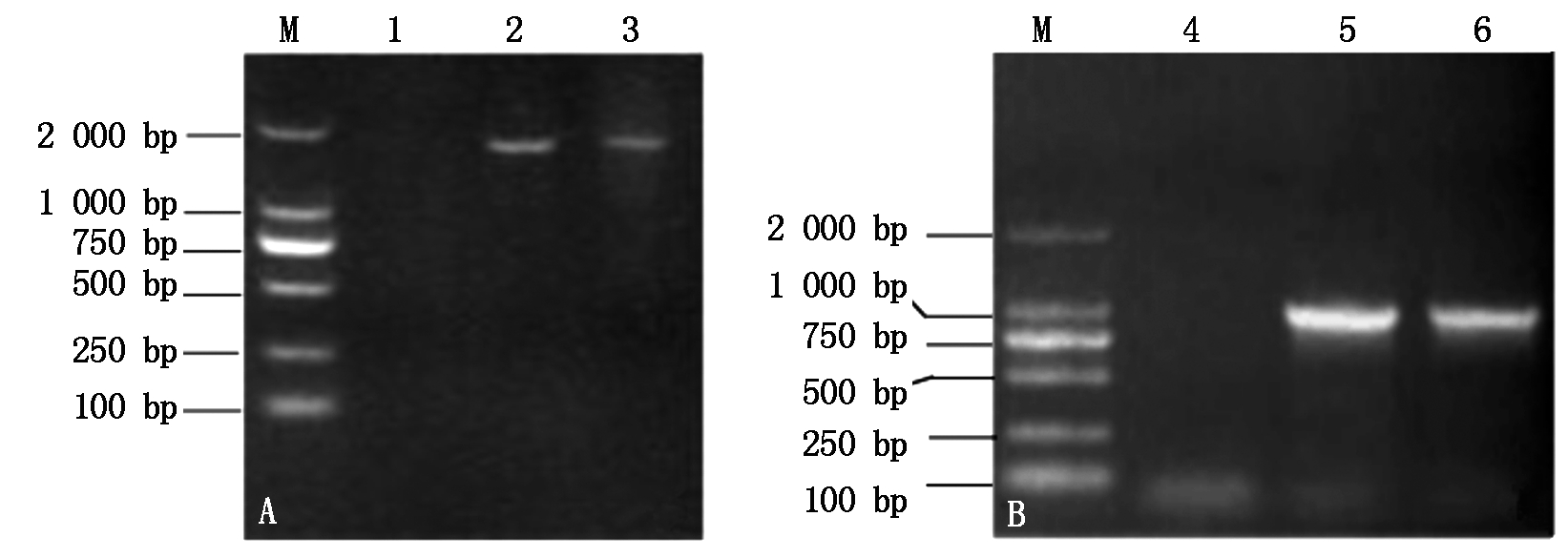
A.以DNA为模板的PCR扩增产物;B.以cDNA为模板的PCR扩增产物;
M.DL2000 DNA分子量标准;1, 4.未加模板对照;2-3.DNA模板;5-6.cDNA模板。
A.PCR amplification products with DNA as template; B.PCR amplification products with cDNA as template;
M.DNA Marker DL2000; 1, 4. Control without DNA template; 2-3.DNA templates; 5-6.cDNA templates.
图2 以DNA和cDNA为模板的Ah-Chi 扩增产物
Fig.2 PCR amplification products of Ah-Chi with DNA and cDNA as template
通过NCBI在线进行BlastP比对,发现Ah-Chi编码产物与花生几丁质酶基因X82330编码蛋白同源关系100%,与水稻(CAA39535.1)、玉米(ALP46629.1)、苜蓿(ABX90065.1)、大豆(XP014618309.1)和拟南芥(NP181885.1)的相关蛋白的同源性分别达到83%,83%,72%,58%,49%(图3-A);氨基酸序列的多重比较结果显示,这些几丁质酶基因编码产物之间具有较高的保守性(图3-B);Ah-Chi与花生野生种(Arachis duranensis,XP_015963545.1)和(Arachis ipaensis,XP_016201396.1)编码的27 ku的酸性内切几丁质酶同源性分别为100%,98%,含有保守蛋白结构域chitinase_glyco_hydro_19,该结构域中包括约50个氨基酸的催化位点和60个氨基酸的糖结合位点(图3-C)。
将构建的过表达载体pCAMBIA1301-Ah-Chi通过冻融法转化农杆菌菌株EHA105获得重组菌株。利用农杆菌介导法转化鲁花14胚小叶外植体,胚小叶外植体在体胚诱导培养基上筛选培养28 d后,大部分将褐化死亡,只得到小部分抗性体胚(图4-A、B),将抗性体胚转移到体胚伸长培养基上,培养35~42 d后体胚明显伸长,长出叶片(图4-C)。继续培养21~28 d后可得约4~5 cm高的小苗(图4-D),将小苗从基部切下,利用嫁接法将再生植株移栽田间[18-19]。
提取转基因植株和非转基因植株基因组DNA,采用35S引物对基因组DNA及pCAMBIA1301-Ah-Chi质粒进行扩增,结果如图5-A所示,1号未加模板对照与3号非转基因植株均未扩增出相应条带,4-8号转化植株均扩增得到了195 bp左右的目的条带,与2号pCAMBIA1301-Ah-Chi质粒阳性对照扩增出的片段长度一致,说明重组质粒成功转入花生。RT-PCR结果表明,1号未加模板对照未扩增出相应条带;2号非转基因植株与3-5号转基因植株均扩增出Ah-Actin亮度一致的条带;对于Ah-Chi 基因,2号非转基因植株的扩增条带明显比3-5号转基因植株扩增条带弱得多。说明转基因植株中的Ah-Chi 得到了过量表达(5-B)。
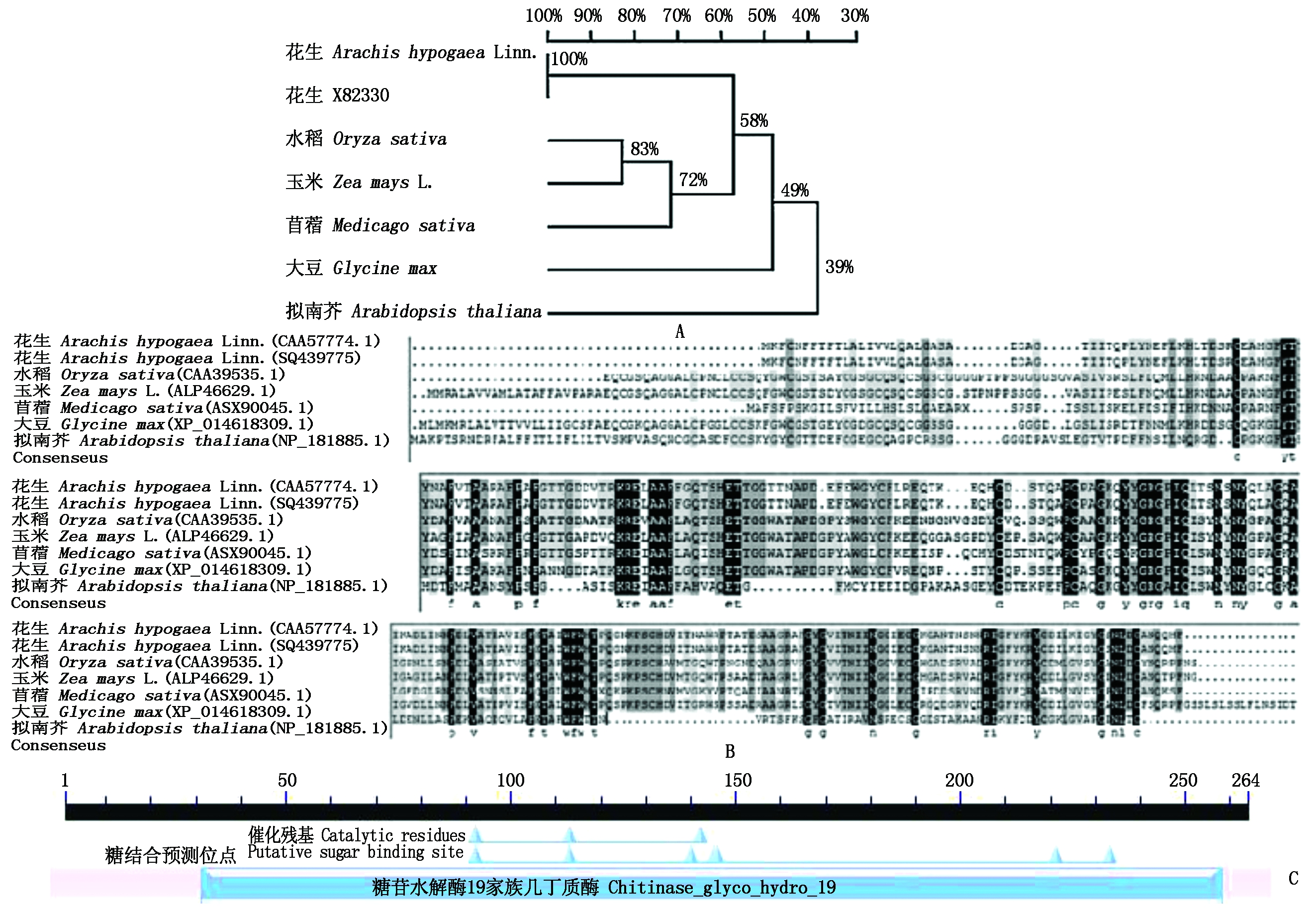
A.花生及其他高等植物几丁质酶蛋白序列的系统进化树;B.花生及其他高等植物几丁
质酶蛋白序列比对结果;C.花生几丁质酶保守结构域预测。
A.Phylogenetic tree of chitinase protein in peanut and other higher plants;B.Amino acid alignment of
chitinase proteins in peanut and other higher plants;C.Chitinase conservative domain in peanut.
图3 花生几丁质酶与其他高等植物几丁质酶的蛋白序列比较
Fig.3 The sequence alignment of chitinase between peanut and other higher plants

A~B.抗性体胚;C.经伸长培养35~42 d的体胚小苗;D.抗性植株。
A-B.Resistant somatic embryos;C.Somatic embryo seedlings that had been elongated for 35-42 days;D.Resistant plants.
图4 抗性体胚的伸长与植株再生
Fig.4 Elongation of resistant somatic embryos and regenerated plantlets
经黑斑病菌(Cercosporidium personatum)接种处理转基因阳性植株和非转基因对照植株离体叶片7 d后,发现非转基因植株叶片褐化及坏死程度较为严重(图6-A),病斑平均直径为3.5 mm,而2个转基因植株叶片褐化及坏死程度相对较轻(图6-B、C),病斑平均直径为2.8 mm。初步说明转化几丁质酶基因的植株抗病性有所提高。
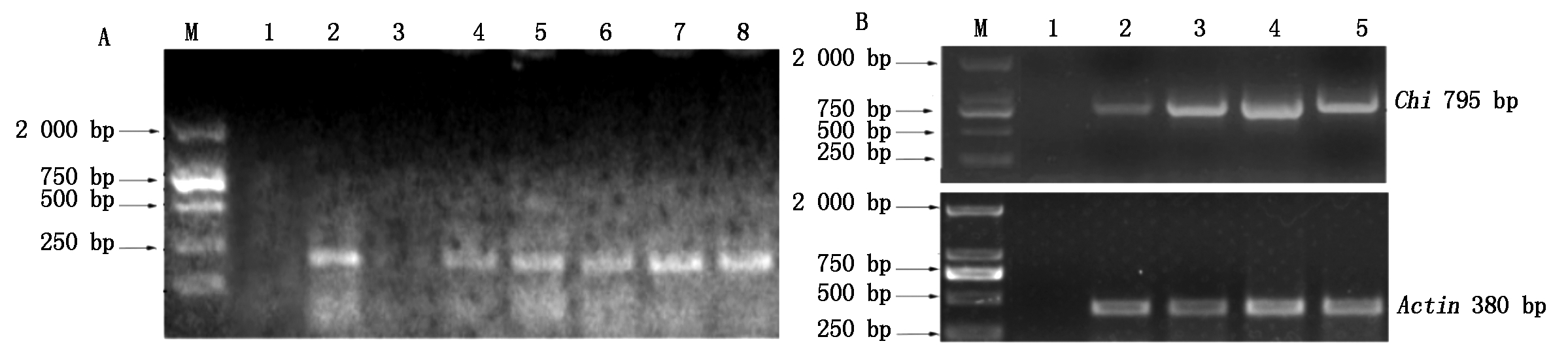
A.35S引物扩增检测转基因花生植株:M.DL2000;1.未加模板对照;2.pCAMBIA1301-Ah-Chi质粒;3.非转基因植株;4-8.转基因植株;B.RT-PCR扩增检测Ah-Chi基因表达量:M.DL2000;1.未加模板对照;2.非转基因植株;3-5.转基因植株。
A.Confirmation on transgenic plants by PCR amplification with 35S primers: M.DL2000;1.Control without DNA template;2.pCAMBIA1301-Ah-Chi;3.Non-transgenic plants;4-8.Transgenic plants; B.Ah-Chi expression level determined by RT-PCR amplification:M.DL2000;1.Control without DNA template;2.Non-transgenic plants;3-5.Transgenic plants.
图5 转基因植株的PCR和RT-PCR扩增检测
Fig.5 Confirmation on transgenic plants in DNA and mRNA using PCR and RT-PCR amplification

A.非转基因植株叶片;B~C.转基因植株叶片。
A.Non-transgenic plant leaves;B-C.Transgenic plant leaves.
图6 转基因植株的抗病性鉴定
Fig.6 Evaluation on disease resistance of transgenic plants
几丁质酶是重要的病程相关蛋白(PR蛋白),在植物抵御真菌性病害中发挥重要作用,是植物抗病基因工程的主要研究对象。Cuero等[20]发现,能产毒的黄曲霉菌可诱导萌芽状态的花生种子产生分子量约36~45 ku的几丁质酶,因此,确定花生几丁质酶与黄曲霉、叶斑病之间有一定的相关性[21]。Prasad等[22]利用农杆菌介导法将水稻几丁质酶基因Rchit转化3个花生品种获得30个转基因事件,转基因植株叶片几丁质酶活性比非转基因对照提高2~14倍,其中来自于2个转化事件的3个株系对晚斑病、锈病和黄曲霉病的抗性明显增强。Iqbal等[23]将水稻几丁质酶基因Rchit-3转化到花生子叶中,通过离体培养得到转基因植株T0,T1植株进行褐斑病(Cercospora arachidicola)抗性测试,转基因植株的抗病性明显高于非转基因对照植株。Qiao等[24]研究表明,过量表达花生β-1,3-葡聚糖基因(Ah-Glu)的转基因植株对褐斑病菌的抗病性增强。几丁质酶基因在植物体内以多基因家族的形式存在,Herget等[25]从花生培养细胞中分离出Chit1~4,并研究证实Chit2 能够被病原菌强烈诱导。本研究结果也表明,表达花生Ah-Chi的转基因植株对黑斑病菌的抗病性增强。几丁质和葡聚糖都是真菌细胞壁的主要成分,几丁质酶和β-1,3-葡聚糖酶在抵御植物真菌性病害中具有协同效应[26]。后续研究中可将几丁质酶和β-1,3-葡聚糖酶这2个基因共同转化来发挥这2个蛋白的协同作用,获得高抗病性的转基因植株以便更好地利用转基因技术来增强花生对真菌病害的抵抗能力。
花生属于较难转化的植物,本研究利用丁霄等[16]建立的高效花生再生体系,利用农杆菌介导法,通过体胚发生途径诱导植株再生,得到的再生植株来源于单个细胞,与传统的器官发生途径相比较,避免了再生植株是嵌合体的弊端。花生组织培养及遗传转化中遇到的另外一个问题是根的再生比较困难而且生根质量较差,移栽难以成活,本研究利用郝世俊等[18]、宋汝涛等[19]发明的嫁接技术将再生苗移栽田间,大大提高了再生苗的存活率。而Iqbal等[23]利用巴基斯坦当地花生品种GOLDEN and BARI-2000进行遗传转化,在添加了0.5 mg/L NAA的MS培养基上诱导出较为健壮的根,这表明不同基因型的花生品种存在着生根难易的区别,花生再生及遗传转化体系仍需进一步优化。
本研究结果表明,利用遗传转化方法在花生中过量表达自身抗病基因提高花生的抗病性是可行的,后期将结合田间试验对这些转基因材料进行进一步评价,为将来在政策允许条件下的田间释放提供依据。另外,与近年所提出的聚合育种相比,单一基因转移对作物的改良存在一定的局限性,如能将几种抗病基因同时转移至受体,获得对多种病害免疫或者高抗的特殊材料,或者转入不同来源及不同功能的基因对多个农艺性状进行改良,培育高产优质多抗的植物新材料、新品种,这些相关工作的有效展开将大大提高农业生产的效率。
[1] 张 丽. 兴安落叶松几丁质酶基因的克隆及特性分析[D]. 呼和浩特: 内蒙古大学, 2016.
[2] 耿莉娜. 烟草Ⅰ型几丁质酶的生物信息学分析[J]. 中国农学通报, 2014, 30(31): 95-99.
[3] García-Breijo F J, Garro R, Conejero V. C7 (P32) and C6 (P34) PR proteins induced in tobacco leaves by citrus exocortis virorid infection are chitinases[J]. Physiol Mol Plant Pathol,1990,36: 249-260.
[4] Conrads-Strauch J, Dow J M, Milligan D E, et al. Induction of hydrolytic enzymes inBrassica campestris in response to pathovars ofXanthomonas campestris[J]. Plant Physiology, 1990, 93(1): 238-243.
[5] Berglund L, Brunstedt J, Nielsen K K, et al. A proline-rich chitinase fromBeta vulgaris[J]. Plant Molecular Biology, 1995, 27(1): 211-216.
[6] 姜竹峪, 陈 羽, 魏锦兴, 等. 几丁质酶的研究进展[J]. 沈阳药科大学学报, 2016, 33(5): 414-418.
[7] 郑家敏, 梁燕辉, 朱 凡, 等. 几丁质酶基因的克隆表达及酶学性质[J]. 微生物学通报, 2018, 45(5): 1027-1033.
[8] 陈少波, 吴根福. 几丁质酶研究进展[J]. 科技通报, 2004, 20(3): 258-262.
[9] Broglie K, Chet I, Holliday M, et al. Transgenic plants with enhanced resistance to the fungal pathogenRhizoctonia solani[J]. Science 1991, 254(5035):1194-1197.
[10] Osman G H, Assem S K, Alreedy R M, et al. Development of insect resistant maize plants expressing a chitinase gene from the cotton leaf worm,Spodoptera littoralis[J]. Scientific Reports, 2015, 5: 18067.
[11] Richa K, Tiwari I M, Devanna B N, et al. Novel chitinase geneLOC_Os11g47510 from indica rice tetep provides enhanced resistance against sheath blight pathogenRhizoctonia solani in rice[J]. Frontiers in Plant Science, 2017, 8: 596.
[12] Marchant R, Davey M R, Lucas J A, et al. Expression of a chitinase transgene in rose 9(Rosa hybrida L.)reduces development of black spot disease(Diplocarpon rosae wolf)[J]. Molecular Breeding, 1998, 187(2): 33-36.
[13] 郭林霞, 董 旋, 赵德刚. 转杜仲几丁质酶基因EuCHIT1番茄提高对灰霉病的抗性[J]. 植物生理学报, 2016, 52(5): 703-714.
[14] 金学博, 柳 青, 尹佳悦, 等. 一种新型几丁质酶基因LcChi在转基因水稻中的功能分析[J]. 生物技术进展, 2016, 6(2): 77-84.
[15] 程笑笑. 棉花黄萎病菌内源几丁质酶基因VDECH功能分析 [D].北京:中国农业科学院, 2017.
[16] 丁 霄, 隋炯明,王晶珊, 等. 以木糖异构酶基因作为选择标记的花生遗传转化[J]. 核农学报, 2012, 26 (3):444-448,483.
[17] Huynh Q K, Hironaka C M, Levine E B, et al. Antifungal proteins from plants. Purification, molecular cloning, and antifungal properties of chitinases from maize seed[J]. The Journal of Biological Chemistry, 1992, 267(10): 6635-6640.
[18] 郝世俊, 隋炯明,乔利仙,等. 花生组培苗嫁接技术的研究[J]. 青岛农业大学学报:自然科学版, 2010, 27(2):110-113.
[19] 宋汝涛, 陈新利, 于明洋, 等. 以木糖作为筛选剂的花生子叶外植体遗传转化[J]. 农业生物技术学报, 2015, 23(9): 114-1148.
[20] Cuero R G, Osuji G O.Aspergillus flavus-induced chitinase in germinating corn and peanut seeds:A.flavus mechanism for growth dominance over associated fungi and concomitant aflatoxin production[J]. Food Additives and Contaminants, 1995, 12(3): 47-483.
[21] 曲明静, 黄忠林, 鞠 倩, 等. 花生网斑病菌和黄曲霉菌对花生几丁质酶诱导的研究[J]. 花生学报, 2008,37(1): 1-6.
[22] Prasad K, Bhatnagar-Mathur P, Waliyar F, et al. Over expression of a chitinase gene in transgenic peanut confers enhanced resistance to major soil borne and foliar fungal pathogens[J]. J Plant Biochem Biotechnol, 2013, 22(2): 222-233.
[23] Iqbal M M, Nazir F, Ali S, et al. Over expression of rice chitinase gene in transgenic peanut (Arachis hypogaea L.) improves resistance against leaf spot[J]. Molecular Biotechnology, 2012, 50(2): 129-136.
[24] Qiao L X, Ding X, Wang H C, et al. Characterization of the β-1,3-glucanase gene in peanut (Arachis hypogaea L.) by cloning and genetic transformation[J]. Genetics and Molecular Research, 2014, 13(1): 1893-1904.
[25] Herget T, Schell J, Schreier P H. Elicitor-specific induction of one member of the chitinase gene family inArachis hypogaea[J]. Molecular & General Genetics, 1990, 224(3): 469-476.
[26] 李志芳, 冯自力, 赵丽红, 等. 转几丁质酶和葡聚糖酶双价基因棉花对土壤细菌种群多样性的影响[J]. 遗传, 2015, 37(8): 821-827.