玉米AGPL2蛋白多克隆抗体制备及时空表达分析
吕亚楠1,余国武1,2,黄玉碧1,2
(1.四川农业大学 农学院,四川 成都 611130;2.四川农业大学 农学院 作物科学实验教学中心,四川 成都 611130)
摘要:为探讨玉米AGPL2在籽粒发育时期淀粉积累过程中的功能机制,通过AGPL2 基因克隆和构建带有 GST 标签的原核表达载体PGEX-6T-1-AGPL2,并利用大肠杆菌诱导表达体系,用 0.5 mmol/L 异丙基-β-D-硫代半乳糖苷(IPTG)在28 ℃条件下诱导表达 6 h 后,GST-AGPL2融合蛋白能够得到高水平表达,然后利用GST(Glutathione S-transferase)标签蛋白纯化介质进行亲和层析纯化,能够得到质量较高的GST-AGPL2 融合蛋白;利用纯化所得的GST-AGPL2重组蛋白免疫新西兰大白兔制备了AGPL2多克隆抗体,分离并纯化抗血清,然后用rTEV Protease去除抗原GST-AGPL2 融合蛋白的GST标签,并用纯化后的AGPL2多克隆抗体进行Western Blot检测,结果发现,AGPL2多克隆抗体具有较高特异性和灵敏性,可用于检测纳克级抗原蛋白;并利用Western Blot方法研究了AGPL2蛋白在玉米不同组织和不同授粉时期胚乳中的分布和表达模式,结果显示,AGL2蛋白在玉米不同组织中的表达具有组织特异性,且在胚乳中含量最高。AGPL2蛋白在玉米胚乳不同授粉时期表达量先增加后降低,且在授粉中期达到最大值。其结果与玉米籽粒发育过程中淀粉的积累规律一致,说明AGPL2主要存在于玉米胚乳中,且可能参与淀粉的合成,也说明AGPL2多克隆抗体具有很好的特异性,能够识别玉米体内的AGPL2抗原。
关键词:AGPL2蛋白;基因克隆;原核表达;Western Blotting
淀粉(Amylum)作为植物中重要的贮藏多糖,是植物种子的主要成分。淀粉可以为食物提供80%的能量,是食物的重要组成部分[1]。玉米是三大粮食作物之一,随着时代的进步和科技的发展,淀粉已经成为一种重要的商业产品,在能源、医药、化工等领域的应用,已进入稳步健康发展阶段[2]。在玉米籽粒中,淀粉的比例达到70%左右,因此,淀粉的质量对玉米的质量有直接的影响[3]。植物体内淀粉的合成是一个复杂的生理过程,它是由几种酶共同催化下,以蔗糖为起始原料,进行一系列生理生化反应合成的[4]。而其中ADPG焦磷酸化酶(AGPase)是淀粉合成代谢途径中起始关键限速酶[5]。因此,深入研究AGPase,对淀粉的合成起到重要作用,有利于研究淀粉生物合成的分子机制及其调控。
有研究表明,AGPase的活性影响淀粉的合成。在植物的叶和块茎中,通过效应子3-磷酸甘油酸的激活作用和无机磷酸的抑制作用,AGPase的活力与光合作用活性相协调[6-7]。Stark等[8]在马铃薯中转入AGPase,结果发现,增加了35%的淀粉产量。同样, Wang等[9]研究中,构建AGPase与胚乳组织特异启动子的重组载体,并将其转入到玉米中表达,结果发现,种子质量增加了22%~25%。另外,发现了一种大肠杆菌突变体,将其转进水稻进行表达,水稻的产量提高了11%[10]。因此,深入研究AGPase,提高其活性,有利于淀粉产量的增加,对作物的育种研究有重要的意义。
高等植物的AGPase是由2个大亚基(LSU)和2个稍小的小亚基(SSU)组成的一个异源四聚体酶(α2β2)。一般大亚基对AGPase具有调控的功能,而小亚基则具有催化功能[11]。AGPase有多种类型的同工酶,并且有多个基因编码。其中,玉米AGPL2是AGPase同工酶的一种大亚基,主要存在于胚乳中,编码518个氨基酸。它可以与AGPase其他亚基组成一种或几种形式的AGPase。水稻胚乳AGPase是由2个小亚基(AGPS2b)和2个大亚基(AGPL2)组成的异源四聚体,在其催化作用下在细胞质中合成ADP-葡萄糖[12]。而且在水稻胚乳中,ADP-葡萄糖焦磷酸化酶(AGPL2和AGPS2b)的表达水平在空间上与淀粉颗粒的差异性分布是相关的,并且编码ADP-葡萄糖焦磷酸化酶的AGPL2和AGPS2b的转录水平似乎调节颖果发育时期淀粉颗粒的异步发育[13]。有研究表明,改变AGPase 7种亚基的组合方式和结构,能够增强土豆(Solanum tuberosum)块茎[7,14]、玉米(Zea mays)[15]、小麦(Triticum aestivum)[16]和水稻(Oryza sativa)种子[17]中AGPase的活性和淀粉的积累。因此,设计玉米AGPL2特异性引物,构建原核表达载体,使其在E.coli能够高效表达,纯化目的蛋白并制备AGPL2多克隆抗体,为研究玉米AGPL2蛋白的表达分析、AGPase的活性乃至淀粉的合成奠定基础。
1 材料和方法
1.1 材料和试剂
以四川农业大学玉米研究所选育的中国西南地区优良玉米骨干系08-641(R08)为材料,该材料特点为淀粉含量较高。
本研究所用的主要试剂:反转录试剂盒、限制性内切酶EcoRⅠ和SalⅠ以及DNA连接酶和蛋白酶抑制剂等(TaKaRa);蛋白质亲和纯化介质GSH-coupled Agarose Affinity Matris(Genstar)、NC膜(Hybond C Extra);弗氏完全佐剂和不完全佐剂(Sigma)、HRP标记的羊抗兔抗体(Abbkine);Quick StartTMBradford 1x dye reagen(Bio-Rad)、HRP-DAB显色试剂盒(Thermo)、蛋白分子量预染蛋白Marker(Solarbio)、WB-MASTER Protein Standard(GenScript)。其他试剂均为国产分析纯试剂。雌性新西兰大白兔,质量为1.5~2.0 kg,由达硕实验动物中心提供。
1.2 试验方法
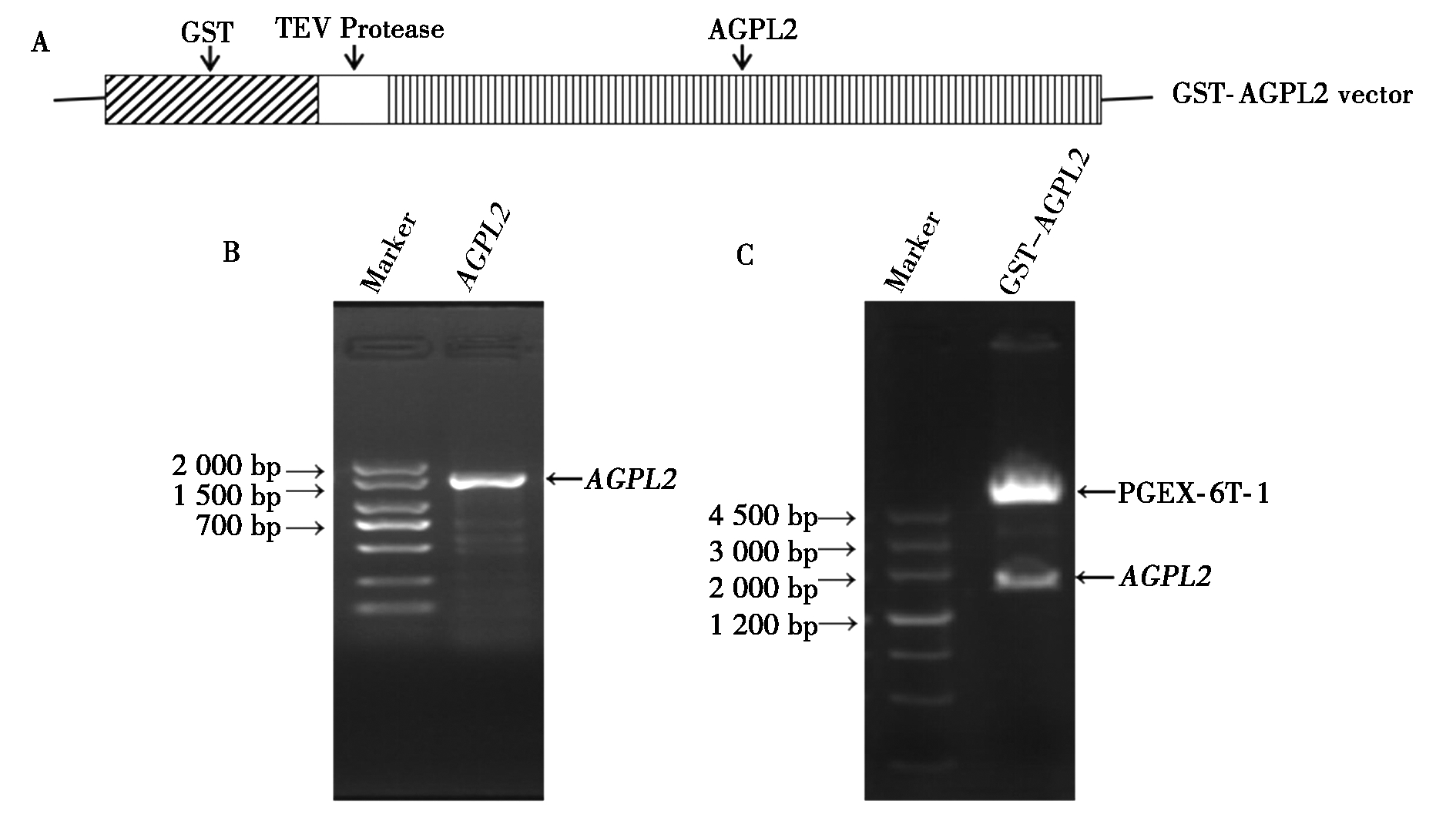
1.2.1 PGEX-6T-1-AGPL2原核表达载体的构建 玉米授粉后20 d,分离胚乳,提取总RNA,并反转录成cDNA后置于-20 ℃冰箱保存备用。Primer 5.0软件设计AGPL2带有EcoR Ⅰ和Sal Ⅰ酶切位点的上下游引物。通过PCR从玉米胚乳cDNA中扩增目的片段,连接至pMD-19-simple-T载体扩增后,用EcoRⅠ和Sal Ⅰ双酶切回收AGPL2基因片段,与同样双酶切后的表达质粒PGEX-6T-1定向连接,用CaCl2化学法通过热击转化E.coli DH5α菌株,涂板后倒平板培养过夜,挑取单菌落于1 mL Luria-Bertani(LB)液体培基(含100 μg/mL氨苄青霉素)中,37 ℃振荡培养4~6 h,进行菌液PCR检测,选取能够检测到目的条带的菌液扩大培养并用碱裂解法提取质粒,进行EcoR Ⅰ和Sal Ⅰ双酶切验证,然后将重组质粒送到测序公司进行最后确认。
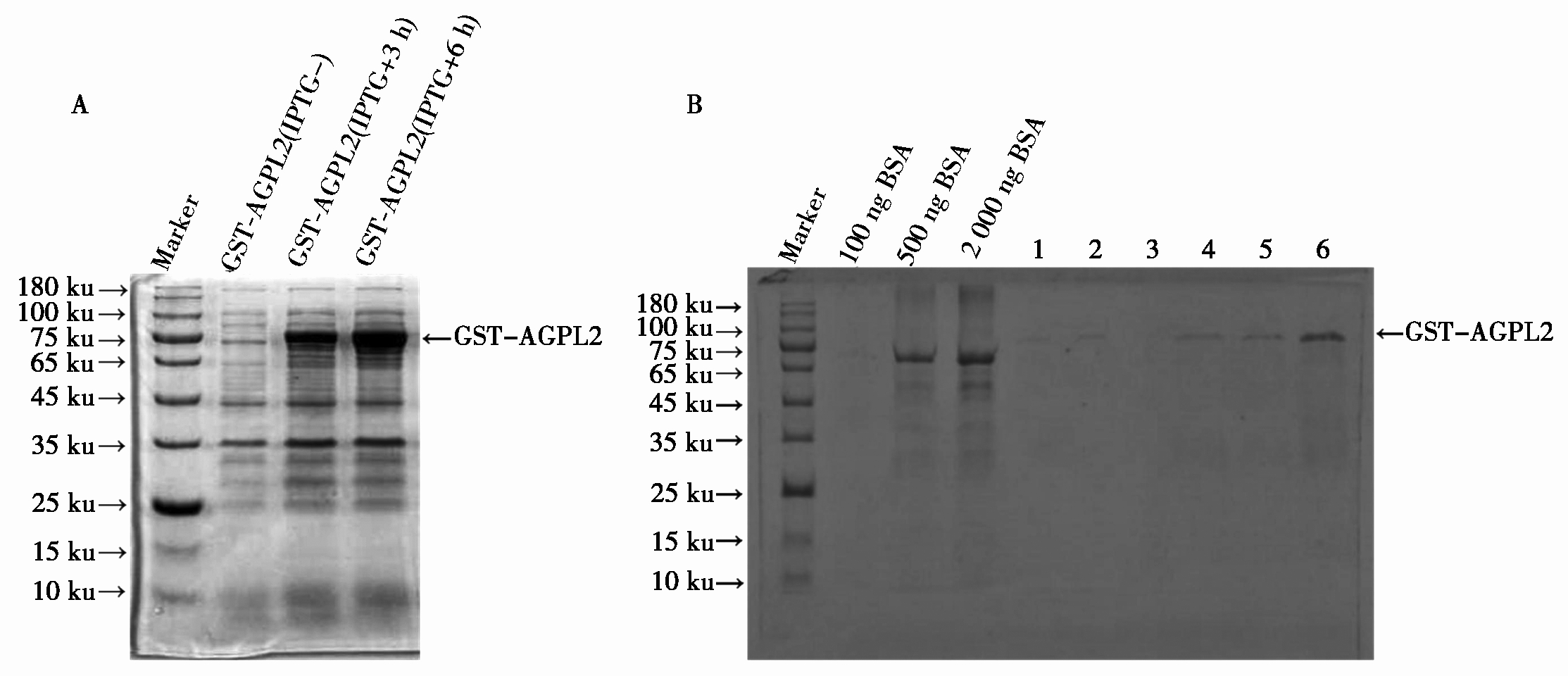
1.2.2 GST-AGPL2融合蛋白的诱导表达 将经过确认的重组质粒转入E.coli 表达感受态细胞BL21,涂板并倒平板过夜培养,挑取单克隆于1 mL LB(含100 μg/mL氨苄青霉素)中,37 ℃培养4~6 h,然后进行菌液PCR检测。将检测正确的菌液接种于LB(含100 μg/mL氨苄青霉素)中,37 ℃振荡培养,使菌液OD600在0.4~0.8,加入0.5 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)于28 ℃诱导表达6 h。分别在诱导0,3,6 h时取1 mL菌液,收集菌体,用100 μL超纯水重悬菌体,加入蛋白上样缓冲(20 mmol/L Tris-HCl,0.4% SDS,5%甘油,1% β-巯基乙醇,0.02%溴酚蓝,pH值6.8),煮沸裂解5~10 min,离心(12 000 r/min,2~5 min),吸取上清进行10% SDS-PAGE(SDS-聚丙烯酰胺凝胶电泳)检测重组蛋白的表达。
1.2.3 GST-AGPL2融合蛋白的纯化 将融合蛋白表达成功的菌液离心(4 ℃,4 000 r/min,5~10 min),去上清收集菌体,重悬于PBS缓冲液,离心去上清,重复2~3次。然后用PBS重悬菌体并加入蛋白酶抑制剂,置于冰上,超声破碎使细胞裂解,离心(4 ℃,10 000 r/min,10 min)收集上清。将上清加入预先平衡的含Glutathione beads的纯化柱中,在4 ℃摇床过夜结合。去除上清,用5~10倍柱体积的PBS缓冲液洗涤beads。再用洗脱液洗脱,收集组分,重复5次。最后将收集的蛋白各取出10 μL进行10% SDS-PAGE(SDS-聚丙烯酰胺凝胶电泳)检测。
1.2.4 多克隆抗体的制备 购买2 kg新西兰大白兔,适应环境3~4 d。取兔耳静脉血约500 μL,分离血清作为阴性对照。血液于37 ℃放置2 h,然后4 ℃放置过夜;离心(4 ℃,4 000 r/min,10 min),收集上清,重复2~3次;血清中加入15%的甘油和0.2‰的叠氮化钠,混匀后置于-80 ℃保存。第一次免疫新西兰大白兔时,将纯化的蛋白和不完全佐剂按1∶1混合,直至1 000 r/min离心不分层,然后多点注射兔子皮下。再次注射时,纯化的蛋白和完全佐剂按1∶1混合。每隔14 d免疫一次,连续免疫4次。最后一次注射7 d后,在兔子的颈动脉处取所有血液,分离血清并Western Blot检测评价抗血清。
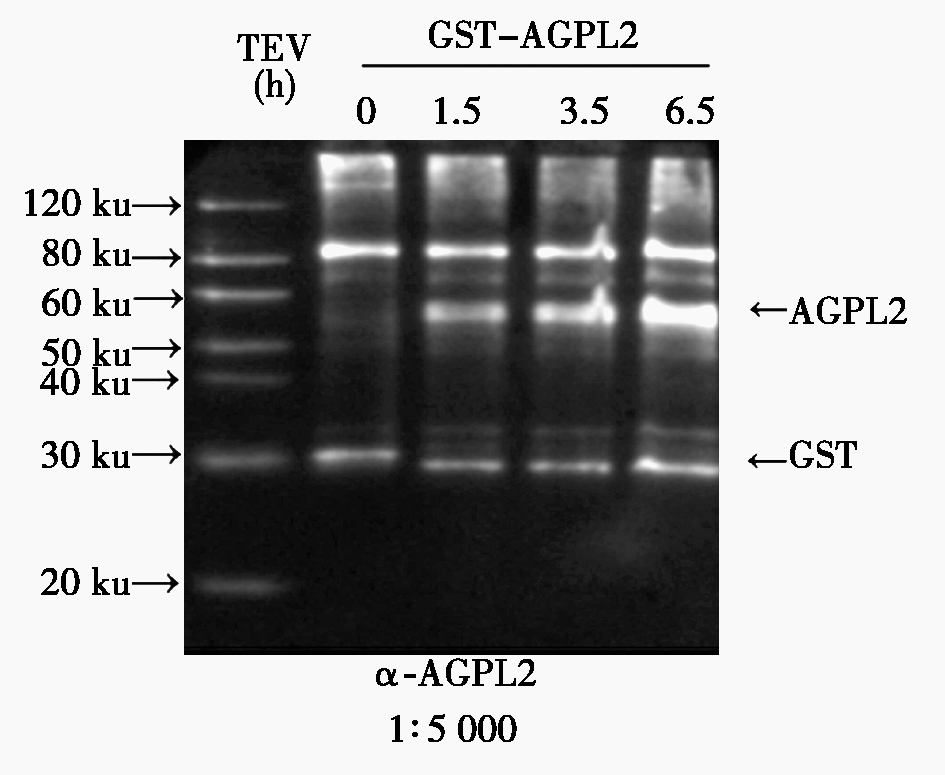
1.2.5 GST-AGPL2蛋白rTEV Protease酶切反应 取7.5 μg纯化的GST-AGPL2融合蛋白,总体系为150 μL,pH值7.0,加入rTEV Protease(3 μL 25 U)30 ℃孵育,在0,1.5,3.5,6.5 h分别取出30 μL反应液,然后各取出10 μL约 500 ng蛋白进行Western Blot检测。
1.2.6 玉米不同组织蛋白的提取及蛋白定量 将样品在液氮中研磨至粉末,称质量,以1 g样品加入2 mL蛋白提取液(100 mmol/L Tris-HCl,pH值7.0,40 mmol/L β-巯基乙醇,10 mmol/L MgCl2,100 mmol/L KCl,15%甘油)的比例加入适当的提取液,并加入蛋白酶抑制剂,混匀,放置冰上30 min;离心(4 ℃,12 000 r/min,15 min),收集上清,重复2次;在1 mL快速测定蛋白浓度反应液中加入2 μL的上清,测OD595以确定其蛋白浓度。
1.2.7 Western Blot试验 Western Blot采用湿转法,在SDS-PAGE结束后,电压90 V,转膜2 h;用丽春红染液染色5 min,观察实际的转膜效果,TBST(150 mmol/L NaCl,20 mmol/L Tris-HCl,pH值8.0,0.05% Tween 20)洗膜3次,每次5 min;加入封闭液(含有5%脱脂奶粉的TBST),在摇床上缓慢摇动,室温封闭1 h;将AGPL2多克隆兔抗体按照适当比例用TBST稀释,4 ℃缓慢摇动孵育过夜,回收一抗,TBST洗膜4次,每次10 min;将HRP标记的羊抗兔IgG按照1∶10 000稀释,室温孵育1 h,回收二抗,再用TBST缓冲液清洗膜4次,每次10 min;加入1∶1混合均匀的显影液和定影液,进行化学发光显影。
2 结果与分析
2.1 PGEX-6T-1-AGPL2原核表达载体的构建
为了构建原核表达载体PGEX-6T-1-AGPL2,选取PGEX-6T-1作为目标载体,该载体含有一个GST标签,GST与目的基因间还有一个TEV Protease酶切位点,可以在试验需要时去除GST标签(图1-A)。以玉米胚乳cDNA为模板,PCR扩增得到AGPL2基因片段,其大小为1 500 bp左右,与理论分子量相符(图1-B)。经酶切、连接反应成功构建PGEX-6T-1-AGPL2载体。将重组质粒PGEX-6T-1-AGPL2进行EcoR Ⅰ和Sal Ⅰ双酶切验证,获得条带大小约为1 500 bp的片段,与预期结果一致(图1-C)。进一步测序验证,表明PGEX-6T-1-AGPL2表达载体构建成功。
2.2 PGEX-6T-1-AGPL2融合蛋白的诱导纯化及鉴定
由上步获得的PGEX-6T-1-AGPL2质粒转化大肠杆菌BL21(DE3)菌株,获得重组工程菌株。在0.5 mmol/L IPTG诱导下,GST-AGPL2融合蛋白的表达量增加,蛋白分子量约83 ku,与理论分子量相符(图2-A)。并且在28 ℃条件下,用0.5 mmol/L IPTG诱导6 h,目的蛋白表达量随诱导时间的增加而增加,说明目的蛋白在此条件下能够得到高水平表达。为获得足够量的AGPL2蛋白,先后纯化得到6管浓度不一的蛋白,其条带比较单一,蛋白质量较高(图2-B)。用已知的不同浓度BSA作对照,6管蛋白浓度介于10~200 ng/μL;其中第6管蛋白浓度最高,介于50~200 ng/μL。这些结果表明,GST-AGPL2重组蛋白成功被纯化,可用作抗原制备抗体。
2.3 兔抗血清制备及特异性检测
将上步获得的高质量纯化蛋白,免疫新西兰大白兔,分离血清,获得兔多克隆抗体。为了验证AGPL2抗体的特异性,将上步纯化得到的GST-AGPL2融合蛋白用rTEV Protease去除GST标签,进行Western Blot检测(图3)。结果表明,rTEV Protease酶切前抗体能够特异地检测到GST-AGPL2蛋白条带,酶切后抗体检测到GST-AGPL2、AGPL2和GST这3条带,且随着酶切时间的增加AGPL2条带的信号逐渐增强,说明AGPL2抗体能够特异地检测纳克级抗原,具有很好的特异性和灵敏性。
2.4 玉米AGPL2蛋白的时空表达分析
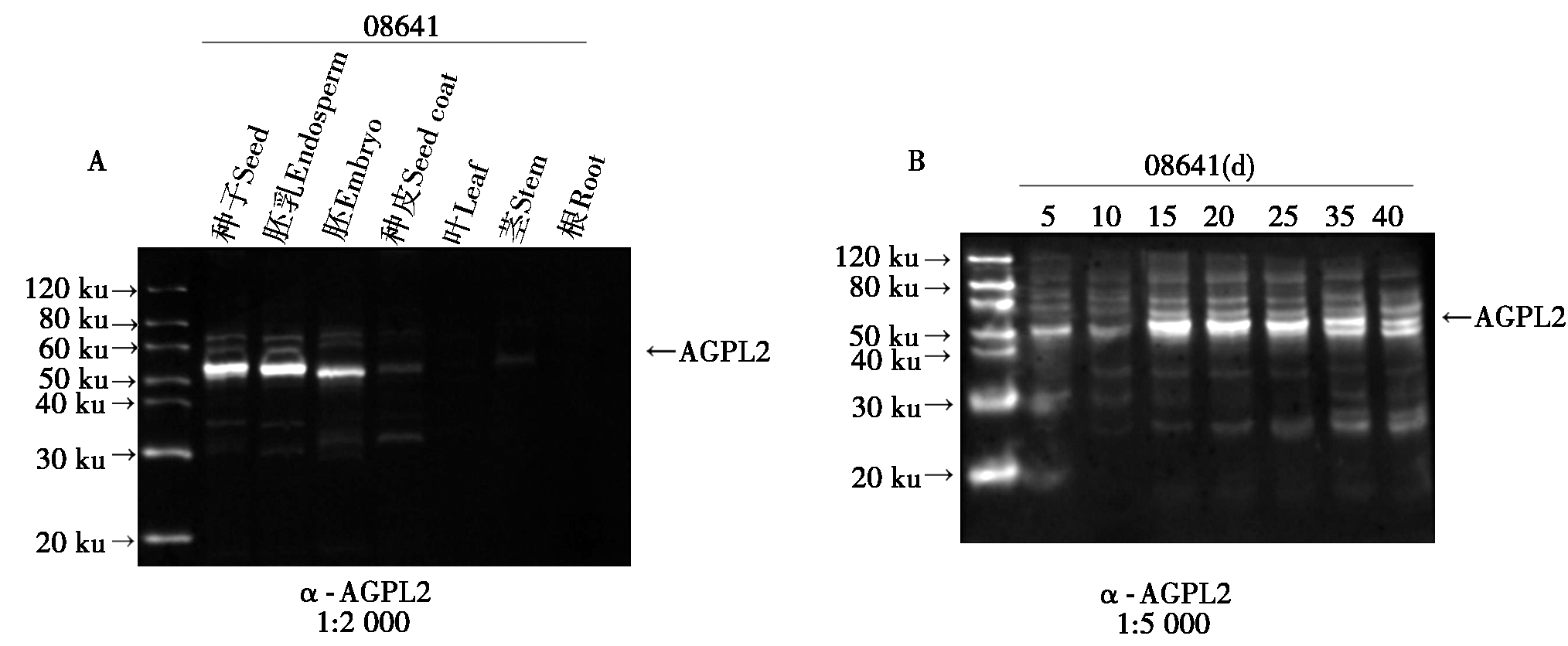
在体外,AGPL2抗体能识别其抗原,但是否能识别玉米体内的蛋白还不清楚。因此,为了研究玉米内源AGPL2蛋白是否能被制备的抗体识别及AGPL2表达模式与分布情况,提取玉米08641不同组织及其授粉后不同时期的胚乳蛋白,进行Western Blot检测,结果表明,玉米不同组织中检测到的信号强弱不一,说明AGPL2蛋白在不同组织中的表达具有组织特异性(图4-A)。胚乳中AGPL2蛋白的表达量最高,其次是胚,而在根、茎和叶中表达量很少甚至检测不到,说明AGPL2蛋白功能主要在胚和胚乳中。淀粉主要在胚乳中积累,为了进一步研究在淀粉积累中胚乳AGPL2的表达模式,分离授粉后不同阶段的胚乳,提取总蛋白并进行Western Blot检测,结果表明,在授粉10 d内AGPL2蛋白含量很少,10~15 d AGPL2蛋白的表达量剧增,在15,20 d的信号最强,随后逐渐减弱(图4-B)。这一结果与淀粉的积累模式相符,说明AGPL2在淀粉的积累过程中可能参与了淀粉的合成。也表明AGPL2抗体能够很好地识别玉米胚乳内的抗原。以上结果说明,AGPL2多克隆抗体能特异地识别玉米体内的蛋白。在玉米中,AGPL2的表达主要在胚乳中,尤其在授粉后15,20 d表达水平较高。
3 结论与讨论
本研究扩增编码AGPase大亚基多个基因之一的AGPL2基因,成功构建了原核表达载体PGEX-6T-1-AGPL2。在大肠杆菌BL21(DE3)中诱导表达GST-AGPL2蛋白,结果发现,在28 ℃、0.5 mmol/L IPTG条件下该蛋白能够得到高水平的表达。用亲和纯化的GST-AGPL2蛋白作为抗原,免疫新西兰大白兔成功制备其多克隆抗体,抗体具有较高的特异性和灵敏性。并利用AGPL2抗体初步研究了玉米AGPL2蛋白的时空表达分布,说明AGPL2蛋白主要存在于胚乳,其表达模式与淀粉积累规律一致,对进一步探索和研究植物中AGPL2蛋白、AGPase及淀粉的合成具有重要的意义。
兔多克隆抗体AGPL2具有较高的特异性和效价。在体外抗体特异性试验中,检测的总抗原蛋白500 ng,rTEV Protease去除GST标签前检测到了GST-AGPL2,而酶切后出现了不带标签的AGPL2及GST蛋白。结果表明,AGPL2多克隆抗体不但能识别AGPL2蛋白,而且也能识别GST。而在玉米体内不存在GST蛋白,因此,AGPL2多克隆抗体具有较高的特异性。在抗体效价方面,试验并未直接用Elisa实验去评估效价[18],直接采用了Western Blot去验证抗体。因在抗原检测中,抗体的稀释比为1∶5 000,在体内玉米AGPL2蛋白检测试验中,也采用了1∶2 000的稀释比例。这些结果表明,AGPL2抗体具有较高的效价。另外,AGPL2抗体检测的总抗原蛋白为500 ng,其中AGPL2的量远低于500 ng,因此证明AGPL2抗体可用于检测纳克级蛋白,具有较高的特异性和灵敏性。总之,以上结果说明,试验获得了具有较高特异性和效价的抗体。
在多种植物中发现,AGPase的大小亚基不止一种基因编码,而是由多个基因编码,并且这些基因存在于不同的组织或器官,具有组织表达特异性[19-24]。本研究对玉米的根、茎、叶、种皮、胚、胚乳中的AGPL2亚基进行免疫杂交时,不同组织AGPL2蛋白的表达量不同,并且AGPL2在胚乳中表达量最高,表明了AGPL2亚基具有组织表达特异性且主要存在于胚乳。在黄斌全[25]的研究中,对胚乳、胚、根和叶中的AGPL2进行荧光定量,结果出现AGPL2在胚中的表达量最高,其次是叶,最低是根。与本研究的结果不一致,可能是因为本研究是基于蛋白水平,而黄斌全[25]是在RNA水平上进行研究的。有研究表明,RNA水平和蛋白水平往往不一致[26]。并对玉米不同授粉时期的胚乳裂解液进行Western Blot检测,检测到的信号强弱不一,且信号由弱到强再变弱,表明了玉米胚乳中AGPL2的表达模式是先增加后降低,这与黄斌全[25]研究的荧光定量结果一致,且与淀粉的积累规律相符。在玉米胚乳组织的表达分布中,AGPL2抗体在35,40 d主要识别了2条条带,推测由于大亚基蛋白同源性较高AGPL2抗体也可能识别AGPase的其他亚基。
参考文献:
[1] 尤 新. 玉米深加工技术[M]. 北京: 轻工业出版社,2011:5-15.
[2] Chen J,Yi Q,Cao Y,et al. ZmbZIP91 regulates expression of starch synthesis-related genes by binding to ACTCAT elements in their promoters[J]. Journal of Experimental Botany,2015,67(5):1327-1338.
[3] Dinges J R,Colleoni C,Myers A M,et al. Molecular structure of three mutations at the maize sugary1 locus and their allele-specific phenotypic effects[J]. Plant Physiology,2001,125(3):1406-1418.
[4] Huang B,Keeling P L,Hennen-Bierwagen T A,et al. Comparativein vitro analyses of recombinant maize starch synthases SSI,SSIIa,and SSIII reveal direct regulatory interactions and thermosensitivity[J]. Archives of Biochemistry and Biophysics,2016,596:63-72.
[5] Cifuente J O,Comino N,Madariaga-Marcos J,et al. Structural basis of glycogen biosynthesis regulation in bacteria[J]. Structure,2016,24(9):1613-1622.
[6] Rodriguez-L pez M,Baroja-Fern ndez E,Zandueta-Criado A,et al. Adenosine diphosphate glucose pyrophosphatase:A plastidial phosphodiesterase that prevents starch biosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(15):8705-8710.
[7] Cross J M,Clancy M,Shaw J R,et al. Both subunits of ADP-glucose pyrophosphorylase are regulatory[J]. Plant Physiology,2004,135(1):137-144.
[8] Stark D M,Timmerman K P,Barry G F,et al. Regulation of the amount of starch in plant tissues by ADP glucose pyrophosphorylase[J]. Science,1992,258(5080):287-292.
[9] Wang Z,Chen X,Wang J,et al. Increasing maize seed weight by enhancing the cytoplasmic ADP-glucose pyrophosphorylase activity in transgenic maize plants[J]. Plant Cell,Tissueand Organ Culture,2007,88:83-92.
[10] Sakulsingharoj C,Choi S B,Hwang S K,et al. Engineering starch biosynthesis for increasing rice seed weight:the role of the cytoplasmic ADP-glucose pyrophosphorylase[J]. Plant Science,2004,167(6):1323-1333.
[11] Batra R,Saripalli G,Mohan A,et al. Comparative analysis of AGPase genes and encoded proteins in eight monocots and three dicots with emphasis on wheat[J]. Frontiers in Plant Science,2017,8:19.
[12] Inukai T. Differential regulation of starch-synthetic gene expression in endosperm between indica and japonica rice cultivars[J]. Rice,2017,10(1):7.
[13] Ishimaru T,Ida M,Hirose S,et al. Laser microdissection-based gene expression analysis in the aleurone layer and starchy endosperm of developing rice caryopses in the early storage phase[J]. Rice,2015,8(1):57.
[14] Subasinghe R M,Liu F,Polack U C,et al. Multimeric states of starch phosphorylase determine protein-protein interactions with starch biosynthetic enzymes in amyloplasts[J]. Plant Physiology and Biochemistry,2014,83:168-179.
[15] Giroux M J,Shaw J,Barry G,et al. A single mutation that increases maize seed weight[J]. Proceedings of the National Academy of Sciences of the United States of America,1996,93(12):5824-5829.
[16] Smidansky E D,Clancy M,Meyer F D,et al. Enhanced ADP-glucose pyrophosphorylase activity in wheat endosperm increases seed yield[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(3):1724-1729.
[17] Smidansky E D,Martin J M,Hannah L C,et al. Seed yield and plant biomass increases in rice are conferred by deregulation of endosperm ADP-glucose pyrophosphorylase[J]. Planta,2003,216(4):656-664.
[18] 蒋佳颖,王一成,杨孝朴,等. 双抗体夹心ELIsA法测定猪d-干扰素的浓度[J]. 浙江农业学报,2015,27(5):740-745.
[19] Burton R A,Jenner H,Carrangis L,et al. Starch granule initiation and growth are altered in barley mutants that lack isoamylase activity[J]. The Plant Journal:for Cell and Molecular Biology,2002,31(1):97-112.
[20] Giroux M J,Hannah L C. ADP-glucose pyrophosphorylase in shrunken-2 and brittle-2 mutants of maize[J]. Molecular & General Genetics,1994,243(4):400-408.
[21] Lee S K,Hwang S K,Han M,et al. Identification of the ADP-glucose pyrophosphorylase isoforms essential for starch synthesis in the leaf and seed endosperm of rice (Oryza sativa L.) [J]. Plant Molecular Biology,2007,65(4):531-546.
[22] Müller-Röber B T,Kossmann J,Hannah L C,et al. One of two different ADP-glucose pyrophosphorylase genes from potato responds strongly to elevated levels of sucrose[J]. Molecular & General Genetics,1990,224(1):136-146.
[23] Nakata P A,Greene T W,Anderson J M,et al. Comparison of the primary sequences of two potato tuber ADP-glucose pyrophosphorylase subunits[J]. Plant Molecular Biology,1991,17(5):1089-1093.
[24] Ohdan T,Francisco P B,Sawada T,et al. Expression profiling of genes involved in starch synthesis in sink and source organs of rice[J].Journal of Experimental Botany,2005,56(422):3229-3244.
[25] 黄斌全.玉米淀粉合成关键酶:AGPase和isoamylase的功能研究[D].雅安:四川农业大学,2012.
[26] Walley J W,Shen Z,Sartor R,et al. Reconstruction of protein networks from an Atlas of maize seed proteotypes[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(49):4808-4817.
Preparation of Polyclonal Antibody of Maize AGPL2 Protein andAnalysis of Its Spatiotemporal Expression Analysis
LÜ Yanan1,YU Guowu1,2,HUANG Yubi1,2
(1.College of Agronomy,Sichuan Agricultural University,Chengdu 611130,China;2.Center for Crop Science Experimental Teaching,College of Agronomy,Sichuan Agricultural University,Chengdu 611130,China)
Abstract:In order to investigate the functional mechanism of maize AGPL2 in starch accumulation during grain development,this study clonedAGPL2 gene and constructed the GST-tagged prokaryotic expression vector PGEX-6T-1-AGPL2. Using to the inducing expression system ofEscherichia coli,GST-AGPL2 fusion protein was able to be obtained expression at high levels by inducing with 0.5 mmol/L was opropyl-β-D-thiogalactoside (IPTG) at 28 ℃ for 6 h. Then GST (Glutathione S-transferase) tag protein purification medium was used to obtain higher quality GST-AGPL2 fusion protein by affinity chromatography. The AGPL2 polyclonal antibody was prepared by immunizing New Zealand white rabbit with purified GST-AGPL2 recombinant protein,and the antiserum was isolated and purified. Then the GST tag of the antigen GST-AGPL2 fusion protein was removed by rTEV Protease,and Western Blot assayed with the purified AGPL2 polyclonal antibody showed that AGPL2 polyclonal antibody had high specificity and sensitivity and could be used to detect nanogram antigen protein. The distribution and expression patterns of AGPL2 protein in different tissues and pollination stages of maize was studied by Western Blot. The results showed that the expression of AGL2 protein in different tissues of maize was tissue-specific and the highest in endosperm. The expression level of AGPL2 protein increased first and then decreased during the different pollination period of maize endosperm,and reached the maximum in the middle pollination. The results were consistent with the accumulation of starch during the development of maize kernels,and indicated that AGPL2 was mainly present in maize endosperm and might be involved in the synthesis of starch. It also indicated that AGPL2 polyclonal antibody was highly specific and could recognize AGPL2 antigen in corn.
Key words:AGPL2 protein; Gene cloning; Prokaryotic expression; Western Blotting
中图分类号:Q78;S513.03
文献标识码:A
文章编号:1000-7091(2018)06-0017-07
doi:10.7668/hbnxb.2018.06.003
收稿日期:2018-07-11
基金项目:国家自然科学基金项目(31501322);留学回国人员科技活动择优资助项目(00124300);四川省博士后特别资助项目(03130104)
作者简介:吕亚楠(1991-),女,河南南阳人,硕士,主要从事生物化学与分子生物学研究。
通讯作者:
余国武(1980-),男,湖北荆门人,副教授,博士后,主要从事玉米淀粉合成调控研究。
黄玉碧(1963-),男,四川南充人,教授,博士,主要从事玉米淀粉合成调控研究。