根际是植物、土壤、微生物及其环境相互作用的中心,是各种养分和有害物质从无机环境进入生命系统参与食物链物质循环的必经通道和瓶颈[1]。根际土壤微生物是根际微生态的重要组成部分,其在根际土壤有机质分解、氮的固定、土壤养分转化和植株生长发育过程中发挥着重要的作用,且对环境变化十分敏感[2]。施肥对根际微生物的影响因肥料的数量、种类、施肥时间长短及不同肥料的配合方式而不同,微生物则通过改变生物量、活性速率和群落结构对不同的施肥产生响应[3]。吴迪等[4]研究认为,施肥会提高根际土壤细菌、真菌和放线菌数量,且有机肥比无机肥效果显著。芦思佳等[5]研究发现,长期平衡施肥使根际土壤微生物量碳、氮的含量增加。文景芝等[6]研究认为,施用有机肥或复合肥均有利于根际微生物的生长繁殖,根际细菌多样性指数和均匀度指数也有所提高。唐海明等[7]研究认为,长期施用有机肥或无机肥均会促进根际土壤微生物的代谢活性,提高土壤微生物多样性,且有机肥配施化肥的效果极佳。也有研究表明[8],施用尿素后土壤微生物功能多样性显著降低,但是无机氮肥和磷肥对土壤微生物多样性无明显影响。Lovell等[9]研究认为,长期施用无机氮肥会降低土壤微生物活性。虽然目前的研究结果不尽相同,但长期施肥对农田生态系统的影响极其显著,进一步研究不同化肥配施对根际微生物生态的影响对农业生产和土地可持续发展有重要价值。
高粱(Sorghum bicolor L. Moench)已经广泛应用于饲料,且具有较强的耐瘠薄能力,是“镰刀湾”地区产业结构增调的一种作物[10-11]。目前施肥对高粱根际微生物特性的研究仅限于可培养微生物的数量[4],前人研究发现,高粱根系分泌的对羟基苯丙酸和对苯醌等生物硝化抑制物能专一抑制土壤中氨氧化微生物,进而抑制硝化作用,提高氮素吸收和氮肥利用率[12-14],有必要进一步研究高粱根际微生物代谢功能多样性对氮、磷、钾胁迫的响应。
本研究以高粱/玉米轮作的长期定位大田试验为基础,结合人工温室的盆栽试验,采用BIOLOG微平板法研究了长期不同施肥条件下高粱根际土壤微生物功能多样性的变化,以期明确高粱根际微生物对氮、磷、钾胁迫的响应,为不同土壤养分条件下高粱的养分管理提供理论依据。
1 材料和方法
1.1 试验材料
供试高粱品种为晋中0592。
1.2 试验设计
大田试验在山西省晋中市榆次区山西省农业科学院东阳试验基地进行,海拔802 m,年平均气温为9.7 ℃,年平均降水量为450 mm,降水70%以上集中在6-9月。试验地土壤类型为潮土,土壤质地为黏壤土,试验始于2011年,共设NPK、PK、NK、NP、CK(无肥处理)5个处理,其中每年N、P、K施用量分别为N 225 kg/hm2、P2O5 75 kg/hm2、K2O 75 kg/hm2,氮、磷及钾肥分别为尿素、过磷酸钙和硫酸钾。磷肥和钾肥作为基肥一次性施入;氮肥的1/2作为基肥,剩余1/2在拔节期时追施。试验采用随机区组排列,每个小区面积为15 m×5 m=75 m2,重复3次。为避免连作障碍对试验的影响,进行高粱与玉米轮作,从2011年开始种植玉米与高粱的地在2012年分别种植高粱与玉米,以此类推一年一季,年年倒茬,每年的施肥和管理都相同。于2016年5月13日播种, 9月28日收获,留苗密度为19万株/hm2,生育期为138 d。
盆栽试验在山西省农业科学院人工智能温室内进行。供试土壤于2017年3月19日采自大田试验的对应处理。设NPK、PK、NK、NP、CK(无肥处理)5个处理,5个重复。N、P、K施用量分别为:N 0.20 g/kg,P2O5 0.15 g/kg,K2O 0.15 g/kg。所有肥料用化学试剂配制后,按照处理以每个盆为单元在播前把肥料和风干土混合均匀后装盆。每个塑料盆装风干土5 kg。于2017年4月25日播种,为了维持作物生长,在出苗后25 d所有处理补施 P2O5 0.009 4 g/kg,出苗后31 d定苗为每盆3株,7月3日(穗花期)收获。各处理供试土壤化学特性如表1所示。与NPK处理相比,PK处理的全氮和硝态氮含量有所降低,NK处理的有效磷含量和NP处理速效钾含量显著降低。
表1 各施肥处理播种前土壤化学特征
Tab.1 Soil chemical characteristics before sowing
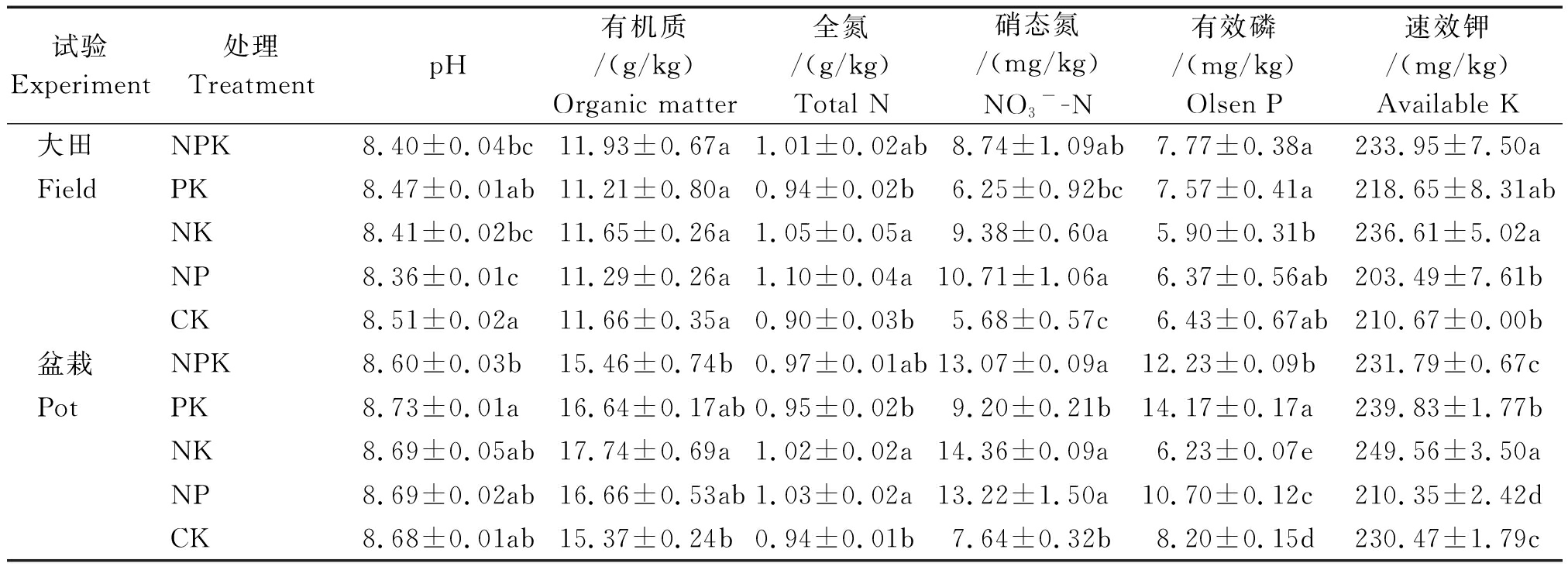
试验Experiment处理TreatmentpH有机质/(g/kg)Organic matter全氮/(g/kg)Total N硝态氮 /(mg/kg)NO3--N有效磷/(mg/kg)Olsen P速效钾/(mg/kg)Available K大田NPK8.40±0.04bc11.93±0.67a1.01±0.02ab8.74±1.09ab7.77±0.38a233.95±7.50aFieldPK8.47±0.01ab11.21±0.80a0.94±0.02b6.25±0.92bc7.57±0.41a218.65±8.31abNK8.41±0.02bc11.65±0.26a1.05±0.05a9.38±0.60a5.90±0.31b236.61±5.02aNP8.36±0.01c11.29±0.26a1.10±0.04a10.71±1.06a6.37±0.56ab203.49±7.61bCK8.51±0.02a11.66±0.35a0.90±0.03b5.68±0.57c6.43±0.67ab210.67±0.00b盆栽NPK8.60±0.03b15.46±0.74b0.97±0.01ab13.07±0.09a12.23±0.09b231.79±0.67cPotPK8.73±0.01a16.64±0.17ab0.95±0.02b9.20±0.21b14.17±0.17a239.83±1.77bNK8.69±0.05ab17.74±0.69a1.02±0.02a14.36±0.09a6.23±0.07e249.56±3.50aNP8.69±0.02ab16.66±0.53ab1.03±0.02a13.22±1.50a10.70±0.12c210.35±2.42dCK8.68±0.01ab15.37±0.24b0.94±0.01b7.64±0.32b8.20±0.15d230.47±1.79c
注:同列不同小写字母表示不同处理间差异显著(P<0.05)。表2-3同。
Note:Different lowercases in a column indicate significant differences at 0.05 level among Different treatments. The same as Tab.2-3.
1.3 根际土样的采集与处理
在高粱穗花期用抖根法[15]采集根际土样:田间试验中随机选取长势均匀并有代表性的5株植株,去掉0~2 cm的表土,用小铲切取高粱根部及其周围土壤,轻轻抖掉根系外围土后,用灭菌的镊子轻刷黏附在根表面的土壤样品,密封到无菌袋后置于冰盒内运回实验室,过2 mm 筛混匀后保存于-80 ℃超低温冰箱。盆栽试验中按盆取样,用剪刀剪去地上部植株,去掉0~2 cm的表土后,将盆倒扣到灭菌的报纸上取样,之后取样及处理的方法与大田一致。
1.4 土壤微生物代谢功能多样性测定
采用BIOLOG ECO微平板法测定[16-17],称取相当于10 g 烘干土的新鲜土样,加入到盛有90 mL 无菌水的三角瓶内,用无菌滤膜封口后在200 r/min 下振荡30 min,然后逐步稀释到1 000倍。将150 μL 的稀释液接种到生态板(ECO MicroPlate, 美国Matrix Technologies Corporation 生产),每样1 板(3次重复),将接种好的测试板加盖置于28 ℃的恒温培养箱,每隔24 h用BIOLOG 自动读数装置在波长590 nm 下读数,连测7 d。
采用Garland等[18]的方法计算测试板孔中溶液吸光值平均颜色变化率(AWCD)。
AWCD=∑(Ci-R) /31
①
式中,Ci 为每个有培养基孔的吸光值;R为对照空白孔的吸光值。
采用Shannon-Wiener多样性指数(H),碳源利用丰富度指数(S)(即颜色变化的孔数(吸光值小于0.25 视为颜色没有变化)),Shannon-Wiener均匀度指数(E)和Simpson优势度指数参数表征土壤微生物群落功能代谢多样性[19]。
H =-∑Pi lnPi
②
S =被利用碳源的总数
③
E=H/lnS
④
Ds=1-∑Pi2
⑤
Pi=(Ci-R)/∑(Ci-R)
⑥
式中,Pi为第i孔吸光值与对照孔吸光值之差与整个平板吸光值总和的比率;H为 Shannon多样性指数;S为碳源利用丰富度指数。
1.5 数据统计分析
采用Microsoft Excel 2010 对数据进行整理和统计分析;采用SPSS 20.0 进行单因子方差分析和主成分分析,如有显著差异时用Duncan法进行多重比较,显著性水平设定为α=0.05。图表中数据均为3个重复的平均数±标准误。
2 结果与分析
2.1 不同施肥处理对根际微生物碳源利用能力的影响
平均颜色变化率(AWCD)能够表征土壤微生物群落的碳源利用率,是反映土壤微生物生理代谢活性、微生物群落功能多样性的重要指标[20]。AWCD 值增加的越快,表明微生物群落的代谢活性越强[21]。大田试验结果表明(图1),在整个培养期间,NPK和NP处理的AWCD值间均无显著差异(P>0.05);在培养前72 h,NK与NPK和NP处理的AWCD值差异不显著(P>0.05),但144 h后与NPK、NP处理比较,NK处理显著降低了AWCD值(P<0.05),说明连续不施钾肥对微生物碳源利用能力影响不大;而不施磷肥显著降低了培养后期根际微生物代谢活性。整个培养期间,PK处理的AWCD值显著高于其他处理(P<0.05),CK的AWCD值显著低于其他各施肥处理(P<0.05);培养结束时,各处理的AWCD值表现为:PK>NPK>NP>NK>CK;与CK处理比较,PK、NPK、NP和NK处理根际微生物对碳源利用能力分别增加了46.26%,24.15%,23.17%和14.04%(P<0.05);施肥处理显著影响根际土壤微生物对碳源的利用能力(P<0.05),PK处理具有最高的AWCD值,说明施肥显著提高了根际微生物利用碳源的能力,长期不施氮但磷钾充分时,根际微生物对碳源利用的能力最强,长期不施用氮磷钾肥显著降低了根际微生物的代谢活性。
盆栽试验结果表明,除培养前24 h外,在整个培养期间,NP和NK处理与NPK的AWCD值间均无显著差异(P>0.05),但培养后期NP和NK处理均有下降的趋势,说明盆栽试验中不施钾肥或不施磷肥对根际微生物碳源利用能力影响不大。整个培养期间,PK处理的AWCD值最高,但与NPK和NK间差异未达显著水平(P>0.05);除培养前24 h外,CK的AWCD值显著低于其他各施肥处理(P<0.05);培养结束时,各处理的AWCD值表现为:PK>NPK>NK>NP>CK;与CK处理比较,PK、NPK、NK和NP处理碳源利用能力分别增加了33.76%,23.19%,20.35%和13.39%(P<0.05)。可见,盆栽试验的结果与大田一致,但处理间差异没有大田显著。
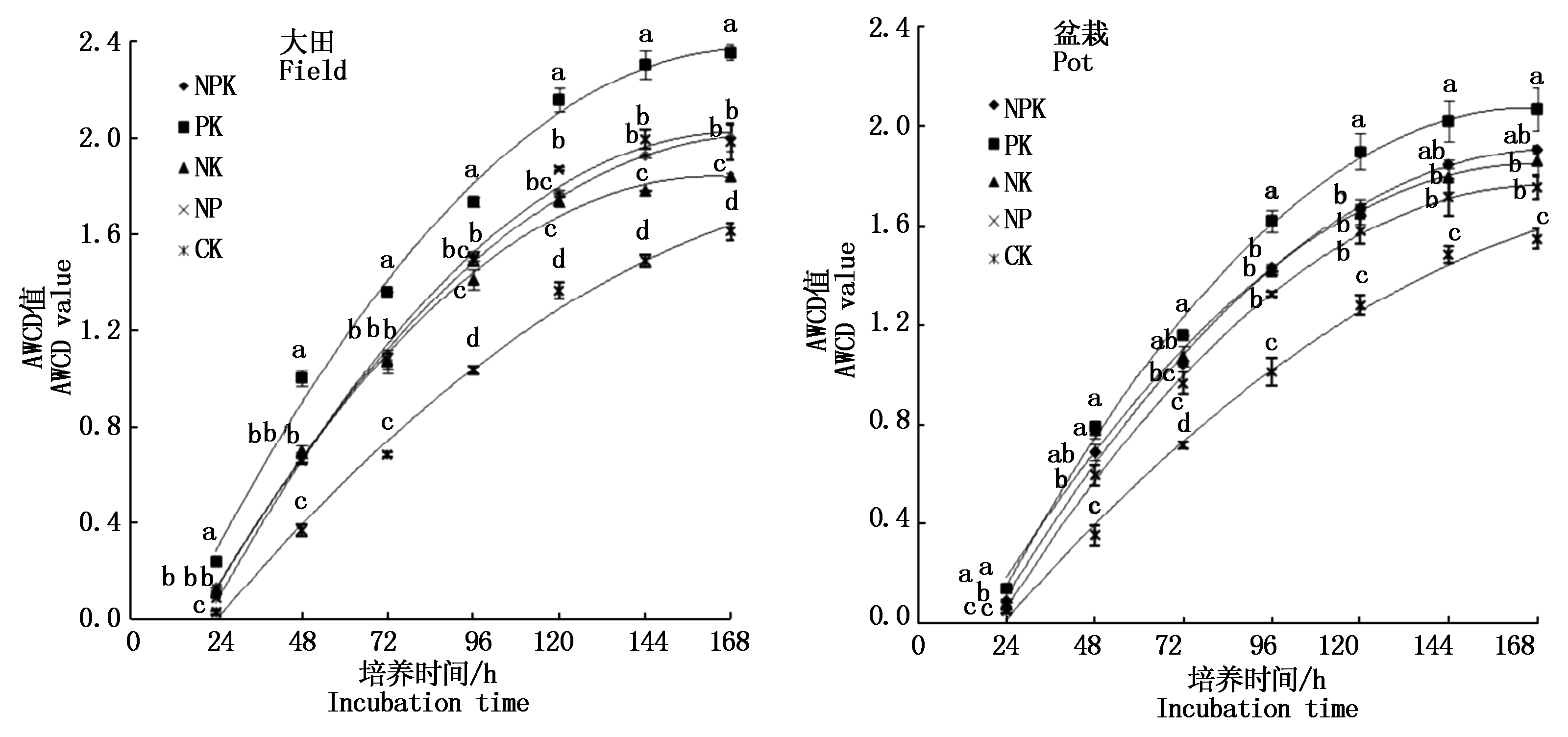
图1 不同施肥处理AWCD值随培养时间的变化
Fig.1 The change of AWCD value with incubation time in different fertilization treatments
2.2 不同施肥处理对根际微生物利用分类碳源能力的影响
就培养96 h微生物对分类碳源利用情况分析可知(表2),大田试验结果,氨基酸类除NK与NP间的差异不显著外(P>0.05),未施磷处理(NK和CK)利用氨基酸类物质的能力显著低于施磷处理(NPK、PK和NP)(P<0.05)。与施氮处理NPK、NP和NK相比,PK对羧酸类物质的利用分别显著增加了19.14%,34.63%和21.91%;CK则分别显著降低了35.59%,27.21%和34.09%(P<0.05)。不同处理对胺类物质的利用表现出PK>NP>NPK>CK>NK的趋势,其中,PK处理显著高于其他处理,未施磷处理(NK和CK)低于施磷处理(NPK、PK和NP)(P<0.05)。PK和NK对糖类物质的利用无显著差异,但二者显著高于其他处理,CK显著低于其他处理(P<0.05)。不同处理对聚合物的利用表现出PK>NP>NPK>NK>CK的趋势,其中,施氮处理(NPK、NP和NK)间差异不显著(P>0.05),PK显著高于除NP外的其他处理,CK显著低于除NK外的其他处理(P<0.05)。不同处理对双亲化合物的利用表现出NPK>NP>PK=CK>NK的趋势,NPK显著高于其他处理(P<0.05)。综上所述,就根际微生物对氨基酸类、羧酸类、胺类、糖类和聚合物的利用而言,PK处理最高,CK最低,且PK处理对羧酸类、胺类的利用显著高于其他处理,CK对羧酸类和糖类的利用显著低于其他处理。但缺肥处理对双亲化合物的利用均显著降低。
盆栽试验结果表明,不同处理对氨基酸类物质的利用表现出PK>NK>NP>NPK>CK的趋势,其中,PK显著高于除NK外的其他处理(P<0.05),CK显著低于其他处理(P<0.05);不同处理对羧酸类和胺类的利用均表现出PK>NK>NPK>NP>CK的趋势,PK对胺类的利用显著高于除NK外的其他处理(P<0.05);对糖类的利用表现出PK>NPK>NK>NP>CK的趋势,其中,PK显著高于除NPK外的其他处理(P<0.05),CK显著低于其他处理(P<0.05);PK对聚合物的利用显著高于其他处理(P<0.05);不同处理对双亲化合物的利用表现出NPK>NP>PK>NK>CK的趋势,NPK处理最高,CK最低。可见,盆栽试验较好地验证了大田试验的结果,PK处理增加了根际微生物对氨基酸类、羧酸类、胺类、糖类和聚合物的利用,降低了对双亲化合物的利用;CK处理对6类碳源的利用均降低。
表2 不同施肥处理对根际土壤微生物利用分类碳源能力的影响
Tab.2 Effects of different fertilization treatments on microbial classification of carbon source capacity in rhizosphere soil
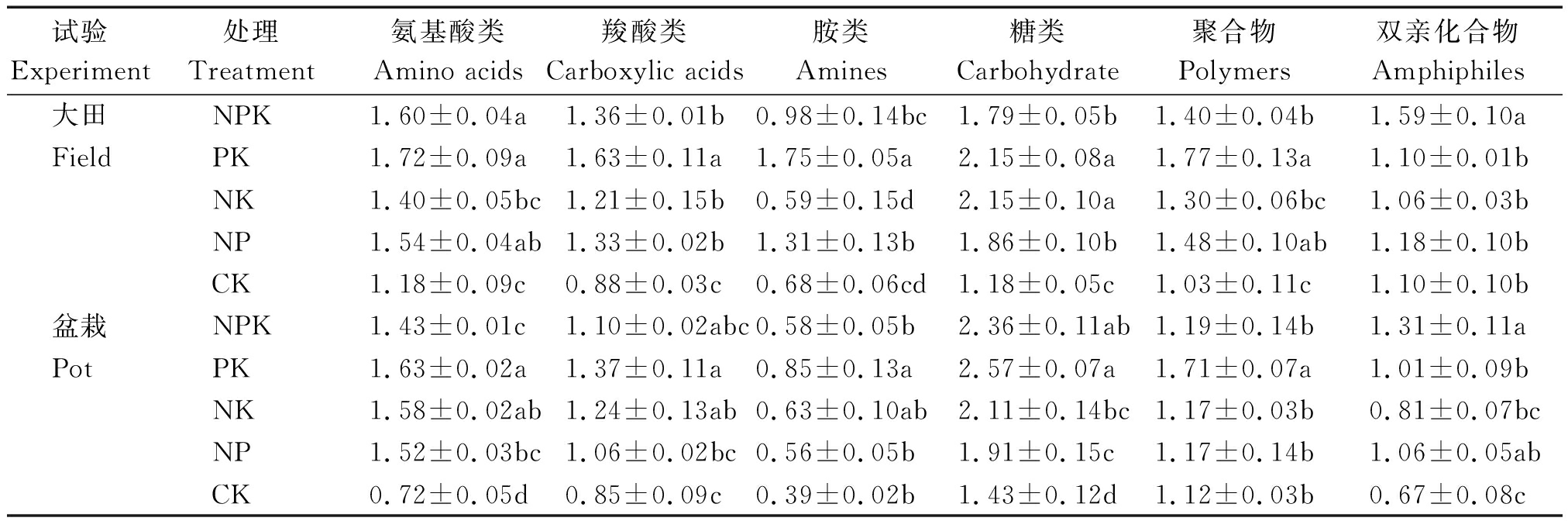
试验Experiment处理Treatment氨基酸类Amino acids羧酸类Carboxylic acids胺类Amines糖类Carbohydrate聚合物Polymers双亲化合物Amphiphiles大田NPK1.60±0.04a1.36±0.01b0.98±0.14bc1.79±0.05b1.40±0.04b1.59±0.10aFieldPK1.72±0.09a1.63±0.11a1.75±0.05a2.15±0.08a1.77±0.13a1.10±0.01bNK1.40±0.05bc1.21±0.15b0.59±0.15d2.15±0.10a1.30±0.06bc1.06±0.03bNP1.54±0.04ab1.33±0.02b1.31±0.13b1.86±0.10b1.48±0.10ab1.18±0.10bCK1.18±0.09c0.88±0.03c0.68±0.06cd1.18±0.05c1.03±0.11c1.10±0.10b盆栽NPK1.43±0.01c1.10±0.02abc0.58±0.05b2.36±0.11ab1.19±0.14b1.31±0.11aPotPK1.63±0.02a1.37±0.11a0.85±0.13a2.57±0.07a1.71±0.07a1.01±0.09bNK1.58±0.02ab1.24±0.13ab0.63±0.10ab2.11±0.14bc1.17±0.03b0.81±0.07bcNP1.52±0.03bc1.06±0.02bc0.56±0.05b1.91±0.15c1.17±0.14b1.06±0.05abCK0.72±0.05d0.85±0.09c0.39±0.02b1.43±0.12d1.12±0.03b0.67±0.08c
2.3 不同施肥处理对根际微生物群落多样性指数的影响
利用培养96 h后测定的AWCD值计算微生物群落功能代谢多样性指数,结果如表3所示。大田试验不同处理的Shannon-Wiener多样性指数变化趋势为:PK>NP>NPK>NK>CK,3个施氮处理NPK、NK和NP间的差异不显著(P>0.05),而PK处理显著高于施氮处理(P<0.05),CK处理显著低于施氮处理(P<0.05)。丰富度指数(S)的变化趋势及处理间的差异均与多样性指数一致。盆栽试验中,Shannon-Wiener多样性指数和丰富度指数变化趋势为:PK>NPK>NP>NK>CK,除NPK外,PK显著高于其他处理(P<0.05)。说明长期不施氮肥磷钾配施可促进根际微生物种类增加,提高土壤微生物多样性,但不施肥降低了根际土壤微生物的多样性,微生物种类减少;不施磷肥或钾肥对微生物种类影响不大;且大田的结果比盆栽显著。
Shannon-Wiener均匀度指数(E),大田试验的变化趋势为CK>NPK>NK>NP>PK,仅CK处理显著高于PK处理(P<0.05);盆栽试验的变化趋势为:CK>NP>NK>PK>NPK,CK和NP显著高于PK和NPK处理(P<0.05)。Simpson优势度指数(Ds),大田试验的变化趋势为PK>NP>NK>NPK=CK,仅 PK处理显著高于NPK和CK处理(P<0.05);盆栽试验的变化趋势为PK>NP>NPK>NK=CK,PK显著高于NK和CK处理(P<0.05)。说明长期施用化肥降低了根际微生物群落的均匀度;而磷钾配施增加了根际土壤微生物的优势度;且在大田中更明显。
表3 长期不同施肥处理下根际土壤微生物代谢功能多样性指数
Tab.3 Microbial metabolic function diversity index of rhizosphere soil under different long-term fertilization treatments
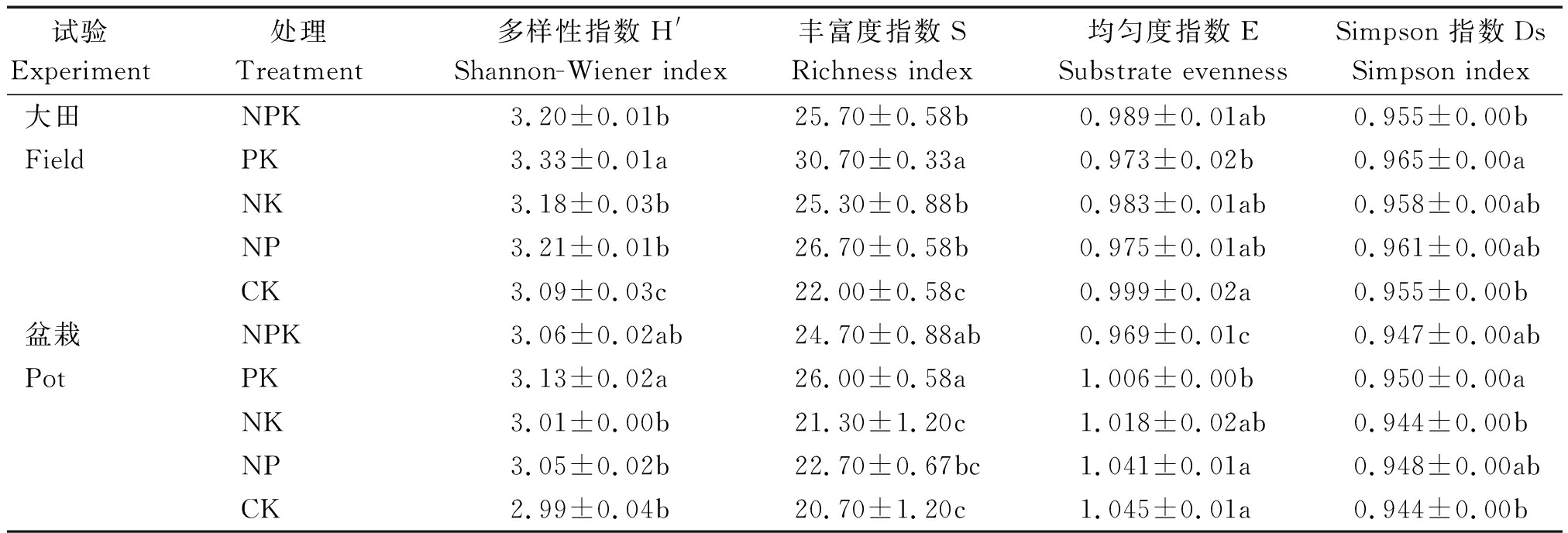
试验Experiment处理Treatment多样性指数H'Shannon-Wiener index丰富度指数SRichness index均匀度指数ESubstrate evennessSimpson 指数DsSimpson index大田NPK3.20±0.01b25.70±0.58b0.989±0.01ab0.955±0.00bFieldPK3.33±0.01a30.70±0.33a0.973±0.02b0.965±0.00aNK3.18±0.03b25.30±0.88b0.983±0.01ab0.958±0.00abNP3.21±0.01b26.70±0.58b0.975±0.01ab0.961±0.00abCK3.09±0.03c22.00±0.58c0.999±0.02a0.955±0.00b盆栽NPK3.06±0.02ab24.70±0.88ab0.969±0.01c0.947±0.00abPotPK3.13±0.02a26.00±0.58a1.006±0.00b0.950±0.00aNK3.01±0.00b21.30±1.20c1.018±0.02ab0.944±0.00bNP3.05±0.02b22.70±0.67bc1.041±0.01a0.948±0.00abCK2.99±0.04b20.70±1.20c1.045±0.01a0.944±0.00b
2.4 不同施肥处理土壤微生物碳源利用的主成分分析
应用主成分分析,根据降维后所得的主成分截荷图可直观地反映出不同处理间土壤微生物群落的功能代谢差异[22]。利用培养96 h后测定的数据进行主成分分析,根据提取的主成分个数一般要求累计方差贡献率达到85% 的原则提取主成分[23],结果显示,提取出来的前2个主成分方差贡献率分别为:大田试验的贡献率分别为37.71%和28.09%,盆栽试验的贡献率分别为29.48%和20.21%。对前2个主成分进行分析,将不同处理在2个主成分上的得分值以PC1、PC2为横纵坐标构建主成分截荷图(图2)。由图2可知,大田试验PC1轴上PK处理分布在正方向,NK和CK处理分布在负方向,NPK和NP处理分布在零点附近;PC2轴上NPK和NP处理分布在正方向,CK、NK和PK处理分布在负方向。对各处理的碳源主成分得分系数进一步进行方差分析,结果表明,在PC1轴上,仅NPK和NP处理间无显著差异(P>0.05),其余处理间差异显著(P<0.05);在PC2轴上,5个处理间均表现出显著差异(P<0.05)。
盆栽试验,PC1轴上PK、NK和NP处理分布在正方向,CK处理分布在负方向,NPK处理分布在零点附近;PC2轴上NPK处理分布在正方向,PK、NK和CK处理分布在负方向,NP处理分布在零点附近;方差分析结果表明,PC1轴上,施氮处理NPK、NK和NP间的差异不显著(P>0.05),而PK处理显著高于施氮处理(P<0.05),CK处理显著低于施氮处理(P<0.05);PC2轴上,5个处理间均表现出显著差异(P<0.05)。综上所述,大田试验中NPK和NP处理根际土壤微生物碳源利用能力和类型差异不显著,其余处理间差异显著;盆栽试验中施氮处理NPK、NK和NP利用碳源能力和类型差异不显著,其余处理间差异显著。
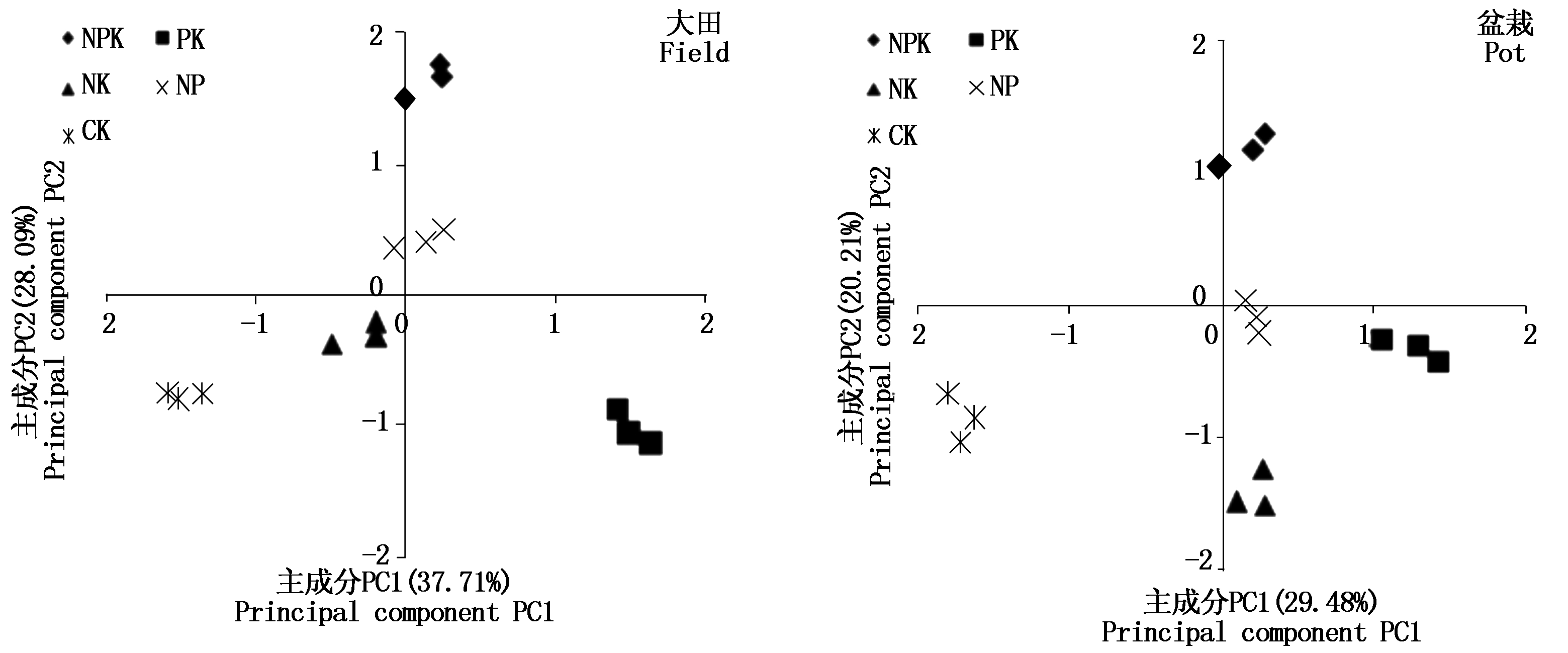
图2 土壤微生物碳源利用的主成分分析
Fig.2 Principal component analysis of soil microbial carbon source utilization
3 结论与讨论
土壤中微生物数量庞大,种类繁多,且存在大量无法培养的微生物类群,采用BIOLOG微平板法测定土壤微生物对不同碳源利用能力及其代谢差异,是较为深入了解土壤微生物信息、表征其功能多样性的一种最具代表性的方法[24]。土壤中微生物的种群数量受土壤和地上部作物的共同影响,长期施肥改变了根际土壤的理化性质[25-26],根际养分的改变会进一步影响根系分泌物的种类和数量[27],而根际微生物消耗和转化根系分泌物中的有机物[28],进而导致根际微生物群落产生变化。Liljeroth等[29]研究认为,氮对土壤微生物的种群数量和密度的影响是通过改变根系分泌物间接实现的。前人研究发现,植物有很强的自我调控能力,有些抗逆性较强的植物在环境养分胁迫时,植物体内会合成专一性的根系分泌物,通过酸化、配位交换及还原作用活化难溶性无机化合物,提高其养分吸收利用效率[28,30]。如白羽扇豆在缺磷胁迫时会分泌大量的柠檬酸[31],豆科作物在缺锌胁迫时根系分泌物中糖、氨基酸和有机酸的比例会发生变化[32]。
黄红娟等[33]研究认为,假高粱根系分泌物的多样性在花果期最高,主要分泌对-羟基苯甲醛、对-羟基苯甲酸、对- 羟基苯甲酸乙酯、麦黄酮和香叶木素,其中对-羟基苯甲醛和对-羟基苯甲酸是土壤微生物的碳源,对-羟基苯甲醛能够改变土壤微生物群落结构及多样性。
本试验研究了高粱穗花期根际微生物对氮磷钾胁迫的响应,结果发现,缺氮胁迫提高了高粱根际微生物代谢活性,对氨基酸类、羧酸类、胺类、糖类和聚合物的利用能力均得以提高,但降低了对双亲化合物的利用,土壤微生物种类及优势度指数也明显高于其他处理。前人有关氮胁迫对小麦[17]、蚕豆[22]和玉米[34]微生物群落的研究均未得出类似结论。BIOLOG微平板上的碳源受地上部植物和根系分泌物种类多样的影响[24] ,所以氮胁迫下高粱根际微生物活性增强的原因可能是由于高粱自身为克服和缓解氮素的亏缺而合成并分泌了特定的物质,这些分泌物影响了根际土壤氮转化过程功能微生物的丰度、多样性及群落结构,致使原本利用双亲化合物的微生物处于劣势,而利用羧酸类和胺类等有机物的微生物种类增多,这可能是高粱较其他作物耐氮的原因之一。
高明霞等[17]研究指出,长期施用磷肥可以提高塿土微生物群落的代谢活性,这与本研究结果一致。本研究大田试验结果表明,长期缺磷显著降低了培养后期根际微生物代谢活性,这可能是因为高粱是喜磷禾本科作物[35],缺磷抑制了其根际微生物的生长。而盆栽试验中,不施磷肥对根际微生物碳源利用能力影响不显著是受苗期补施磷肥的影响。本试验中,连续不施钾肥对微生物碳源利用能力和多样性指数的影响不大,一方面可能是因为根据全国第二次土壤普查推荐的土壤养分分级标准来看,本试验供试土壤的速效钾含量极高;另一方面可能是由于高粱对钾不太敏感。但长期不施肥显著降低了根际微生物对碳源的利用能力,导致微生物种类减少,促进了各种类微生物的均衡发展,这一结果与前人的研究结果一致[17,24]。其原因可能是由于长期不施肥处理土壤中养分含量低,微生物生长所需的碳源和能源受到了极大的限制。
Garland等[18]研究认为,主成分分析结果中各处理在空间上位置的不同和微生物的碳源利用能力相关联。本研究大田试验的主成分分析结果表明,NPK和NP处理根际土壤微生物碳源利用能力和类型差异不显著,其余处理间差异显著;而盆栽试验中施氮处理NPK、NK和NP利用碳源的能力和类型差异不显著,其余处理间差异显著。盆栽试验很好地验证了大田试验的结果,而NK处理前后结果的不一致可能是因为盆栽是在控制条件下进行的,养分胁迫没有大田那样严重,且盆栽补施磷肥导致NK处理缺磷胁迫没有大田严重。
综上所述,不同施肥处理对高粱根际微生物群落功能多样性的影响不同。长期磷钾配施显著增强了根际微生物的代谢活性,微生物种类及优势度指数均增加;长期氮钾配施降低了培养后期微生物代谢活性;长期氮磷配施的影响不大;长期不施肥抑制了微生物的生长,但有利于各种类微生物的均衡发展。可见,施肥有利于改善土壤微生物特性。高粱根际微生物对氮、磷、钾胁迫的响应不同,氮胁迫时,根际微生物代谢活性的增强可能是高粱耐氮的原因之一。
[1] 陆雅海,张福锁. 根际微生物研究进展[J]. 土壤,2006,38(2):113-121.
[2] Degens B P,Schipper L A,Sparling G P,et al. Decreases in organic C reserves in soils can reduce the catabolic diversity of soil microbial communities[J]. Soil Biology and Biochemistry,2000,32(2):189-196.
[3] Denef K,Roobroeck D,Manimel Wadu M C,et al. Microbial community composition and rhizodeposit-carbon assimilation in
Differently managed temperate grassland soils[J]. Soil Biology & Biochemistry,2009,41(1):144-153.
[4] 吴 迪,魏成熙. 施肥对酒用高粱根际土壤微生物的影响[J]. 贵州科学,2010,29(1):52-54.
[5] 芦思佳,韩晓增,张 迪.长期施肥对大豆根际微生物量碳,氮的影响[J]. 大豆科学,2009,28(3):495-498.
[6] 文景芝,李 刚,张齐凤. 施肥对大棚黄瓜根际微生物群落结构和数量消长的影响[J]. 中国蔬菜,2007(12):11-14.
[7] 唐海明,肖小平,李微艳. 长期施肥对双季稻田根际土壤微生物群落功能多样性的影响[J]. 生态环境学报,2016,25(3):402-408.
[8] Sarathchandra S U,Ghani A,Yeates G W,et al. Effect of nitrogen and phosphate fertilizers on microbial and nematode diversity in pasture soils[J]. Soil Biology and Biochemistry,2001,33(7/8):953-964.
[9] Lovell R D,Jarvis S C,Bardgett R D. Soil microbial biomass and activity in long term grass land:effects of management change[J]. Soil Biology and Biochemistry,1995,27(7):969-975.
[10] Jampala B,Rooney W L,Peterson G C,et al. Estimating the relative effects of the endosperm traits of waxy and high protein digestibility on yield in grain sorghum[J]. Field Crops Research,2012,139:57-62.
[11] 王劲松,焦晓燕,丁玉川,等. 粒用高粱养分吸收,产量及品质对氮磷钾营养的响应[J]. 作物学报,2015,41(8):1269-1278.
[12] 周金泉. 高粱分泌生物硝化抑制物(MHPP)的机制及其对土壤N2O排放的影响[D]. 南京:南京农业大学,2015:1-63.
[13] Watanabe T,Venkata S P,Sahrawat K L,et al. Acidification in rhizospheric soil of field-grown sorghum decreases nitrification activity[J]. JARQ-Japan Agricultural Research Quarterly,2015,49(3):245-253.
[14] Subbarao G V,Nakahara K,Ando Y,et al. Biological nitrification inhibition(BNI)activity in sorghum:potential role for enhancing nitrogen-use efficiency(NUE) [J]. Journal of Physical Chemistry A,2015,111(39):91-96.
[15] 华菊玲,刘光荣,黄劲松. 连作对芝麻根际土壤微生物群落的影响[J]. 生态学报,2012,32(9):2936-2942.
[16] Haack S K,Garchow H,Klug M J,et al. Analysis of factors affecting the accuracy,reproducibility and interpretation of microbial community carbon source utilization patterns[J]. Applied & Environmental Microbiology,1995,61(4):1458-1468.
[17] 高明霞,孙 瑞,崔全红,等. 长期施用化肥对塿土微生物多样性的影响[J]. 植物营养与肥料学报,2015,21(6):1572-1580.
[18] Garland J L,Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology,1991,57(8):2351-2359.
[19] Schutter M,Dick R. Shifts in substrate utilization potential and structure of soil microbial communities in response to Carbon substrates[J]. Soil Biology and Biochemistry,2001,33(11):1481-1491.
[20] Zabinski C A,Gannon J E. Effects of recreational impacts on soil microbial communities[J]. Environmental Management,1997,21(2):233-238.
[21] 岳冰冰,李 鑫,张会慧,等. 连作对黑龙江烤烟土壤微生物功能多样性的影响[J]. 土壤,2013,45(1):116-119.
[22] 董 艳,杨智仙,董 坤,等. 施氮水平对蚕豆枯萎病和根际微生物代谢功能多样性的影响[J]. 应用生态学报,2013,24(4):1101-1108.
[23] 郝黎仁,樊 元,郝哲欧. SPSS 实用统计分析[M]. 北京:中国水利水电出版社,2003.
[24] 徐万里,唐光木,葛春辉,等. 长期施肥对新疆灰漠土土壤微生物群落结构与功能多样性的影响[J]. 生态学报,2015,35(2):468-477.
[25] Wu M N,Qin H L,Chen Z,et al. Effect of long-term fertilization on bacterial composition in rice paddy soil[J]. Biology and Fertility of Soils,2011,47(4):397-405.
[26] 徐永刚,宇万太,马 强,等. 长期不同施肥制度对潮棕壤微生物生物量碳、氮及细菌群落结构的影响[J]. 应用生态学报,2010,21(8):2078-2085.
[27] Turner S M,Newman E I,Campbell R. Microbial population of ryegrass root surfaces:influence of Nitrogen and Phosphorus supply[J]. Soil Biology & Biochemistry,1985,17(5):711-715.
[28] 张锡洲,李廷轩,王永东. 植物生长环境与根系分泌物的关系[J]. 土壤通报,2007,38(4):785-789.
[29] Liljeroth E,Baath E,Mathias S M,et al. Root exudation and rhizoplane bacterial abundance of barley(Hordeum vulgare L.)in relation to nitrogen fertilization and root growth[J]. Plant and Soil,1990,127(1):81-89.
[30] 张福锁. 根分泌物与禾本科植物对缺铁胁迫的适应机理[J]. 植物营养与肥料学报,1995,1(1):17-23.
[31] Lipton D,Blancher B,Blevins B,et al. Citrate,malate and succinate concentration in exudates from P-sufficiency and P-stressed Medicago sativus L.seedlings[J]. Plant Physiology,1987,85(2):315-317.
[32] Ohwaki Y,Hirata H. Differences in carboxylic acid exudation among P-stressed leguminous crops in relation to carboxylic acid contents in plant tissues and phospholipid level in roots[J]. Soil Science Plant Nutrition,1992,38(2):235-243.
[33] 黄红娟,王慧敏,魏守珲,等. 假高梁根系分泌物及其对土壤微生物群落结构的影响[C]//第十三届全国杂草科学大会论文摘要集,北京:中国植物保护学会杂草学分会,2017:104.
[34] 夏 雪,谷 洁,车升国,等. 施氮水平对塿土微生物群落和酶活性的影响[J]. 中国农业科学,2011,44(8):1618-1627.
[35] 辽宁省农业科学院. 中国高粱栽培学[M]. 辽宁:农业出版社,1988:243-244.